【Coord.Chem.Rev.】刺激响应性有机小分子近红外二区荧光探针
核心亮点
系统总结了刺激响应性有机小分子近红外二区(NIR-II)荧光探针的研究进展。
深入介绍了NIR-II荧光探针的分子设计策略与激活机制。
探讨了刺激响应性有机小分子NIR-II荧光探针目前面临的挑战与未来方向。
摘要
发射波长位于第二近红外窗口(NIR-II, 1000–1700 nm)的有机小分子荧光染料,凭借其卓越的光学特性(包括有效降低光子散射、抑制组织自发荧光和实现更深的组织穿透),近年来在生物医学成像领域备受关注。这些优势使得近红外二区荧光成像(FLI)能够提供更高的时空分辨率、信噪比和成像深度,成为在复杂生物系统中进行精确诊断的强大工具。与传统的“始终开启”型探针不同,刺激响应型NIR-II荧光探针能被特定生物靶标选择性激活,从而显著提升靶标检测的特异性和准确性。本综述总结了刺激响应型小分子有机NIR-II荧光探针的最新研究进展,重点阐述了其核心的分子设计策略、激活机制以及在生物成像中的代表性应用。此外,本文还对该领域当前面临的挑战和未来发展前景进行了深入的讨论。
关键词
刺激响应性、近红外二区、荧光、辐射衰减、有机染料
1. 引言
近红外荧光成像(FLI)以其高特异性、高灵敏度和无创性的优点,在过去十年中已发展成为一种强大的生物医学成像技术,广泛应用于基础研究和临床诊断。然而,传统荧光成像主要在可见光(400–700 nm)和第一近红外(NIR-I, 700–900 nm)光谱区工作,这些波段的光信号受到光子与组织相互作用的严重限制。具体而言,生物组织内的血红蛋白和水等内源性生色团在这些波段有强烈吸收,将组织穿透深度限制在1–3毫米。此外,组织散射会降低空间分辨率,而来自内源性荧光物质(如胶原蛋白、弹性蛋白)的背景自发荧光则因光谱重叠和相干干扰,进一步降低了信噪比(SBR)。
近红外二区(NIR-II)荧光成像为上述难题提供了解决方案。在NIR-II波段,光子在生物组织中的散射和吸收均大幅减少,从而能够实现更深的组织穿透、更高的空间分辨率、更低的背景自发荧光以及显著提升的信噪比。得益于这些优势,NIR-II FLI在多种生物医学应用中展现出卓越性能。2019年,该技术已成功应用于临床肝肿瘤(包括原发性和转移性肿瘤)的切除手术,充分证明了其相较于传统NIR-I FLI的优越性。
开发具有临床转化潜力的NIR-II荧光探针,推动了对无机和有机两类材料的深入探索。无机纳米探针,如碳纳米管、金纳米簇、量子点及稀土掺杂纳米颗粒,虽具有优异的光稳定性和强荧光,但其长期毒性和潜在的生物蓄积风险限制了其应用。相比之下,有机探针,包括半导体聚合物和π-共轭小分子,具有生物相容性高、易于清除和结构可调等优点,更适合临床转化。值得注意的是,有机染料吲哚菁绿(ICG)和亚甲蓝(MB)已获得FDA批准用于临床。尽管如此,荧光量子产率(FLQY)低、发射波长偏短以及合成复杂等问题,仍是制约其成像深度、分辨率和临床应用潜力的瓶颈。
近年来,分子工程领域的进展为解决这些问题带来了希望。大多数有机NIR-II荧光团采用“给体-受体-给体”(D-A-D)结构,这种设计能促进分子内电荷转移(ICT),减小分子的HOMO-LUMO能隙,从而实现吸收和发射光谱的红移。通过扩展π-共轭体系、优化给/受体单元以及芳环稠合等策略,可以进一步将探针的光谱响应推向NIR-II区。荧光量子产率是决定荧光亮度的关键。目前,提高有机小分子NIR-II荧光量子产率的策略主要包括:
引入刚性骨架或共价键锁定分子构象,以抑制非辐射弛豫;
设计具有聚集诱导发光(AIE)特性的荧光团,克服传统染料的聚集导致猝灭(ACQ)效应;
优化D-A结构和π-共轭骨架,提升光吸收和发射效率;
引入长链聚乙二醇等亲水基团作为屏蔽单元,减少水分子的猝灭效应;
与白蛋白等蛋白质形成超分子复合物,进一步限制分子运动,改善其在生理环境下的荧光性能。
目前,用于深层组织成像、实时生物标志物检测和术中导航的有机NIR-II荧光探针已取得长足进步,展现出巨大的生物医学应用潜力。然而,多数已报道的NIR-II荧光团为“始终开启”型探针,主要依赖增强渗透和滞留(EPR)效应在病理部位富集。这种策略虽然能获得一定的靶向/背景信号比,但探针在健康组织中的非特异性激活和聚集会产生背景荧光和假阳性信号,从而降低成像的灵敏度和特异性。
相比之下,可激活的NIR-II荧光探针基于“关-开”机制,仅在特定生物条件下才发射荧光。这类探针在正常组织中背景信号极低,其荧光由肿瘤特异性生物标志物或病理微环境(如氧化还原状态、pH、粘度、缺氧、酶活性等)选择性触发。凭借高选择性和高灵敏度,可激活探针特别适用于肿瘤成像、炎症追踪和手术引导等需要精确定位的应用场景。其增强的对比度和最小化的背景干扰,极大地推动了实时动态成像和疾病早期检测技术的发展。
本综述旨在概述刺激响应性有机小分子NIR-II荧光探针的分子设计与光诊疗应用的最新进展,总结其多样的激活机制及其对成像灵敏度和对比度的影响,并探讨该领域当前面临的挑战,以期为下一代用于病理部位精准成像的刺激响应性NIR-II荧光探针的设计提供有益的参考。
2. 刺激响应性有机NIR-II荧光探针
生物标志物与疾病的发生发展密切相关。这些可测量的指标,涵盖基因、蛋白质、代谢物乃至细胞和影像特征,是评估生理病理状态和治疗反应的关键。其表达水平的变化通常能反映疾病的发生、严重程度、进展和治疗效果,因此在早期诊断、疾病分型、预后评估和个性化医疗中扮演着不可或缺的角色。
基于这一原理,研究人员已开发出多种能够选择性响应特定生物刺激的有机NIR-II荧光探针。这些探针在正常生理条件下通常处于荧光猝灭的“关闭”状态,当遇到目标分析物时,其分子结构或所处微环境发生改变,触发其向荧光发射的“开启”状态转变。这一激活过程可通过Förster共振能量转移(FRET)、光诱导电子转移(PET)、分子内电荷转移(ICT)或化学结构重排等多种机制实现,最终表现为显著的荧光增强。这类探针已被广泛用于实时成像多种生物标志物,如活性氧(ROS)、活性氮(RNS)、活性硫(RSS)、pH、缺氧、粘度和酶,实现了在生命活体中高对比度、高时空分辨率的可视化监测。
2.1. 氧化还原响应探针
氧化还原稳态对维持细胞完整性至关重要,它调控着氧化与还原过程的动态平衡。这一平衡是关键生理功能的基础,其失调与心血管疾病、癌症和慢性炎症等多种疾病的发生发展密切相关。体内的关键氧化还原活性物种包括活性氧(ROS)、活性氮(RNS)和活性硫(RSS)。
在生理条件下,ROS和RNS通过精密的抗氧化系统维持在较低浓度。当平衡被打破时,过量的氧化剂会引发氧化或亚硝基化应激,导致细胞损伤、线粒体功能障碍和免疫失调。因此,监测这些氧化还原物种对于理解疾病机制和开发精准疗法至关重要。有机NIR-II荧光探针因其可调控的光物理性质和对特定分析物的高响应性,为氧化还原成像提供了一个强大的平台,推动了疾病早期诊断和治疗监测技术的进步。
2.1.1. 羟基自由基(•OH)响应探针
羟基自由基(•OH)是ROS中反应活性最强的物种,其半衰期极短。在体内,•OH主要通过芬顿反应或高能辐射下的水解离产生。由于其极端的亲电性,•OH能以接近扩散极限的速率无差别地攻击脂质、蛋白质和DNA,是氧化损伤的主要介导者。正常生理条件下,抗氧化系统能迅速清除•OH;然而,•OH的过量产生与神经退行性疾病、心血管疾病、癌症和炎症等多种疾病的病理过程密切相关。
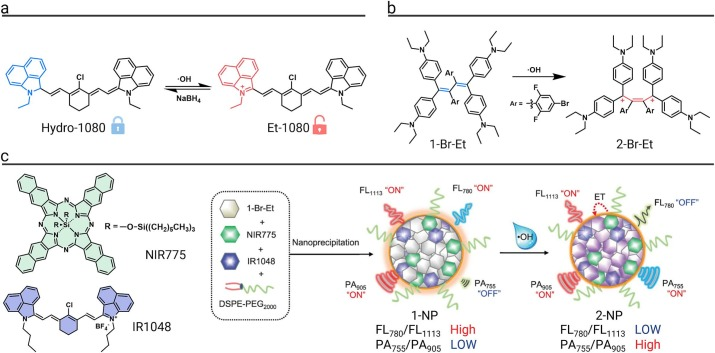
首个用于•OH检测的NIR-II探针Hydro-1080,其设计巧妙之处在于通过π-共轭体系和结构刚性的可逆破坏与恢复来调控荧光。Hydro-1080分子呈非平面结构,π-共轭程度差,几乎不发荧光。其分子一侧的C-N单键可被•OH氧化为C=N双键,形成共轭程度高且结构平面的产物Et-1080,从而发出强烈的NIR-IIa区(1300–1400 nm)荧光,实现了“关-开”式的激活。该探针成功用于动态监测由脂多糖(LPS)诱导的全身性炎症和药物诱导的肝毒性模型中的•OH波动,其独特的“NIR-II激发/NIR-IIa发射”特性使信噪比高达6.0,实现了对肝脏•OH梯度的高对比度成像。
比率型荧光探针通过测量两个不同波长的荧光强度比来进行定量分析,能够有效排除探针浓度、光漂白和仪器因素的干扰,灵敏度和可靠性更高。一种创新的比率型近红外荧光/光声(FL/PA)双模态纳米探针1-NP,被用于追踪放疗和铁死亡过程中的治疗响应。该探针在被•OH氧化后,其内部的能量转移过程发生改变,导致780 nm处的NIR-I荧光信号猝灭,而1113 nm处的NIR-II荧光信号保持不变,FL₇₈₀/FL₁₁₁₃比值大幅下降;同时,755 nm处的光声信号被激活,PA₇₅₅/PA₉₀₅比值显著升高。这一双模态、比率型的设计实现了对体内•OH动态变化的精确、无创和实时成像。
2.1.2. 过氧化氢(H₂O₂)响应探针
过氧化氢(H₂O₂)是肿瘤微环境(TME)中的关键信号分子,也是肿瘤细胞中含量最丰富的ROS。它在肿瘤的发生发展中扮演着复杂角色。因此,对H₂O₂的选择性检测和调控对于癌症诊断与治疗至关重要。
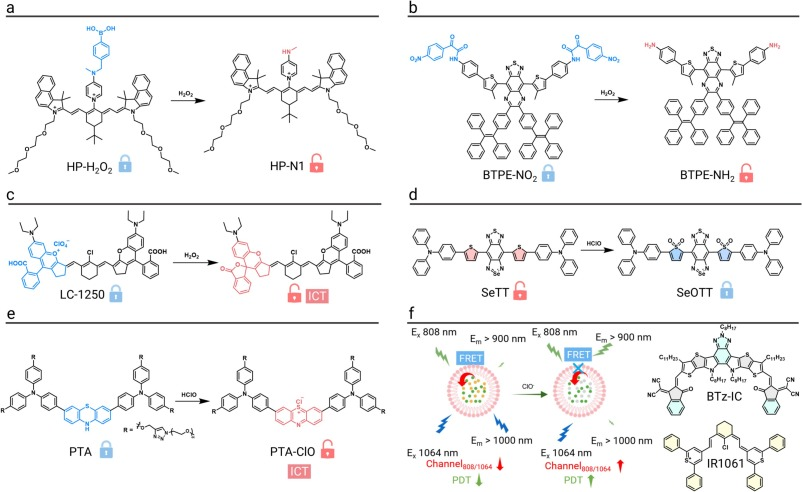
苯基硼酸酯是最常用的H₂O₂识别基团之一。基于此,研究人员开发了一种肿瘤靶向的H₂O₂响应性NIR-II探针HP-H₂O₂。该探针在与H₂O₂反应后,硼酸酯基团断裂,释放出母体染料,恢复并增强其NIR-II荧光。在急性炎症、急性肺损伤(ALI)和肾缺血再灌注损伤(IRI)等动物模型中,该探针均表现出良好的成像能力,其荧光信号强度与组织损伤的严重程度密切相关。
为克服传统染料的聚集猝灭问题,一种基于苯并噻二唑(BBT)衍生物的响应性纳米探针BTPE-NO₂@F127被设计出来。该探针具有AIE特性,并以硝基苯基-氧代乙酰胺作为H₂O₂响应单元。在病理性H₂O₂作用下,该基团断裂,恢复分子的共轭体系,使吸收峰红移并开启强烈的NIR-II荧光。该探针在间质性膀胱炎和药物性肝损伤等多种疾病模型中,通过NIR-II FLI和多光谱光声断层扫描(MSOT)实现了病灶的精确定位。
口服给药是胃肠道疾病无创诊断的理想方式,但消化道的严酷环境对探针稳定性提出了巨大挑战。一种单组分比率型NIR-II荧光纳米探针LC-1250 NP被开发用于检测肠道炎症中的H₂O₂。该探针利用螺内酰胺环的开闭来调控荧光。在H₂O₂作用下,螺环闭合,导致发射波长从1243 nm蓝移至1045 nm,同时保留1243 nm处的信号作为内参,实现了比率成像。在DSS诱导的结肠炎小鼠模型中,口服该探针成功实现了对内源性H₂O₂波动的实时监测,准确勾勒出发炎区域。
2.1.3. 次氯酸(HClO/ClO⁻)响应探针
次氯酸盐(ClO⁻)是免疫系统用于杀灭病原体的重要武器,但其过量产生也会损害宿主组织,引发炎症和退行性疾病。因此,精确监测ClO⁻对于理解氧化应激相关疾病至关重要。
为了实现对ClO⁻的实时检测,一种NIR-II比率型纳米探针DCNP@SeTT@PEG被成功构建。该探针由一个对HClO响应的含硒荧光团(1150 nm发射)和一个作为内参的上转换纳米颗粒(1550 nm发射)组成。在HClO作用下,荧光团被氧化猝灭,而内参信号保持不变,通过计算I₁₁₅₀/I₁₅₅₀的比值即可实现定量检测。该探针已成功应用于肿瘤、腹膜炎、关节炎等多种疾病模型的HClO成像。
在类风湿性关节炎(RA)的研究中,一种“关-开”型NIR-II荧光探针PTA被设计用于早期深层组织成像。该探针基于吩噻嗪骨架,在被HClO氧化后,其分子内电荷转移(ICT)效应增强,激活了936 nm和1237 nm处的双通道荧光。在RA模型中,发炎关节的荧光强度比对照组高出4.3倍,显示出其在早期诊断中的应用潜力。
为了整合诊疗功能,一种用于HClO响应性肿瘤成像和光动力疗法(PDT)的比率型NIR-II纳米探针BTz-IC@IR1061被开发出来。该探针巧妙地利用了FRET机制。在正常情况下,荧光染料IR1061猝灭光敏剂BTz-IC的荧光并抑制其PDT效应。在富含HClO的肿瘤微环境中,IR1061被选择性降解,FRET过程被破坏,从而恢复BTz-IC的荧光并“解锁”其PDT功能,实现了成像引导的精准治疗。
2.1.4. 一氧化氮(NO)响应探针
一氧化氮(NO)是参与血管舒张、神经传递和免疫调节的关键信号分子。其水平异常与多种病理状况密切相关。
一款用于无创检测药物性肝损伤的NIR-II响应探针QY-N被成功开发。该探针的丁胺基团在与NO反应发生_N_-亚硝基化后,分子的ICT效应增强,导致吸收光谱红移并开启强烈的NIR-II荧光。结合AIE特性,该探针通过NIR-II FLI和MSOT双模态成像,实现了对肝损伤病灶的精确定位和严重程度的量化评估。
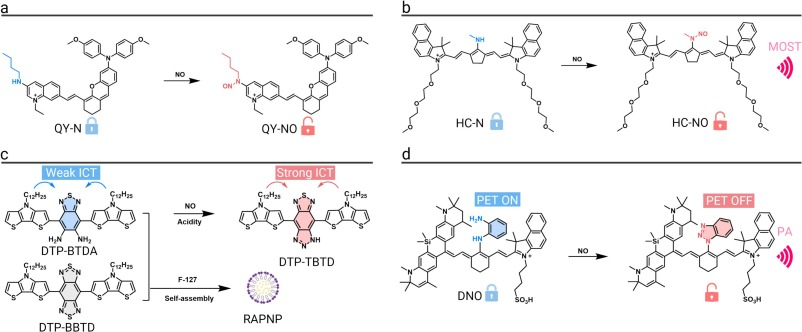
另一款NO响应探针HC-N被用于急性炎症病灶的检测与成像。该探针在与NO反应后,其吸收峰从660 nm红移至865 nm,并发出900至1150 nm的NIR-II荧光。在急性皮炎和关节炎模型中,该探针通过NIR-II FL/PA双模态成像,促进了急性炎症的精确诊断。
针对炎症性肠病(IBD)中NO过量产生的问题,研究人员开发了首个用于NO检测的比率型NIR-II FL/PA双模态成像纳米探针RAPNP。该探针在酸性和NO的双重刺激下,其荧光发射峰从706 nm红移至940 nm,同时激活了光声信号。在IBD模型中,病变组织的信号比值相较于健康组织提高了4.3倍,清晰地区分了病变与正常组织。
为探究糖尿病与乳腺癌共病中NO的作用,一种双模态NO响应探针DNPS被成功构建。该探针在NO作用下,其荧光猝灭基团转变为苯并三唑,恢复荧光。在糖尿病乳腺癌模型中,该探针的荧光信号比非糖尿病模型强2.3倍且持续时间更长,有效地揭示了共病状态下NO的失调。
2.1.5. 过氧亚硝酸盐(ONOO⁻)响应探针
过氧亚硝酸盐(ONOO⁻)是一种强氧化剂和硝化剂,其过量产生会诱导氧化/硝化应激,促进多种疾病的进展。
为了精确监测体内的ONOO⁻,一种双响应NIR-II探针PN910被设计出来,它能同时响应ONOO⁻和pH值。该探针的硼酸酯部分在被目标分析物氧化裂解后,ICT过程恢复,触发强烈的NIR-II荧光。在DSS诱导的结肠炎模型中,发炎结肠组织的信号比对照组增强了10倍,成功用于监测炎症反应。
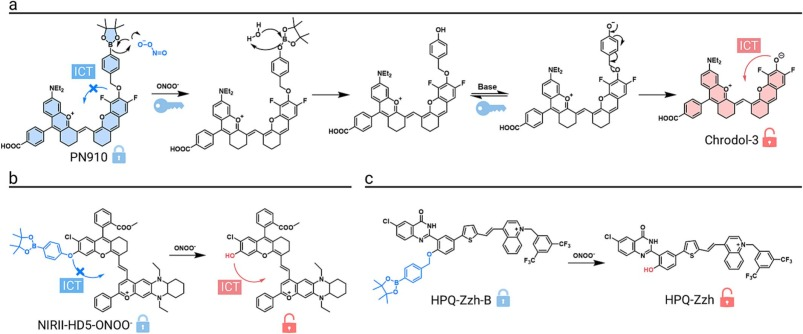
为拓宽探针设计思路,一种新型ONOO⁻响应性NIR-II荧光探针NIRII-HD5-ONOO⁻被成功构建。该探针通过结构创新实现了光谱红移和化学稳定性优化。在ONOO⁻作用下,其掩蔽的酚羟基被释放,ICT效应增强,产生强烈的荧光发射。该探针已成功应用于体内淋巴炎症的可视化。
为克服传统J-聚集体稳定性差的缺点,一种无载体的ONOO⁻响应性J-聚集体探针HPQ-Zzh-B被开发用于肿瘤的原位长时程成像和精准手术切除。该探针在生物条件下无荧光,但在ONOO⁻触发下去保护后,分子会快速二聚化并自组装成明亮且稳定的NIR-II荧光J-聚集体。在荷瘤小鼠中,该探针实现了高达4.4的信噪比,为高分辨率成像和手术导航提供了新策略。
2.1.6. 硫化氢(H₂S)响应探针
硫化氢(H₂S)是一种内源性气体信号分子,其水平异常是多种疾病的潜在诊断标志物。
一种H₂S激活的纳米探针NPs@BOD/CPT被用于诊断富含H₂S的结直肠肿瘤并实现光控药物释放。该探针中的荧光染料与H₂S发生亲核芳香取代(SNAr)反应后,其荧光发射波长发生显著红移,进入NIR-II区,从而实现对肿瘤的精确诊断。
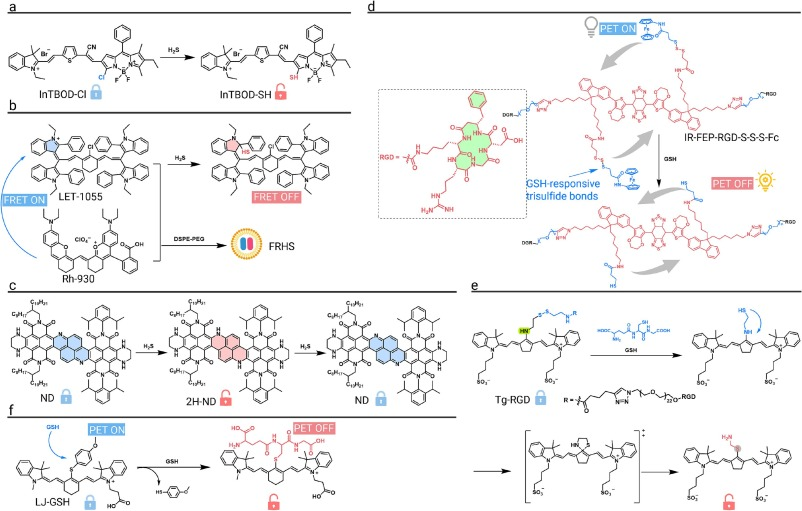
为了实现对H₂S的精确定量,一种基于FRET的比率型NIR-II纳米探针FRHS被开发出来。该探针的受体染料会被H₂S选择性猝灭,从而关闭FRET过程,导致两个荧光通道的信号比发生变化。在原位肝肿瘤和肝损伤模型中,该探针均显示出优异的成像效果和高信号比。
为克服传统探针背景干扰的问题,一种具有“关-开-关”独特激活机制的氧化还原响应NIR-II探针NDPs被成功开发。该探针在富含H₂S的肿瘤区域被还原,荧光信号增强12000倍;当其迁移到正常含氧组织时,又会被氧化回无荧光状态。这种双向循环激活机制实现了前所未有的超过50:1的肿瘤/正常组织信号比,能够以极高的对比度追踪毫米级病灶。
2.1.7. 谷胱甘肽(GSH)响应探针
谷胱甘肽(GSH)是细胞内最重要的抗氧化剂,其水平异常与肿瘤、肝损伤和神经退行性疾病等密切相关。
一种GSH响应的NIR-II光诊疗纳米平台IR-FEP-RGD-S-S-S-Fc被构建用于肿瘤的诊疗一体化。在肿瘤高浓度GSH作用下,平台内的三硫键断裂,释放荧光猝灭剂,从而激活NIR-II荧光。该平台在体内成像中表现出高肿瘤特异性,信噪比在12小时达到8.6,实现了肿瘤区域的精确定位。
利用经典的二硫键(-S-S-)作为GSH响应基序,一种NIR-II荧光探针Tg-RGD被开发用于检测原位肿瘤和肝转移。在肿瘤微环境的高GSH水平下,二硫键断裂,引发分子内重排,开启NIR-II荧光。在原位乳腺癌和肝转移模型中,该探针均能清晰地勾画出肿瘤边界,并实现对转移灶的稳健可视化。
另一款GSH响应的NIR-II荧光探针LJ-GSH被设计用于肺癌转移的成像和术中肿瘤引导。该探针在GSH作用下,其猝灭基团被裂解,荧光团骨架变得平坦,导致发射波长红移并开启荧光。在原位肿瘤和肺转移模型中,该探针均能有效区分肿瘤与正常组织,信噪比最高可达7.2,为转移灶的识别和定位提供了有力工具。
2.2. 肿瘤微环境响应探针
肿瘤微环境(TME)是一个复杂的病理生态系统,具有酸性、缺氧、高间质液压和高粘度等区别于正常组织的生化和物理特征。这些特征不仅影响肿瘤的进展和治疗反应,也为靶向成像提供了独特的生物标志物。
2.2.1. pH响应探针
实体瘤的酸性微环境是其标志性特征之一。pH响应的NIR-II探针通常包含酸敏感基团(如腙键或叔胺),在酸性条件下发生结构或电子变化,改变分子的ICT特性,从而实现肿瘤特异性的荧光激活。
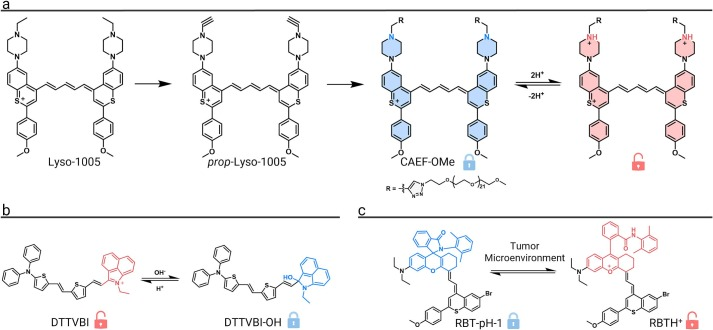
一款pH激活的NIR-II荧光探针CEAF-OMe,其分子内的哌嗪基团在酸性环境中质子化,抑制了荧光猝灭,使荧光强度显著增加。该探针在生理条件下形成无荧光的纳米聚集体,进入细胞后在酸性的溶酶体中被激活,荧光增强高达108倍。在体内,它能快速勾画出肿瘤轮廓,信噪比可达10以上并维持超过36小时。
另一款具有AIE特性的pH响应探针DTTVBI NPs,被设计为一种可逆的NIR-II光敏剂,用于成像引导的光疗。在肿瘤的酸性微环境(pH ~6.5)下,探针的C=N双键质子化,不仅增强了荧光,还提升了光动力疗效。在回到中性环境后,探针则会自我失活,从而最大限度地减少对健康组织的损伤。
通过对罗丹明染料进行结构改造,研究人员开发了pH响应的NIR-II光敏剂RBT-pH-1 NPs。其螺内酰胺环在酸性条件下开环,扩展了π-共轭体系,使荧光发射波长红移并显著增强。在小鼠肿瘤模型中,该探针在肿瘤部位选择性富集,并发出强烈的NIR-II荧光,验证了其在肿瘤精准可视化和PDT中的应用潜力。
2.2.2. 缺氧响应探针
缺氧是实体瘤的另一典型特征,它为肿瘤特异性成像和治疗提供了宝贵靶点。硝基还原酶(NTR)是肿瘤缺氧的关键生物标志物之一。
首个NTR响应的比率型NIR-II荧光探针Rap-N被成功开发,用于可视化肿瘤内部的氧气水平。在缺氧微环境中,NTR将探针的硝基还原,引发1,6-消除反应,使荧光发射峰从940 nm红移至1010 nm。这种比率信号的变化能够动态、定量地反映肿瘤的氧合状态,有助于识别侵袭性强的缺氧区域。
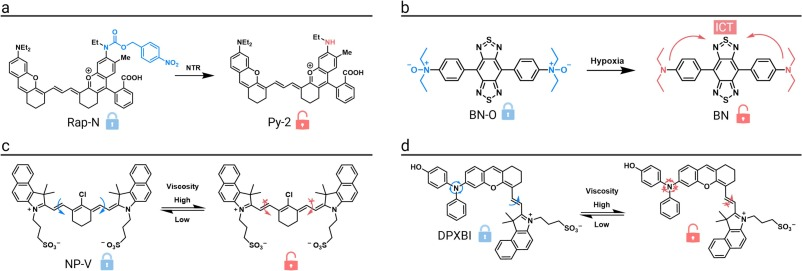
为整合诊疗功能,一种缺氧响应的诊疗纳米探针BC@Z-M被成功构建。该探针中的荧光染料含有一个缺氧敏感的N-氧化物基团,在缺氧条件下被还原,导致分子结构从A-A型转变为D-A型,ICT效应增强,荧光红移至约900 nm,信号增强112倍。该探针在激活NIR-II荧光的同时,还可用于光声成像,显示出在缺氧肿瘤诊断中的巨大潜力。
2.2.3. 粘度响应探针
粘度是生物系统的一个基本物理性质,也是一种新兴的疾病诊断生物标志物。癌症、肝损伤等病理过程常伴随着细胞内或细胞外粘度的改变。
一款创新的粘度响应NIR-II荧光探针NP-V被开发用于标记肝损伤部位并指导手术切除。该探针是一种“分子转子”,在低粘度环境中,分子内旋转消耗了激发态能量,导致荧光猝灭;在高粘度环境中,分子内旋转受限,非辐射衰减途径被抑制,荧光显著增强。在肝缺血再灌注损伤(HIRI)小鼠模型中,该探针在肝损伤区域的荧光远高于正常组织,信噪比达到3.7,有效指导了损伤组织的手术切除。
另一款具有AIE特性的粘度响应NIR-II荧光探针DPXBI,同样基于分子转子机制。随着粘度升高,其分子内旋转受限,荧光恢复,发射峰位于911 nm附近,荧光增强近10倍。在HIRI小鼠模型中,该探针成功实现了对早期肝损伤的可视化,并揭示了损伤部位的空间异质性,展示了其在高精度手术导航中的应用价值。
2.3. 酶响应探针
酶是生物体内高效、专一的催化剂,其异常表达或功能失调与多种重大疾病的发生发展密切相关。
碱性磷酸酶(ALP)是肝损伤等疾病的重要标志物。一款智能荧光探针TTX-P被设计用于原位检测糖尿病肝损伤。该探针的磷酸基团在ALP催化下水解为羟基,释放出荧光团,增强了分子的给电子能力,导致荧光信号显著增加。由于酶的高度特异性,该探针能够以高达5的信噪比对肿瘤和糖尿病肝损伤进行成像。
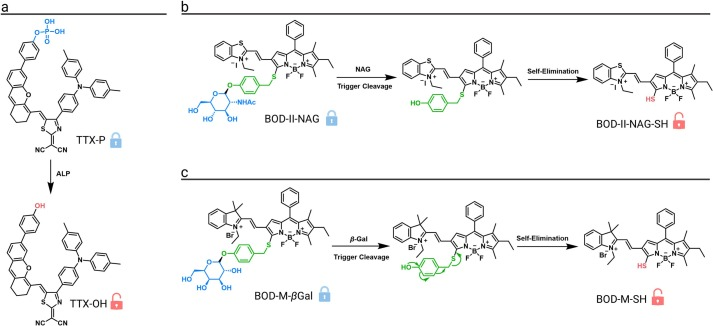
N-乙酰-β-D-葡糖胺酶(NAG)是肾损伤的重要生物标志物。一款由NAG激活的智能NIR-II荧光纳米探针BOD-II-NAG-NP被成功设计。NAG酶能够特异性水解探针上的N-乙酰-β-D-葡糖胺残基,随后发生1,6-消除反应,释放出NIR-II荧光染料,使其在1000 nm处的荧光显著增强。在药物诱导的急性肾损伤和糖尿病肾病模型中,该探针均显示出高度的特异性和灵敏的响应性。
β-半乳糖苷酶(β-gal)水平升高是卵巢癌的特征之一。一款小分子探针BOD-M-βGal通过将β-半乳糖残基与BODIPY染料共轭而构建。在β-gal催化下,半乳糖残基水解,随后发生自消除反应,激活染料的NIR-II荧光,信号增强高达35倍。在模拟深层组织成像中,该探针的信噪比达到6.43,并在卵巢肿瘤模型中观察到强烈的NIR-II荧光信号。
2.4. 双重刺激响应探针
为提高靶向精度、减少假阳性,研究人员开发了双重刺激响应探针,它们能整合对两种不同病理信号的响应,如氧化还原失衡、pH变化、缺氧或酶过表达等。这类探针通常采用“与”逻辑门设计,即只有在两种刺激同时存在时才激活荧光,从而实现更精细的时空控制和更高的成像精度。
一款能够同时监测NO和H₂S动态变化的双响应荧光探针BOD-NH-SC被成功设计。该探针包含两个独立的响应模块:一个对NO响应,激活645 nm的近红外荧光;另一个对H₂S响应,开启936 nm的NIR-II荧光。更有趣的是,该探针可以通过H₂S触发的反应可逆地释放S-亚硝基,实现荧光信号在两个波段之间的多次循环切换。
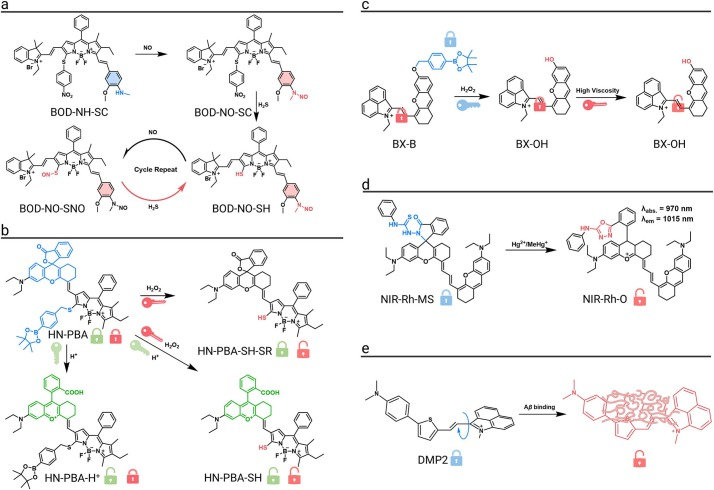
针对肿瘤微环境高粘度和高H₂O₂水平的特征,一款双响应NIR-I/II荧光探针BX-B被设计出来。在H₂O₂存在下,探针释放NIR-I荧光信号;在高粘度环境中,荧光进一步放大并发出NIR-II荧光。只有当两种刺激同时存在时,NIR-II荧光才会显著增强,从而最大限度地减少了假阳性。该探针还可用于评估PDT和PTT的治疗效果。
利用肿瘤微环境低pH和高H₂O₂的特点,一款pH/H₂O₂双响应的NIR-II荧光探针HN-PBA被设计用于肿瘤成像和术中导航。在酸性和H₂O₂的双重作用下,探针的“双重锁”被打开,NIR-II荧光信号显著增强约17.1倍。在动物模型中,该探针对原发肿瘤和肺转移灶的成像信噪比分别高达24.3和6.4。
2.5. 其他响应探针
除上述常见生物标志物外,重金属离子、疾病特异性蛋白等也可作为NIR-II荧光探针的激活刺激物,拓宽了响应性成像的应用范围。
为了实时监测剧毒重金属汞离子(Hg²⁺ 和 MeHg⁺)在体内的积累,一款NIR-II响应荧光探针NIR-Rh-MS被成功开发。该探针在与汞离子结合后,其螺内酰胺环开环,触发1015 nm处强烈的荧光“开启”信号。在体内,该探针成功地区分了Hg²⁺诱导的肝毒性(肝脏荧光增强8.1倍)和MeHg⁺诱导的脑毒性(脑部荧光显著增强),为评估汞毒性分布提供了有力工具。
针对阿尔茨海默病(AD)的标志物——淀粉样β(Aβ)斑块,一系列NIR-II荧光探针被设计用于其体内检测。其中,DMP2表现出最高的结合亲和力。在与Aβ纤维结合后,其扭曲分子内电荷转移(TICT)过程被抑制,分子转变为高荧光发射状态,NIR-II荧光强度增强41.8倍。由于其良好的血脑屏障通透性,DMP2在AD模型小鼠的脑中迅速富集,荧光强度比野生型对照组高约1.5倍,证实了其对Aβ斑块的特异性靶向能力。
3. 结论与展望
综上所述,刺激响应性NIR-II荧光探针基于“关-开”工作机制,仅在特定生物条件下才发射荧光。它们在正常组织中背景信号低,能提供更高的时空分辨率和对比度,已成为生物成像领域的一项前沿技术。这类探针凭借其精确可调的结构、光物理性质和良好的生物相容性,在响应氧化还原、pH、粘度、酶活性和缺氧等多种刺激方面取得了显著进展,极大地提升了深层组织荧光成像的信噪比和空间分辨率。
尽管该领域已取得长足进步,但要实现临床转化,仍面临诸多挑战:
首先,探针的靶向特异性有待提高。 目前,多数探针依赖于EPR效应进行被动靶向,效率有限且存在个体差异。未来,需要通过引入适配体、单克隆抗体或靶向肽等实现主动靶向,以克服EPR效应的局限性,从而提高靶向效率和信噪比,实现更精准的病灶定位和分子成像。
其次,探针的激活效率和光学性能需要优化。 当前,多数刺激响应探针的吸收波长仍局限于NIR-I区,在NIR-II区同时具有高效吸收和发射的探针数量有限,这限制了其在深层组织成像中的应用。此外,许多探针激活后的荧光量子产率仍然偏低,信号放大倍数不足,难以满足高灵敏度成像的需求。未来的研究应聚焦于探针分子轨道能级的精细调控和激发态行为的系统研究,以提升其综合光学性能。
第三,需要开发诊疗一体化的多功能平台。 将刺激响应性NIR-II荧光探针与MRI、光声成像等高分辨率成像技术,以及PDT、PTT等治疗手段相结合,是实现精准医疗的重要方向。这种多功能平台能够克服单一模态的局限性,实现对病理组织的全面评估,并基于成像信息进行实时治疗反馈和精准引导,从而提升治疗的整体效果与安全性。
最后,必须加速探针的临床转化进程。 这要求对探针的生物安全性、体内代谢途径和排泄动力学进行系统性研究。在大动物或类器官模型上评估探针的分布、代谢归宿和最终清除情况,对其潜在毒性和长期安全风险进行全面评估,是确保人类健康和临床应用可持续性的关键所在。