💡【Chem. Soc. Rev】透视生命:近红外二区荧光成像10年简史与有机探针的7重进化
[!INFO] ✨文章标题:Construction and optimization of organic fluorophores in NIR-II fluorescence imaging ✉️作者: Xiaozhen Li, Wei Huang 等 🔗链接:https://doi.org/10.1039/D5CS00063G
在现代医学的诊断与治疗中,体内成像技术发挥着不可替代的作用。我们熟知的计算机断层扫描(CT)、磁共振成像(MRI)和正电子发射断层扫描(PET)等技术,虽然功能强大,但仍存在成本高昂、存在电离辐射或空间分辨率有限等缺点 。因此,寻找一种高灵敏、无创、低成本的互补成像模式,一直是科研人员追求的目标。
荧光成像(FLI) 以其高时空分辨率、高灵敏度和低成本的优势脱颖而出 。然而,传统的荧光成像,无论是可见光区(Visible, 400-700 nm)还是第一近红外区(NIR-I, 700-900 nm),都面临一个无法绕开的物理难题:生物组织的散射和自发荧光 。人体组织内的蛋白质、脂肪和水分等内源性物质会吸收和散射这些波长的光子,导致穿透深度非常有限(NIR-I 通常只有 ) 。
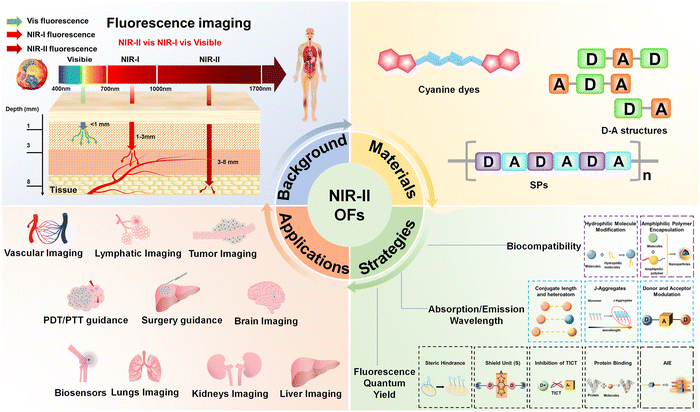
大约在 2009 年,科学界引入了第二近红外区(NIR-II) 的概念,其波长范围在 至 之间 。这是一个生物组织散射和自发荧光都大幅减弱的“光学窗口”,允许光子在体内畅行。因此,近红外二区荧光成像(NIR-II FLI) 能够实现 的更深穿透深度和更清晰的成像质量,在肿瘤成像、手术导航、器官功能监测等生物医学领域展现出巨大的潜力 。
虽然无机荧光探针(如稀土纳米颗粒、量子点)曾是早期研究的热点,但其潜在的重金属毒性泄漏和不可生物降解性阻碍了临床应用 。正因如此,有机荧光探针(OFs) 凭借其低毒性、易于生物降解以及结构可灵活调控的独特优势,成为了 NIR-II FLI 领域最炙手可热的“明星” 。
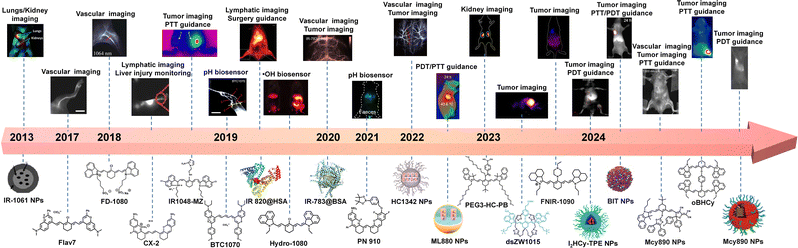
这篇权威综述系统性地梳理了近 10 年来有机探针在 NIR-II FLI 领域的研发进展,揭示了科学家们如何通过 7 种核心技术策略,克服了探针性能的“先天不足”,点亮了纳米世界的深层奥秘 。
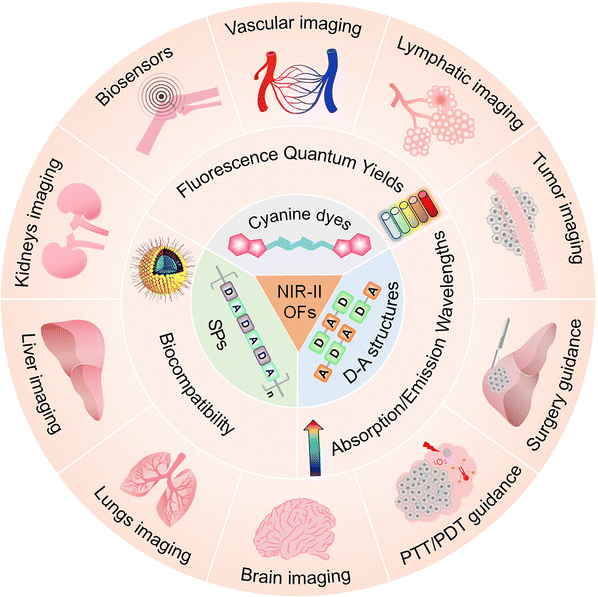
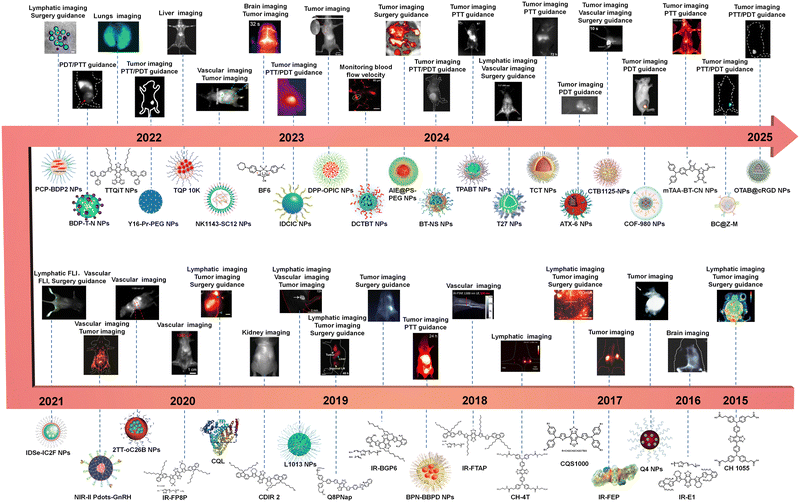
领域全景图与主要进展梳理:有机探针的三大分支与七重进化
自 NIR-II 概念提出以来,有机荧光探针的研究经历了爆发式增长。从分子结构上看,目前主流的 NIR-II 有机探针可以归纳为三大主要分支,它们各有侧重,共同构筑了该领域的全景图。
1. 经典分支:花青染料(Cyanine Dyes)
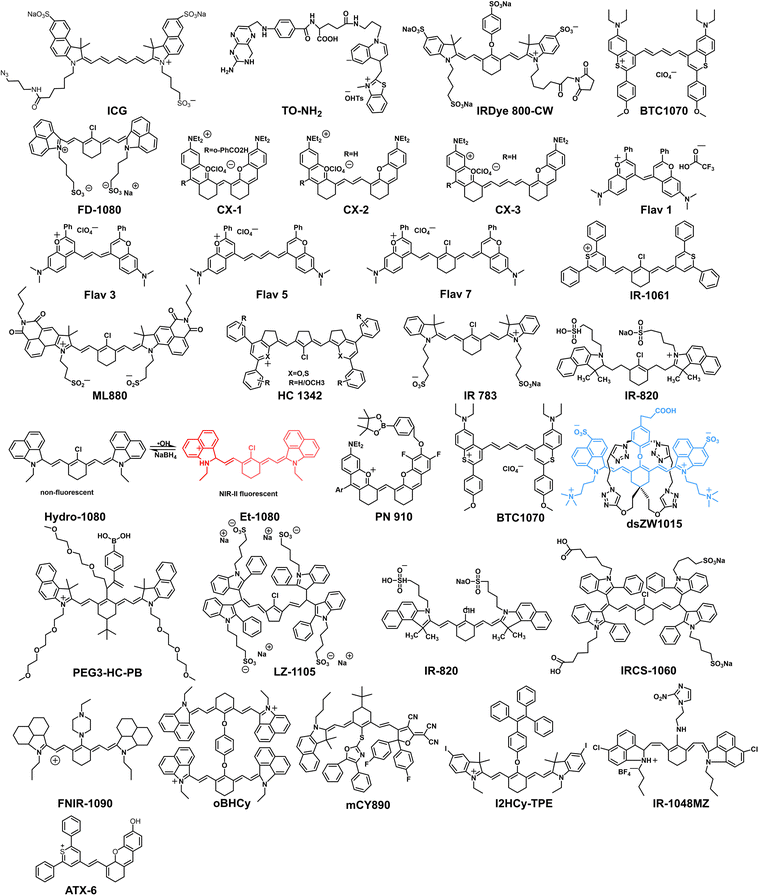
花青染料是历史最悠久、应用最广泛的荧光染料之一,最早可追溯到 1856 年的合成 。它们以其高摩尔消光系数、窄吸收/发射带宽以及荧光光谱易于调控的特点而著称 。尤其值得一提的是,目前 FDA 批准临床使用的染料——吲哚菁绿(ICG) 就是花青染料的代表 。
然而,传统花青染料的不足也十分明显:它们往往发射波长较短(多集中在 NIR-I),并且在水溶液中易发生荧光猝灭,稳定性较差 。为了克服这些问题,科研人员必须对花青骨架进行复杂的功能化和纳米化。例如,FD-1080 是一种新型花青染料,其最大发射波长可达 ,通过与胎牛血清(FBS)形成复合物后,其量子产率可以从 提升至 。另一系列 CX 染料(如 CX-2)则展现出优异的淋巴成像性能,在裸鼠体内能清晰分辨出细微的淋巴管 。
2. 核心分支:D-A 结构共轭小分子(D-A Structured Small Molecules)
这类探针通过在分子结构中精确连接电子供体(D) 和电子受体(A) 单元,形成了独特的推拉电子系统(例如 D-A-D、A-D-A 等) 。这是目前 NIR-II 探针设计中最核心的方法体系,其优势在于:
精确调控: 通过精确调控 D/A 单元及其共轭连接单元,可以灵活调节分子的分子内电荷转移(ICT) 效应,进而精细地控制分子的光带隙和吸收/发射波长 。
性能优异: 它们具有明确的化学结构、稳定的光学特性、高消光系数以及良好的生物代谢特性 。
例如,BTFQ/DMPC 是一种基于 D-A-D 结构的两性离子荧光团,它能与脂质体纳米剂(DMPC)结合,在水溶液中仍保持较高的量子产率(约 ) 。在活体成像中,BTFQ 在 激光激发下,其脑血管、腹部血管和后肢血管的信噪比(SBR) 比 激发高出 2 到 5 倍,充分展示了 NIR-II 成像的优越性 。
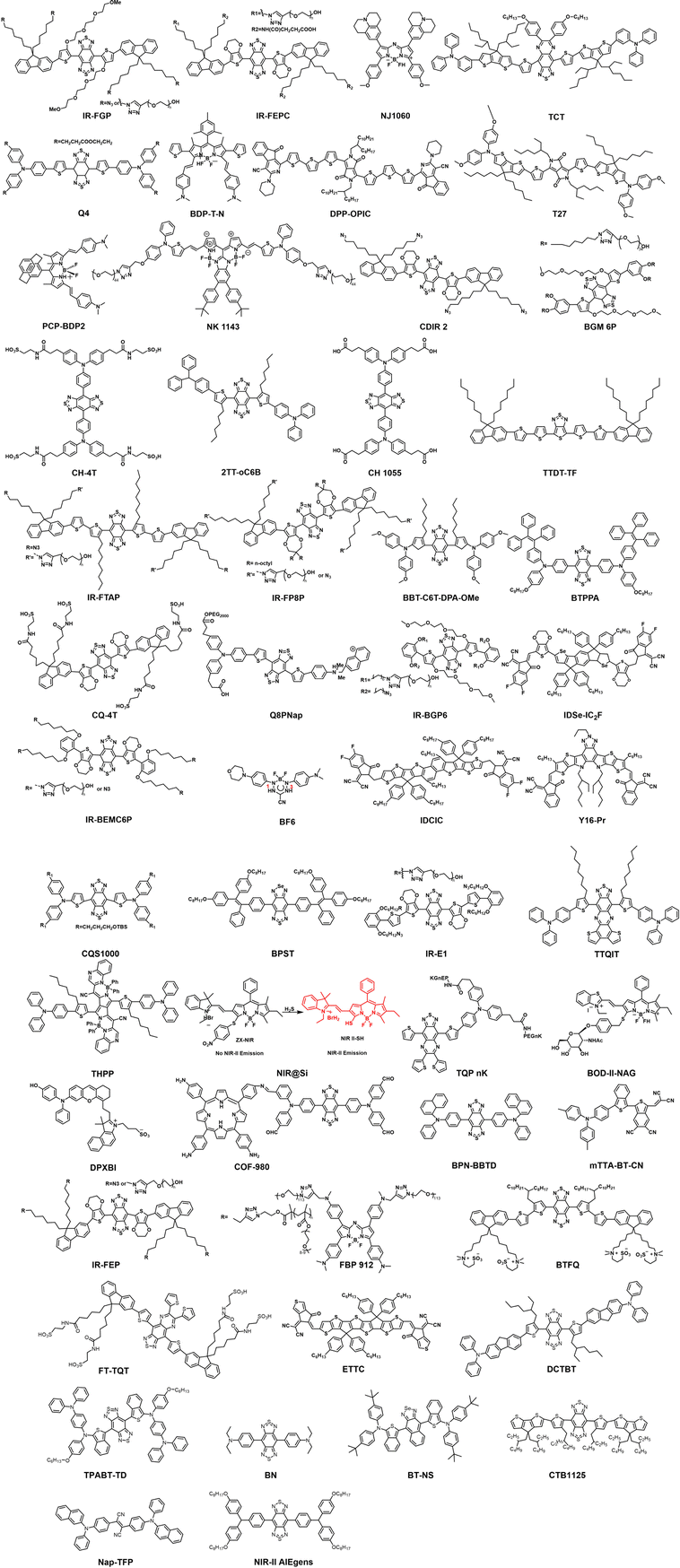
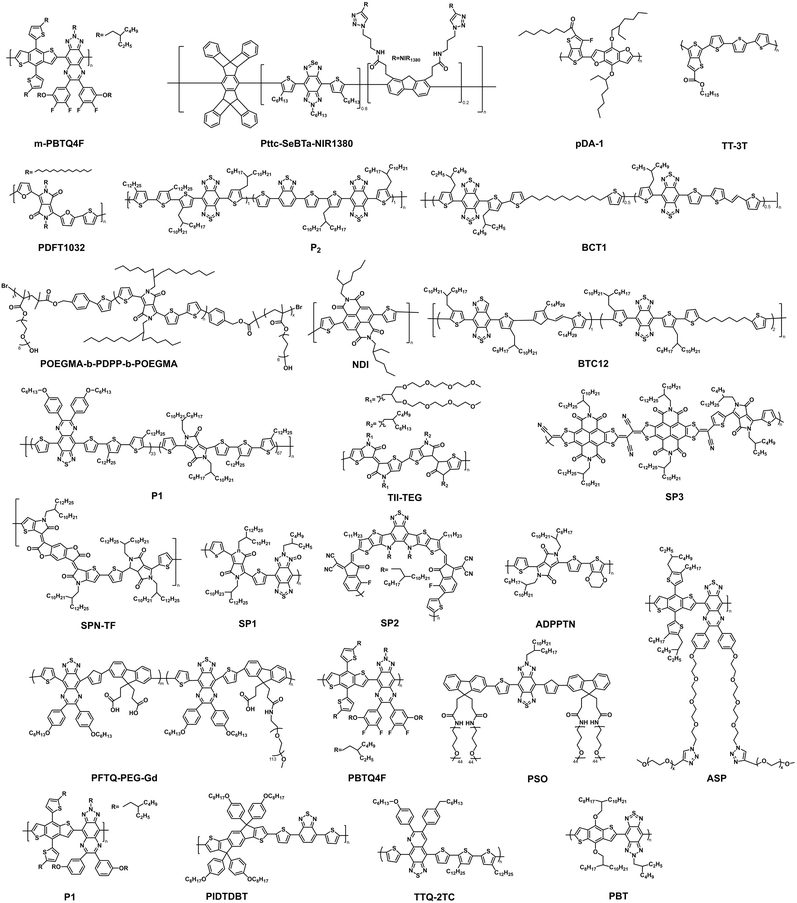
3. 前沿分支:半导体聚合物(Semiconducting Polymers, SPs)
半导体聚合物是分子量高达 的大分子,由多个共轭小分子单元聚合而成 。它们是解决荧光亮度不足的“终极武器”:
超高亮度: 由于重复的结构单元增加了共轭体系的长度,SP 具有极高的光吸收系数,这在低功率密度的深层组织成像中至关重要 。根据荧光亮度公式 ,高吸收系数()能显著提升整体亮度 。
多功能性: 它们具有良好的光稳定性、易于修饰和功能化以及优秀的生物相容性 。
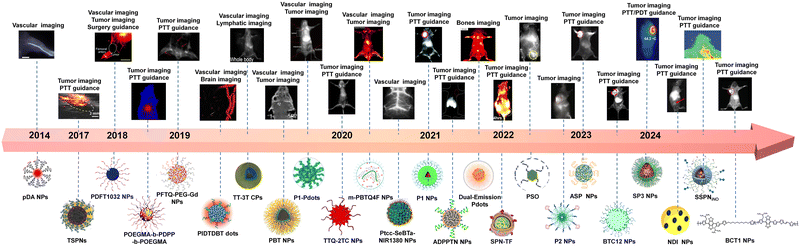
例如,pDA-PEG 是最早被报道的 NIR-II SPs 之一,其发射峰在 ,被用于血管成像,能够以超短的曝光时间()观察到直径小于 的毛细血管 。P2 纳米颗粒是基于 D-A-D-A 结构的 SPs,结合了 NIR-II FLI 和光声成像(PAI) 的双模态功能,可实现对肿瘤的精确诊断和光热治疗指导 。
有机探针的“七重进化”:核心性能优化策略
要让这些有机探针真正投入使用,必须克服荧光量子产率(QYs)低、吸收/发射波长不够长和生物相容性差这三大核心挑战 。科研人员通过精妙的分子和纳米工程,开发了七大关键优化策略,实现了探针性能的质的飞跃。
第一重进化:量子产率(QYs)增强的四重策略
提高量子产率是增强 NIR-II FLI 信号、改善信噪比(SBR)和提高成像清晰度的关键 。
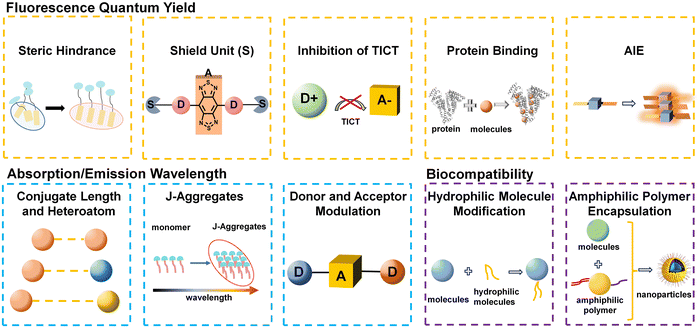
空间位阻抑制聚集猝灭(ACQ):
聚集体诱导猝灭(ACQ)是花青染料等传统荧光团在水溶液中亮度下降的主要原因 。引入较大的空间位阻基团可以减少分子间相互作用,有效抑制聚集,从而减轻 ACQ 效应 。例如,NK1143 染料通过与空间位阻调节剂 SC12 共组装,显著提高了荧光亮度,并实现了 8 mm 的深层组织穿透深度 。
引入屏蔽单元(Shielding Units):
将非共轭的屏蔽单元插入共轭骨架中,能够隔离共轭骨架与溶剂分子或其他分子间的相互作用,有效抑制水溶液中的荧光猝灭 。例如,S-D-A-D-S 结构的 CDIR2 探针,通过引入二烷基芴作为屏蔽单元,使其在 PBS 中的 QY 达到 2.2%,显著优于 CH1055 和 IR1061 等传统探针 。
抑制扭曲分子内电荷转移(TICT):
TICT 是一种伴随分子结构扭曲的电荷转移过程,虽然可能导致发射波长红移,但会通过非辐射衰减猝灭荧光并损害光稳定性 。通过将分子结构“刚化”(如环化)、调整电子供/受体能力或利用大体积基团/脂质体,可以有效抑制 TICT 现象,从而大幅提升荧光强度 。
构建聚集诱导发光(AIE)体系:
AIE 现象的原理与 ACQ 恰好相反,它依赖于限制分子内运动(RIM)。在聚集态下,分子内振动和旋转等非辐射弛豫途径受限,从而激活辐射衰减,实现强烈的荧光发射 。例如,2TT-0C26B 纳米颗粒就是一种结合了抑制 TICT 和 AIE 机制的 D-A 型分子,实现了高达 11.5% 的高 QY,并在 1500 nm 波段实现了高分辨率血管造影 。
第二重进化:发射波长 () 红移的三重机制
将探针的吸收和发射波长推向更长的 NIR-II 波段,是实现深层组织成像和提高分辨率的物理基础 。
延长共轭长度与引入杂原子:
遵循“花青极限”等规则,通过增加共轭链的碳原子数或引入杂原子(如噻吩)来扩展 π 电子云分布,可以减小分子的 HOMO-LUMO 能隙,从而使吸收和发射光谱向长波长红移 。例如,Flav 系列染料通过增加甲川单元,成功将发射波长从 680 nm 扩展至 1045 nm 。
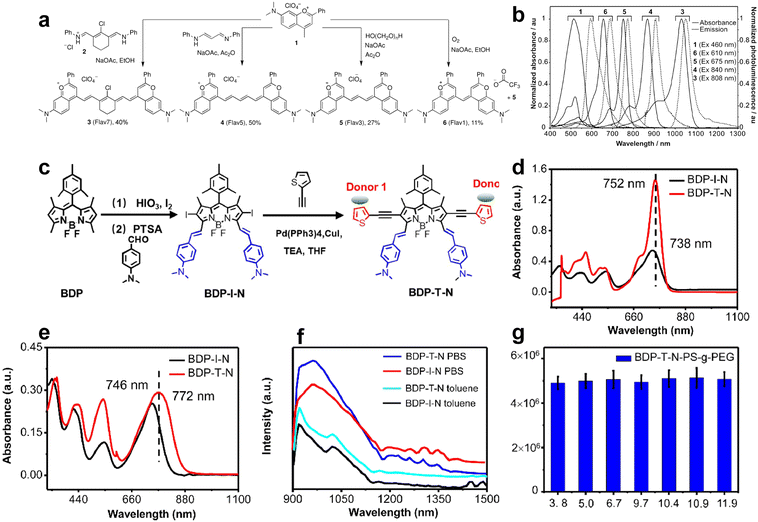
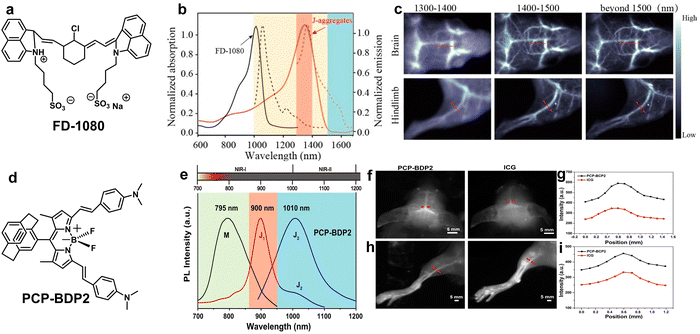
构建 J-聚集体:
J-聚集体是一种“头尾相接”的高序分子堆叠模式,能够实现相长激子耦合,从而使吸收和发射峰出现显著的红移 。例如,FD-1080 染料通过组装形成的 J-聚集体,其发射波长从单体的 1080 nm 显著红移了约 300 nm,达到了 1370 nm,实现了 1300−1500 nm 范围的高分辨率血管成像 。
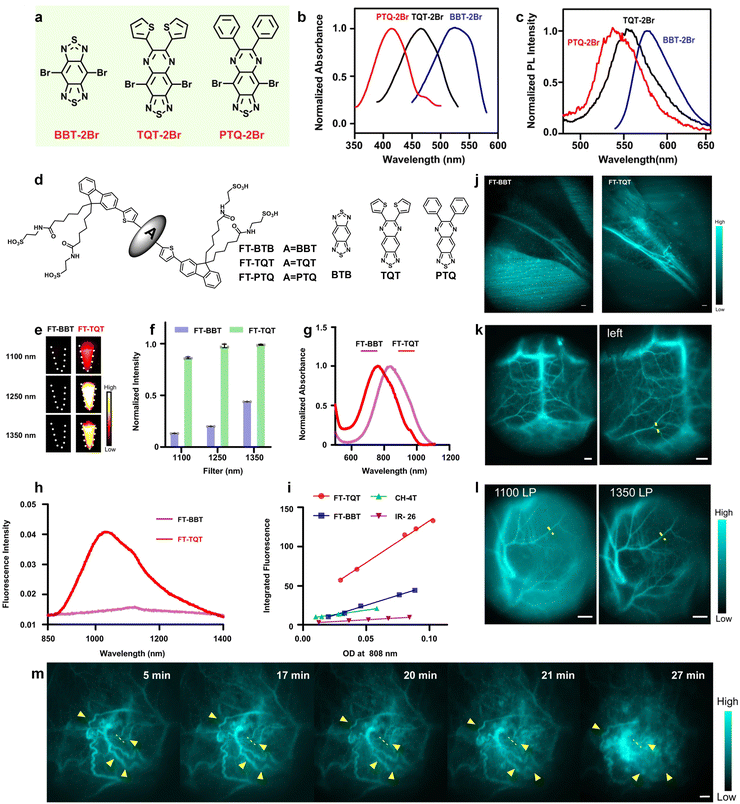
D/A 单元精确调控:
通过改变 D-A 结构中供体和受体单元的电子推拉能力,可以精确调控分子内电荷转移程度,进而收窄 HOMO-LUMO 能隙,实现波长红移 。例如,FT-TQT 探针通过使用 TQT(噻吩并喹啉噻二唑)这一强电子受体,成功将能隙调至 1.3 eV 左右,使其 QY 达到 0.49%(高于 FT-BBT 的 0.23%),在血管成像中显示出更高的对比度 。
第三重进化:生物相容性(Biocompatibility)提升的双向路径
低水溶性、非特异性聚集和体内降解是阻碍 OFs 临床应用的主要障碍 。
亲水分子修饰:
这是最直接的分子工程方法,通过在疏水分子上直接引入亲水基团,如聚乙二醇(PEG)链、羧酸或磺酸基团,来提高水溶性并促进肾脏排泄,避免聚集和潜在的排泄功能障碍 。例如,CH1055-PEG 化后,其分子量(8.9 kDa)低于肾脏排泄阈值,实现了 24 h 内超过 90% 的快速尿液清除 。
两亲性聚合物纳米封装:
对于难溶的疏水性 OFs,常采用纳米沉淀法等方法将其封装到两亲性聚合物(如 DSPE-PEG、F127)中形成纳米颗粒(NPs) 。这种纳米化策略不仅极大地提高了水相稳定性,减少了与生物分子(如蛋白质)的非特异性相互作用,还为其体内应用提供了良好的生物相容性 。例如,水不溶性的 IR-1061 染料经过 PEG 化脂质体封装后,其在血清和血液中的稳定性显著增强,成功应用于活体血管成像 。
关键挑战与争议热点分析:五大瓶颈亟待突破
尽管有机探针领域取得了巨大的成就,但距离大规模临床应用仍有诸多挑战。综述文献清晰地指出了该领域当前面临的五大关键瓶颈。
首先,是光学性能的“权衡悖论”。几乎所有的优化策略都难以同时兼顾所有理想特性 。例如,延长共轭长度虽然可以实现波长红移,但往往会牺牲量子产率或增加分子内运动,从而降低亮度。在许多情况下,探针的性能提升是相互排斥的。因此,如何通过更复杂的理性分子设计,在量子产率、波长和生物动力学之间找到最佳的平衡点,仍然是该领域的核心科学问题 。
其次,是硬件与标准化之间的“鸿沟”。当前的成像仪器在满足深穿透深度和高分辨率的实时动态监测方面存在局限性 。例如,高灵敏度的 InGaAs 探测器通常价格昂贵且定位率低,限制了基层医疗的应用 。更重要的是,现有系统需要较长的积分时间(秒级),难以捕捉血液微循环等快速生理过程(流速 ) 。此外,缺乏统一的 NIR-II FLI 成像窗口定义和评估标准,导致不同实验室和设备之间的成像结果缺乏可比性。建立标准化的成像协议和评估指标是推动 NIR-II FLI 广泛应用的关键 。
第三,是应用范围的“局限性”。目前,大多数 NIR-II 有机探针的应用主要集中在实体肿瘤的成像、血管造影和淋巴系统示踪 。对于许多至关重要的器官和疾病,如心脏、脾脏、膀胱、生殖系统以及复杂的神经系统和肺部疾病,缺乏专门的 NIR-II 有机探针 。如何将应用范围扩展到更广阔的临床领域,特别是针对血脑屏障(BBB)的脑部疾病成像,是未来的挑战。
第四,是临床转化的“天堑”。尽管研究成果丰硕,但迄今为止,只有 ICG 和亚甲基蓝(MB)获得了临床批准 。几乎所有下一代探针都停留在小动物(小鼠、大鼠)实验阶段 。从小动物模型向大动物或非人灵长类动物的过渡面临巨大挑战:不仅包括生物体结构和体内循环的差异导致的外推性问题,还涉及非人灵长类动物实验的高昂成本和严格的安全法规限制,这些都要求在早期研究阶段对探针的毒理学和安全性进行更全面、更细致的评估 。
最后,是多功能集成与单模态的“不足”。单纯依赖一种成像模式难以提供全面的诊断信息 。如何将 NIR-II FLI 与其他成像技术(如 PAI、MRI、PET)或治疗功能(如光热/光动力治疗,PTT/PDT)进行有效结合,实现诊疗一体化(Theranostics) 的多功能探针,是未来研究必须重点解决的技术难题 。
趋势展望与未来应用:多模态、广覆盖与标准化
展望未来,有机荧光探针在 NIR-II FLI 领域的发展将聚焦于以下几个前沿趋势:
多功能化与多模态融合的深度发展:未来的探针设计将更加强调功能集成。有机探针将不再局限于单一的成像功能,而是通过结合 PTT/PDT 活性、PAI 信号、甚至 MRI 顺磁中心,实现多模态成像引导下的精准诊疗 。例如,开发能够实时监测肿瘤微环境(如 pH 值、活性氧)的智能激活型生物传感器,并将其与治疗功能结合,可以极大地提高癌症治疗的效率和精准度 。
组织与器官成像的“全面覆盖”:随着探针性能的优化,研究将扩展到当前覆盖较少的器官和疾病。重点攻克血脑屏障的递送难题,开发针对阿尔茨海默病、脑外伤等神经系统疾病的特异性 NIR-II 探针 。此外,通过探索新的应用方法,如将探针溶解在特定体液(如胆汁)中以实现胆道、胰腺等深层器官的高分辨率成像,将为临床诊断提供新的可能性 。
影像学技术的迭代升级:为了充分发挥高性能探针的潜力,成像设备必须同步升级。未来需要开发具有更高灵敏度、更短曝光时间的国产探测器和成像系统,以实现对微循环等动态生理过程的实时、高帧率捕获 。同时,多种成像技术的协调与整合将成为常态,如 FLI 与 PAI 的结合,能够提供结构、功能和分子特异性的全面信息,大幅提升诊断的准确性 。
推进临床转化的“标准化行动”:为了加速新一代 NIR-II OFs 进入临床,建立统一的成像标准和评估体系势在必行 。这不仅包括规范成像窗口和探针性能指标,还要求研究界积极开展大动物模型实验,系统评估探针的毒理学和药代动力学,以弥合基础研究与临床应用之间的巨大差距 。
总而言之,在过去 10 年中,有机荧光探针在 NIR-II FLI 领域经历了从无到有、从“勉强能用”到“性能卓越”的七重技术进化。通过持续聚焦于理性分子设计和多功能集成,我们有理由相信,这些下一代 NIR-II 探针将在未来的器官成像、肿瘤精准检测、影像引导手术和治疗等多个领域,发挥出颠覆性的作用,最终实现从“透视”小动物到 “透视”人体生命活动的伟大飞跃 。