【NSC通俗解读】🧬肿瘤里的“DNA游击队”被发现弱点,或将开启抗癌新路径!
当我们谈到癌症的“狡猾”,你可能会想到它不断突变、对药物产生抗性。但你或许不知道,有一种名为 环外DNA(ecDNA) 的“脱轨DNA”分子,正在幕后推动癌细胞的进化与逃脱。这项最新研究首次揭示了这些“叛变分子”如何与DNA损伤修复系统“勾结”,从而让癌细胞逃过一劫并继续扩张。
📌什么是环外DNA(ecDNA)?
简单来说,环外DNA 就是那些脱离了染色体、独立存在于肿瘤细胞内的 环状DNA片段。它们不受正常遗传机制的约束,却拥有肿瘤相关的强力基因(比如EGFR、MYC等),就像体制外却异常强势的“DNA游击队”。
这些环外DNA有几个“能力值”特别突出:
- 高拷贝数扩增癌基因,推动肿瘤快速生长
- 随机分配给后代细胞,增加肿瘤内的基因多样性
- 对治疗具有高度适应性,能快速复制耐药基因
所以,破解ecDNA的“生存法则”,将可能颠覆我们目前的抗癌策略。
🔬这项研究做了什么?
为了揭示ecDNA是如何在癌细胞中复制、维持并长期存在的,中国科研团队构建了人类细胞的 ecDNA模型系统,并通过一系列尖端实验技术一步步揭开了它的生存秘密。
具体做了几件关键的事情:
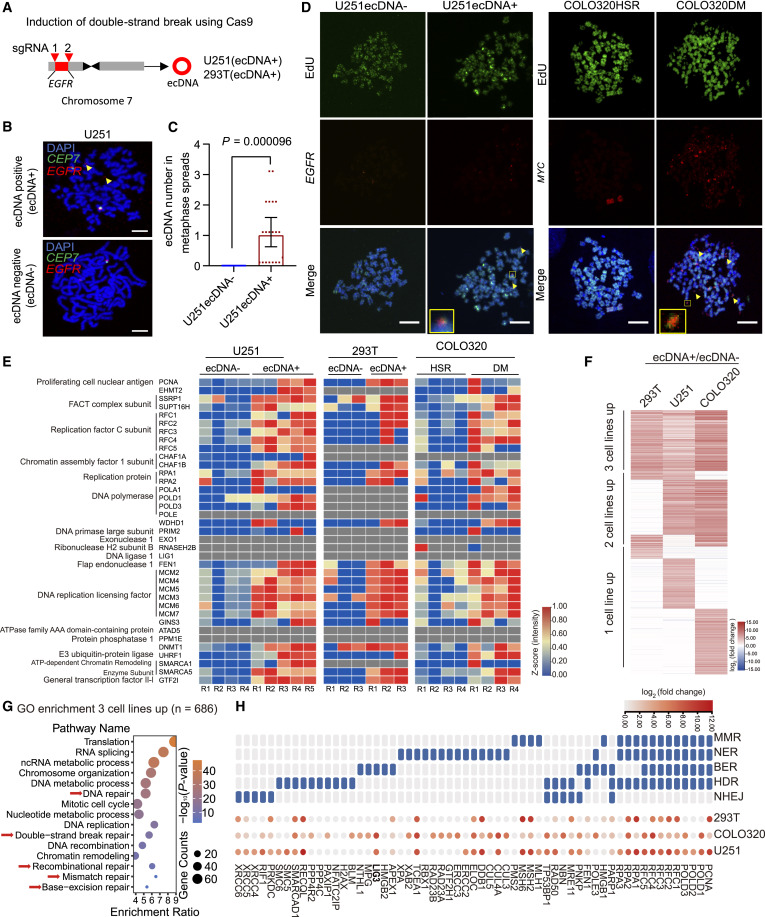
用CRISPR-C技术创建携带ecDNA的肿瘤细胞
比如把EGFR基因剪下来,让它形成环状DNA,模拟癌细胞里真实的ecDNA。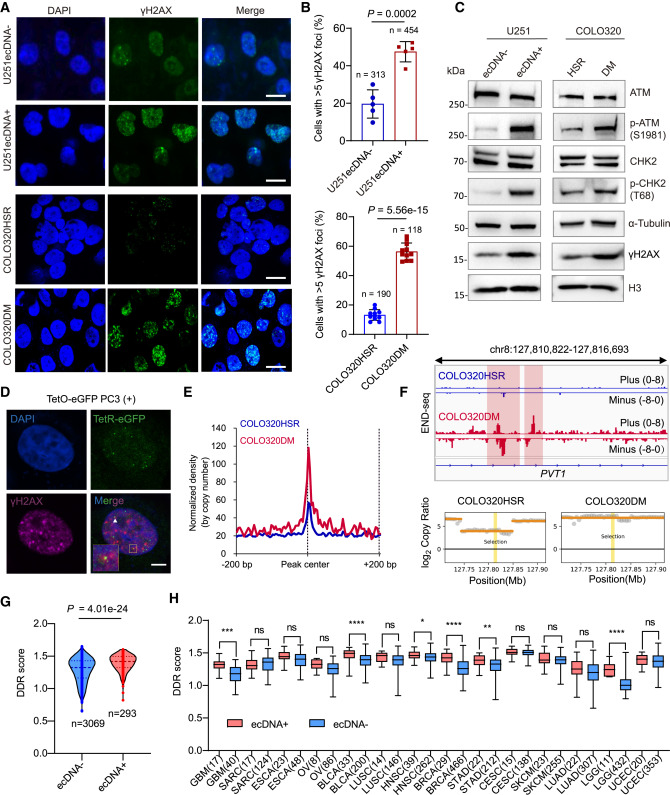
追踪ecDNA的复制过程
用染料标记新合成DNA,并确认ecDNA能自主复制,不依赖染色体。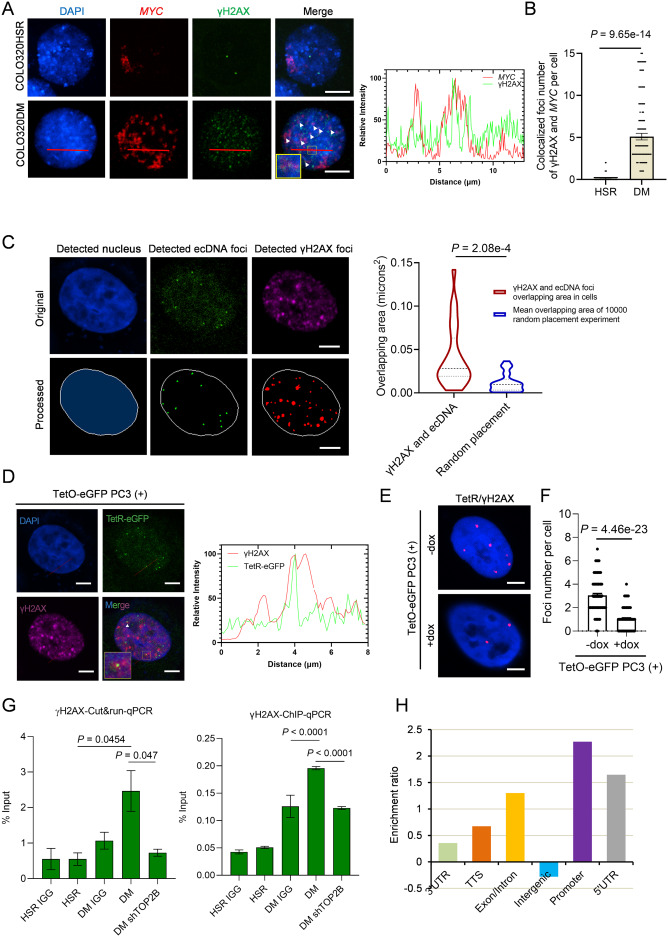
分析细胞蛋白质变化
使用蛋白质组学手段,找到哪些蛋白与ecDNA复制和维护有关。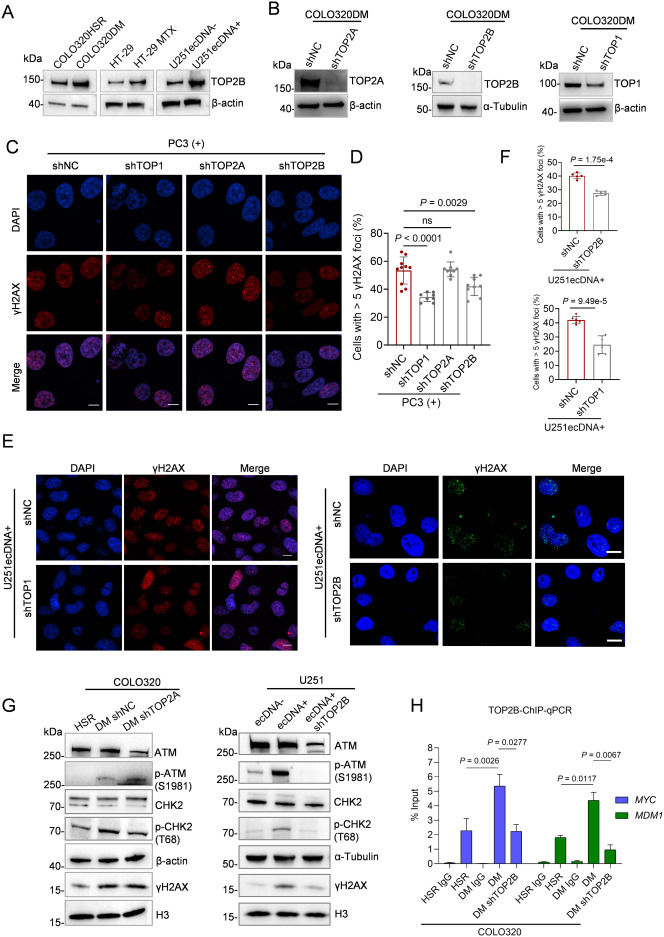
研究DNA损伤反应(DDR)的作用
检测DNA损伤标志物(如γH2AX),探索ecDNA是否与“DNA修复机制”存在联系。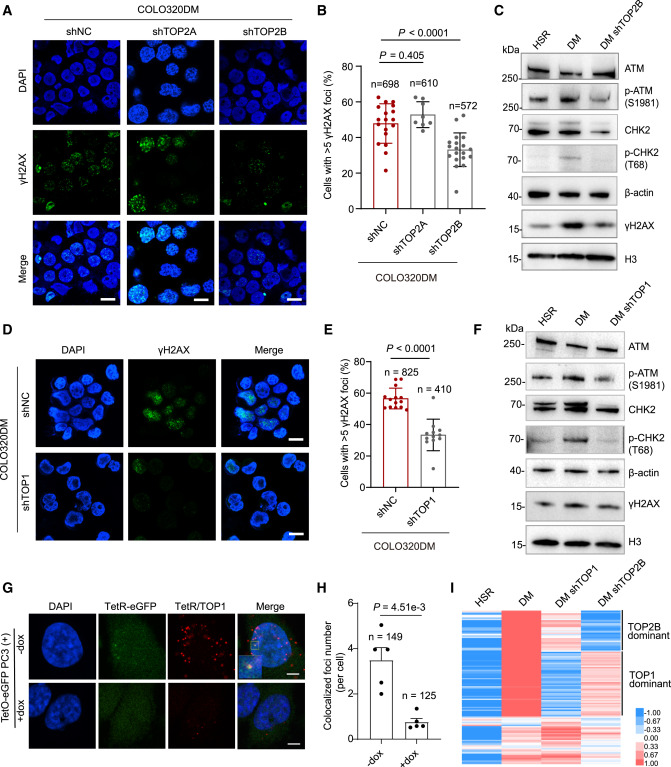
沉浸式“地图”分析
用高通量测序绘制DNA断裂图谱,找到这些损伤主要集中在哪些基因区域。
🧠研究发现了什么?
这项研究得出几个关键发现,让我们用“人话”总结一下:
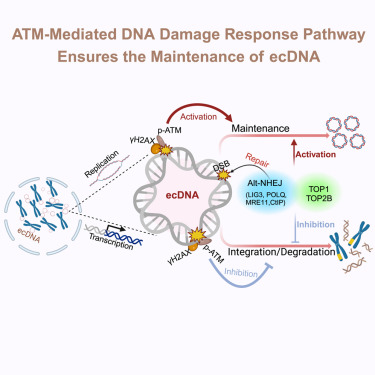
1️⃣ ecDNA复制会引发DNA损伤反应(DDR)
每次ecDNA复制时,都会带来“扭曲”和“缠绕”问题,导致DNA容易断裂(双链断裂)。细胞立刻启动 以ATM为核心的DDR机制,试图修复这些损伤。
但奇怪的是,这种“损伤修复反应”竟然反过来帮助ecDNA维持稳定和繁殖。就像一座桥梁,每次施工都容易塌,但不断修复又让它更牢固。
2️⃣ 两种“解DNA纠结”的酶功不可没
研究发现,拓扑异构酶TOP1和TOP2B 是推动ecDNA复制中的“关键工人”。
- TOP1可以缓解DNA超螺旋,但如果失控会制造断裂点;
- TOP2B则会在DNA上“剪断+缝合”以解开缠绕,失误时就变成“事故现场”。
这些酶生成的“失败剪辑”,正是触发DNA损伤反应的原因。
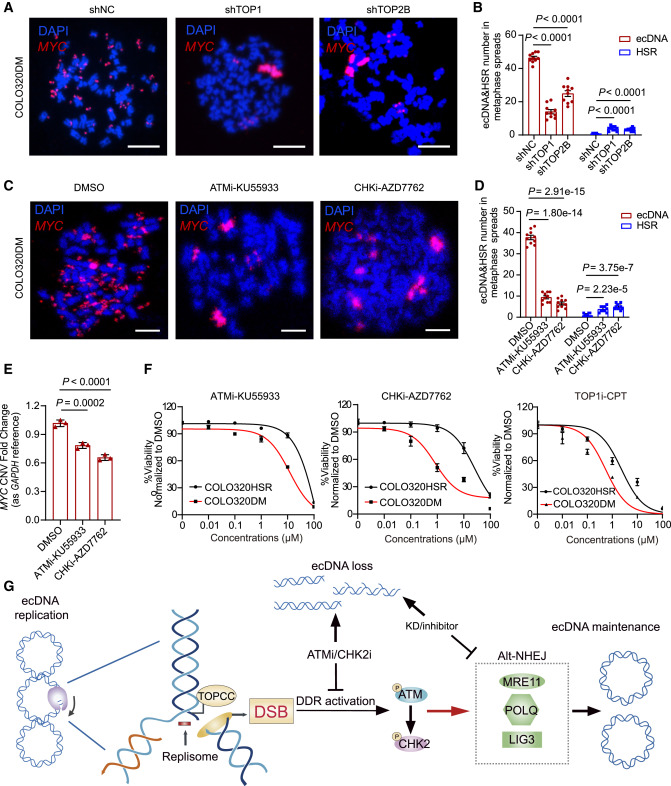
3️⃣ ecDNA复制优先使用“快速但粗糙”的修复通道
当DNA出现断裂时,细胞有两种修复路径:
- 一种是“精准修复”(同源重组),慢但准确;
- 另一种是“快速拼接”(alt-NHEJ),快但可能出错。
ecDNA更偏爱 alt-NHEJ这条捷径,尤其依赖 LIG3 和 POLθ 两个分子。如果阻断这条路径,ecDNA的“圆形结构”就难以维持。
4️⃣ 阻断DNA损伤反应,可抑制ecDNA的维持
研究进一步验证:抑制ATM途径、削弱DDR反应,会导致ecDNA无法维持“圆形状态”,从而逐渐在细胞中消失。
这意味着:癌细胞赖以生存和进化的“DNA游击队”可能被击溃!
💡这项研究有什么意义?
这并不只是“癌细胞又多了一个花招”的发现,而是一个颠覆性的新起点!
✅ 提供全新抗癌策略:精准狙击ecDNA
目前很多抗癌药无效,就是因为癌细胞靠ecDNA逃脱打击。现在我们知道只要 切断DDR通路、特别是ATM信号和alt-NHEJ路径,就可以阻断ecDNA的形成和稳定。
也就是说:
不必正面对抗癌细胞,可以“拆掉它的后勤系统”。
已有的 ATM抑制剂 和 拓扑酶抑制剂 甚至已经在某些药物中出现,未来可望针对ecDNA+肿瘤做精准用药。
✅ ecDNA可作为新型癌症“生物标志物”
由于ecDNA结构特殊、数量剧烈波动,它可作为 肿瘤早期诊断、复发风险评估、耐药监测 的“影子指标”。
你未来去医院,医生可能不仅查基因突变,还会查“你体内有没有这些DNA游击队”。
✅ 推动癌症进化研究新里程
癌症为什么难治?部分原因在于它进化太快。
本研究给出了线索:ecDNA就像“基因加速器”,而这种加速的发生要靠DNA修复系统默许。看似“善意修复”的机制,在癌细胞中却被歪用成“维稳工具”。
这为我们理解癌症适应性、快速进化、转移与耐药的原理提供了新视角。
✨结语:破解癌细胞“生存密码”的又一砖
在这场与癌症的拉锯战中,我们一直在寻找那个“命门”。这项研究表明,有时候最关键的地方不是癌细胞的武器,而是它的“维修系统”。
当我们能精准切断ecDNA的“补给线”,未来或许就能:
- 减缓肿瘤进展
- 延迟耐药发生
- 放大抗癌药物疗效
这篇研究,不只是一次生物学的突破,更是一次未来医学的布局。
如果你喜欢这类内容,欢迎关注科研趣味,带你探索更多来自《自然》《科学》《细胞》等顶刊中的奇妙研究世界🧪🧠🌍
参考文献
Kang, X.; Li, X.; Zhou, J.; Zhang, Y.; Qiu, L.; Tian, C.; Deng, Z.; Liang, X.; Zhang, Z.; Du, S.; Hu, S.; Wang, N.; Yue, Z.; Xu, Y.; Gao, Y.; Dai, J.; Wang, Z.; Yu, C.; Chen, J.; Wu, Y.; Chen, L.; Yao, Y.; Yao, S.; Yang, X.; Yan, L.; Wen, Q.; Depies, O. M.; Chan, K.; Liang, X.; Li, G.; Zi, Z.; Liu, X.; Gan, H. Extrachromosomal DNA Replication and Maintenance Couple with DNA Damage Pathway in Tumors. Cell 2025, 188 (13), 3405-3421.e27. https://doi.org/10.1016/j.cell.2025.04.012.