【Nat.Photon.】5nm “荧光探针” 横空出世!单链超小荧光聚合物点实现16nm活细胞单蛋白追踪精度达
✨文章标题:Single-chain ultrasmall fluorescent polymer dots enable nanometre-resolution cellular imaging and single protein tracking ✉️作者:Yifei Jiang, Qingrui Fan, Jianjun Wang & Xiaohong Fang 等 🔗链接:https://doi.org/10.1038/s41566-025-01767-1
在生物医学的微观世界里,科学家们一直渴望拥有一双 “超高清显微镜”。它不仅要能看清细胞内纳米级的生物结构,还要能实时追踪单个蛋白质的动态活动,这对理解生命机制、攻克疾病至关重要。
但长期以来,这个愿望被两个难题困住:传统荧光染料和蛋白虽小(<5nm),却亮度不足、光稳定性差,难以捕捉快速变化的微观过程;而荧光纳米颗粒虽亮度高、稳定性强,却体型偏大(>10nm) ,容易干扰生物分子的自然活动,且表面化学性质复杂,难以实现精准标记。
就在 2025 年 10 月,发表在《Nature Photonics》上的一项研究,彻底打破了这个僵局。中国科学院的科研团队研发出一种单链超小荧光聚合物点(suPdots) ,尺寸小于 5nm,兼具超高亮度、优异光稳定性和精准标记能力,让纳米级生物成像和单蛋白追踪变得更高效、更易实现。
核心突破:5nm “荧光探针” 是如何炼成的?
要解决传统荧光探针的痛点,关键在于找到 “小尺寸” 与 “高性能” 的平衡点。科研团队另辟蹊径,采用了一种类似 “速冻保鲜” 的创新方法 ——玻璃化策略,成功制备出单链超小荧光聚合物点。
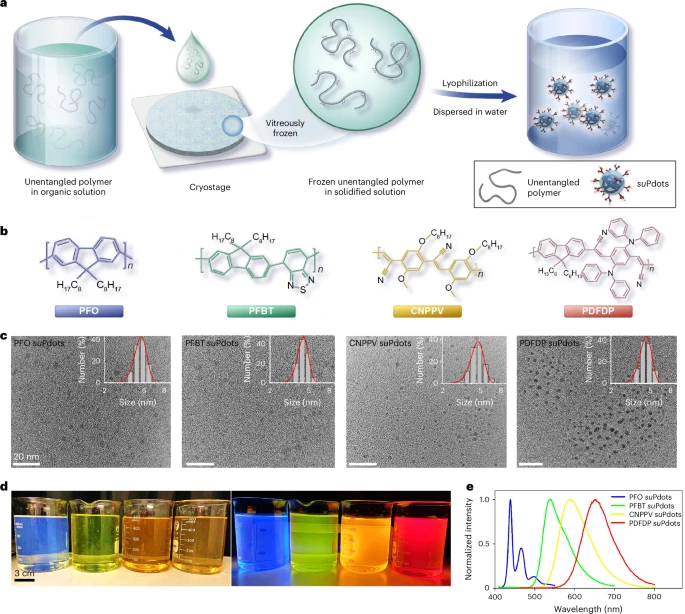
制备原理:给聚合物链 “速冻定型”
这个制备过程可以类比为制作 “纳米级果冻”。首先,科研团队将共轭聚合物溶解在有机溶剂中,形成均匀的前驱体溶液。此时,溶液中的聚合物链像一根根散开的细线,保持着独立的状态,这一步要严格控制聚合物浓度,避免链之间相互缠绕。
接着,他们将这种溶液滴在预先用液氮冷却至≤-150℃的低温台上。瞬间的超低温让溶剂迅速凝固,就像把聚合物链 “冻” 在玻璃状的固体基质中,这就是 “玻璃化” 过程。这个步骤的关键作用是锁定聚合物链的自然构象,防止它们在后续处理中聚集。
最后,通过冷冻干燥去除凝固的溶剂,再将得到的固体重新分散在水中,就形成了单分散的 suPdots。整个过程就像把散开的细线快速冷冻固定,再去除周围的介质,最终得到一根根独立的、尺寸极小的 “荧光探针”。
这种制备方法的优势十分明显。一方面,它能有效抑制聚合物链的缠绕,确保 suPdots 的尺寸控制在 5nm 以下,与绿色荧光蛋白相当;另一方面,该方法具有广泛的适用性,能用于多种商业化荧光聚合物,实现 420-650nm 的可调荧光发射,为多色成像提供了可能。
更重要的是,这种制备工艺还具备良好的 scalability,轻松就能实现 500ml 规模的生产,且不同批次的产品重复性高,为后续的实际应用奠定了基础。储存方面也很便利,在 4℃避光条件下,suPdots 能稳定保存至少 6 个月,始终保持其超小尺寸和优异的光学性能。
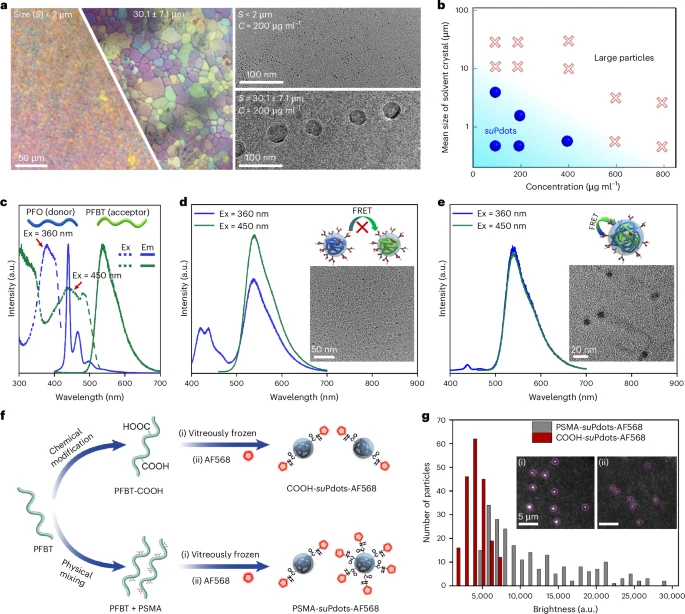
结构特性:单链设计 + 可控功能化
suPdots 最核心的结构特点是 “单链组成” ,这也是它区别于传统荧光纳米颗粒的关键。为了证实这一点,科研团队设计了一组巧妙的实验。他们选择了两种光谱重叠的聚合物 PFO(供体)和 PFBT(受体),如果它们处于同一颗粒中,会发生福斯特共振能量转移(FRET),表现为单一的发射峰。
实验结果显示,通过玻璃化策略制备的 suPdots,在不同激发波长下呈现出两个独立的发射峰,分别对应 PFO 和 PFBT,说明 FRET 效应几乎没有发生,证明每个 suPdots 只包含一种聚合物链。而通过传统纳米沉淀法制备的大尺寸颗粒,则表现出单一发射峰,证实了多链聚集的存在。
这种单链结构带来了一个重要优势:可以精准调控表面功能基团的密度。科研团队通过两种方式实现了羧基(-COOH)功能化:一种是将荧光聚合物与含酸酐的表面活性剂物理混合,另一种是直接在聚合物链上化学引入羧基。
通过与荧光染料 Alexa Fluor 568 的共价结合实验验证,化学合成的 COOH-suPdots 表面羧基密度更均匀,荧光强度分布更窄。这意味着,未来可以通过侧链工程,实现 suPdots 与目标分子的精准化学计量比结合,为精准生物标记提供了可能。
性能实测:碾压传统探针的 “荧光利器”
一款优秀的荧光探针,最终要靠性能说话。科研团队从光物理特性、生物标记能力、超分辨成像表现等多个维度,对 suPdots 进行了全面测试,结果堪称 “碾压级”。
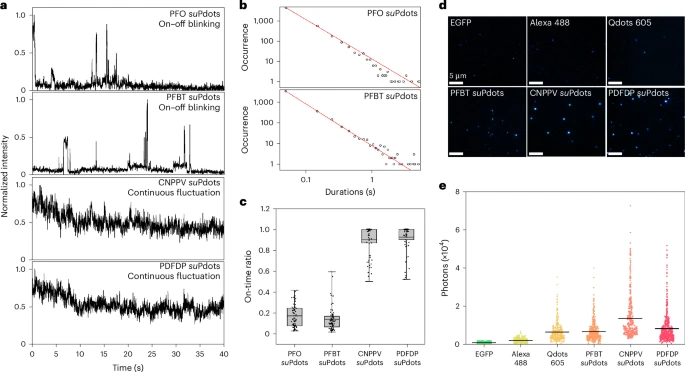
光物理性能:亮度爆表 + 稳定性拉满
亮度是荧光探针的核心指标之一,直接决定了成像的清晰度和追踪的灵敏度。科研团队将 suPdots 与三种常用的商业探针 —— 荧光蛋白(EGFP)、有机染料(Alexa 488)和量子点(Qdots 605)进行了对比测试。
在相同的成像条件下,CNPPV suPdots 的单颗粒每秒光子计数达到了 1.4×10⁴,是 EGFP(约 850)的 15 倍,Alexa 488(约 2.1×10³)的 7 倍,甚至是量子点 Qdots 605(约 6.5×10³)的 2 倍。如果进一步提高激光功率,suPdots 的亮度还能再提升约 2 倍,饱和激发功率仅为 0.2kW/cm²,展现出极强的光响应能力。
光稳定性同样表现出色。在 STED 成像中,经过 150 帧的连续拍摄后,商用 STED 染料 ATTO 565 的荧光信号几乎完全漂白,而CNPPV suPdots 仍保留了超过 50% 的初始荧光强度,PDFDP suPdots 更是保留了 90% 以上,这为长时间持续成像提供了保障。
不同类型的 suPdots 还表现出多样化的闪烁行为。PFO 和 PFBT suPdots 呈现出明显的 “开关闪烁”,而 CNPPV 和 PDFDP suPdots 则表现为连续波动。这种差异与聚合物的主链结构、侧链取代基和缺陷有关,意味着可以通过分子设计来调控 suPdots 的闪烁特性,适配不同的成像需求。
生物标记:高密度 + 低干扰
生物相容性和标记特异性是荧光探针进入生物体系的 “敲门砖”。suPdots 在这方面表现优异,细胞毒性实验显示,即使在 50μg/ml 和 100μg/ml 的高浓度下,孵育 48 小时后,HeLa 细胞的存活率仍保持在较高水平,证明其良好的生物相容性。
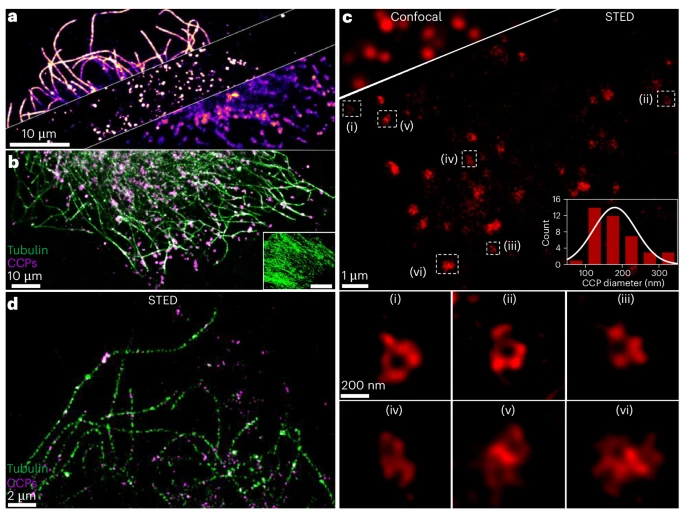
超小尺寸(<5nm)带来了一个关键优势:极低的空间位阻。这使得 suPdots 能够实现高密度的特异性标记,避免了传统大尺寸颗粒因空间拥挤导致的标记不连续问题。科研团队成功用 suPdots 标记了细胞内的多种亚细胞结构 —— 微管蛋白、网格蛋白包被小窝(CCPs)和线粒体,都获得了清晰的成像效果。
尤其是对微管蛋白的标记,suPdots 展现出连续的丝状结构,而传统大尺寸聚合物点(~20nm)标记则呈现出不连续的点状分布,对比十分明显。多色标记方面,利用不同发射波长的 suPdots(CNPPV 发射绿色荧光,PDFDP 发射品红色荧光),可以同时清晰观察到微管蛋白和 CCPs 的相对分布位置,为多靶点成像提供了便利。
超分辨成像:25nm 分辨率 + 多色兼容
刺激发射损耗(STED)显微镜是常用的超分辨成像技术,而探针的性能直接决定了成像分辨率。suPdots 凭借其超小尺寸和高光稳定性,在 STED 成像中表现出惊人的能力。
针对 CCPs 的成像结果显示,在共聚焦显微镜下只能看到模糊的斑点,而使用 CNPPV suPdots 的 STED 成像,成功分辨出了连续的环状结构,甚至能清晰观察到由 2-3 个环状结构组成的 CCPs 聚集体。定量分析表明,STED 成像下 CCPs 的平均直径为 178nm,与电子显微镜和随机光学重建显微镜的结果一致,证明了其成像的准确性。
分辨率方面,CNPPV 和 PDFDP suPdots 在 STED 成像中都实现了25nm 的超高分辨率,是传统聚合物点的 3 倍左右。更令人惊喜的是,suPdots 的大斯托克斯位移(~250nm)让多色 STED 成像变得异常简单 —— 只需一对激发 / 损耗激光(488nm 激发,775nm 损耗),就能实现双色超分辨成像,分辨率达到 51nm,远超现有双色 STED 纳米探针的性能。
这一突破解决了传统多色 STED 成像中需要精准对齐多条光路的难题,大大降低了实验复杂度,为同时观察多种生物结构的动态相互作用提供了强大工具。
单蛋白追踪:16nm 步长 + 50Hz 帧率
在活细胞内追踪单个蛋白质的动态过程,是理解生命活动机制的关键,但这对荧光探针的要求极为苛刻 —— 既要足够小,不干扰蛋白质功能,又要足够亮,能在高帧率下提供清晰信号。
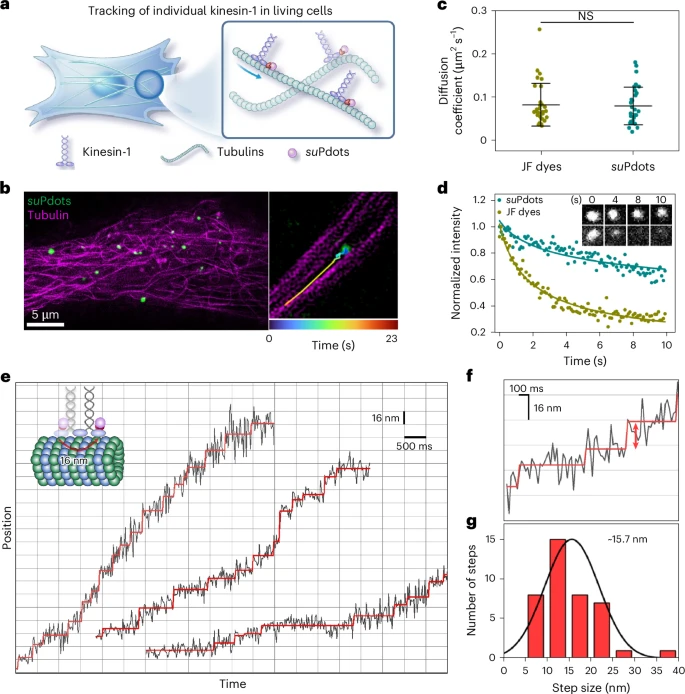
此前,要在活细胞内观察驱动蛋白 - 1(kinesin-1)的步进运动,只能依靠昂贵且复杂的 MINFLUX 显微镜。而科研团队用 suPdots 实现了一个壮举:在普通的转盘共聚焦显微镜上,就完成了活细胞内单个驱动蛋白 - 1 的纳米级追踪。
他们通过 HaloTag 配体将 suPdots 与驱动蛋白 - 1 特异性结合,再通过电穿孔技术将其导入 HeLa 细胞。成像结果显示,suPdots 标记的驱动蛋白 - 1 能沿着微管蛋白定向移动,扩散系数与染料标记的驱动蛋白 - 1 几乎一致(P=0.81),证明suPdots 的结合并没有影响驱动蛋白的正常功能。
追踪精度方面,suPdots 的定位不确定度仅为 8.1nm(理论值 8.5nm),在 50Hz 的 temporal 分辨率下(每帧 20ms),成功捕捉到了驱动蛋白 - 1 约 16nm 的步进运动,统计平均步长为 15.7nm,与 MINFLUX 显微镜的观测结果完全一致。
光稳定性测试中,suPdots 在连续扫描 10 秒后仍保留了 70% 的初始信噪比,而商用 JF 染料在 4 秒后信号就几乎消失了。这意味着,suPdots 能够支持长时间的单蛋白动态追踪,为研究蛋白质在生理环境下的工作机制提供了前所未有的便利。
应用展望:从基础科研到临床诊断的无限可能
suPdots 的出现,不仅解决了荧光探针领域长期存在的 “尺寸 - 性能” 矛盾,更在多个领域展现出巨大的应用潜力。
在基础生物学研究中,它将成为科学家的 “微观望远镜”。凭借超高的空间分辨率和时间分辨率,研究人员可以更清晰地观察细胞内亚细胞结构的精细形态,比如 CCPs 的环状聚集、微管蛋白的网络分布等;更重要的是,能够实时追踪单个蛋白质的动态过程,如驱动蛋白的运输机制、酶的催化过程、受体与配体的相互作用等,为破解生命奥秘提供关键数据。
多色超分辨成像能力则让同时观察多个生物过程成为可能,比如在同一细胞内观察微管运输与囊泡形成的协同作用,这对理解细胞内复杂的信号网络和代谢路径具有重要意义。
在医学诊断领域,suPdots 也有着广阔的前景。其超高灵敏度可以实现早期疾病标志物的精准检测,比如血液中微量肿瘤标志物的检测,为癌症的早期筛查提供新工具;细胞水平的精准成像则有助于病理切片的更精准分析,帮助医生发现传统成像技术难以察觉的微小病变。
未来,随着表面功能化技术的进一步优化,suPdots 有望实现靶向给药与成像监测的一体化—— 既可以作为药物载体,将药物精准递送到病灶部位,又能通过荧光成像实时监测药物的分布和作用效果,为个性化治疗提供支持。
不过,这项技术目前也存在一些需要完善的地方。比如,部分 suPdots 存在的 “开关闪烁” 行为,虽然在某些场景下有用,但在需要持续成像的应用中可能会造成信号中断;此外,虽然已经实现了较大规模的制备,但要满足临床应用的巨大需求,还需要进一步优化工艺,降低成本。
科研团队表示,未来将通过分子结构设计进一步调控 suPdots 的光学性能,同时开发更多针对特定生物靶点的功能化探针,拓展其在活体成像、临床诊断等领域的应用。
结语:荧光探针的 “纳米革命”
从传统荧光染料的亮度不足,到纳米颗粒的尺寸困扰,生物成像领域的科学家们一直在寻找完美的荧光探针。中国科学院团队研发的 suPdots,以5nm 的超小尺寸、15 倍于荧光蛋白的亮度、25nm 的超分辨能力和 16nm 的单蛋白追踪精度,实现了一次颠覆性的突破。
更重要的是,它采用的玻璃化制备方法简单高效、易于规模化,且兼容普通显微镜设备,大大降低了纳米级生物成像的门槛。这意味着,未来更多实验室都能用上这种高性能探针,加速生物医学研究的进程。
随着技术的不断成熟,我们有理由相信,suPdots 将在基础科研、医学诊断、药物研发等多个领域发挥关键作用,帮助我们更深入地探索微观生命世界,为人类健康带来新的希望。这场由中国科学家引领的荧光探针 “纳米革命”,才刚刚拉开序幕。