💊【Nat. Biomed. Eng】 癌症免疫疗法迎来“精确制导”!北大新策略:在肿瘤内“即时组装”抗癌药,T细胞活化率暴增14.8倍,毒性几近于零!
✨文章标题:Tumour-specific bioorthogonal synthesis of proteolysis-targeting chimeras and nanoparticles boosts T cell activity ✉️作者:Zhibo Liu 等 🔗链接:https://doi.org/10.1038/s41551-025-01560-z
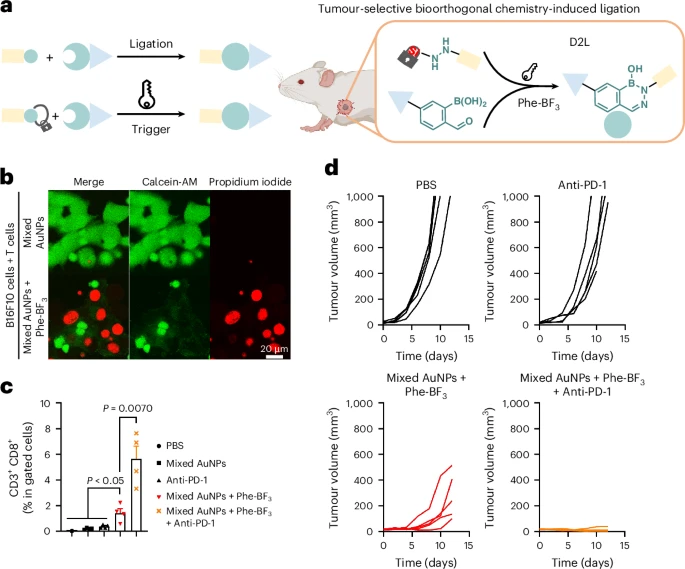
🎯 从“痛点”到“突破”:癌症治疗的精准困境
在现代癌症治疗的战场上,靶向疗法和免疫疗法是两把最有力的武器。它们的核心思路都是一个字:“近”——通过诱导靶蛋白或免疫细胞在癌细胞附近聚集,实现“近距离”杀伤。
比如近年来大热的PROTACs(蛋白水解靶向嵌合体)药物,以及备受瞩目的T细胞免疫疗法。它们的工作机制就像在体内安装了一个“生化遥控器”,能高效地调控细胞命运,诱导蛋白降解或细胞死亡。
然而,这些“近距离”疗法一直面临一个巨大的挑战:脱靶毒性(OTOT toxicity)。因为癌细胞的许多靶点,如HER2或其他抗原,也经常在健康组织上表达。这就导致药物或免疫细胞在攻击肿瘤的同时,误伤了正常器官。
这种“误伤”后果严重。PROTAC药物可能降解整个蛋白质,造成意想不到的后果,甚至导致临床试验终止。免疫疗法可能引发细胞因子释放综合征,甚至像HER2靶向的CAR-T疗法,曾导致结直肠癌患者出现致死性的心肺毒性。
简单来说,当前迫切需要一种能够精确控制这些疗法在时间和位置上发挥作用的技术,就像科幻电影里的“精确制导”系统。而北京大学的科学家们,正是基于此,创造性地提出了一种**“肿瘤选择性”的生物正交连接策略**,成功解决了这一世纪难题。
🔬 核心方法与技术细节:体内“即时组装”的D2L策略
这项革命性策略被称为 “去笼到连接”(Decaging-to-Ligation, D2L) 化学,其精妙之处在于它利用了癌细胞独特的代谢环境,将药物的“生产线”直接搬进了肿瘤内部,实现了药物或纳米颗粒的按需、定点、即时合成。
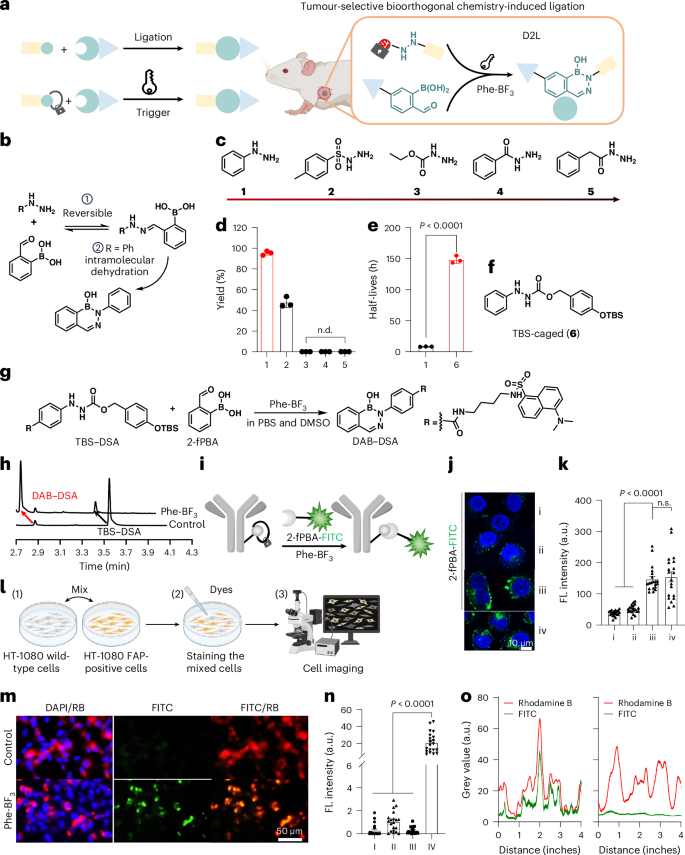
1. 肿瘤内的“暗号”:氨基酸模拟物与去笼化
D2L策略的第一个关键是 “触发器”(Trigger)。
研究团队选择了一种名为苯丙氨酸三氟硼酸盐(Phe-BF) 的氨基酸模拟物作为触发剂。癌细胞通常具有代谢旺盛的特点,依赖于一种叫做LAT-1(大中性氨基酸转运体1)的转运蛋白,来大量摄取营养物质。Phe-BF正是利用这个机制,被肿瘤细胞富集。
当Phe-BF在肿瘤细胞内达到一定浓度时,它会触发一个被称为 “去甲硅烷基化”(desilylation)的化学反应。这个反应的作用,就是“解开” 药物前体的 “保护笼”。
为了保护药物前体在健康组织中不被激活,科学家们使用了甲硅烷基-酚醚系统(silyl-phenolic ether system)来“笼罩”住一个关键的化学基团:苯肼。苯肼在生理条件下不稳定(半衰期仅约8.2小时),但一旦被甲硅烷基-酚醚“笼罩”,其稳定性得到了极大的提升(半衰期超过100小时)。
Phe-BF就像一把 “肿瘤特供的钥匙”,精准地解开了甲硅烷基-酚醚这个“保护笼”,释放出具有高度活性的苯肼基团。
2. 快速“握手”:生物正交连接反应
D2L策略的第二个关键是 “连接”(Ligation)。
被释放出来的苯肼基团,其活性极高,能在体内环境中迅速与另一个药物前体上的2-甲酰苯硼酸(2-fPBA) 发生反应。这种反应被称为 “二氮杂硼烷连接”(diazaborine ligation),是一种生物正交反应。
所谓 “生物正交”,简单理解就是一种能在复杂的生物体内(如血液、细胞内环境)发生,但不干扰任何其他生物分子(如蛋白质、DNA、其他细胞成分)的特定化学反应。
苯肼与2-fPBA的反应速度非常快,其速率常数超过 。更重要的是,这个反应具有极高的抗干扰性。例如,即使在生理水平的半胱氨酸(一种在生物体内广泛存在,且会干扰许多其他反应的分子)存在的情况下,苯肼与2-fPBA的反应也不会受到影响。
通过这两个步骤:“富集-去笼化”(Phe-BF富集并解开苯肼保护笼)和 “快速-连接”(苯肼与2-fPBA迅速反应),研究团队成功地在肿瘤位点实现了两个药物前体的精确、快速连接,从而 “即时组装” 出具有完整活性的治疗分子。
这种D2L化学方法,不仅保证了治疗分子只在需要的地方——肿瘤部位——高浓度合成,也极大地避免了药物在全身循环中产生的毒副作用。
3. 细胞实验验证:抗体和PROTACs的原位合成
在细胞实验层面,研究人员首先用D2L策略实现了抗体在细胞膜上的选择性荧光标记。这证明了该策略可以在活细胞环境中高效运行。
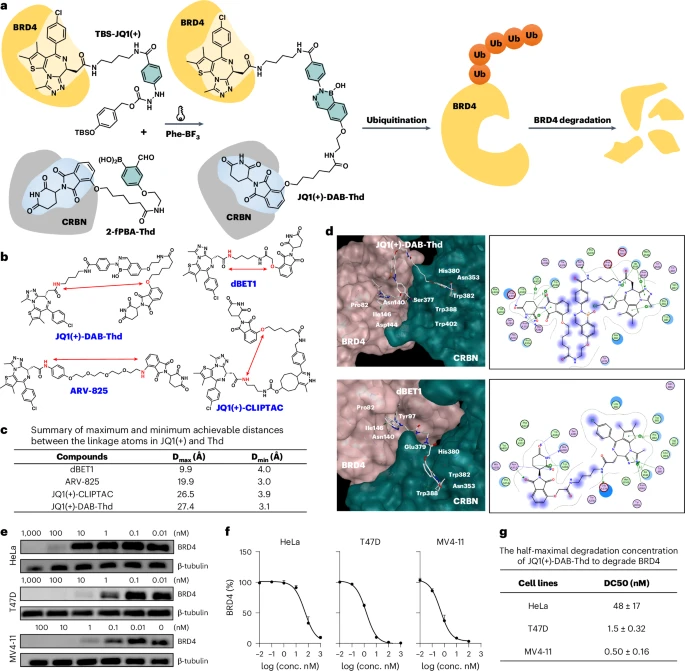
随后,他们将D2L应用于核心药物分子 PROTAC 的合成。他们设计了两个无活性的前体:一个是被TBS保护的BRD4靶向分子(TBS-JQ1(+))和一个CRBN招募分子(2-fPBA-Thd)。
通过D2L策略在细胞内将它们原位连接,成功合成了具有活性、可降解BRD4蛋白的PROTAC分子 JQ1(+)-DAB-Thd。
- 结果显示: 在HeLa、T47D和MV4-11三种癌细胞中,通过D2L合成的PROTAC,成功实现了浓度依赖性的BRD4降解。例如,在MV4-11细胞中,其半数最大降解浓度(DC)低至 nM,表明其具有很高的降解效力。
这一阶段的成功,证明了D2L策略不仅是一个化学概念,而且是一个可实用化的、能够在活细胞内合成复杂功能药物分子的平台技术。
📈 数据背后的创新与颠覆性:14.8倍的T细胞活化飞跃
真正令人兴奋和颠覆性的结果,体现在其在活体小鼠模型中展现出的极高选择性、极低毒性和惊人疗效。
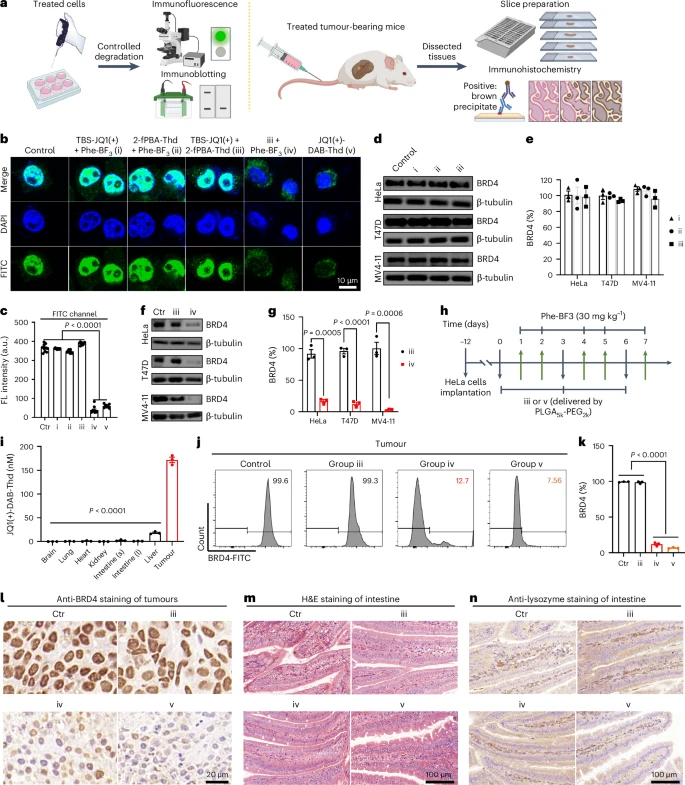
1. PROTACs的肿瘤“专供”合成与毒性消除
在小鼠肿瘤模型中,研究人员对比了直接注射成品PROTAC(JQ1(+)-DAB-Thd)和使用D2L策略原位合成PROTAC的效果。
精确的肿瘤富集: 通过D2L策略,PROTAC分子在肿瘤组织中的浓度达到了 172 nM。这个浓度是肝脏中的9.4倍,并且远高于HeLa细胞的 值(48 nM),足以驱动目标蛋白BRD4的有效降解。
全身毒性近乎为零: 在小鼠的大脑、肺、心脏、肾脏、小肠、大肠等正常组织中,几乎检测不到PROTAC分子的存在,这些组织中的BRD4蛋白水平也保持不变。
消除严重副作用: 关键在于,直接注射成品PROTAC的小鼠,其小肠组织出现了明显的形态变化和组织损伤,表现为潘氏细胞(Paneth cell)的消耗。这是BRD4降解在正常组织中引发的严重毒副作用。然而,采用D2L肿瘤选择性合成策略的小鼠,完全避免了这种严重的组织学损伤。
这一结果具有划时代的意义:它首次证明了通过 “时空精准控制” 的生物正交连接,可以完全避免传统PROTAC药物最棘手的 “脱靶毒性”。
2. 纳米“分子胶”的原位组装:激活T细胞军团
D2L策略的另一个颠覆性应用,是将其用于细胞接近(cell proximity)的调控,也就是癌症免疫疗法。
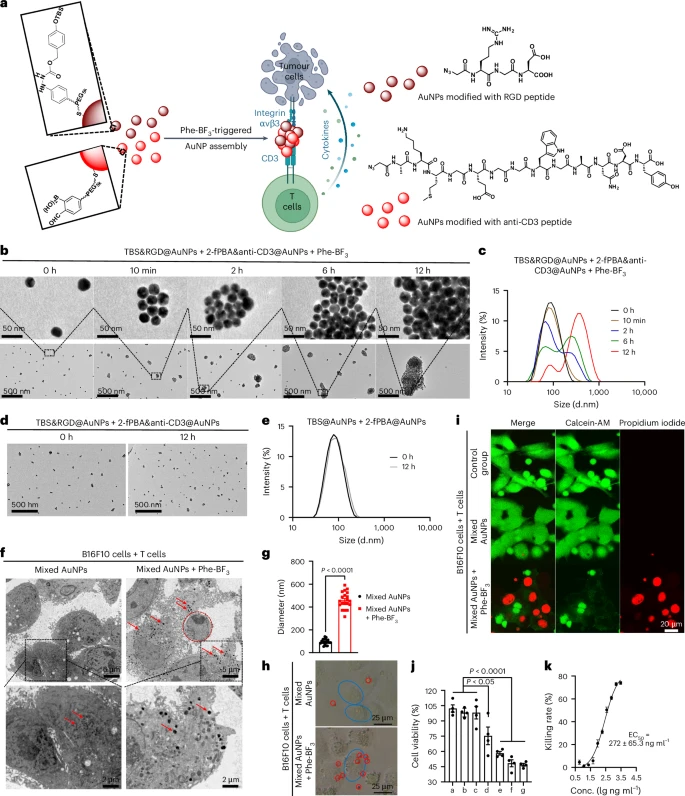
研究团队设计了一种纳米级别的 “分子胶”(nano-glue),它的目标是将T细胞和肿瘤细胞拉近距离,模仿双特异性T细胞衔接器(BiTE)的作用。
他们将两种前体分子分别修饰到金纳米颗粒(AuNPs)上:
肿瘤靶向组分: 修饰了靶向肿瘤细胞表面整合素 的RGD肽,并带有TBS保护基团(TBS&RGD@AuNPs)。
T细胞靶向组分: 修饰了靶向T细胞表面CD3的抗体肽,并带有2-fPBA基团(2-fPBA&anti-CD3@AuNPs)。
在体外实验中,只有在加入Phe-BF触发剂后,这两种纳米颗粒才会发生D2L连接反应,在12小时内从约80 nm的单个颗粒,组装成直径约350 nm的纳米聚集体。没有Phe-BF时,它们保持分散。
- 体外细胞杀伤力: 当这些纳米颗粒在肿瘤细胞和T细胞的共培养环境中,被Phe-BF触发组装后,T细胞被成功招募到肿瘤细胞周围。在T细胞与肿瘤细胞比例为10:1的条件下,这种原位组装的纳米分子胶展示出强大的抗肿瘤活性,其半数最大有效浓度(EC)为 。
3. 活体疗效:T细胞活化率的14.8倍暴增
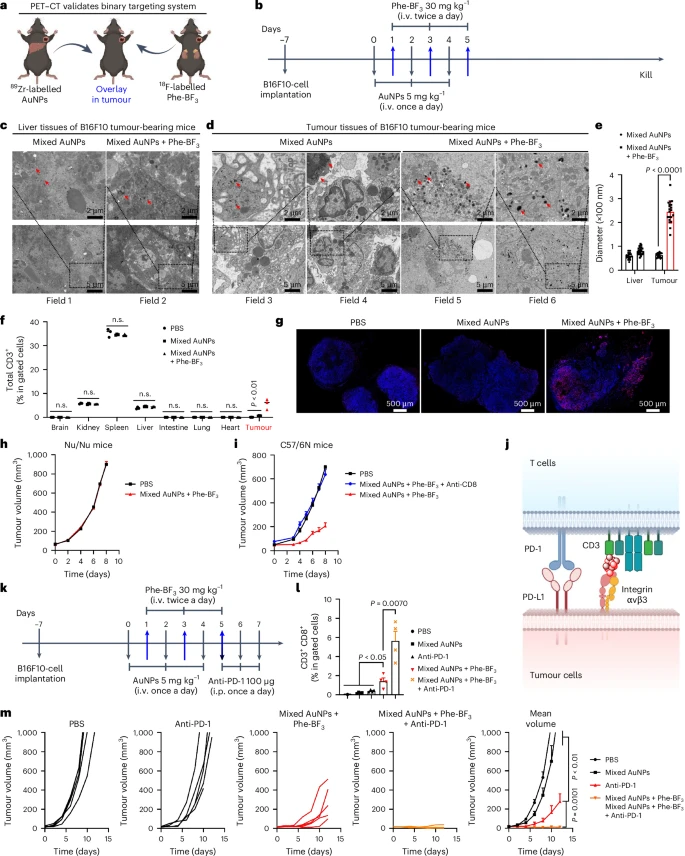
在B16F10黑色素瘤小鼠模型中,研究人员验证了这种 “双重靶向” 策略:AuNPs通过EPR效应富集在肿瘤,而Phe-BF通过LAT-1转运体富集在肿瘤。
肿瘤内组装与细胞招募: 只有在同时注射两种纳米颗粒前体和Phe-BF的小鼠肿瘤组织中,才能观察到明显的纳米颗粒聚集(直径达 nm),而在肝脏等其他器官中,纳米颗粒仍然是分散的(直径 nm)。更关键的是,只有在Phe-BF激活组,才观察到明显的T细胞向肿瘤部位的招募和浸润。
惊人的免疫活化: 研究人员进一步将此策略与免疫检查点抑制剂 抗PD-1抗体 联合使用。结果显示,在联合治疗组中,具有强大杀伤力的CD3CD8细胞毒性T细胞在肿瘤微环境中的比例达到了 。
这个数字意味着什么?
它比单独使用抗PD-1抗体治疗组的 高出14.8倍!
它比单独使用纳米分子胶单药治疗组的 高出3.97倍!
T细胞活化率的14.8倍暴增,直接带来了显著的疗效。联合治疗组的小鼠肿瘤体积被显著抑制,并且在实验过程中,所有小鼠都没有出现显著的体重下降或内脏器官病理变化。
更值得注意的是,在未经控制的非选择性连接药物(游离的双特异性AuNPs)治疗组中,小鼠出现了严重的免疫系统功能障碍:白细胞、淋巴细胞和中性粒细胞数量分别增加了 74.9倍、6.27倍和107.7倍。而采用D2L控制连接系统的小鼠,血液细胞计数几乎没有变化,副作用几乎可以忽略不计。
这一系列无可辩驳的数据,强有力地证明了D2L策略在癌症免疫治疗领域的突破性、颠覆性价值。
🔮 应用展望、局限性与未来路线图:从科研到临床
北京大学团队的这项“去笼到连接”(D2L)策略,为精准癌症治疗领域提供了一个通用、可推广的激活治疗组装体的方法。
未来的路线图与应用展望
这项技术最直接的价值,在于为解决邻近效应介导的癌症治疗(如PROTACs和T细胞疗法)中的脱靶毒性提供了根本性的解决方案。
新一代PROTACs: 它可以用于开发“前药PROTACs”,这些前药在体内大部分时间处于非活性状态,只有在肿瘤特有的微环境(由Phe-BF富集触发)中,才能“现身”并高效降解靶蛋白,从而实现治疗窗口的最大化。
精准免疫激活剂: D2L策略使纳米材料的自组装和T细胞招募实现“肿瘤选择性”。未来可以将其应用于构建更复杂的纳米生物材料,甚至用于精确调控其他免疫细胞、释放细胞因子等,实现更精细的免疫调控。
其他疾病治疗: D2L作为一种精准的生物正交连接平台技术,其应用潜力远不止于此。它可以被启发性地应用于其他重要领域,只要找到一个疾病组织特有的“生物标志物”作为触发剂,就能实现其他功能分子或药物的局部合成和激活。
客观的局限性讨论
尽管成果令人振奋,但任何开创性的技术在走向临床前都必然存在挑战:
D2L触发剂的临床转化: Phe-BF作为触发剂,虽然在体内显示出肿瘤富集能力,但其作为药物的药代动力学、长期毒性、以及在人体内不同肿瘤类型中的富集效率,都需要进行更深入的临床前和临床研究。
纳米颗粒的规模化生产和稳定性: 虽然金纳米颗粒(AuNPs)已在临床研究中用于热疗,但用于D2L系统的纳米颗粒前体(TBS&RGD@AuNPs 和 2-fPBA&anti-CD3@AuNPs)的长期储存稳定性、大规模、高均一性的生产工艺,以及在人体内复杂的生物屏障(如血脑屏障)穿透性,仍是需要克服的工程和生物学挑战。
免疫疗法的复杂性: T细胞活化是一个复杂的多因素过程。D2L策略的成功很大程度上依赖于T细胞的有效招募和活化,但在“冷肿瘤”或免疫抑制程度更高的肿瘤微环境中,这种效果是否能保持,还需要进一步优化和研究。
总而言之,这项研究在化学生物学和药物发现的交叉领域取得了重大创新,为克服癌症治疗中的脱靶毒性和提高免疫疗法疗效开辟了一条全新的道路。我们有理由相信,这项精准“即时组装”的D2L技术,将为未来的癌症患者带来一个毒性更低、疗效更高的治疗时代。