【Adv. Mater.】"背"上细菌不仅能促进M1型转变,还能重新极化肿瘤相关巨噬细胞
Adoptive Cell Therapy
过继性细胞治疗
过继性细胞治疗已经成为有望用于癌症治疗的一种方法。然而,由于免疫抑制性肿瘤微环境(TME)内的细胞表型会动态地从抗肿瘤状态转变为促肿瘤状态,因此对实体肿瘤的巨噬细胞转移效果受到了限制。
引言
作者提出了一种基于细菌的背包(Mø@bac)概念,细菌可以附着在巨噬细胞上,利用细菌的天然免疫原性来引导体内细胞极化。这些附着在巨噬细胞上的细菌被称为“背包”。它们不仅富含促炎因子,还能在肿瘤组织中繁殖,从而持续激活Mø@bac朝着M1表型发展。此外,Mø@bac可以重新极化内源性的肿瘤相关巨噬细胞(TAMs),从而改造免疫抑制性的肿瘤微环境。 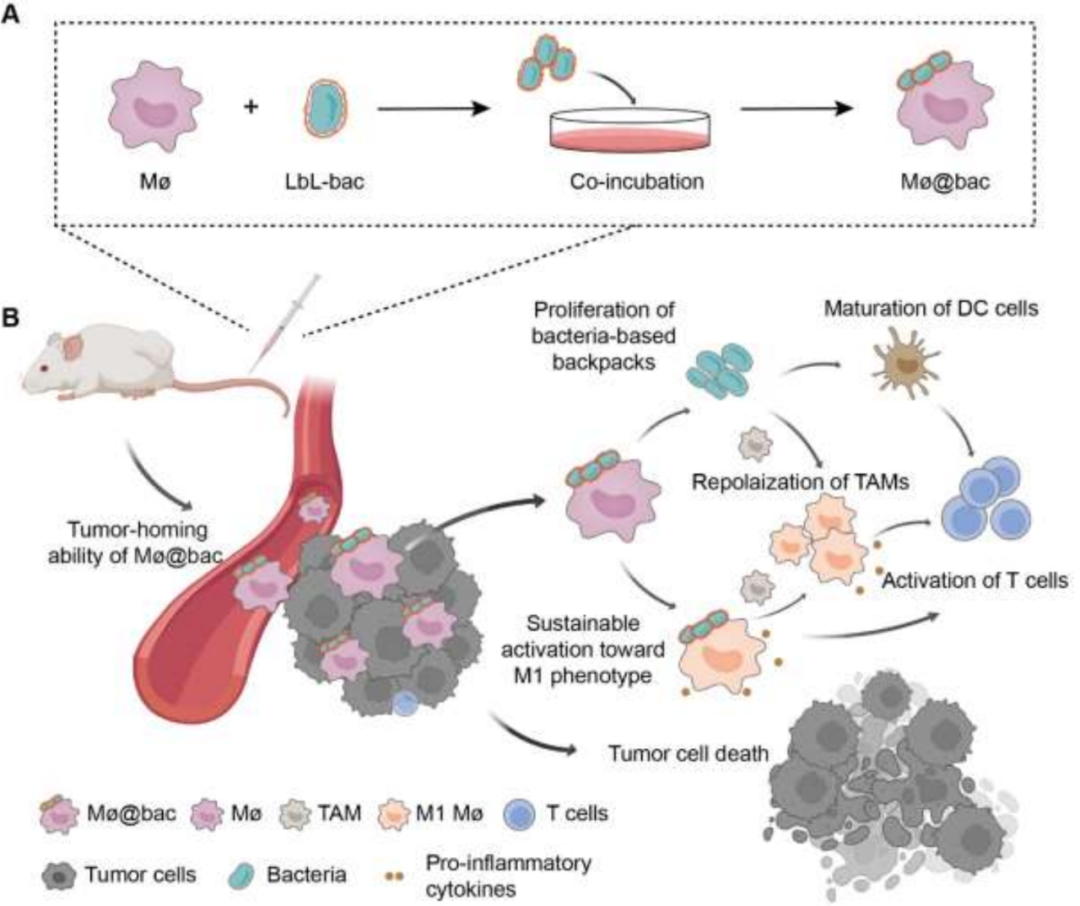
材料制备
作者选用非致病性品系大肠杆菌 Nissle 1917(EcN)作为背包构建的模型细菌。细菌表面的粘附性纳米涂层是通过逐层组装制成的,由两层多糖交替构成,分别是壳聚糖(CHI)和羧甲基壳聚糖(CMC)(图2A)。由于EcN带负电荷,阳离子聚合物CHI首先通过与EcN共培养15分钟而沉积在表面。之后,EcN呈现出相反的ζ电位+7 mV(图2B)。然后, CMC吸附在EcN表面,导致ζ电位为-20 mV(图2B)。共聚焦激光扫描显微镜(CLSM)、透射电子显微镜(TEM)图像及扫描电子显微镜(SEM)都表明了两者的有效结合(图2C).
之后,LbL-EcN与巨噬细胞共培养以获得覆盖有细菌的巨噬细胞(Mø@Bac)(图2D),同样,通过共聚焦激光扫描显微镜(图2E)和透射电子显微镜(图2F)可以证实两者的有效结合,并且,作者使用流式定量的分析了这两者结合的效率(图2G),通过优化LbL-EcN的浓度,作者可以做到超过92.7%的巨噬细胞上都附着有细菌,并且这些细菌可以长时间滞留在细胞表面。 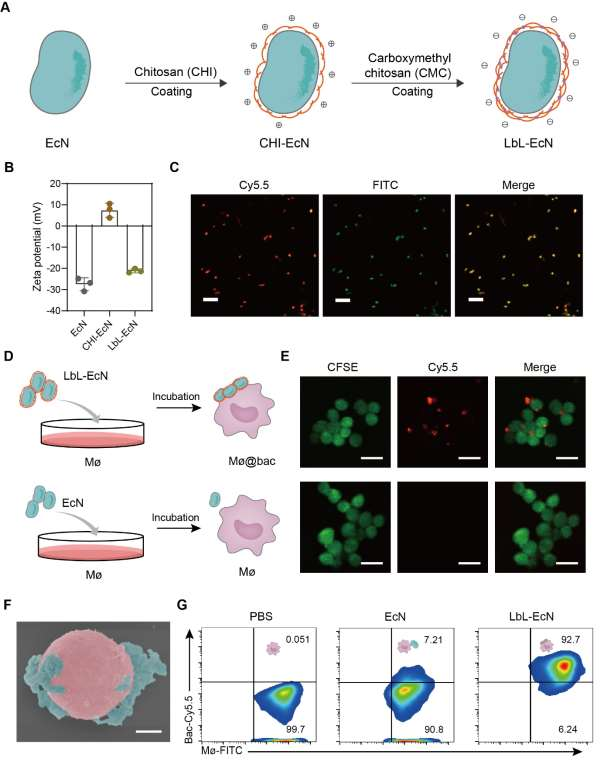
体外测试
为了探究Mø@bac的肿瘤的细胞毒性,作者首先在小鼠皮下瘤模型中研究了Mø@bac的运输时间,结果表明,Mø@bac可以在2小时内到达肿瘤部位,并且在12小时内可以稳定的积累(图3A)。而对炎症细胞因子 IL-6 和 TNF-α、活性氧物质ROS及一氧化氮合酶的定量测定表明Mø@bac组的小鼠的几项验证指标都有显著提升,因此作者推断Mø@bac可以向促炎表型极化,并产生细胞毒性分子来杀死肿瘤细胞。而肿瘤消融实验也证明了,与Mø相比,Mø@bac对4T1细胞的肿瘤溶解效率要高得多(图3E-G)。此外,作者还验证Mø@bac可以抵抗免疫抑制性TME并在体内维持其M1表型的假设,在注射了药物两天后,使用流式细胞术分析了 CD80(M1 标记物)和 CD206(M2 标记物)的表达情况,结果表明,虽然 M1 Mø 在接种前表现出较高的 M1 表型表达,但 Mø@bac 在实体瘤内至少 48 小时内强烈表现出促炎症表型的特征。而由于 Mø@bac 不断极化为 M1 表型,作者因此推断 Mø@bac 可以激活 TME 中周围的免疫细胞,尤其是 TAMs,从而促进免疫反应,而这一推断也Transwell实验得到了证实,作者将 TAMs 的这种极化归因于以下因素:(i) 细菌背包释放的细菌成分的免疫原性;(ii) Mø@bac 以类似旁分泌物的方式分泌的促炎因子。 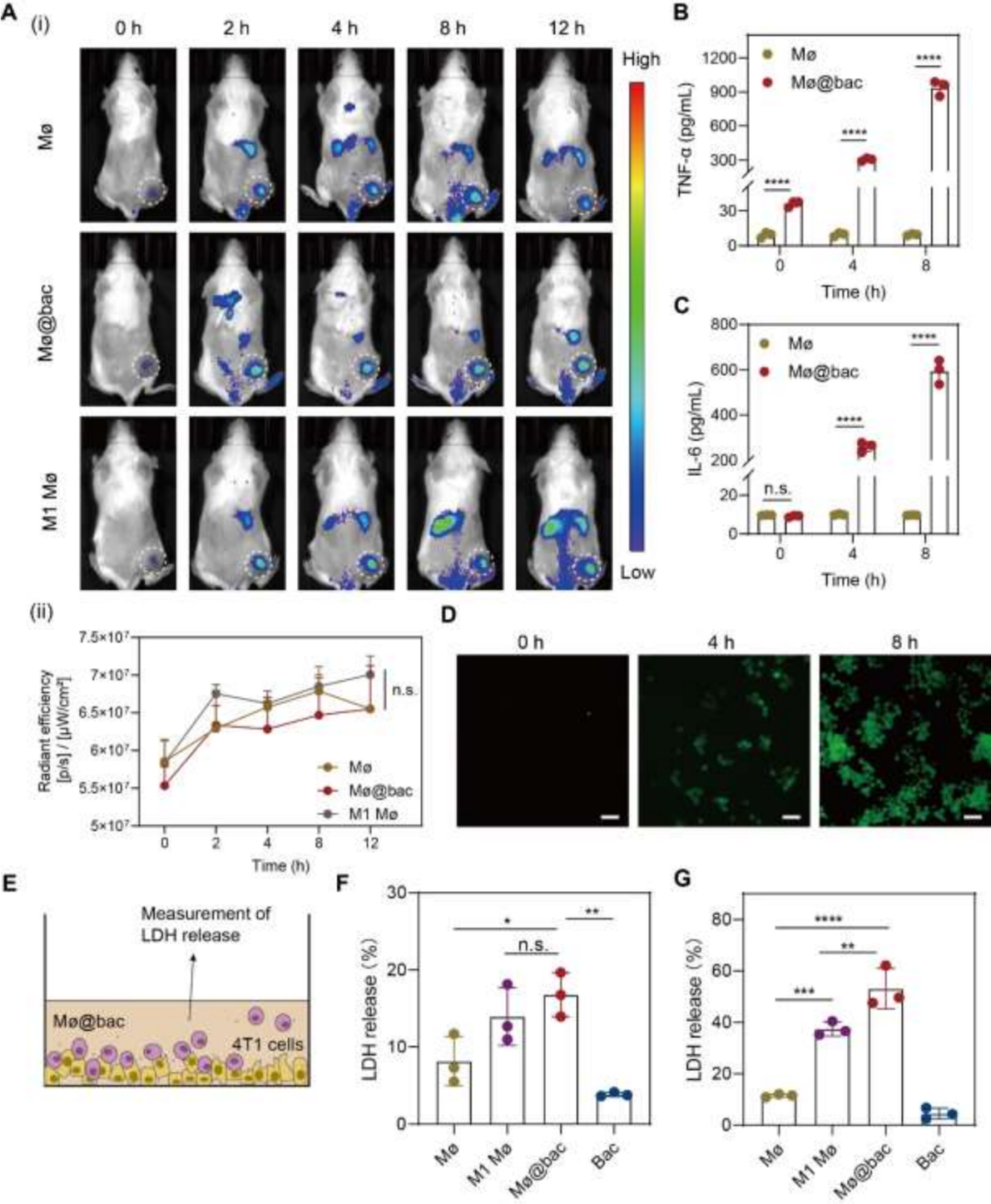
体内
由于 Mø@bac 的免疫激活功效已在体外得到验证,作者接下来进行了小鼠体内测试。首先,作者评估了材料的安全性,作者收集了注射后 1、4、7 和 10 天的小鼠血液样本,并使用生化分析仪和血常规分析仪进行了分析,结果表明,经过Mø@bac处理的小鼠在多项生化指标上没有出现异常,表明这种材料具有一定的生物安全性,同时也不会引发炎症。
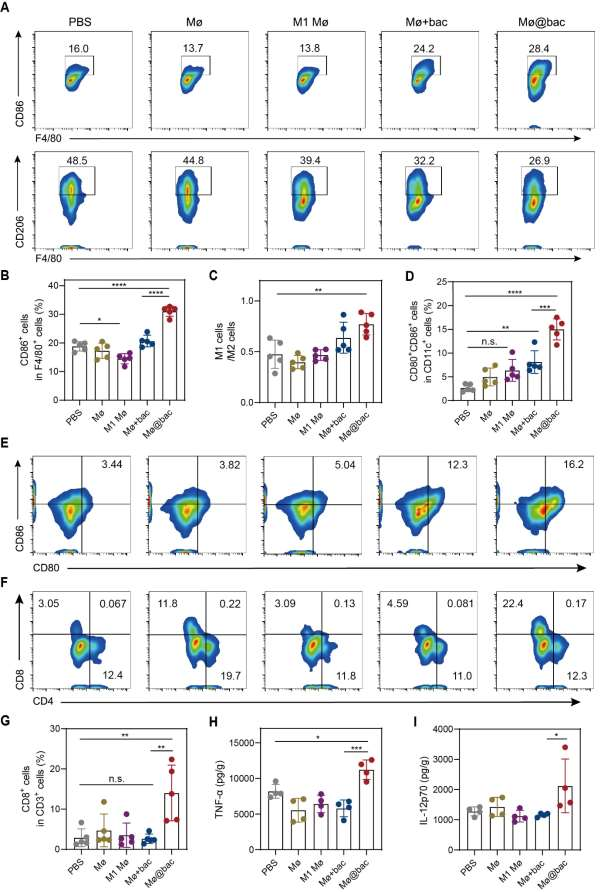
接着,作者通过对比肿瘤体积的变化确定了Mø@bac的肿瘤抑制效果,与空白组相比,Mø@bac的肿瘤抑制率达到了64.5%,但这是多种因素共同作用的结果,首先作者发现,服用 Mø@bac 可使 CD86 的表达率从 16.0% 上升至 28.4(图 A),同时,Mø@bac 使 CD206 的水平从 48.5% 降至 26.9%,且 M1/M2 的比例明显高于 PBS 处理组。这表明 Mø@bac 能够降低 TME 中 TAMs 的比例,从而大大提高免疫疗法的疗效。此外,作者还检测了淋巴结中 DC 细胞的成熟情况,结果表明 Mø@bac 使 DC 成熟率从 3.44% 显著提高到 16.2%(图 4E),与 PBS 处理的肿瘤相比,Mø@bac 处理的肿瘤的 TNF-α 和 IL-12p70 分别增加了 1.7 倍和 1.4 倍(图 4F,I)。这些结果表明,Mø@bac不仅能使TAMs重新极化为M1表型,还能促进DC细胞的成熟和杀伤肿瘤的T细胞的增值,从而促进更强大的抗肿瘤免疫反应。
结论
总的来说,作者报道了一种基于细菌的背包策略,通过将细菌附着在巨噬细胞表面(Mø@bac),可以可持续地控制体内移植巨噬细胞的表型特征。实验证明,Mø@bac能够在相对短的时间内迁移到肿瘤部位,在肿瘤微环境中保持其M1表型,并增强抗肿瘤功效。此外,Mø@bac能够重新极化内源性肿瘤相关巨噬细胞,刺激细胞毒性T细胞,并重塑肿瘤免疫抑制性微环境。如在皮下和原位4T1乳腺肿瘤模型中展示的那样,与仅注射Mø或M1 Mø相比,Mø@bac的给药显示出了更强大的抑制肿瘤能力。值得注意的是,与仅与细菌混合(Mø+bac)相比,这种基于细菌的背包对细胞表型的调控效率更高。同时,由于纳米涂层的保护,Mø@bac没有显示出任何全身性炎症反应,具有进一步临床应用的巨大潜力。
参考文献
An, J.; Han, Z.; Qin, Y.; Li, C.; He, J.; Zhang, X. Bacteria‐based Backpacks to Enhance Adoptive Macrophage Transfer against Solid Tumors. Advanced Materials 2023, 2305384. https://doi.org/10.1002/adma.202305384.