【Small】一石三鸟,针对肿瘤和细菌的特异、超快近红外光敏剂
摘要
细菌感染与癌症的发展密切相关,清除与癌症相关的细菌可以改善癌症治疗的效果。然而,采用两种或以上的化学药物联合治疗可能会增加潜在的副作用。图像引导的光动力疗法因其高度精准性,成为治疗肿瘤和微生物感染的一种潜在有效方法。
本文合成了一组具有近红外(NIR)聚集诱导发光(AIEgens)的化合物,它们具备Ⅰ型和Ⅱ型活性氧(ROS)生成能力,结构上呈现供体-受体-π桥-受体(D-A-π-A)特征。这组化合物包括TQTPy、TQTPy、TQTC和TQTC四种。其中,TQTPy展现出独特的线粒体靶向能力、最优的ROS生成效率、良好的肿瘤滞留特性,并且具备三合一的荧光成像引导疗法,能够同时处理肿瘤和微生物感染问题。
体内外实验结果证实,TQTPy在近红外荧光成像引导下的光动力癌症诊断和治疗中表现出色。此外,TQTPy的两亲性和正电荷使其能够特异性地、迅速地识别并清除革兰氏阳性(G+)金黄色葡萄球菌,同时不会影响革兰氏阴性(G-)大肠杆菌和正常细胞。
这项研究为构建图像引导的光动力癌症治疗与细菌清除相结合的三合一疗法提供了一个指导框架。
1 引言
癌症是一种高死亡率、高侵袭性和高发病率的疾病,严重威胁全球人类健康。研究表明,微生物感染与肿瘤的发生和发展密切相关,清除与癌症相关的细菌可以显著提高癌症治疗的效果。为此,临床上通常采用抗生素与抗癌药物联用来提升疗效。然而,同时使用多种药物可能会增加潜在的不良反应,且滥用抗生素可能导致细菌产生耐药性,使得传统抗生素在抗炎治疗中的效用下降。因此,如何在癌症治疗中整合抗菌活性,同时降低细菌耐药性的风险,成为了开发联合疗法的关键挑战。
光动力疗法(PDT)作为一种前景广阔的癌症治疗方法,具有无创、低毒、可控及无初始耐药性的特点。通过光照射,光敏剂(PSs)能通过I型(电子转移)或II型(能量转移)机制产生细胞毒性活性氧(ROS)。ROS能够迅速与生物分子相互作用,诱导癌细胞死亡。特别地,基于光的疗法被视为一种治疗微生物感染的有前景的方法,且不会引发耐药性。
大多数PSs通过II型途径(能量转移过程),依赖氧气产生单线态氧(1O2),在常氧条件下对肿瘤区域具有较强的破坏力。然而,缺氧是伤口深层的普遍现象,会阻碍伤口愈合。为解决这一难题,研究人员探索了多种方法来提高瘤内的氧气浓度。尽管如此,仍然存在一些不必要的副作用,如高氧惊厥、生物毒性和气压创伤等问题。考虑到这一点,I型PSs作为一类对氧气需求较低且能高效产生活性自由基的选择,可以解决II型PDT的局限性,并为实体瘤治疗开辟新的途径。O2 作为I型过程的主要前体,可以进一步转化为更强的 ·OH,从而增强PDT的抗癌效果。
近红外(NIR)荧光成像相比于可见光,具有较小的细胞光损伤、更低的光散射、更深的穿透能力和更高的信噪比,被认为更适合生物成像。常用的有机PSs,如酞菁和卟啉,由于平面π共轭结构和较差的水溶性,在生物体系中面临着严重的聚集淬灭(ACQ)问题,导致荧光发射效率较低。2001年,唐本忠教授提出了聚集诱导发光(AIE)的概念。AIE发光体(AIEgens)在溶液中发射较弱或几乎不发射,在聚集状态下由于分子内运动受限,发射效率显著提高。此外,AIE活性PSs在聚集时减弱了分子间的π-π相互作用,改善了系间穿越(ISC)过程,从而产生更多ROS。增强供体-受体(D-A)强度有助于分子内电荷转移(ICT),使单线态(S1)和三线态(T1)间的能级差(ΔE st)最小化,从而加速ISC过程。
线粒体是真核细胞中的重要能量中心,参与氧化磷酸化循环及细胞信号传导、生长、自噬和凋亡等多个过程。值得注意的是,线粒体对PDT产生的ROS更加敏感,在PDT诱导的细胞凋亡过程中,线粒体早期就会受到损害。
据此,作者根据分子工程策略设计并合成了四种具有供体-受体-π桥-受体(D-A-π-A)特征的AIEgens(TQTPy、TQTPy、TQTC和TQTC),用于PDT研究。与已报道的供体-π桥-受体(D-π-A)型AIEgens相比,作者的设计原则主要考虑以下几点:首先,喹喔啉上的三苯胺(TPA)和苯或其异辛氧基取代衍生物的转子结构可以减少聚集态分子间的π-π相互作用,从而抑制非辐射弛豫,激活辐射通道和ISC通道。其次,将传统的D-π-A结构转变为D-A-π-A结构具有多种优势:1)利用喹喔啉作为额外的受体构建D-A-π-A结构光敏剂,可增强分子内的D-A强度,进一步促进ISC过程;2)在D-A-π-A结构中加入额外的受体喹喔啉,可以增加一个TPA-喹喔啉吸收带,进一步红移光敏剂的吸收和发射;3)以喹喔啉单元上的苯环作为转子结构,可促进光敏剂的AIE性能。第三,引入不同的电子受体(丙二腈和吡啶)来调控ROS生成和细胞器靶向能力。这四种PS均展现出AIE趋势,吸收范围覆盖可见光区域。所有PS都具有近红外发射,有利于生物组织的穿透。以吡啶为受体的TQTPy具有线粒体靶向能力,并拥有最佳的ROS生成效率(I型和II型)。体内外实验证实了TQTPy在近红外荧光成像引导下的PDT方面表现出色。此外,两亲性且带正电荷的TQTPy具有超快识别和杀灭革兰氏阳性(G+)金黄色葡萄球菌和革兰氏阴性(G-)大肠杆菌以及正常细胞的能力。因此,TQTPy具备三项功能:近红外荧光成像、抗癌PDT和杀菌作用。这种针对肿瘤和细菌的三合一光动力疗法在临床应用中展现出极高的潜力。
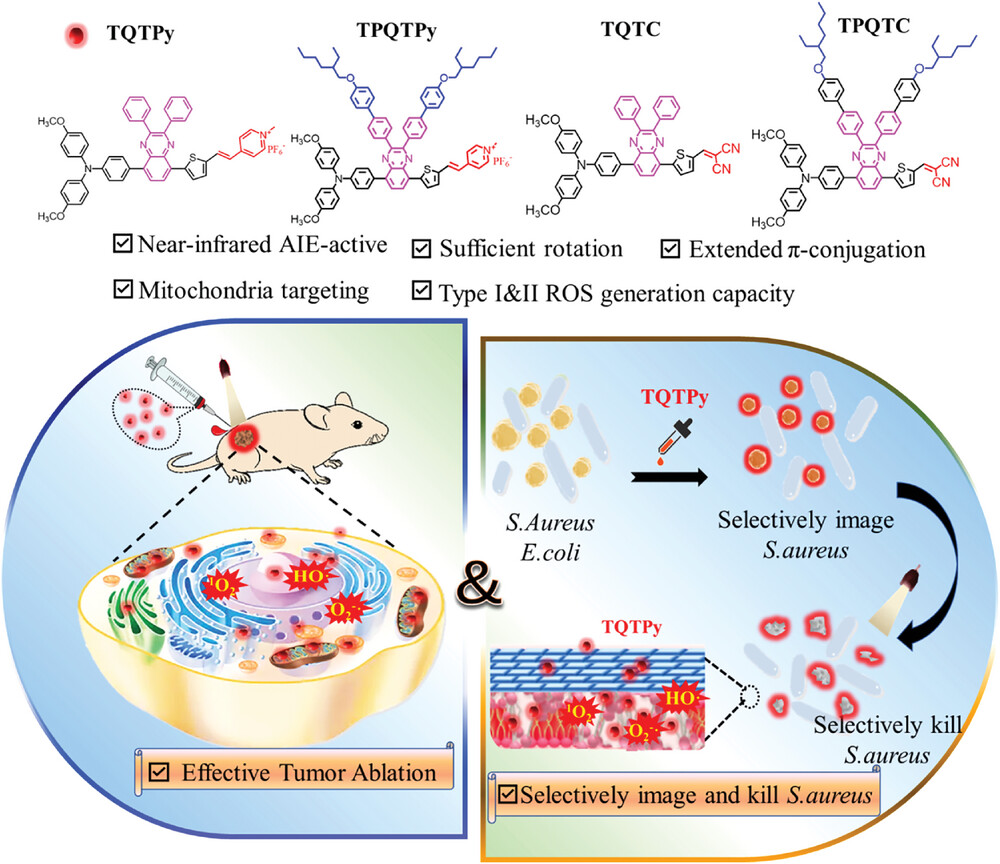
示意图1. AIEgen TQTPy用于成像和杀死肿瘤细胞和革兰氏阳性细菌的三合一处理示意图。
2 结果与讨论
2.1 合成与表征
设计并合成了四种新型 D-A-π-A 型光敏剂,其中喹喔啉为附加受体,吡啶或丙二腈为受体,具体的合成路径见示意图2. 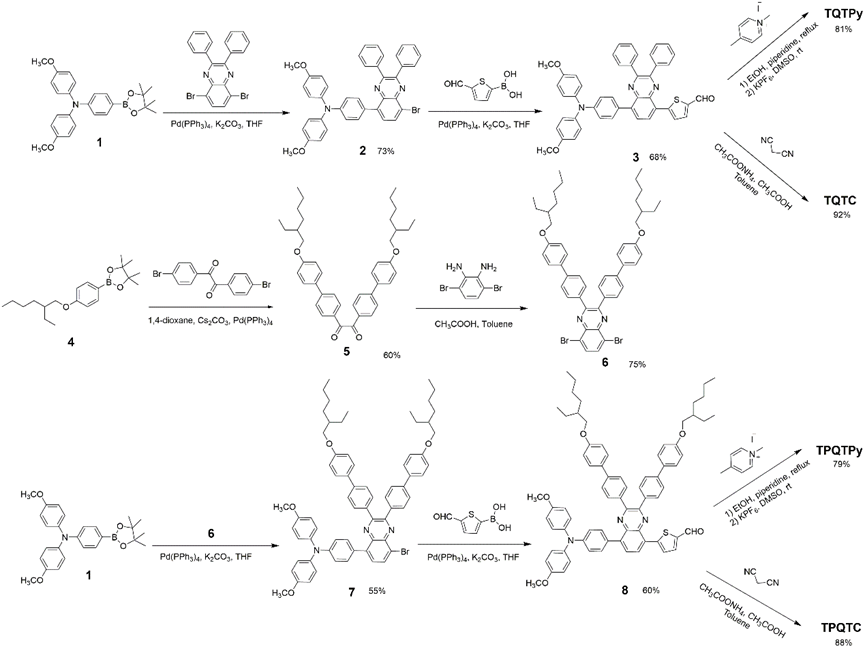
示意图2. TQTPy、TPQTPy、TQTC和TPQTC的合成路径
2.2 光物理性质
对四种光敏剂——TQTPy、TPQTPy、TQTC和TPQTC的光物理特性进行了详尽的研究,并将结果汇总在表 1中。
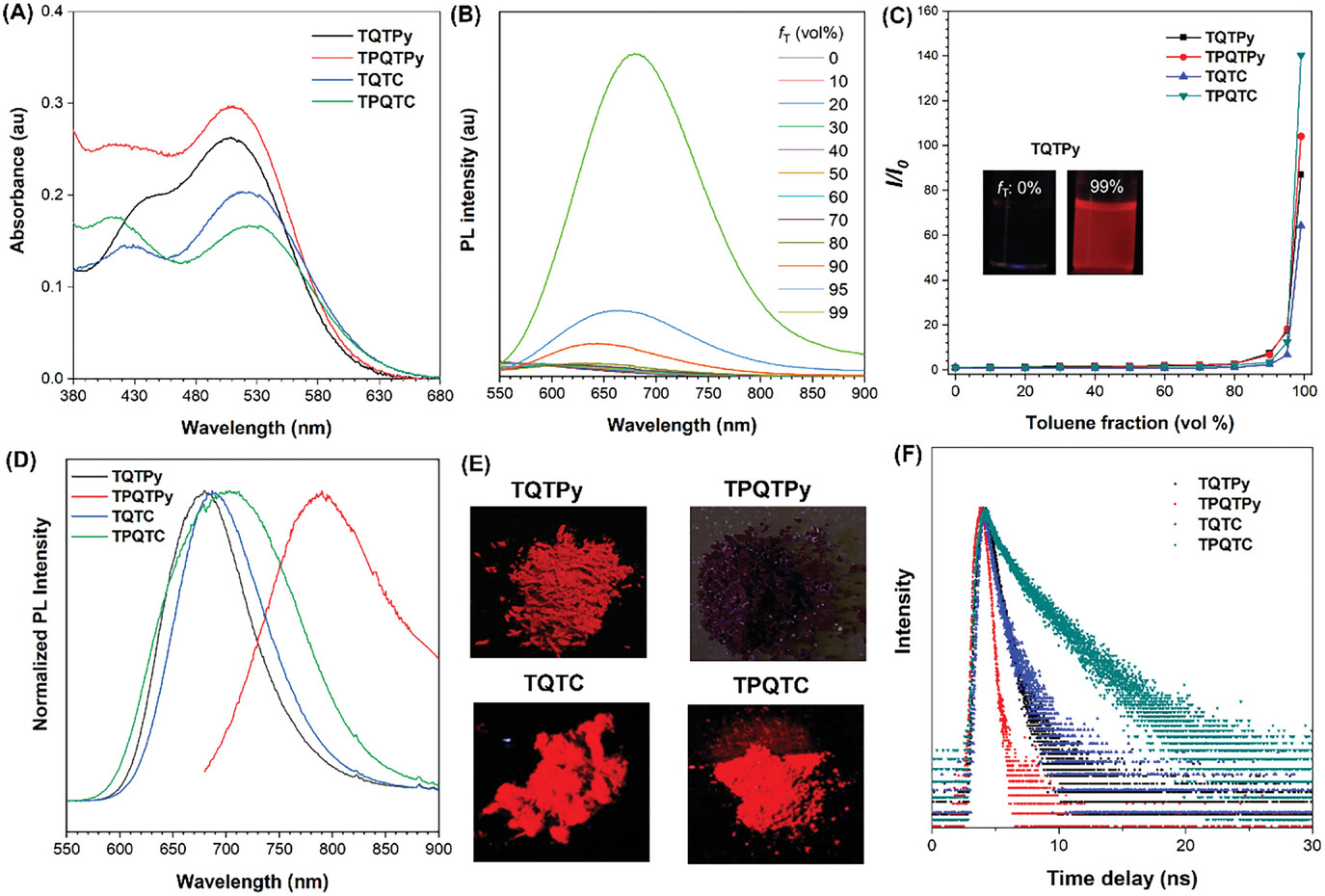
图1. A) TQTPy、TPQTPy、TQTC 和 TPQTC 在 DMSO 溶液(10 μM)中的吸收光谱。B) TQTPy(10 μM)在不同甲苯馏分(fT)的二甲基亚砜/甲苯混合物中的 PL 光谱。C) I/I0 与不同 fT 的关系图。插图:TQTPy 在 DMSO 溶液中以及在含 99% 甲苯的 DMSO/ 甲苯混合物中的荧光图片。D) TQTPy、TPQTPy、TQTC 和 TPQTC 在固态下的归一化聚光光谱。E) 在 365 nm紫外灯照射下,TQTPy、TQTPy、TQTC 和 TPQTC的荧光照片。F) TQTPy、TPQTPy、TQTC 和 TPQTC 在固态下的时间分辨衰变曲线。
表1. TQTPy、TPQTPy、TQTC和TPQTC的光物理特性
| AIEgen | λabs in DMSO | λem in DMSO (ΦF) | λem in aggregates (ΦF) | λem in solids (ΦF) | Lifetime in solids |
|---|---|---|---|---|---|
| TQTPy | 509 nm | --(0.3%) | 679 nm (3.5%) | 679 nm(3.0%) | 0.81 ns |
| TPQTPy | 511 nm | --(0.2%) | 674 nm (4.8%) | 790 nm(1.0%) | 0.53 ns |
| TQTC | 518 nm | 668 nm(0.1%) | 669 nm (9.8%) | 687 nm(4.4%) | 0.95 ns |
| TPQTC | 524 nm | --(0.2%) | 668 nm (11.6%) | 704 nm(7.1%) | 2.73 ns |
这些光敏剂在二甲基亚砜(DMSO)中的最大吸收波长分别为509、511、518和524nm(图 1A)。在约500nm处的较长波长吸收带是由TPA与吡啶或丙二腈之间的分子内电荷转移(ICT)造成的。而在约430nm处的吸收带则归因于TPA与喹喔啉之间的ICT。这一点也被化合物2和7在DMSO溶液中的吸收光谱所证实(图2)。 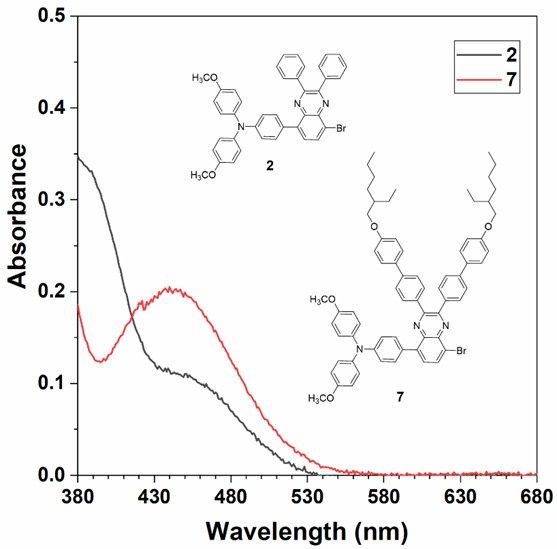 图2. 化合物2和7的吸收光谱
图2. 化合物2和7的吸收光谱
与以吡啶为受体的两种光敏剂相比,以丙二腈为受体的TQTC和TPQTC的最大吸收波长向红移了大约10nm。这四种光敏剂的吸收带覆盖了可见光谱的大部分范围,有利于与白光光源匹配(图 1A)。
为了评估这四种光敏剂的AIE效应,作者在含有不同比例甲苯(fT)的DMSO/甲苯混合物中进行了实验(图1B)。在纯DMSO溶液中,观察到了微弱的荧光,并且它们在DMSO中的量子产率(QYs)非常低(0.1-0.3%)(表 1)。形成聚集体后,这些光敏剂显示出了强烈的发射,最大发射波长分别为679、674、669和668nm,荧光强度提升了超过60倍(图 1C)。在fT为99%的DMSO/甲苯溶液中,TQTPy、TPQTPy、TQTC和TPQTC的聚集体溶液的量子产率分别达到了3.5%、4.8%、9.8%和11.6%(表 1)。图 1C中的插图展示了TQTPy在甲苯含量分别为0%和99%的DMSO/甲苯混合物中的荧光照片,分别显示了几乎无荧光强度和强荧光强度。这些结果表明这些光敏剂具有出色的AIE特性。
图 1D展示了TQTPy、TPQTPy、TQTC和TPQTC在固态下的归一化发光光谱,其发射峰值分别位于约679、790、687和704nm,呈现出近红外发射的特点。图 1E展示了四种AIEgens在365nm紫外灯照射下的照片,其中TQTPy、TQTC和TPQTC显示出了明亮的近红外荧光发射。在固态下,四种AIEgens的量子产率分别为3.0%、1.0%、4.4%和7.1%,相应的荧光寿命分别为0.81、0.53、0.95和2.73纳秒(图 1F;表 1)。从量子产率和荧光寿命的数据来看,含有丙二腈单元的TQTC和TPQTC的荧光发射性能似乎优于另外两种含吡啶单元的光敏剂。值得一提的是,TQTC展示出了显著的结晶诱导发射效应,这一点可以通过补充材料中的图3的结果得到证实。 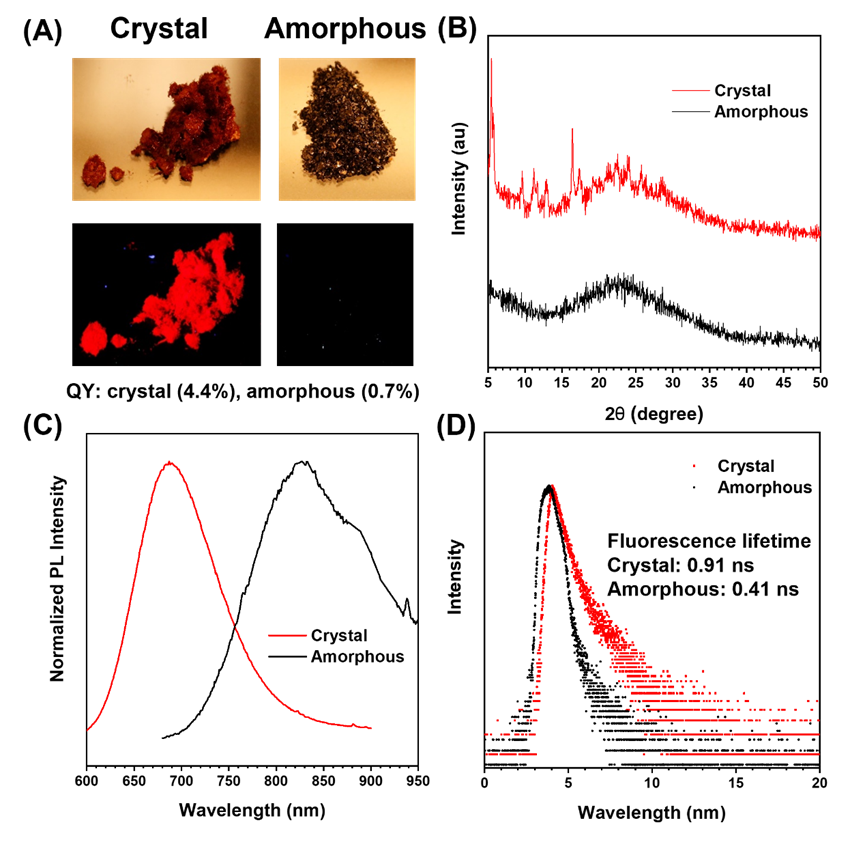 图3. (A) TQTC在明场或 365 nm紫外灯照射下的固体照片。(B) 晶体或无定形TQTC的 XRD 数据。(C) 晶体或无定形TQTC的归一化聚光光谱。(D) 晶体或无定形TQTC的寿命。
图3. (A) TQTC在明场或 365 nm紫外灯照射下的固体照片。(B) 晶体或无定形TQTC的 XRD 数据。(C) 晶体或无定形TQTC的归一化聚光光谱。(D) 晶体或无定形TQTC的寿命。
作者获得了TQTPy的单晶体,以探究其分子构象及堆积方式。如图 4A、B 所示,TQTPy呈现非平面的分子构象。TPA 部分的构象有所扭曲,喹啉与TPA苯环之间的扭转角为30.16°,喹啉与喹啉上的苯环之间的扭转角分别为41.43°和42.83°。这种扭曲构型使得相邻分子间的距离大于3.4 Å,有效地减少了分子间的π-π相互作用,从而避免了在聚集状态下出现的发射淬灭现象。
晶体结构中存在着几种较弱的分子间相互作用,包括C-H···F (2.6521 Å)、C-H···O (2.6095 Å)以及C-H···π (2.8235 Å, 2.8878 Å)。这些相互作用有助于稳定分子构象,进而限制了分子的运动自由度,减少了光激发过程中非辐射跃迁的发生概率,促使分子展现出AIE特性。
为进一步深入了解这四种AIEgens的光学性能,作者进行了密度泛函理论(DFT)计算(图 2C)。孤立的最高占据分子轨道(HOMO)和最低未占据分子轨道(LUMO)进一步证实了AIEgens独特的电荷转移特性。作者也计算了AIEgens的单重态和三重态激发态(图 2D)。据文献报道,当最低单激发态(S1)和三重激发态(Tn)之间的能量差(Δ_E_st)小于0.3 eV时,可以极大促进单重态至三重态的体系间交叉(ISC)过程,有助于提高1O2的产生效率。基于作者的计算结果,从S1到T2的多数ISC转变是可行的。
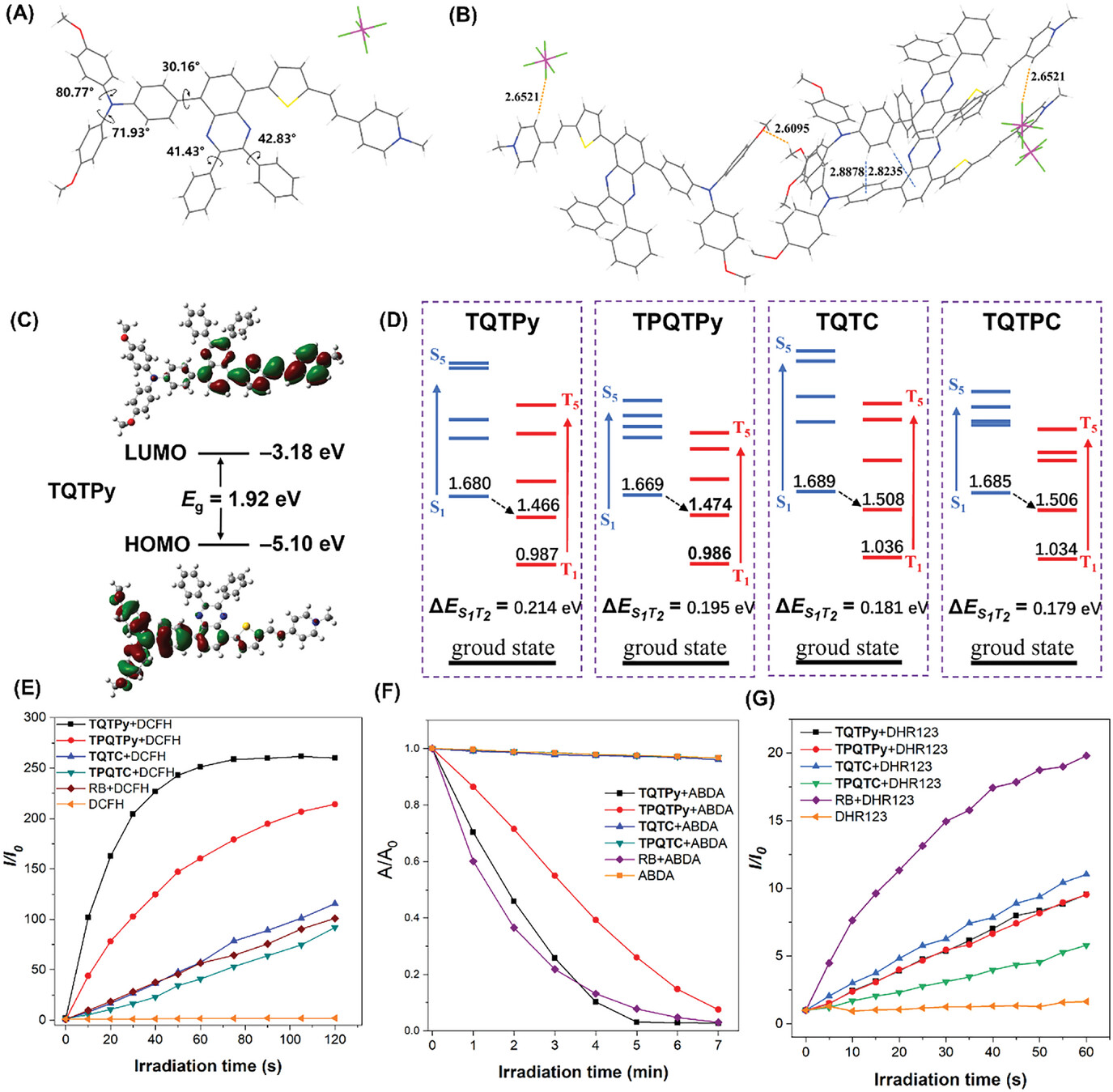
图4. A) TQTPy的晶体结构和扭转角。B) TQTPy单晶中分子间相互作用和短接触情况。C) DFT 在 B3LYP/6-311 g (d, p) 基集上计算的TQTPy的 HOMO 和 LUMO 能级的前沿轨道分布。D) 通过 B3LYP/6-311 g (d, p) 基集计算的TQTPy、TQTPy、TQTC和TQTC的激发单重态和三重态的能级分布。E) 在不同的光照射时间下,I/I0 在 AIEgens 的存在下。I0 和 I 分别是照射前后 DCFH 在 525 nm波长处的荧光强度。F) 不同光照时间下,AIEgens 存在时的 A/A0。A0 和 A 分别为照射前后 ABDA 在 378 nm波长处的吸光度。G) 不同光照时间下,有 AIEgens 存在时的 I/I0 。I0 和 I 分别为照射前后 DHR123 在 525 nm波长处的荧光强度。
接着,作者研究了TQTPy、TPQTPy、TQTC和TPQTC四种化合物的活性氧物种(ROS)生成能力和具体ROS种类。使用2',7'-二氯二氢荧光素二乙酸酯(DCFH-DA)作为经典ROS指标来验证总体ROS的产生能力。如图2E所示,当将DCFH-DA与这些AIEgens混合并在光照下照射时,DCFH的荧光强度显著增加。四种光敏剂产生ROS的总体能力按以下顺序递减:TQTPy > TPQTPy > TQTC > TPQTC。就总体ROS生成而言,TQTPy和TPQTPy的表现优于商用光敏剂玫瑰红(RB)。
ROS生成的结果显示,以吡啶作为受体单元的光敏剂TQTPy和TPQTPy,在ROS生成方面的能力超过了以丙二腈作为受体单元的光敏剂TQTC和TPQTC。进一步使用市售的探针9,10-蒽二基双(亚甲基)二丙二酸(ABDA,用于检测1O2)、二氢罗丹明123(DHR123,用于检测·O2·)以及羟苯基荧光素(HPF,用于检测-OH)来评估四种AIEgens的具体ROS种类。
如图2F所示,当存在TQTPy时,ABDA在378nm波长处的吸光度随着时间的延长而逐渐降低。相比之下,在TQTC和TPQTC的存在下,ABDA在该波长处的吸光度并没有明显下降。这表明四种光敏剂产生1O2的能力顺序为TQTPy≈RB > TPQTPy > TQTC ≈ TPQTC。如图2G所示,在光敏剂存在的情况下,DHR123在525nm处的荧光强度随着照射时间的延长而增强。四种AIEgens产生·O2·的能力顺序为RB > TQTC > TQTPy ≈ TPQTPy > TPQTC。另外,HPF评估结果表明TQTPy和TPQTPy的-OH生成能力高于TQTC、TPQTC和RB。
为了更深入地了解这四种AIEgens生成的I型ROS物种,采用5,5-二甲基-1-吡咯啉-N-氧化物作为I型ROS的自旋捕获剂,并进行电子自旋共振(ESR)测量来监测氧自由基的形成。如图5所示,随着照射时间的延长,·O2·和·OH的特征ESR信号出现并逐渐增强,表明这四种AIEgens具有显著的I型ROS生成能力。 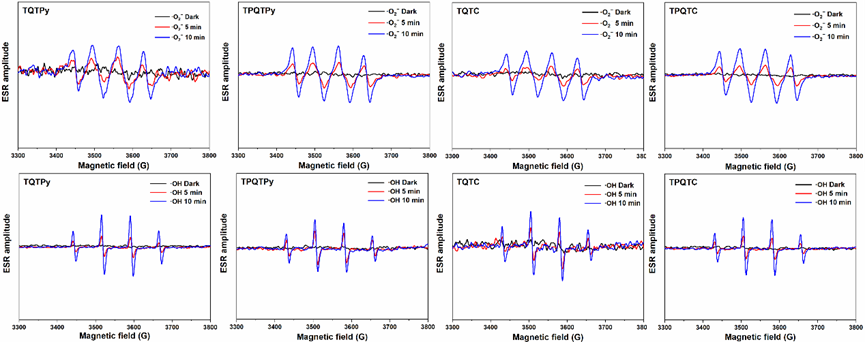 图5. TQTPy、TQTPy、TQTC和TQTC的 ESR 光谱
图5. TQTPy、TQTPy、TQTC和TQTC的 ESR 光谱
上述实验结果证明,光敏剂特别是TQTPy,能够同时产生I型和II型ROS,有利于克服实体瘤中严重的缺氧问题,实现高效的光动力疗法(PDT)。因此,鉴于其出色的ROS生成能力,TQTPy被应用于随后的细胞和动物实验中。
2.3 细胞研究
针对细胞器的光敏剂可以实现更有效的光导治疗。为了验证TQTPy对特定细胞器的靶向特性,将HeLa细胞用TQTPy染色30分钟后,再用Lyso-Tracker Green和MitoTracker Green进行双重染色,并通过共定位实验进行确认(图6)。如图6所示,TQTPy的红色荧光与MitoTracker Green的绿色荧光几乎完全重叠,皮尔逊相关系数达到0.92,这表明TQTPy具有显著的线粒体靶向性,而其与溶酶体的共定位系数只有0.76 (图7) 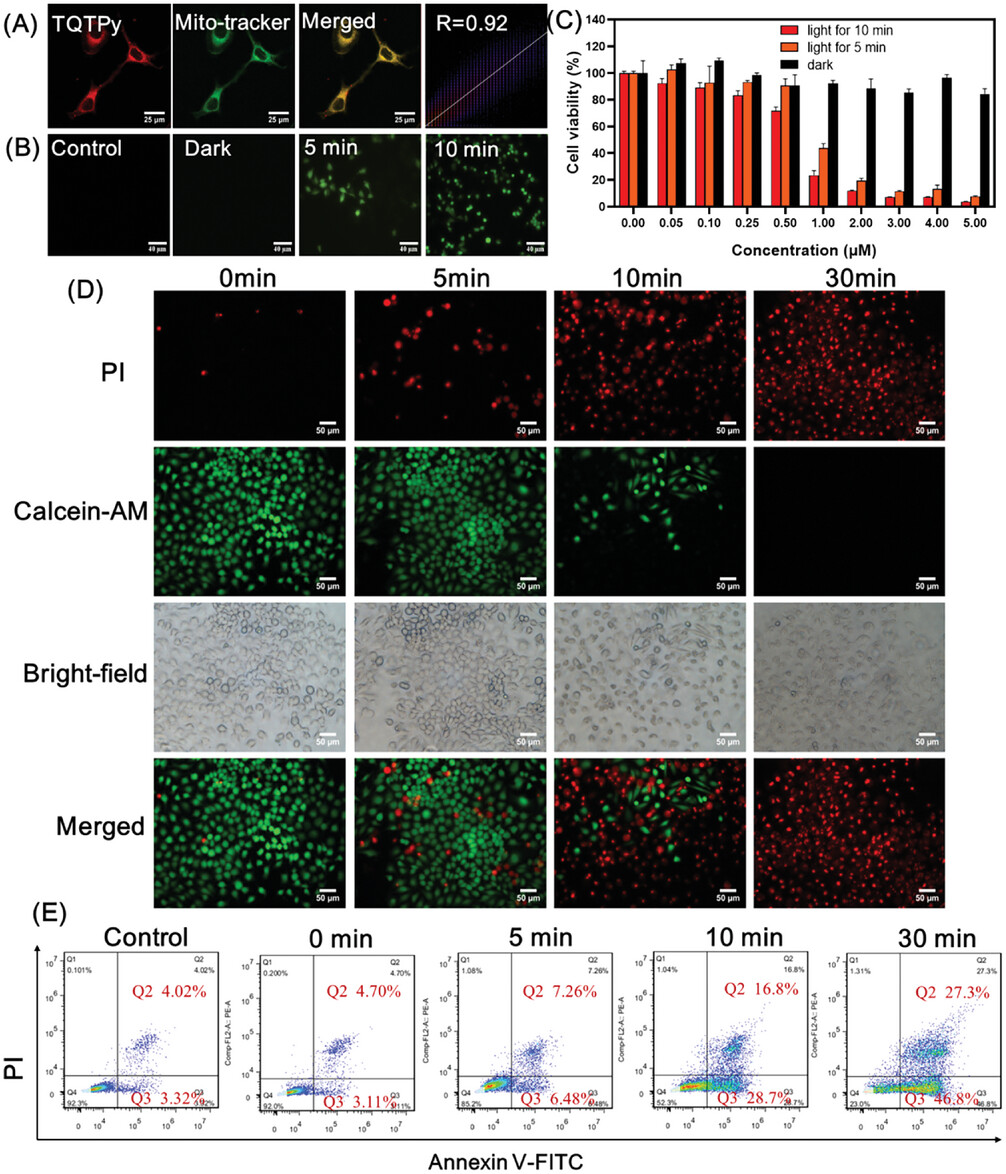
图6. A)用TQTPy和 MitoTracker Green 染色的 HeLa 细胞的共聚焦成像实验,B) 以 DCFH 为指示剂检测细胞内 ROS 的产生,C) 用 CCK8 检测法测定在黑暗或白光照射(25 mW cm-2)下用不同浓度的TQTPy培养的 HeLa 细胞的细胞活力(n = 3)。D) 用TQTPy(2 µm)处理并用白光照射不同时间的 HeLa 细胞,用 Calcein-AM 和 PI 染色,E) 不同时间的光照射处理后,使用流式细胞仪对细胞进行Annexin V-FITC/PI双染色,分析细胞凋亡和坏死情况。
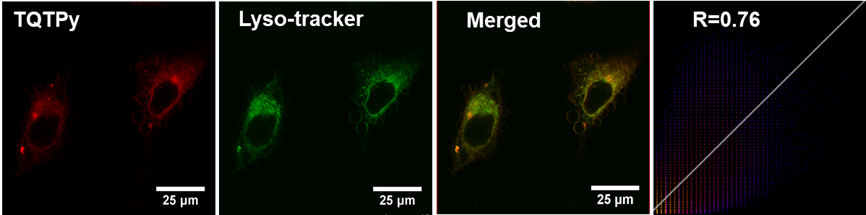 图7. 用TQTPy和 Lyso-tracker 染色的 HeLa 细胞的共聚焦成像实验
图7. 用TQTPy和 Lyso-tracker 染色的 HeLa 细胞的共聚焦成像实验
接下来,使用DCFH作为ROS指示剂,在不同白光照射时间内评估了TQTPy产生细胞内ROS的能力。如图6B所示,在黑暗条件下,对照组和TQTPy处理组均未观察到荧光信号。而在光照条件下,TQTPy处理组显示出明亮且随时间逐渐增强的绿色荧光,表明细胞内有效生成了ROS。通过CCK8检测方法评估了TQTPy对HeLa细胞的光动力抗肿瘤作用。如图6C所示,即使在较高浓度下,TQTPy在黑暗条件下的细胞毒性也很小,表明其具有良好的生物相容性。然而,在光照条件下,TQTPy对HeLa细胞产生了明显的剂量依赖性光毒性,随着照射时间的延长,HeLa细胞的存活率明显下降。
作者还研究了TQTPy在光照和非光照条件下对正常细胞(包括人脐静脉内皮细胞(HUVEC)、正常大鼠肾脏细胞(NRK)和人角质细胞(HaCaT))的影响(图8)。在黑暗条件下,TQTPy对这些正常细胞的毒性较弱,当光敏剂浓度为5 μM时,细胞存活率保持在80%以上。然而,在光照条件下,TQTPy对正常细胞展现出光毒性。
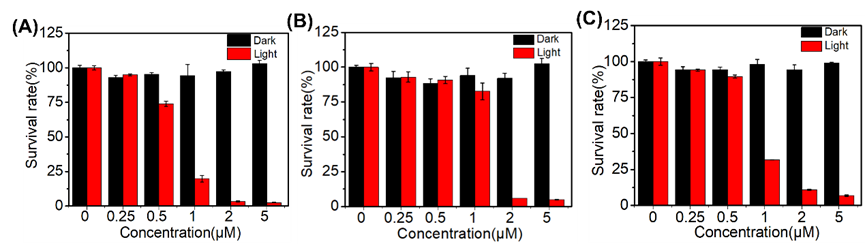 图8. 用 CCK8 检测法测定(A)HUVEC、(B)NRK 和(C)HaCaT 细胞与不同浓度的TQTPy在黑暗或白光照射(25 mW cm-2)下孵育 10 分钟后的细胞活力。
图8. 用 CCK8 检测法测定(A)HUVEC、(B)NRK 和(C)HaCaT 细胞与不同浓度的TQTPy在黑暗或白光照射(25 mW cm-2)下孵育 10 分钟后的细胞活力。
为了进一步证实TQTPy的PDT效果,作者进行了活细胞/死细胞双重染色实验,如图6D所示,随着照射时间的延长至30分钟,红色荧光变得更加明亮并占据视野中的大部分区域,而绿色荧光则几乎消失。这一实验结果进一步证实了TQTPy出色的PDT能力。使用流式细胞术进一步评估了TQTPy在白光照射下的PDT效应(图6E)。在无光照条件下,对照组和TQTPy处理组的活细胞比例(Q4象限)接近92%。但随着光照时间的延长,凋亡和坏死细胞的比例显著增加。在30分钟的照射后,凋亡和坏死细胞的比例增加到了77%。这些结果与CCK8和活/死细胞染色检测的结果一致。
2.4 体内成像和 PDT
通过瘤内注射的方式,作者评估了TQTPy对携带HeLa肿瘤的BALB/c裸鼠体内荧光成像的能力。如图9A所示,这些小鼠在注射TQTPy之后的不同时间点呈现出荧光图像的变化。在注射后1小时,肿瘤部位开始出现荧光信号,并且随着时间的推移,荧光强度逐渐增强。直至注射后72小时,肿瘤部位仍然保持着明显的荧光,而其他正常组织区域的荧光信号则非常微弱(图4B),这表明TQTPy具有良好的肿瘤滞留特性。
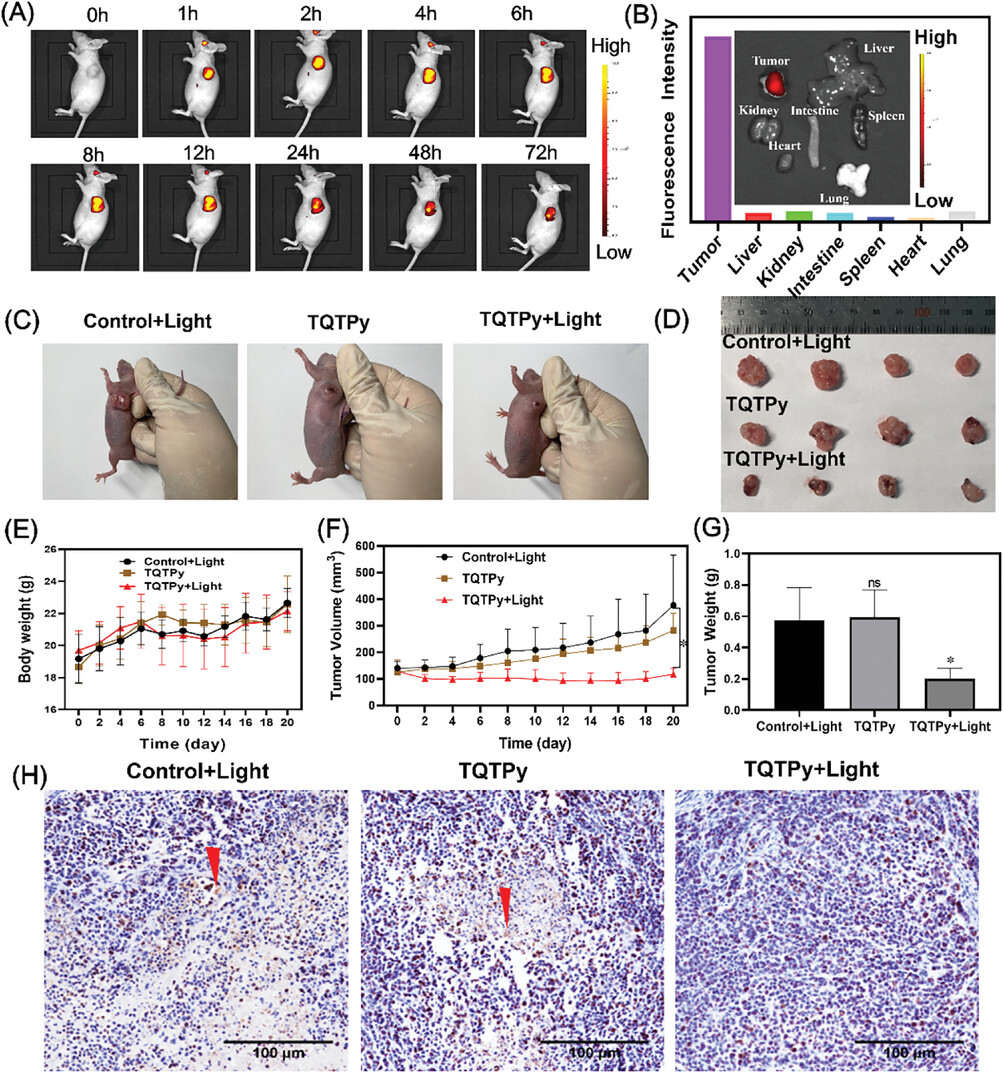
图9. TQTPy对携带 HeLa 肿瘤的 BALB/c 裸鼠的体内荧光图像和光动力疗法。A) 注射TQTPy后不同时间肿瘤小鼠的荧光图像。B) 注射 TQTPy 72 小时后,小鼠主要器官和肿瘤的体外荧光图像。 C) 不同组别 HeLa 肿瘤小鼠治疗 21 天后的照片。D) 治疗 21 天后各组肿瘤的照片(每组 n = 4)。E) 21 天治疗后各组肿瘤小鼠的体重和 F) 肿瘤体积增长曲线(每组,n = 4)。G) 21 天治疗后不同治疗组的肿瘤重量(每组,n = 4)。H) 不同治疗组肿瘤组织的 Ki67 染色分析。
接下来,作者评估了TQTPy的体内抗肿瘤活性。图9C展示了不同治疗组别HeLa肿瘤小鼠在接受治疗21天后的外观照片。HeLa肿瘤小鼠被随机分成三组:对照组+光照组、仅TQTPy组以及TQTPy+光照组。通过记录治疗过程中小鼠的肿瘤图像和监测肿瘤的体积及重量(图9D-G),评估了各组的肿瘤消退效果。正如预期,TQTPy+光照组在治疗21天后有效地抑制了肿瘤的生长,同时在整个治疗期间,小鼠的体重变化不大。
为了进一步确认TQTPy的肿瘤抑制效果,作者对三组小鼠进行了Ki67单克隆抗体染色检测(图9H)。结果显示,在TQTPy+光照组中,Ki67阳性细胞的比例明显降低,这证实了TQTPy在光照下的光动力治疗(PDT)效果更为显著。
此外,通过H&E染色法,作者进一步评估了TQTPy的生物相容性。如图10所示,三组小鼠的心脏、肝脏、肾脏、脾脏、肺部和肠道等重要器官的组织切片均未观察到明显的组织损伤或炎症迹象,这有力地证明了TQTPy对于体内的主要器官具有较低的毒性。
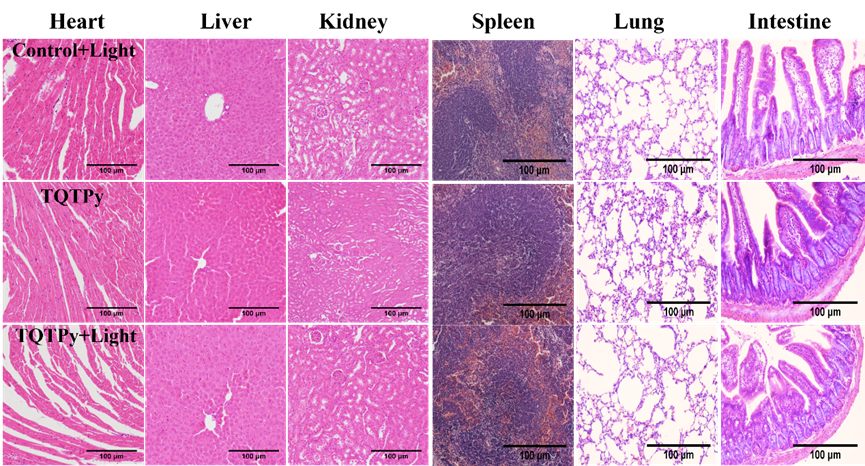
图10. 不同组小鼠组织切片(心、肝、肾、脾、肺、肠)的 H&E 染色图像
2.5 选择性快速成像和杀灭革兰氏阳性(G+)细菌
光动力疗法因其无耐药性、治疗可控和图像引导下精确杀灭细菌的优点而备受关注。本文选择了金黄色葡萄球菌(S. aureus)、大肠埃希氏菌(E. coli)和NIH/3T3细胞分别作为革兰氏阳性(G+)、革兰氏阴性(G-)细菌和正常细胞的代表,以评估TQTPy的荧光成像和杀菌能力。
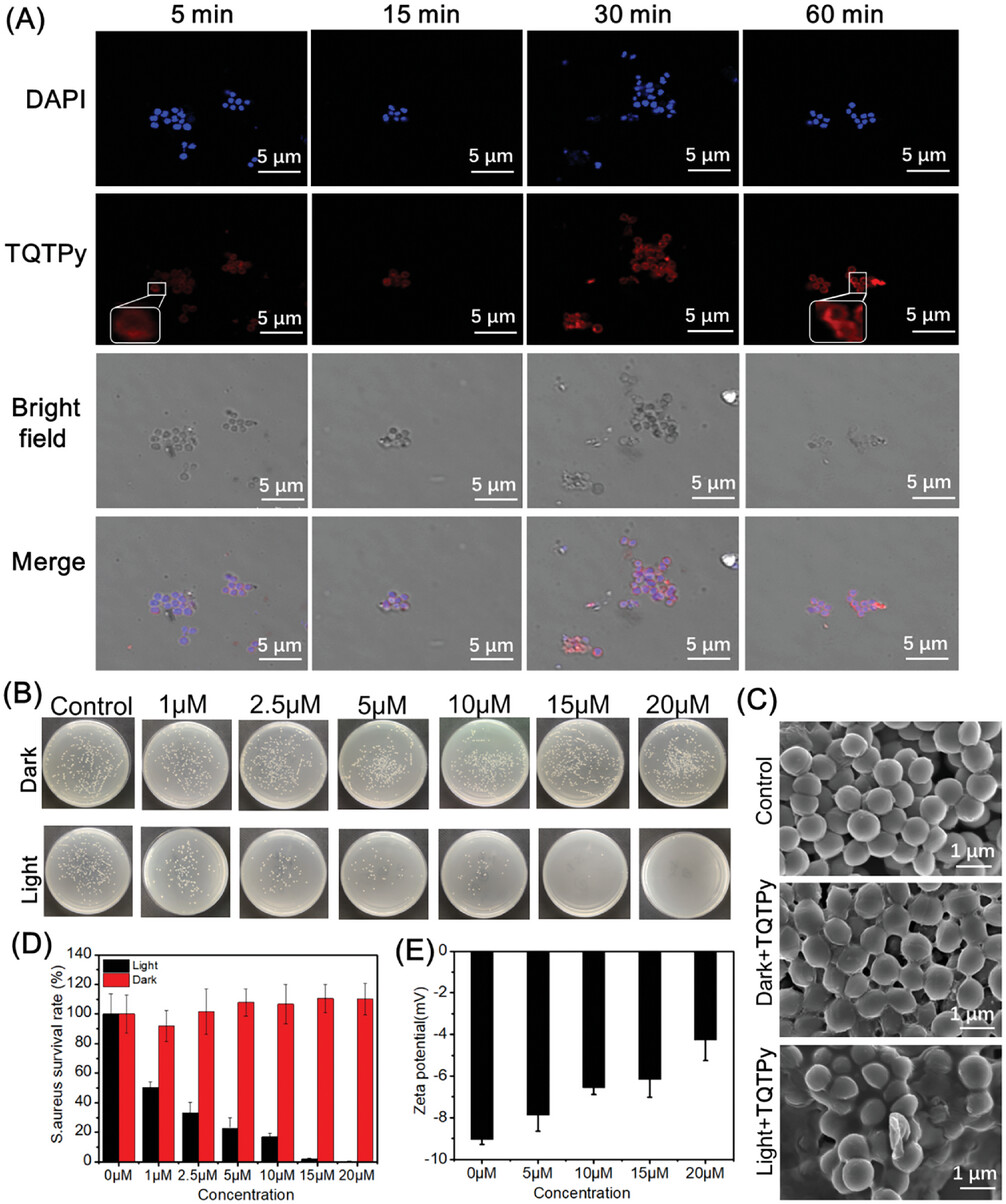
图11. A) S. aureus 与 TQTPy(20 µm)在不同培养时间下的 CLSM 图像。B) 用不同浓度的 TQTPy 处理革兰氏阳性菌 S. aureus 的琼脂平板照片。C) 在光照或不光照的情况下,用 TQTPy 处理革兰氏阳性菌 S. aureus 后的扫描电镜图像。[ TQTPy ] = 10 µm。D) 经不同浓度的TQTPy处理(25 mW cm-2,n = 3)或不经光照射(25 mW cm-2,n = 3)后,金黄色葡萄球菌的存活率。E)不同浓度的TQTPy在 37 °C、轻微振荡条件下培养 30 分钟后 S. aureus 的 Zeta 电位(n = 3)。
为了评估TQTPy对金黄色葡萄球菌的成像能力,作者将金黄色葡萄球菌与TQTPy在不同时间点共同培养。如图11A所示,当金黄色葡萄球菌与TQTPy共同培养5分钟后,可以观察到圆形的红色荧光信号,这表明TQTPy能够快速对金黄色葡萄球菌进行染色和成像。随着培养时间的延长至60分钟,荧光强度变得更加强烈(图12)。作者通过共焦成像实验评估了TPQTPy、TPQTC和TQTC对金黄色葡萄球菌成像的能力。与TPQTPy共同培养30分钟和60分钟后,金黄色葡萄球菌发出轻微的红色荧光。然而,在与TPQTC和TQTC共同培养不同时间后,并未检测到红色荧光信号,这表明仅有TPQTPy对金黄色葡萄球菌具有一定的亲和力(图13)。 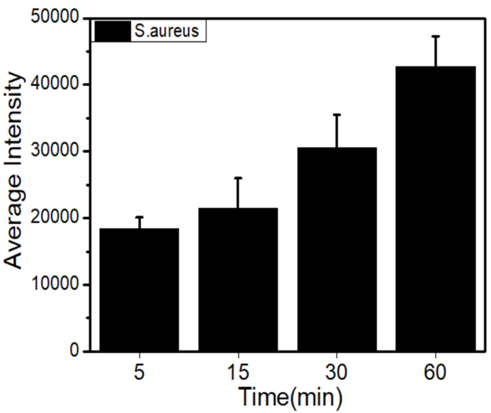 图12. 不同培养时间下 S. aureus 与 TQTPy(20 μM)培养的CLSM图像定量分析。
图12. 不同培养时间下 S. aureus 与 TQTPy(20 μM)培养的CLSM图像定量分析。
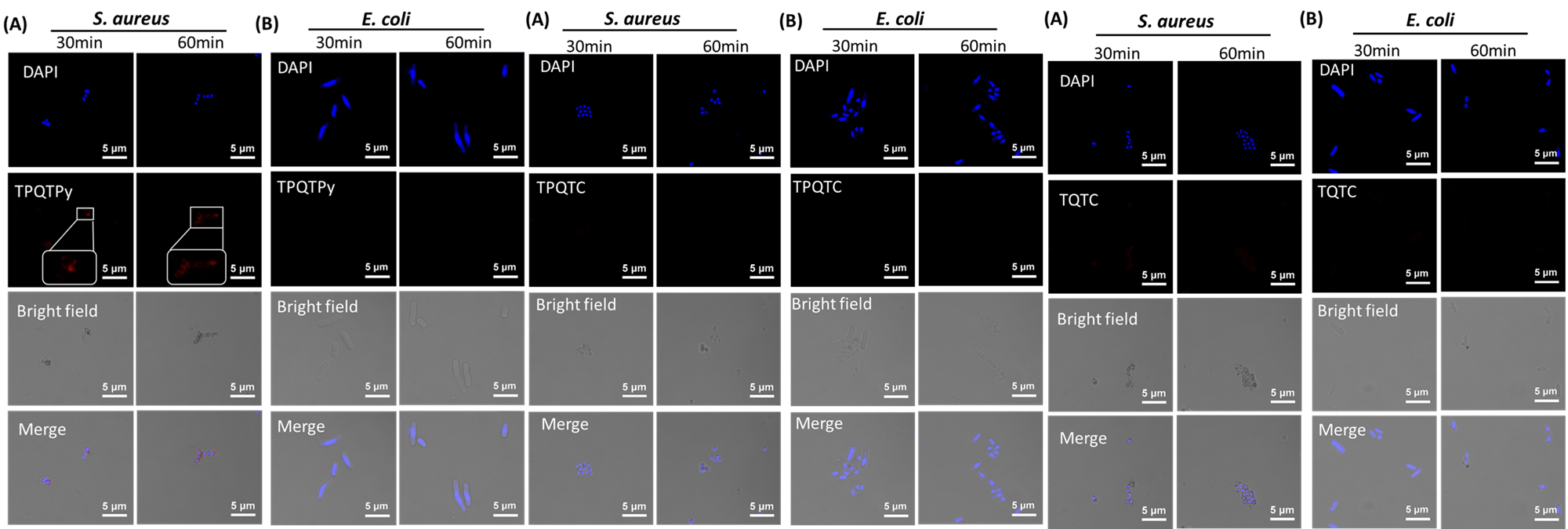 图13. (A) S. aureus 与不同探针在不同培养时间下的 CLSM 图像。(B) E.coli 与不同探针在不同培养时间下的 CLSM 图像。
图13. (A) S. aureus 与不同探针在不同培养时间下的 CLSM 图像。(B) E.coli 与不同探针在不同培养时间下的 CLSM 图像。
作者通过平板计数法测试了TQTPy对金黄色葡萄球菌的抑菌作用。将金黄色葡萄球菌与不同浓度的TQTPy共同培养30分钟。如图11B所示,在高浓度TQTPy下,金黄色葡萄球菌在黑暗中仍然能够生长形成菌落。此外,金黄色葡萄球菌在与TQTPy共同培养后在黑暗中的形态没有变化,这也表明TQTPy对金黄色葡萄球菌的黑暗毒性较低(扫描电子显微镜(SEM)图像见图11C)。在白光照射下,金黄色葡萄球菌的活力显著下降。用15 µM的TQTPy处理后,超过98%的金黄色葡萄球菌被杀死,这表明TQTPy对革兰氏阳性菌具有极佳的抗菌活性(图11D)。如图11C所示,在白光照射下,用TQTPy处理金黄色葡萄球菌后,观察到其膜变形和融合,这表明光动力疗法大大增强了对细菌包膜的破坏。TQTPy与金黄色葡萄球菌的结合亲和力进一步解释了这种出色的光动力效应。带负电荷的金黄色葡萄球菌细胞壁的zeta电位为-9.1 mV(图11E)。带正电荷的TQTPy孵育后,金黄色葡萄球菌表面的负电荷减小,表明细菌膜与TQTPy之间发生了静电吸附。当金黄色葡萄球菌与TQTPy共同培养时,TQTPy能够捕捉到明亮的红色荧光,这也证明了TQTPy与金黄色葡萄球菌的良好结合亲和力(图11A)。TQTPy在金黄色葡萄球菌上的聚集有利于通过产生ROS直接破坏细菌的膜结构,从而达到良好的光动力杀灭金黄色葡萄球菌的效果。
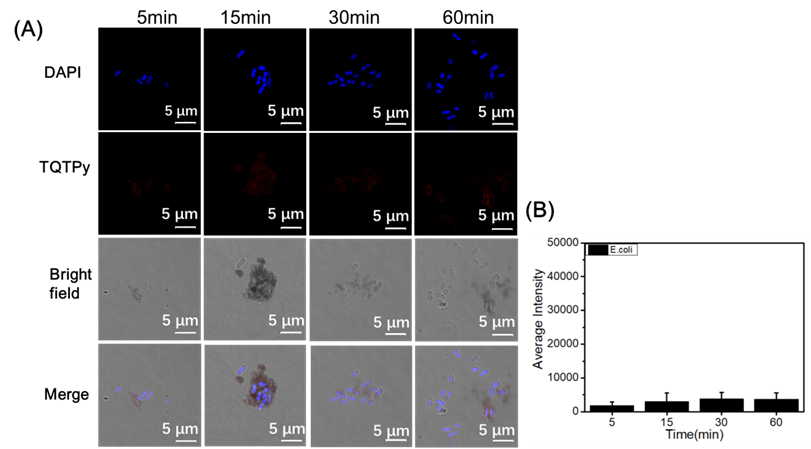 图14. (A) E. coli 与 TQTPy(20 μM)在不同培养时间下的 CLSM 图像。(B) (A) 中的定量分析。
图14. (A) E. coli 与 TQTPy(20 μM)在不同培养时间下的 CLSM 图像。(B) (A) 中的定量分析。
通过将大肠埃希氏菌与TQTPy共同培养不同时间,作者评估了TQTPy对大肠埃希氏菌成像的能力。大肠埃希氏菌与TQTPy共同培养5至60分钟后,几乎检测不到荧光信号(图14)。此外,大肠埃希氏菌与TQTPy、TQTC和TPQTC分别共同培养30分钟和60分钟后也几乎检测不到荧光信号(图13)。结果表明,这四种PS无法对大肠埃希氏菌进行染色和成像。金黄色葡萄球菌和大肠埃希氏菌与TQTPy共同培养的成像结果显示,TQTPy可以选择性地“点亮”金黄色葡萄球菌(图15A)。更重要的是,当TQTPy与金黄色葡萄球菌和NIH/3T3细胞共同培养时,TQTPy也能选择性地“点亮”金黄色葡萄球菌,但不能点亮NIH/3T3细胞(图15B)。这表明,在生理条件下,TQTPy能够选择性地快速成像革兰氏阳性(G+)细菌,而不是革兰氏阴性(G-)细菌和正常细胞。TQTPy对革兰氏阳性菌和革兰氏阴性菌的不同选择性是由于它们的结构复杂性不同。G-细菌的外包膜由外膜、交联肽聚糖网和胞质膜组成,比只有肽聚糖网和胞质膜的G+细菌复杂得多。这种更完整复杂的包膜结构阻碍了大多数AIE光敏剂接近G-细菌,导致细菌染色共焦图像暗淡。G+细菌缺乏有效的屏障来阻止AIE光敏剂的插入,从而实现明亮的荧光发射。因此,AIE光敏剂TQTPy能够快速成像并杀死G+细菌。TQTPy对G+细菌和正常细胞的选择性不同,是因为细菌和正常细胞的表层组成和结构不同。一个重要的区别是,阴离子脂质暴露在细菌膜的表面,而在真核生物膜中,阴离子脂质被封闭在面向细胞或细胞器内部的单层中。因此,带正电荷的光敏剂TQTPy更容易静电吸附在细菌膜上,从而对细菌膜的选择性大于正常活细胞。
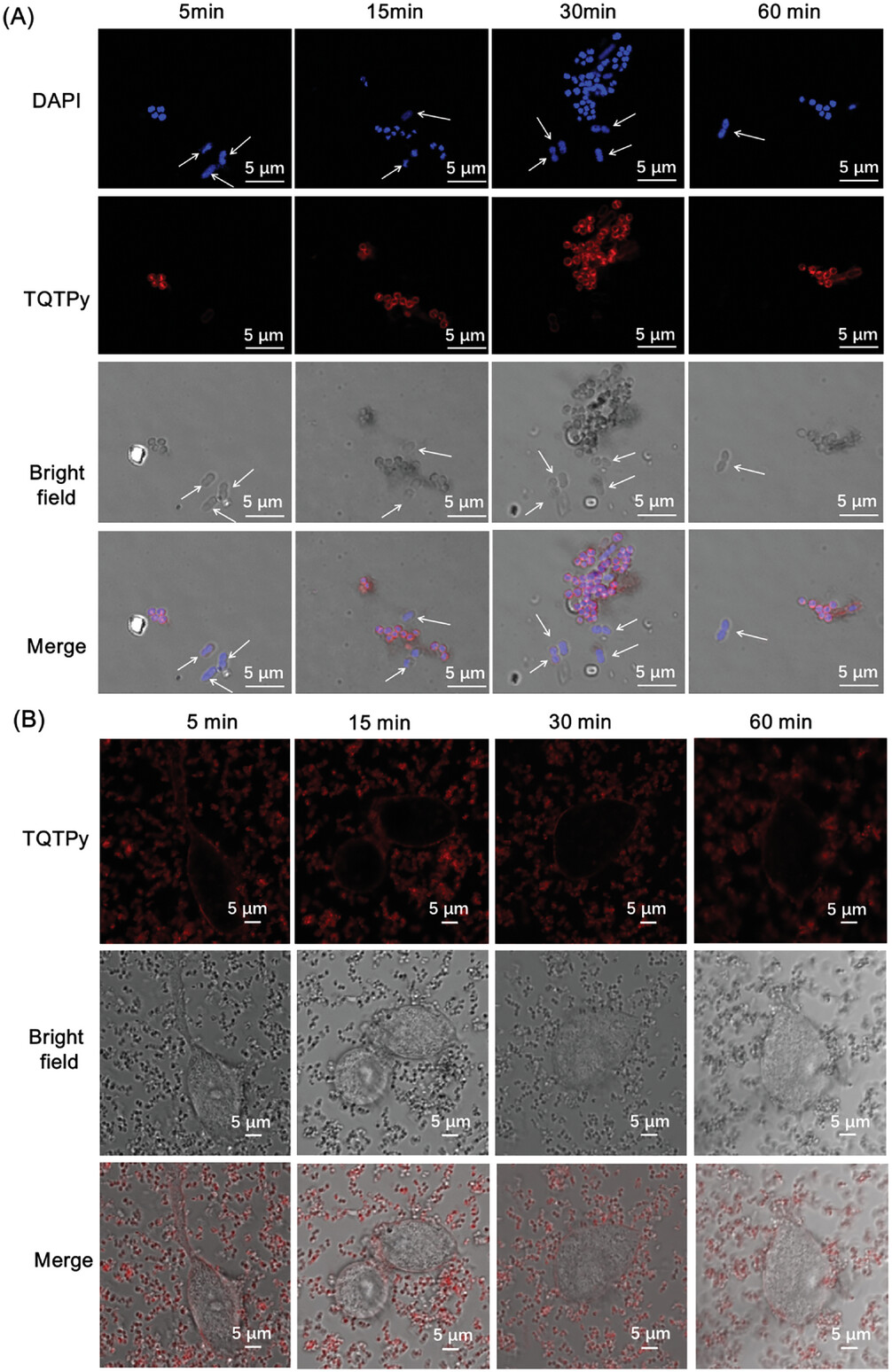
图15. 用 TQTPy(20 µm)对 A)革兰氏阳性菌_金黄色葡萄球菌_和 B)NIH/3T3 正常细胞进行选择性染色。白色箭头所指的是大肠杆菌。
作者还研究了TQTPy对革兰氏阴性菌的光动力效应抗菌性能。用不同浓度的TQTPy处理大肠埃希氏菌,在光照或不光照的情况下处理不同的时间,如图16A所示。随着TQTPy浓度的增加或光照时间的延长,大肠埃希氏菌的活力仍然很高(图16B),大肠埃希氏菌的表面结构也保持完好(图16D)。在使用不同浓度的TQTPy培养前后,大肠埃希氏菌的表面电位没有发生明显变化(图16C)。上述结果表明,TQTPy与革兰氏阴性菌的亲和力较差。图14和图15A也证明了这一结果。因此,TQTPy在选择性成像和通过光动力疗法灭活革兰氏阳性菌方面具有突出的优势,这意味着它在临床上具有广阔的应用前景。
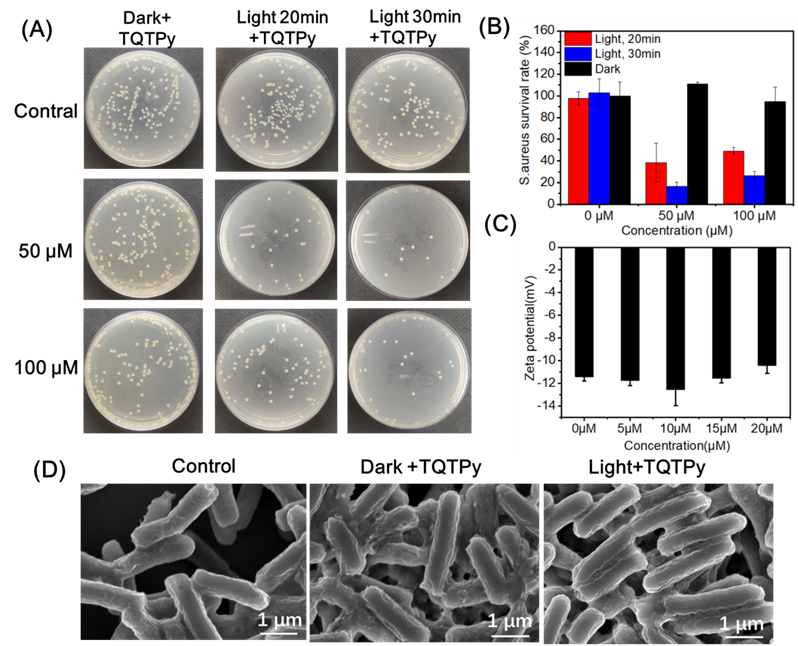 图16.琼脂平板上的照片(A)和不同浓度 TQTPy 在黑暗和 25 mW cm-2 光照下_E. coli_ 的细菌存活率(B)。(C) E.coli 分别与不同浓度的 TQTPy 在 37 ℃ 下培养 30 分钟后的 Zeta 电位。(D) 革兰氏阴性大肠杆菌在无TQTPy或有TQTPy的情况下的扫描电镜图像。
图16.琼脂平板上的照片(A)和不同浓度 TQTPy 在黑暗和 25 mW cm-2 光照下_E. coli_ 的细菌存活率(B)。(C) E.coli 分别与不同浓度的 TQTPy 在 37 ℃ 下培养 30 分钟后的 Zeta 电位。(D) 革兰氏阴性大肠杆菌在无TQTPy或有TQTPy的情况下的扫描电镜图像。
3 结论
综上所述,作者根据分子工程策略成功开发了四种近红外D-A-π-A型AIEgens(TQTPy、TQTPy、TQTC和TQTC),它们集成了I型和II型ROS生成。以吡啶鎓为受体的 AIEgen TQTPy表现出优异的性能,包括近红外荧光发射、线粒体靶向能力、最佳的 ROS 生成效率(I 型和 II 型)、良好的生物相容性和肿瘤长期存留能力。阳离子两亲TQTPy在近红外荧光成像引导的光动力抗癌治疗、超快分辨和杀灭革兰氏阳性菌等三合一实际生物医学应用中表现出色。综上所述,该材料系统提供了一种双管齐下的治疗/诊断策略,可在成像引导下精确治疗癌症和细菌感染。
参考文献
Quan, Y.; Pan, T.; Zhang, Z.; Wang, S.; Wang, G.; Yu, L.; Wang, Y.; Zang, X.; Zhang, F.; Ye, X.; Pan, X.; Huang, Z. Three‐in‐One: Molecular Engineering of D–A–π–A Featured Type I and Type II Near‐Infrared AIE Photosensitizers for Efficient Photodynamic Cancer Therapy and Bacteria Killing. Small 2024, 2402854. https://doi.org/10.1002/smll.202402854.