【Coord. Chem. Rev.】二区近红外荧光/光声双模态成像探针-前言及探针设计策略
NIR-II fluorescence/photoacoustic dual-modality imaging probe
NIR-II FL/PA 双模态成像探针
 •
•
近红外-II(NIR-II)荧光成像(FLI)技术,以其独特的低自发荧光背景、出色的组织穿透能力和高分辨率特性,在生物医学成像领域受到了广泛的研究关注。与此同时,光声成像(PAI)作为一种新兴的非侵入性成像技术,其结合了光学成像的高对比度和声学成像的深穿透力,已成为当前研究的热点之一。
在此背景下,近红外-II探针作为能够实现荧光(FL)与光声(PA)双模式成像的先进工具,为成像技术的发展提供了新的方向。这种双模态成像探针不仅展现了在生物医学成像领域的巨大潜力,还为多模态成像技术的联合应用开辟了新的道路。
本综述旨在全面介绍近红外-II FL/PA双模态成像探针的研究进展。首先,我们将详细探讨探针的设计策略,包括如何优化探针的光学和声学性质,以实现高效的双模态成像。接着,我们将对探针的分类进行梳理,以便读者更好地理解不同探针的特点和应用范围。
此外,我们还将关注可激活探针的开发,这类探针能够在特定条件下被激活,从而实现更精确的成像效果。同时,我们也将探讨这些探针在生物医学领域的应用,包括肿瘤诊断、血管成像和神经科学研究等方面。
最后,我们将对近红外-II FL/PA双模态成像探针的发展情况进行总结,并展望其未来的发展前景和面临的挑战。我们希望通过这篇综述,能够激发读者对近红外-II FL/PA双模态成像探针研究的兴趣,并为其在生物医学领域的应用提供有益的参考。
目录
1引言
- 近红外-II FL/PA 双模态成像探针的设计策略
2.1. “常亮”型探针
2.2. “点亮”型探针
2.3. 比率型探针
- 近红外-IIFL/PA双模态成像探针的分类
3.1. 有机材料
3.1.1. 有机小分子荧光染料
3.1.2. 有机小分子纳米粒子
3.1.3. 聚合物纳米粒子
3.2. 有机-无机纳米复合材料
3.2.1. 金属硫化物复合纳米粒子
3.2.2. 金纳米复合粒子
3.2.3. 稀土金属参杂的纳米粒子
3.2.4. 碳复合材料
3.2.5. 其他复合材料
- 可激活的近红外-II荧光/光声(FL/PA)双模态探针
4.1. NO 激活探针
4.2. 生物硫醇激活探针
4.3. ROS 激活探针
4.4. pH激活的探针
4.5. NTR 激活探针
4.6. 其他激活探针
- 生物医药应用
5.1. 体内成像
5.1.1. 肿瘤治疗
5.1.2. 血管成像
5.1.3.其他部位的成像
5.2. 肿瘤治疗
5.2.1. 手术导航
5.2.2. 药物递送
- 结论与展望
引言
随着近红外(NIR,700-1700 nm)成像技术的迅猛发展,荧光(FL)探针技术已成为科研与工业界瞩目的焦点。特别地,二区近红外(NIR-II,1000-1700 nm)荧光成像(FLI)技术,凭借其低毒性、卓越的时空分辨率、深度穿透能力、无创性、高信噪比(SNR)以及成本效益,已成为科学研究和医疗诊断的重要工具。根据发射波长的差异,NIR-II 可细分为NIR-IIa'(1000-1300 nm)、NIR-IIa(1300-1400 nm)和NIR-IIb(1500-1700 nm)三个子区域。
目前,用于合成NIR-II荧光探针的荧光团主要包括有机小分子染料、半导体聚合物、量子点(QD)以及碳纳米管等。与此同时,光声(PA)现象作为一种新兴的分子成像技术,近年来逐渐受到重视。此前,尽管正电子发射断层扫描(PET)、磁共振成像(MRI)和计算机断层扫描(CT)等成像技术层出不穷,但由于各自存在的局限性,如PET的放射性照射、MRI对金属物体的限制以及CT的低软组织对比度,使得结合了光学成像和超声成像优势的PAI逐渐崭露头角。当生物组织受到激光照射时,造影剂会发生光热转换,产生超声波,这些信号随后通过光声成像系统转化为图像。其中,多光谱光声断层成像(MSOT)以其多波长照射和三维(3D)图像采集能力,在生物成像领域展现出巨大的潜力。
多模态成像技术通过融合两种或多种成像模式,不仅吸收了各自的优势,还克服了单一模式的局限性,从而实现了生物成像的灵活性和准确性。为了克服FLI中光散射和PAI灵敏度低的问题,研究者们越来越多地转向FL/PA双模态成像模式。当前,近红外-II FL/PA双模态成像探针主要以近红外-II FL/NIR-I PA成像为主,仅有少数实现了近红外-II FL/NIR-II PA成像。
针对这一领域的研究现状,本文综述了近五年来NIR-II FL/PA双模态成像探针的研究进展。首先,我们深入探讨了”常量”、”点亮”以及比率测量探针分子的设计策略。随后,对探针分子的分类进行了详细介绍。进而,评估了用于生物标志物检测的可激活近红外-II FL/PA双模态成像探针。最后,我们讨论了近红外-II FL/PA双模态成像探针在生物医学领域的应用前景、面临的挑战以及未来发展方向。
近红外-II FL/PA 双模态成像探针的设计策略
基于探针分子在响应不同信号时展现的特性,近红外-II FL/PA双模态成像探针的设计策略可细分为四种主要类型:“开-关”型、”常量”型、“关-开”型以及比率测量型。
首先,“开-关”型探针,在初始状态下具有较强的荧光强度,但一旦与待测物发生反应,其荧光会显著减弱甚至完全消失。这种特性使得它们特别适用于检测那些能够引起荧光淬灭效应的生物标记物。然而,值得注意的是,温度和氧气等环境因素也可能导致荧光淬灭,从而可能引入误差,影响检测结果的准确性。此外,虽然“开-关”型探针分子在设计上相对简单,但荧光衰减导致的低信噪比和低灵敏度限制了它们在生物应用中的进一步应用。
鉴于“开-关”型探针的局限性,本文将重点介绍”常量”、“关-开”和比率测量型这三种设计策略。这些策略在保持高信噪比和灵敏度的同时,能够更准确地反映生物体内复杂环境的变化,为生物医学研究提供更可靠的实验工具。
“常亮”型探针
"常亮"探针在荧光成像技术中扮演着重要角色。通过监测探针分子在正常与病变区域积累的浓度差异,我们可以捕获到不同的信号强度,进而指示病变部位(如图1A所示)。为了维持持续的信号发射,这类探针需要精心选择荧光团,以确保其提供稳定且持久的荧光信号。余辉发光材料因其在外部激发停止后仍能持续发射光子的特性,常被用于设计"常亮"探针。
尽管"常亮"探针无法选择性地激活特定区域内的荧光信号,但通过引入具有光活化特性的荧光团,我们可以提高探针的时空分辨率,从而实现对特定区域变化的精确观测。此外,优化探针的亲水性-疏水性、生物相容性和尺寸效应,有助于其在体内的定向累积和渗透保留。
然而,"常亮"探针在生物体内通过血液循环分布于全身时,过于依赖信号强度的收集可能导致较低的信噪比(SBR),从而增加成像信号的误判风险。为了克服这一局限性,成像探针技术不断发展,结合了光学和超声成像优势的PAI(光声成像)技术应运而生。基于"始终开启"的近红外-II FL/PA双模态成像探针也被成功开发。
目前,大多数近红外-II FL/PA双模态成像探针均采用了”常量”型设计。与传统的”常量”式单模态探针相比,近红外-II双模态探针凭借其更高的分辨率和更深的组织穿透力,为生物医学成像领域带来了显著的进步。同时,FL/PA双模态成像方法能够有效提供不同空间分辨率和不同深度的生物组织信息,从而显著提高了成像的准确性和可靠性。 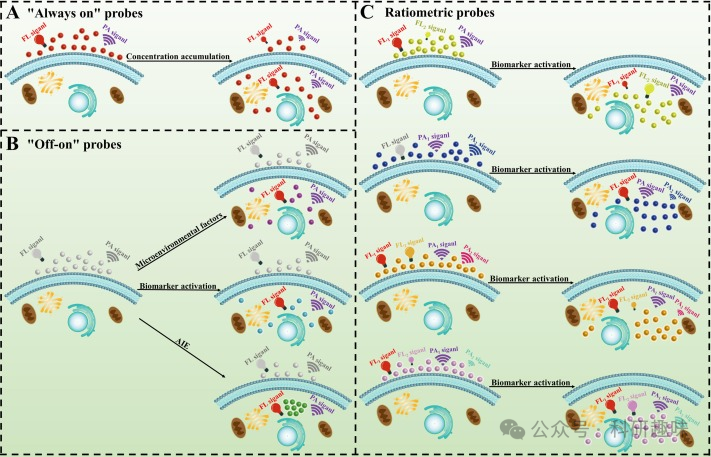 图1.(A)”常亮”近红外-IIFL/PA双模态成像探针的设计策略;(B)NIR-IIFL/PA双模态成像探针的"关闭-开启"设计策略;(C)比率测量NIR-IIFL/PA双模态成像探针的设计策略;
图1.(A)”常亮”近红外-IIFL/PA双模态成像探针的设计策略;(B)NIR-IIFL/PA双模态成像探针的"关闭-开启"设计策略;(C)比率测量NIR-IIFL/PA双模态成像探针的设计策略;
“点亮”型探针
鉴于“常亮”探针的局限性,科研人员开发了一种具有可激活特性的“非常亮”探针,即”点亮”探针。相较于”常量”探针,”点亮”探针不受探针分子浓度的影响,展现出更低的成像错误率、更高的灵敏度和特异性。然而,这些探针亦存在挑战,例如光稳定性欠佳、对环境波动的敏感性以及定量检测的困难。
“点亮”探针的设计策略涵盖了可激活型和聚集诱导发光(AIE)型。可激活探针通过引入特定的反应基团来检测与疾病相关的生物标记物(如阳离子、阴离子、活性氮物种(RNS)和活性氧物种(ROS))和微环境差异(如微酸和缺氧)。探针分子初始时处于信号关闭状态,一旦受到病变微环境的刺激或与目标物发生特异性反应,会触发显著的信号开启现象(如图1B所示)。基于NIR-II FL/PA双模态成像的”点亮”探针,能够通过无创成像实现对生物标记物和微环境因素的快速、可控和实时检测,为疾病发病机制的揭示提供了有力工具。
2001年,Tang研究团队首次提出了AIE机制的科学概念。经过20余年的研究,基于AIE机制的“开关”探针在化学、生物医学和材料科学领域发挥着关键作用。这类探针分子在稀溶液中发光微弱甚至不发光,但在分子聚集状态下,荧光会显著增强(如图1B所示)。AIE机制有效地解决了传统有机发光材料中的聚集淬灭(ACQ)问题,成为了当前探针研究领域的热点。
AIE机制的核心原理是分子内运动限制(RIM),包括分子内旋转限制和分子内振动限制,它们通过降低激发态弛豫来产生发光效应。常见的AIE类荧光团如四苯基乙烯(TPE)和三苯胺等,这些结构具有能够旋转的螺旋桨状构象。在光激发下,分子内的剧烈旋转会导致激发态的能量主要通过非辐射衰变途径消耗,这一过程具有高的光热转换效率(PCE),是光声成像(PAI)的关键因素。因此,AIE机制在近红外-II FL/PA双模态成像中得到了广泛应用。
此外,具有AIE特性的分子在聚集时能够显著提高产生ROS的效率,为光动力疗法提供了平台。由于有机小分子在水溶性和稳定性方面的不足,通常将具有AIE功能的探针分子制备成纳米粒子,以提高其在生物体内的生物相容性。基于AIE机制的NIR-II FL/PA双模态成像探针,能够克服传统光学成像在光穿透深度和荧光效率方面的限制,展现出临床转化的巨大潜力。
比率型探针
"点亮"探针通常采用单通道发射技术,以实现目标的定性检测。然而,随着技术的发展,双通道或多通道发射的比率荧光探针因其独特的优势而受到青睐。这类探针通过自我校准内部信号,能够有效消除仪器参数和环境因素对实验结果的影响,从而提供更为准确的半定量和定量检测。作为生物医学研究的重要工具,比率测量探针的未来发展将聚焦于提升检测精度、优化生物相容性、增强稳定性和抗光漂白性,以及实现多功能深度成像和临床转化等目标。
在设计比率测量探针时,通常有两种策略。第一种策略是引入一个对目标不敏感的参考信号作为内标,同时结合对目标有响应的传感信号,并对传感信号进行归一化处理,以实现比率测量。第二种策略更为灵活,它涉及在探针分子中引入两个相关的响应感应信号。当探针分子与目标物发生反应时,一个感应信号增强,而另一个感应信号减弱,从而实现信号可逆的比率测量检测。与依赖参考信号的比率测量法相比,这种方法具有更低的信噪比(SBR)。
目前,基于近红外-II FL/PA双模态成像的比率荧光探针已经取得了显著进展。这些探针主要可分为FL比率法、PA比率法和FL/PA双比率法(如图1C所示)。近红外-II双模态比率成像技术不仅提高了活体成像的准确性,还显著改善了空间分辨率、时间分辨率和深层组织穿透能力。此外,比率成像探针还能够实时监测细胞内生物标记物的波动,并进行定量分析,为疾病的诊断和治疗提供了强有力的支持。总之,近红外-II FL/PA双模态成像的比率测量探针对未来医学领域的发展具有重要意义。
近红外-IIFL/PA双模态成像探针的分类
随着探针技术的不断进步,用于近红外-II FL/PA 双模态成像探针的材料类型也呈现出持续增长的趋势。从有机小分子染料到有机纳米材料,再到有机-无机纳米杂化材料,近红外-II FL/PA 双模态成像探针层出不穷。本节综述了用于构建近红外-II 双模态成像的有机小分子染料、有机小分子纳米粒子和有机-无机纳米杂化材料,并介绍了各种材料的优缺点,希望能为开发新材料提供参考思路。
3.1. 有机材料
3.1.1. 有机小分子荧光染料
有机小分子染料作为一类分子量较小的荧光化合物,在化学、生物和医学领域扮演着至关重要的角色。这类染料凭借其易于标记、优异的光学性能和良好的可控性,在多个领域中展现出广泛的应用前景。然而,随着成像波长扩展到近红外-II区域,对有机小分子染料的连续共轭程度提出了严峻的挑战。
共轭体系的增加虽能带来某些性能上的提升,但往往会导致有机小分子染料在水中的溶解度降低,稳定性下降,以及生物相容性变差。多数有机小分子染料在有机溶剂中表现出较高的溶解度,而在水中溶解度较低,这一特性限制了它们在生物系统中的应用。
在常见的有机小分子染料中,苯并噻二唑(BTD)、氰基和硼-二吡咯并二胺(BODIPY)衍生物等因其独特的化学结构而备受关注。这些染料多具备供体-受体-供体(D-A-D)的推拉电子结构,通过合理的共轭体系设计,能够显著提升探针分子的生物相容性、光稳定性、发射波长和斯托克斯位移。
特别地,用于近红外-II荧光/光声(FL/PA)双模态成像的有机小分子探针,其结构往往以苯并噻唑和氰基等为基础(如示例1所示)。这些多样化的化学结构不仅提升了探针的性能,还为生物医学应用提供了高质量的近红外-II荧光/光声双模态成像,极大地推动了生物医学成像技术的发展。 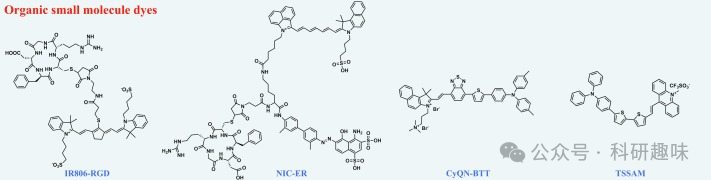 示例1.用于近红外-IIFL/PA双模态成像的有机小分子染料的化学结构;
示例1.用于近红外-IIFL/PA双模态成像的有机小分子染料的化学结构;
在2021年,Wang等人成功研制了一种名为NIC-ER的NIL-II FL/PA双模态成像青色染料,该染料具有内源性白蛋白的携带能力(https://doi.org/10.1186/s12951-021-01075-0)。NIC这一不对称氰基染料是通过将苯并[c,d]吲哚引入吲哚菁绿羧酸(ICG-COOH)的一侧苯并吲哚来合成的。随后,通过对其羧基进行修饰,并引入环状新生血管靶向肽和白蛋白结合基团,赋予了NIC-ER主动靶向和携带白蛋白的能力(如图2A所示)。
NIC-ER在1030纳米波长下展现出了明亮的近红外-II发射,并且其荧光强度随着人血清白蛋白(HSA)溶液浓度的增加而逐渐增强(如图2B所示)。这种高荧光强度和光稳定性为近红外-II FL/PA双模态成像提供了坚实的基础(如图2C和2D所示)。此外,NIC-ER探针分子能够在肿瘤部位聚集,从而实现对肿瘤轮廓的清晰观察。双模态成像的相互印证进一步证明了NIC-ER在肿瘤成像中的巨大应用价值。
Peng研究组则以苯并芘为受体,合成了三种用于近红外-II双模态成像的单分子光敏剂(如图2E所示)(https://doi.org/10.1039/d2sc02879d)。其中,CyQN-BTT由于分子中引入了BTD的π桥结构,在NIR-II区域表现出强烈的尾发射(如图2F所示)和优异的光热稳定性(如图2G所示)。与CyE-TT和CyQN-TT相比,CyQN-BTT的结构更为扭曲,这种扭曲的分子内电荷转移机制使得探针分子更容易受到非辐射跃迁的影响,从而导致了较低的荧光量子产率(QY)和荧光强度。然而,当水溶液比例增加时,分子聚集限制了分子旋转,导致荧光强度显著增强,并呈现出聚集诱导发光(AIE)的特性(如图2H所示)。
此外,CyE-TT和CyQN-TT结构中的正电荷赋予了它们良好的线粒体靶向能力。而CyQN-TT中的双电荷结构更是能够特异性地靶向癌细胞。这些特性使得NIR-II FL/PA双模态成像技术能够实现对小鼠肿瘤的精确成像。 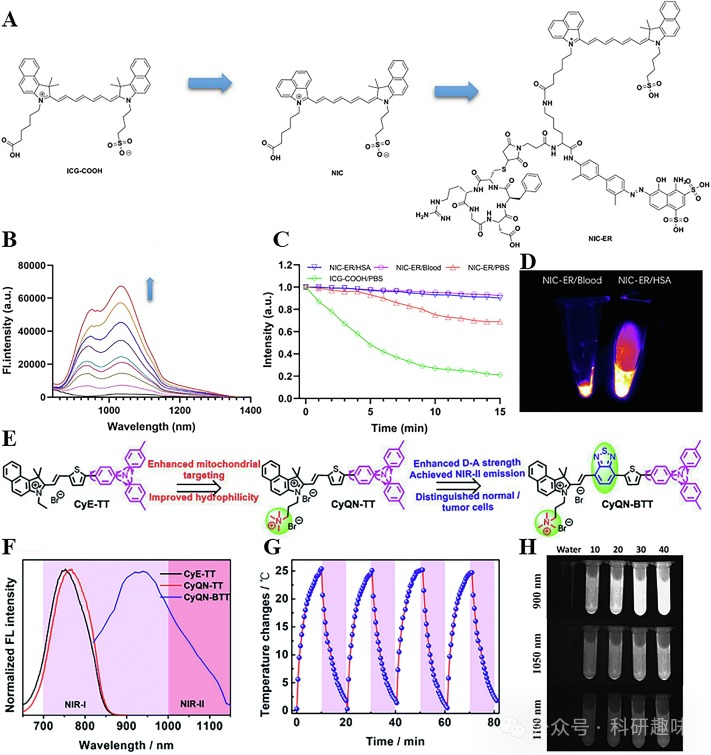 图2.(A)NIC-ER的设计策略;(B)NIC-ER在不同浓度HSA中的荧光发射光谱;(C)NIC-ER和ICG-COOH的光稳定吸收光谱;(D)NIC-ER在血液和HSA中的近红外-II荧光成像;(E)CyE-TT、CyQN-TT和CyQN-BTT的设计策略;(F)CyE-TT、CyQN-TT和CyQN-BTT的归一化荧光光谱;(G)CyQN-BTT的光热稳定性曲线;(H)CyQN-BTT在不同体积水溶液中的近红外-II荧光成像;
图2.(A)NIC-ER的设计策略;(B)NIC-ER在不同浓度HSA中的荧光发射光谱;(C)NIC-ER和ICG-COOH的光稳定吸收光谱;(D)NIC-ER在血液和HSA中的近红外-II荧光成像;(E)CyE-TT、CyQN-TT和CyQN-BTT的设计策略;(F)CyE-TT、CyQN-TT和CyQN-BTT的归一化荧光光谱;(G)CyQN-BTT的光热稳定性曲线;(H)CyQN-BTT在不同体积水溶液中的近红外-II荧光成像;
3.1.2. 有机小分子纳米粒子
鉴于有机小分子在体内靶向性、溶解性和稳定性不佳,且血液循环时间较短,难以穿越血管壁抵达病变部位,纳米粒子(NPs)已成为近年来备受关注的研究领域。为了解决这些难题,研究者通过巧妙设计,利用DSPE-PEG和Pluronic F127等有机聚合物对有机小分子化合物进行表面包覆,成功制备出水溶性有机小分子纳米粒子(OSMNPs)(示例 2)。
OSMNPs的尺寸范围通常介于1-100纳米之间,这一特性赋予了它们更高的比表面积和优异的生物相容性,使其能够更轻松地在生物体内分散和吸附,并通过循环系统迅速渗透到各个组织和器官中。OSMNPs的合成方法丰富多样,它们充分利用了有机小分子卓越的光电特性,在近红外-II荧光/光声(FL/PA)双模态成像中扮演了至关重要的角色。
然而,纳米粒子在生物体内长期积累可能会引发一定的毒性反应,因此,开发具有低毒性且可生物降解的OSMNPs成为了未来研究的重点方向。这将有助于进一步推动OSMNPs在生物医学领域的应用,为实现更高效、安全的诊断和治疗手段提供有力支持。  示例2.用于近红外-IIFL/PA双模态成像的有机小分子纳米粒子的化学结构.
示例2.用于近红外-IIFL/PA双模态成像的有机小分子纳米粒子的化学结构.
在2020年,Sun等人报道了一种基于聚集诱导发光(AIE)机制的新型近红外二区(NIR-II)荧光/光声(FL/PA)双模态成像探针ZSY-TPE(https://doi.org/10.1016/j.biomaterials.2020.120315)。ZSY-TPE的设计以具有强电子受体苯并二噻二唑(BBTD)为核心,两侧配备TPE和咔唑基团作为供体单元,共同构建了D-A-D结构的ZSY-TPE(如图3A所示)。TPE赋予了探针分子优异的光稳定性(图3B),较长的发射波长以及高达290 nm的斯托克斯位移,从而显著减少了生物损伤和背景干扰(图3C)。由于ZSY-TPE具有连续的大共轭体系,其水溶性相对较差。当水溶液比例增加至90%时,探针分子发生强烈聚集,荧光强度达到峰值(图3D)。为了克服水溶性不佳的局限,研究者采用DSPE-PEG5000表面活性剂对ZSY-TPE进行封装,形成了ZSY-TPE纳米点。此外,ZSY-TPE纳米点还展现出抗肿瘤和抗金黄色葡萄球菌的潜力。相较于单模态成像,NIR-II FL/PA双模态成像为伤口细菌感染和抗肿瘤治疗提供了更为精准的指导。
随后,在2021年,Tang研究小组提出了三种苯并噻二唑-喹喔啉衍生物(https://doi.org/10.1002/anie.202111767)。与BBTD型探针分子相比,这些衍生物具有更为紧凑的结构,增强了分子的稳定性,并抑制了分子的迁移,从而有利于AIE机制的实现(图3E)。其中,TPA-DPTQ在水溶液中展现出卓越的AIE效果,但其发射波长仅限于910 nm,限制了其在近红外二区成像中的应用。DPTA-DPTQ则因分子间相互作用力的影响,其AIE效应受到抑制,呈现出聚集诱导猝灭(ACQ)效应。仅有DPBTA-DPTQ表现出近红外二区发射(1120纳米)和微弱的AIE效应(图3F)。通过使用两亲性DSPE-PEG2000-FA对DPBTA-DPTQ进行纳米化(图3G),得到的纳米粒子展现出优异的光电转换效率(PCE),有助于FL/PA双模态成像(图3H)。
最近,Lan等人报道了一种基于半氰基结构的NIR-II荧光探针M1,并通过DSPE-PEG2000-NH2制备了水溶性M1纳米粒子(图3I)(https://doi.org/10.1021/cbmi.2c00004)。该分子结构融合了强电子供体二乙氨基和强电子受体氰基,形成了具有稳定光热特性的供体-π-受体结构(图3J)。同时,两个可自由旋转的N,N-二乙基氨基苯基增加了非辐射能量消耗,使得PCE高达77.5%(图3K)。M1纳米粒子不仅具有长发射波长(图3L),还具备抗肿瘤作用。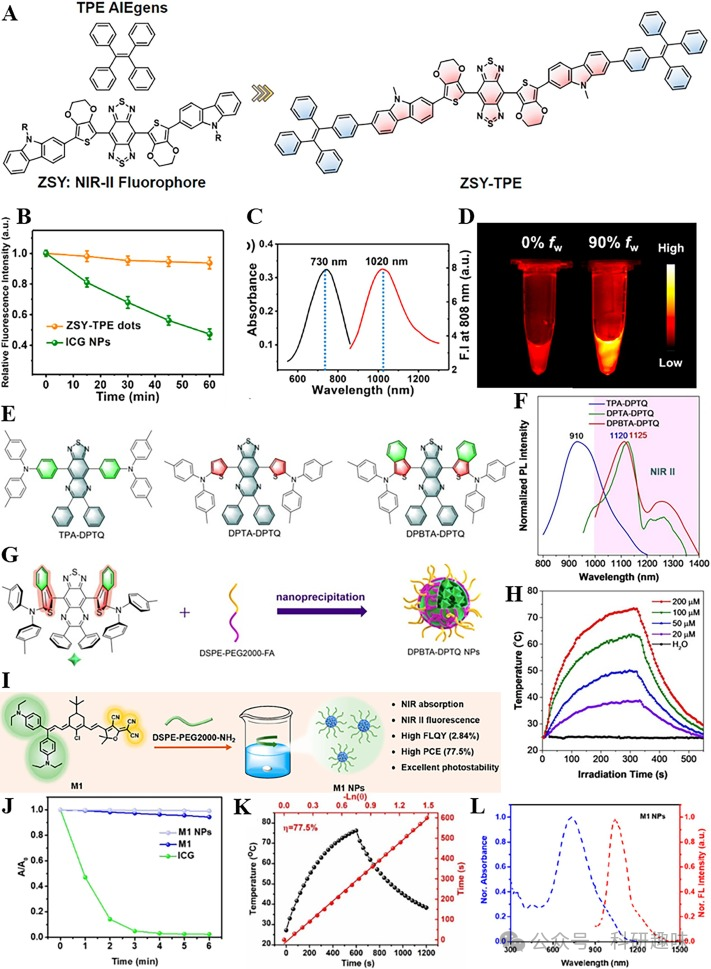 图3.(A)ZSY-TPE的结构;(B)ZSY-TPE和ICGNPs的光稳定性吸收光谱;(C)ZSY-TPE的吸收和发射光谱;(D)ZSY-TPE在不同体积水溶液中的NIR-IIFLI;(E)TPA-DPTQ、DPTA-DPTQ和DPBTA-DPTQ的结构;(F)TPA-DPTQ、DPTA-DPTQ和DPBTA-DPTQ的归一化荧光光谱;(G)DPBTA-DPTQNPs的制备;(H)DPBTA-DPTQNPs的光热转换行为;(I)M1NPs的制备;(J)M1NPs、M1和ICG的光稳定吸收光谱;(K)M1NPs的光热转换行为;(L)M1NPs的归一化吸收和发射光谱;
图3.(A)ZSY-TPE的结构;(B)ZSY-TPE和ICGNPs的光稳定性吸收光谱;(C)ZSY-TPE的吸收和发射光谱;(D)ZSY-TPE在不同体积水溶液中的NIR-IIFLI;(E)TPA-DPTQ、DPTA-DPTQ和DPBTA-DPTQ的结构;(F)TPA-DPTQ、DPTA-DPTQ和DPBTA-DPTQ的归一化荧光光谱;(G)DPBTA-DPTQNPs的制备;(H)DPBTA-DPTQNPs的光热转换行为;(I)M1NPs的制备;(J)M1NPs、M1和ICG的光稳定吸收光谱;(K)M1NPs的光热转换行为;(L)M1NPs的归一化吸收和发射光谱;
3.1.3. 聚合物纳米粒子
共轭聚合物(CP)作为一种前沿的功能性发光材料,其独特的π共轭体系由连续交替的单键和双键构成。这种结构中离域π键的形成显著扩大了π电子的活动范围,降低了体系能量,减小了能级间距,从而改变了材料的吸光特性和导电能力。与有机小分子相比,CP展现出更高的荧光亮度和光稳定性,因此在荧光染料和光电器件领域得到了广泛应用。
然而,CP的聚合选择性不佳,且容易形成结构缺陷,这些缺陷对材料的光电性能造成负面影响。此外,聚合物的扭曲形态还会降低分子内电荷转移的效率。因此,开发具有卓越光电转换效率和高稳定性的CP材料对于生物成像领域而言至关重要。
为了提升生物成像中的生物相容性,研究人员成功将CP转化为水分散的球形共轭聚合物纳米粒子(CPNs)。这些CPNs的化学结构以及包覆的两亲嵌段共聚物类型已在示例3中详细阐述。
值得一提的是,半导体聚合物纳米粒子(SPNs)作为CPNs的一个重要分支,因其高导电性在健康监测和医疗设备等领域展现出巨大的应用潜力。然而,合成具有可拉伸性能和高迁移率的SPNs仍面临诸多挑战。未来的研究将致力于克服这些挑战,以推动SPNs在更多领域的应用。  示例3.用于近红外-IIFL/PA双模态成像的聚合物纳米粒子的化学结构.
示例3.用于近红外-IIFL/PA双模态成像的聚合物纳米粒子的化学结构.
共轭聚合物纳米粒子以其卓越的近红外吸收和出色的光稳定性,在光声成像(PAI)领域展现出非凡的潜力。鉴于当前共轭聚合物纳米粒子(CPN)多用于单模态成像的现状,开发适用于近红外-II荧光/光声(FL/PA)双模态成像的CPN具有巨大的研究前景。
Cong团队成功设计了一种基于吡嗪和噻吩结构的共轭聚合物SP(如图4A所示),并通过与两亲性聚合物DSPE-PEG2000的共沉淀法,制备出SPN(如图4B所示)(https://doi.org/10.1002/cbic.201900309)。这种SPN展现出优异的NIR-II发射性能(如图4C所示)和出色的光稳定性,其在猪肉组织中的穿透深度可达4毫米。随后,他们进一步开发了基于环戊二烯噻吩结构的共轭聚合物P-TT和P-DPP(如图4D所示)(https://doi.org/10.1039/C9TB01196J)。利用DSPE-PEG2000,他们成功制备了相应的纳米粒子(如图4E所示)。与SPN相比,P-TT和P-DPP形成的CPN在荧光发射波长上表现出显著的红移(如图4F所示)。特别地,P-DPP具有更高的荧光量子产率(1.5%)和更强的组织穿透性(8毫米),为近红外-II FL/PA成像提供了极具前景的造影剂。
在2022年,Xie等人通过改性PEG SPNs和酚类SPNs的自组装方法,合成了一种名为PFG-MPNs的NIR-II FL/PA双模态成像纳米粒子(如图4G所示)(https://doi.org/10.1021/jacs.1c09753)。PFG-MPNs展现出1063 nm的近红外-II发射波长(如图4H所示),并在溶液中显示出良好的稳定性(如图4I所示)。随着PFG-MPNs溶液浓度的增加,FL和PA信号均逐渐增强,证实了其卓越的近红外-II FL/PA双模态成像能力(如图4J所示)。尤为重要的是,该纳米粒子中封装了外泌体抑制剂和铁死亡诱导剂,为加速肿瘤细胞的铁死亡并抑制恶性肿瘤的生长和转移提供了新策略。 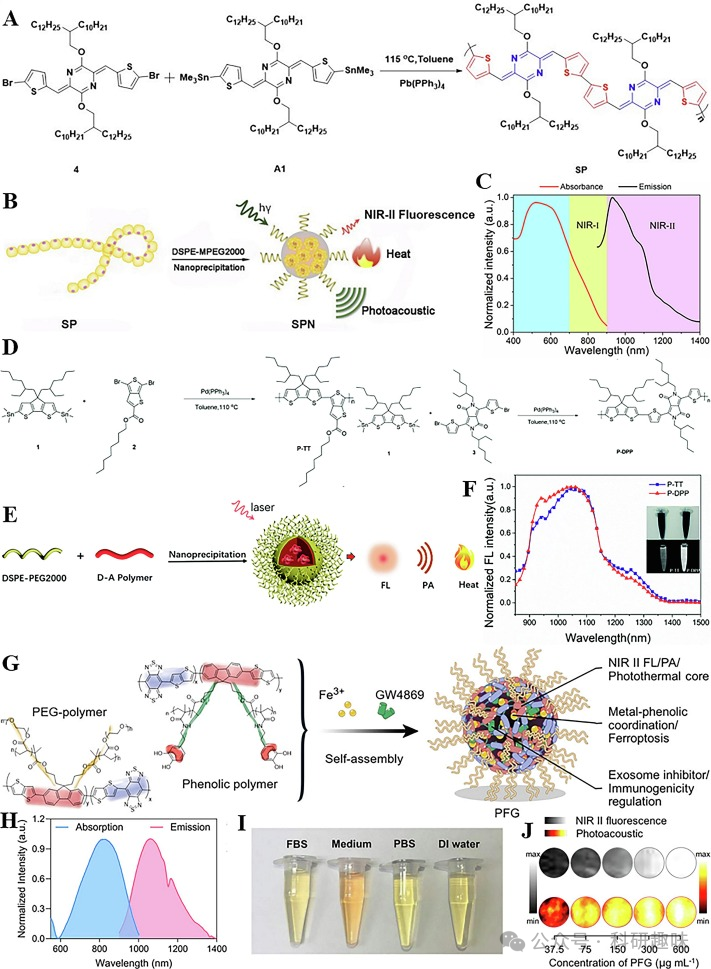 图4:(A)SP的合成;(B)SPN的制备;(C)SPN的归一化吸收光谱和发射光谱;(D)P-TT和P-DPP的合成;(E)P-TTCPNs和P-DPPCPNs的制备;(F)P-TTCPNs和P-DPPCPNs的归一化发射光谱;;(G)PFG-MPNs的制备;(H)PFG-MPNs的归一化发射光谱;(I)PFG-MPNs在不同溶液中放置7天的稳定性照片;(J)不同浓度PFG-MPNs的FLI和PAI;
图4:(A)SP的合成;(B)SPN的制备;(C)SPN的归一化吸收光谱和发射光谱;(D)P-TT和P-DPP的合成;(E)P-TTCPNs和P-DPPCPNs的制备;(F)P-TTCPNs和P-DPPCPNs的归一化发射光谱;;(G)PFG-MPNs的制备;(H)PFG-MPNs的归一化发射光谱;(I)PFG-MPNs在不同溶液中放置7天的稳定性照片;(J)不同浓度PFG-MPNs的FLI和PAI;
3.2. 有机-无机纳米复合材料
3.2.1. 金属硫化物复合纳米粒子
金属硫化物纳米粒子(MSNPs)作为一类由金属元素和硫元素构成的纳米级材料,展现出独特的结构和性质。这些纳米粒子的尺寸通常在1至100纳米之间,其高量子尺寸效应和较大的比表面积赋予它们卓越的反应活性和表面活性。MSNPs的多样性晶相结构允许通过调整能带和电子结构来优化其光学和电子传输特性。此外,MSNPs还因其优异的抗菌性、热稳定性和光稳定性而广泛应用于食品包装、能量储存、环境监测、光电设备和催化领域。
然而,金属硫化物面临离子扩散速率低和导电性不佳的挑战,这要求通过孔隙掺杂等手段来提升其离子导电性能。同时,MSNPs的生物降解性有限,易在生态环境中受pH值和光照等因素影响,转化为潜在的有毒物质,通过食物链累积在生物体内,对生物健康构成威胁。因此,绿色MSNP的研发成为当前的研究热点。
在生物医学领域,MSNP的NIR-II荧光/光声(FL/PA)双模态成像技术发挥着重要作用,其中Ag₂S基纳米材料尤为突出。随着纳米技术的飞速发展,从单一的Ag₂S纳米材料逐步演进至有机-无机杂化的多组分纳米系统,显著丰富了纳米材料的功能性。例如,Chen课题组于2017年报道了一种Ag₂S纳米点,其通过精确调控HSA纳米笼中Ag₂S的生长,实现了尺寸依赖性的Ag₂S-NDs合成(图5A)(https://doi.org/10.1021/acsnano.6b07866)。这些纳米点展现出与颗粒大小相关的近红外-II荧光发射(图5B),并具备高达35%的光电转换效率(PCE),产生了强烈的FL和PA信号(图5C)。随着纳米点浓度的增加,FL和PA信号均呈现线性增强(图5D和5E)。尤为值得一提的是,Ag₂S-NDs还展现出强大的抗光漂白能力,为肿瘤部位的长效积累和体内快速清除提供了可能,为MSNPs在NIR-II FL/PA双模态成像中的应用奠定了基础。
此外,Zhao等人构建了一种基于Ag₂S和多肽的杂化纳米凝胶系统(https://doi.org/10.1039/C7CC09266K)。通过将Ag₂S量子点(QD)嵌入多肽自组装水凝胶PC10ARGD中,成功合成了Ag₂S QD@PC10ARGD纳米复合材料(图5F)。该纳米系统通过Ag₂S QD改变多肽与水之间的折射率,实现了10nm的发射波长红移(图5G)。同时,随着Ag₂S QD浓度的增加,纳米凝胶系统的荧光强度也呈现上升趋势(图5H),计算得到的PCE为28.7%,为肿瘤的NIR-II FL/PA双模态成像提供了有力支持。
金属有机框架(MOFs)作为一种快速发展的三维多孔配位聚合物,为MSNPs的应用提供了新途径。2022年,Li等人利用MOFs将Ag₂S QD和透明质酸酶(HAase)封装在合成的AHZ NPs中(https://doi.org/10.1021/acsami.2c08930)。在肿瘤细胞的酸性环境中,AHZ NPs能够释放HAase和Ag₂S QD(图5J)。HAase能够降解透明质酸(HA),破坏肿瘤细胞基质,从而抑制肿瘤细胞的扩散和转移。同时,Ag₂S QD能够轻松穿越肿瘤基质,深入肿瘤组织,提供显著的NIR-II FL/PA成像。此外,随着AHZ NPs浓度的增加,荧光强度逐渐增强,表现出浓度依赖性(图5K),为肿瘤的精确治疗提供了重要的指导。
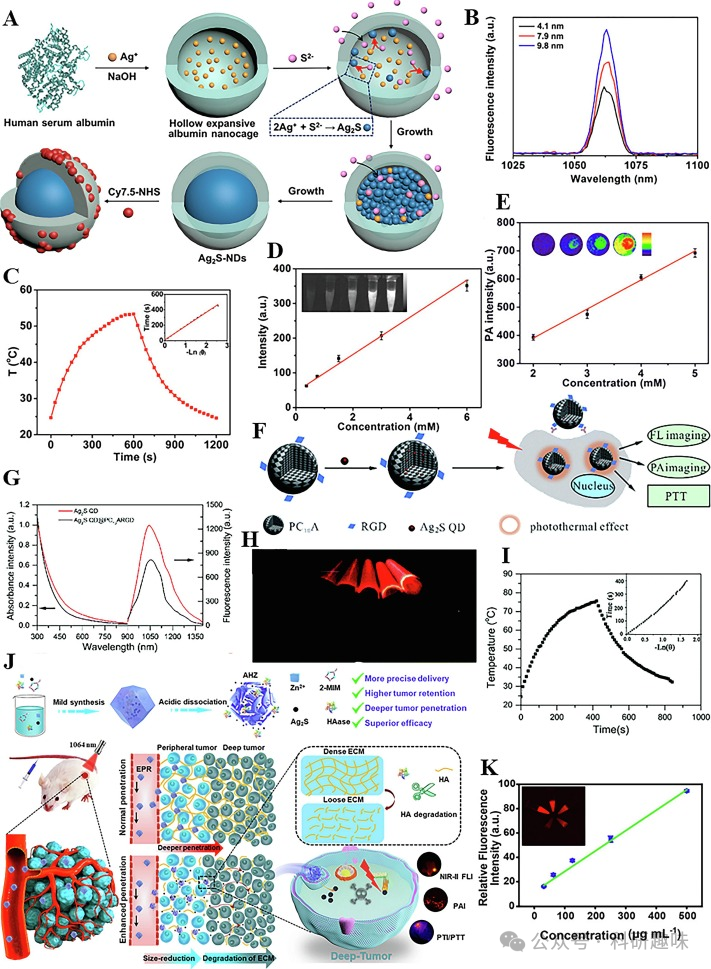 图5.(A)Ag2S-NDs的制备;(B)不同粒径Ag2S-ND的荧光发射光谱;(C)9.8nmAg2S-NDs的光热转换行为;(D)不同浓度的Ag2S-NDs与荧光强度的线性图;(E)不同浓度的Ag2S-NDs与PA强度的线性图;(F)Ag2SQD@PC10ARGD的制备;(G)Ag2SQD和Ag2SQD@PC10ARGD的吸收和发射光谱;(H)不同浓度Ag2SQD@PC10ARGD的近红外-IIFLI;(I)Ag2SQD@PC10ARGD的光热转换行为;(J)AHZNPs的制备及肿瘤穿透图;(K)不同浓度的AHZNPs与FL强度的线性图.
图5.(A)Ag2S-NDs的制备;(B)不同粒径Ag2S-ND的荧光发射光谱;(C)9.8nmAg2S-NDs的光热转换行为;(D)不同浓度的Ag2S-NDs与荧光强度的线性图;(E)不同浓度的Ag2S-NDs与PA强度的线性图;(F)Ag2SQD@PC10ARGD的制备;(G)Ag2SQD和Ag2SQD@PC10ARGD的吸收和发射光谱;(H)不同浓度Ag2SQD@PC10ARGD的近红外-IIFLI;(I)Ag2SQD@PC10ARGD的光热转换行为;(J)AHZNPs的制备及肿瘤穿透图;(K)不同浓度的AHZNPs与FL强度的线性图.
3.2.2. 金纳米复合粒子
金(Au)作为一种化学稳定性卓越的元素,其纳米形态展现出了独特的光电性质和优异的生物相容性。因此,金纳米材料(Au NMs)的研发在纳米科技领域一直备受瞩目,其结构发展从零维扩展至三维,完成了从点到体的跨越。不同尺寸和形态结构的金纳米材料展现出了多样化的物理化学特性,并在多个领域拥有广泛的应用前景。
在近红外-II FL/PA双模态成像领域,金纳米材料主要可分为两类:金纳米团簇(Au NCs)和金纳米粒子(Au NPs)。Au NCs作为一种特殊的纳米材料,由数十至数百个金原子组成,具有小尺寸、大比表面积、优异的光稳定性、高发光效率和良好的生物相容性,适用于生物检测和成像。其独特的能级带间离散电子跃迁能够在可见光区域产生特征吸收峰,减少生物成像中的背景干扰。
与Au NCs不同,Au NPs由更多金原子组成,具有更大的纳米尺寸,但其发光效率相对较低。然而,Au NPs独特的表面等离子体共振(SPR)吸收峰显著增强了拉曼散射信号,适用于通过NIR-II FL/PA双模态成像进行实时监测和痕量检测。为了提升Au NPs的稳定性,通常会在其表面吸附不同类型的保护剂,这些保护剂的电荷性质决定了整个Au NPs凝胶团的电荷状态。
金纳米棒(Au NRs)作为一种具有独特光学和电子特性的胶囊状金NPs,其SPR波长可通过调节长宽比实现从可见光区到近红外-II区的连续可调。这种连续可调的光电转换效率(PCE)有助于双模态成像在癌症诊断和治疗中的应用。
尽管金纳米材料在生命科学领域取得了显著成果,但仍需通过表面改性来克服免疫抑制和蛋白质电晕等问题,以实现在人体内的更好应用。
3.2.2.1. 金纳米簇复合材料
Gui的研究团队最近报道了一种基于金纳米氧化物的双模态成像诊断剂,该诊断剂在近红外-II区域实现了荧光(FL)和光声(PA)双模态成像(https://doi.org/10.1039/d2tb02096c)。通过对牛血清白蛋白(BSA)进行精确改性,该纳米材料展现出了卓越的生物相容性和稳定性。其中,AuPd-BSA复合纳米簇(CNs)不仅与葡萄糖氧化酶(GOX)具有相似的催化活性,能有效促进活性氧(ROS)的产生(如图6A所示),而且通过掺杂钯(Pd)与金形成Au-Pd合金,显著增强了其FL(图6B)和PA(图6C)信号强度,为近红外II区FL/PA双模态成像提供了强有力的工具。
与此同时,Yuan研究团队也开发了一种新型的Au44纳米簇,即Au44MBA26-Cy7 NCs,用于近红外II区FL/PA双模态成像(https://doi.org/10.1039/d2sc05729h)。他们通过点击化学反应将荧光染料Cy7成功地连接到纳米团簇表面,不仅显著增强了纳米材料的近红外II区荧光信号,还提高了其光电转换效率(PCE),使得该探针能够无损地进行体内双模态成像(如图6D所示)。值得注意的是,Au44MBA26-Cy7 NCs在近红外-II区域拥有两个发射峰,最大发射峰位于约1300纳米处,这一特性显著提高了近红外-II荧光成像的组织穿透深度和成像清晰度(如图6E所示)。此外,Au44MBA26 NCs和Au44MBA26-Cy7 NCs的浓度与其荧光强度呈现出良好的线性关系(如图6F所示)。更重要的是,Au44MBA26-Cy7 NCs展现了出色的生物安全性,成为首个利用NIR-II FL/PA双模态成像技术来指导癌症无创精准治疗的金纳米簇。 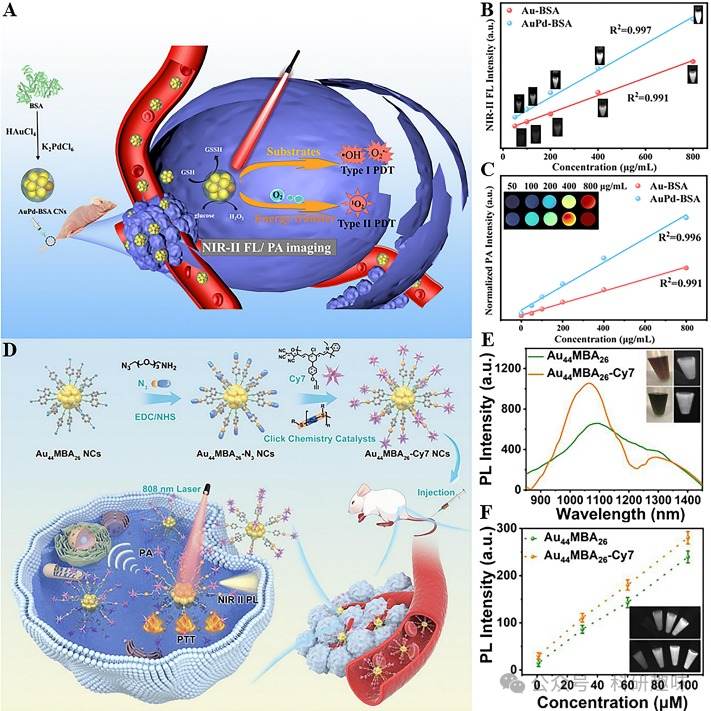 图6.(A)AuPd-BSACNs的制备及用于指导癌症治疗的NIR-IIFL/PA双模态成像示意图;(B)不同浓度的Au-BSACNs和AuPd-BSACNs的荧光强度图;(C)不同浓度Au-BSACNs和AuPd-BSACNs的PA强度图;(D)Au44MBA26-Cy7NCs的制备和用于指导癌症治疗的NIR-IIFL/PA双模式成像示意图;(E)Au44MBA26NCs和Au44MBA26-Cy7NCs的近红外-II荧光发射光谱;(F)不同浓度的Au44MBA26NCs和Au44MBA26-Cy7NCs的荧光强度图;
图6.(A)AuPd-BSACNs的制备及用于指导癌症治疗的NIR-IIFL/PA双模态成像示意图;(B)不同浓度的Au-BSACNs和AuPd-BSACNs的荧光强度图;(C)不同浓度Au-BSACNs和AuPd-BSACNs的PA强度图;(D)Au44MBA26-Cy7NCs的制备和用于指导癌症治疗的NIR-IIFL/PA双模式成像示意图;(E)Au44MBA26NCs和Au44MBA26-Cy7NCs的近红外-II荧光发射光谱;(F)不同浓度的Au44MBA26NCs和Au44MBA26-Cy7NCs的荧光强度图;
3.2.2.2. 金纳米粒子复合材料
纳米金氧化物(Au NEs)是一种独特的二聚体金基纳米材料,其表面布满了可调长宽比的金纳米棒(Au NRs)。这些Au NRs的几何特性显著增强了表面等离子体共振效应,进而展现出高摩尔吸收系数和紫外至近红外-IIb区的宽光谱吸收,为深穿透和高对比度近红外-II光声成像(PAI)提供了可能。金NEs通常表现出优异的上转换能力,使其在近红外-II成像领域展现出高灵敏度和光稳定性。
2016年,Hwang研究团队成功开发出一种金NEs,能够同时应用于近红外-II荧光(FL)和近红外-II光声(PA)成像(https://doi.org/10.1002/admt.201600107)。为了提升Au NEs-PEG-folate的生物相容性和肿瘤靶向性,通过聚丙烯酸和NH2-PEG-folate对Au NEs表面进行了精细修饰(图7A)。与其他有机小分子染料和纳米粒子(NPs)相比,Au NEs-PEG-folate展现出了更高的摩尔吸收系数,其紫外吸收波长可延伸至1700纳米(图7B)。该探针在674纳米波长处具有显著的上转换荧光发射,且所需激光功率远低于其他Au NPs,有效减少了皮肤损伤的风险(图7C)。此外,Au NEs在低强度激光照射下成功实现了近红外-II FL和近红外-II PA的双模态成像。
2020年,Song研究团队报道了一种Au NRs囊泡光敏剂AuNR@PEG/PolyRu Ves,用于NIR-II FL和NIR-II PA双模态成像(https://doi.org/10.7150/thno.44376)。该囊泡通过自组装技术将钌聚合物(PolyRu)、PEG和NIR-II荧光染料IR 1061涂覆在Au NRs表面而制得(图7D)。在近红外激光照射下,PolyRu被激活,导致囊泡裂解并释放出IR 1061和Ru复合物,进而产生可检测的近红外-II FL和近红外-II PA信号变化。随着激光照射时间的延长,近红外-II PA信号逐渐减弱(图7E),而近红外-II FL信号则逐渐增强(图7F)。在MCF-7细胞中,AuNR@PEG/PolyRu Ves展现出了相似的FL和PA信号变化(图7G)。此外,该Au NRs囊泡还显示出良好的抗肿瘤作用,为近红外-II FL/NIR-II PA双模态成像指导下的肿瘤诊断和治疗提供了新途径。
Zhang等人则制备了哑铃状的金纳米哑铃(AuNDs),用于NIR-II双模态引导的肿瘤免疫治疗(图7H)(https://doi.org/10.1016/j.nantod.2020.100987)。通过多核苷酸修饰金纳米棒的表面,并调控两者比例,成功将金纳米棒转化为AuNDs。这些合成的AuNDs相较于普通Au NRs展现出了更高的热稳定性和光电转换效率(PCE,高达84.9%),为近红外-II PA成像提供了理想平台(图7I)。随着AuNDs浓度的增加,体外近红外-II PA信号强度逐渐增强,并显示出浓度依赖性(图7J)。为了增强肿瘤靶向性和细胞摄取率,研究人员进一步采用靶向核仁蛋白的核酸适配体AS1411和mPEG2000-SH对AuNDs表面进行修饰,制备了Ap-AuNDs(图7K)。这种Ap-AuNDs具有免疫原性,可通过近红外-II双模态成像介导肿瘤免疫治疗。 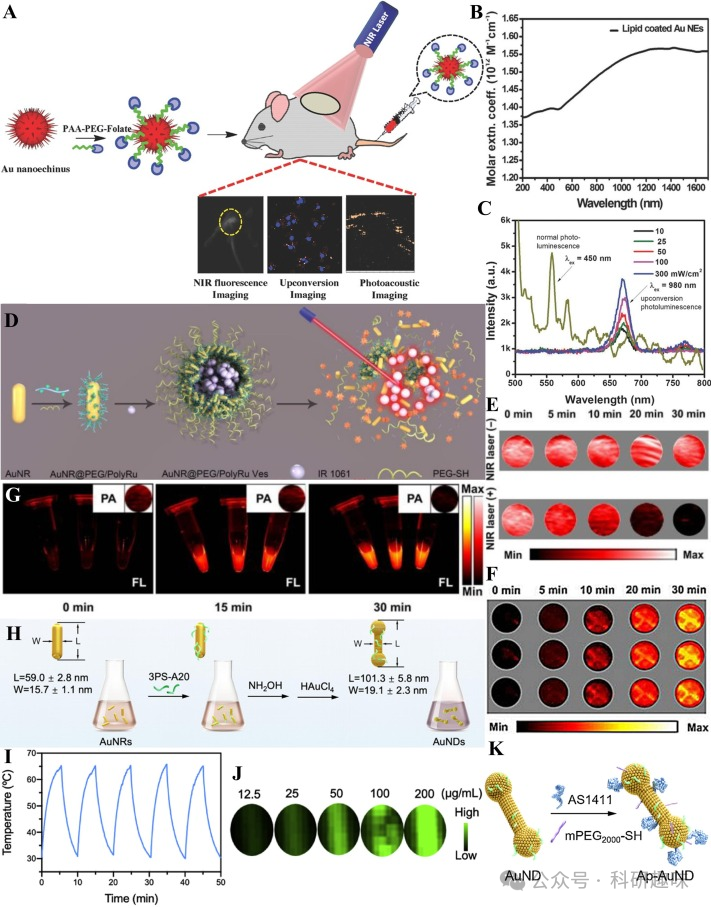 图7.(A)AuNEs-PEG-folate的制备;(B)AuNEs-PEG-folate的摩尔吸光度光谱;(C)AuNEs-PEG-folate的上转换荧光光谱;(D)AuNR@PEG/PolyRuVes的制备;(E)AuNR@PEG/PolyRuVes经激光照射和未经激光照射时的PA图像;(F)不同激光照射时间下AuNR@PEG/PolyRuVes的近红外-IIFLI;(G)不同激光照射时间、PBS溶液中MCF-7细胞的近红外-IIFLI和近红外-IIPAI;(H)AuNDs的制备;(I)AuNDs的光热稳定性曲线;(J)不同浓度AuNDs的体外PAI;(K)表面修饰AuNDs以制备Ap-AuNDs;
图7.(A)AuNEs-PEG-folate的制备;(B)AuNEs-PEG-folate的摩尔吸光度光谱;(C)AuNEs-PEG-folate的上转换荧光光谱;(D)AuNR@PEG/PolyRuVes的制备;(E)AuNR@PEG/PolyRuVes经激光照射和未经激光照射时的PA图像;(F)不同激光照射时间下AuNR@PEG/PolyRuVes的近红外-IIFLI;(G)不同激光照射时间、PBS溶液中MCF-7细胞的近红外-IIFLI和近红外-IIPAI;(H)AuNDs的制备;(I)AuNDs的光热稳定性曲线;(J)不同浓度AuNDs的体外PAI;(K)表面修饰AuNDs以制备Ap-AuNDs;
3.2.3. 稀土金属参杂的纳米粒子
稀土金属,由钇、钪以及镧系元素共17种化学元素组成,其中钇和钪因常与镧系元素共生于同一矿床并展现相似的化学性质,亦被纳入稀土金属范畴。稀土金属因其独特的4f电子层结构,在外部光照射下,f-f或f-d组态间会发生复杂的能级跃迁与辐射转变,进而产生紫外至红外波段的光辐射。掺杂稀土的纳米粒子(RENPs)作为一类功能型纳米材料,其光物理性质深受掺杂稀土元素类型、浓度以及基体材料影响。RENPs的发光性能,特别是上转换和下转换发光,源于其独特的能级结构和跃迁特性。此外,RENPs还具备光稳定性强、发光性能可调、生物毒性低、自背景荧光弱等特性,为NIR-II FL/PA双模态成像技术提供了有力支持,并在生物成像、传感以及3D显示等领域展现出广阔的应用前景。然而,RENPs在尺寸控制、表面缺陷以及合成策略等方面仍面临挑战。
2019年,Cheng研究团队提出了一种基于掺稀土偶氮苯聚合物的近红外-II FL/PA双模态成像材料(https://doi.org/10.1002/adom.201900045)。通过在纳米粒子中掺杂NaYF4和NaYbF4,实现了NIR-II荧光发射及高上转换效率。如图8A所示,该材料UCNPs@PAA-Azo是通过在上转换纳米粒子(UCNPs)表面改性光开关聚合物制得。与UCNPs相比,UCNPs@PAA-Azo在紫外线和蓝光区域的吸收强度较低,但光声(PA)强度显著增强(图8B和8C),这归因于其能将短波长的可见光转化为超声波,从而增强上转换PA信号的强度。此外,UCNPs与UCNPs@PAA-Azo的荧光强度相近,表明改性光开关聚合物对近红外-II荧光吸收无显著影响(图8D)。这种双模态成像技术不仅可实现实时肿瘤监测,还能通过PAI的高时间分辨率提高成像效率,两者优势互补,增强了UCNPs@PAA-Azo在疾病成像中的效果。
2020年,Cheng研究小组进一步开发了一种具有聚多巴胺(PDA)涂层的下转换纳米粒子(DCNPs),作为近红外-II FL/PA双模态造影剂(https://doi.org/10.1016/j.bios.2019.112000)。DCNP@PDA NPs通过核壳结构设计,在掺入不同稀土元素后,实现了从壳到核的能量转移,并产生具有大斯托克斯位移的NIR-II FL发射(图8E)。这种稀土掺杂的DCNPs不仅具有低生物毒性、强抗光漂白能力以及良好的生物交联灵活性,而且PDA涂层进一步提高了探针分子的生物相容性。DCNP@PDA NPs的FL和PA信号强度均与浓度相关,为各种生物实验提供了有效的探针选择(图8F和8G)。该纳米探针以其高空间和时间分辨率,为胃肠道等生物组织的实时成像提供了强有力的支持。
最近,Wu等人利用镧系元素、Fe3+和没食子酸(GA)合成了一种有机-无机杂化纳米复合材料Ln@Fe NPs(图8H)(https://doi.org/10.1016/j.cej.2023.143827)。该探针分子中掺杂的镧系元素提供了近红外I波段的多波段上转换发射和近红外IIb波段的反斯托克斯发射(图8I)。此外,探针中的GA能够还原Fe3+为Fe2+,通过芬顿反应产生强氧化性的羟自由基(-OH),对癌细胞造成氧化损伤并诱导铁死亡。Ln@Fe NPs在肿瘤诊断和治疗中展现出了巨大的潜力,通过其引发的氧化应激与近红外-II FL/PA双模态成像技术,为疾病的诊疗提供了一个全新的平台。 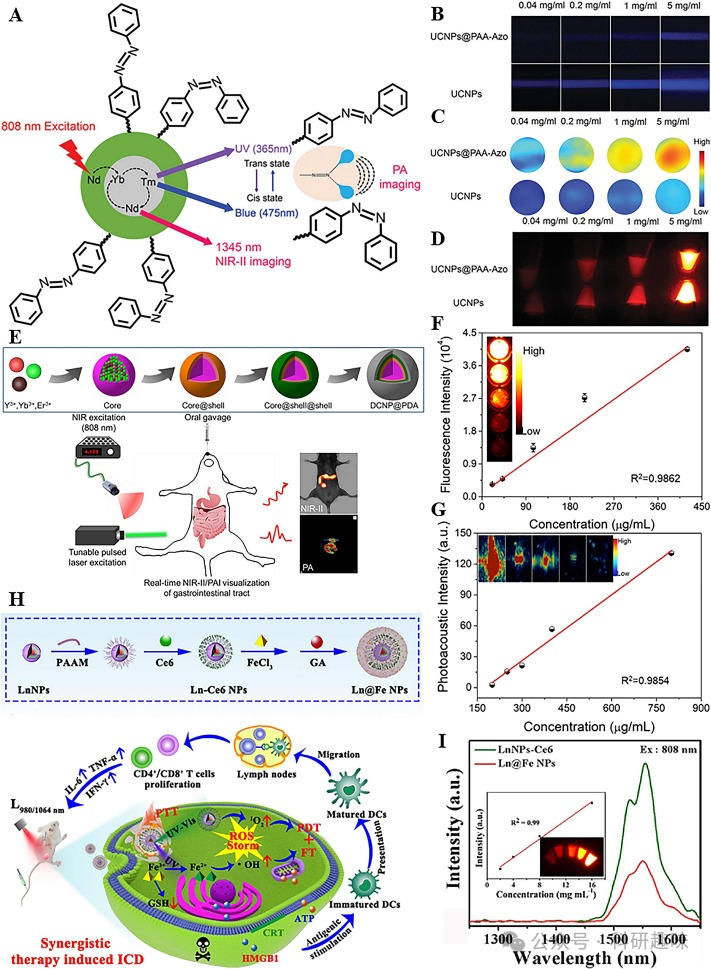 图8.(A)UCNPs@PAA-Azo的NIR-IIFL/PA双模态成像示意图;(B)不同浓度UCNPs@PAA-Azo和UCNPs的可见光图像;(C)不同浓度UCNPs@PAA-Azo和UCNPs的PA图像;(D)不同浓度UCNPs@PAA-Azo和UCNPs的FL图像;(E)DCNP@PDANPs的制备和NIR-IIFL/PA双模态成像示意图;(F)不同浓度的DCNP@PDANPs与荧光强度的线性图;(G)不同浓度的DCNP@PDANPs与PA强度的线性图;(H)Ln@FeNPs的制备及肿瘤治疗机制;(I)LnNPs-Ce6和Ln@FeNPs的荧光发射光谱.
图8.(A)UCNPs@PAA-Azo的NIR-IIFL/PA双模态成像示意图;(B)不同浓度UCNPs@PAA-Azo和UCNPs的可见光图像;(C)不同浓度UCNPs@PAA-Azo和UCNPs的PA图像;(D)不同浓度UCNPs@PAA-Azo和UCNPs的FL图像;(E)DCNP@PDANPs的制备和NIR-IIFL/PA双模态成像示意图;(F)不同浓度的DCNP@PDANPs与荧光强度的线性图;(G)不同浓度的DCNP@PDANPs与PA强度的线性图;(H)Ln@FeNPs的制备及肿瘤治疗机制;(I)LnNPs-Ce6和Ln@FeNPs的荧光发射光谱.
3.2.4. 碳复合材料
碳,作为生物体的基石元素和地壳中极为丰富的元素,其纳米形态——碳纳米材料(CNMs)因无污染、轻质、高导电性等特点,在材料科学领域占据着举足轻重的地位。传统的CNMs包括碳纳米球、碳纳米管和碳纳米纤维等,它们凭借纳米尺度的优势,展现出了卓越的电学、光学、热学和机械性能,已广泛应用于透明导电薄膜、储能设备、光电设备、气体传感器和生物成像等多个领域。
然而,CNMs的稳定性和溶解性等问题限制了其性能。为解决这些问题,科研人员通过有机分子、无机纳米粒子、聚合物和生物大分子的掺杂,成功制备了具有特殊几何形状和理化性质的新型杂化CNMs,显著拓宽了其应用领域。碳原子的不同杂化模式(sp³、sp²和sp)亦对CNMs的电子结构和光学特性产生深远影响,为生物成像提供了不同的对比度和分辨率。特别地,杂化CNMs的高生物相容性、生物柔韧性、光电转换性能、低生物组织损伤和低信号背景干扰等特点,使其成为近红外-II FL/PA双模态成像的理想选择。尽管如此,针对深部组织的成像分辨率和信号强度的优化仍是未来研究的重点。
纳米酶,作为一类具有酶活性的人工合成仿生物纳米材料,不仅继承了纳米材料的光电磁和物理化学特性,还具备独特的类酶催化活性。在生物传感领域,纳米酶通过高效的信号传导和调制,显著提高了生物物质的检测效率,展现出巨大的应用潜力。Zheng等人通过精心设计的合成步骤,成功制备了多合一纳米酶HSC-2,该材料在肿瘤纳米催化治疗方面展现出显著优势(https://doi.org/10.1002/smll.202103252)。HSC-2的合成过程涉及沸石型纳米分子筛的水热合成、离子液体吸附、高温碳化以及氮掺杂碳中间体的形成。氮掺杂碳不仅改善了碳材料的电化学性能,还通过精确控制Si/C比(图9A),赋予了HSC-2优异的近红外-II FL和近红外-II PA成像功能(图9B和9C)。Guo等人则通过引入碳缺陷,成功构建了新型碳化硼纳米片,实现了近红外-II FL/NIR-II PA双模态成像的显著优化(https://doi.org/10.1021/acsbiomaterials.1c00578)。碳缺陷的引入有效调节了材料的光学和声学特性,增强了光吸收和声发射,从而大幅提升了杂化碳纳米片的成像性能(图9D)。此外,B4C@C和B4C的吸收波长从紫外-可见光区扩展至近红外-II区(图9E),进一步促进了近红外-II区的FL/PA双模式成像(图9F)。
最近,Shi小组提出了飞秒激光泵浦光声空化技术,并结合碳化铌(Nb2C)和聚乙烯吡咯烷酮(PVP)制备了Nb2C-PVP纳米片,实现了近红外-II FL/NIR-II PA双模态成像(图9G) (https://doi.org/10.1039/D3NR03665K)。Nb2C作为一种新型二维过渡金属碳化物,具有高机械韧性和大比表面积,同时其表面的亲水端基官能团为纳米材料的加工和功能化提供了丰富的反应位点。Nb2C-PVP在近红外-II波段展现出宽而强的吸收带,有利于成像应用(图9H)。此外,Nb2C-PVP良好的水分散性和亲水性,以及与生物体的优异相容性(图9I),为其在生物医学领域的应用提供了有力支持。在NIR-II飞秒激光的照射下,Nb2C产生的PA信号比纳秒激光更强,为肿瘤的连续高精度爆破治疗提供了新途径(图9J)。 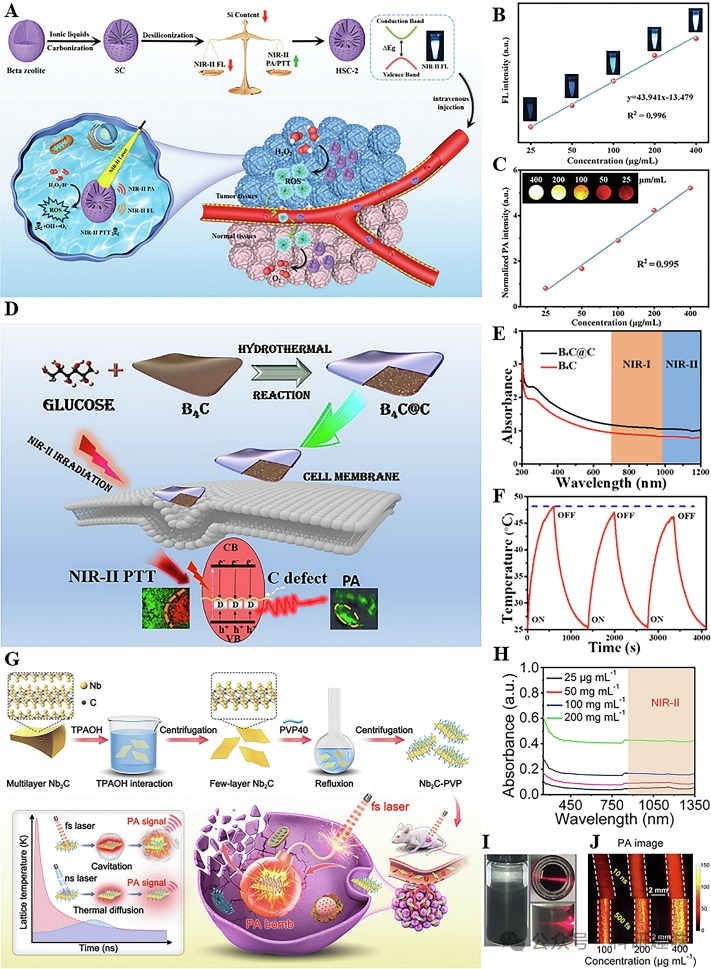 图9.(A)HSC-2制备和近红外-IIFL/NIR-IIPA双模态成像示意图;(B)不同浓度的HSC-2与FL强度的线性图;(C)不同浓度的HSC-2与PA强度的线性图;(D)B4C@C的制备;(E)B4C@C和B4C的紫外吸收光谱;(F)B4C@C的光热稳定性曲线.(G)制备Nb2C-PVP和飞秒激光泵浦光声空化爆破肿瘤的示意图;(H)不同浓度Nb2C-PVP的紫外吸收光谱;(I)保存一周的Nb2C-PVP水分散性照片;(J)纳秒和飞秒激光照射下毛细管中Nb2C纳米片的PA图像;
图9.(A)HSC-2制备和近红外-IIFL/NIR-IIPA双模态成像示意图;(B)不同浓度的HSC-2与FL强度的线性图;(C)不同浓度的HSC-2与PA强度的线性图;(D)B4C@C的制备;(E)B4C@C和B4C的紫外吸收光谱;(F)B4C@C的光热稳定性曲线.(G)制备Nb2C-PVP和飞秒激光泵浦光声空化爆破肿瘤的示意图;(H)不同浓度Nb2C-PVP的紫外吸收光谱;(I)保存一周的Nb2C-PVP水分散性照片;(J)纳秒和飞秒激光照射下毛细管中Nb2C纳米片的PA图像;
3.2.5. 其他复合材料
除了前述的有机-无机纳米杂化材料外,还有多种杂化纳米材料同样适用于近红外-II荧光/光声(FL/PA)双模态成像,例如放射性金属掺杂的纳米材料、沸石咪唑框架(ZIF)基材料和纳米聚集体。这些材料以其多样化的形态结构以及易于表面功能化修饰的特性,在吸附、光电、催化、磁性和生物成像等领域备受关注。然而,它们也面临着稳定性不足、生物相容性差以及合成挑战等问题。
2020年,Hu's团队开发了一种基于稀有放射性金属锝的杂化纳米材料,用于淋巴结转移的近红外-II FL/PA双模态成像(https://doi.org/10.1021/acsami.0c14576)。他们首先通过自组装技术将NIR-II有机荧光染料IR-1061与聚乳酸-乙醇酸等有机聚合物合成荧光聚合物(FIP),随后将放射性同位素99mTc螯合到FIP表面,形成FIP-99mTc纳米复合材料(图10A)。由于IR-1061在二氯甲烷溶液和FIP中的环境差异,FIP的最大发射波长出现蓝移(图10B)。此外,FIP还具有宽范围的光声信号(图10C)和良好的浓度线性关系(图10D),使其成为淋巴结转移的NIR-II FL/PA双模态成像的多功能纳米平台。
Qu等人报道了一种基于ZIF的杂交纳米粒子ZIMH,在近红外-II FL/PA双模态成像中展现出优异性能(https://doi.org/10.1039/D0RA09545A)。他们通过将近红外荧光染料IR820均匀地封装在ZIF内部,有效避免了聚集导致的猝灭(ACQ)效应。同时,在ZIF外部涂覆具有良好水溶性和生物相容性的透明质酸(HA)(图10E),进一步提高了其生物应用潜力。体外实验表明,ZIMH的浓度与生物体内光声成像(PAI)的信号强度呈线性相关(图10F)。ZIMH的发射光谱延伸至近红外II段,能够高效吸收近红外线,从而显著促进近红外II段荧光成像(FLI)(图10G)。这一研究为实现小鼠肿瘤的定位和可视化提供了有力工具。
An等人则探究了一种基于白蛋白-锰纳米聚集体的C-BM/I复合物在肿瘤治疗和近红外-II FL/PA双模态成像中的应用(https://doi.org/10.1039/d2tb02529a)。他们通过交联反应将白蛋白与锰纳米粒子结合,形成具有敏化T1弛豫的C-BM纳米聚集体。随后,将吲哚菁绿(ICG)负载于C-BM上,形成C-BM/I复合物(图10H)。实验表明,相较于游离的ICG在激光照射下易发生光漂白、荧光强度逐渐降低的现象(图10I),负载于C-BM上的ICG在激光照射下展现出良好的光稳定性(图10J)。细胞内的吸收实验进一步揭示,虽然C-BM/I的荧光强度略低于ICG,但其光声强度却优于ICG(图10K和10L)。这一发现不仅证明了C-BM在提高ICG近红外-II荧光稳定性的同时,还增强了其光声效应,为白蛋白-锰纳米团聚体在近红外-II FL/PA双模态成像中的应用开辟了新途径。 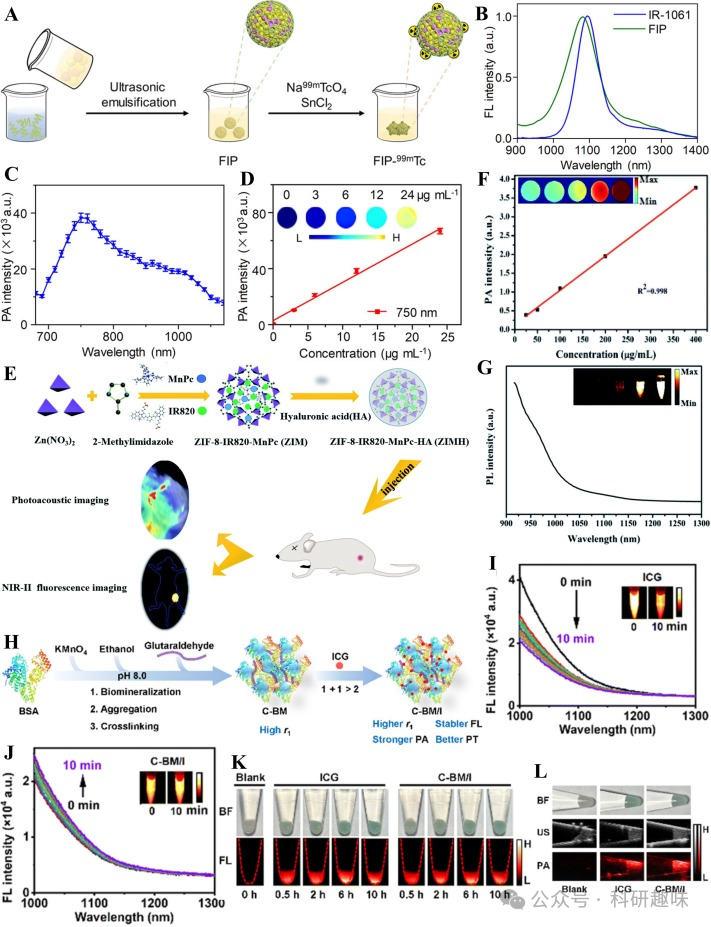 图10.(A)FIP-99mTc的制备;(B)IR-1061和FIP的荧光发射光谱;(C)FIP的PA光谱;(D)不同浓度下FIP与PA强度的线性图;(E)ZIMH和NIR-IIFL/PA双模态成像制备示意图;(F)不同浓度ZIMH与PA强度的线性图;(G)ZIMH的荧光发射光谱;(H)C-BM/I的制备;(I)激光照射10分钟后ICG的荧光发射光谱;(J)激光照射10分钟后C-BM/I的荧光发射光谱;(K)ICG和C-BM/I的NIR-IIFL图像;(L)ICG和C-BM/I的PA图像;
图10.(A)FIP-99mTc的制备;(B)IR-1061和FIP的荧光发射光谱;(C)FIP的PA光谱;(D)不同浓度下FIP与PA强度的线性图;(E)ZIMH和NIR-IIFL/PA双模态成像制备示意图;(F)不同浓度ZIMH与PA强度的线性图;(G)ZIMH的荧光发射光谱;(H)C-BM/I的制备;(I)激光照射10分钟后ICG的荧光发射光谱;(J)激光照射10分钟后C-BM/I的荧光发射光谱;(K)ICG和C-BM/I的NIR-IIFL图像;(L)ICG和C-BM/I的PA图像;
在此,我们系统地归纳了用于构建近红外-II荧光/光声(FL/PA)双模态成像技术的有机小分子染料、有机纳米粒子以及有机-无机纳米杂化材料的详细参数(表 1)。在众多近红外-II FL/PA双模态成像探针中,有机小分子纳米粒子占据主导地位。然而,值得注意的是,大多数探针的发射波长主要集中在近红外-IIa'区域,仅有少数能在近红外-IIb区域进行高效的荧光成像。考虑到近红外-II FL/NIR-II PA双模态成像探针能够提供更深入的生理和病理信息,目前这类探针的数量仍然相对较少,但其在生物医学领域的应用潜力巨大。
为了进一步推动近红外-II FL/PA双模态成像技术的发展,我们需要针对粒度、量子产率(QY)和光声转换效率(PCE)等关键参数进行优化。这些优化工作将有助于提高探针的生物分布均匀性、组织穿透深度、细胞内化效率和体内稳定性,从而为实现更精准的生物医学成像提供有力支持。
Table 1. Classification and parameters of NIR-II FL/PA dual-modality imaging probes.
| Probe name | λmax abs/nm | FLmax em/nm | PAex/nm | Size/nm | QY/% | PCE/% | Biomedical applications |
|---|---|---|---|---|---|---|---|
| NIC-ER | 910 | 1030 | 910 | – | 3.56 | – | Tumor and vascular imaging |
| CyQN-BTT | 677 | 938 | 671 | – | 0.12 | 37.8 | Tumor imaging |
| IR806-RGD | 815 | 855 | 808 | – | 0.17 | – | Tumor imaging |
| TSSAM | ∼640 | 950 | 660 | – | 0.156 | 40.1 | Tumor imaging |
| ZSY-TPE | 730 | 1020 | 808 | ∼90 | 3.1 | 28.4 | Tumor imaging and antimicrobial |
| DPBTA-DPTQ | 817 | 1125 | – | ∼105 | 0.16 | 40.6 | Tumor imaging |
| M1 | 734 | 1040 | 808 | 100 | 2.84 | 77.5 | Tumor imaging |
| SYL | ∼765 | ∼976 | 760 | ∼120 | – | ∼21.8 | Tumor imaging |
| SY1080 | 820 | 1080 | 808 | ∼120 | 1.5 | 22.3 | Tumor imaging |
| TPA-BT-DPTQ | 853 | 1117 | 870 | 54.1 | 0.13 | 23 | Tumor imaging |
| CEB | ∼900 | ∼1120 | 820 | ∼100 | 0.98 | – | Tumor imaging |
| TSST | 731 | 1077 | 808 | ∼120 | – | – | Tumor imaging and ferroptosis |
| DTTB@PEG | 750 | 1050 | 808 | ∼80 | 13.4 | 47.3 | Tumor and vascular imaging, drug delivery |
| BDTR9-OC8 | 757 | 1072 | 808 | ∼28 | 0.41 | 78 | Tumor imaging |
| BDTR9-C8 | 766 | 1054 | 808 | ∼36 | 1.89 | 71 | Tumor imaging |
| DHTDP NP@M | 840 | 1050 | – | ∼118 | 0.125 | – | Tumor imaging |
| BBTD-1302 | 942 | 1302 | 980 | ∼80 | 2.4 | 28.6 | Tumor imaging |
| BTP-4F-DMO | 650 − 850 | ∼900 | – | ∼33 | – | 90.5 ± 5 | Tumor imaging |
| BTP-TCID-2CN | – | 914 | – | ∼178.3 | 3.77 | 33.5 | Tumor imaging |
| AIE@R837 | – | 1163 | 808 | ∼150 | – | 27.9 | Tumor and vascular imaging |
| DFTQ–DTPA | 922 | 1127 | 922 | ∼89.8 | 0.064 | 51.6 | Tumor and vascular imaging |
| DTP-DPTQ | 852 | 1120 | 852 | ∼65 | 0.01 | 51.55 | Tumor and vascular imaging |
| ICR-QuNPs | 770 | 1032 | 808 | 176.8 | 1.47 | 81.1 | Tumor imaging |
| DPP-BDT | 625 | 980 | 660 | ∼90 | 0.52 | 23 | Tumor imaging |
| ETTC | – | 900 − 1200 | – | 59.3 | 3 | 52.8 | Tumor imaging |
| TTT-4 | 568 | 813 | – | 32.14 | 0.8 | 39.9 | Tumor imaging |
| TPEDCAc | 460 − 580 | 980 | 660 | 70 | 0.4 | 44.1 | Tumor imaging |
| Y16-Pr-PEG | 600 − 900 | 920 | – | 126 | – | 82.4 | Tumor imaging |
| FE-IDMN | 1050 | – | 808 | ∼160 | 0.066 | 82.6 | Tumor imaging |
| DPP-FCPP | 611 | 1090 | 760 | ∼100 | 0.82 | 16 | Liver imaging |
| IDCIC | 760 | ∼1000 | – | ∼80 | 1.2 | 78.9 | Tumor imaging |
| TDA | 625 | 935 | 825 | ∼103 | 0.62 | 20.5 | Liver imaging |
| FEAA | 637 | 1109 | 760 | ∼65 | 0.81 | 23.4 | Liver imaging |
| SPN | ∼521 | ∼930 | 530 | 92.5 ± 1.01 | ∼0.2 | 29.7 | Liver imaging |
| P-DPP | 763 | 1066 | 530 | ∼80 | 1.5 | 15 | Liver and vascular imaging |
| PFG | 826 | 1063 | 808 | ∼80 | – | 75.6 | Tumor imaging and ferroptosis |
| PFTQ-PEG-Gd | 760 | 1056 | 760 | 138.4 ± 3.1 | 0.38 | 26 | Tumor and vascular imaging |
| B@SP-C | 1310 | – | 1260 | 168 | – | 73 | Thrombus imaging |
| DPP-TT | − | 1000 − 1400 | 808 | 90 | – | 45.4 | Tumor imaging |
| PFTDPP-SNAP | 550 − 900 | 1060 | 808 | 52 | 2.2 | 48 | Tumor and vascular imaging |
| Tat-BTNP | 854 | 1106 | 532, 840 | ∼45 | 0.1 | – | Vascular imaging and inflammation tracking |
| SPN-PT | 703 | 961 | 695 | 124.24 ± 1.34 | – | 41.8 | Tumor imaging |
| Ag2S-NDs | – | 1060 | 800 | 32.8 | 1.26 − 1.32 | 35 | Tumor and vascular imaging |
| Ag2S@DP-FA | – | ∼1100 | 523, 744 | ∼200 | – | – | Tumor and vascular imaging |
| CPCC-Ag2S | – | 1099 | 744 | 3.44 | 3.78 | 21 | Tumor imaging |
| ICG@PEG-Ag2S | ∼800 | 1100 | 780 | 172.2 | – | – | Atherosclerosis imaging |
| Au NEs-PEG-folate | 980 | 500 − 800 | 1064 | ∼350 ± 50 | – | – | Tumor imaging |
| APHA@CM | – | 1170 | – | 172.6 ± 18.3 | – | 26.89 | Tumor imaging |
| UCNPs@PAA-Azo | 976 | 1345 | 808 | 37.6 ± 2.1 | 5.6 | – | Organs and vascular imaging, image-guided surgery |
| DCNP@PDA | – | 1340 | 700 | 32.3 ± 2.7 | – | 40 | Gastrointestinal tract imaging, image-guided surgery |
| Ln@Fe | – | 1550 | 808 | ∼88.6 | – | 40.3 | Tumor and vascular imaging, ferroptosis |
| HSC-2 | – | ∼957 | 808 | 142.2 | 0.412 | 41.41 | Tumor imaging |
| B4C@C | 200 − 1200 | – | 1064 | 120 ± 2 | – | 45.4 | Tumor imaging |
| Nb2C-PVP | 750 − 1350 | – | 1035, 1064 | ∼220 | – | 37.48 | Tumor imaging |
| QD@Si/GO–FA | – | 1120 | 523, 744 | 250 ± 7 | ∼1.12 | 30.6 | Tumor and vascular imaging |
| FIP-99mTc | 1069 | 1095 | 750 | 182 | – | ∼32.8 | Tumor imaging |
| ZIMH | 820 | – | 880 | 213.9 | – | – | Tumor imaging |
| C-BM/I | 786 | – | 830 | ∼309 | – | 16 | Tumor imaging |
可激活的近红外-II荧光/光声(FL/PA)双模态探针
可激活的近红外-II荧光/光声(FL/PA)双模态探针,作为一种具备独特功能的新型材料,具备与目标分子反应后产生显著信号变化的特性。当前,多数报道的此类探针都采用了“关闭-开启”机制。这种机制使得这些探针在生物成像、药物筛选以及疾病诊断等领域展现出巨大的应用潜力,特别是在检测生物体内各种生物标志物的异常状态方面,其独特的性能更是备受瞩目。
NO 激活探针
一氧化氮(NO)在人体生理过程中占据核心地位,它调节血管张力、具有抗炎特性,并参与神经传递、免疫调节和细胞凋亡等关键生物过程,因此被视为一种至关重要的信号分子。在生物医学成像领域,NIR-II荧光/光声(FL/PA)双模态成像技术通过FL信号定位并显示生物样本中的NO水平,而PA信号则用于定量分析,两者结合能提供更准确、可靠的成像结果。然而,由于目前大多数NO探针采用不可逆的键合反应机制,实现内源性NO的原位和动态实时监测仍面临挑战。
药物性肝损伤(DILI)通常导致肝脏NO水平升高,使其成为DILI的直接生物标志物。Wu研究小组开发了一种基于聚集诱导发光(AIE)机制的NIR-II FL/PA双模态探针,用于检测中药诱导的DILI(https://doi.org/10.1002/adhm.202100867)。该探针分子QY-N上的电子负载丁胺结构能有效削弱喹啉的电子吸收能力,实现荧光淬灭(图11A)。丁胺作为芳香环上的仲胺,与NO发生N-亚硝基化反应,形成亚硝基,进而引发FL和PA信号的“关闭-开启”变化。这一纳米探针成功应用于无创原位监测和跟踪三苯氧胺诱导的肝损伤。
随后,Wu研究小组在2022年提出了一种针对近红外II FL/PA急性炎症成像的NO响应探针HC-N(https://doi.org/10.1039/d2cc05386a)。与QY-N类似,HC-N上的电子供体仲胺也能与NO发生N-亚硝基化反应,形成HC-NO(图11B)。在急性皮炎和关节炎小鼠模型中,HC-N通过近红外-II FL/PA双模态成像技术成功检测了原位生物标记物NO,为急性炎症的检测提供了一种有效方法。
为了克服荧光自淬和背景信号干扰,Xiao等人开发了首个用于检测NO的NIR-II FL/PA双模态比率探针RAPNP(https://doi.org/10.1016/j.biomaterials.2023.121993)。在弱酸性条件下,DTP-BTDA上的氨基能被NO快速氧化生成DTP-TBTD,这一转变产生了强烈的分子内电荷转移效应,从而激活了F127胶束中的FL和PA信号,并导致吸收和发射波长的显著位移。作为内参的DTP-BBTD对NO无响应,但在950纳米波长处提供光声信号,在1120纳米波长处提供荧光信号(图 11C)。RAPNP是首个基于二噻吩基吡咯结构的NIR-II FL/PA双模态成像探针,适用于炎症性肠病中内源性NO的比率测量检测。
此外,Chen等人利用探针分子BDNA上的邻二氨基作为反应位点,通过与NO氧化环化生成BDNANO(https://doi.org/10.1016/j.xcrp.2021.100570)。BDNA与2-hydroxypropyl-β-cyclodextrin形成两性复合物BNDA-HβCD,进而在水介质中自组装成纳米探针BNDA@HβCD(图 11D)。这一纳米探针通过近红外-II FL/PA双模态成像技术,成功实现了托森丹和对乙酰氨基酚诱导的DILI小鼠模型的病灶定位。同时,BNDA@HβCD也展现出检测内源性NO的强大能力,成功应用于大豆芽内NO的近红外-II FL/PA双模态成像。 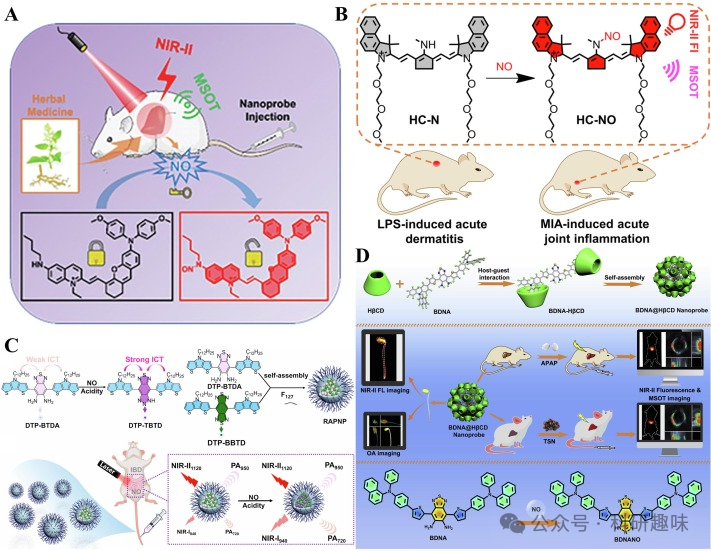
图11.(A)QY-N的NO反应机制和肝损伤应用示意图;版权所有2021年,Wiley-VCH;(B)氮氧化物反应机制示意图和HC-N的急性炎症应用;(C)RAPNP制备、NO响应机制和FL/PA信号变化示意图.(D)BNDA@HβCD的制备、肝损伤应用和NO响应机制示意图.
生物硫醇激活探针
生物硫醇,即含有巯基(-SH)官能团的非芳香族化合物,在生物体内扮演着至关重要的角色,常见的包括硫化氢(H₂S)、谷胱甘肽(GSH)、同型半胱氨酸和半胱氨酸,它们与生物体的多种生理和病理过程紧密相关。近年来,为了精确检测和分析肿瘤微环境中的生物硫醇,研究人员致力于开发新型的可激发荧光探针,这些探针通过特定的化学结构与生物硫醇发生反应,从而实现生物硫醇的定量和定位分析。
生物硫醇激活荧光探针的反应机制多样,包括还原反应、迈克尔加成、芳香族亲核取代、醛环化和硫解等,这些机制利用硫醇基团与探针的特定化学结构相互作用,导致荧光或光声信号的变化。其中,可激活的近红外-II荧光/光声(NIR-II FL/PA)双模态探针以其高灵敏度和高选择性,成为生物硫醇检测领域的新星。
2020年,Zhang研究小组成功开发了一种基于NIR-II FL/PA双模态成像系统,该系统利用二烯丙基三硫醚(DATS)和叠氮基团(-N₃)的引入,实现了对GSH和H₂S的连续刺激响应(https://doi.org/10.1039/D0NR02543G)。该系统通过光声成像技术,将近红外-II荧光探针与光声造影剂相结合,实现了生物硫醇的双重检测(图 12A)。Zeng研究小组则提出了一种基于SiO₂@Ag的内源性H₂S触发的NIR-II FL/PA双模态智能纳米探针(https://doi.org/10.1021/acs.analchem.1c02200)。在该探针中,H₂S与Ag发生硫化反应,生成Ag₂S纳米点,从而产生强烈的PA信号和红移NIR-II发射荧光。这一成果为结直肠癌的早期检测提供了新的成像方法(图 12B)。
Gong课题组设计了一种基于氰基染料自组装和解组装的可激活探针MC-PSE,用于体内GSH的近红外-II FL/PA双模态成像(https://doi.org/10.1021/acs.analchem.3c02664)。该探针通过硒苯基与GSH发生亲核取代反应,实现了对GSH的特异性识别和荧光/光声信号的双重变化(图 12C)。MC-PSE是首个实现体内GSH荧光和比率光声双模态成像的NIR-II探针分子。
2021年,Liu研究组开发了一种NIR/GSH顺序激活的纳米探针AsHMS-TA/FeIII@NK(https://doi.org/10.1002/advs.202103498)。该纳米探针由自然杀伤(NK)细胞膜和类病毒二硫键掺杂的中空介孔二氧化硅AsHMS-TA/FeIII组成。该探针在肿瘤部位聚集后,通过激光照射触发NK细胞膜裂解,进而释放出的GSH与二硫键反应,产生自由基引发剂(AIPH),诱导肿瘤细胞凋亡,抑制肿瘤生长(图 12D)。近红外-II FL/PA双模态成像技术证实了该纳米探针在肿瘤部位的有效聚集能力。
最近,Liu研究组又报道了一种新型NIR-II FL/PA双模态成像探针,该探针通过将Na₂S₂O₈纳米晶体封装成空心四硫化物,并引入介孔二氧化硅,形成类似“蛋黄壳”结构的纳米系统Na₂S₂O₈@HTSMSEF(https://doi.org/10.1002/EXP.20230054)。在肿瘤细胞中,GSH裂解四硫化物释放AIPH,产生硫酸根自由基和-OH,有效诱导肿瘤细胞凋亡。与之前的纳米探针相比,Na₂S₂O₈@HTSMSEF在肿瘤部位的蓄积时间更长,通过长时间的NIR-II FL/PA双模态成像可以更准确地确定肿瘤的位置、大小和形态(图 12E)。 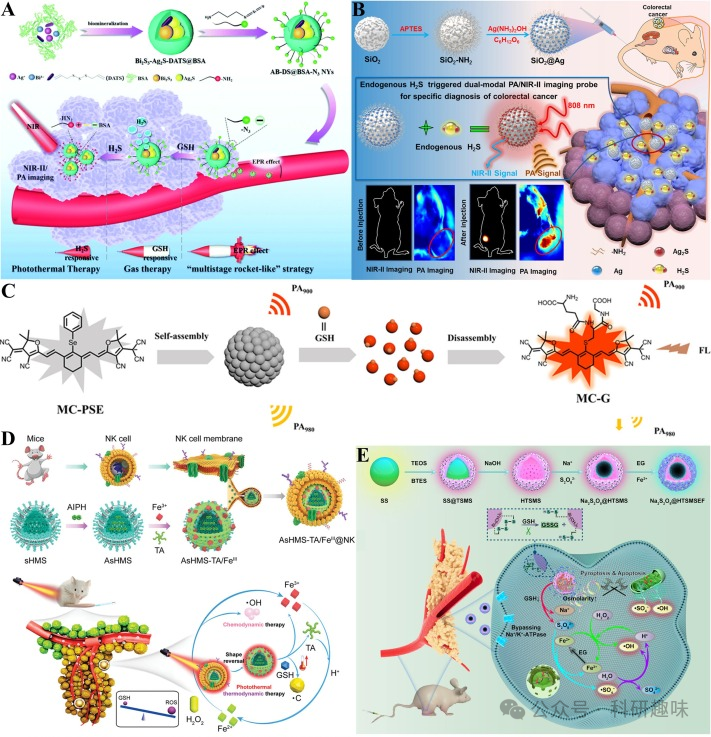 图12.(A)AB-DS@BSA-N3Nys的制备及GSH/H2S响应机制.(B)SiO2@Ag的制备和H2S响应机制示意图.(C)MC-PSE的结构和GSH响应机制示意图.(D)AsHMS-TA/FeIII@NK的制备及近红外/GSH顺序活化示意图.(E)Na2S2O8@HTSMSEF的制备和GSH响应机制示意图.
图12.(A)AB-DS@BSA-N3Nys的制备及GSH/H2S响应机制.(B)SiO2@Ag的制备和H2S响应机制示意图.(C)MC-PSE的结构和GSH响应机制示意图.(D)AsHMS-TA/FeIII@NK的制备及近红外/GSH顺序活化示意图.(E)Na2S2O8@HTSMSEF的制备和GSH响应机制示意图.
ROS 激活探针
活性氧(ROS)是一系列关键的化学活性氧分子,其家族成员包括超氧阴离子、单线态氧、过氧化氢(H2O2)和羟基自由基(-OH)等。ROS在细胞代谢中占据核心地位,作为细胞内氧化还原状态的关键指示剂,能够调控代谢酶和转录因子的表达,进而影响细胞的分化、增殖以及炎症反应过程。此外,ROS作为体内氧化应激的主要产物,长期被视为肿瘤发生、发展及复发的重要因素之一。
为精准检测病变微环境中的ROS,研究者们开发了多种可激活的ROS探针,其中,针对近红外-II荧光/光声(NIR-II FL/PA)双模态成像的ROS标记物,特别是H2O2和-OH,展现出显著的优势。这些探针克服了传统ROS激活探针波长短、组织穿透性差以及体内成像困难等挑战。然而,ROS的完整功能和作用机制尚未被全面揭示,探针分子在特异性ROS检测中的靶向性、选择性和抗干扰性仍需进一步优化。
2021年,Wu研究团队提出了一种新型H2O2可激活的纳米探针BTPE-NO₂,用于间质性膀胱炎和肝缺血再灌注损伤的NIR-II FL/MSOT双模态成像(https://doi.org/10.1038/s41467-021-27233-4)。该探针两端的硝基苯氧乙酰胺基团不仅有效淬灭荧光,还能特异性识别H2O2。炎症性疾病的病灶区域会大量产生H2O2,进而诱导硝基苯氧乙酰胺基团的裂解,产生强烈的荧光信号,显著提升病灶检测的准确性(图13A)。随后,Wu团队进一步拓展了H2O2激活探针的种类,包括TC-H2O2(https://doi.org/10.1039/D1CC02845F)、BHC-Lut(https://doi.org/10.1016/j.aca.2022.339831)、PEG3-HC-PB(https://doi.org/10.1021/acsami.3c00956)和BX-BOH(https://doi.org/10.1039/d2cc06031k)。这些探针分别利用硝基苯氧乙酰胺基团、硼酸键和苯硼酸基团作为反应位点,展现出不同的作用机制和成像效果(图13B-E)。在各种小鼠肝损伤模型中,这些探针成功应用于NIR-II FL/MSOT双模态成像,为炎症性疾病的诊断提供了新的工具。
Song研究小组报道了一种ROS响应型NIR-II FL/PA双模态成像探针BBT-IR/Se-MN(https://doi.org/10.1002/anie.202305744)。该探针上的吸电子硝基通过提升肿瘤细胞内的ROS水平,增强了放射治疗的效果。同时,ROS诱导分子中二硒化物的裂解,导致近红外-II比率荧光信号的变化。通过PAI技术验证了缺氧程度与肿瘤大小的正相关性。这一探针不仅可预测早期放疗对原位胶质瘤的疗效,还能实时定量监测ROS水平(图13F)。
此外,Song团队还介绍了一种等离子体H2O2激活探针Ag/Ag₂S JNPs(https://doi.org/10.1021/acs.nanolett.1c00197)。在激光照射下,Ag和Ag₂S之间的电子补偿效应维持荧光"关闭"状态。当病变部位的Ag被内源性H2O2氧化成Ag+时,电子补偿效应减弱,Ag₂S NPs的荧光被激活(图13G)。该探针在NIR-II FL/PA双模态成像中的卓越性能使其能够无创定位体内炎症和肿瘤。
Ye研究小组则报道了一种-OH可激活的NIR-II FL/PA双模态成像探针1-NP(https://doi.org/10.1038/s41467-021-26380-y)。该探针中的二烯电致变色材料1-Br-Et可被肿瘤中的-OH氧化并带正电荷,转化为2-NP。与-OH反应后,探针分子的吸收增强和光热效应导致近红外-II FL/PA双比率信号变化,实现了肿瘤内源性-OH的实时无创成像。1-NP具有高选择性和灵敏度,检测限低至3.69 nM,能够在铁死亡和放疗过程中准确监测-OH水平(图13H)。  图13.(A)BTPE-NO2的制备、H2O2响应机制和应用示意图;(B)TC-H2O2与H2O2响应机制示意图.(C)BHC-Lut与H2O2反应机制示意图.(D)PEG3-HC-PB与H2O2反应机制示意图.(E)BX-BOH@BSA与H2O2反应机制示意图.(F)BBT-IR/Se-MN的结构、ROS响应机制和应用示意图.(G)Ag/Ag2SJNPs与H2O2响应机制示意图.(H)1-NP的制备和近红外-IIFL/PA双模态成像-OH响应机制示意图.
图13.(A)BTPE-NO2的制备、H2O2响应机制和应用示意图;(B)TC-H2O2与H2O2响应机制示意图.(C)BHC-Lut与H2O2反应机制示意图.(D)PEG3-HC-PB与H2O2反应机制示意图.(E)BX-BOH@BSA与H2O2反应机制示意图.(F)BBT-IR/Se-MN的结构、ROS响应机制和应用示意图.(G)Ag/Ag2SJNPs与H2O2响应机制示意图.(H)1-NP的制备和近红外-IIFL/PA双模态成像-OH响应机制示意图.
pH激活的探针
pH值是维持生物体内环境稳态的关键参数。首先,酸碱平衡对于生物体进行正常的生命活动至关重要。例如,过酸或过碱的环境会干扰蛋白质合成和能量转换等基本生命过程,对生物体的存活构成威胁。其次,酸碱度对生物体的多个系统如免疫系统、神经系统和循环系统具有显著影响。在过酸条件下,它可能刺激呼吸系统和胃酸分泌,引发呼吸加速和胃溃疡等疾病;而过碱环境则可能导致皮肤症状如瘙痒、红肿,严重时甚至导致休克。
为了实时监测细胞和组织内酸碱度的变化,并研究细胞新陈代谢、信号传导、肿瘤和其他疾病机制,研究人员开发了可激活pH值的探针,这些探针特别适用于近红外-II荧光/光声(NIR-II FL/PA)双模态成像。近红外-II成像技术克服了近红外-I成像在穿透深度和分辨率方面的限制。目前,大多数pH活化近红外-II FL/PA双模态成像探针的表面都集成了酸响应物质,这些物质在肿瘤细胞的酸性微环境中会发生特定的化学变化。由于肿瘤细胞内外pH值波动较小,因此设计具有高灵敏度和窄阈值的pH响应探针显得尤为重要。
Chen等人成功设计并制备了一种pH响应型自组装纳米囊泡AuNNR-DCNP混合等离子体(https://doi.org/10.1007/s12274-020-3000-9)。这些囊泡在酸性条件下会裂解,释放纳米封装的金纳米棒(AuNNRs)和DCNPs,显著增强光学效应。由于高糖酵解活性的肿瘤细胞特异性吸收并酸化AuNNR-DCNP,因此能够产生强烈的NIR-II荧光和NIR-II光声信号,从而实现肿瘤的精准可视化(图14A)。
Lv等人提出了一种由金纳米粒子(AuNNPs)和Ag2S量子点(QDs)自组装而成的AuNNPs-Ag2S混合囊泡(https://doi.org/10.1002/adom.202200694)。在自组装过程中,金纳米粒子产生的强大局部表面等离子体共振效应增强了近红外-II光声信号,而Ag2S QDs的近红外-II荧光信号则被淬灭。这种混合囊泡的表面覆盖了对pH敏感的聚合物,在肿瘤酸性环境下分解,导致AuNNPs的等离子体耦合反应减弱,近红外-II光声信号降低,而Ag2S QDs的近红外-II荧光信号增强。这种设计实现了肿瘤的近红外-II荧光和近红外-II光声双模式成像,并促进了精确的放射治疗(图14B)。
Wang等人基于DNA编码策略,组装了一种pH可激活的NIR-II FL/PA双模式成像探针CuS-i(https://doi.org/10.1002/anie.202316562)。通过在CuS-i中引入具有pH响应特性的i-motif连接器,实现了探针在酸性和中性条件下的可逆组装。CuS-i能够穿透肿瘤血管,进入肿瘤实质,为深部组织提供清晰的近红外-II荧光/光声双模态成像(图14C)。此外,DNA编码合成的Ag2S QDs具有肾脏清除能力,降低了生物毒性。与传统的NIR-II FL/PA双模态成像探针相比,基于DNA编码策略组装的探针展现出更高的智能化、清晰度、精确度和成像效率。
Xu等人开发了一种镧系元素掺杂的上/下转换平台LDACs,该平台对肿瘤微环境的pH值变化敏感,并适用于NIR-II FL/PA双模态成像(https://doi.org/10.1016/j.jcis.2023.12.088)。LDACs表面覆盖有碳酸钙(CaCO3)涂层,在肿瘤酸性环境下分解并产生二氧化碳(CO2)气泡。随着CaCO3的降解,NIR-IIb荧光信号逐渐增强。同时,由于二氧化碳气泡引发的惯性空化效应,纳米探针内装载的Au NPs的光声信号也相应增强(图14D)。LDACs的发射波长位于近红外-IIb区域,实现了信号自增强的双模态肿瘤成像。 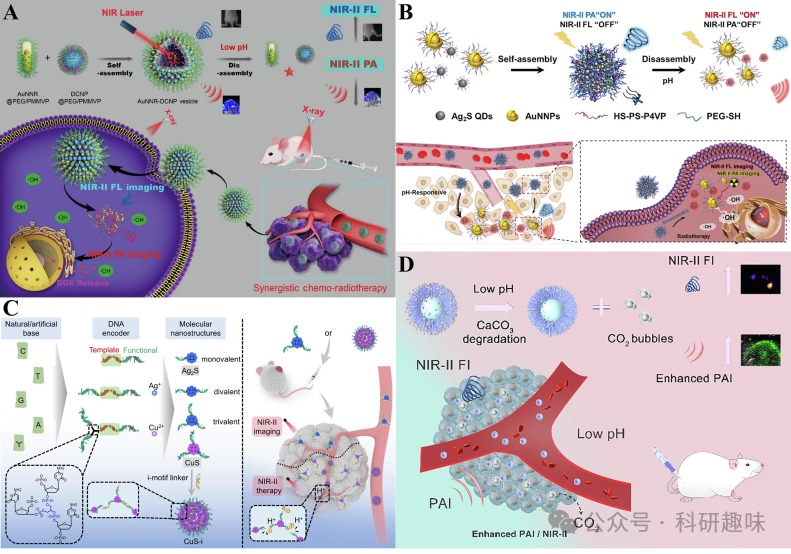 图14:(A)AuNNR-DCNP纳米粒子的制备和pH响应机制示意图;(B)AuNNPs-Ag2S混合囊泡的制备、pH响应机制和应用示意图.(C)CuS-i的DNA编码策略和pH响应机制示意图.(D)LDACs的pH响应机制示意图
图14:(A)AuNNR-DCNP纳米粒子的制备和pH响应机制示意图;(B)AuNNPs-Ag2S混合囊泡的制备、pH响应机制和应用示意图.(C)CuS-i的DNA编码策略和pH响应机制示意图.(D)LDACs的pH响应机制示意图
NTR 激活探针
硝基还原酶(NTR)作为细胞能量代谢的关键酶,其催化硝基化合物向胺的转化在生物学过程中占据重要地位。NTR的活性受到缺氧环境的显著影响,这种特性赋予它在生物体内的多重生理功能,包括氮代谢的调节和抗氧化应激的能力。近年来,NTR在生物医学领域的应用日益凸显,特别是在药物合成、生物传感以及疾病诊断等领域。
在实体瘤中,由于血管供应不足和细胞增殖迅速,常常出现缺氧现象,这导致NTR水平升高。因此,NTR成为实体瘤的潜在生物标志物,为开发近红外-II荧光/光声(NIR-II FL/PA)双模式成像的激活型探针提供了契机。这类探针在动物模型中已展现出优异的成像效果,预示着在肿瘤的诊断和治疗中的巨大潜力。
然而,目前这些探针的设计仍面临挑战,特别是在实现特定病变器官的靶向性、穿越血脑屏障以检测脑部NTR异常,以及平衡FL和PA信号强度以提高成像的适用性、准确性和转化能力方面。
Cai课题组于2018年成功合成了有机小分子探针IR 1048-MZ,该探针通过连接近红外II染料和NTR响应配体实现(https://doi.org/10.7150/thno.26607)。硝基咪唑分子的退电子感应效应在探针中发挥了关键作用,它能够减弱近红外-II FL/PA信号。在肿瘤缺氧环境中,NTR将硝基还原为氨基,生成IR 1048-MZH,从而显著增强NIR-II FL/PA信号(图 15A)。这种探针凭借其深组织穿透性、高空间分辨率和低自背景荧光,为缺氧相关疾病的双模态成像提供了有力工具。
Wu研究组则设计了一种可激活NTR的纳米复合探针BH-NO2@BSA,结合具有聚集诱导发光(AIE)特性的近红外-II荧光成像技术和MSOT光声成像系统,实现了早期肝癌的原位检测(https://doi.org/10.1021/acs.analchem.0c01596)。在肝脏肿瘤缺氧环境中,探针中的硝基被NTR还原为氨基,产生强烈的NIR-II FL/PA信号(图 15B)。该探针具有良好的生物相容性,适用于体外和体内的高对比度双模态成像,并展示了在肝脏肿瘤术前定位和术中导航方面的应用潜力。
随后,Wu的研究小组进一步提出了NTR响应型荧光探针NP-Q-NO2(https://doi.org/10.1002/anie.201913149)。该探针在硝基被NTR还原为氨基后,醚键发生自诱导消除反应,生成羟基。NP-Q-NO2以其高选择性和稳定性,为乳腺癌向远处器官转移的近红外-II FL/PA双模态成像提供了有效工具(图 15C)。
Zheng等人则构建了一种周期性增强的NTR响应纳米探针CGH NAs,通过双重敏化策略精确激活NIR-II FL/PA双模态成像引导的肿瘤协同治疗(https://doi.org/10.1016/j.mtbio.2022.100478)。探针表面的2-硝基咪唑在肿瘤细胞内NTR的作用下还原为水溶性2-氨基咪唑,同时HA的分解释放出CQ4T和GOX,产生大量ROS以杀死肿瘤细胞(图 15D)。这种双重增敏策略不仅提高了治疗效果的准确性和可靠性,还为NTR在不同肿瘤缺氧阶段的高灵敏度反应提供了新的解决策略。 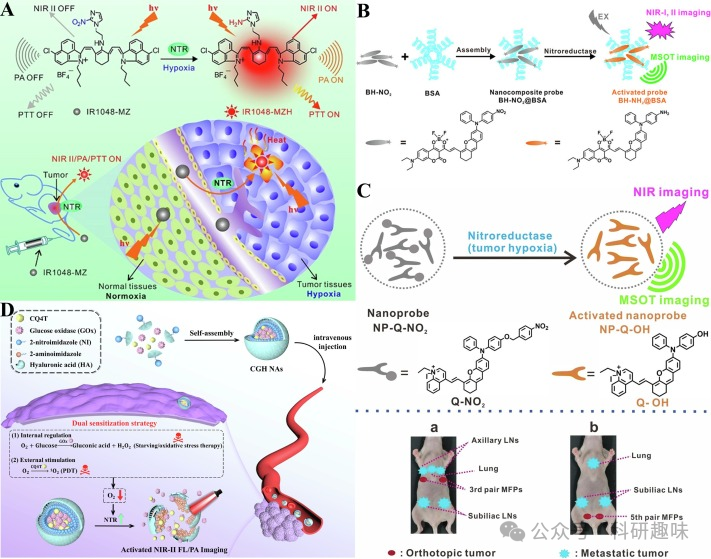 图15.(A)IR1048-MZ与NTR反应机制和肿瘤内反应示意图.(B)BH-NO2@BSA的制备及NTR反应机制示意图.(C)NP-Q-NO2和NTR反应机制示意图.(D)CGHNas的制备和NTR响应机制示意图.
图15.(A)IR1048-MZ与NTR反应机制和肿瘤内反应示意图.(B)BH-NO2@BSA的制备及NTR反应机制示意图.(C)NP-Q-NO2和NTR反应机制示意图.(D)CGHNas的制备和NTR响应机制示意图.
其他激活probes
除了前面提及的可激活近红外-II FL/PA双模态成像探针外,还有少数探针能够针对其他与疾病紧密相关的生物酶(如Ⅴ类)进行检测。近年来,双响应探针在环境监测、生物分析和医学成像领域展现出了巨大的应用潜力,其设计与应用已成为一个充满活力且充满挑战的研究领域。在此,我们将介绍几种用于近红外-II FL/PA双模态成像的其他可激活探针。
Fu等人研发了一种能够响应凋亡酶caspase-3的近红外-II FL和近红外-II PA双模态成像探针AuNNP@DEVD-IR1048(https://doi.org/10.1002/ange.202112237)。该探针在初始状态下不显示FL和PA信号,但在X射线照射下,诱导产生的大量ROS会激活caspase-3。随后,活化的caspase-3特异性地切断肽链,释放NIR-II荧光染料IR-1048和AuNNPs聚集体,从而触发NIR-II FL和NIR-II PA信号的显著增强。其中,AuNNPs聚集体的形成可增强局部表面等离子体共振效应,进一步影响探针的吸光度和PA信号强度。这种可激活的有机-无机杂化纳米复合材料不仅可用于早期疗效评估,还为新型治疗系统的开发提供了有力工具。
氨基肽酶N(APN)在肿瘤细胞的增殖、侵袭和转移过程中起着关键作用。Chen等人开发了一种可激活APN的纳米探针TX-APN@BSA,用于NIR-II FL/PA双模态成像(https://doi.org/10.1021/acs.analchem.2c01241)。该探针中的丙氨酸在肿瘤中过表达的APN作用下转化为氨基,从而激活探针的近红外-II FL/PA信号。这种双模态成像技术能够准确描绘肿瘤的原位位置和追踪淋巴转移路径。
Wu研究小组设计了一种pH/H2O2双响应NIR-II FL/PA双模态成像纳米系统QM@EP(https://doi.org/10.1016/j.biomaterials.2022.121468)。该系统在结肠的特定pH值下发生裂解,释放内部探针分子QY-SN-H2O2。随后,QY-SN-H2O2上的五氟苯磺酸盐被结肠内壁产生的H2O2分解,生成羟基,进而活化QY-SN-OH并增强其AIE效应,从而显著增强近红外-II FL/PA信号。这一系统为溃疡性结肠炎等疾病的检测提供了新的可能。
此外,Wu研究小组还提出了另一种基于BODIPY的pH/H2O2双响应近红外-II FL/PA双模态成像纳米系统BM@EP(https://doi.org/10.1002/adhm.202201544)。该系统中的BOD-XT-DHM上的硼酸酯键在H2O2作用下分解形成BOD-XT,阻断光致发光电子传递过程,从而显著增强近红外-II FL/PA信号。
Zheng等人报道了一种针对成纤维细胞活化蛋白(FAP)和H2O2的双响应NIR-II FL/PA双模态成像纳米系统PPAC(https://doi.org/10.1002/smll.202201179)。该系统利用钯纳米片上的FAP响应肽被肿瘤基质成纤维细胞中过表达的FAP特异性裂解,释放BSA-CQ4T,开启NIR-II FL信号。同时,纳米平台负载的Ag也被H2O2氧化成Ag+,导致比率PA信号的变化。PPAC主要通过肝脏和肠道清除,是一种极具前景的双激活近红外-II荧光/PA双模式成像系统。 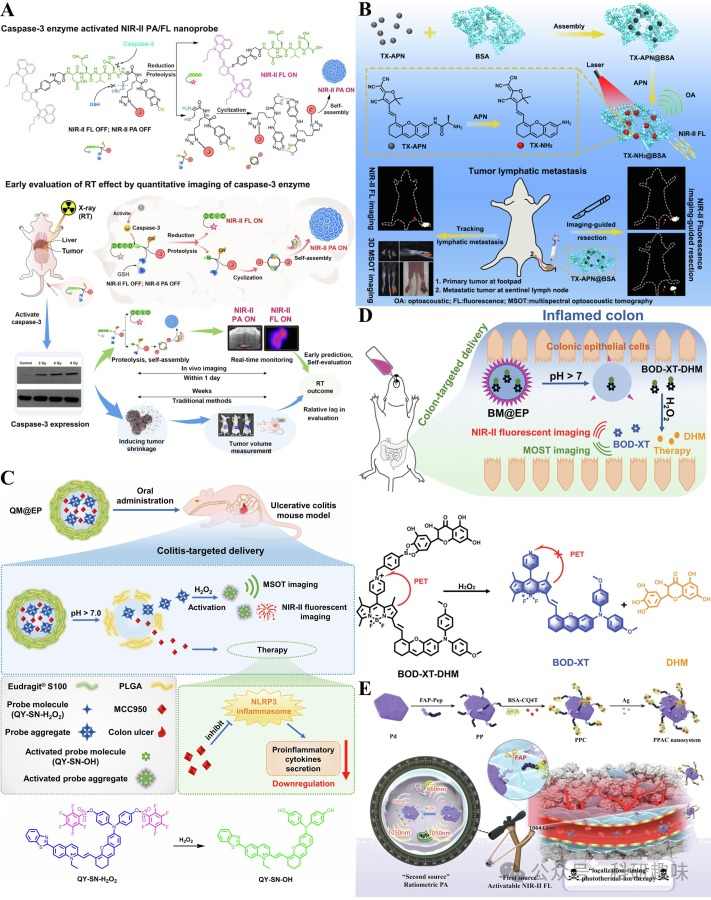 图16.(A)AuNNP@DEVD-IR1048与caspase-3的反应机制和应用示意图.(B)TX-APN@BSA的制备、APN响应机制和应用示意图.(C)pH/H2O2双响应机制示意图及QM@EP的应用.(D)pH/H2O2双重响应机制示意图及BM@EP的应用.(E)PPAC的制备和FAP/H2O2双响应机制示意图.
图16.(A)AuNNP@DEVD-IR1048与caspase-3的反应机制和应用示意图.(B)TX-APN@BSA的制备、APN响应机制和应用示意图.(C)pH/H2O2双响应机制示意图及QM@EP的应用.(D)pH/H2O2双重响应机制示意图及BM@EP的应用.(E)PPAC的制备和FAP/H2O2双响应机制示意图.
5. 生物医药应用
近红外-II荧光/光声(FL/PA)双模态成像技术,作为一种先进的生物医学成像方法,巧妙地将近红外-II荧光成像(FLI)与光声成像(PAI)的优势相结合。这种双模态成像技术不仅克服了单模态成像技术的局限性,更在成像的准确性和可靠性上实现了显著提升。在生物医学领域,近红外-II FL/PA双模态成像技术展现出广泛的应用前景,特别是在体内成像和肿瘤治疗监测方面,其独特的成像能力为疾病的早期诊断和治疗提供了有力的支持。
5.1. 体内成像
5.1.1. 肿瘤治疗
癌症作为全球性的主要健康威胁,其发病率和死亡率因环境污染、饮食模式的转变及人口老龄化而预计将持续攀升。早期且准确的肿瘤诊断对于提高患者的存活率及生活质量至关重要。为此,科研人员采用近红外-II荧光/光声(NIR-II FL/PA)双模态成像技术,以实现癌症的早期精准诊断。
肿瘤靶向策略可划分为被动靶向和主动靶向两类。被动靶向依赖于肿瘤部位特有的生理和病理特征以及探针本身的性质,使其在肿瘤区域有效积累。而主动靶向则基于探针表面分子与肿瘤部位特定分子的主动识别,实现探针分子在肿瘤细胞和组织中的选择性聚集。当前,多数探针主要通过肿瘤血管的通透性和滞留性增强效应(EPR)实现被动靶向,但这种方法仅适用于实体瘤形成后,此时肿瘤可能已发生转移。因此,开发不依赖EPR效应的新型主动靶向探针,对于早期肿瘤的诊断和治疗至关重要。
在近期研究中,Sun等人成功将小分子染料与黑色素纳米粒子结合,形成用于喉癌NIR-II FL/PA双模态成像的探针(https://doi.org/10.2147/IJN.S284520)。通过NH2-PEG-NH2高分子复合物的表面修饰,显著改善了探针的水溶性、毒性和体内循环性,展现出明显的EPR效应,实现对肿瘤组织的被动靶向。实验结果显示,小鼠注射后8小时,近红外-II荧光信号达到峰值(图17A),肿瘤荧光成像的信号背景比(SBR)约为130.2 ± 6.6(图17B)。同时,肿瘤区域的PA信号也被量化(图17C),为肿瘤诊断提供了更为全面的成像信息。
PDA因其良好的生物相容性、光热转换性能、表面附着力和化学反应活性,常被用于构建肿瘤靶向探针。Wang等人利用PDA在DCNP表面形成涂层,实现了结肠癌的NIR-II FL/NIR-II PA双模态成像(图17D)(https://doi.org/10.1002/adom.202302796)。经尾静脉注射后,探针DCNP-Cu2O@PDA通过EPR效应迅速在结肠肿瘤部位聚集,24小时后NIR-II FL信号达到峰值(图17E)。该探针能与肿瘤内源性H2S反应生成DCNP-Cu2-XS@PDA,导致NIR-II FL信号减弱,而NIR-II PA信号增强,并在48小时达到峰值(图17F)。通过L-蛋氨酸(SAM)和氨基氧乙酸(AOAA)调控内源性H2S的产生,研究人员进一步验证了该探针在不同H2S水平下的双模态成像能力。
Zhang等人则通过π偶联共轭荧光团与聚乙二醇链的连接,合成了近红外-II FL/PA双模态成像探针Flavchrom-4(https://doi.org/10.1021/acsmaterialslett.2c00451)。该探针能够被动靶向卵巢肿瘤组织,并检测内源性β-半乳糖苷酶水平(图17G)。尾静脉注射60分钟后,探针的NIR-II FL信号达到最大值。经β-半乳糖苷酶抑制剂预处理的肿瘤部位FL信号变化不明显,表明探针能被β-半乳糖苷酶有效激活(图17H)。通过三维MSOT横截面成像,发现PA信号强度在注射6小时后达到峰值,证明了该探针在卵巢肿瘤靶向和成像方面的优异性能(图17I)。 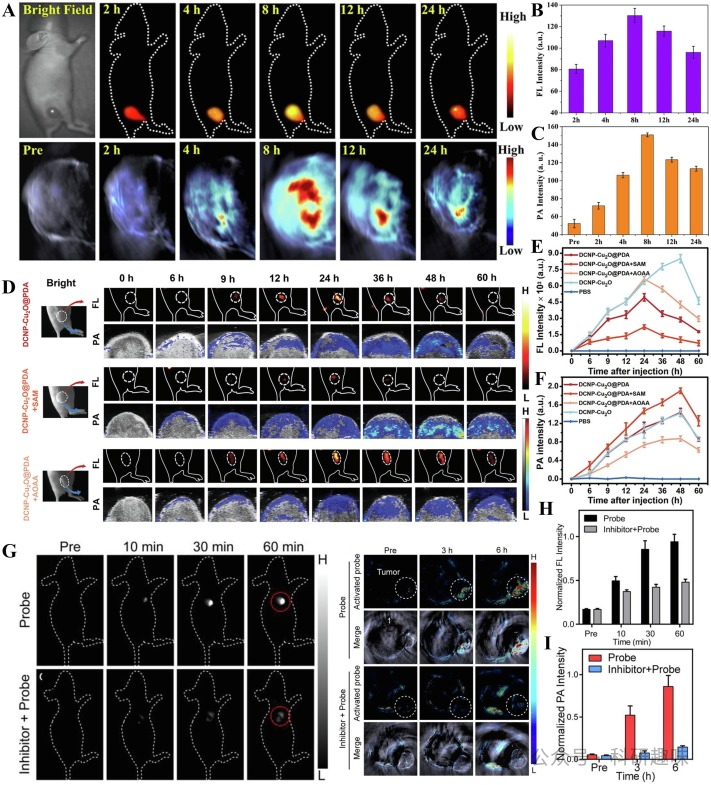 图17.(A)MNPH2的活体近红外-IIFL/PA双模态成像;(B)MNPH2的活体近红外-IIFL信号强度图;(C)MNPH2的活体PA信号强度图;(D)DCNP-Cu2O@PDA组和SAM、AOAA预处理组的体内NIR-IIFL/NIR-IIPA双模态成像;(E)DCNP-Cu2O@PDA组和SAM、AOAA预处理组的体内近红外-IIFL信号强度图;(F)DCNP-Cu2O@PDA组和SAM、AOAA预处理组的活体PA信号强度图;(G)Flavchrom-4的体内近红外-IIFL/PA双模态成像;(H)Flavchrom-4的体内近红外-IIFL归一化信号强度图;(I)Flavchrom-4的体内PA归一化信号强度图;
图17.(A)MNPH2的活体近红外-IIFL/PA双模态成像;(B)MNPH2的活体近红外-IIFL信号强度图;(C)MNPH2的活体PA信号强度图;(D)DCNP-Cu2O@PDA组和SAM、AOAA预处理组的体内NIR-IIFL/NIR-IIPA双模态成像;(E)DCNP-Cu2O@PDA组和SAM、AOAA预处理组的体内近红外-IIFL信号强度图;(F)DCNP-Cu2O@PDA组和SAM、AOAA预处理组的活体PA信号强度图;(G)Flavchrom-4的体内近红外-IIFL/PA双模态成像;(H)Flavchrom-4的体内近红外-IIFL归一化信号强度图;(I)Flavchrom-4的体内PA归一化信号强度图;
Yuan等人通过精心设计的化学合成,将半导体聚合物与靶向肽相结合,成功制备了NIR-II荧光/光声(FL/PA)双模态成像探针SPN-PT和SPN-SP(https://doi.org/10.1186/s12951-022-01249-4)。这些探针分子展现出了与骨肉瘤特定靶点结合的主动靶向能力(如图18A所示)。在980 nm长通滤光片(LP)的条件下,肿瘤区域的近红外-II荧光强度在24小时内逐渐增强,并在24小时时达到最大值,其中SPN-PT在肿瘤中的聚集能力显著优于SPN-SP(如图18B所示)。此外,SPN-PT的二维/三维光声成像显示,注射后4至8小时内信号强度显著上升,24小时时达到峰值(如图18C所示)。尽管NIR-II荧光成像在灵敏度上占据优势,但光声成像技术却能够提供更清晰的肿瘤精细结构信息,为诊断提供有力支持。
Xu等人则通过化学合成手段,制备了基于噻二唑-苯并三唑(TBZ)的多功能NIR-II FL/PA双模态成像探针DTPA-TBZ(https://doi.org/10.1039/D0SC03160G)。该探针外表面被叶酸(FA)修饰的磷脂聚合物所覆盖,能够特异性地与肿瘤细胞膜表面高表达的叶酸受体结合并内化,实现主动肿瘤靶向。在体内注射后,DTPA-TBZ的NIR-II荧光信号在6小时内达到峰值。而在790 nm激光的激发下,其光声信号在1小时内达到峰值,且信号背景比(SBR)高达3.47至8.39(如图18D所示)。DTPA-TBZ所展现出的优异肿瘤主动靶向性和双模态成像能力,为肿瘤的早期诊断提供了有力工具。
Lin研究团队则以聚乙二醇胶束为载体,通过共载NIR-II pH响应探针Fe2+和葡萄糖氧化酶(GOX),成功构建了NIR-II FL/PA双模态成像平台GFL@PM(如图18E所示)(https://doi.org/10.1021/acsnano.3c03279)。在肿瘤的酸性微环境中,GFL@PM通过电荷反转的阳离子化作用,显著增强了在肿瘤部位的聚集能力。同时,GOX催化引发的pH值降低也进一步促进了这一过程。因此,在注射后24小时,GFL@PM组的近红外-II荧光/光声信号强度明显高于未加载Fe2+的GL@PM对照组(如图18F和18G所示)。这项研究为全面优化用于肿瘤诊断的NIR-II FL/PA双模态成像技术提供了一种新的策略。 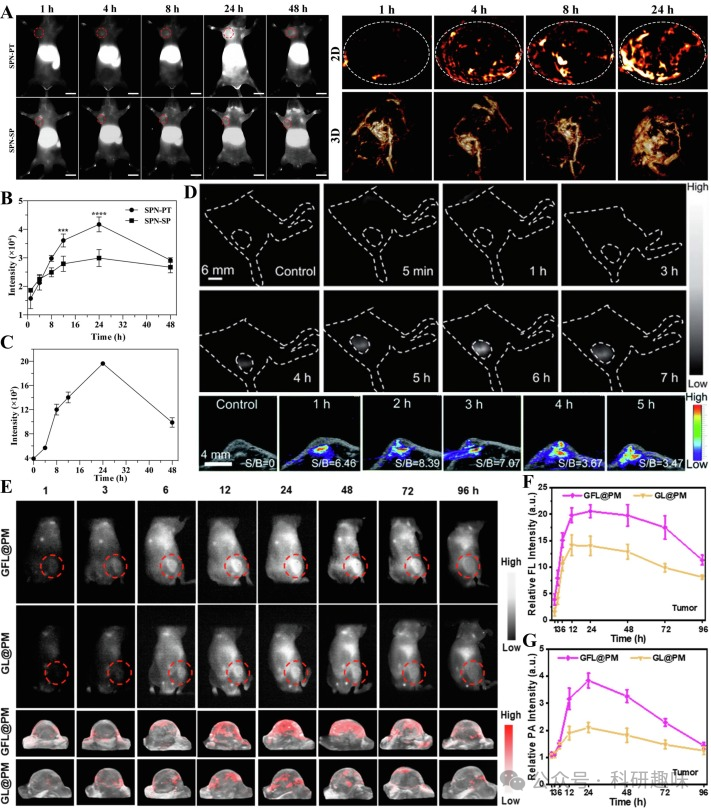 图18.(A)SPN-PT/SPN-SP的活体NIR-IIFL成像和SPN-PT的PA成像;(B)SPN-PT/SPN-SP的体内NIR-IIFL信号强度图;(C)SPN-PT的活体PA信号强度图;(D)DTPA-TBZ的活体NIR-IIFL/PA双模态成像;(E)GFL@PM/GL@PM的体内NIR-IIFL/PA双模态成像;(F)GFL@PM/GL@PM的体内FL信号强度图;(G)GFL@PM/GL@PM的活体PA信号强度图;
图18.(A)SPN-PT/SPN-SP的活体NIR-IIFL成像和SPN-PT的PA成像;(B)SPN-PT/SPN-SP的体内NIR-IIFL信号强度图;(C)SPN-PT的活体PA信号强度图;(D)DTPA-TBZ的活体NIR-IIFL/PA双模态成像;(E)GFL@PM/GL@PM的体内NIR-IIFL/PA双模态成像;(F)GFL@PM/GL@PM的体内FL信号强度图;(G)GFL@PM/GL@PM的活体PA信号强度图;
5.1.2. 血管成像
血管系统作为生命活动不可或缺的部分,在营养输送、代谢废物排除、体温调节、酸碱平衡维持以及免疫防御等方面扮演着核心角色,对维持人体健康及预防疾病至关重要。近年来,近红外-II(NIR-II)荧光探针因其独特的深组织穿透能力而被广泛应用于小鼠血管动态信息的获取。然而,尽管NIR-II荧光波段具有显著的穿透力,但生物组织的散射和吸收作用依然对其图像分辨率和对比度构成挑战。相较之下,光声(PA)成像技术以其更高的组织穿透深度和空间分辨率,能够更精确地描绘血管的形态结构与狭窄程度。随着科学技术的不断进步,NIR-II FL/PA双模态成像技术的应用将日益广泛,为医生准确诊断血管异常相关疾病提供有力支持。
在NIR-II FL/PA双模态血管成像领域,小鼠的后肢、肿瘤、耳朵和大脑成为研究的主要部位。Cheng等人通过Affibody-DAPs探针,成功实现了小鼠后肢及甲状腺肿瘤内血管的NIR-II FL/PA双模态成像(https://doi.org/10.1021/acsnano.7b05966)。在1000 nm长通滤光片下,小鼠后肢股血管清晰可见,分界线处血管宽度经测量为346 μm,与PAI计算所得的300 μm相近,表明两种成像模式在空间分辨率上具有一致性。甲状腺肿瘤成像则揭示了两种模式在血管密度呈现上的相似性,并允许通过信号强度量化血管密度(如图19A所示)。
Li课题组则以TBZ为核心,构建了具备NIR-II FL/PA双模态成像能力的纳米探针BTB,用于小鼠耳部和脑部血管的观测(https://doi.org/10.1039/D1TB02282B)。在1000 nm长通滤光片下,该探针展现出高荧光测量精度和空间分辨率,小鼠耳血管和脑血管的半峰全宽分别为71.67 μm和110.31 μm。此外,PAI所显示的血管结构相较于NIR-II FLI更为精细,为耳部和脑血管疾病的精确成像提供了新方向(如图19B所示)。
Li的研究小组进一步利用Tat-BTNP标记的中性粒细胞,对炎症小鼠的耳部血管异常进行了NIR-II FL/PA双模态成像研究(https://doi.org/10.1021/acs.analchem.1c00690)。注射后,耳部炎症血管的双模态成像信号在2小时后开始增强,并于18小时后达到峰值,显示出探针在实时追踪炎症部位中性粒细胞反应方面的能力。在PAI中,耳朵的血管结构清晰可见,且532 nm激发下的成像分辨率优于840 nm激发(如图19C所示),为监测炎症区域功能细胞的作用和变化提供了有力工具。
Cheng小组则对小鼠后肢进行了NIR-II FL/PA双模态成像研究(https://doi.org/10.1002/adom.201900045)。使用UCNPs@PAA-Azo探针,近红外-II FL成像显示的股血管宽度为497.3 μm,略低于PA成像的558.1 μm,这表明NIR-II成像在分辨率上具有一定优势。然而,PAI的信噪比却是NIR-II FLI的两倍,成像均匀性和细节表现更佳。二维和三维PAI进一步证实了PAA-Azo在增强PA信号方面的能力(如图19D所示)。尽管NIR-II FL/PA双模态成像在血管可视化方面展现出巨大潜力,但目前仍缺乏能够灵敏监测和评估血管内功能障碍的特异性探针,这将是未来研究的重要方向。 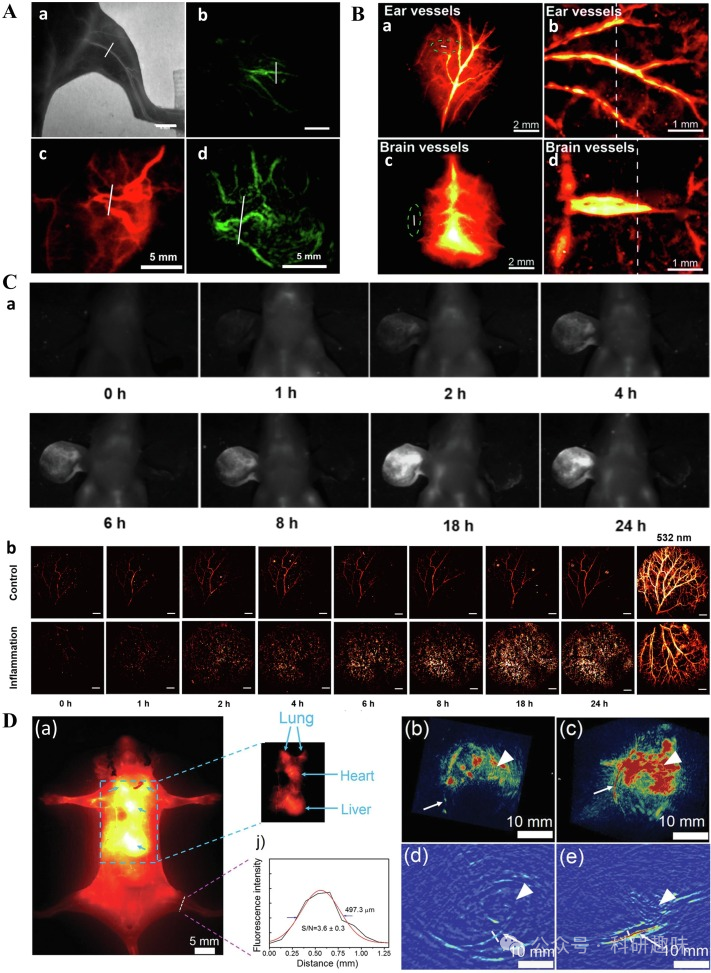 图19.(A)a和b分别为注射Affibody-DAPs后,后肢血管的NIR-IIFL和PA成像;c和d分别为注射Affibody-DAPs后,甲状腺肿瘤血管的NIR-IIFL和PA成像;美国化学学会2017年版权所有;(B)a和b分别为注射BTB后耳血管的NIR-IIFL和PA成像;c和d分别为注射BTB后脑血管的NIR-IIFL和PA成像;(C)a和b分别为注射Tat-BTNP标记的中性粒细胞后耳血管的近红外-IIFL和PA成像;(D)a为注射UCNPs@PAA-Azo后的活体NIR-IIFL图像和荧光强度分布;b和c分别为注射UCNPs和UCNPs@PAA-Azo后的后肢血管三维PA图像;d和e分别为注射UCNPs和UCNPs@PAA-Azo后的后肢血管二维PA图像;
图19.(A)a和b分别为注射Affibody-DAPs后,后肢血管的NIR-IIFL和PA成像;c和d分别为注射Affibody-DAPs后,甲状腺肿瘤血管的NIR-IIFL和PA成像;美国化学学会2017年版权所有;(B)a和b分别为注射BTB后耳血管的NIR-IIFL和PA成像;c和d分别为注射BTB后脑血管的NIR-IIFL和PA成像;(C)a和b分别为注射Tat-BTNP标记的中性粒细胞后耳血管的近红外-IIFL和PA成像;(D)a为注射UCNPs@PAA-Azo后的活体NIR-IIFL图像和荧光强度分布;b和c分别为注射UCNPs和UCNPs@PAA-Azo后的后肢血管三维PA图像;d和e分别为注射UCNPs和UCNPs@PAA-Azo后的后肢血管二维PA图像;
5.1.3.其他部位的成像
除了上述常规区域的NIR-II FL/PA双模态成像技术外,科研人员还通过采用特定的荧光探针标记不同的生物大分子或组织结构,实现了对其他病灶区域的成像,为生物医学信息的获取提供了更全面、更精确的视角。
Wang研究团队成功合成了针对动脉粥样硬化的NIR-II FL/PA双模态成像探针ICG@PEG-Ag2S。(https://doi.org/10.1039/C6NR00060F)主动脉的近红外-II荧光成像结果表明,该探针能够选择性地聚集在动脉粥样硬化斑块区域。通过免疫组化切片分析,该探针能够清晰地检测出动脉粥样硬化斑块,并揭示了斑块边缘富含巨噬细胞的现象(如图20A所示)。在载脂蛋白E基因敲除小鼠模型中,注射ICG@PEG-Ag2S后,PA信号强度随时间逐渐增加(如图20B所示),并在3小时后达到空白组的6倍,且信号持续长达24小时(如图20C所示)。这一成果为临床动脉粥样硬化疾病的靶向成像提供了一种新的策略。
Li研究团队则开发了一种用于近红外-II FL/PA双模态肝脏成像的黑磷纳米探针BP@lipid-PEG(https://doi.org/10.1021/acsami.9b05825)。静脉注射后仅5分钟,肝脏区域的NIR-II FL信号即达到峰值。随后,随着探针逐渐被肝脏代谢,荧光强度逐渐降低。PA成像显示,8小时后信号强度达到最大,而48小时后探针被肝脏完全代谢(如图20D所示)。BP@lipid-PEG探针具有优异的生物降解性和高信噪比。
Tang研究小组利用AIE-4PEG550探针实现了对小鼠肾脏纤维化的近红外-II FL/PA双模态成像(https://doi.org/10.1002/adma.202206643)。在正常小鼠中,注射探针后4分钟,肾脏和膀胱的近红外-II FL信号达到最大值,随后在40分钟内逐渐消失。PA成像结果与NIR-II FL信号趋势相吻合(如图20E所示)。值得注意的是,肝脏中几乎无信号出现,表明探针主要通过肾脏系统清除。此外,利用FA诱导的肾脏纤维化小鼠模型显示,探针能够在肾脏和膀胱中长期累积。由于肾纤维化小鼠的尿液代谢速度较慢,其肾脏中的近红外-II FL/PA信号高于正常小鼠,而膀胱中的信号则相对较低。最后,通过三维PA成像技术,研究人员清晰地描绘了小鼠肾脏和膀胱的轮廓(如图20F所示)。这项研究通过近红外-II FL/PA双模态成像技术有效地区分了正常肾脏和纤维化肾脏,为相关疾病的诊断和治疗提供了有力支持。 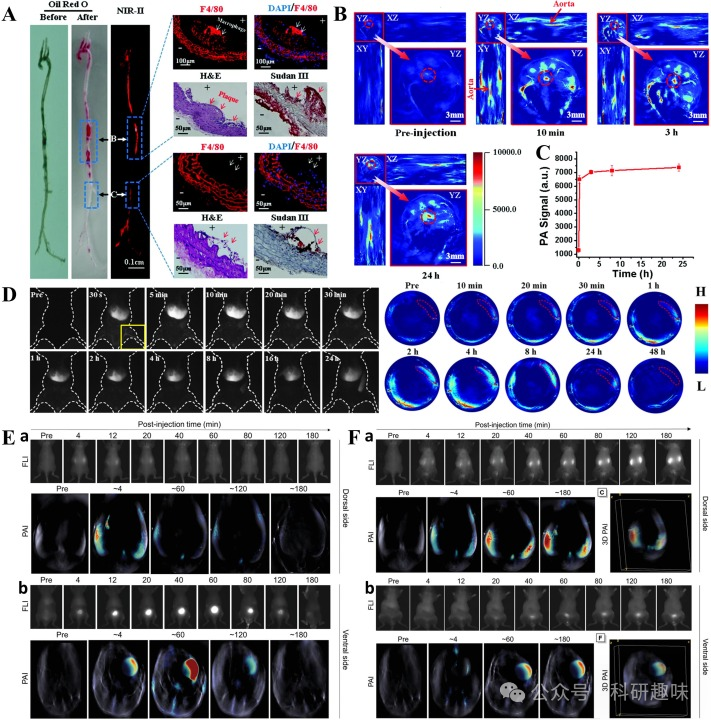 图20.(A)注射ICG@PEG-Ag2S后动脉粥样硬化斑块的NIR-IIFL成像和免疫组化切片图像;(B)注射ICG@PEG-Ag2S后的主动脉PA成像;(C)注射ICG@PEG-Ag2S后的主动脉PA信号强度图;(D)注射BP@lipid-PEG后肝脏的NIR-IIFL/PA双模态成像.(E)a和b分别为正常小鼠注射AIE-4PEG550后肾脏和膀胱的NIR-IIFL/PA双模态成像;(F)a和b分别为肾纤维化小鼠注射AIE-4PEG550后肾脏和膀胱的近红外-IIFL/PA双模态成像;
图20.(A)注射ICG@PEG-Ag2S后动脉粥样硬化斑块的NIR-IIFL成像和免疫组化切片图像;(B)注射ICG@PEG-Ag2S后的主动脉PA成像;(C)注射ICG@PEG-Ag2S后的主动脉PA信号强度图;(D)注射BP@lipid-PEG后肝脏的NIR-IIFL/PA双模态成像.(E)a和b分别为正常小鼠注射AIE-4PEG550后肾脏和膀胱的NIR-IIFL/PA双模态成像;(F)a和b分别为肾纤维化小鼠注射AIE-4PEG550后肾脏和膀胱的近红外-IIFL/PA双模态成像;
5.2. 肿瘤治疗
肿瘤治疗是一个多样化的领域,包括各种治疗方法和策略。利用近红外-II荧光/PA双模态成像技术治疗肿瘤的主要方法包括图像引导手术和纳米给药系统(DDs)。
5.2.1. 手术导航
近红外-II FL/PA双模态成像技术在图像引导手术应用中展现出显著价值。在手术过程中,该技术不仅能为外科医生提供实时的解剖结构和功能数据,实现手术的精准监控和导航,还有助于更准确地定位并切除病灶,从而优化手术策略和结果,降低并发症和复发率,提升手术成功率和患者的生活质量。然而,当前在无创区分病变区域与正常组织边界方面仍面临挑战。
Chen等人借助NIR-II FL/PA双模态成像技术,成功实现了小鼠前哨淋巴结转移瘤和足底原发肿瘤的精准切除(https://doi.org/10.1021/acs.analchem.2c01241)。首先,通过三维MSOT成像技术精确确定了肿瘤的位置(如图21A所示)。接着,在手术前将探针TX-APN@BSA注入小鼠足底,观察到肿瘤区域呈现出强烈的近红外-II荧光信号。在图像引导下,他们成功实施了第一次手术以切除淋巴结转移瘤,并在随后的第二次手术中切除了原发性足底肿瘤,验证了探针分子在引导小鼠肿瘤切除过程中的准确性(如图21B所示)。
类似地,Zeng等人也利用类似方法指导了肝脏肿瘤切除术(https://doi.org/10.1021/acs.analchem.0c01596)。在手术前,通过三维MSOT成像技术实现了肝脏肿瘤的定位和大小评估(如图21C所示)。由于生物发光和组织光散射的影响,肿瘤及其边缘的精确位置难以确定。因此,他们将探针溶液喷洒在肝组织上,由肿瘤内的APN激活后发出强烈的NIR-II信号。这些肿瘤边缘产生的荧光信号为手术的切除提供了明确指导(如图21D所示)。
BH-NO2@BSA作为一种可激活的近红外-II FL/PA双模态成像探针,为术前和术后的图像引导手术提供了新的思路。此外,Cheng的研究小组利用UCNPs@PAA-Azo探针实现了骶骨和腘窝淋巴结的精确切除(https://doi.org/10.1002/adom.201900045)。将探针注入小鼠足底后,10分钟即可获得骶骨和腘窝淋巴结的PA信号,而腘窝淋巴结的NIR-II FL信号则在30分钟后被收集。探针的PAI技术提供了更高的时间分辨率(如图21E所示),使得淋巴结的边缘在10分钟内即可被清晰分辨,从而降低了手术过程中的失血风险,提高了手术引导的切除成功率(如图21F所示)。 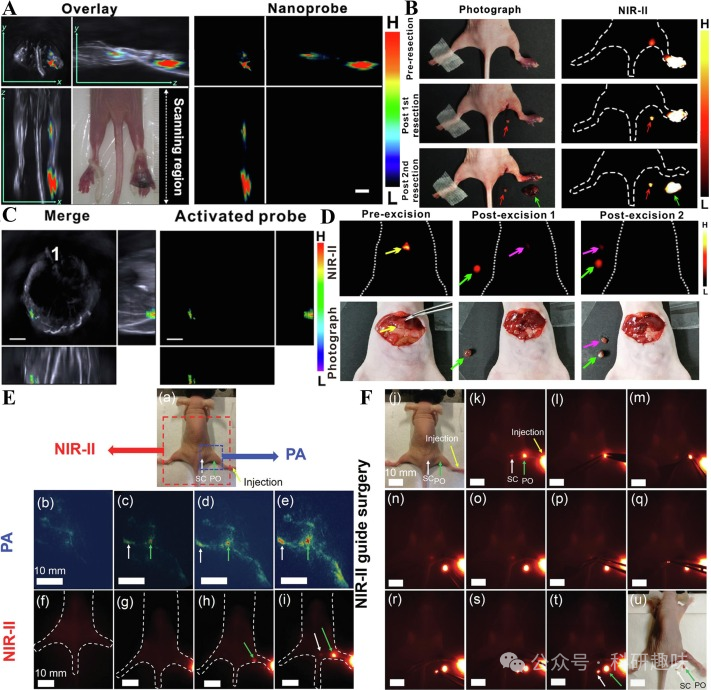 图21.(A)注射APN@BSA后前哨淋巴结转移瘤和足底原发肿瘤的PA成像;(B)注射APN@BSA后前哨淋巴结转移瘤和足底原发肿瘤的近红外-IIFL成像和图像引导下的肿瘤切除术;(C)BH-NO2@BSA引导下手术切除肝脏肿瘤的PA成像;(D)BH-NO2@BSA在肝脏上的近红外-II荧光成像以及手术引导下的肿瘤切除.(E)a为UCNPs@PAA-Azo的NIR-IIFL/PA双模态成像区域示意图;b-e分别为探针在0、10、30和120分钟时的PA成像;f-i分别为探针在0、10、30和120分钟时的NIR-IIFL成像;(F)j是图像引导下手术切除淋巴结的位置示意图;k-u是UCNPs@PAA-Azo引导下切除淋巴结的过程;
图21.(A)注射APN@BSA后前哨淋巴结转移瘤和足底原发肿瘤的PA成像;(B)注射APN@BSA后前哨淋巴结转移瘤和足底原发肿瘤的近红外-IIFL成像和图像引导下的肿瘤切除术;(C)BH-NO2@BSA引导下手术切除肝脏肿瘤的PA成像;(D)BH-NO2@BSA在肝脏上的近红外-II荧光成像以及手术引导下的肿瘤切除.(E)a为UCNPs@PAA-Azo的NIR-IIFL/PA双模态成像区域示意图;b-e分别为探针在0、10、30和120分钟时的PA成像;f-i分别为探针在0、10、30和120分钟时的NIR-IIFL成像;(F)j是图像引导下手术切除淋巴结的位置示意图;k-u是UCNPs@PAA-Azo引导下切除淋巴结的过程;
5.2.2. 药物递送
化疗作为目前临床治疗肿瘤的主要手段之一,尽管效果显著,但传统给药方式面临药物利用率低和肿瘤靶向性差的挑战。化疗药物在杀灭肿瘤细胞的同时,不可避免地损害正常细胞,导致诸如过敏、呕吐、脱发、骨髓抑制和肝肾功能异常等严重副作用。随着纳米材料和肿瘤学研究的飞速进步,药物递送系统(DDS)在肿瘤治疗中显示出巨大潜力。DDS通过提高药物溶解度、改善肿瘤靶向性、增强药物稳定性和利用率,并降低药物剂量和毒副作用,为肿瘤治疗带来了新希望。
纳米DDS凭借其独特的尺寸、形貌可控性和易于修饰的特点,能有效封装、吸附或共价交联亲水/疏水药物分子,成为药物递送领域的研究热点。其中,NIR-II FL/PA双模态成像探针在监测给药过程中的不良反应、药物在体内的生物分布以及评估药物疗效方面展现出独特优势。
Fan研究小组开发了一种由单波长激光触发的多功能药物载体P(DPP-BT/DOX)(https://doi.org/10.1002/adfm.201901480)。该载体利用有机相变材料实现了有机小分子染料DPP-BT和化疗药物多柔比星(DOX)的负载,并通过FA功能化两亲分子实现肿瘤主动靶向。DPP-BT不仅作为NIR-II FL/PA双模态成像对比剂,还兼具光热剂功能。在730纳米激光照射下,DPP-BT产生的热量导致纳米粒子相变,释放DOX,发挥多重抗肿瘤作用(图 22A)。这一智能DDS为癌症的诊疗一体化提供了有力支持。
Yu研究小组则合成了具有近红外-II FL/PA双模态成像功能的新型AIE分子TST(https://doi.org/10.1002/advs.202104793)。TST、喜树碱酯化合物和腺苷受体拮抗剂AZD4635被自组装到药物载体CAT-NP中。纳米粒子进入癌细胞后,喜树碱酯化合物被降解释放TST,加速光热转换,有利于PA成像。释放的喜树碱抑制DNA拓扑异构酶I,发挥抗癌作用;而AZD4635则维持免疫细胞活性,促进肿瘤细胞杀伤(图 22B)。
Li课题组成功构建了无载体纳米药物CA@ICG-MTX,包含ICG、甲氨蝶呤和氯法拉滨(https://doi.org/10.1021/acsami.0c09090)。该纳米药物具有可激活、自靶向和超长循环等特点,通过FA受体促进肿瘤细胞吸收。在酸性肿瘤微环境和近红外光刺激下,纳米药物裂解释放药物,实现联合化疗。NIR-II FL/PA双模态成像技术实时监测纳米药物在肿瘤部位的积累情况(图 22C)。
Stang研究小组将小分子染料和离散铂(II)金属环嵌入黑色素纳米粒子,构建出具有近红外-II FL/PA双模态成像特性的纳米载体(https://doi.org/10.1073/pnas.1908761116)。黑色素点高比表面积和PCE特性不仅提升药物装载量,还将热量转化为PA信号,用于肿瘤治疗引导。在肿瘤细胞中,纳米粒子裂解释放铂(II)金属环,与DNA结合抑制肿瘤细胞增殖(图 22D)。
此外,Wu小组开发的双响应探针QM@EP(https://doi.org/10.1016/j.biomaterials.2022.121468)和BM@EP(https://doi.org/10.1002/adhm.202201544),分别携带炎性囊泡抑制剂MCC950和二氢杨梅素,为溃疡性结肠炎的治疗提供了新思路,为生物标记响应DDS的研究提供了重要见解(图 16C 和 16D)。 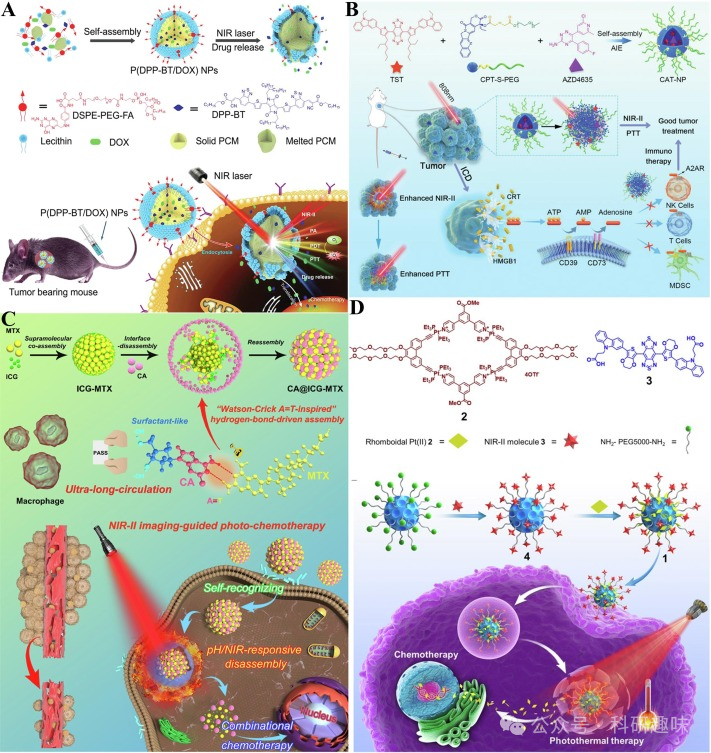 图22.(A)P(DPP-BT/DOX)制备和肿瘤靶向治疗示意图.(B)CAT-NP制备和肿瘤靶向治疗示意图.(C)CA@ICG-MTX的制备和肿瘤靶向治疗示意图.(D)纳米载体1的制备和肿瘤靶向治疗示意图;
图22.(A)P(DPP-BT/DOX)制备和肿瘤靶向治疗示意图.(B)CAT-NP制备和肿瘤靶向治疗示意图.(C)CA@ICG-MTX的制备和肿瘤靶向治疗示意图.(D)纳米载体1的制备和肿瘤靶向治疗示意图;
6. Conclusion and outlook
近红外-II FL/PA双模态成像探针,作为一项尖端的生物医学成像技术,融合了近红外-II荧光成像(FLI)和光声成像(PAI)两种模态的优势,为疾病诊断和治疗提供了更为精准的信息。相较于传统的单模态成像技术,近红外-II FL/PA双模态成像展现出更高的灵敏度和特异性,能够生成高对比度和高分辨率的生物图像。其无创、高保真、高时空分辨率等特点,使得该技术能够实时动态地监测活体组织和器官,同时保持生物体的正常生理功能。因此,开发近红外-II FL/PA双模态成像探针对于深入理解生理过程和疾病机制具有举足轻重的意义。
在探讨近红外-II FL/PA双模态成像探针的设计策略时,我们详细阐述了三种不同方法。其中,比率测量探针因其出色的抗环境干扰能力和定量分析能力,在未来的生物医学研究和临床诊断中展现出更为广泛和可靠的应用前景。此外,我们还系统地梳理了近红外-II FL/PA双模态成像探针的分类,从有机材料到有机-无机纳米杂化材料,材料的多样性不仅为科学研究提供了丰富的工具和方法,也推动了多学科的交叉融合。探针材料的发展将围绕高亮度、低毒性、可降解、性能强、合成简单等方向展开。
针对可激活的NIR-II FL/PA双模态成像探针的研究进展,我们进行了深入探讨。目前已知的生物标志物和微环境因素种类繁多,而现有的近红外-II FL/PA双模态成像探针仅覆盖了其中的一小部分。因此,开发更多种类的可激活探针,以满足不同疾病诊断和监测的需求,成为当前研究的重点。
在回顾近红外-II FL/PA双模态成像探针的生物医学应用时,我们注意到该技术主要应用于体内成像和肿瘤治疗。尽管在药物发现、神经科学和再生医学等领域的应用潜力巨大,但仍需进一步开发。
尽管近红外-II FL/PA双模态成像探针具有诸多优势,但在实际应用中仍面临一系列技术挑战。基于这些挑战,我们对该技术的未来发展提出以下建议:首先,探针的设计和合成需要精确控制,以确保其光学特性和生物相容性;其次,提高探针的稳定性和靶向性是提高成像可靠性和准确性的关键;第三,尽管某些近红外-II FL/PA双模态成像探针有望应用于临床,但从实验室到临床的转化仍面临诸多挑战;第四,降低先进成像技术和探针的生产成本,以推动其在资源有限的医疗环境中的广泛应用;第五,增强探针的多功能性,以充分释放其在生物医学中的潜力;第六,进一步关注比率计量近红外-II探针的开发,以减少信号背景的干扰;最后,提高成像仪器的性能,以满足近红外-II生物通道双模式成像探针的更高要求。
总之,近红外-II FL/PA双模态成像探针凭借其独特的物理和化学特性以及高量子产率,在生物医学领域展现出广阔的应用前景。随着该技术的不断进步和应用领域的不断拓展,相信它将在未来的生物医学领域发挥更加重要的作用。
参考文献
Pan, W.; Rafiq, M.; Haider, W.; Guo, Y.; Wang, H.; Xu, M.; Yu, B.; Cong, H.; Shen, Y. Recent Advances in NIR-II Fluorescence/Photoacoustic Dual-Modality Imaging Probes. Coordination Chemistry Reviews 2024, 514, 215907. https://doi.org/10.1016/j.ccr.2024.215907.