【Coord.Chem.Rev.】一文足够,最全PDT之肿瘤免疫疗法
光动力疗法和肿瘤免疫疗法的发展
随着高灵敏度单细胞分析技术的飞速发展,我们对错综复杂的肿瘤微环境(TME)的认知达到了前所未有的深度,促使临床策略的核心逐渐聚焦于单细胞水平的肿瘤分层亚群表型解析。针对肿瘤免疫微环境(TIME)的精准干预策略,为实现癌症治疗的个性化与高效化开辟了新途径。尽管免疫疗法的兴起为肿瘤治疗带来了革命性变化,其面临的挑战亦不容忽视,特别是免疫逃逸现象及伴随的免疫相关不良反应,显著制约了免疫疗法的整体疗效。
鉴于此,为了安全且高效地激发机体抗肿瘤免疫反应,免疫疗法往往需与多种治疗手段联合探索。其中,光动力疗法(PDT)凭借其独特的细胞毒性直接作用、对肿瘤血管系统的破坏力及激发强大免疫应答的能力,在弥补当前癌症免疫治疗短板方面展现出巨大潜力。近年来,PDT与肿瘤免疫景观之间的相互作用机制成为研究热点,人们普遍认为,将PDT与靶向肿瘤免疫景观的策略相结合,有望成为抗癌治疗的新“金钥匙”。
然而,传统给药方式在深入穿透致密肿瘤组织及减少正常组织毒性方面存在局限,这大大限制了PDT的临床应用前景。为此,基于多功能纳米材料的给药系统应运而生,它们不仅实现了药物释放的精准调控,还能有效促进与其他治疗手段的协同效应,成为连接PDT与免疫治疗的桥梁。
本文首次系统性地回顾了以纳米材料为媒介的光动力免疫疗法在靶向调控肿瘤相关免疫景观中的协同作用机制。遵循“基础研究向临床应用转化”的理念,我们深入剖析了这些纳米材料的协同治疗分子机制,详细阐述了其设计原理与方法论,并广泛探讨了这些前沿纳米技术在最新临床应用中的先进实例、面临的转化挑战以及未来发展趋势。这不仅为光动力免疫疗法的进一步优化提供了理论依据,也为肿瘤治疗领域的创新发展指明了方向。
近十年来,癌症治疗领域见证了从传统广谱抗癌药物向基于单克隆抗体的免疫疗法(Immunotherapy, IT)的深刻转变,这一变革旨在通过刺激或激活肿瘤特异性免疫反应,揭示并利用肿瘤免疫微环境(Tumor Immune Microenvironment, TIME)中的治疗潜力,以促进患者的整体健康恢复。免疫环境,这一复杂网络,涵盖了影响抗癌免疫反应的多重因素,随着高分辨率单细胞技术的飞速发展,临床策略已逐渐从组织病理学层面的肿瘤亚型分类,细化至单细胞表型的精准分层,为个体化治疗方案的制定提供了更为精确的指导。
自2011年首个免疫检查点阻断剂(Immune Checkpoint Blockade, ICB)药物伊匹单抗(ipilimumab)获得美国食品药品监督管理局(FDA)批准以来,IT已成为癌症治疗领域的核心支柱。然而,随着临床实践的深入,IT的局限性也逐渐显现,包括主动癌症疫苗和被动免疫疗法(如针对PD-1或CTLA-4的免疫检查点抑制剂ICIs,以及CAR-T疗法)在内的多种策略,均面临半衰期短、患者响应率低(约20%)、脱靶效应及免疫相关不良事件(irAEs)等挑战。因此,探索与其他疗法的联合应用,以减轻副作用或优化药物剂量,成为抗肿瘤治疗研究的热点。
光动力疗法(Photodynamic Therapy, PDT)作为一种临床验证的微创治疗手段,因其基于非侵入性光化学反应诱导局部细胞死亡的特性而备受瞩目。光敏剂(Photosensitizers, PSs)通过复杂的能量与电子转移机制、光化学反应及光物理过程,展现出强大的光生物活性。通过优化PSs在病变区域的选择性聚集及精确控制光照条件,PDT能够最大限度地减少对周围正常组织的损伤。PDT的抗肿瘤机制涉及三个方面:直接的细胞毒性作用、对肿瘤血管系统的破坏,以及诱导机体产生有效的抗肿瘤免疫反应。这一疗法在弥补当前IT领域中的不足,如免疫抑制性微环境及T细胞激活受限等方面,展现出巨大潜力。
PDT与靶向免疫景观疗法的结合,建立在坚实的生物学基础之上。PDT不仅能够触发多种免疫原性反应,生成损伤相关分子模式(DAMPs),进而激发全身性抗肿瘤免疫反应,还能通过增强抗原呈递、缓解免疫抑制等途径,提升治疗效果。然而,单纯PDT治疗亦存在局限性,如诱导免疫抑制因子产生、细胞凋亡加剧,以及在缺氧及免疫抑制性TIME中疗效受限等。因此,将全身性IT作为PDT的辅助疗法,成为提升治疗效果的新思路。
在光动力免疫疗法(Photodynamic Immunotherapy, PDIT)的临床实践中,已取得了一系列令人振奋的成果。例如,首个针对头颈部恶性肿瘤的PDIT药物(PSs“IR700”与人工抗体“Akalux”复合物)已于2020年获批上市。此外,多项临床试验结果显示,PDT治疗后肿瘤及瘤周基质中细胞毒性与调节性T细胞(Tregs)比例显著增加,与ICI联用更可实现协同增效。
然而,PDIT的广泛应用仍面临诸多挑战,主要包括:PSs依赖肿瘤部位氧气生成活性氧(ROS)的限制、对PDIT与免疫系统相互作用机制的不完全理解,以及传统给药方式导致的疗效下降等。为解决这些问题,材料科学的快速发展为PDIT提供了有力支持。纳米材料凭借其独特的理化性质及优势,在改善药物靶向性、延长循环时间、增强肿瘤组织穿透力及减少正常组织损伤等方面展现出巨大潜力。特别是基于荧光共振能量转移(FRET)原理的具有自发荧光特性的生物材料(如功能化上转换纳米粒子UCNPs),能够在低能量激光(近红外光)照射下实现深部光导治疗及图像引导治疗,为PDIT的临床应用开辟了新途径。
Table 1. Photosensitizers (PSs) for cancer therapy.
| Approaches | Typical cases | Strengths | Weaknesses |
|---|---|---|---|
| Classical PSs | First-generation PSs: haematoporphyrin derivatives (HpD), porfimer sodium | good water solubility; well-tolerated by patients at clinical doses | poor photostability; skin photosensitivity; limited absorption of red light when administered intravenously to patients; |
| Second-generation PSs: chlorin, cyanine dyes, phenothiazinium salts | higher PDT efficiency than the first-generation PSs; higher photoconversion efficiency than the first-generation PSs; ease of chemical modification; shorter skin photosensitivity periods | low organisational penetration; therapeutic range is limited to local administration; poor circulation lifetime; undesired self-aggregation | |
| Third-generation PSs: nanomaterials-based PSs | enhanced photosensitivity; high selectivity for tumor; good biocompatibility | cumbersome preparation process and additional quality control considerations; demand for more advanced analysis and purification techniques; massive production and secure implementation continue to pose a significant issue; more expensive than even existing therapies; | |
| Aggregation-induced Emission PSs | Tetraphenylethylene (TPE); cyclooctatetrathiophene (Coth); Tetraphenylethylene and dicyanovinyl moieties (TPEDC) | high quantum yield, large Stokes shift, high signal-to-noise ratios (compared with classic PSs), and tunable emission properties; the luminescence and PDT effect make them simultaneously treating tumor and studying the therapeutic mechanism | widespread biological effects remain to be explored in detail; short wavelength absorption and broad emission; aggregation dependent brightness; high working concentrations makes it unsuitable for in vivo or clinical studies. |
| Activatable PSs | mPEG-GALGLPG-PPa | selective PS accumulation and focused laser irradiation ensuring a highly specific tumor-local PDT response; easier to synthesis, more readily orally accessible, and more stable compared to other advanced drug delivery techniques; high translatability into low-resource settings; | inter-individual variations might hinder the deployment of prodrugs; may not as effective as the parent drug; rapid renal clearance and hepatic metabolism. |
| Innovative PSs | KillerRed, miniSOG | avoiding photobleaching reactions; precise and controlled intracellular localization; highly efficient 1O2 generation; precision targeting and spatial control of PDT; the mechanism of ROS production needs to be further characterized | It is necessary to study the genes encoding PSs for delivery of proteins by tumor-specific delivery systems while overcoming low-expression genes. |
综上所述,对光动力疗法(PDT)与靶向肿瘤相关免疫景观策略的及时且全面的回顾显得尤为重要。本系列文章不仅深入阐述了光动力免疫疗法(PDIT)的基本原理与实际应用案例,还首次通过一系列典型实例,系统地总结了PDT对肿瘤免疫微环境(TIME)中关键反应因子(涵盖细胞因子、反应性免疫细胞亚群及微生物组等)的调控作用。这些反应因子在免疫系统中的复杂互作,为设计高效的纳米材料基PDIT策略提供了科学依据。
鉴于这些反应因子在免疫调节中的不同角色与功能,本系列文章进一步探讨了当前及前沿的策略,旨在指导如何合理地利用纳米材料的独特性质,以优化PDIT的治疗效果。这些策略不仅关注于纳米材料对药物输送效率的提升,还涉及增强药物在肿瘤部位的靶向积聚、促进药物与免疫细胞的相互作用,以及调节免疫反应的时序与强度等多个方面。
此外,本系列文章还深刻剖析了从药物设计到临床转化过程中可能遭遇的关键挑战,如纳米材料的生物相容性、体内稳定性、免疫原性及规模化生产等难题,并针对性地提出了相应的解决方案。同时,对于PDIT纳米材料的未来发展方向,本系列文章也提出了批判性的见解,旨在引导读者全面认识该领域面临的机遇与挑战,激发科研人员对这一重要癌症治疗领域的探索热情与创新思维。
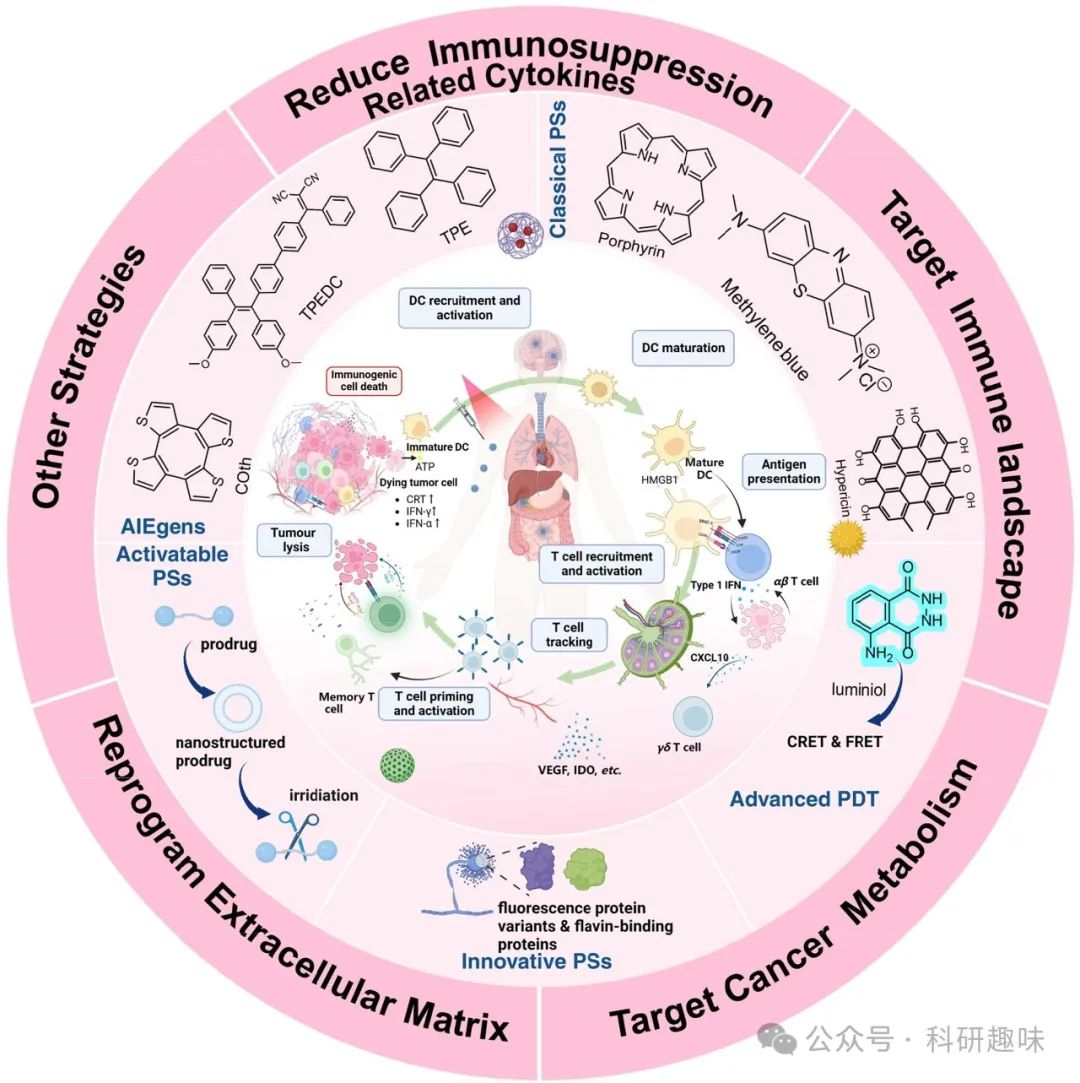 光动力疗法与靶向肿瘤免疫原理和方法相结合的示意图。
光动力疗法与靶向肿瘤免疫原理和方法相结合的示意图。
光动力疗法原理及生物应用
1. 现代医学中的光
光,作为自然界中赋予生命的最初恩赐,其重要性在《创世纪》的神话叙事中便得以彰显,作为创世之初的三大奇迹之一,同时也是推动人类文明进步不可或缺的力量。在自然界光的启迪下,科学界不断探索并应用光的发光机制,利用发光材料作为探针,揭示了众多先前未知的生物化学结构与动态过程,从而深化了对生命活动途径的理解。
从物理学的角度来看,光本质上是一种特定频率范围内的光子流。光源发光,源于其内部电子获取额外能量后的跃迁行为。若能量不足以使电子跃迁至更高能级的轨道,电子则会以加速运动的形式释放能量,以光波的形式辐射出去。1925年,法国物理学家德布罗意进一步提出物质波粒二象性的理论,为理解光在生物医学领域的应用提供了坚实的理论基础。在此框架下,光在生物医学应用中常被视为粒子,其光物理与光化学特性成为研究的核心。
光作为一种外部控制的治疗手段,相较于传统化学药物,展现出了无可比拟的优势,包括精确的时空调控能力和低毒性特点。尤为值得一提的是,光的这些特性可通过调节光源的功率、照射时长乃至波长来精细调控药物的激活与释放过程。光疗通常聚焦于紫外线-可见光(UV-Vis,波长范围200-760纳米)及红外线(IR)区域,而光的组织穿透能力则是选择适当波长的关键因素。这一能力受组织特性、光传输参数与技术、光敏药物的消光系数(ε)及量子产率(Φ)等多重因素影响,同时也需考虑生物大分子(如血红蛋白、黑色素)对光子的吸收竞争。
为优化光的组织穿透深度,现代技术已能利用可降解光纤或微型无线光源替代传统外部光源,实现更为精准的治疗。ε与Φ的乘积,即光敏性指标,是衡量光治疗剂效能的重要参数。值得注意的是,尽管短波长光(<600 nm)在某些情况下会因生物分子的强吸收而导致组织穿透性下降,但最新研究表明,多数光活化化合物均能有效吸收300-450纳米范围内的短波光子,因此,红色及红外光区域成为光疗的优选频段。
追溯历史,光疗作为一种非侵入性治疗手段,其应用可上溯至三千多年前的古文明时期,如古印度、古埃及及中国,均有利用光治疗皮肤疾病及佝偻病的记载。19世纪末,尼尔斯·芬森(Niels Ryberg Finsen)开创性地运用光辐射治疗寻常狼疮,标志着现代光疗法的诞生。随后,赫尔曼·冯·塔佩纳与杰西内克等人通过曙红与白光联合疗法成功治疗皮肤癌,进一步推动了光疗的发展。进入20世纪60年代,蓝光疗法在治疗新生儿高胆红素血症方面的巨大成功,更是光疗史上的里程碑事件。自此以后,基于激光技术的各类治疗剂与设备不断涌现,广泛应用于临床前研究与临床实践中,开启了光疗新时代的大门。
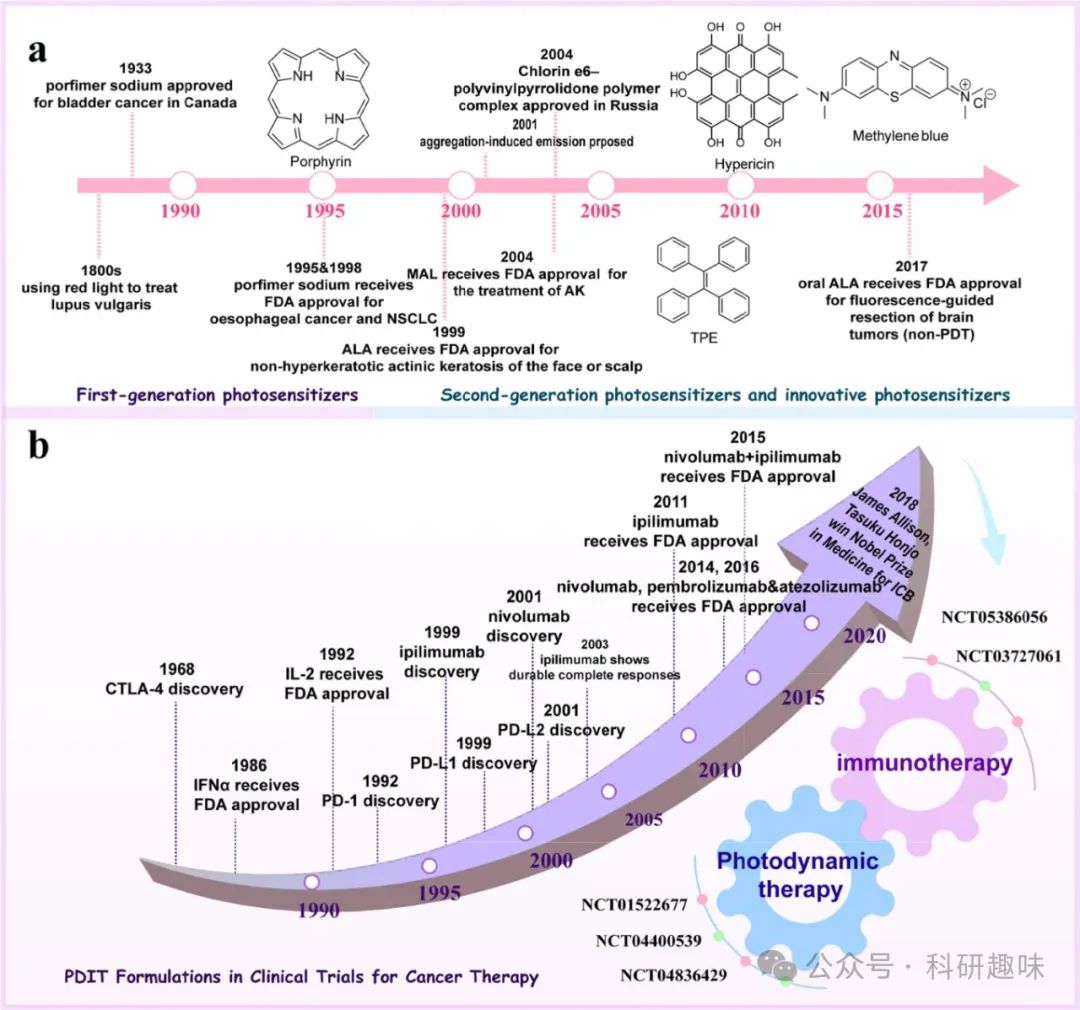
图 1. 光动力疗法光敏剂(a)和免疫疗法(主要是免疫检查点抑制剂,b)的监管审批时间表和关键里程碑,以及光动力免疫组合疗法的未来发展方向。
2. 光治疗及其原理
光疗作为一种先进的医疗手段,其核心在于将低强度、无害的光线与特定的外源性光敏物质(Photosensitizer, PS)结合,以治疗多种疾病。这一过程主要涵盖光动力疗法(Photodynamic Therapy, PDT)与光热疗法(Photothermal Therapy, PTT)两大领域。PDT的设计精妙地利用了三个关键要素的相互作用:首先是PS,其次是能与PS吸收光谱匹配的光源,最后是氧气环境。
在理想状态下,PS能够特异性地在肿瘤组织区域富集,并通过精确控制的光源激发,引发其电子能级的跃迁。雅布隆斯基图(Jablonski Diagram)为我们提供了一个直观理解这一过程的工具。在基态(S0),PS分子中的两个电子占据低能轨道,且自旋方向相反,形成稳定的单电子态。当PS吸收光子能量后,一个电子被激发至高能态,形成不稳定的激发单重态(S1),此状态寿命短暂(约10^-6秒)。
在S1态,电子自旋方向相同,经历弛豫过程,可能通过系统间交叉(Intersystem Crossing, ISC)跃迁至更为稳定的激发三重态(T1),其寿命显著延长(约10^-2秒)。在T1态,电子可经历辐射衰减,释放荧光能量(磷光),这一过程常用于生物成像的引导。另一方面,非辐射衰减则导致局部温度升高,产生热能与机械能,如热膨胀和压力波,这些效应在PTT或光声成像(Photoacoustic Imaging, PAI)中发挥关键作用。
尤为重要的是,通过ISC过程,T1态的电子自旋方向反转,使得其能够引发一系列化学反应。一方面,T1态可直接或间接促进活性氧物种(Reactive Oxygen Species, ROS)的生成(第一类机制),或是通过能量转移生成单线态氧(^1O2)(第二类机制),这些强氧化性物质能有效破坏肿瘤细胞结构,实现PDT的治疗效果。
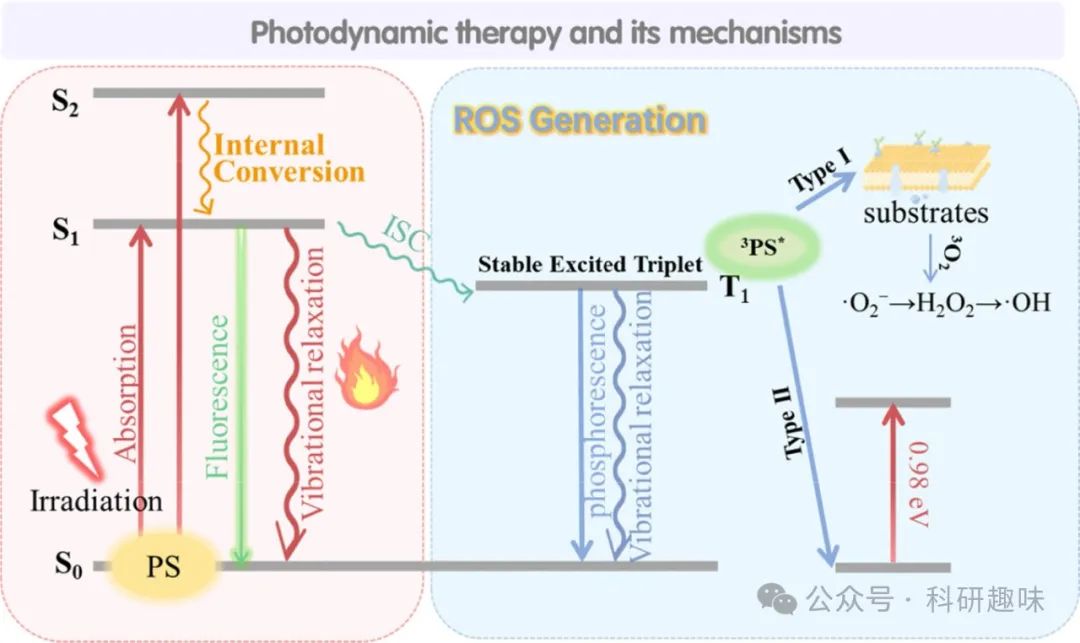
图 2. 显示光疗原理的 Jablonski 图。在照射下,PS 的电子吸收光子的能量并发生一系列能级转换,从而引发化学反应,促进 ROS(I 类机制)或 1O2 与氧(II 类机制)的产生,从而杀死肿瘤细胞。
在光动力疗法(PDT)的I型机制中,处于三重激发态(T1,3PS* )的光敏剂(PS)通过质子或电子转移过程与邻近的生物分子底物(如细胞膜组分、蛋白质、脂质等)相互作用,导致自由基阴离子与自由基阳离子的生成。这些初级自由基进一步参与化学反应链,依次生成超氧阴离子自由基(O2•-,如方程式3所示)、过氧化氢(H2O2,方程式4)以及最为活跃的羟自由基(•OH,方程式5)。


尽管超氧阴离子自由基(O2•-)本身毒性相对较低,不足以直接造成显著的氧化性损害,但在超氧化物歧化酶(SOD)催化下或通过单电子还原途径转化为H2O2时,其代谢平衡可能被打破,进而生成高细胞毒性的•OH。


另一方面,PDT的II型机制则依赖于3PS* 与基态氧分子(3O2)之间的能量转移,由于两者电子自旋多重性匹配,3PS*能有效激发3O2至单线态,生成高活性的单线态氧(1O2)。此过程需克服约0.98 eV的能量差,因此要求三重态PS的能量水平必须高于此阈值。
1O2以其高度亲电性著称,是PDT诱导细胞毒性的关键因子之一。鉴于其在生物环境中极短的半衰期(<0.04 μs)和有限的作用半径(<0.02 μm),PDT的细胞毒性效应高度局限于PS分子附近区域,从而确保了治疗过程对周围正常组织的安全性。
值得注意的是,PDT过程中I型和II型反应往往并存,且两者之间的相对贡献受PS种类、底物特性、氧气浓度以及PS与底物间亲和力等多重因素影响。鉴于多数PS主要通过II型机制发挥作用,氧气成为PDT不可或缺的要素。
相较于光热疗法(PTT),PDT以其较低的能量需求、独特的治疗机制、良好的安全性及操作简便性,在癌症治疗领域展现出越来越大的应用潜力。近年来,PDT因其独特的优势,在癌症治疗领域内日益受到重视与青睐。
3. 用于癌症治疗的光敏剂 (PS)
在光疗领域,光敏剂(PS)的高效捕光能力是确保治疗效果的关键。因此,我们倾向于采用高灵敏度但低强度的光源进行照射,这一选择直接关联到PS的性能对治疗效果的深远影响。近期综述已深入探讨了理想PS应具备的核心特性,这些特性可概括为以下几点:
- 1. 高效生成活性氧物种(ROS):PS需能有效触发生物系统中ROS的产生,这些高反应性的分子对于细胞损伤和肿瘤抑制至关重要。
- 2. 组织穿透深度与波长匹配:光疗通常选用红光(620-750 nm)、近红外I区(750-1000 nm)及近红外II区(1000-1350 nm)等波长,以最大化利用组织的光学窗口(600-900 nm)。理想的PS应在此波长范围内表现出优异的吸收特性,以平衡穿透深度与ROS生成效率的矛盾——短波长穿透力有限,而长波长则可能因能量不足而难以有效激发ROS生成。
- 3. 生物相容性与靶向性:PS应具备无细胞毒性的特性,并能在肿瘤组织中特异性地富集,同时确保从非目标组织中的快速清除,以减少对正常细胞的潜在伤害。
- 4. 合成便捷与高效:理想的PS应拥有简短的合成路径、易于操作的工艺流程以及高产量的生产能力,这对于临床应用的推广具有重要意义。
- 5. 化学稳定性与储运便利性:PS在存储和运输过程中应保持稳定,不易分解或变性,以保证治疗时的有效性和安全性。
截至目前,已有多种PS被探索并应用于临床或临床前光动力疗法中,其中,以四吡咯结构(如卟啉类化合物)为代表的PS因其大型共轭结构能有效吸收光能并高效生成单线态氧而备受瞩目。此外,其他新型光活性材料,诸如硼-二吡咯甲烷、氰基染料、富勒烯、半导体纳米颗粒以及聚集诱导发射荧光染料等,也展现出了巨大的应用潜力,正逐步成为光疗领域的新兴力量。这些材料的引入不仅丰富了光疗手段的选择,也为未来精准医疗和个性化治疗提供了更多可能性。
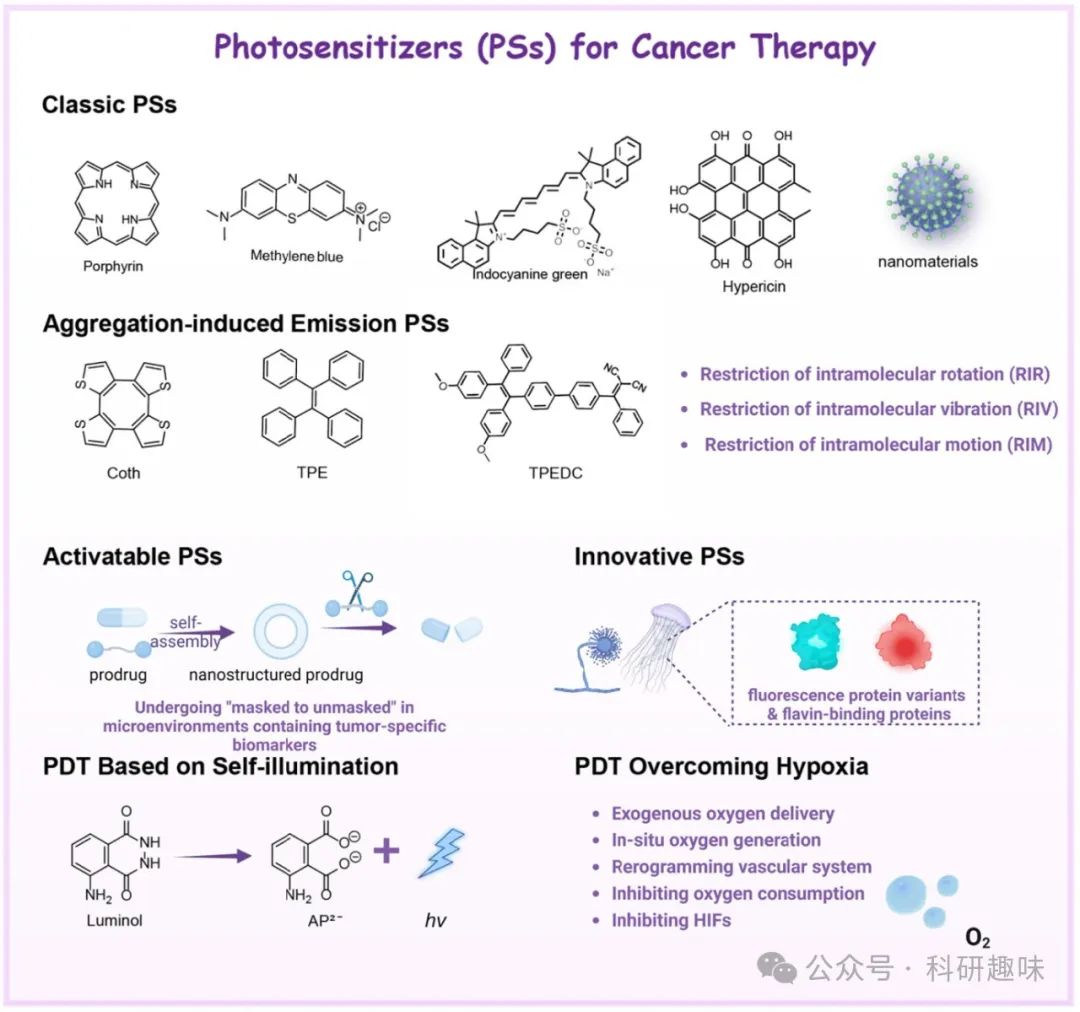
Fig. 3. 癌症治疗 PS 的分类和典型示例示意图。
Table 2. Approaches to PDT overcoming hypoxia.
| Approaches | Typical cases | Effectiveness | Limitations |
|---|---|---|---|
| Exogenous O2 delivery | hemoglobin (Hb) | O2 carriers in the blood ; excellent ability to overcome biological barriers; delayed uptake by the monocyte-phagocytic system | (1) High nephrotoxicity and neurotoxicity ; (2) Susceptible deformation; (3) O2 carried by Hb is not released efficiently in acidic TME as affected by PH . |
| perfluorocarbons (PFC) | good oxygen solubility | (1) Low polarity, requires mixing with surfactants to prepare ; (2) High concentrations of surfactants can cause side effects; (3) O2 level which PFC released is in a linear relationship with arterial partial pressure, so the patient must to be in a highpressure O2 state | |
| metal–organic frameworks (MOFs) | high porosity | biosafety to be further studied . | |
| in situ oxygen generation | catabolism of endogenous H2O2 using Catalase or nanoenzymes with CAT-like activity | excessive H2O2 in the TME; tumor-specific | (1) CAT preparation and purification processes are complex and costly; (2) CAT-like nanoenzymes are mostly based on precious metals, and high concentrations lead to serious side effects ; (3) Limited H2O2 content of tumor cells. |
| bionic photosynthesis (conversion of water to oxygen by protists, bacteria) , ; water decomposition catalyst , , ; metal peroxide | continuous production of O2 with H2O from cells without additional chemical reactions | Significant biosafety challenges. | |
| reduction of oxygen consumption | ATO, Metformin (MET), carrying NO donors | blocking the respiratory electron transport chain inhibition of endogenous O2 consumption , ; inhibition of mitochondrial-associated oxidative phosphorylation (OXPHOS) | Tumors are primarily based on anaerobic glycolysis for energy supply (Warburg effect), partial inhibition of cellular respiration saves only alittle of O2 . |
| normalization of the tumor vascular system and ECM disrupting | normalization of the vascular system based on chemopharmaceutical nanosystems; collagenase; PTT and PDT combination therapy | reducing vascular permeability and increasing oxygen delivery to the tumor site ; disrupting ECM , ; enhancing oxygen supply by promoting vasodilation and blood circulation , | (1) Biosafety of antiangiogenic drugs; (2) Consideration needs to be given to the damage that laser-mediated PTT can cause to the patient’s superficial tissues. |
| Inhibition of the HIFs-related signaling pathway | Small molecule HIF-1α inhibitors , , ; siHIF-1α , | Suppression of side effects such as hypoxia-induced drug resistance | The regulation of HIFs-related signaling pathways is very complex, and the structural domains and molecular mechanisms of their key functions need to be further elucidated. |
3.1. 传统的PSs
在光动力疗法(PDT)的发展中,一系列具有独特化学结构的光敏剂(PS)被深入研究并应用于临床实践中。这些PS包括环状四吡咯类(如卟啉、酞菁及其衍生物、氯素)、氰基染料、吩噻嗪盐(典型代表为亚甲基蓝MB和甲苯胺蓝O TBO)以及硼-二吡咯烷酮/氮-硼-二吡咯烷酮(BODIPYs/aza-BODIPYs),它们因卓越的生物相容性和高效的活性氧物种(ROS)产生能力而备受青睐。
自上世纪70年代以来,PS在癌症治疗中的应用已历经四十余载,其中“血卟啉衍生物”(HpD)作为先驱,开启了PDT的临床探索之路。1978年,Dougherty团队利用氩染料激光器发出的红光成功实现了对皮肤及皮下肿瘤的消融治疗。卟啉,作为一类具有环状四吡咯结构的化合物,因其广泛存在于自然界(如血红蛋白、肌红蛋白、叶绿素)而被誉为“生命色素”。其独特的18π芳香族大环结构,由四个吡咯环通过甲烷桥连接而成,为PDT提供了光吸收与能量转换的基础。
随着研究的深入,HpD的纯化产物porfimer sodium相继获得加拿大及美国FDA的批准,应用于膀胱癌、阻塞性食道癌及非小细胞肺癌(NSCLC)的治疗,标志着第一代PSs的诞生。尽管这些PSs在临床剂量下展现出良好的耐受性和水溶性,但其引起的皮肤光敏反应及有限的红光吸收能力仍待改进。
为解决上述问题,第二代PSs应运而生,包括氯素、细菌氯素、酞菁衍生物等次级卟啉,它们凭借更高的光透射效率、更短的皮肤光敏期及增强的肿瘤选择性,在部分司法管辖区获得了癌症治疗的监管批准。此外,为进一步提升PSs的结合亲和力与功能多样性,研究人员通过引入功能基团(如阳离子基团、靶向肽)对天然环状四吡咯结构进行修饰,开发出多功能PSs。目前,第二代PSs如photocyanine、hemoporfin、photodithazine等已进入临床开发阶段,并在特定地区获准用于癌症治疗。
除卟啉外,多环醌类和吩噻嗪类PS作为二级PS,也在临床上展现出重要价值。多环醌类如菊花黄素、姜黄素,源自天然植物,减少了化学合成的复杂性;而吩噻嗪类不仅具有抗肿瘤活性,还具备荧光特性,可用于淋巴结及肺结节的检测。然而,这些PSs在应用中常面临光线穿透力有限及聚集诱导淬灭(ACQ)效应的挑战。
为克服上述局限,纳米技术的引入为PDT带来了革命性的变化。基于功能性纳米材料开发的三代PSs,不仅增强了光敏性、肿瘤选择性和生物相容性,还通过纳米平台实现了PSs的有效递送与控释。例如,将齐墩果酸(OA)与血卟啉(Hp)整合于纳米增敏剂中,有效减少了Hp的π-π聚集,实现了PDT疗效的显著提升。这一创新策略为PDT的未来发展开辟了新的方向,预示着更加精准、高效的癌症治疗时代的到来。
3.2. 聚集诱导发光PSs
在光动力疗法(PDT)及生物成像领域,具有发光特性的光敏剂(PS)能够通过发光信号精确指示光照射位置,对于提高治疗精准度至关重要。然而,传统PS如卟啉类在生理亲水环境下易于聚集,引发聚合诱导的淬灭效应(ACQ),严重阻碍了其发光性能及ROS生成能力。幸运的是,2001年唐本忠研究团队提出的聚集诱导发光(AIE)现象,为克服ACQ效应提供了新思路。
AIE发光剂(AIEgens)展现出独特的性质:在稀溶液中几乎不发光,而在聚集状态下,由于分子内运动受限(包括旋转、振动等),非辐射衰变路径被阻断,导致荧光显著增强,并伴随增强的ROS生成,即聚集诱导的ROS生成(AIG-ROS)。这一发现为开发高性能PS开辟了新的途径。
当前研究广泛的AIEgens通常具备高度扭曲的分子结构和丰富的旋转振动自由度,如四苯基乙烯(TPE)、环辛四噻吩(Coth)及其衍生物等。其工作机制可通过限制分子内运动(RIM)机制阐释:在聚集状态下,分子内旋转和振动受限,促进了辐射跃迁,从而增强了荧光和ROS生成。实验数据显示,AIE聚集体中的ROS生成效率远高于单体,且激发态单重态与三重态之间的能级差(ΔE_ST)对ROS生成具有重要影响。
AIEgens在肿瘤诊断和治疗中的应用也取得了显著进展。例如,Lou团队利用带正电的TPE-Z探针通过静电作用与DNA结合,实现了对端粒酶活性的高灵敏度检测,为癌症早期诊断提供了新方法(https://doi.org/10.1021/acs.analchem.5b01099)。Min团队则开发了基于TPE-DNA复合探针的膀胱癌尿液microRNA检测技术,利用核酸酶水解释放TPE,通过RIM过程产生强荧光信号,实现了高灵敏度的分子诊断(https://doi.org/10.1021/acsami.5b04821)。
AIEgens以其高量子产率、大斯托克斯位移、优异的光稳定性和生物相容性,在肿瘤成像和PDT中展现出巨大潜力。通过结构调控和功能化修饰,AIEgens能够实现亚细胞器靶向、生物标志物检测和量子产率提升,进一步拓宽其应用范围。例如,通过引入亲脂性阳离子,构建线粒体靶向的AIEgens,利用其跨膜电位实现线粒体高效富集,为肿瘤治疗提供新策略(https://doi.org/10.1021/ja508043q)。
此外,聚合物PS作为另一类重要光敏材料,通过增加重复单元数量和优化结构设计,不仅增强了捕光能力和ROS生成效率,还克服了小分子AIE PS在双光子激发光动力疗法(2PE-PDT)中的局限,展现出更深的组织穿透能力和高度时空精确性。(https://doi.org/10.1021/acsnano.8b08398)这些特性使得聚合物PS在复杂生物环境中的应用前景更加广阔。
尽管AIEgens和聚合物PS在生物医学领域取得了显著进展,但仍面临诸多挑战,如低浓度下的治疗诊断技术开发、生物相互作用机制研究不足以及光谱特性优化等。未来研究需进一步深入探索AIEgens和聚合物PS的分子设计、作用机制及临床应用潜力,推动其在肿瘤诊断和治疗中的广泛应用。
3.3. 可激活PSs
尽管小分子光敏剂(PSs)在特定肿瘤治疗中取得了显著成效,但仍面临靶向性不足及潜在毒性风险的挑战。尤为关键的是,传统光动力疗法(PDT)过程中,非靶标组织中的残留PSs可能因光激发而产生光毒性,导致眼部敏感、皮肤晒伤及炎症反应等不良后果。鉴于此,近十年来,科学界聚焦于光激活前药策略,旨在提升PDT/光热疗法(PTT)的精准性。
相较于纳米颗粒、功能性辅料等复杂载体,光激活前药(即原药)因其合成简便、口服性好及稳定性高而备受青睐。原药在常态下处于非活性状态,几乎无药理效应,但在肿瘤特异性微环境(TME)中,能响应特定生物标志物实现“去掩蔽”,进而在目标位点释放并蓄积活性药物。
通过巧妙设计,利用光物理性质的转变,可激活PSs被构想为类似原药的机制,即PDT激发波长被精心调控,仅当PSs暴露于肿瘤特有的生物标记物时才被激活。TME的独特性,包括快速增殖的癌细胞、多样的基质细胞与免疫细胞、复杂的血管网络及细胞外基质,共同营造了一个低pH、富含炎症生物标志物(如谷胱甘肽、基质金属蛋白酶、组蛋白B等)的微环境,这些特性为PSs前体的精准激活提供了可能。
PSs前体策略超越了传统PSs的双重选择性局限,即不仅依赖于PSs的特异性积累,还需肿瘤相关刺激的触发,从而确保了PDT反应的高度肿瘤局部特异性。这一策略正引领着精准医疗的新方向,尽管原药策略在延长治疗窗口、减少非靶组织损伤方面展现出优势,但患者间的药物基因组学差异可能影响原药释放效果,且原药本身亦可能带来独特问题。
进一步地,针对小分子PSs的快速代谢问题,开发纳米级递送系统成为研究热点。例如,Gao团队通过引入MMP-2敏感肽连接体,成功构建了mPEG-GALGLPG-PPa纳米前药,并整合了吲哚胺2,3-二氧合酶1(IDO-1)抑制剂于同一纳米平台(https://doi.org/10.1021/acs.nanolett.9b04012)。在MMP-2的介导下,前药PSs被激活并深入渗透至肿瘤内部,实现高效PDT与荧光成像。同时,该平台还通过抑制PDT诱导的IDO-1过表达,有效预防了适应性免疫逃逸与肿瘤复发,为增强PDT疗效提供了新的思路。
3.4. 下一代PSs
当前,科研界已深刻认识到肿瘤微环境(TME)的复杂性对传统光动力疗法(PDT)构成的挑战。化学光敏剂(PS)在肿瘤区域内的非均匀分布,使得临床上精准调控光剂量以实现有效PDT同时避免光漂白成为难题。为应对化学PSs的固有问题,基因编码的光毒性蛋白质作为新型PSs的开发平台,展现出了独特潜力。这些蛋白质PSs多源自植物、海洋无脊椎动物等自然生态系统中的生物体,其蛋白质受体经过长期进化,具备高效光能转换能力,并能在特定亚细胞位置表达,实现精确的空间定位。
在蛋白质PSs中,MiniSOG作为研究最为深入的黄素结合蛋白之一,源自含有光、氧和电压(LOV)结构域的蓝光受体,广泛存在于真菌、藻类和细菌中。通过基因工程手段,对拟南芥(A. thaliana)光营养因子2的LOV2结构域进行突变,引入MiniSOG,使其与黄素单核苷酸(FMN)结合,显著提升荧光信号。MiniSOG能够在细胞内精确控制并高效生成单线态氧(¹O₂),这是由于其独特的结构特性,使¹O₂成为主要活性氧种类(ROS),对细胞构成较大威胁。进一步地,通过氨基酸替换(如miniSOGQ102L/V的Q102L突变),减少氢键结合,增强了能量转移效率。此外,Pp2FbFPL30M等改进型黄素结合蛋白通过LOV结构域的优化,实现了更高的量子产率(Φ),为PDT提供了更强大的光动力效应。
另一方面,源自水母的KillerRed及其衍生物,如KillerOrange,通过特定的点突变,不仅保留了优异的光化学特性,还展现出独特的ROS生成机制。KillerRed的结构设计使其能够将激发能传递给通过水性中心孔扩散的氧气,生成ROS并通过同一通道排出,实现了高效的能量转换与ROS释放。为克服KillerRed二聚化导致的空间阻碍,研究开发了Supernova等单一突变体,进一步提升了其应用潜力。
值得注意的是,光敏蛋白在跨生物系统中高效生成ROS的能力,相较于化学PS,为PDT的精确靶向与空间控制提供了新途径。然而,要实现这些蛋白质PSs在PDT中的广泛应用,还需深入研究编码PSs的基因,开发高效的肿瘤特异性递送系统,并克服基因表达效率低下的难题。
回顾传统PS,尽管部分经典染料已获监管批准用于癌症治疗,但其聚集诱导淬灭(ACQ)效应、低肿瘤选择性蓄积等问题仍限制了其临床效果。为此,研究人员开发了聚集诱导发光(AIE)分子和可激活PSs,前者在聚集状态下不仅避免了ACQ效应,还增强了光捕获与ROS生成能力;后者则通过特定刺激激活,提高在肿瘤中的积累与持续时间,同时减少非靶组织损伤。然而,这些新型PSs在临床转化中仍面临诸多挑战,如生物效应复杂性与个体差异等,需进一步探索以优化其治疗效果。
4. PDT治疗技术
局部放射光疗法(LRT)的核心在于光与光敏剂(PS)之间的相互作用。尽管在利用多样化光敏剂(PSs)强化光动力疗法(PDT)方面取得了显著进展,但外部光源穿透生物组织以触及深层癌症病灶的能力仍受显著限制。发一般LED光源常发出660纳米和600纳米波长的光,这些波长虽与典型光敏剂如原卟啉IX(PpIX)或Ce6的吸收峰相匹配,处于生物组织的光学透明窗口内,却不足以穿透至超过一定深度的肿瘤组织(通常约2厘米为界),限制了其在深层肿瘤治疗中的应用。
为解决这一难题,研究界已将目光投向了更先进的自发光技术,旨在无需外部光源即可在肿瘤局部产生光能,从而规避了组织穿透力不足的障碍。同时,针对第二类PDT策略(如基于5-氨基乙酰丙酸(5-ALA)和Ce6的光动力疗法),其可能加剧肿瘤内部缺氧环境的问题也备受关注。缺氧环境的恶化会削弱PDT效果,甚至引发治疗抵抗性和肿瘤复发,成为癌症治疗中的一大挑战。
因此,癌症治疗领域正积极探索能够显著增强光透射疗法组织穿透能力的新技术,或开发能够有效管理肿瘤缺氧状态的治疗策略。这些努力旨在通过创新性的材料科学、化学及生物学方法,提高PDT的疗效,拓宽其适应症范围,特别是在深层肿瘤及复杂肿瘤微环境中的应用潜力。
4.1. 基于自发光的PDT
在化学与生物科学领域,化学发光(CL)与生物发光(BL)作为无需外部光源的发光现象,展现出卓越的灵敏度和选择性,尤其在肿瘤组织内部的能量传递中表现出色。CL 主要源自过氧化物(O-O)键断裂或富电子基团间的化学反应,以光子的形式释放能量。其中,鲁米诺作为CL研究的明星分子,在碱性环境下经H2O2和氧化催化剂作用,能发出425纳米波长的强烈蓝光,成为临床诊断、生物医学研究及环境监测中的关键工具。
基于鲁米诺的自发光特性,科研人员创新性地构建了血红蛋白(Hb)封装的生物仿脂聚合物纳米颗粒(Hb-NPs)系统,该系统集发光、供氧与高效光动力疗法(PDT)于一体(https://doi.org/10.1002/anie.201905884)。Hb作为含铁蛋白,能吸收鲁米诺发出的光并敏化氧分子,生成活性氧(ROS),同时H2O2的加入促进了肿瘤区域的充氧,改善了缺氧环境。此外,利用具有大斯托克斯偏移的光敏剂(PSs),在420至650纳米激发/发射范围内,实现了CL与PSs之间的化学发光共振能量转移(CRET)和荧光共振能量转移(FRET),显著提升了ROS的生成效率(https://doi.org/10.1021/ac404201s)。
生物发光(BL),作为CL的一种特殊形式,在自然界如萤火虫中尤为显著。萤火虫体内的荧光素酶催化荧光素氧化,生成不稳定的二氧杂环丁酮中间体,随后通过辐射弛豫发出可见光。这一机制在Renilla荧光素酶-腔肠素、Gaussia荧光素酶-腔肠素等系统中得到应用,其荧光发射波长分别覆盖560-610纳米和480纳米范围,广泛用于生物过程的体内外监测。BL因哺乳动物细胞内缺乏相应响应系统,故背景干扰极低。通过基因编码或纯蛋白形式,荧光素酶可靶向肿瘤组织,实现局部发光。
尽管BL在PDT中的应用自2003年起便有所报道,如萤火虫荧光素酶-荧光素系统通过BRET降低细胞活力,但早期研究表明其光子产率不足以单独触发常规光敏剂如RB或chrysin(https://doi.org/10.1007/s11307-006-0048-1)。为克服这一局限,近十年来,基于萤火虫荧光素酶的光导疗法取得了显著进展,通过与纳米结构(如金纳米粒子、半导体量子点)的生物耦合,不仅提升了光子产率,还实现了多功能成像与治疗的一体化。另外,量子点(QDs)与荧光素酶的耦合策略,不仅实现了体内多模态成像,还通过BRET机制将能量传递给QDs,用于激活如m-THPC等临床光敏剂,从而克服了PDT的光穿透限制,提升了深部肿瘤的治疗效果(https://doi.org/10.1016/j.biomaterials.2012.08.044)。此外,通过EDC/Sulfo-NHS活化缩合反应,直接将PSs耦合到Renilla荧光素酶上,开创了PSs与荧光蛋白结合的新途径,为PDT技术的发展开辟了新方向。这些创新策略不仅增强了光动力疗法的疗效,还拓展了其在癌症治疗中的应用前景。
4.2. 克服缺氧的PDT
在探讨光动力疗法(PDT)的局限性时,我们着重指出,鉴于大多数光敏剂(PS)主要依赖于II型反应机制,肿瘤微环境(TME)中的供氧不足,即肿瘤缺氧,构成了PDT疗效提升的主要障碍。肿瘤缺氧,作为晚期实体瘤的一个标志性特征,其根源在于肿瘤细胞的快速增殖对营养物质的极度渴求与异常血管网络供给能力之间的严重失衡。这种不平衡状态不仅预示着恶性肿瘤的预后不佳,还通过激活一系列与细胞存活紧密相关的信号通路,深刻影响着肿瘤的生物学行为。低氧环境稳定了低氧诱导因子(HIFs)的表达,这些因子转而促进肿瘤细胞对低氧环境的适应性调节,包括但不限于增强细胞的增殖潜力、抑制凋亡途径、调整代谢策略、诱导上皮-间质转化(EMT)以及促进血管新生。这一系列复杂的生理变化共同促进了肿瘤细胞的侵袭性和远端转移能力,使得肿瘤治疗面临更加严峻的挑战。
尤为值得注意的是,PDT作为一种依赖氧分子参与的治疗手段,其过程本身即会消耗大量氧气,从而进一步加剧肿瘤内部的缺氧状态。这种恶性循环不仅削弱了PDT的治疗效果,还可能触发肿瘤细胞的缺氧适应性反应,导致治疗耐药性的产生。
此外,免疫状态作为评估免疫治疗效果的关键参数,同样受到肿瘤缺氧的深远影响。缺氧环境通过多种机制促进免疫抑制性TME的形成,限制了免疫系统的正常功能,包括抑制免疫细胞的活化与迁移、干扰免疫细胞间的相互作用以及降低对肿瘤细胞的杀伤能力等。这一系列效应最终削弱了免疫治疗药物的疗效,增加了患者对免疫治疗产生耐药性的风险。因此,在探索PDT及免疫治疗等新型肿瘤治疗策略时,必须充分考虑肿瘤缺氧这一关键因素,并寻求有效的干预手段以打破其介导的恶性循环。
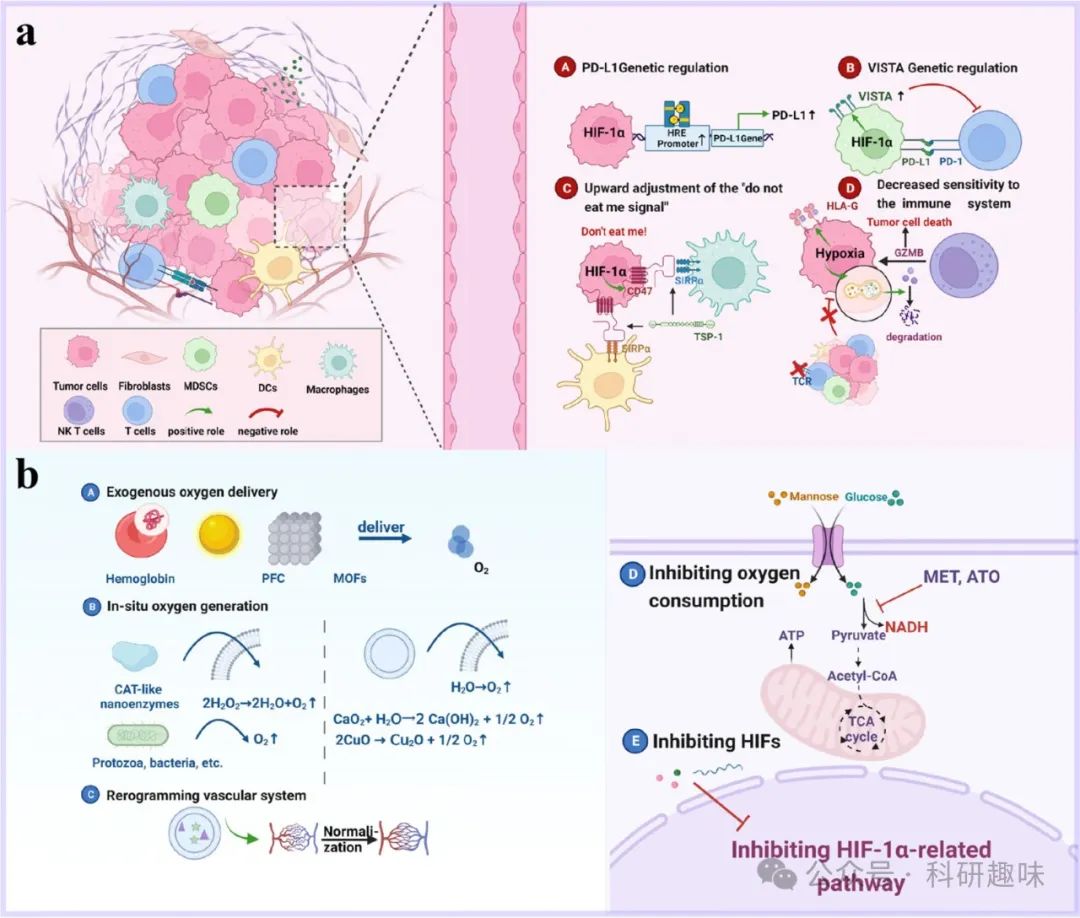
图 4. 缺氧对肿瘤免疫格局的影响机制(a)和 PDT 克服缺氧的方法(b)
缺氧对肿瘤免疫微环境的多维度调控及其治疗策略
在肿瘤生物学中,缺氧作为晚期实体瘤的显著特征,通过复杂的分子机制深刻影响着肿瘤细胞的免疫逃逸能力。其中,缺氧诱导因子-1α(HIF-1α)和HIF-2在调控肿瘤免疫检查点表达中扮演了核心角色。
1. 缺氧与免疫检查点表达的调控
缺氧环境下,HIF-1α直接结合至多种肿瘤细胞(如肺癌、黑色素瘤、前列腺癌及乳腺癌)的PD-L1基因启动子中的低氧反应元件(HRE),上调PD-L1的表达。此外,在肾透明细胞癌(ccRCC)中,HIF-2的稳定由特定基因突变诱导,这些突变亦与PD-L1表达增加紧密相关。
另一方面,缺氧还通过上调V-Domain Ig Suppressor of T Cell Activation(VISTA)的表达,增强髓源性抑制细胞(MDSCs)的免疫抑制功能。在CT-26结肠小鼠模型和结肠癌患者中,VISTA在缺氧区域及TME中浸润的CD11b^highGr1^+ MDSCs上显著过表达。这一过程涉及HIF-1α与VISTA启动子中保守HRE的结合,进而上调MDSCs中VISTA的表达。阻断VISTA表达可有效缓解MDSCs介导的T细胞抑制。
2. CD47与吞噬阻遏的缺氧调控
CD47作为跨膜免疫检查点蛋白,在肿瘤细胞和造血细胞表面表达,通过与巨噬细胞和树突状细胞(DC)上的信号调节蛋白α(SIRPα)及血小板反应蛋白-1(TSP-1)结合,抑制吞噬作用。在乳腺癌中,缺氧促进HIF-1α下游靶基因表达,进而上调CD47表达,二者呈正相关关系。
3. 缺氧诱导自噬与免疫逃逸
缺氧还诱导肿瘤细胞自噬,通过降解受损细胞器和蛋白质维持细胞功能,同时降低对免疫攻击的敏感性。HIF-1α在此过程中诱导Bcl-2相关蛋白(如BNIP3和BNIP3L)表达,促进Beclin1与Bcl-2解耦,激活自噬。阻断自噬可恢复肺癌细胞在低氧条件下对细胞毒性T淋巴细胞(CTL)的敏感性,这与自噬介导的泛素-蛋白酶体系统(UPS)降解磷酸化信号转导子和转录激活子蛋白(pSTAT3)相关。此外,自噬还帮助肿瘤细胞降解NK细胞释放的颗粒酶B(GZMB),并上调HLA-G等免疫抑制性分子的表达,促进免疫逃逸。
4. 基于纳米技术的缺氧缓解策略
为应对肿瘤缺氧挑战,研究者开发了多种基于纳米给药系统(NDDS)的治疗策略,主要包括:
- • 外源供氧:利用血红蛋白(Hb)、全氟化碳(PFC)和金属有机框架(MOFs)等材料直接向肿瘤组织输送氧气。
- • 原位制氧:通过过氧化氢酶(CAT)或类CAT纳米酶降解内源性H2O2,或以H2O为底物生成O2。
- • 减少O2消耗:通过抑制肿瘤细胞的呼吸作用来降低氧气消耗。
- • 改善TME:通过肿瘤血管正常化或ECM降解改善血液灌注和氧气输送,尤其在光热治疗(PTT)或PDT与免疫治疗的联合策略中尤为重要。
- • 抑制HIFs信号通路:直接干预HIFs信号,以缓解肿瘤缺氧并减少相关副作用。
综上所述,缺氧对肿瘤免疫微环境的调控机制复杂且深远,而基于纳米技术的创新治疗策略则为克服肿瘤缺氧、提升免疫治疗效果提供了新的思路和工具。
光动力治疗与肿瘤免疫治疗
肿瘤微环境(TME)是一个高度复杂的生态系统,由多细胞组分、细胞外基质(ECM)、各类分泌分子以及错综复杂的血液与淋巴管网络共同构成,这一环境对肿瘤的发生与发展起着至关重要的作用。癌症的免疫环境则是一个涵盖多种因素的综合性概念,这些因素共同影响着机体的抗癌免疫反应。
近十年来,随着对TME认识的不断深化以及免疫疗法(IT)和光动力疗法(PDT)在临床实践中的迅速崛起,科学家们愈发关注PDT与肿瘤相关免疫之间的协同增效作用。PDT作为一种非侵入性治疗手段,在激活宿主免疫系统方面展现出独特优势。PDT治疗后,不仅能够有效调节先天性免疫应答,还能增强适应性免疫的效能,从而优化肿瘤免疫微环境(TIME),促进免疫细胞对肿瘤细胞的识别和清除,进而激发更为强烈的抗肿瘤免疫反应。
此外,基于PDT的联合治疗方案更是将这一潜力发挥到了极致。通过将PDT与特异性信号通路抑制剂及免疫应答的强力激活剂相结合,科学家们能够实现对肿瘤免疫应答的精准调控和持续增强。这种联合治疗策略不仅能够有效克服单一疗法的局限性,还能通过多途径、多靶点的综合作用,实现对肿瘤细胞的全面打击,为癌症治疗开辟了新的道路。
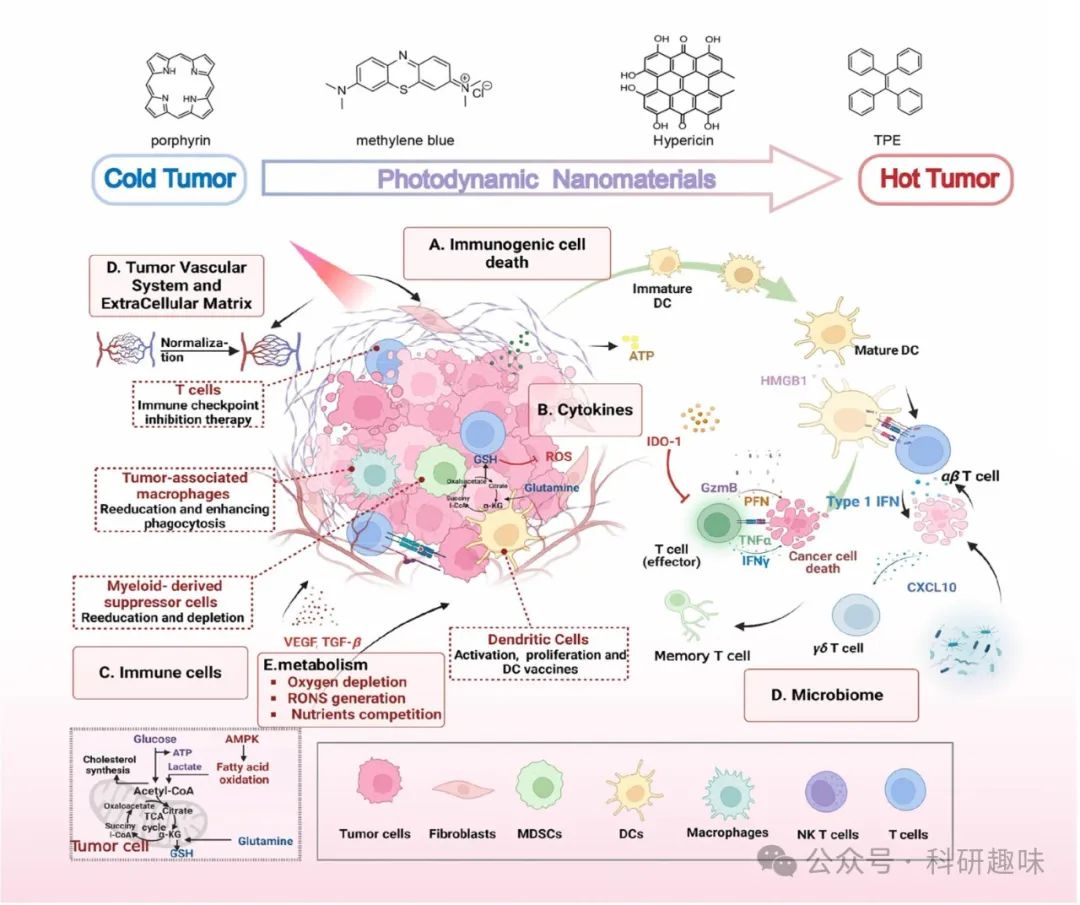
图 1. 光动力疗法与靶向肿瘤相关免疫景观策略之间相互促进的相互作用。
1. PDT 刺激的抗肿瘤免疫效应
光动力疗法(PDT)在调节免疫系统,特别是先天性免疫与适应性免疫方面展现出显著成效。首先,PDT诱导的肿瘤局部组织损伤能触发急性炎症反应,这一直接途径旨在清除受损组织并恢复体内稳态。早在1991年,Yamamoto团队即观察到PDT过程中生物体免疫系统的响应,特别是PDT产生的活性氧(ROS)诱导淋巴细胞膜脂质过氧化,随后通过Fc受体介导巨噬细胞活化(https://doi.org/10.1016/0277-5379(91)90388-T)。2002年,Sun等人的研究进一步证实,PDT后小鼠体内CD11b/CD18和CD11c/CD18表达上调及髓过氧化物酶活性增强,表明中性粒细胞积极参与了PDT介导的急性炎症调控,其在早期血管损伤及肿瘤细胞靶向破坏中扮演关键角色(https://doi.org/10.1039/b204254a)。然而,2003年的研究也警示我们,过度的炎症反应可能不利于临床应用,因此需精细调控炎症介质以优化PDT疗效(https://doi.org/10.1089/104454702753474931)。
另一方面,PDT通过诱导免疫原性细胞死亡(ICD)机制,有效激发先天性免疫反应,并触发适应性免疫应答的激活,进而形成长期免疫记忆。这一过程依赖于PDT诱导的肿瘤细胞损伤后释放的一系列损伤相关分子模式(DAMPs),它们作为“危险信号”促进抗原呈递细胞(APCs)的招募与激活。例如,内质网钙网蛋白(CRT)的膜转位、NF-κB转录因子上调导致的热休克蛋白(HSP)暴露、ATP及高迁移率族蛋白B1(HMGB1)的释放等,均参与了APCs的成熟、迁移及抗原呈递,最终激活效应T细胞对肿瘤细胞的特异性杀伤。此外,HSPs还促进树突状细胞(DCs)的成熟与迁移,而炎症因子的分泌则进一步加速了APCs的成熟过程。这一系列复杂而精密的免疫反应构成了PDT抗肿瘤免疫的基石。
然而,PDT对免疫系统的影响并非全然积极。其诱导的免疫抑制效应亦不容忽视,这主要与光敏剂(PS)类型、光源参数及辐射区域等因素相关。PDT可激活T细胞介导的免疫抑制过程,并涉及巨噬细胞的参与。同时,PDT诱导的血管效应及组织缺氧可稳定缺氧诱导因子-1α(HIF-1α),后者与血管内皮生长因子(VEGF)基因启动子结合,促进VEGF分泌,进而抑制T细胞的发育并可能引发肿瘤诱导的免疫抑制。此外,某些PS还可能通过影响细胞内铁代谢直接杀伤活化T细胞,进一步削弱免疫反应。
综上所述,PDT在调节免疫系统方面展现出复杂的双重效应:既能有效激活抗肿瘤免疫应答,又可能诱发免疫抑制。因此,在PDT的临床应用中,需综合考虑多种因素,通过优化治疗参数及联合其他治疗手段以最大限度地发挥其抗肿瘤优势并减少副作用。
2. 光动力-免疫疗法(PDIT)协同抗肿瘤治疗
免疫系统在调控肿瘤生长方面展现出双刃剑效应:既能通过其防御机制抑制肿瘤,又可能经由慢性炎症和肿瘤免疫微环境(TIME)的重塑,促进肿瘤的生长与转移,这一过程被形象地称为“癌症免疫编辑”,涵盖消除、平衡(稳态)及逃逸三大阶段。光动力疗法(PDT)实施后,会诱导肿瘤相关抗原(TAAs)的释放,随后抗原呈递细胞(APCs),如树突状细胞(DCs)、巨噬细胞、中性粒细胞及淋巴内皮细胞,会捕获并处理这些新抗原。这些新抗原被加工并展示于主要组织相容性复合体(MHC)I和II分子上,通过与T细胞受体(TCR)的结合,激活位于引流淋巴结(LN)中的未成熟T细胞(包括初始CD8+ T细胞和CD4+ T细胞)。此激活过程依赖于多个信号通路的协同作用,包括MHC-TCR间的突触形成、共刺激分子(如APC上的CD80/CD86与T细胞上的CD28)的相互作用,以及APC释放的细胞因子触发的T细胞极化。
被激活的肿瘤特异性T细胞在协同刺激下被激活并渗透至肿瘤微环境(TME)中,它们能够识别并诱导癌细胞凋亡,从而清除目标癌细胞。这一过程伴随着死亡肿瘤细胞继续释放TAAs,启动新一轮的肿瘤抗原-免疫循环。然而,值得注意的是,并非所有肿瘤细胞都能被有效清除,未被根除的癌细胞将促使癌症进入稳态阶段。在此阶段,TME通过免疫编辑机制塑造TIME,导致高免疫原性克隆的淘汰,并激活多种免疫逃逸策略,这些策略能够阻断免疫循环中的一个或多个关键环节,使癌细胞逃避免疫监视,减弱免疫系统的抗肿瘤反应。
此外,PDT的全身效应受限不仅归因于TIME的屏障作用,还因为PDT本身可能诱导全身性的免疫抑制状态,这一现象早在1989年即由David等人揭示(https://doi.org/10.1111/j.1751-1097.1989.tb09194.x),他们发现PDT能触发巨噬细胞介导的免疫抑制,且与小鼠的接触超敏反应抑制相关。进一步地,许多II型光敏剂(PSs)会加剧肿瘤组织的缺氧状态,促进缺氧诱导因子-1(HIF-1)的转录激活,从而加剧免疫抑制并可能诱导PDT耐受性。
因此,将PDT与针对肿瘤相关免疫环境的策略相结合显得尤为重要。这种联合疗法旨在通过诱导免疫原性细胞死亡(ICD)来调整TIME,增强全身免疫力;同时,也是克服PDT和免疫疗法(IT)耐药性的关键途径。通过优化肿瘤免疫环境,如增强抗原呈递、促进T细胞浸润与活化、抑制免疫抑制性细胞及因子等五种策略,可以有效改善PDT的局限性或实现PDT与免疫疗法的协同增效。
2.1. 作用于免疫抑制相关的细胞因子
在缺氧的肿瘤微环境(TME)中,促血管生成因子如血管内皮生长因子(VEGF)的过度表达,导致了血管系统的异常增殖与无序分布,表现为血管高通透性增加、间质压力(IFP)上升以及淋巴循环失调。这些变化构成了物理屏障,阻碍了免疫细胞、光敏剂(PSs)及纳米药物的肿瘤靶向递送。VEGF的上调与光动力疗法(PDT)诱导的缺氧环境和氧化应激紧密相关。值得注意的是,Perftoran作为一种干预手段,通过下调低氧诱导的miRNA(hypoxamiRs),进而抑制VEGF的表达,显著增强了Visudyne诱导的肿瘤细胞晚期凋亡与坏死效应。此外,联合抗血管生成疗法,特别是索拉非尼对VEGF的抑制,促进了肿瘤血管的正常化,改善了免疫抑制性TME,从而放大了T细胞介导的免疫原性细胞死亡(ICD)效果。将VEGF靶向毒素融入PDT策略中,可作为免疫检查点抑制剂(如αCTLA-4)的佐剂,潜在地降低了免疫治疗所需的药物剂量。
另一方面,吲哚胺 2,3-双加氧酶 1(IDO1),作为一种在肿瘤浸润淋巴细胞(TILs)中过表达的血红素酶,通过犬尿氨酸(Kyn)途径催化L-色氨酸的氧化降解,生成一系列具有免疫调节功能的代谢物。这些代谢物中,部分能够抑制T细胞的体外增殖或诱导其凋亡,同时IDO1还通过局部色氨酸耗竭,激活应激反应途径,如抑制mTOR激酶活性并触发GCN2激酶,促进幼稚CD4+ T细胞向具有免疫抑制功能的调节性T细胞(Tregs)分化。大量临床前研究揭示了PDT与IDO-1抑制剂联合使用的潜力,鉴于IDO-1在促进免疫耐受、增强犬尿氨酸毒性及促进Tregs分化方面的作用,该联合策略在临床研究中展现出合理的应用前景。
再者,转化生长因子-β(TGF-β)在肿瘤进展中扮演多重角色,包括促进血管生成、诱导EMT相关转录因子表达、抑制细胞周期进程及重塑细胞骨架,共同构建了一个有利于肿瘤侵袭与转移的微环境。因此,通过联合阻断TGF-β信号通路,可以逆转PDT可能引发的晚期免疫抑制,为肿瘤治疗提供新的策略方向。
2.2. 肿瘤免疫相关的免疫细胞调控
在肿瘤免疫学的最新进展中,肿瘤相关免疫微环境(TME)的复杂性得到了深入探索,这一环境由多种因素交织而成,共同塑造着抗癌免疫反应的面貌。最新一期《自然》杂志刊登的两项研究,借助高精度的35重成像质谱(IMC)技术,精准解析了大脑与肺部TME中的约20种关键细胞组分,包括癌细胞、多样化的免疫细胞亚群以及内皮细胞,从而细致描绘了这些器官的免疫景观特征(https://doi.org/10.1038/s41586-022-05680-3,https://doi.org/10.1038/s41586-022-05672-3)。
免疫细胞,作为TME中数量庞大的非癌性居民,由先天性免疫细胞和适应性免疫细胞两大类构成,它们在抗肿瘤免疫中发挥着不可或缺的作用。然而,在多种TME背景下,免疫细胞可能通过减少在肿瘤组织中的有效归巢以及扩增具有免疫抑制功能的细胞群体,来抑制宿主的免疫系统,形成免疫逃逸的屏障。
为了克服这一挑战,当前的临床前研究正积极致力于重新编程肿瘤浸润免疫微环境(TIME),通过特异性或非特异性的策略靶向那些与免疫抑制紧密相关的分子机制。这一努力旨在增强光动力疗法(PDT)及其诱导的免疫原性细胞死亡(ICD)的效能,从而更有效地激发抗肿瘤免疫反应。
尤为值得注意的是,PDT与免疫疗法(IT)的联合应用展现出了非凡的潜力。PDT不仅能够显著提升IT的疗效,还能够有效弥补免疫检查点阻断(ICB)疗法在特异性、成本效益及安全性方面的局限性。通过这一创新策略,科学家们正逐步揭开肿瘤免疫治疗的新篇章,为癌症患者带来更加精准、高效且安全的治疗选择。
2.2.1. T细胞
在抗肿瘤免疫学的广阔领域中,T细胞凭借其卓越的细胞杀伤能力,已成为研究的核心焦点。TME(肿瘤微环境)内,多种T细胞亚群如细胞毒性T淋巴细胞(CTLs)、调节性T细胞(Tregs)及辅助性T细胞(Th)协同作用,介导复杂的免疫反应。其中,CTLs在靶向并摧毁肿瘤细胞的过程中扮演着核心角色。为精确调控这一过程,免疫系统配备了诸如CTLA-4与PD-1/PD-L1等负性调控因子作为检查点分子,它们既是免疫稳态的守护者,也可能被肿瘤细胞劫持以逃避免疫监视。
PD-1,一种在T细胞活化后表达的免疫检查点受体,通过与配体结合,触发一系列磷酸化-去磷酸化反应,抑制T细胞功能。针对PD-1/PD-L1通路的单克隆抗体(mAb)疗法,通过阻断这一抑制信号,有效激活CTLs介导的特异性抗肿瘤免疫。此类抑制剂在临床试验中展现出延长患者总生存期(OS)的显著优势,尤其以Pembrolizumab和nivolumab为代表,已被FDA批准用于黑色素瘤治疗。然而,其疗效受限于PD-L1在肿瘤细胞表面的表达水平及CTLs的浸润程度,对于非选择性人群的有效率相对较低。
为克服这一挑战,结合Pheophorbide A介导的光动力疗法(PDT)与αPD-L1治疗,旨在通过增加肿瘤内PD-L1表达及T细胞浸润,提升治疗效果(https://doi.org/10.3390/pharmaceutics14112513)。研究表明,血管靶向PDT联合αPD-L1/αPD-1治疗,能够优化肿瘤免疫微环境,促进CD8+与CD4+ T细胞相对Tregs的增殖,从而加速原发性肿瘤消退并预防远端转移。
另一重要检查点CTLA-4,在效应T细胞(Teff)中表达,通过与APC上的B7分子结合,抑制T细胞活化。利用NIR-PDT结合CTLA-4阻断策略,可诱导急性炎症反应,促进DC成熟与活化,延长实验动物生存期。基于Redaporfin的PDT与αCTLA-4阻断联合,不仅促进T细胞增殖与活化,还降低了ICI治疗的剂量需求,简化了治疗管理(https://doi.org/10.1016/j.addr.2017.05.011)。
Tregs,作为免疫耐受与自身免疫抑制的关键调节者,其在肿瘤部位的浸润通过多种机制增强肿瘤逃逸。通过表达高亲和力IL-2受体、分泌免疫抑制细胞因子、高亲和力CTLA-4结合共刺激分子及诱导CTL功能障碍,Tregs限制了抗肿瘤免疫的效力。PDT后,Tregs的短暂激增可能是调节免疫激活与抑制平衡的机制之一,而PDT本身也削弱了Tregs与其他免疫细胞的相互作用。因此,PDT联合Tregs抑制剂(如CD25耗竭抗体、环磷酰胺)的研究正深入展开,旨在通过降低Tregs活性,进一步提升PDT的治疗效果。
2.2.2. 肿瘤相关巨噬细胞(TAMs)
巨噬细胞,作为众多组织中的常驻免疫细胞,在维护机体非特异性及特异性防御机制中扮演核心角色,是维持组织稳态不可或缺的媒介。然而,肿瘤微环境(TME)的异常改变,如增殖失控、血管生成加剧及转移潜能的提升,显著扰乱了巨噬细胞的正常功能。在肿瘤病灶处,巨噬细胞群体既包含原位增殖的细胞,也吸引着单核细胞衍生的巨噬细胞(MDM)的迁入,共同作用于肿瘤的生长与进展过程。
肿瘤相关巨噬细胞(TAM)作为肿瘤炎症的关键调控者,通过多种机制促进肿瘤恶化,包括但不限于加剧遗传不稳定性、滋养癌症干细胞以及助力肿瘤细胞的转移扩散。TAM的极化状态,依据其接触的细胞因子谱,可划分为促炎的经典活化M1表型和抗炎的交替活化M2表型。随着肿瘤进展,TME中的酶、细胞因子及趋化因子等因素共同作用,促使浸润的巨噬细胞更倾向于向M2表型分化。
值得注意的是,通过激活STING信号通路并释放线粒体DNA(mtDNA),以Ce6为光敏剂的光动力疗法(PDT)能够有效诱导TAM向M1表型极化(https://doi.org/10.1186/s12951-020-00653-y)。此外,PDT还能促使肿瘤细胞释放热休克蛋白70(HSP70),该蛋白随后激活TLR2/4受体并触发肿瘤坏死因子α(TNFα)的释放,从而产生PDT后的间接杀伤效应(https://doi.org/10.1158/0008-5472.1018.65.3)。同时,巨噬细胞表面表达的补体受体赋予其识别并吞噬被C3及甘露糖结合凝集素(MBL)标记的肿瘤细胞的能力,进一步促进PDT对肿瘤组织的清除作用。
尤为重要的是,M1极化的TAM通过招募更多M1巨噬细胞,增强了PDT对皮肤鳞状细胞癌等肿瘤的治疗响应性(https://doi.org/10.1007/s00262-005-0088-4)。此外,结合TLR拮抗剂对TAMs进行重编程,并与PDT联合应用,展现出启动针对远处及转移性肿瘤的新型免疫疗法的巨大潜力。这一策略不仅加深了我们对TAM在肿瘤免疫中作用机制的理解,也为开发更加高效、精准的肿瘤治疗手段开辟了新途径。
2.2.3. 髓源性抑制细胞
在肿瘤微环境(TME)的复杂调控网络中,除了肿瘤相关巨噬细胞(TAMs)外,髓源性抑制细胞(MDSCs)同样构成了靶向疗法的重要潜在靶点。这些细胞在癌症、炎症等病理状态下,展现出高度的异质性,形成一群能够抑制T细胞功能的细胞群体。MDSCs,作为病理环境中未成熟髓系细胞的集合体,通过多途径促进肿瘤生长,包括直接抑制T细胞活性、招募免疫抑制性细胞、诱导巨噬细胞向M2样TAMs极化,以及削弱自然杀伤细胞(NK细胞)的功能,从而在癌症进展的每一个阶段对免疫反应施加负向调控,精细调节着先天性与适应性免疫系统的平衡。
MDSCs的活性受到一系列病原体信号网络的精密调控,这些信号以损伤相关分子模式(DAMPs)、病原体相关分子模式(PAMPs)或Toll样受体(TLR)配体的形式存在,揭示了PDT与MDSCs调节剂联合应用的潜在可行性。PDT不仅具备对MDSCs的固有招募能力,还能通过延缓Gr1+细胞(一种MDSCs标志物)的耗竭,间接提升PDT的治疗效果(https://doi.org/10.1158/2326-6066.CIR-16-0297)。
此外,全反式维甲酸(ATRA)作为一种有效的调节剂,被证实能够诱导免疫抑制性的MDSCs向非抑制性的成熟表型转变,这一发现为增强PDT的抗肿瘤效力提供了新策略。通过ATRA的应用(https://doi.org/10.3390/ijms161126008),可以预期进一步削弱MDSCs对免疫系统的抑制作用,从而放大PDT在肿瘤治疗中的正面效应。
综上所述,当前针对MDSCs及其与PDT相互作用机制的研究正不断深入,这些努力无疑将在不远的将来为精准靶向髓系细胞、优化肿瘤免疫治疗方案提供宝贵的理论依据和实践指导。
2.2.4. 树突状细胞(DC)
树突状细胞(DCs)作为一类至关重要的抗原呈递细胞(APCs),源自CD34+骨髓前体细胞,展现出卓越的从凋亡或垂死肿瘤细胞中交叉呈递突变新生抗原,以及从感染细胞内交叉呈递病原体衍生抗原的能力。目前,DCs被细分为两大主要亚群:浆细胞样树突状细胞(pDCs)和经典树突状细胞(cDCs),每一亚群均拥有独特的功能特性。
pDCs,亦称类浆细胞样树突状细胞,能够产生并释放I型干扰素(IFN-I),在免疫应答中展现出免疫原性与耐受性的双重面貌。它们通过促进DCs与促炎巨噬细胞的成熟与活化、推动B细胞向浆细胞分化、增强NK细胞与T细胞的细胞毒性,从而强化先天性与适应性免疫。同时,pDCs亦能诱导免疫调节分子的表达与分泌,招募免疫抑制细胞,参与肿瘤免疫微环境(TIME)的构建。
cDCs则进一步细化为cDC1(Clec9aXCR1+)与cDC2(SirpαCD11b+)两种同工型,两者在功能特性与转录因子依赖上各有千秋。cDC1亚群独具将肿瘤相关抗原(TAAs)引流至淋巴结,并通过MHC I分子将抗原交叉呈递给未成熟CD8+ T细胞的能力。而cDC2则主要负责向CD4+ T细胞交叉呈递MHC II分子结合的抗原,并参与Th17细胞的诱导过程。总体而言,肿瘤微环境(TME)中cDC(尤其是cDC1)密度的增加,往往预示着更为乐观的癌症预后。
DCs表达可识别损伤相关分子模式(DAMPs)的模式识别受体(PRRs),这一特性使得基于PRRs的信号传导在光动力疗法(PDT)后成为促进DC活化的关键机制。大量研究表明,PDT诱导的肿瘤裂解可促使TAAs的释放与扩散,进而刺激DCs的招募与原位DC疫苗的形成,触发强大的免疫级联反应,这一过程甚至无需额外佐剂的辅助。
值得注意的是,PDT与DC疫苗疗法之间存在显著的互补性,二者联合应用相较于单一治疗展现出更为显著的疗效。这些发现预示着PDT-DC疫苗接种策略有望成为多种肿瘤类型协同治疗的新选择,有效遏制肿瘤的转移与复发。
2.3. 针对肿瘤血管系统功能障碍和促进免疫抑制的细胞外基质沉积
肿瘤血管生成的异常性是癌症的一个标志性特征,其表现为内皮细胞(ECs)的异常增殖、血管壁细胞覆盖的紊乱、细胞间紧密连接的减少以及细胞外基质(ECM)沉积的显著增加。这一异常导致肿瘤血管系统结构复杂且功能失调,迂回曲折,旨在高效地为快速增殖的肿瘤细胞提供养分。通过精细调控血管生成信号通路,促进或抑制血管形成,可以优化肿瘤血管网络,增强其免疫调节功能,从而激发更强大的抗肿瘤免疫反应。抗血管生成策略不仅优化免疫微环境,还能有效缓解肿瘤内部因血管功能不足导致的缺氧状态,克服光动力疗法(PDT)在某些情况下的局限性。
除了血管系统的异常,ECM的过度沉积也是肿瘤微环境(TME)的重要特征之一,尤其在浸润性癌中,ECM的重塑与免疫抑制环境的形成及对免疫疗法的抵抗密切相关。这一过程通过影响肿瘤相关巨噬细胞(TAMs)的表型及其在TME中的分布,直接作用于免疫系统。
癌相关成纤维细胞(CAFs)作为TME中ECM的主要生产者,其角色尤为关键。在正常生理状态下,CAFs作为静止的间充质细胞嵌入ECM中,仅在伤口愈合等过程中被激活,促进炎症修复与再生。然而,在肿瘤这一“永不愈合的伤口”中,CAFs的持续激活促进了ECM的沉积、基质重塑酶的分泌及多种细胞因子的产生,从而加剧肿瘤的侵袭与转移。此外,CAFs还通过多种机制介导TME的免疫抑制,包括分泌趋化因子与细胞因子、表达免疫检查点分子(如PD-L1/2)以及产生免疫调节代谢物,共同塑造了抗肿瘤免疫抵抗的TIME。
鉴于CAFs在肿瘤进展与免疫逃避中的核心作用,其已成为抗肿瘤免疫疗法的新靶点。PDT与CAFs的相互作用研究显示,通过减少光敏剂PpIX的积累,可降低肿瘤对光毒性的敏感性并缓解药物耐药性。此外,5-ALA介导的局部PDT能够下调α-SMA和FAP等CAF活化标志物,进而抑制鳞状细胞癌的生长与转移。
尽管针对CAFs的治疗策略取得了一定进展,但现有药物如FAP靶向药物常伴随严重副作用甚至全身毒性。为此,研究者们提出了创新的解决方案,如利用FAPα响应性裂解的诊断探针结合PDT与免疫检查点阻断(ICB),以实现CAF与肿瘤细胞的双重破坏,达到协同增效的抗癌效果。同时,通过设计智能纳米平台,实现药物释放的精确时间与空间控制,不仅能够有效调节CAF相关的抗肿瘤免疫,还能显著减少全身毒性,为癌症治疗开辟了新的途径。
2.4. 通过微生物组协同抗肿瘤免疫
近期科学研究揭示,肿瘤组织内驻留的微生物群落对宿主生理机能具有深远影响,它们能够调控宿主基因组的特定方面,诱导一系列促肿瘤效应。这些效应包括但不限于直接诱发DNA损伤、塑造利于肿瘤发展的炎症微环境,以及生成具有致癌潜能的有害代谢副产物。尤为引人注目的是,组织内微生物组通过精细调控细胞因子网络及免疫细胞亚群分布,重塑整体免疫格局,具体表现为促进肿瘤相关巨噬细胞(TAMs)向免疫抑制性的M2表型极化、增强髓源性抑制细胞(MDSCs)的免疫抑制功能,并分泌多种免疫抑制性炎症因子。
鉴于微生物组在塑造免疫环境及多种生理过程中的核心地位,通过精准靶向与重组这些微生物群落,或应用其衍生物以增强免疫应答,有望成为未来癌症治疗领域的关键策略。在癌症治疗的探索中,微生物组的应用聚焦于两大核心目标:一是提升治疗效果,二是减轻治疗副作用。值得注意的是,光动力疗法(PDT)作为一种非侵入性的抗癌手段,其应用范围已不仅限于直接杀伤肿瘤细胞,还展现出对肿瘤微生物群的有效调控能力。最新研究显示,PDT在消融肿瘤细胞的同时,亦能清除人类乳头状瘤病毒及宫颈病理相关微生物群,表明其具备调节肿瘤微生物群以削弱其原发肿瘤促进及免疫抑制作用的潜力。
因此,结合微生物组调控与PDT等先进治疗手段,有望为癌症治疗开辟新的路径,实现更高效、更精准的治疗效果,同时减轻患者负担。
2.5. 癌症代谢重编程和 PDIT
在肿瘤生物学领域,肿瘤内部常展现出复杂多样的中枢代谢途径异常。回溯至20世纪20年代,奥托·沃伯格(Otto Warburg)的开创性工作首次揭示了肿瘤细胞即便在富氧环境中也偏好通过糖酵解途径获取能量的独特现象,即著名的“沃伯格效应”。随着肿瘤代谢重编程研究的不断深化,我们逐渐认识到肿瘤免疫反应与组织代谢之间的密切互动,前者可显著影响耗氧量、活性氮和氧物种(RONS)的生成以及营养物质的分配,而后者则通过代谢产物反馈调节免疫细胞的发育、分化及免疫检查点的表达。
最新研究揭示了一个重要的竞争机制:免疫细胞与肿瘤微环境(TME)中的癌细胞及其他增殖细胞之间对营养资源的激烈争夺,这提示了代谢干预策略在增强抗肿瘤免疫疗法效果中的潜力。具体而言,药物干预能够精准调控T细胞的代谢适应性与持久性,例如,PI3K抑制剂的应用在CAR-T细胞激活后促进了糖酵解通量,显著提升了抗肿瘤效能(https://doi.org/10.1038/s41375-017-0008-6)。此外,通过抑制mTORC2-AKT信号通路以阻断糖酵解,促进了T细胞记忆表型的形成,这对于长期免疫监控至关重要。
值得注意的是,癌症能量平衡的重编程与光动力疗法(PDT)之间存在着显著的协同效应。这种协同主要体现在PDT反应底物浓度的提升、还原物质合成的减少以及免疫原性细胞死亡(ICD)的改善上。特别地,抑制肿瘤细胞的氧化磷酸化(OXPHOS)不仅能增加TME中的氧分压,还提高了适用于II型PDT的反应底物浓度,从而增强了治疗效果。进一步地,通过干扰与新陈代谢紧密相关的信号通路并减少肿瘤细胞内代谢物的积累,可以有效避免活化T细胞的耗竭及免疫检查点的上调,这些都是导致ICD失败的关键因素。
在此背景下,谷氨酰胺作为谷胱甘肽(GSH)的直接前体,其在TME中的代谢调控显得尤为重要。限制肿瘤细胞对谷氨酰胺的摄取与利用,能够削弱GSH对活性氧(ROS)的抗氧化防御,进而增加ROS对肿瘤细胞的杀伤作用,并促进免疫细胞对营养资源的摄取,最终防止ICD的失败,为肿瘤治疗开辟了新的策略方向。
2.6. PDT与免疫环境的相互串扰
在肿瘤微环境(TME)的复杂架构中,癌细胞深植其间,与多种基质细胞(涵盖癌细胞本身、免疫细胞、血管内皮细胞及成纤维细胞活化蛋白细胞,即CAFs)形成动态交互网络。这一网络通过代谢耦合与旁分泌信号传导机制,借助细胞因子作为媒介,深刻影响着肿瘤的生物学特性。一方面,这些成分间的相互作用,在无外界干预时,倾向于构建一个免疫抑制性的微环境;另一方面,此现象也为肿瘤治疗策略的设计提供了新思路,特别是PDIT(一种假设的协同治疗策略,可能指光动力免疫疗法或其他基于光动力学的免疫疗法)的引入,旨在通过扰乱肿瘤内部的相互作用网络,解除免疫抑制的桎梏。
以IDO-1抑制剂为例,其疗效常受限于肿瘤细胞氧化还原稳态的失衡及效应T淋巴细胞(特别是CD4+和CD8+ T细胞)浸润的障碍。然而,结合光动力疗法,IDO-1抑制剂能够通过诱导程序性细胞凋亡及免疫原性细胞死亡(ICD),促使T淋巴细胞的有效浸润与肿瘤清除。
此外,CAFs过度沉积的细胞外基质(ECM)与肿瘤细胞快速增殖产生的机械应力共同作用,导致实体瘤硬度增加,压迫血管与淋巴管,降低血液灌注,加剧肿瘤缺氧状态。针对此,ECM降解酶的应用成为关键,它能有效瓦解肿瘤的物理屏障,促进药物渗透,恢复血液流动,并缓解缺氧。结合PDT对CD8+ T细胞的招募效应,这种双重策略显著提升了治疗响应率。
肿瘤细胞通过代谢重编程策略,不仅促进自身增殖、转移与侵袭,还通过竞争营养物质与生成代谢副产物,间接调控周围细胞的组成与功能。干扰其葡萄糖代谢路径可触发热休克反应,激发强大的抗肿瘤免疫反应,伴随炎症细胞因子的释放。进一步地,通过限制肿瘤细胞对谷氨酰胺的摄取,PDT的效能得以增强,减少了谷胱甘肽(GSH)与烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的抗氧化作用,从而克服了PDT的某些局限性。
综上所述,TME是一个由正常细胞与恶性细胞交织而成的复杂生态系统,其中各成分间的相互作用既竞争又合作,共同塑造了肿瘤免疫微环境(TIME)。通过利用PDT对CD8+ T细胞的招募效应,并结合其他单一疗法,我们有望实现对肿瘤景观的全面调控与优化。
光动力疗法与肿瘤相关免疫靶向疗法相结合的纳米材料
在深入探讨肿瘤免疫微环境的复杂性时,我们观察到细胞因子、肿瘤细胞及免疫细胞间的协同作用显著延迟了患者对光化学疗法(PDT)及免疫疗法(IT),特别是免疫检查点阻断(ICB)疗法的响应。从理论框架出发,PDT与IT通过协同构建高度免疫原性的肿瘤微环境,旨在重振患者的内在免疫系统,从而克服各自单独治疗时的局限性,展现出作为先进治疗策略的广阔前景。
纳米医学的兴起,为抗肿瘤免疫疗法开辟了一条创新且极具潜力的路径。其独特优势在于个性化定制能力、易于修饰以赋予多种生物活性功能,以及对抗肿瘤耐药性的卓越效果。借助先进的生物材料技术,我们能够设计并实施一系列肿瘤靶向的免疫景观调控策略,这些策略与PDT形成强大的协同效应,旨在优化PDT与IT的联合治疗(简称PDIT,此处可理解为一种假想的协同治疗模式),具体措施涵盖:
- 1. 增强免疫原性细胞死亡(ICD):通过优化PDT参数或结合特定纳米制剂,促进肿瘤细胞发生更为显著的ICD,释放更多肿瘤相关抗原及危险信号,从而激活并增强抗肿瘤免疫反应。
- 2. 抑制免疫抑制性细胞因子:利用纳米载体递送靶向抑制剂,精准调控免疫抑制性细胞因子的表达与功能,打破肿瘤微环境中的免疫抑制屏障。
- 3. 调节免疫细胞活性:通过纳米技术调节肿瘤浸润免疫细胞的表型与功能,如促进效应T细胞的活化与增殖,抑制调节性T细胞(Tregs)的免疫抑制作用,重塑免疫平衡。
- 4. 重塑肿瘤血管系统与细胞外基质(ECM):应用纳米材料改善肿瘤血管通透性,促进药物及免疫细胞在肿瘤内的渗透与分布;同时,调节ECM成分,降低肿瘤硬度,改善局部微环境。
- 5. 重编程肿瘤代谢:利用纳米平台递送代谢调节剂,干扰肿瘤细胞的关键代谢途径,如糖酵解、谷氨酰胺代谢等,削弱其生存与增殖能力,同时增强免疫细胞的代谢适应性。
- 6. 微生物组调控:通过纳米技术调节肿瘤微环境中的微生物群落,减少有害菌的丰度,增加有益菌的定植,或利用微生物代谢产物增强抗肿瘤免疫反应,形成新的治疗靶点。
综上所述,纳米医学与PDT的协同作用,为抗肿瘤免疫疗法提供了前所未有的机遇与挑战,通过精准调控肿瘤免疫景观的多个维度,有望实现更高效、更精准的肿瘤治疗。
1. 增强免疫性细胞死亡
在探索光动力疗法(PDT)诱导的免疫原性细胞死亡(ICD)作为抗癌策略的过程中,尽管其展现出巨大潜力,但先天性免疫系统的负向调节仍是制约ICD疗效及肿瘤彻底清除的关键因素。树突状细胞(DCs)的抗原呈递效率紧密依赖于肿瘤内部损伤相关分子模式(DAMPs)的丰度,因此,高效释放ICD过程中产生的DAMPs对于提升PDT与免疫治疗结合(PDIT)的整体效率具有决定性意义。
钙离子(Ca²⁺)作为关键的第二信使,在维持免疫细胞活化及表位转换过程中发挥着核心作用。最新研究表明,肿瘤细胞内的Ca²⁺超载现象能够显著加速DAMPs的释放,为增强ICD提供了新途径。Huang等人巧妙设计了一种基于CaO₂的复合纳米材料,表面封装有超小型CuS-MnO₂纳米颗粒,通过实施钙超载策略与CuS的PDT效应相协同,实现了对ICD的双重增强(图6a)(https://doi.org/10.1002/adma.202207593)。
该纳米系统中,透明质酸(HA)作为表面涂层,利用其特异性靶向4T1肿瘤细胞表面CD44受体的能力,增强了药物的细胞摄取效率。在肿瘤微环境的酸性条件下,CaO₂通过CD44介导的内吞作用进入肿瘤细胞内部,随后释放Ca²⁺和氧气。值得注意的是,PDT过程中产生的活性氧(ROS)会攻击线粒体,导致其功能障碍,进而失去对细胞内Ca²⁺浓度的调控能力,诱发细胞内Ca²⁺超载,这一机制与PDT效应相辅相成,共同促进了ICD的双途径增强。
进一步地,当这种钙基纳米药物与抗程序性死亡配体1(αPD-L1)抗体联合使用时,在近红外二区光的照射下,对4T1复发性肿瘤模型展现出了显著的抑制效果。这一发现不仅深化了我们对PDT与免疫治疗协同作用机制的理解,也为开发更加高效、精准的抗肿瘤疗法提供了新的策略与思路。
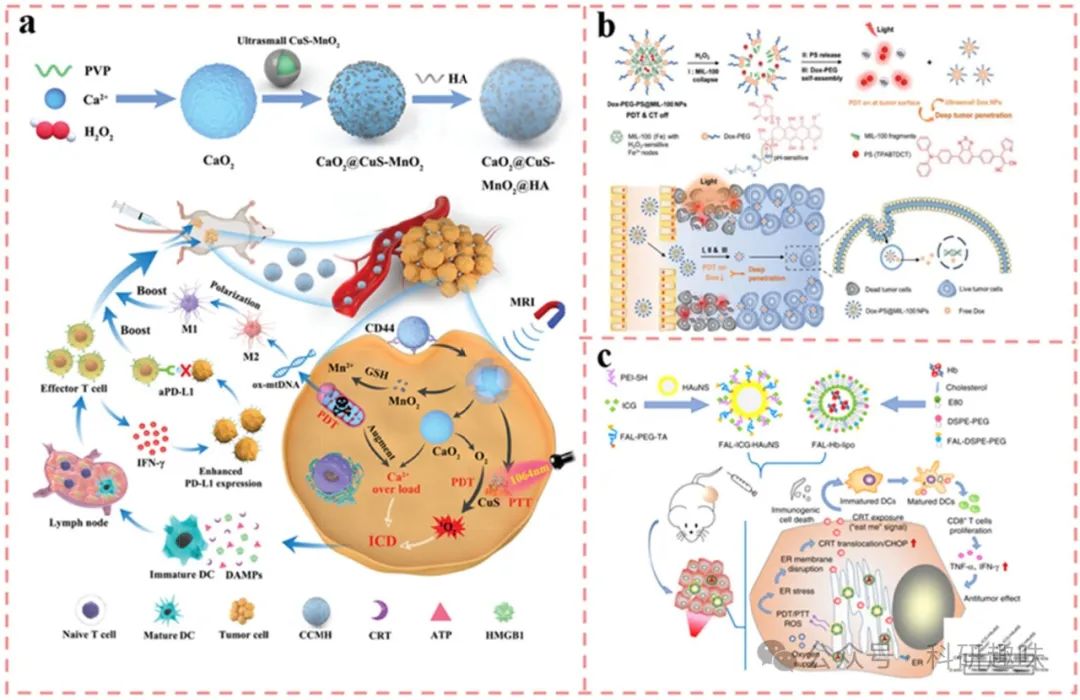
图 6. ICD 增强策略
在探讨肿瘤治疗策略的多样性时,除了光动力疗法(PDT)外,化学治疗药物如多柔比星(DOX)、奥沙利铂(OXa)和环磷酰胺也被证实能够通过诱导免疫原性细胞死亡(ICD)来激活宿主免疫反应。Wang及其团队独创性地合成了具有(供体)-A'(辅助受体)-π(π间隔物)-A(真正受体)独特构型的聚集诱导发光分子(AIEgens)(https://doi.org/10.1002/adfm.202010241),并借助纳米级铁(III)和铜(II)金属有机框架(MOF,具体为MIL-100)实现了聚乙二醇甲醚(PEG)链与AIEgens的连接,同时构建了治疗剂的环境响应性级联释放系统(如Dox-PEG-PS@MIL-100,图6b所示)。该系统在肿瘤部位,因H2O2的过表达促使MIL-100结构瓦解,从而精准释放DOX-PEG与光敏剂(PSs),后者在肿瘤间质中进一步自组装成超小型DOX纳米颗粒(NPs),有效穿透肿瘤组织,进入细胞核,直接损伤DNA,协同增强ICD的触发效率。
另一方面,钙网蛋白(CRT)所在的内质网(ER)作为细胞信号传导的核心,其应激状态是DAMPs释放的关键途径。因此,精确地将光敏剂(PSs)靶向至ER对于激发ICD相关的免疫原性至关重要。然而,挑战在于,多数PSs在细胞内化后难以有效积累于ER中。Wei等研究者通过巧妙的设计,将叶酸(FAL)肽修饰的脂质体应用于吲哚菁绿(ICG)耦合的空心金纳米球(HAuNS)表面(FAL-ICG-HAuNS,图6c)(https://doi.org/10.1038/s41467-019-11269-8),实现了对ER的特异性靶向。在近红外光激发下,FAL-ICG-HAuNS引发了强烈的ROS介导的ER应激,显著上调了ER凋亡相关蛋白CHOP的表达,并促使ER向细胞表面转位。这种ER靶向策略显著增强了ICD效果,进而有效抑制了肿瘤生长,并延长了动物模型的生存期。
综上所述,PDT触发的ICD在前期临床研究中展现了巨大潜力。然而,面对肿瘤缺氧微环境、肿瘤细胞通过分子机制规避免疫监视以及肿瘤免疫微环境(TIME)中复杂成分的相互作用,单纯依赖PDT诱导的ICD尚难以完全根除癌细胞。因此,探索PDT与其他治疗手段的联合策略,如化疗药物的协同作用,成为未来研究的重要方向,以期实现更高效的肿瘤治疗。
2. 减少免疫抑制相关细胞因子的光动力疗法
在肿瘤免疫治疗的演进历程中,细胞因子作为先驱治疗药物,其应用开启了全新的治疗篇章。随着信息技术的飞跃与肿瘤微环境(TME)认知的深化,细胞因子导向的疗法凭借其增强其他治疗手段活性或减轻免疫相关毒性的能力,成为科研领域的热点。当前,聚焦于调节血管内皮生长因子(VEGF)、吲哚胺2,3-双加氧酶(IDO)及缺氧诱导因子(HIFs)的生物材料研究尤为活跃,这些因子在肿瘤生长与复发中扮演关键角色。
鉴于光动力疗法(PDT)高度依赖氧气生成活性氧(ROS)以杀灭肿瘤细胞,而VEGF作为关键的氧调节因子,在缺氧严重的深部肿瘤区域过度表达,成为肿瘤复发的重要推手。因此,在PDT中同步抑制VEGF的过度表达,对于提升肿瘤治疗效果至关重要。Dong等人巧妙设计了一种基于树枝状精氨酸阳离子两亲肽与二硫键连接硬脂酸的纳米载体(ALS)(https://doi.org/10.1002/adhm.202001850),该载体能够同时递送疏水型光敏剂(PS)HPPH与VEGF的小干扰RNA(siVEGF)(图7a)。此策略旨在通过基因沉默技术下调VEGF表达,改善肿瘤内部缺氧状态,从而优化PDT效果。
值得注意的是,该团队在光剂量调控上亦进行了深入考量:高剂量光(HDL)虽能增强PDT效应,但可能加剧TME缺氧,引发剧烈的细胞坏死、炎症反应及组织损伤;相比之下,低剂量光(LDL)诱导的细胞凋亡更为温和,且能通过激活细胞膜表面的钙离子(Ca²⁺)通道,增强细胞间通透性,促进PSs向深部肿瘤渗透。然而,单纯LDL不足以触发高效的光导放疗效应。为此,他们创新性地提出了交替使用低密度脂蛋白(LDL)与高密度脂蛋白(HDL)的策略(ALHDL),该策略不仅有效规避了细胞内外屏障,实现了siVEGF的高效递送与HPPH的深部渗透,还借助HDL的快速细胞消融能力,显著增强了PDT的整体疗效。
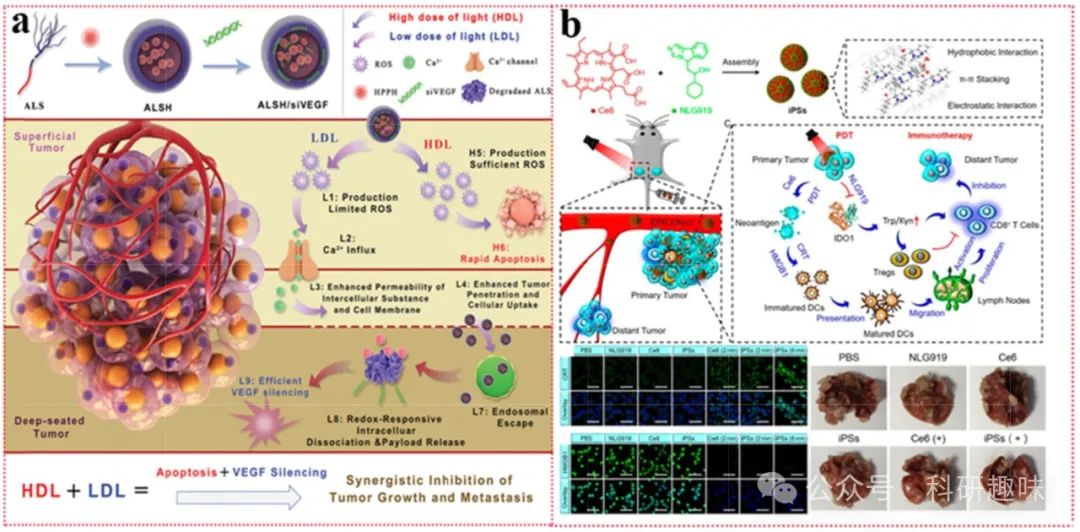
图 7. PDT 结合减少免疫抑制细胞因子的策略。
在纳米药物设计的前沿探索中,吲哚胺2,3-双加氧酶-1(IDO-1)抑制剂如NLG-919、1-甲基色氨酸(1-MT)及IND等,常被巧妙地融入其中。Zhao及其团队通过创新的策略(https://doi.org/10.1021/acsnano.0c06765),利用π-π堆积、疏水相互作用以及离子键的协同作用,成功地将光敏剂二氢卟吩e6(Ce6)与IDO-1抑制剂NLG919自组装成无载体、自我递送的光免疫纳米体系(iPSs,图b)。此设计不仅实现了Ce6与NLG919的高效共递送,还显著提升了二者的溶解性能,从而在光动力敏化免疫治疗领域展现出非凡潜力。
实验结果显示,iPSs系统对原发肿瘤及远处转移病灶均表现出优异的抑制效果,进一步在转移性CT26肿瘤模型小鼠中验证了其抑制肺转移的能力。该体系简洁的制备流程及其显著的光动力敏化免疫治疗功效,预示着其在临床应用中具有巨大的潜力和价值。
尽管众多临床前研究数据支持IDO-1抑制剂与光动力疗法联合应用的优越性,但值得注意的是,并非所有肿瘤均呈现IDO-1阳性表达,因此,在评估其临床应用前景时,需对原发性肿瘤及转移瘤中IDO-1的表达水平进行细致考量。尽管单一IDO-1抑制剂在现有研究中尚未能单独激发强烈的免疫反应,但光动力疗法与IDO-1抑制剂之间的显著协同作用,无疑为肿瘤治疗提供了新的思路与方向。因此,深入探索并优化这一联合疗法,应成为未来研究的重要课题。
3. 以 PDT 为靶点的肿瘤免疫治疗
3.1. 调节 T 细胞的 PDT
在肿瘤微环境(TME)的免疫应答机制中,细胞毒性T细胞(Cytotoxic T Lymphocytes, CTLs)占据着至关重要的核心地位。为了精准且高效地激活这些CTLs以攻击肿瘤细胞,纳米药物技术提供了一种创新的解决方案,能够直接将免疫治疗药物靶向递送至CD8+ T细胞表面。通过这一策略,CD8+ T细胞能够响应趋化因子浓度梯度的引导,有效迁移并渗透至肿瘤组织内部。
在众多免疫检查点中,PD-1/PD-L1通路因其深入的研究基础和明确的疗效机制,成为了免疫疗法中的典范。在纳米药物的设计策略中,针对该通路的抑制方法多种多样且日益精进。其中,单克隆抗体(mAbs)因其高特异性和强亲和力,被广泛用于阻断PD-1或PD-L1的结合,从而解除对T细胞活化的抑制。此外,小分子PD-1/PD-L1抑制剂通过化学阻断的方式,同样能够有效地干扰该通路的信号传导。
除了直接针对蛋白-蛋白相互作用的策略外,纳米药物还引入了先进的基因干扰技术,如RNA干扰(RNAi),通过特异性地降解或抑制PD-1或PD-L1的mRNA,从而在基因表达层面实现对通路的调控。这些创新方法不仅丰富了免疫治疗的工具箱,也为个性化医疗和精准治疗提供了有力支持。
综上所述,纳米药物技术在细胞毒性T细胞的免疫治疗中展现出了巨大的潜力和优势,通过精准递送和高效抑制PD-1/PD-L1通路等策略,有望为肿瘤患者带来更加安全、有效的治疗选择。
Table 3. PDT combined with tumor-associated immune landscape modulation therapeutic strategy.
| Target | System | PSs & immunotherapeutics | Types of Immunotherapeutics | Mechanisms | |
|---|---|---|---|---|---|
| T cell | Transition Metal Complex | ICG/αPD-1 | mAbs | Reducing the reducing substance GSH in TME and increasing ROS levels induces a powerful ICD storm that works with αPD-1 to eradicate tumors | |
| PFC | PFC vector-coated HEK293T cell membranes expressing PD-1 protein | PD-1 protein | Boosting DC cell maturation and tumor infiltration of cytotoxic T lymphocytes | ||
| Albumin | A heptamethine cyanine dye analog (nIR-68) with tumor selectivity and mitochondrial targeting/lonidamine | OXPHOS destructive agent | Activation of AMPK by selective disruption of OXPHOS in tumor cells and further leading to accumulation and degradation of PD-L1 at ER; sensitization of PDT by inhibition of endogenous oxygen consumption | ||
| nucleic acid nanogel | Pheophorbide A/si PD-L1 | siRNA | Use of si PD-L1 as the cross-linker to avoid digestion by nucleases; si-PD-L1 knocks down intracellular PD-L1; DNA fraction assists in enhancing the water solubility of PPA. | ||
| Polymeric nanocapsules | Pheophorbide A/αPD-1 | mAbs | PDT promotes IFN-γ intratumoral secretion by triggering ICD; inhibition of endogenous SLC7A11 and SLC3A2 expression by IFN-γ induces ferroptosis of tumor cell; Ferroptosis counteracts IFN-γ-induced PD-L1 upregulation in tumor cells in concert with αPD-1. | ||
| Polymeric nanocapsules | AIE PS (TPRA)/DC-DPPA | PD-L1 blocking peptide | Promoting apoptosis-pyroptosis transition after PDT through epigenetic modulation;Immunogenic pyroptosis combined with ICB therapy induces a robust tumor immune response. | ||
| (Upconversion nanoparticles) UCNPs | Ce6/αCTLA-4 | mAbs | Effective ablation of irradiated deep and distant tumors through the intrinsic properties of UCNPs combined with αCTLA-4 | ||
| Self-assembled nanostructure | Ce6/αPD-L1 and αCTLA-4 | mAbs | Simultaneous delivery of multiple mAbs; Red fluorescence image-guided surgery based on Ce6 can be realized. | ||
| TAM | Re-educating TAMs and inhibiting the recruitment of macrophages | nanomaterial with p–n type heterojunction | BiFeO3/Bi2WO6 (heterostructured photocatalyst) | / | (1) Separation of photoinduced hole-electron pairs for photoactivated self-supply of O2; (2) Simultaneous generation of ROS and O2 and collaborative reprogramming of TAMs |
| Polymeric nanocapsules | IR780/CUDC2 | EGFR & CD47 inhibitor | Enhancement of phagocytosis by inhibition of CD47 binding to SIRPα; Re-education of TAMs by PDT-induced P53 expression | ||
| Enhancing phagocytosis | Bovine serum albumin | Ce6/PEP20 | CD47 inhibitory peptide | CD47-SIRPα blocking; Depletion of reducing substances and amplification of PDT; Self-supplied O2; Ferroptosis activation and sensitization. | |
| MDSCs | Re-educating MDSCs | Mesoporous CuS nanoparticles | PpIX/docetaxel (Low dosage) | Chemotherapeutics | Low-dose chemotherapeutics induced phenotypic polarization in MDSCs; PDT amplified immunostimulation. |
| Eliminating MDSCs | Porphyrinic metal–organic framework (pMOF) | meso-tetra (4-carboxyphenyl) porphine/Gemcitabine | Chemotherapeutics | Elimination of MDSCs mediated by gemcitabine; Small-sized nanomedicines ensure deeper intratumoral penetration. | |
| DCs | Based on cGAS-STING pathway | pMOF | TCPP/Mn (ⅠⅠ) | Metal Forest | Nucleus-targeted AS1411 aptamer lead TCPP to the nucleus for direct DNA damage; HDAC inhibitors prevented DNA repair; Mn (ⅠⅠ) facilitated cGAS-STING recognition of ds DNA. |
| Based on toll-like receptors (TLR) agonists | Mesoporous silica nanoparticles (MSN) | Ce6/CpG & Adpgk (neoantigen peptide) | TLR agonists | neoantigen peptide triggered a robust neoantigen-specific T-cell response; CpG and ICD contributed to the phenotype and function of DCs in different dimensions. | |
| Based on inflammatory death of tumor cells | sericin derivative | IR780/Tumor cell contents | Cancer vaccine | IR780-induced mito ROS production activated GSDME-dependent pyroptosis and generated a sustained immune response. | |
| CAFs | Therapeutic diagnostic probes | methylene blue (MB)/FAPα-cleavable peptide substrate | FAPα-cleavable peptide substrate | FAPα-activatable local pro-therapeutic diagnostic probe; Specific killing of CAFs at the tumor site. | |
| Cancer metabolism | Targeting glucose metabolism | Self-assembled nanostructure | Ce6/Salvianolic acid B Ce6/GLS inhibitor compound 968 | Chemotherapeutics | inhibiting the cancer-specific (HK2); Acting on GLUT1 to alleviate hypoxia in tumor tissues. |
| Targeting amino acid metabolism | Carrier-free self-assembled nanostructures | Ce6/GLS inhibitor compound 968 | Chemotherapeutics | Inhibiting glutamine metabolism, and reducing GSH production to sensitize PDT; Inhibition of M2-type TAM glutamine metabolism and re-education of TAM. |
在肿瘤免疫治疗领域,一种被广泛采纳的策略是将针对程序性死亡受体-1(PD-1)或其配体PD-L1的单克隆抗体(mAbs)与具备光动力疗法(PDT)功能的纳米药物进行直接整合。此策略旨在实现双重治疗效应:首先,多功能纳米药物通过逆转肿瘤免疫微环境(TIME)的抑制状态,将原本“冷”(非免疫原性)的肿瘤转变为“热”(免疫原性)肿瘤,从而优化肿瘤微环境(TME),使其更利于免疫检查点阻断(ICB)疗法的实施。其次,PDT诱导的免疫原性细胞死亡(ICD)与ICB疗法形成协同效应,不仅降低了免疫检查点抑制剂(ICI)的日给药剂量,还显著减少了免疫相关不良事件(irAEs)的发生。
Hou等人创新性地设计了一种纳米平台,该平台能够激发强烈的活性氧(ROS)风暴并触发ICD级联反应(https://doi.org/10.1016/j.cej.2022.134778)。他们通过温和的化学方法,利用酰肼化透明质酸与Cu²⁺进行交联,并借助原位矿化技术形成酰肼化铜配位结构,最终合成了一种兼具谷胱甘肽(GSH)氧化酶样活性和过氧化氢(H2O2)酶样活性的铜基药物载体。随后,他们将吲哚菁绿(ICG)的磺酸基团以配位键形式锚定在这一纳米平台上,构建了HA@Cu(OH)₂-ICG体系(图a)。该铜基载体凭借其固有的酶活性,能够提升TME内的氧化应激水平,通过消耗还原性谷胱甘肽(GSH)来触发剧烈的ROS风暴。尤为关键的是,HA@Cu(OH)₂-ICG与αPD-1抗体的联合应用,在彻底清除原发性肿瘤的同时,有效激发了全身性的抗肿瘤免疫反应,从而有效遏制了肿瘤的转移与复发。
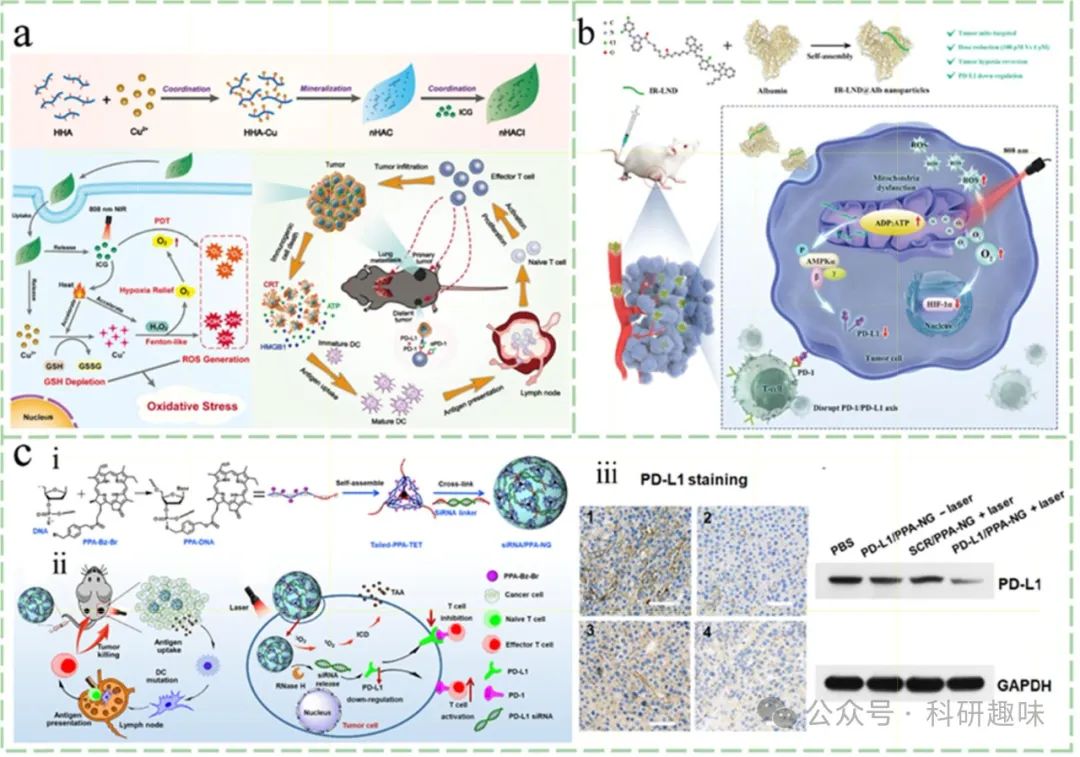
图 8. PDT 与靶向 PD-1/PD-L1 通路阻断的联合策略。
在深入探讨肿瘤免疫治疗的策略时,将抗PD-1/PD-L1抗体、多肽与纳米药物或生物材料的整合成为了一个重要的研究方向,旨在实现多层次的协同治疗效果。鉴于免疫球蛋白G(IgG)抗体的Fc区具有高度保守性,抗IgG(Fc特异性)抗体(αFc)能够通过非共价相互作用特异性地识别并结合任何含有Fc片段的单克隆抗体(mAbs)。Jiang等人巧妙地利用这一点,通过将αFc氧化偶联至纳米粒子表面,构建了多抗体偶联平台(αFc-NP)(https://doi.org/10.1038/s41467-021-21497-6)。该平台能够在温和条件下通过Fc识别机制,有效固定包括αPD-1和αPD-L1在内的多种mAbs,形成免疫调节纳米适配体(imNAs)。在多个动物模型中的研究表明,与常规组合相比,imNAs能够显著增强NK细胞、效应T细胞和巨噬细胞介导的免疫反应,然而,这仅是抗体组合治疗的初步探索,要实现肿瘤的彻底清除,还需与其他治疗手段联合应用。
值得注意的是,尽管抗PD-1/PD-L1抗体在临床应用中取得了显著成效,但它们主要作用于T细胞表面的PD-1/PD-L1轴,而对细胞内PD-L1蛋白的调控有限。为此,研究者们开始探索小分子抗肿瘤药物如多肽、奥希莫替尼以及氧化磷酸化(OXPHOS)抑制剂在PD-1/PD-L1抑制方面的潜力。特别是,OXPHOS抑制剂通过干扰线粒体能量代谢,激活AMPK信号通路,进而促进PD-L1的降解,为肿瘤治疗提供了新的思路。Liu等人通过将lonidamine(LND)与线粒体靶向的七甲基青染料类似物(nIR-68)结合,创制了新型化合物IR-LND(https://doi.org/10.1002/adma.202206121),并利用白蛋白递送系统(IR-LND@Alb)实现了肿瘤组织的优先积累。这一策略不仅增强了药物的靶向性,还通过抑制线粒体功能,有效降低了细胞内PD-L1的表达,展现了良好的抗肿瘤效果。
此外,针对疏水性光敏剂(PS)与大分子mAbs理化性质差异导致的封装难题,研究者们开发了基于核酸凝胶的递送系统。Guo等人通过将光敏剂Ppheophorbide A(PPA)共价接枝到硫代磷酸酯修饰的DNA骨架上,构建了超分子自组装的核酸凝胶。(https://doi.org/10.1126/sciadv.abn2941)同时,利用siPD-L1作为交联剂,将siRNA嵌入三维核酸凝胶结构中,形成了siRNA/PPA-NG复合物。该复合物不仅继承了核酸的优异水溶性,还通过保护siRNA免受核酸酶降解,提高了其生物稳定性和治疗效果。
在基因治疗领域,CRISPR/Cas9技术为实现PD-1或PD-L1基因的精确敲除提供了可能。通过敲除CAR T细胞中的内源性_Pdcd1_基因座或PD-1基因,可以避免PD-1的长期刺激导致的T细胞功能障碍和衰竭。初步的临床研究表明,PD-1基因敲除的CAR T细胞在合成免疫功能正常的小鼠模型中表现出长期的功能稳定性和有效性。然而,目前尚无文献报道将PDT与PD-1基因敲除策略相结合的研究。随着KO CAR-T细胞临床数据的积累,探索PDT与PD-1基因敲除的联合疗法,以增强抗原递呈细胞(APC)的抗原递呈能力,将成为未来研究的重要方向。
综上所述,通过整合纳米技术、基因编辑技术以及小分子药物等多种治疗手段,我们可以构建出更加高效、精准的肿瘤免疫治疗方案。这些方案的实施不仅依赖于对免疫系统和肿瘤学复杂性的深入理解,还需要跨学科的合作与创新,以推动肿瘤免疫治疗领域的持续发展。
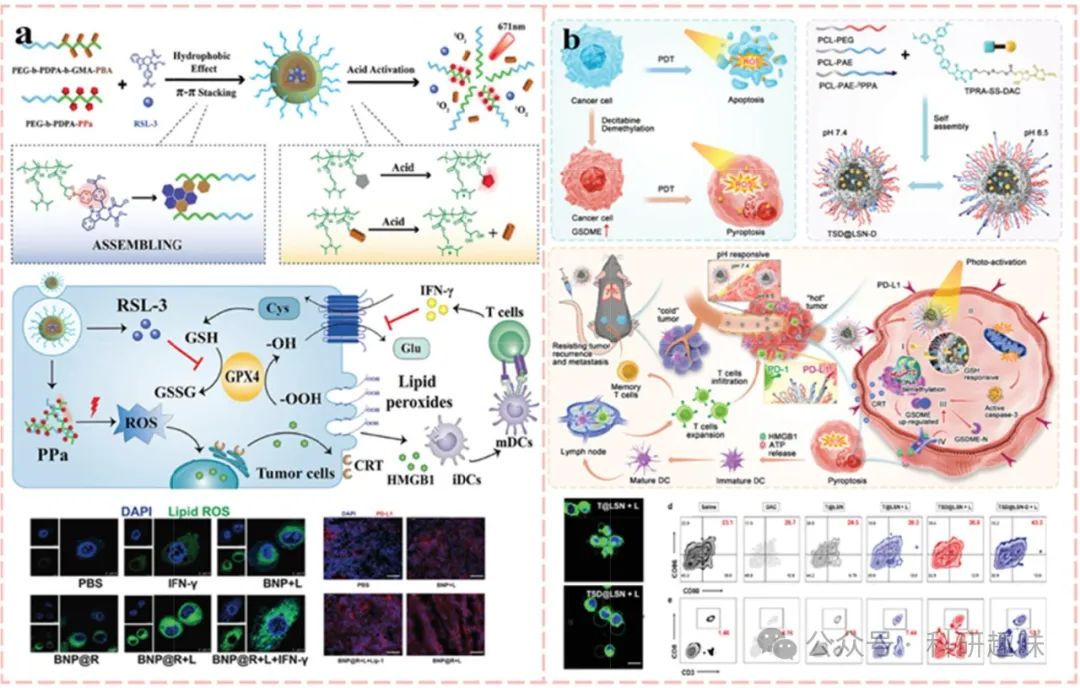
图 9. 多种癌症疗法与 ICB 策略的结合。
在深入探索免疫系统与肿瘤学复杂交互的进程中,将免疫检查点阻断(ICB)疗法与其他癌症治疗手段相结合,已成为未来研究的主流趋势。近期,铁代谢与免疫应答之间的动态联系在癌症治疗领域备受瞩目。具体而言,铁凋亡通过调节免疫细胞表型、释放KRAS蛋白及影响TAMs极化,深刻影响着肿瘤微环境(TME)。同时,T淋巴细胞浸润释放的IFN-γ在TME中抑制SLC7A11和SLC3A2表达,进而诱导肿瘤细胞铁凋亡。值得注意的是,光动力疗法(PDT)通过触发免疫原性细胞死亡(ICD),不仅直接促进免疫细胞在TME中的浸润,还间接增强了IFN-γ的分泌,从而进一步诱导铁凋亡。基于这些发现,Song等人巧妙地设计了一种pH响应性纳米药物系统,该系统利用PEG-b-PDPA二嵌段共聚物与可酸解的苯硼酸酯(PBE)动态共价键构建囊泡,将GPX4抑制剂RSL-3包封其中,并在酸性TME中(pH 5.8-6.2)触发药物释放,协同增强PDT、ICD及铁凋亡效应,同时抵消IFN-γ诱导的PD-L1上调,与αPD-1阻断形成协同效应。
尽管细胞凋亡是癌症治疗的重要策略,但癌细胞对凋亡的抗性及免疫原性不足限制了其疗效。相比之下,热凋亡作为一种炎症性程序性死亡方式,以其独特的质膜破裂、细胞肿胀及大量促炎性细胞因子释放为特征,有效促进了肿瘤相关抗原(TAAs)的暴露。这一过程的关键在于caspase炎症体介导的gasdermin-E(GSDME)裂解,生成具有膜穿孔活性的GSDME-N片段。然而,肿瘤细胞中GSDME的低表达限制了PDT诱导的热凋亡效果。为此,Wang等人通过DNA去甲基化策略(https://doi.org/10.1002/adfm.202214499),将DNA甲基转移酶抑制剂地西他滨与AIE光敏剂TPRA共价偶联,制备了肿瘤微环境响应性释放的原药(TSDs),并结合pH响应性共聚物纳米载体,实现了PDT后肿瘤凋亡向热凋亡的转变,显著增强了免疫原性和治疗效果。
此外,一种新兴的铜依赖型细胞死亡方式——铜死亡(cuproptosis)正逐渐成为研究热点。细胞内铜积累可触发线粒体脂质过氧化及Fe-S簇蛋白不稳定,进而诱导细胞死亡。鉴于铜离子载体能增强肿瘤细胞PD-L1表达,将铜突变诱导剂与ICI结合展现出巨大治疗潜力。Guo等人利用ROS敏感的非离子生物可降解聚合物包裹铜离子载体伊利司莫(ES)和铜(https://doi.org/10.1002/adma.202212267),构建了NP@ESCu纳米系统,实现了线粒体铜的持续积累,不仅诱发了杯突症,还显著增强了ICI对肿瘤细胞的杀伤效果,同时重塑了肿瘤免疫格局。这一研究为PDT与杯突症的结合提供了新思路,预示着两者联合应用将成为增强抗肿瘤免疫应答的重要策略。
在深入探讨其他关键免疫检查点,诸如CTLA-4、LAG3信号传导路径以及TIM3受体等领域时,当前的研究趋势倾向于构建精密的纳米平台,这些平台能够直接靶向并结合上述通路或受体的特异性抑制剂,以此激发强劲的肿瘤免疫原性反应。以Xu等人的创新研究为例(https://doi.org/10.1021/acsnano.7b00715),他们巧妙地利用上转换纳米颗粒(UCNPs)作为载体,将光敏剂Ce6与Toll样受体7(TLR-7)激动剂咪喹莫特(R837)协同装载于内,实现了肿瘤相关抗原(TAAs)的高效释放与呈现(图10a)。这一过程中,UCNPs凭借其独特的多光子吸收/单光子发射特性,成功将长波长光转换为短波长光,有效穿透并消融深层肿瘤组织。进一步地,通过将抗CTLA-4检查点阻断疗法与这一纳米系统相结合,不仅显著增强了局部及远处肿瘤的治疗效果,还诱导了强大的免疫记忆效应,为长期抗肿瘤免疫提供了坚实基础。值得注意的是,Ce6与免疫球蛋白G(IgG)之间的纳米摩尔级亲和力,确保了其在药用赋形剂聚乙烯吡咯烷酮(PVP)的辅助下能够自发组装成稳定的纳米结构(https://doi.org/10.1021/acsnano.9b03466)。这一纳米平台不仅实现了多种单克隆抗体(mAbs),如αPD-L1和αCTLA-4的共递送,还依托Ce6的光学特性(图10b),实现了红光荧光成像引导下的精准手术操作,为肿瘤治疗的可视化与个性化开辟了新途径。
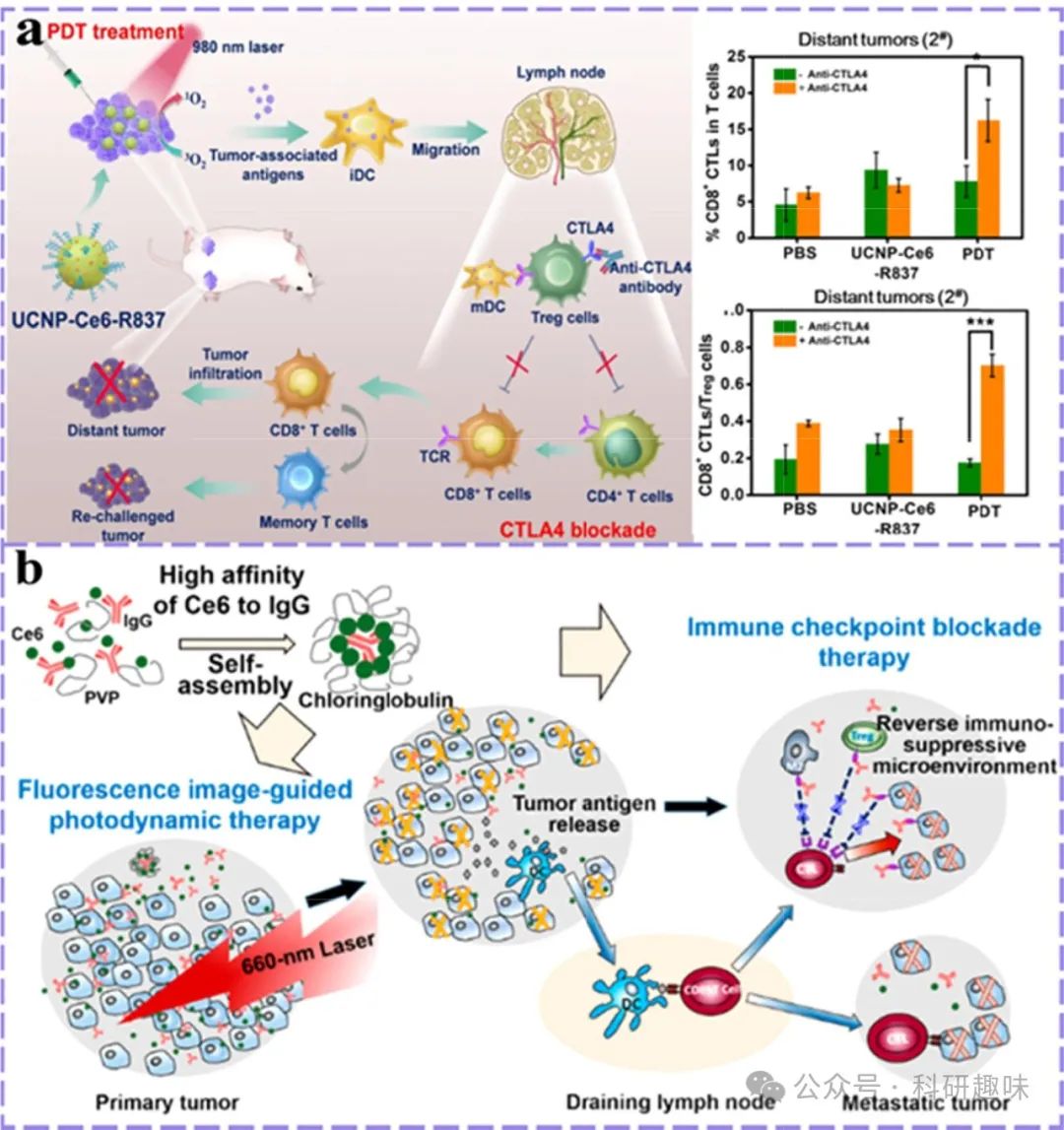
图 10. 光导疗法与其他免疫检查点阻断剂的结合。
3.2. 调节肿瘤相关巨噬细胞的 PDT
在探讨肿瘤微环境(TME)调控中,肿瘤相关巨噬细胞(TAMs)的角色至关重要,它们通过多种机制驱动肿瘤的生长与进展。光动力疗法(PDT)作为一种先进的治疗手段,能够干预TAMs的免疫抑制功能,不仅通过释放肿瘤相关抗原(TAAs)重塑免疫环境,还加速线粒体活性氧(ROS)的生成,诱导线粒体DNA(mtDNA)氧化损伤,进而促进M1型TAMs的极化。当前研究聚焦于利用PDT直接或联合针对TAMs的特异性治疗药物,以干扰其生存信号、功能转变、增强吞噬活性、抑制招募,并推动其向抗肿瘤表型转化。
氧气作为生命活动的基石,在缓解肿瘤缺氧、调节TAMs招募与极化、促进T细胞浸润等方面扮演着关键角色。尽管PDT能借由ROS生成刺激M1型TAMs极化,但使用II型光敏剂(PSs)可能加剧TME的缺氧状态,对M1极化介导的抗肿瘤免疫产生不利影响。为此,将I型PSs与纳米平台集成的缺氧缓解策略应运而生,如Yang等人设计的p-n型异质结光催化剂BiFeO3/Bi2WO6纳米复合材料(https://doi.org/10.1002/adma.202108908),经PVP改性后,在近红外光激发下高效分离光生空穴-电子对,与H2O和过量H2O2反应生成ROS与O2,同步实现肿瘤消融与TME缺氧缓解,增强了放疗敏感性与免疫微环境的双重优化。此外,该材料还具备CT成像潜力,为诊疗一体化提供了可能。
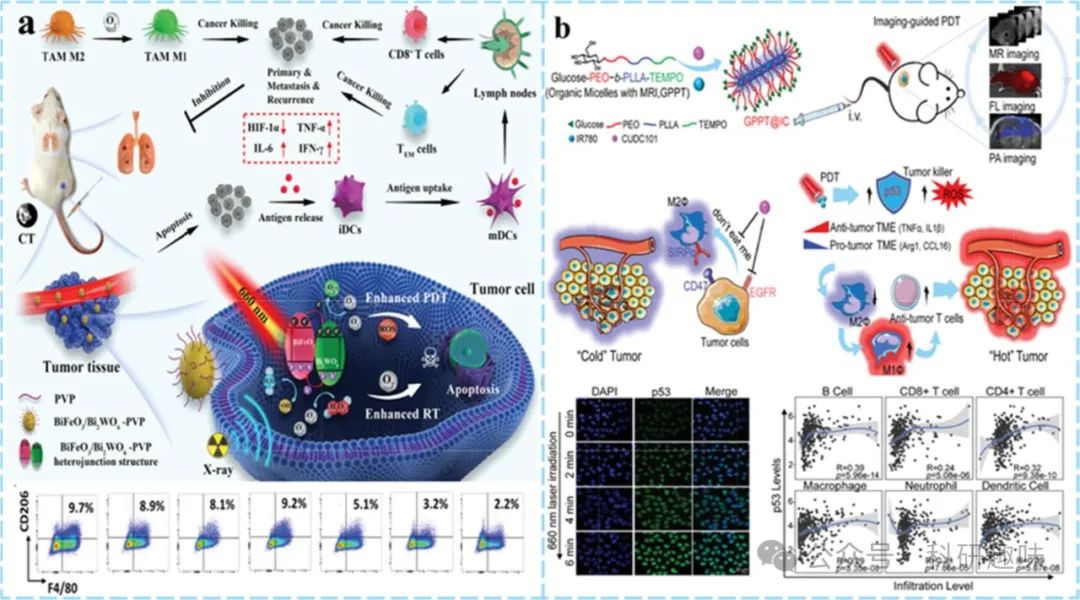
图 11. 利用 PDT 重极化 TAMs 策略。
脂质体作为纳米医学领域的明星载体,能够封装多种治疗药物。Cheng等人的工作利用葡萄糖基多嵌段共聚物构建了集成化TME调控胶束,共包载疏水PS(IR780)与多靶点抑制剂CUDC2(https://doi.org/10.1002/adma.202107674)。CUDC2通过抑制CD47-SIRPα相互作用及重编程TAMs为抗肿瘤表型,显著增强了吞噬效能。尤为重要的是,PDT诱导的P53表达进一步促进了TAMs的再教育,验证了PDT与TAMs靶向疗法协同作用的科学基础。
巨噬细胞作为先天免疫的关键防线,其吞噬能力对于肿瘤清除至关重要。肿瘤细胞表面CD47与巨噬细胞SIRPα的结合形成了免疫逃逸的屏障。He等人创新性地设计了集氧气自供、铁死亡激活与免疫激活于一体的纳米平台(https://doi.org/10.1016/j.biomaterials.2022.121832),利用BSA搭载Ce6与Hemin,并表面修饰CD47抑制肽PEP20包覆的M1巨噬细胞膜(MP@CH/BSA NP)。该平台通过血红素模拟过氧化氢酶(CAT)活性缓解肿瘤缺氧,提升Ce6光疗效率,同时触发铁死亡路径。CD47抑制肽的引入显著增强了巨噬细胞对肿瘤细胞的吞噬能力,并经由IFN-γ过表达与Xc-系统下调,增加了肿瘤细胞对铁死亡的敏感性,为肿瘤综合治疗策略开辟了新的视角。
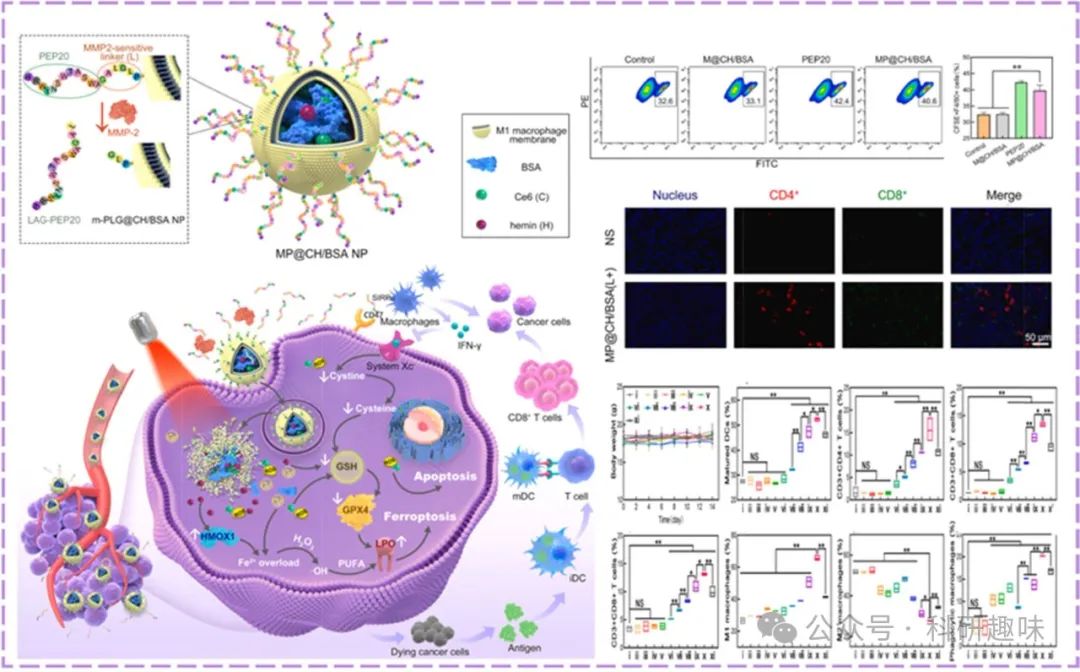
图 12. 利用 PDT 增强吞噬作用的策略。
在探讨肿瘤微环境(TME)中肿瘤相关巨噬细胞(TAM)的调控机制时,阻断循环单核细胞向TAM的补充路径成为了一种间接抑制TAM促肿瘤作用的有效策略。这一过程的核心在于调控趋化因子网络,因为循环单核细胞的募集强烈依赖于多种趋化因子的导向作用。通过干扰这些趋化因子的信号转导路径,可以显著降低TAM在TME中的聚集密度,进而削弱其促肿瘤生长的功能。
近期的研究揭示了光动力疗法(PDT)对趋化因子及其受体表达谱的潜在影响。Zhu等人利用高通量芯片分析技术,系统地评估了5-氨基乙酰丙酸(5-ALA)介导的PDT对趋化因子和趋化因子受体表达的影响(https://doi.org/10.1016/j.pdpdt.2019.04.018)。他们发现,PDT后共有21种趋化因子和13种相关受体的表达显著上调,其中CXCL13尤为突出。这一发现表明,PDT不仅能够直接杀伤肿瘤细胞,还可能通过调节趋化因子网络来间接影响免疫细胞的募集和分布。
此外,除了趋化因子外,其他细胞因子如巨噬细胞迁移抑制因子(MIF)和单核细胞趋化蛋白1(MCP-1)在ALA介导的PDT后也表现出类似的分泌变化。这些细胞因子的变化可能进一步抑制了循环单核细胞的募集,从而减少了TAM的来源,最终削弱了TAM在TME中的促肿瘤作用。
4.3.3. 利用髓源性抑制细胞调控PDT
在深入剖析《免疫学》中关于免疫治疗(IT)对特定癌症疗效受限的论述时,我们认识到这一挑战主要归因于淋巴细胞与髓源性抑制细胞(MDSCs)之间的复杂相互作用及其有效过滤机制。最新科研进展揭示,低剂量传统化疗药物诱导的免疫原性细胞死亡(ICDs)能够激活免疫系统,具体表现为减少MDSCs比例并诱导其向M1样抗肿瘤表型转变。
Chen等人的研究中,巧妙地将介孔硫化铜纳米粒子(CuS NPs)作为光热治疗(PTT)的媒介(https://doi.org/10.1002/adma.201904997),并辅以低剂量多西他赛以协同激发免疫反应。为进一步扩大免疫刺激效果,他们创新地将聚乙烯亚胺修饰的原卟啉IX(PEI-PpIX)共轭物与CpG寡核苷酸交替锚定于纳米复合物表面,并通过迈克尔加成反应将肿瘤靶向配体叶酸(FA)接枝其上,形成FA-CuS/DTX@PEI-PpIX-CpG复合体系(a)。此体系中,多西他赛诱导的MDSCs表型极化促进了炎症因子的释放,进而增强了免疫反应,有效防止了细胞毒性T淋巴细胞(CTL)的功能障碍与失效。
此外,吉西他滨(GEM)作为另一种能够削弱MDSCs免疫抑制作用的化疗药物,尽管因其血液半衰期短而难以在肿瘤部位有效积累,限制了其治疗效果。为解决这一问题,研究者利用阳离子树枝状聚合物PEG-DGL将GEM包裹成约10纳米大小的纳米颗粒(https://doi.org/10.1002/advs.202000411),实现了在实体瘤组织中的深层渗透与高效递送,有效清除了肿瘤浸润的免疫抑制性微环境(TME)。进一步地,结合卟啉金属有机框架(pMOF)进行光导治疗,不仅增强了GEM的抗肿瘤效果,还通过ICD协同作用促进了肿瘤内CTL的浸润与肿瘤免疫微环境(TIME)的重塑(图13b)。
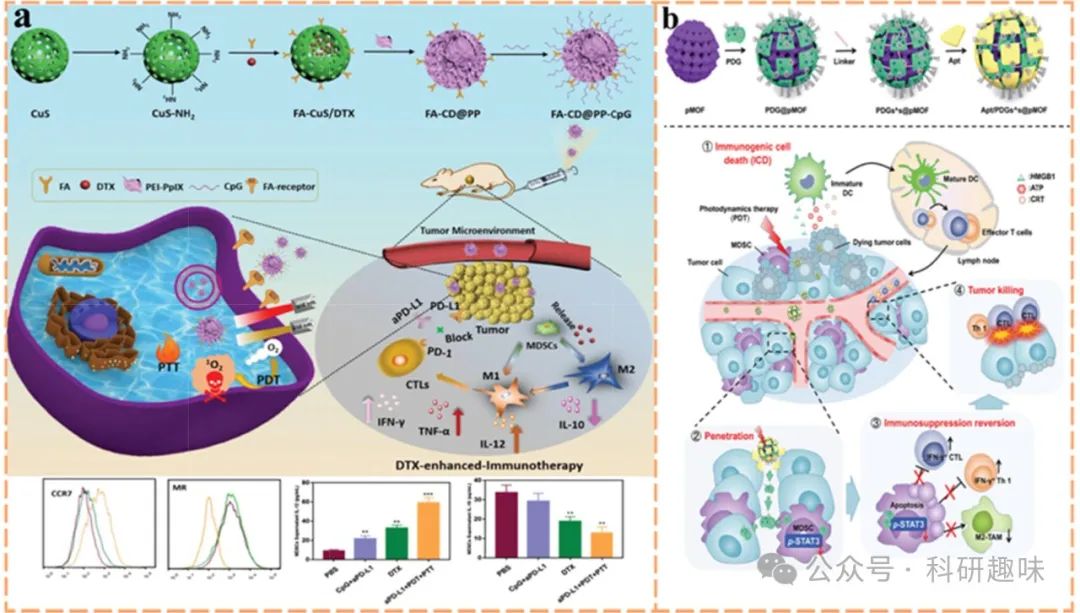
图 13. PDT 与 MDSCs 的调控。
4.3.4. 利用树突状细胞调控 PDT
在癌症的免疫逃逸机制中,抗原呈递功能的下调与丧失占据着核心地位。树突状细胞(DCs)凭借其独特的三大固有特性——在淋巴与非淋巴组织间的迁移能力、与细胞毒性T淋巴细胞(CTLs)的交叉呈递抗原能力,以及趋化因子与细胞因子的释放能力,成为激发强大且持久抗肿瘤反应的关键。因此,针对DCs的肿瘤免疫微环境(TIME)调控策略被视为极具潜力的治疗靶点。光动力疗法(PDT)诱导的免疫原性细胞死亡(ICD)在促进抗原呈递方面展现出积极作用,已催生多种策略以优化DC功能,包括:
- 1. 激活cGAS-STING通路:通过刺激环状GMP-AMP合成酶-干扰素基因刺激器(cGAS-STING)诱导的I型干扰素(IFN)信号通路,增强抗原呈递细胞(APCs)的激活状态。这一通路作为细胞质DNA的关键感知机制,在增强肿瘤与免疫细胞间交流、放大免疫反应方面发挥重要作用,尤其DC对其敏感性远超TME中其他免疫细胞。
- 2. 免疫佐剂联合应用:结合使用免疫佐剂,促进DC的增殖、成熟与存活,从而增强抗原呈递效率。
- 3. 炎性死亡模式诱导抗原释放:利用特定模式诱导细胞炎性死亡,促进肿瘤抗原的有效释放,为DC提供更多抗原源。
在先天免疫的框架下,cGAS-STING通路作为连接肿瘤与免疫系统的桥梁,其重要性日益凸显。赵等人通过创新策略,将组蛋白去乙酰化酶(HDAC)抑制剂伏立诺他(SAHA)封装于锰-卟啉金属有机框架(Mn(III)-TCPP MOF)中,结合PDT效应,通过诱导染色质解体和减少组蛋白-DNA相互作用,加速双链DNA(dsDNA)的释放。这一过程不仅增强了PDT对DNA的直接损伤,还通过Mn²⁺的释放激活了cGAS-STING通路,促进了先天性与适应性免疫的双重激活(https://doi.org/10.1002/adfm.202108883)。
此外,DCs通过Toll样受体(TLRs)感知抗原,TLRs的活化对DC的分化、表型调控及功能发挥具有关键作用。PDT与TLR激动剂(如CpG寡脱氧核苷酸,CpG ODN)的组合策略,能够从不同层面促进DC的成熟与活化,显著提升基于DC的免疫治疗的免疫原性。Cheng等人利用介孔二氧化硅纳米粒子(MSN)作为载体,成功实现了Ce6与CpG的共载,通过Ce6诱导的ICD增强免疫原性,同时CpG促进DC的抗原呈递,共同促进先天免疫的激活及新抗原特异性T细胞反应的引发(https://doi.org/10.1021/acsnano.9b06691)。
综上所述,通过精准调控DCs的功能状态,结合PDT及免疫佐剂的联合应用,为癌症免疫治疗开辟了新的路径,展现了广阔的临床应用前景。
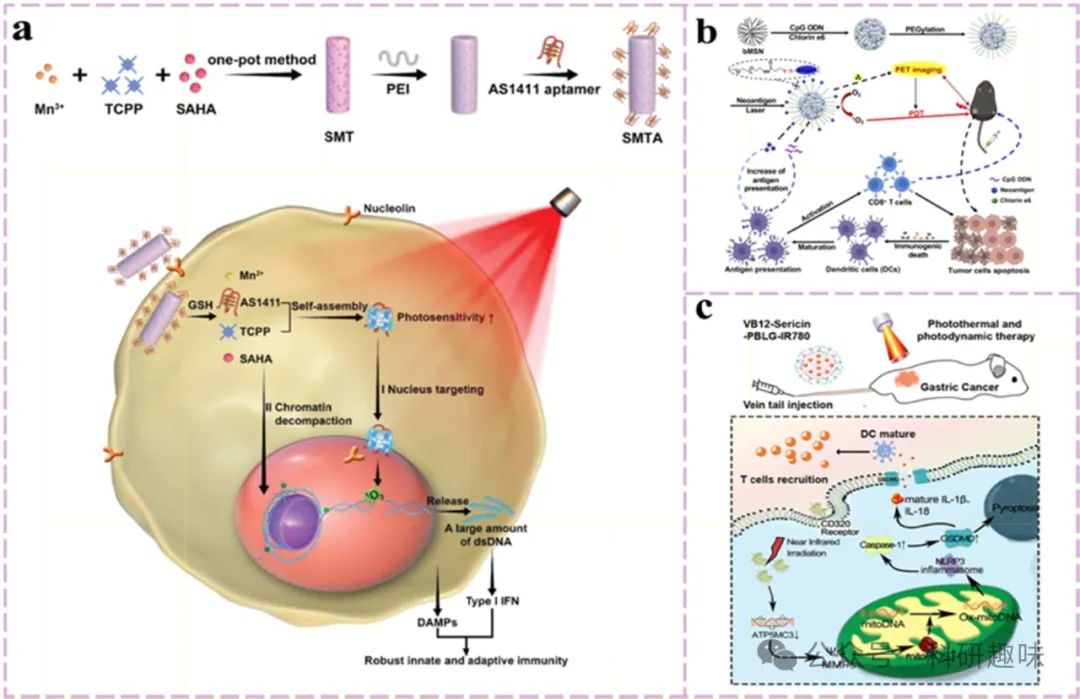
图 14. 利用 PDT 增强直流细胞抗原捕获能力的策略。
免疫原性细胞死亡(ICD)通过释放损伤相关分子模式(DAMPs)触发细胞凋亡过程,显著增强了细胞的免疫原性。然而,传统细胞凋亡往往呈现出“静默死亡”的特征,限制了免疫系统的有效响应。相比之下,热凋亡作为一种促炎性细胞死亡模式,其核心在于Gasdermin N端蛋白介导的质膜穿孔,导致细胞内容物的大量外泄,进而激发强烈的免疫反应,特别是树突状细胞(DC)的活化。这一过程的关键在于肿瘤细胞内Gasdermin家族成员GSDME的表达与活化。
在Caspase-3的催化下,GSDME被切割为GSDME-C(C端片段)和GSDME-N(N端片段),这一过程激活了肿瘤细胞的热解效应,即所谓的“化脓作用”。值得注意的是,尽管存在化学方法能够激活裂解酶,但其效能高度依赖于GSDME的表达水平,而GSDME在多种癌症中常表现为表达下调,这构成了治疗的一大障碍。
鉴于此,Guo等人提出了一种创新的光激活热蛋白沉积策略,利用丝裂霉素衍生物与聚(γ-苄基-L-谷氨酸)(PBLG)纳米载体,结合肿瘤靶向维生素B12(VB12)分子负载的光敏剂IR780(形成VB12-VB12-丝裂霉素-PBLG-IR780复合体系)(https://doi.org/10.1021/acsami.1c22804)。该策略通过增强肿瘤细胞对IR780的吸收,诱导线粒体活性氧(mitoROS)的爆发,进而激活GSDME依赖的热蛋白沉积机制,实现持续的免疫激活效应,包括免疫细胞的募集和免疫因子的释放。
综上所述,临床前研究表明,光动力疗法(PDT)增强的DC激活策略在多种癌症模型中展现出显著疗效,有效克服了传统DC改良剂在抗肿瘤效果上的局限性。此外,随着对DC亚群多样性及其在肿瘤微环境(TME)激活中作用机制的深入认识,针对特定DC亚群的靶向疗法与ICD的联合应用,为肿瘤治疗开辟了新的途径,有望开发出更加高效、精准的肿瘤疫苗。
4.4. 通过细胞外基质重编程增强 PDIT
细胞外基质(ECM)的重编程策略,通过调控肿瘤组织的血管生成,能够有效调节肿瘤微环境(TME)的氧合状态与能量供应,这一过程的核心在于抑制血管内皮生长因子(VEGF)的表达,此点已在4.1章节中详尽阐述。此外,鉴于癌细胞相关成纤维细胞(CAFs)作为肿瘤基质中最丰富的细胞类型,针对CAFs的靶向干预成为ECM重塑的另一关键途径。鉴于成纤维细胞活化蛋白α(FAPα)这一生物标志物在超过90%的人类肿瘤组织中普遍存在过表达现象,FAPα因此成为CAF靶向治疗的重要靶点。
Zhou等人开创性地设计了一种FAPα激活型治疗诊断探针(FMP)(https://doi.org/10.1002/adma.202211485),该探针创新性地融合了光动力疗法(PDT)与CAF特异性识别功能,旨在同时清除CAFs与癌细胞,进而削弱肿瘤细胞的侵袭与迁移能力。FMP由亚甲蓝(MB)基团与FAPα可裂解肽底物构成,后者通过氨基甲酸酯自硫醇连接,确保了探针的靶向性与响应性。在FAPα诱导的肽水解作用下,FMP能够主动靶向肿瘤区域,并释放活性MB分子,从而激活PDT并引导光声成像(PAI),实现了对肿瘤部位的精准治疗与监测。
然而,值得注意的是,直接靶向并灭活CAF可能导致组织平衡的破坏,反而促进肿瘤生长。因此,Xin等人提出了一种更为温和的策略(https://doi.org/10.1038/s41467-022-30306-7),他们将维生素D受体配体钙泊三醇(Cal)与典型的光敏剂吲哚菁绿(PS-ICG)共同封装于肿瘤衍生颗粒中,通过下调α-平滑肌肌动蛋白(α-SMA,CAF活化标志物)的表达,使CAF处于静息状态,而非完全消除,从而维持了组织稳态并抑制了肿瘤复发与转移。
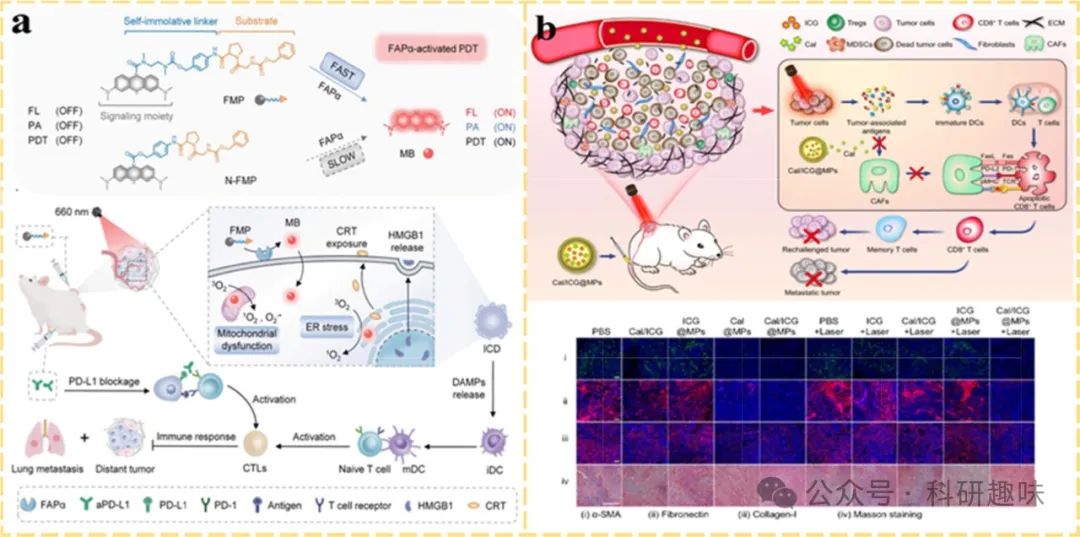
图 15. 通过细胞外基质重编程增强 PDIT 的策略。
更重要的是,PDT 与 CAFs 靶向疗法的结合不仅从机理上提高了疗效,而且由于 PDT 的局部光活化性质,如前面提到的情况,局部活化原药的设计只在激光照射部位释放 CAFs 靶向药物,避免了普通 CAF 靶向疗法的脱靶效应。
4.5. 通过针对癌症新陈代谢增强 PDIT
近年来,信息技术领域的突破促使科学界更加关注肿瘤微环境(TME)中非癌细胞的角色,这一认识复兴了对癌症特异性代谢途径靶向抑制策略的研究热情。该领域的研究焦点集中于代谢活跃的肿瘤细胞、免疫细胞及基质细胞间的复杂相互作用,这些细胞共同调控着肿瘤的生物学行为。
葡萄糖作为生物合成的基础,不仅为细胞提供能量,还作为碳骨架支撑生命活动。正常细胞依赖氨基酸和脂肪酸的代谢来维持其结构与功能,而癌细胞的生长与增殖则高度依赖于三羧酸循环(TCA)的中间产物、由氨基酸合成的新核苷酸(特别是嘌呤和嘧啶核苷酸)以及磷酸戊糖途径(PPP)中葡萄糖衍生的核糖。鉴于这些代谢特征,当前的治疗策略聚焦于精准打击肿瘤的葡萄糖代谢、氨基酸代谢及核酸代谢网络。
糖酵解,作为肿瘤葡萄糖代谢的独特且核心过程,其异常活跃是肿瘤的一个标志性特征。增加葡萄糖摄入可加剧肿瘤糖酵解,进而上调程序性死亡配体1(PD-L1)的表达,影响免疫治疗效果。因此,葡萄糖代谢途径被视为癌症治疗的新兴靶点。
Su等研究者创新性地设计了含有二硫键的有机硅交联胶束(S-S-OSCLMs)作为载体系统(https://doi.org/10.1016/j.biomaterials.2023.122017),该系统能够响应肿瘤细胞内高浓度的谷胱甘肽(GSH),精准递送己糖激酶2(HK2)抑制剂——丹酚酸B(Sal-B)以及Fe(Ⅲ)和Ce6的复合物(a)。与广泛使用的糖酵解抑制剂如3-溴丙酮酸和洛尼达明(它们分别针对甘油醛-3-磷酸脱氢酶和线粒体丙酮酸载体)相比,S-S-OSCLMs介导的HK2靶向策略显著降低了对正常细胞的潜在毒性。此外,Sal-B通过抑制PI3K/ATK/HIF-1α信号通路,不仅直接削弱糖酵解过程,还间接调控葡萄糖转运体1(GLUT1)的表达,改善TME的缺氧环境,从而增强了光动力疗法(PDT)的治疗效果。这一研究为开发高效、低毒的癌症代谢干预策略提供了新的视角和工具。

图 16. 利用新陈代谢干预的 PDT
鉴于癌细胞的快速增殖特性,其对合成代谢与能量的需求极为迫切,依赖多样化的代谢途径以维持生长与生存。除葡萄糖这一经典能量来源外,谷氨酰胺在提供合成代谢所需的碳源与氮源方面扮演着不可或缺的角色,并参与调控细胞内的氧化还原稳态。具体而言,谷氨酰胺酶(GLS)催化谷氨酰胺转化为谷氨酸,后者则是谷胱甘肽(GSH)从头合成的关键前体。肿瘤细胞通过上调GLS活性,促进GSH生成,从而有效清除活性氧(ROS),维护氧化还原平衡。值得注意的是,谷氨酰胺代谢与肿瘤免疫微环境(TIME)的塑造紧密相连,特别是免疫抑制性的M2型肿瘤相关巨噬细胞(TAMs)相较于M1型更依赖于此代谢途径。因此,靶向谷氨酰胺代谢成为了一种“一箭双雕”的治疗策略。
此外,脂肪酸与胆固醇代谢等其他代谢模式亦对免疫细胞功能产生深远影响。例如,细胞内不饱和脂肪酸水平上升可刺激巨噬细胞释放IL-1α等炎症因子,加剧炎症反应。当前,研究者正致力于通过调控肿瘤细胞与免疫细胞的代谢网络,以增强抗肿瘤免疫反应。Liu等人开发的双金属原子纳米酶,集成了多种酶活性(如CAT、GSHOx、OXD、POD、LOX及PLA2),通过靶向花生四烯酸代谢途径,触发铁代谢异常反应,并协同CD8+ T细胞分泌的IFN-γ重编程ACSL4相关磷脂代谢,展示了代谢干预在抗肿瘤免疫中的潜力。
尽管代谢干预与抗肿瘤免疫的协同作用已初露端倪,但肿瘤免疫逃逸的复杂代谢机制及免疫细胞的具体代谢需求尚未完全明晰,限制了其他代谢模式与PDT等疗法结合策略的探索。随着对TME中代谢调控机制的深入理解,联合疗法的治疗潜力将得到进一步挖掘,为抗肿瘤免疫疗法开辟更广阔的应用前景。
临床转化的挑战和未来展望
在过去的二十年间,纳米技术领域取得了显著进展,并成功在全球市场中占据了重要地位。然而,值得注意的是,尽管进展显著,但在光动力免疫疗法(PDIT)纳米药物的开发与转化过程中,临床前研究的数量与深度却未能与纳米技术的快速发展相匹配,这种不平衡状态对其未来可转化性构成了挑战,并引起了业界的广泛关注。
尽管如此,我们应当审慎地评估当前局势。近十年来,随着生物学与免疫学研究的深入,免疫系统各组分的功能逐渐得以揭示,这为纳米材料在PDIT中的应用提供了新的视角与理论依据。在此背景下,过早地否定或低估基于纳米材料的PDIT技术的潜力和进一步开发的必要性,显然是不合时宜的。
在推进纳米药物从设计、生产到临床试验的各个阶段时,必须采取严谨的科学态度,综合考虑多方面的因素。设计阶段需聚焦于优化纳米载体的物理化学性质,以实现药物的高效负载与靶向递送;生产阶段则需确保工艺的稳定性和产品的均一性,以满足临床应用的严格要求。而到了临床试验阶段,则需密切关注药物的安全性、有效性和生物相容性,为最终的转化应用奠定坚实基础。
Table 4. Summary of the studies on photodynamic nanomaterials activating tumor-associated immune landscape.
| Classification | Category | Key material | Nanoplatforms | Photosensitizer | Primary mode of action | Target | Cell Line |
|---|---|---|---|---|---|---|---|
| Inorganic materials | Metal oxides | CaO2 | CaO2@CuS–MnO2@HA | CuS | Type II ROS | ICD of tumor cells | 4T1 |
| BiFeO3/Bi2WO6 | BiFeO3/Bi2WO6-PVP | BiFeO3/Bi2WO6 (heterostructured photocatalyst) | Type II ROS | TAMs | 4T1 | ||
| Metal hydroxides | Cu (OH)2 | HA@Cu(OH)2-ICG | ICG | Type II ROS/PTT/Fenton reaction | PD-1, exhausted T cells | B16F10 | |
| Metal-organic framework | Manoscale iron (III) and copper (II) MOF | AIEgens | Type II ROS | ICD of tumor cells | HeLa | ||
| Porphyrinic metal–organic framework | Apt/PDGss@pMOF | TCPP | Type II ROS | MDSCs | 4T1 | ||
| SMTA | TCPP | Type II ROS | DCs | 4T1 | |||
| Au nanoparticle | Hollow gold nanospheres | FAL-ICG-HAuNS | ICG | Type II ROS/PTT | ICD of tumor cells | CT-26 | |
| UCNP | UCNPs based on 20 % Yb and 2 % Er-doped NaYF4 nanoparticles | UCNP-Ce6-R837 | Ce6 | Type II ROS | CTL-A4, T cells | CT26 | |
| Mesoporous materials | CuS | FA-CuS/DTX@PEI-PpIX-CpG | protoporphyrin IX | Mainly type II ROS | MDSCs | 4T1 | |
| Small mesoporous silica nanoparticles | bMSN(Ce6) | Ce6 | Type II ROS | DCs | MC-38 | ||
| Synthetic materials | Dendrimers | Dendritic arginine-rich peptide and disulfide bond linked stearic acid | ALSH/siVEGF | HPPH | Mainly type II ROS | VEGF | HeLa |
| Polyesters | PEG-b-PDPA, PBE | BNP@R | Ppheophorbide A | Type II ROS | Ferroptosis | B16-F10 | |
| PCL, PAE, PEG | TSD@LSN-D | TPRA (AIEgens) | Type II ROS | Pyroptosis | RM-1 | ||
| PEO, PLLA, TEMPO | GPPT@IC | IR780 | Type II ROS | TAMs | Hep1-6 | ||
| / | VB12, Sericin, PBLG | VB12-Sericin-PBLG-IR780 | IR780 | Type II ROS/PTT | DCs | MFC | |
| / | Organosilica cross-linked micelles with disulfide bond in the framework (S–S-OSCLMs) | C&S/Fe@S–S-OSCLM | Ce6 | Type II ROS | Glycolysis | 4T1 | |
| Carrier-free nanomaterials | Therapeutics | / | iPSs | Ce6 | Type II ROS | IDO1, Tregs | CT26 |
| / | C9SN | Ce6 | Type II ROS | Glutamine metabolism | 4T1 | ||
| Natural materials | Albumin | IR-LND@Alb | nIR-68 | Type II ROS | PD-L1 inside the cells | Hela, MB49 | |
| Nucleic Acids | siRNA/PPA-NG | Ppheophorbide A | Type II ROS | PD-L1 | B16-F10 | ||
| immunoglobulin G | Chloringlobulin | Ce6 | Type II ROS | PD-L1 | GL261 | ||
| BSA | MP@CH/BSA | Ce6 | Type II ROS | TAMs | 4T1 | ||
| Cell microparticles | Cal/ICG@MP | ICG | Type II ROS/PTT | CAFs | HepG2, H22 |
1. 开发光源并进一步确定肿瘤微环境的特征
尽管协同光动力免疫疗法(PDIT)近年来取得了显著进展,但其在光动力疗法(PDT)与免疫疗法(IT)整合过程中仍面临若干关键限制与挑战。PDT的应用目前主要局限于浅表或皮肤相关肿瘤的治疗,其穿透深度的不足构成了核心障碍。为避免光敏剂(PS)的聚集导致荧光淬灭(ACQ)效应并提升活性氧(ROS)的生成效率,研究者们倾注了大量精力,然而,光源的选择与优化同样至关重要,且该领域的发展深受光源技术进步的驱动。临床实践中,已探索了如间隙发光二极管(如NCT00122876试验所示)等植入式光源,通过精准控制光源在特定区域的灵活发射,实现了对肝细胞癌等疾病的治疗。
为克服PDT的穿透力限制,研究者们通过创新手段如将光线集成于内窥镜活检通道,显著提升了光传输的精确性与效率,延长了有效传输距离。此外,新型脉冲激光技术的发展,不仅提升了疾病诊断与治疗的特异性,还激发了光动力材料与新策略的创新浪潮。
抗肿瘤免疫领域虽蓬勃发展,但鉴于免疫系统与肿瘤生物学的极端复杂性,其深层机制仍有诸多未解之谜。即便如免疫检查点抑制剂(ICI)等已成功应用于临床的疗法,也仅能惠及部分癌症类型及少数患者,这主要受制于肿瘤免疫微环境(TIME)的固有局限性。免疫抑制是多因素、多细胞类型相互作用的复杂过程,因此,识别并精准靶向TIME中的关键脆弱点成为关键,这要求对TIME内各类细胞的生物学特性进行详尽解析,并动态监测其在肿瘤进展过程中的变化。
值得注意的是,随着下一代测序技术与肿瘤相关微生物群靶向成像技术的飞跃,肿瘤部位上皮细胞与免疫细胞内细菌群落的生存模式逐渐被揭示。研究显示,上皮内细菌能够影响癌细胞的抗原呈递,并调节转移性黑色素瘤中免疫细胞的活性,这为PDT的应用开辟了新视角。除了直接抗癌作用外,PDT还展现出在治疗微生物感染方面的潜力。因此,理论上PDT不仅能通过诱导免疫原性细胞死亡(ICD)来增强肿瘤免疫原性,还可能通过调节肿瘤微生物群落,进一步重塑TIME的免疫格局,实现更为全面的治疗效果。
2. 研发阶段的合理设计至关重要
在设计给药系统时,应秉持简约原则,力求成分精简。这一策略旨在避免复杂制备流程及其伴随的繁琐质量控制需求,同时减轻对各组分生物安全性及药代动力学特性的详尽评估负担,从而有效减少研发工作量。
在制剂开发的初期阶段,引入高通量、高效且经济的筛选策略至关重要,这些策略能够全面优化制剂的各项参数。此外,结合计算机科学,特别是人工智能等先进技术,可以高效地从海量科研文献中挖掘纳米药物设计的核心信息,并精准预测纳米粒子在生物医学领域的潜在价值及其关键特性,为制剂开发提供科学依据。
然而,值得注意的是,光动力疗法(PDT)在癌症治疗中的临床应用仍面临诸多局限,尤其体现在治疗深度的不足上。这主要是由于当前多数光敏剂(PS)的主要吸收光谱局限于可见光区(波长小于700纳米),未能充分利用光学组织窗口的优势,从而限制了光疗的穿透深度。因此,PDT在临床实践中主要应用于表皮肿瘤或浅表皮肤肿瘤的治疗。
为突破这一瓶颈,研究者们正致力于开发近红外光敏剂,以拓宽治疗窗口。同时,植入式光源(如间隙发光二极管,如NCT00122876所示)的应用也为实现深层PDT提供了新思路。此外,通过超分子自组装技术或生物材料的创新应用,将具有自发光特性的化合物与PS巧妙结合,并在肿瘤部位实现特异性释放,不仅能够触发荧光共振能量转移(FRET)和生物发光共振能量转移(BRET)等生物物理过程,还可能为PDT的深入治疗开辟新途径。
Table 5. Examples of PDIT Formulations in Clinical Trials for Cancer Therapy.
| Indicator | Device | Photosensitizers | Immune modulators | Immunomodulatory therapeutics | light source | Status | ID |
|---|---|---|---|---|---|---|---|
| Colon Cancer | / | 5-ALA | / | ICD | / | Phase 2 | NCT01522677 |
| Malignant pleural mesothelioma | intrapleural photodynamic therapy with videothoracoscopy | 5-ALA | Nivolumab | anti-PD-1 antibodies | 400–500 nm; 25 J/cm2 | Phase 2 | NCT04400539 |
| Non-small Cell Lung Cancer with Pleural Disease | Intraoperative PDT | Porfimer Sodium | / | Immune checkpoint inhibitors | / | Phase 1 | NCT04836429 |
| Head and Neck Cancer | / | Porfimer Sodium | Nivolumab, Pembrolizumab | anti-PD-1 antibodies | Interstitial Illumination | Phase 2 | NCT03727061 |
| Metastatic Esophageal Squamous Cell Carcinoma | / | Sinoporphyrin Sodium | Pembrolizumab | anti-PD-1 antibodies | / | Phase 2 | NCT05386056 |
在纳米药物的设计与研发领域,深刻理解肿瘤微环境(TME)的复杂生态至关重要,TME囊括了免疫细胞、血管系统、受体与信号分子的复杂交互网络。当前,信息技术在肿瘤免疫治疗(IT)领域面临的主要挑战包括患者响应率低下及免疫相关不良事件(irAEs)的频发。此外,肿瘤特异性与免疫抑制机制的差异显著影响治疗效果,限制了IT的广泛应用。基于《肿瘤免疫治疗》(特别是聚焦于PDIT)领域的最新进展,当前的策略聚焦于开发能够增强肿瘤免疫原性的纳米材料。鉴于单克隆抗体(mAbs)如抗PD-L1或抗PD-1在稳定性上的局限性,单纯联合应用难以充分发挥纳米材料的全部潜力。因此,材料科学、生物医学与化学领域的跨学科合作致力于通过纳米载体或表面改性技术,实现mAbs的精准靶向递送,同时规避irAEs的发生。当前研究聚焦于重编程肿瘤相关巨噬细胞(TAMs)的极化状态及恢复TME的正常功能,未来随着肿瘤免疫微环境(TIME)研究的深入,针对其他免疫细胞靶点的治疗药物有望在PDT联合治疗中展现协同增效。
癌症疫苗,作为一种具备潜力诱导全身性肿瘤消退与持久缓解的创新IT策略,正逐步成为研究热点。特别是光反应性癌症疫苗,尽管尚处于研发初期,但其发展迫切需要更高级的光触发递送系统来优化RNA/DNA疫苗的核靶向效率。未来工作可探索新型光响应递送策略,以同步递送光敏剂(PSs)与癌症疫苗,确保疫苗的稳定性与有效性,从而实现免疫增强与治疗效果的最大化。
值得注意的是,除了传统的以缩小肿瘤体积为目标的治疗策略外,临床前PDIT研究还应重视延长患者生存期、提升生存质量、治疗肿瘤相关并发症及症状、预防或减轻治疗相关副作用,并增强患者对现代治疗方案的耐受性。这些方面的优化对于提升PDIT的临床应用价值具有深远意义。
3. 纯化和表征是安全性和有效性研究的先决条件
在构建多功能纳米平台的过程中,集成多种组分虽具潜力,却也对分析化学与纯化技术提出了严峻挑战,增加了系统复杂性与特征界定的难度,进而可能引发不容忽视的重大风险。面对此,纯化流程中至关重要的一环在于依据纳米材料的固有属性进行分类,并呼吁建立统一的国际监管框架,旨在明确界定各类纳米药物产品的物理化学与生物学特征基线。这一框架的实施,将促进纳米材料特性分类的标准化,确保从源头上把控其质量与安全。
针对纳米生物材料的全面剖析,需深入探索其理化特性,包括但不限于纳米粒子跟踪分析(NTA)、粒径分布与多分散性、zeta电位、表面化学性质、化学组成、表面配体密度、稳定性、溶解行为、三维结构等核心参数。这些参数对于理解材料的生物相容性、靶向效率及体内行为至关重要,是构建基于纳米技术的药物质量评价体系的基石。同时,依据先进技术制定纳米药物的质量标准,对于推动其临床转化与应用具有不可估量的价值。
精确控制纳米材料的制备、纯化及表征流程,不仅是保障产品批次间一致性的关键,更是深入理解其生物效应机制的前提。例如,表面正电荷的纳米材料因其静电相互作用易与血小板结合,可能诱发血栓形成风险;而纳米粒子的几何形态则直接影响其在细胞膜上的识别与内吞效率,进而调控靶向递送的动态过程。因此,通过精细化调控纳米材料的这些特性,可以预见性地设计其生物行为,为药物输送系统的优化提供科学依据。
4. 放大生产和临床转化
大规模生产与应用生物材料于医疗领域,尤其是纳米药物,依旧面临诸多挑战。根据良好生产规范(GMP)标准,实现从克级至公斤级的规模化生产,并确保生产工艺的简洁性与可重复性,是纳米药物从实验室迈向临床的必经之路。然而,即便在乐观预期下,纳米药物的成本仍高于传统疗法,尤其是当考虑到制备阶段PS的引入及治疗阶段光源的增设所带来的额外成本。因此,开发易于放大的简洁配方对于加速PDIT纳米药物的临床规模化生产及转化至关重要。微流控技术的崛起,通过缩减制备时间与步骤,有效提升了纳米药物特性的大规模均一控制。
在临床前药效学评估领域,引入先进实验模型成为提升纳米医学研究转化效率的关键。例如,“体外-体内”模型的优化,通过共培养、动态体外模型及三维有机体体外模型,克服了传统二维细胞培养在血流模拟、免疫反应、细胞多样性及细胞间交流等方面的局限。同时,将有机体与免疫细胞共培养,以更贴近实际地模拟内源性免疫信号传导。
另一方面,动物模型在临床前研究中的应用虽广泛,但其与临床结果的直接相关性常受质疑。CDX模型难以全面再现人类肿瘤的基质特征与完整免疫系统,故PDX模型或GEMM模型成为更贴近人类病理微环境的选择。
纳米材料通过静脉注射后,可利用增强渗透性与滞留效应(EPR)在肿瘤组织内富集,理论上减少脱靶效应。然而,EPR效应的强度受个体差异、肿瘤类型等多种因素影响,因此在临床研究中仍存争议。
鉴于肿瘤微环境(TME)的复杂生理结构,包括高间质压、血管压迫及致密的基质细胞,综合策略——如增强血管通透性与细胞外基质(ECM)重塑——在靶向肿瘤细胞与免疫细胞时展现出更优越的治疗潜力,相较于单一靶向方法。此外,短期毒性评估的局限性促使我们关注纳米药物的长期毒性,包括持续释放、载体诱导的细胞毒性、治疗动力学差异及免疫相关不良事件(irAEs)。同时,纳米药物的代谢与排泄机制亦需深入研究,以防止其在体内积累并对正常组织造成潜在危害。
5. 未来纳米材料的特性
尽管PDIT(光动力免疫疗法)纳米医学科学尚处于构建与优化阶段,从研发至临床应用的征途仍布满挑战,但随着对高质量设计原则及最佳研究实践的日益重视,临床转化率有望显著提升。在此进程中,坚持高标准的研究实践不应成为科学进步的桎梏,而应成为推动高效临床转化的强大动力。肿瘤免疫应答的复杂性不言而喻,任何环节的中断均可能削弱抗肿瘤免疫疗法的疗效。因此,未来探索更加高效、精准的疗法,以实现抗肿瘤免疫治疗的理想目标,显得尤为迫切与重要。
展望未来,针对PDIT应用的纳米药物设计应聚焦于以下几点核心特性:
(i) 高效能、低复杂度的光源系统,需既能有效激发光敏剂(PS),又能确保足够的组织穿透深度,以最大化治疗效果。
(ii) 减少“暗毒性”与“ACQ效应”,通过优化PS性质及光动力过程,减轻非光照条件下的细胞毒性,并克服聚集诱导猝灭现象,提升治疗安全性与效率。
(iii) 实现治疗剂的精准免疫细胞靶向,确保药物准确作用于目标免疫细胞,增强治疗效果的特异性与有效性。
(iv) 简化制备与纯化流程,通过优化纳米材料的合成策略与纯化技术,降低生产成本,减少药物损失,提升生产效率。
(v) 满足市场供应需求,建立稳定可靠的生产体系,确保纳米药物能够满足大规模临床应用的需求。
(vi) 增强纳米材料的体内稳定性,通过表面修饰或结构设计等手段,减少纳米材料被单核吞噬系统(MPS)的清除,降低对正常组织的潜在毒性。
(vii) 优化人类疾病动物模型与体外模拟系统,以更准确地模拟不同患者的内源性免疫信号传导与细胞间通讯机制,提高实验结果的预测性与可靠性。
(viii) 实施患者与纳米药物的合理分层策略,基于不同适应症患者的临床特征,提前进行精准分层,通过密切监测免疫反应及其他关键参数,动态调整纳米药物的治疗方案,以实现对缓解者与无应答者的精准管理。
6. PDIT面临的挑战
PDIT作为一种前沿的抗癌策略,为癌症治疗领域注入了巨大的希望与潜力。然而,正如任何治疗手段都伴随其局限性,PDIT亦不例外。其面临的挑战不仅源自光动力疗法与信息技术固有的不足,如患者间疗效差异显著、临床实施中激光介导药物-设备组合操作的复杂性,以及已广泛讨论的免疫相关不良事件(irAEs),更在于其联合治疗策略可能引发的全身性毒性问题。具体而言,免疫系统的过度激活可能诱发一系列免疫相关毒性,这要求我们在治疗过程中实施严密的监测与调控措施。
Malgorzata研究团队的研究亮点在于揭示了PDT与IDO抑制剂(如epacadostat)联合使用的双重效应:一方面展现出显著的抗肿瘤疗效,另一方面却加剧了IL-6介导的全身性急性炎症反应。这一发现强调了治疗过程中细胞因子的复杂调控网络及其潜在的副作用。此外,受损肿瘤细胞的裂解会释放大量DNA、钾离子、磷酸盐及细胞因子,进而触发肿瘤溶解综合征(TLS),这是PDIT治疗中不容忽视的并发症之一。
进一步的研究在无胸腺Nu/Nu雌性小鼠模型上展开,结果显示PDIT治疗后8小时内,小鼠体内ALT、乳酸脱氢酶及血尿素氮水平显著升高,提示PDIT可能对肝脏造成损伤。这一发现凸显了联合使用PDIT时毒性风险增加的现实,强调了剂量优化与严密监测的重要性。
此外,肿瘤微环境(TME)作为影响PDIT疗效的关键因素,其复杂性与多样性远超正常组织。TME中氧化还原状态、谷胱甘肽浓度、病理压力梯度、细胞外基质成分及多种基质细胞的相互作用,共同构成了PDIT治疗的独特挑战。然而,目前关于TME如何影响PDIT机制的具体细节仍待深入探索,这需要大量基础数据的积累与综合分析。
最后,PDIT与肿瘤相关免疫景观基础研究的不完整性,直接导致了实时生物标志物的匮乏。这些生物标志物对于客观评估PDIT疗效、指导临床医生及时调整治疗方案具有不可替代的价值。因此,加强PDIT基础研究与临床转化的深度融合,开发高效、可靠的生物标志物体系,是未来PDIT研究的重要方向。
结束语和展望
免疫疗法,特别是免疫检查点阻断(ICB)抗体疗法与嵌合抗原受体(CAR)T细胞疗法,已成为癌症治疗领域的重大突破。然而,患者间疗效的显著差异及免疫相关不良反应频发,成为制约其广泛应用的主要障碍。近期研究表明,联合疗法策略显著增强了免疫治疗药物的效能,主要通过两大途径:一是增强肿瘤免疫抑制微环境(TIME)的免疫反应性,二是逆转肿瘤内部的免疫抑制状态。在这一背景下,光动力疗法(PDT)凭借其增强免疫原性及减轻免疫毒性的独特优势,在临床前与临床研究中展现出巨大潜力。
纳米药物作为PDT的载体,其特性如肿瘤特异性靶向、药物封装防止提前释放、以及通过内吞作用促进肿瘤细胞摄取等,为光动力-免疫协同疗法(PDIT)提供了关键且互补的功能。本综述深入探讨了PDIT的原理与模式,通过细胞因子、反应性免疫细胞群、微生物组等典型范例,系统阐述了PDIT对肿瘤相关免疫景观的复杂影响机制。
具体而言,文章详细剖析了PDT的基本原理、物理化学机制及光敏剂的研究进展,特别强调了具有自发光特性的PDT在肿瘤成像与治疗中的独特优势与应用潜力。进一步地,文章揭示了PDT与肿瘤免疫微环境成分的相互作用,明确了PDIT的分子机制及联合策略的开发准则。基于这些原则,文章分类讨论了当前及前沿的PDIT策略,旨在指导未来PDIT设计的方向并挖掘其应用潜力。
展望未来,PDIT作为肿瘤治疗的典范,其发展前景令人鼓舞。随着临床与生物学研究的深入,对肿瘤微环境(TME)成分的认知不断加深,加之光学技术的革新与跨学科科学数据的积累,为PDIT在癌症治疗中的应用奠定了坚实基础。科学家们正积极投身于多功能纳米材料的研发,旨在实现对整个肿瘤免疫环境的精准调控,从而优化综合治疗方案,惠及更多癌症患者。在这一过程中,从药物设计到临床转化的每一步都充满挑战,但正是这些挑战激励着科学家们不断探索与创新,共同推动癌症治疗领域的进步。
参考文献
Tian, L.; Li, X.; Guo, L.; Huang, L.; Wu, X.; Gao, W. Visualized Photodynamic Nanomaterials Activating Tumor-Associated Immune Landscape as a next-Generation Anticancer Strategy. Coordination Chemistry Reviews 2024, 517, 216027. https://doi.org/10.1016/j.ccr.2024.216027.