生物医学中的靶向线粒体纳米材料: 治疗策略和成像模式的进展
摘要
本综述从不同的应用角度切入,介绍了线粒体靶向材料在癌症治疗、探针和成像方面的具体应用,以及以线粒体为治疗靶点的疾病治疗。在探讨现有挑战和阐明潜在治疗机制的同时,还概述了未来的发展轨迹和障碍。通过全面探讨靶向线粒体纳米材料的各种应用,旨在促进医学研究中的创新治疗模式和诊断方法。
意义声明
本综述介绍了线粒体靶向纳米材料在生物医学应用方面的最新进展,涵盖癌症治疗、生物探针、成像和各种系统性疾病治疗等多个领域。这项工作的新颖性和意义在于系统分析了线粒体与不同疾病之间错综复杂的关系,以及利用纳米材料的治疗潜力所采用的巧妙设计策略。这篇综述为线粒体靶向纳米材料的开发及其应用提供了重要的见解,为研究创新治疗模式和诊断方法的研究人员提供了宝贵的资源。这篇综述对读者的科学影响和兴趣在于为未来研究确定了有前途的途径,以及这些尖端技术的临床转化潜力。
图文摘要
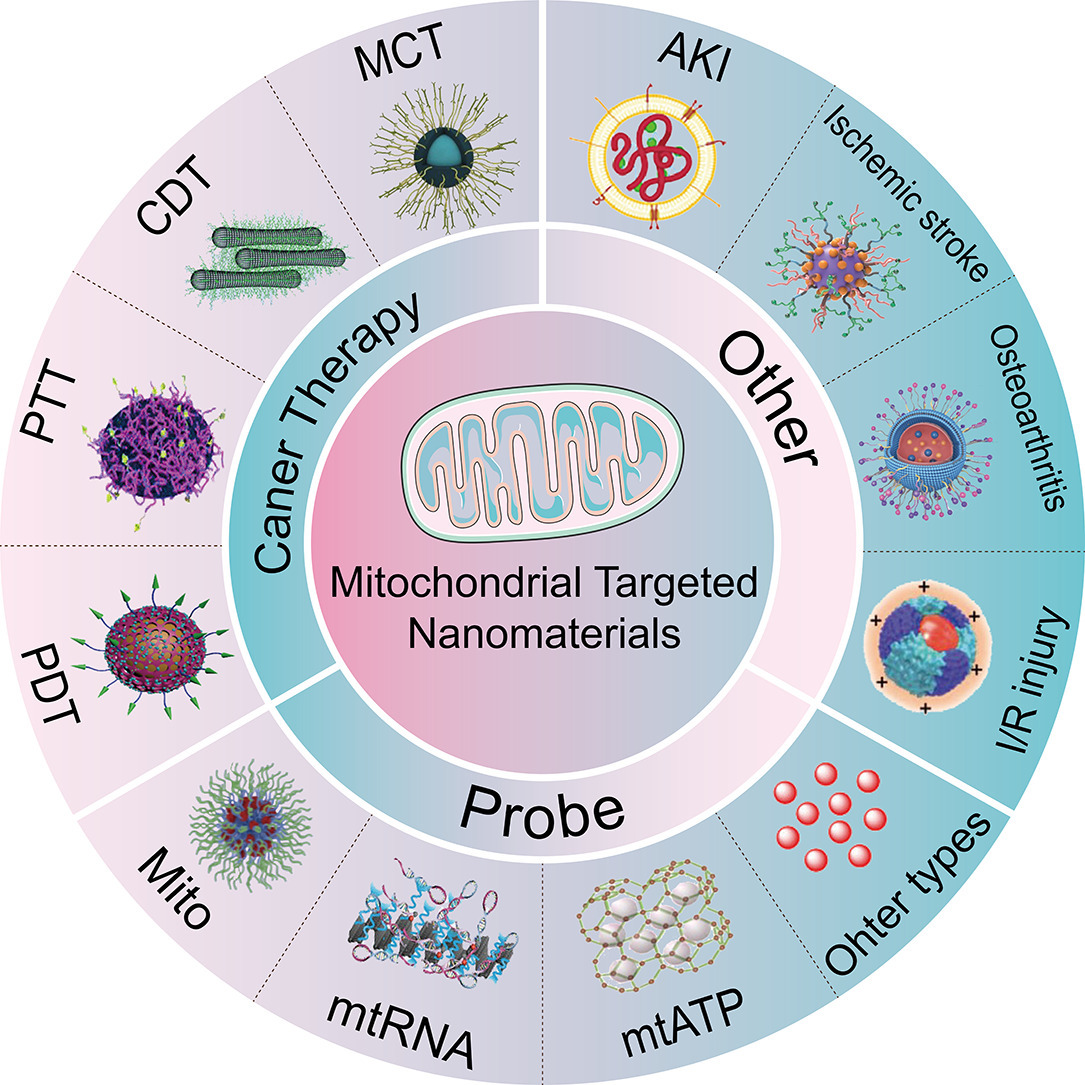
1. 导言
线粒体是真核细胞中普遍存在的重要细胞器,具有独特的双膜结构,包括外膜和平滑的内膜,后者形成了复杂的折叠结构,即嵴。这些嵴显著增大了线粒体内膜的表面积,从而优化了能量生产的效率。线粒体膜的膜电位通常维持在大约-160到-180 mV之间,这对维持线粒体的功能和细胞的生存至关重要。这种负膜电位在能量合成、细胞信号传递、钙离子平衡以及其他多种细胞过程中发挥着核心作用。值得注意的是,许多针对线粒体的策略利用了这种负膜电位来实现特定的细胞内定位。
线粒体作为细胞的能量工厂,参与了多种关键的新陈代谢活动,包括ATP的生成、协调克雷布斯循环、氨基酸合成和脂肪酸分解。线粒体功能障碍或损伤与多种疾病有关。同时,线粒体内的新陈代谢活动是活性氧(ROS)的主要来源,而ROS在多种信号传导途径中扮演着重要角色。线粒体产生的过量ROS会导致包括癌症、神经退行性疾病、糖尿病和缺血性心脏病等多种疾病的发生。因此,调控ROS已成为治疗多种疾病的关键策略。
除了能量生产,线粒体还参与其他重要的细胞过程,如钙离子调节、细胞凋亡和重要生物大分子的合成。线粒体在维持细胞的正常功能和生存方面发挥着不可或缺的作用,并广泛分布于人体的各种组织和器官中,对整体健康和正常新陈代谢至关重要。
近年来,利用纳米材料进行线粒体靶向治疗引起了广泛关注。研究人员利用靶向线粒体的纳米材料输送特定药物或直接干预线粒体,以治疗多种疾病。这些材料包括金属复合物、脂质体、肽、聚合物等。
2. 纳米材料靶向线粒体的策略
为了有效地将纳米材料靶向线粒体用于治疗,重要的是要理解线粒体的独特特性,并据此调整靶向策略。线粒体膜电位是常见的靶向依据,其外膜电位约为 -160 至 -180 mV,这是氧化磷酸化的结果。此外,线粒体外膜具有亲脂性特征,这使得亲脂性阳离子成为线粒体靶向递送的有效工具。
1969 年,斯库拉切夫的研究团队发现了第一个具有线粒体亲和力的微粒——甲基三苯基鏻阳离子。随后,离域亲脂阳离子(DLCs)因其不需要特定的运输机制就能被线粒体吸收而在医学领域受到关注。例如,通过使用三苯基膦(TPP)对 MitoQ 和 MitoE 等抗氧化分子进行修饰,可以实现对线粒体的选择性靶向,以保护线粒体免受氧化应激的影响。其他常用的 DLC 包括 TPP、 地喹氯铵(DQA)及罗丹明 123。
DQA 是一种带有正电荷的双亲化合物,由两个喹啉环和十个亚甲基链组成。起初,DQA 被用作抗菌剂,但在 1987 年发现其具有线粒体亲和力。DQA 在溶液中可以形成胶束,并在水介质中聚集成类似脂质体的结构,称为 DQAsomes。这些 DQAsomes 能够结合 DNA 并促进高效的细胞转染,选择性地在线粒体中积累。由于这些特性,DQA 成为构建药物和基因递送系统的重要组成部分。DQA 的正电荷有助于与线粒体膜的负电荷相互作用,促进药物与膜的结合。
司徒-席勒(Szeto-Schiller,SS)肽是以发现者 Hazel H. Szeto 和 Peter W. Schiller 的名字命名的。SS-31 是一种四肽(D-Arg-Dmt-Lys-Phe-NH2),它是 SS 肽家族的一员,主要用来靶向线粒体。SS-31 能够在线粒体内累积至高浓度,直接作用于线粒体内膜而不是外膜,有效缓解线粒体氧化应激,减少 ROS 的产生,保护线粒体功能,并抑制细胞死亡。
线粒体穿透肽(MPPs)是一类合成肽,包含带有正电荷的赖氨酸(K)和精氨酸(R),以及具有亲脂性的苯丙氨酸(F)和环己基丙氨酸(FX)。这些肽具有正电荷和亲脂性,使它们能够通过细胞和线粒体膜。MPPs 可以直接合成,易于衍生,并且具有良好的生物相容性。
线粒体靶向信号肽(MTSs)是多肽,由 20 至 40 个氨基酸组成,富含带正电荷的残基。然而,MTSs 存在一些局限性,如较大的分子量、合成难度和易降解性。
MITO-Porter 是一种基于脂质体的载体系统,用于将大分子药物输送至线粒体。该系统由经过八精氨酸(R8)修饰的脂质体组成,能够促进内吞作用进入细胞。内层脂质如 1,2-二油酰-sn-甘油-3-磷脂酰乙醇胺(DOPE)或磷脂酸(PA)具有膜融合活性,可与线粒体外膜融合,将蛋白质、DNA 等大分子释放到线粒体中。共聚焦显微镜、电子显微镜和荧光共振能量转移(FRET)实验表明,MITO-Porter 能够有效地将模型蛋白 GFP 和金纳米粒子输送到活细胞的线粒体中。该系统提供了一种新的基因治疗方法,可用于缓解线粒体疾病。
基于过渡金属的配合物,如铂(Pt)、钌(Ru)和铱(Ir)复合物,具有天然的线粒体靶向能力,并展现出优异的光热特性,使其成为光动力疗法的候选物质。
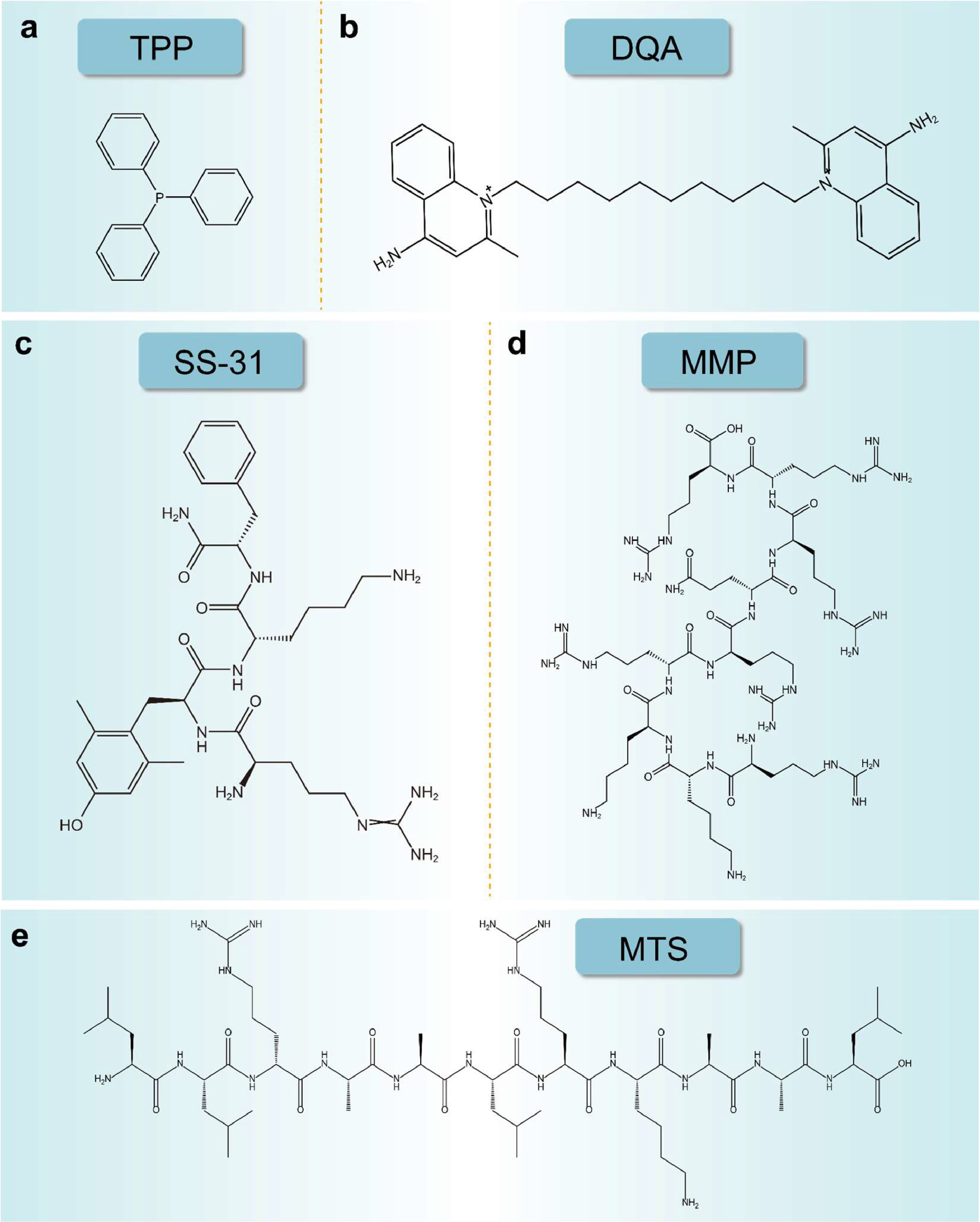
图1. a) TPP. b) SS-31. c) DQA. d) MMPs**(RKKRRQRRR). e)MTSs(LLRAALRKAAL).
3. 纳米材料靶向线粒体治疗癌症
线粒体在生理和病理环境中发挥着至关重要的作用,既是细胞能量生产和生存的关键,也在细胞死亡调控中扮演着重要角色。作为内在凋亡途径的调节器,线粒体通过控制促凋亡蛋白从线粒体膜间隙向细胞质的转运来调控凋亡效应机制的激活。此外,线粒体还参与了多种形式的非凋亡性细胞死亡,尤其是调节性坏死或坏死凋亡。鉴于线粒体在细胞死亡调控中的核心作用以及肿瘤细胞中频繁观察到的线粒体功能异常,利用特定化合物靶向线粒体成为根除化疗难治性癌细胞的一种极具前景的方法。
在肿瘤细胞中,线粒体膜电位(MMP)较高,通常约为 -220 mV。这一现象部分原因是由于 ATP 合成酶的α亚基发生突变,导致其功能下降。功能受损的 ATP 合酶无法有效利用形成的质子梯度,导致质子在中间膜空间(IMS)内积累。近年来,利用靶向纳米材料克服线粒体递送挑战的研究兴趣日益增长,并取得了显著进展。在这个新兴领域,已经开发出多种功能性、精心设计的创新纳米材料。
3.1. 光动力疗法
光动力疗法(PDT)因其微创性、高治愈率和对机体低损伤等特点而备受关注,成为近年来的研究焦点。PDT 的基本原理是在目标治疗区域应用光敏剂(PS),随后用特定波长的光照射,产生具有细胞毒性的活性氧物种(ROS),以破坏和杀死癌细胞。然而,PDT 存在几个局限性。首先,ROS 的扩散距离非常有限(通常小于20nm),这意味着治疗效果仅限于光敏剂附近的区域。其次,在实体瘤中常见的缺氧微环境中,PDT 的效率会显著降低。最后,用于激发光敏剂的光线穿透深度有限,可能会导致光损伤,这也限制了 PDT 的应用范围。为了克服这些局限性,研究人员开发了多种纳米材料来提高光导疗法的治疗效果。
Table 1. Table of Nanomaterials target mitochondria for cancer therapy
| Names | Application | Effect | Targeting strategy |
|---|---|---|---|
| UCMTs | PDT | Targeted and efficient PDT by initiating apoptosis in mitochondria through Near-Infrared activation. | TPP |
| UCNP-GQD/TRITC | PDT | Targeting mitochondria and triggers high-dosage singlet oxygen, initiating apoptosis for tumor treatment. | TRITC |
| LinTT1-HFtn-AIE | PDT | Simultaneously targeting tumor and tumor mitochondria, AIEgens are released to perform photodynamic therapy and tumor imaging functions | LinTT1 |
| UCNPs@G4/Ce6/CAT-CTPP | PDT | Targeting mitochondria to overcome tumor hypoxia and ROS generation enhances PDT therapeutic efficacy | CTPP |
| TPP-UCNPs@MOF-Pt | PDT | Targeted mitochondria were subjected to NIR laser irradiation to induce mitochondrial depolarization to amplify the therapeutic effect of PDT | TPP |
| TSPy-B | PDT | The dual targeting ability of biotin receptor and mitochondria can be used for fluorescence imaging-guided photodynamic tumor therapy. | Pyridinium unit |
| ATO-ICG-GNPs | PDT | Targeting mitochondria inhibits mitochondrial oxidative phosphorylation to reduce oxygen consumption and provide a suitable environment for PDT | ATO |
| ALA&Dz@ZIF-PEG | PDT | OXPHOS inhibitors are used to eliminate the inherent oxygen consumption of tumors to overcome the resistance of hypoxic cancer cells to PDT | ALA |
| Cz-SB | PDT | Mitochondrial targeted fluorescence imaging and hypoxic photodynamic therapy | BODIPY |
| TPEQM-DMA | PDT | Synergistic apoptosis-ferroapoptosis for mitochondria-targeted photodynamic therapy and resolution of tumor hypoxia | Lipocationic property |
| MHI-TMX@ALB | PDT | Targeting mitochondria for photodynamic immunotherapy | Heptamethine cyanine |
| MoS2@PDA-Fe@PEG/TPP | PTT and CDT | Targeting mitochondria PTT and CDT treatment to trigger mitochondrial disorders and cancer death. | TPP |
| CuS-PEI/NO-TPP | PTT | Targeting mitochondria to enhances the therapeutic effect of PTT with the assistance of NO gas. | TPP |
| AuNR@MSN(BNN6)-lipid-DOX, AM(B)LD | PTT and CDT | Multiple modes of targeting tumor mitochondria, photothermal therapy, gaseous therapy (NO), and chemotherapy have demonstrated significant synergistic antitumor activity. | DOX |
| TPC/2DG NSs | PTT | Mitochondria-targeting nanostructures with heat-sensitive properties provide ATP energy consumption /PTT synergistic therapy for tumor | TPP |
| T-IPIC NPs | PTT and PDT | Targeting mitochondria using 808nm NIR irradiation to activate nanoparticle function to cause mitochondrial dysfunction to treat cancer | TPP |
| DIH | PTT and PDT | Targeting mitochondria and disrupting mitochondria using PDT/MTPTT thermogenesis and ROS to cause an ICD effect | dc-IR825 |
| FFSNRs-PEG | CDT and PTT | Fluoride ions cause mitochondrial dysfunction, resulting in cell apoptosis and death | Fluoride ions |
| Cu-BAQ | CDT | Targeting mitochondria to maximize the cell respiration to accelerated O2 consumption of tumor cells | BAM15 |
| Zr-TCPP(TPP)/R837@M | SDT | Targeting mitochondria and acting as sonodynamic therapy induces immunogenic cell death and the release of tumor-associated antigens | TPP |
| DSe-E(T-Ce6/FX11) | SDT | Targeting mitochondria uses SDT to destroy mitochondria leading to cell death | TPP |
Liu等人报道了一种基于钕敏化的上转换金属有机框架(UCMTs)的近红外光激活的线粒体靶向治疗系统()。UCMTs 由卟啉基纳米级金属有机框架(nMOFs)和上转换纳米粒子(UCNPs)构成。金属有机框架(MOFs)是一种通过合成网络结构形成的晶体材料,具有在无机和有机单元之间形成的坚固结合。精心挑选 MOF 的成分可以使晶体具有极高的孔隙率、热稳定性和化学稳定性。这些特性使得 MOF 结构能够进行化学修饰,并在多种应用中展现出巨大潜力。卟啉基 nMOFs 是近年来开发的一种新型光敏剂。基于稀土 UCNPs 的纳米载体能够将近红外光转换为紫外光,在纳米医学领域得到了广泛的研究和设计。与传统下转换材料相比,UCNPs 能将近红外光转换为紫外光或可见光。UCNPs 具有高组织穿透深度、低自发荧光、抗光漂白等优点,因此非常适合用于光导治疗。具有 Janus 纳米结构的 UCMTs 可在 808 nm的近红外光照射下产生单线态氧,从而将组织损伤降到最低。通过破坏线粒体膜电位和启动细胞凋亡,线粒体靶向光导疗法显示出了更强的疗效。在近红外光下,UCMTs 对肿瘤的抑制作用优于非靶向对照组。
Zhang等人设计了一种类似的 UCNPs,它能够激发共轭石墨烯量子点产生单线态氧。同时,肿瘤靶向配体 TRITC 使其具有线粒体靶向能力。该系统能够在肿瘤细胞的线粒体中高效产生单线态氧,诱导线粒体功能障碍,启动细胞程序性凋亡途径,从而抑制肿瘤生长。与非靶向系统相比,该线粒体靶向系统显著提高了近红外光诱导的光动力疗法的疗效。这项研究为癌症的精准治疗提供了一种高效的新策略()。
| Materials/Names | Application | Effect | |
|---|---|---|---|
| Mito-ATO | Immunotherapy | Mitochondrial targeting play a role of reshape the lung tumor microenvironment and enhance the antitumor immune cell energy metabolism | TPP |
| MAP-I | PDT and ICD | Targeting mitochondria combined with photodynamic therapy activates tumor immune response to treat tumors | TPP |
| Au NCs@MBA-TPP | MCT | Multi-stimulus triggered nanoparticles with mitochondrial targeting achieve enhanced PTT/CDT/PDT for further application in cancer therapy | TPP |
| MRT | MCT | Targeting mitochondria uses magnetic nanoparticles and alternating magnetic fields to trigger heat stress leading to ICD killing tumors | TPP |
| MnFe2O4 NPs | MCT | combine CDT, MHT, TPM imaging and, MRI in one nanoplatform for the highly effective and precise treatment of cancer. | Iridium(III) |
| FE-T NPs | MCT | A type of nanoparticle that reacts to glutathione, possesses precise mitochondrial targeting, and, upon amplification through PTT and PDT, can trigger potent ICD. | TPP |
| T-NPCA/NO | Oxidative therapy | Mitochondrial-targeted nanoscale carrier is employed to deliver CA and NO, enabling in-situ nitrite-enhanced peroxide oxidation treatment of hepatocellular carcinoma. | CGKRK |
| PGMA NUs | MCT | Targeting mitochondria triggers mitochondrial disorders and enables multifunctional and high-performance targeted tumor therapy by regulating intracellular H2O2 balance | Platinum |
| SFT-Au | Starving therapy | Promote mitochondrial calcification, thereby enabling efficient and precise starvation therapy to treat tumors | TPP |
| TPGS/dc-IR825 | Mitophagy | Inducing mitochondrial damage and autophagy in cancer cells and leading to ATP depletion and triggering cancer cell death. | dc-IR825 |
| RAP | Apoptosis | Disrupting OMM and Ca2+ homeostasis and inducing apoptosis to treat tumors | Trimethyl ammonium |
| FG/TNanoprodrug | MCT | Targeting mitochondria to enhance metabolic suppression and CDT, thereby enhancing tumor-killing effects and combating drug-resistant cancers | TPP |
| TPP-MNPs | Mechanical forces | Mechanical forces are applied to mitochondria for effective cancer treatment under rotating magnetic field | TPP |
| ZCProP | Cuproptosis | Targeting mitochondria to deliver copper and protons triggers copper sink, iron sink and cancer cell apoptosis to promote tumor therapy. | Cu2+ |
| Cu(I)Br(PPh3)3 | Cuproptosis | Targeting mitochondrial direct delivery Cu (I) cause cuproptosis in order to exert antitumor effect | TPP |
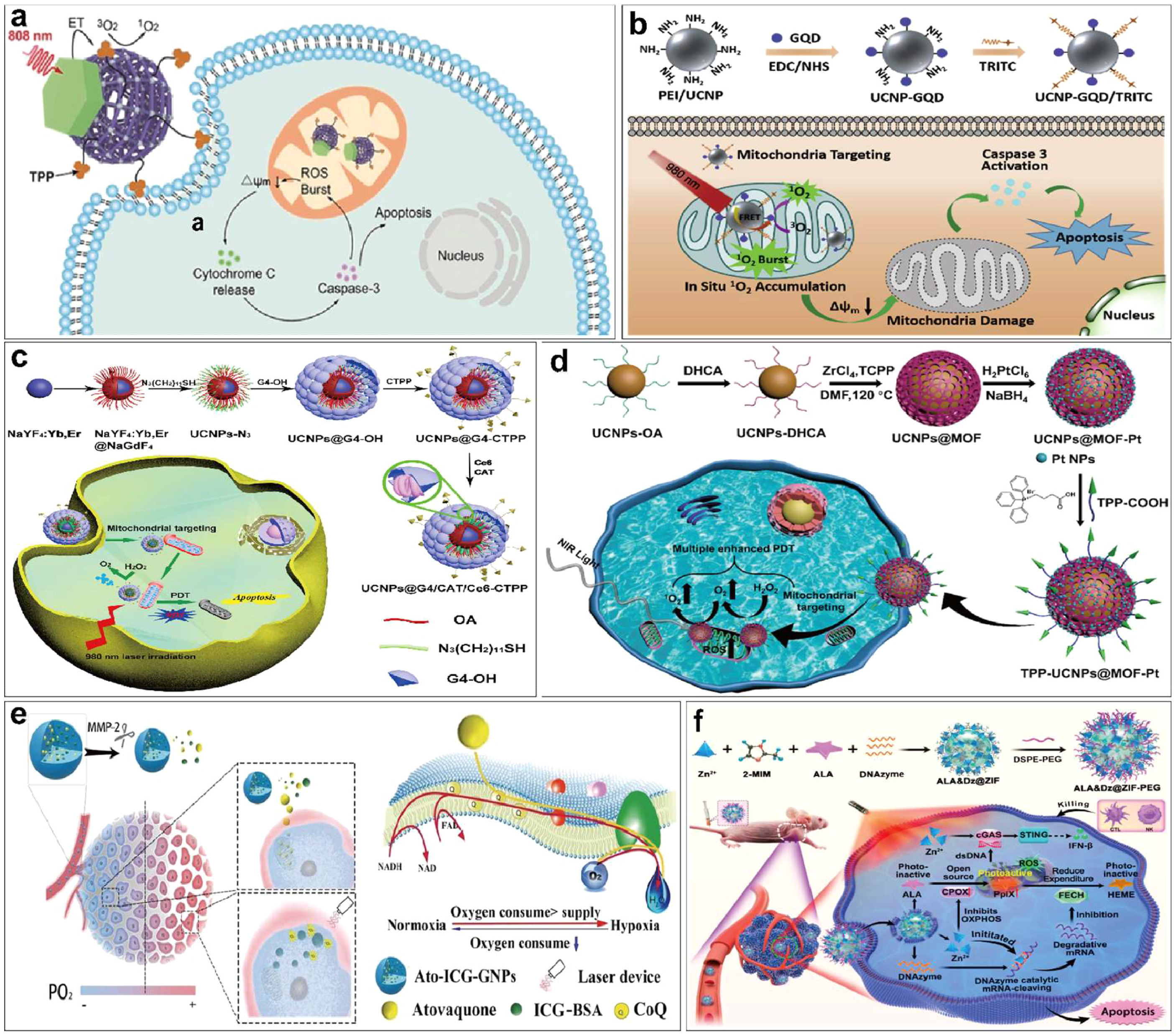
图2.(a)近红外光激活线粒体靶向上转换金属有机框架示意图;(b) 线粒体靶向 UCNP-GQD/TRITC 的制造示意图;(c) UCNPs@G4/Ce6/CAT-CTPP 纳米粒子的合成示意图; (d) 用于多重增强 PDT 的核壳 TPP-UCNPs@MOF-Pt 纳米平台示意图; (e) 使用 Ato-ICG-GNPs 增强 PDT 产生的肿瘤杀伤效应示意图,以及 Ato-ICG-GNPs 协助逆转缺氧的机制; (f) ALA&Dz@ZIF-PEG 纳米颗粒的制备示意图以及 ALA&Dz@ZIF-PEG 促进线粒体靶向光动力免疫疗法的机制。
Wang 等人开发了一种肿瘤靶向治疗策略,通过基因工程技术将肿瘤穿透肽 LinTT1 与人 H 链铁蛋白(HFtn)融合,制造出 LinTT1-HFtn 纳米包。通过 pH 值驱动的解离/重组过程,LinTT1-HFtn 纳米笼进一步封装了近红外 AIE 发光体 MeTTMN,形成了 LinTT1-HFtn-AIE 纳米粒子。这些纳米粒子在肿瘤靶向、穿透和线粒体定位方面表现出卓越的能力。在可见光照射下,LinTT1-HFtn-AIE 纳米粒子能有效产生 ROS,导致线粒体功能障碍和癌细胞凋亡。体内研究表明,这些纳米粒子可以精确成像肿瘤,并显著抑制肿瘤生长。重要的是,LinTT1-HFtn-AIE 纳米粒子表现出优异的生物相容性和安全性,这突显了它们作为癌症治疗和诊断工具的潜力。
尽管光动力疗法在治疗肿瘤方面取得了重大进展,但复杂的肿瘤微环境,尤其是缺氧,严重阻碍了光动力疗法的治疗效果。肿瘤内缺氧削弱了依赖氧气的光动力疗法的治疗效率。此外,PDT 诱导的局部微环境耗氧量以及 ROS 造成的微血管损伤会进一步加剧肿瘤缺氧,最终严重影响 PDT 的疗效。为了解决肿瘤环境中的缺氧问题,Liang 等人构建了一种具有线粒体靶向能力的上转换纳米晶体-树枝状聚合物复合材料,用于 PDT,称为 UCNPs@G4/Ce6/CAT-CTPP。这种纳米系统可以同时装载疏水性光敏剂 Ce6 和亲水性过氧化氢酶,从而克服肿瘤缺氧并提高光动力疗效。具体来说,作者通过硫醇-烯点击反应和铜催化的叠氮-炔环加成反应将树枝状聚合物与 UCNPs 连接起来,形成疏水性和亲水性口袋。随后,Ce6 被载入由油酸配体构成的疏水性口袋中,而过氧化氢酶则被载入亲水性树枝状聚合物中。此外,还对CTPP配体进行了修饰,以实现线粒体靶向。结果表明,该系统能有效产生活性氧,并通过破坏线粒体显著抑制 4T1 肿瘤的生长()。
Chen 等人利用细胞内的 H2O2,在 980 nm激光照射下可被纳米粒子分解产生氧气,从而缓解肿瘤组织缺氧。他们以氧化磷酸化机制受损为靶点,开发出了 Ato-ICG-GNPs,可抑制线粒体呼吸并发挥 PDT 功能,有效缓解肿瘤缺氧。Jiang 等人也利用抑制 OXPHOS 来解决肿瘤缺氧问题,他们开发了 MHI-TMX@ALB,通过庚基甲氰靶向线粒体,并通过 TMX 抑制 OXPHOS。同样,Zhao等人开发的 Dz@ZIF-PEG 利用 Zn2+ 抑制线粒体呼吸链复合物,解决了肿瘤缺氧问题。
光化学疗法通过两种主要机制发挥作用:I 型和 II 型。在 I 型反应中,活化的光敏剂通过电子转移反应产生各种 ROS,如 HO·、H2O2 和 O2-。第二类反应涉及从光敏剂的三重激发态到分子氧的能量转移,将分子氧转化为高活性的单线态氧。这些过程通常在光动力疗法中同时发生,它们之间的平衡受光敏剂浓度、光敏剂和基质的特性以及环境条件等因素的影响。目前大多数光动力疗法系统主要采用第二类机制。传统 II 型光导疗法的疗效主要取决于氧气的存在,只有在氧气充足的条件下才能启动。然而,一些实体瘤的快速生长会导致微环境缺氧,从而大大限制了光动力疗法的效果。克服这一限制已成为研究的重点。I 型 PDT 可利用氧气以外的各种底物产生自由基,为规避缺氧提供了一种直接策略。通过 I 型机制产生的 ROS 通常比 II 型机制产生的单线态氧毒性更强。Pan 等人的线粒体靶向纳米粒子 TSPy-B 通过同时诱导 I 型和 II 型 PDT 解决了 II 型 PDT 对氧的要求。体外实验证明,即使在缺氧条件下,它也能有效杀死肿瘤细胞。Pham 等人通过将乙基咔唑与二吡咯烷硼和噻吩耦合,合成了一种无重原子光敏剂(Cz-SB),该光敏剂利用 I 型 PDT 在缺氧环境中发挥高效功能。Zhuang 等人开发的有机NIR-II 光敏剂(TPEQM-DMA)具有强大的 I 型光疗功效,克服了 PDT 治疗缺氧性肿瘤的固有缺陷。
上述以线粒体为靶点的纳米材料在光动力疗法中表现出了显著的疗效。最初,其治疗效果存在一定的局限性,但随着时间的推移,这些问题已得到解决。目前已开发出克服缺氧和 ROS 扩散不足等难题的解决方案。这使得治疗方法更加精细和接近完美,克服了各种障碍,大大提高了线粒体靶向光动力疗法的临床转化价值。
3.2. 光热疗法
光热疗法(PTT)和 PDT 是两种作用机制不同的治疗方法。PTT 依靠光诱导温度升高的原理来达到治疗效果。它涉及将纳米粒子等光吸收材料输送到目标区域。当这些材料受到特定波长的光照射时,它们会将吸收的光能转化为热量,导致局部温度升高。温度升高可导致组织消融和目标区域的破坏。虽然热效应与周围组织之间的精确相互作用非常复杂,但基于纳米材料的 PTT 在治疗各种癌症的体外和体内治疗中都显示出了良好的前景。
最近,二硫化钼(MoS2)纳米粒子被用作伤口敷料的抗菌材料,由于其光热效应和过氧化物酶模拟活性,展示了其在医疗应用方面的潜力。值得进一步研究的是,具有线粒体靶向能力的 MoS2 纳米粒子是否能提供更有效的治疗效果。Li等人报道了一种线粒体靶向 MoS2 纳米片用于增强NIR-II 光热-化学动力学协同癌症治疗(),该纳米片是通过用多巴胺和 PEG 对 MoS2 纳米片进行改性,并进一步与三苯基膦端肽共轭制备而成,具有线粒体靶向能力()。这些纳米片具有很强的 NIR-II 吸收能力和 Fenton 反应活性,能在肿瘤细胞线粒体中产生大量羟自由基。结合NIR-II 激光照射的高温效应,它们可以有效地破坏线粒体,从而提高抗癌效果()。
Wu 等人设计并合成了一种线粒体靶向的一氧化氮(NO)气体纳米发生器,用于增强NIR-II 生物窗口中的温和 PTT。该纳米发生器由聚乙烯亚胺修饰的硫化铜纳米板组成,以提高其生物相容性,并共轭三苯基膦作为线粒体靶向配体。通过高压加载 NO 气体,该纳米发生器在近红外激光照射下可释放具有线粒体靶向性的 NO 气体。体外和体内研究表明,轻度 PTT 通过增强线粒体损伤、下调热休克蛋白和增加细胞凋亡等机制协同增强了抗肿瘤效果。这项工作为产生一氧化氮气体的纳米发电机的工程设计提供了新的灵感,从而提高了光热疗法的准确性和有效性。
Wang 等人开发了一种近红外刺激多模式协同光热无化疗纳米粒子平台(AuNR@MSN(BNN6)-lips-dox,AM(B)LD),用于线粒体靶向肿瘤治疗。该纳米平台由三部分组成:1)以金纳米棒为核心的介孔硅涂层结构(AuNR@MSN),具有良好的光热转换效率和较高的药物负载能力,可负载 NO 前体药物 BNN6;2)热敏磷脂双分子层,包括 DPPC 和线粒体靶向药物 DSPE-PEG2000-DOX;3)DOX 化疗药物。AM(B)LD 纳米平台可通过 EPR 效应被动靶向和富集肿瘤,而 DSPE-PEG2000-DOX 则使其具有主动靶向线粒体的能力。在线粒体区域,近红外激光可诱导 AuNR@MSN 产生光热效应,使局部温度升高至 42°C 以上,从而引发 BNN6 快速释放 NO,促进 DOX 的释放。该平台整合了靶向线粒体、PTT、气体疗法和化疗等多种模式,在体内和体外实验中显示出显著的协同抗肿瘤活性。机理研究表明,AM(B)LD 纳米平台可通过破坏线粒体膜电位、增加 ROS 水平、启动线粒体介导的细胞凋亡通路等多种途径诱导线粒体氧化应激和细胞凋亡,最终实现对肿瘤细胞的有效杀伤。
Wang 等人开发了一种聚合物氧化物纳米结构(TPC/2DG NSs),用于增强光热效应。该纳米结构由经 TPP 修饰的钙磷复合物和可负载糖酵解抑制剂 2DG 的聚合物氧化物组成。TPC/2DG NSs 不仅具有出色的近红外光热转换性能,还能通过靶向线粒体造成氧化应激损伤。在近红外激光照射下,纳米结构可控地降解和释放 2DG,从而协同抑制肿瘤细胞的糖酵解和线粒体氧化磷酸化代谢途径,导致 ATP 耗竭。ATP 耗竭会进一步下调 HSP 的表达,降低肿瘤细胞的耐热性,最终增强光热疗效。机理研究表明,TPC/2DG NSs 能显著增强肿瘤细胞线粒体氧化损伤和 ROS 水平,破坏线粒体膜电位,与光热作用协同杀死肿瘤细胞。在小鼠模型中,TPC/2DG NSs 也显示出显著的抗肿瘤疗效,且无明显副作用。这种纳米材料通过靶向线粒体诱导 ATP 耗竭并下调 HSP,从而增强光热效应,为肿瘤治疗提供了一种新策略。
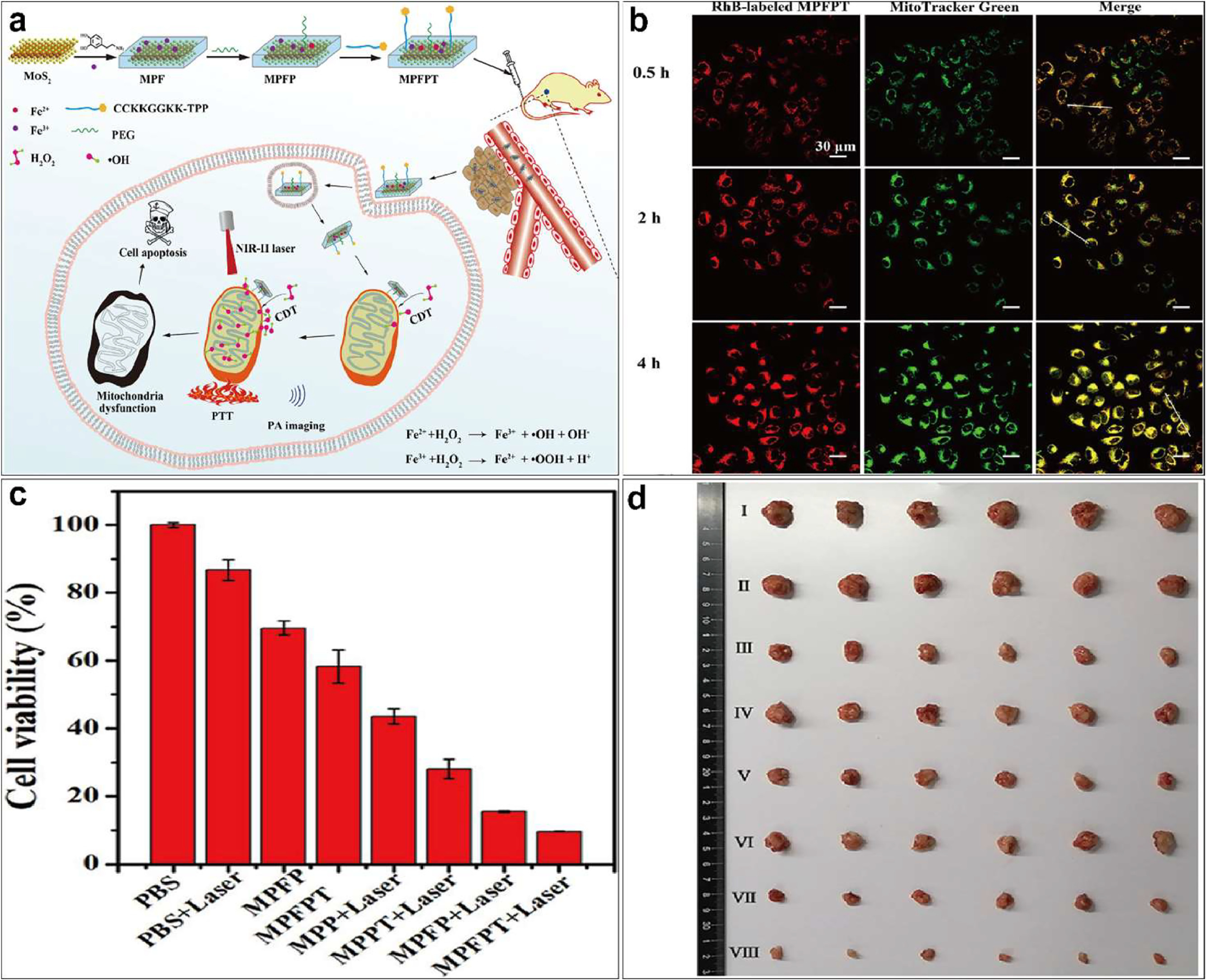
图3.(a)线粒体靶向 MPFPT NSs 的制备过程示意图及其在增强 NIR-II PTT-CDT 协同肿瘤治疗和光声(PA)成像中的应用;(b)MPFPT NSs 与 4T1 细胞线粒体的共定位分析;(c) MPFPT NSs 与 4T1 细胞共孵育后的细胞毒性评估;(d)不同处理组切除肿瘤的照片。
3.3. PTT 联合 PDT
尽管光热疗法 (PTT) 或光动力疗法 (PDT) 取得了显著成就,但由于 PTT 的获得性热休克效应和 PDT 的缺氧微环境,单独使用 PTT 或 PDT 的效率并不理想。Wang 等人设计并制备了一种线粒体靶向的全光热纳米颗粒 T-IPIC NPs,用于 808 nm 激光诱导的高性能近红外 II 成像引导光疗。该纳米颗粒通过简单的纳米沉淀法制备,将疏水性 IPIC 与 TPP 改性的两亲共聚物包裹在一起。该纳米颗粒具有出色的线粒体靶向能力,在 808 nm 激光照射下具有很强的近红外吸收和高近红外-II 荧光发射。在照射时,纳米颗粒可同时产生较高的光热转换效率(39.6%)和丰富的单线态氧(2.3% 的单线态氧量子产率,几乎是临床近红外染料 ICG 的 12 倍),通过诱导线粒体功能障碍和细胞凋亡,在体内产生光热和光动力联合治疗效果。由于其固有的多功能特性,在体内治疗过程中只需要单剂量注射和激光照射。在这项研究中,PTT 和 PDT 的结合产生了显著的治疗效果。
Wang 等人构建了一种涂有透明质酸和 PAMAM 树枝状聚合物的线粒体靶向 PDT 纳米平台。该平台可通过 EPR 效应在肿瘤内聚集,并通过透明质酸与肿瘤细胞上的 CD44 受体特异性结合,实现肿瘤靶向。负载的 dc-IR825 可精确靶向线粒体,在近红外照射下产生活性氧和微热,直接破坏线粒体,实现线粒体靶向 PDT 和微温 PTT 的协同作用。线粒体损伤可引发免疫原性细胞死亡,促进树突状细胞成熟,进而激活免疫反应。这种联合疗法在小鼠模型中表现出显著的抗肿瘤疗效。
在另一项工作中,Yang 等人开发了一种谷胱甘肽响应型纳米粒子 FE-T NP,实现了线粒体的精确靶向和光热/光动力疗法的放大效应,从而引发强大的免疫原性细胞死亡。该纳米粒子通过改性四种三苯基膦实现了对肿瘤细胞线粒体的精确靶向。在谷胱甘肽的作用下,FE-T NP 能迅速在线粒体中聚集,从而有效地诱导线粒体功能障碍和肿瘤细胞凋亡。由于光热疗法和光动力疗法在线粒体中的集中增强效应,这种光热平台可有效提高免疫反应,改善免疫抑制环境,表现出良好的抗肿瘤免疫治疗效果。这项研究为利用线粒体靶向和协同光疗实现有效的肿瘤治疗提供了一种前景广阔的策略。
基于上述研究,线粒体靶向策略在光疗领域展现出巨大的潜力。通过利用光热疗法 PTT 和 PDT 的协同效应,这些策略可以显著提高抗肿瘤疗效并改善免疫反应,为癌症治疗提供新的见解和方法。这些发现进一步支持了线粒体靶向策略在 PDT/PTT 联合疗法中的应用前景,展示了其临床转化的巨大潜力。
3.4. 化学动力疗法
化学动力疗法(CDT)是一种新兴的肿瘤治疗策略,它利用FENTON反应或类FENTON反应在肿瘤部位产生羟基自由基,以杀死肿瘤细胞。CDT 依赖于肿瘤微环境中特有的微弱酸碱度和过量产生的过氧化氢来触发FENTON反应或类FENTON反应。在FENTON反应中,铁离子催化过氧化氢生成具有高度氧化性的羟基自由基,这些自由基能够强烈地损伤肿瘤细胞并诱导其凋亡。由于 CDT 可以利用肿瘤特异性的微环境进行自我化学反应,因此理论上它可以最小化对正常组织的影响。与传统的化疗和放疗相比,CDT 具有更高的选择性和特异性,被认为是一种“绿色”的肿瘤靶向疗法。
Zhang 等人报道了一种用于肿瘤细胞线粒体靶向协同 PTT 和 CDT 的氟化铁纳米粒子 FeF2/Fe1-xS 纳米棒(FFSNRs-PEG)。这种纳米粒子可以释放 Fe2+ 和 F- 离子,通过FENTON反应和氟过载产生羟基自由基,导致线粒体损伤,并激活 Caspase-3 诱导细胞凋亡。同时,FFSNRs-PEG 在第二近红外窗口具有强吸收能力,可以发挥光热效应杀死肿瘤细胞,从而增强 CDT 的疗效。这种多功能纳米系统具有光热-化学协同治疗肿瘤的能力,为线粒体靶向抗癌治疗提供了新思路。
Deng 等人报道了一种金属配位线粒体质子载体解偶联剂(Cu-BAQ),用于肿瘤的排氧增强生物还原治疗。该系统通过 Cu2+、BAM15 和 AQ4N 之间的非共价作用自组装成纳米颗粒,并在肿瘤组织中积累。在谷胱甘肽的作用下,这些纳米颗粒会释放药物。释放出的 BAM15 可以促进线粒体解偶联效应,加速细胞呼吸和耗氧量,从而诱发肿瘤局部缺氧。此外,AQ4N 作为一种生物还原药物,能在缺氧条件下被还原酶激活,抑制肿瘤细胞的生长。这种自组装纳米系统具有协同效应,能显著抑制肿瘤生长。Cu-BAQ 为肿瘤细胞线粒体靶向 CDT 治疗的研究与开发提供了一种新思路。
这些研究成果不仅展示了 CDT 的巨大潜力,也为未来抗肿瘤治疗策略的开发提供了有价值的见解和方向。特别是 Zhang 等人的研究结合了 PTT,协同效应带来的治疗效果十分显著。未来针对线粒体靶向材料的研究可以利用 CDT 与其他治疗方式的协同作用来提高治疗效果。
3.5. 声动力疗法
声动力疗法(SDT)是一种新兴的治疗模式,它利用超声波的力量进行精确和无创的癌症治疗。近年来,这项技术因其穿透深层组织和提供时空特异性的独特能力而备受关注。Nguyen Cao 等人合成了谷胱甘肽(GSH)反应性的二硒化脂(DSe),并将其嵌入外泌体膜中,构建了可生物重现的外泌体--DSe-E。这种纳米载体共同载入了线粒体靶向增敏剂--TPP共轭Ce6(T-Ce6)和糖酵解抑制剂--FX11。在富含 GSH 的肿瘤微环境中,二硒键可被还原性裂解,从而促进药物从负载药物的外泌体中释放出来。研究发现,在超声照射下,DSe-E(T-Ce6/FX11)能有效产生细胞内活性氧,诱导线粒体损伤和能量代谢抑制,显著增强癌细胞凋亡。动物实验表明,DSe-E(T-Ce6/FX11)可实现高效的肿瘤靶向和蓄积,在确保生物安全性的前提下,经超声照射后可明显抑制肿瘤生长。
Luo 等人利用声动力疗法平台开发出了 (Zr-TCPP(TPP)),可有效诱导免疫原性细胞死亡和肿瘤相关抗原释放,并同时提供免疫佐剂 R837 以促进树突状细胞成熟。他们利用免疫疗法和线粒体靶向技术,开发出了足以有效抑制肿瘤生长和转移的材料。
3.6. 免疫疗法
线粒体靶向阿托伐醌(Mitochondria-targeted atovaquone,Mito-ATO)可以重建肺癌的微环境,增强抗肿瘤免疫细胞的能量代谢。研究人员通过单细胞 RNA 测序(scRNA-seq)分析了经 Mito-ATO 处理和未处理的小鼠肺肿瘤免疫细胞,发现 Mito-ATO 能显著降低耗竭态 CD8+ T 细胞的比例,但增加了具有抗肿瘤作用的记忆样 CD8+ T 细胞的比例。机理研究表明,Mito-ATO 能上调 CD8+ 高效记忆 T 细胞、记忆样 CD8+ T 细胞、细胞毒性 CD4+ T 细胞和 M1 巨噬细胞等抗肿瘤免疫细胞的氧化磷酸化和三羧酸循环代谢。然而,调节性 T 细胞和粒细胞源性骨髓抑制细胞等肿瘤促进性免疫细胞的代谢活性却被下调。丙酮酸脱氢酶、异柠檬酸脱氢酶、谷氨酸脱氢酶等关键代谢酶在上述两类免疫细胞中表现出代谢 “可塑性”。综合分析表明,Mito-ATO 能上调抗肿瘤免疫细胞的丙酮酸代谢,但下调促肿瘤免疫细胞的谷氨酰胺代谢。该研究揭示了 Mito-ATO 通过重塑肿瘤微环境中不同免疫细胞的代谢状态来增强抗肿瘤免疫应答的新机制,为肿瘤免疫代谢化学疗法提供了新思路。
Liu 等人报告了一种基于多芳基吡咯结构的 AIE 光敏剂,命名为 MAP-I,该光敏剂可实现线粒体靶向递送并诱导免疫原性细胞死亡(ICD)以达到协同治疗效果。作者精心设计了 MAP-I 的扭曲结构,以提高其产生 ROS 的效率,并加入了三苯基膦官能团,以实现线粒体的高选择性和蓄积。他们的研究结果表明,在激光照射下,MAP-I 会在线粒体内产生大量 ROS,造成线粒体损伤并激活细胞凋亡途径。更重要的是,MAP-I 诱导的强氧化应激环境导致线粒体相关损伤相关分子模式(DAMP)TFAM 的释放,为免疫疗法提供了新的靶点。体外和体内实验都证明,MAP-I 能有效诱导 ICD 相关标志物(CRT、HSP70、HMGB1 等)的表达,促进树突状细胞成熟,激活抗肿瘤免疫反应。在动物实验中,MAP-I 与光动力疗法相结合可延缓肿瘤生长,并产生持久的免疫记忆效应。
3.7. 多模式联合疗法和各种创新疗法
本章介绍的治疗策略并不完全符合前面讨论的任何特定部分。这些方法不仅依赖单一的治疗模式,而是结合了多种方法,包括 PDT、PTT、CDT、SDT 等。此外,本章还探讨了超越上述传统方法的创新治疗策略。本章特别关注在癌症治疗中针对线粒体的创新方法,从而拓宽科学研究的潜在治疗途径。
近年来,多模式联合疗法(MCT)也备受关注。Yang 等人开发了一种多刺激响应金纳米簇纳米适配器(Au NCs@MBA-TPP NAPs),用于线粒体靶向多模式肿瘤联合疗法()。Au NCs@MBA 纳米粒子以血红蛋白为配体和还原剂,采用简单的一步法原位合成。通过在 Au NCs@MBA 纳米粒子表面酰胺化 TPP,构建了具有线粒体靶向能力的 Au NCs@MBA-TPP NAPs()。该纳米适配体具有多种刺激响应特性。首先,Au NCs@MBA-TPP NAPs 可在近红外光的激发下产生光热效应,实现 PTT 和光热成像(PTI)的双重功能。其次,NAPs 中的血红素可催化过氧化氢分解产生氧气,从而增强 PDT。此外,NAPs 还能针对肿瘤微环境中过量的 GSH 和过氧化氢产生羟自由基,从而实现 CDT。最后,NAPs 的线粒体靶向能力可将 PTT、PDT 和 CDT 的作用集中于线粒体部位,从而提高联合疗法的杀瘤效率。这些结果表明,Au NCs@MBA-TPP NAPs 通过调节肿瘤微环境、靶向线粒体和实现 PTT/PDT/CDT 协同作用,在体内和体外均显示出显著的疗效()。
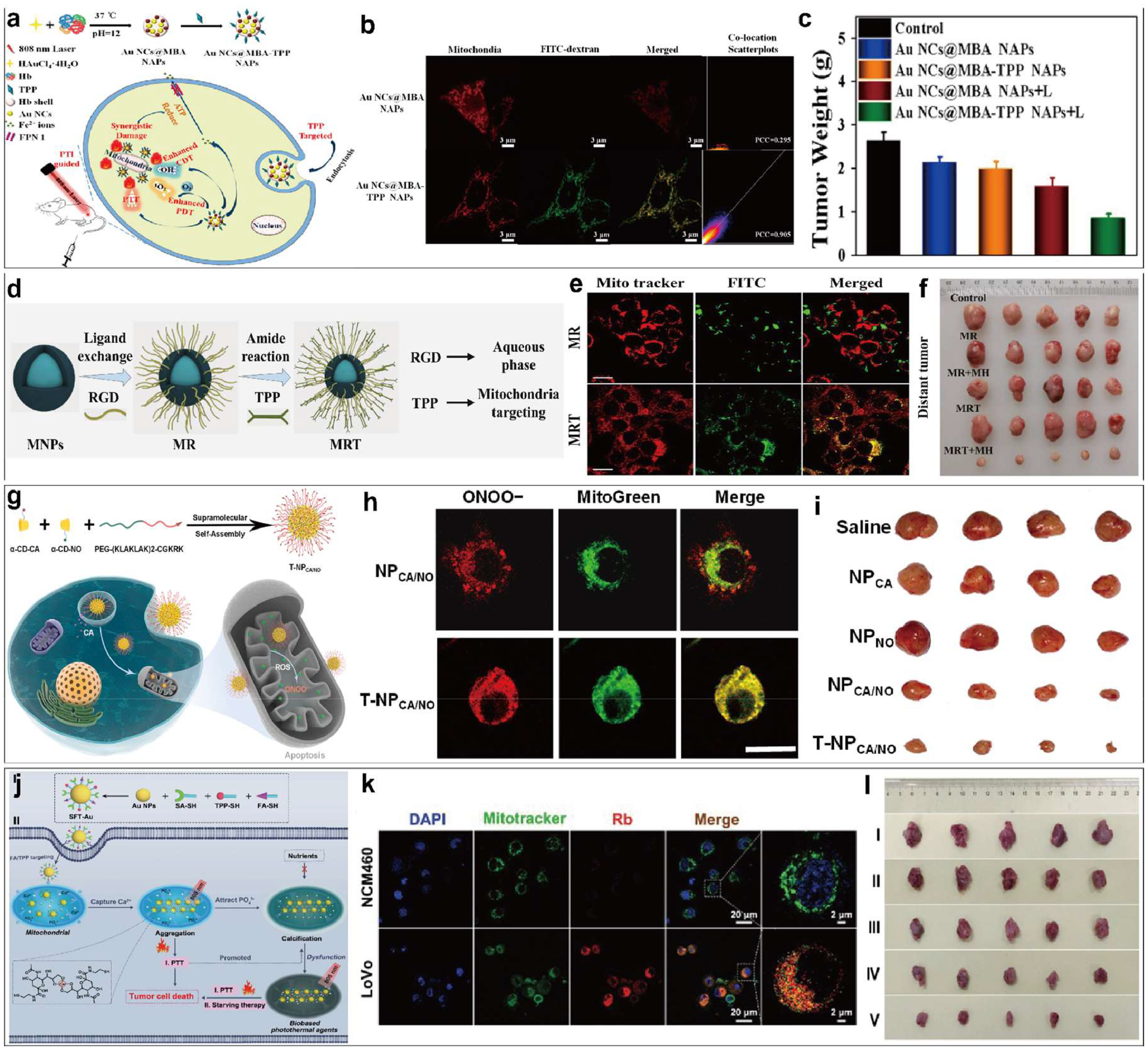
图4.(a)Au NCs@MBA-TPP NAPs 的合成和治疗过程示意图。(b) 用 MitoTracker 和 FITC-葡聚糖标记的样品处理 HepG2 细胞的 CLSM 图像以及相应的共定位散点图。(c) Au NCs@MBA-TPP NAPs 处理后各组的肿瘤重量。(d) ZnCoFe2O4@ZnMnFe2O4 磁性纳米粒子的合成及进一步 RGD/TPP 修饰示意图。(e) Hepa 1-6 细胞与FITC标记的 MR/MRT 纳米粒子共培养的代表性 CLSM 图像。(f)治疗结束时肿瘤照片。(g) 通过超分子组装制备 T-NPCA/NO 并在线粒体中产生 ONOO- 的示意图。(h) 用 NPCA/NO 或 T-NPCA/NO 培养 LM3 细胞的荧光图像。(i)第 16 天不同处理后收获的肿瘤照片。(j) SFT-Au 纳米粒子的合成(I)和治疗机制(II)示意图。(k)用罗丹明 B(Rb)标记的 SFT-Au 培养 48 小时后,结直肠癌 LoVo 细胞和正常 NCM460 细胞的共聚焦荧光显微镜图像。(l)肿瘤小鼠经 SFT-Au 处理后第 21 天的肿瘤照片。
3.7.1. 基于磁性纳米材料的疗法
磁性纳米粒子在交变磁场下产生的热量可用于热疗,近年来在癌症治疗方面显示出巨大潜力。Jiang 等人合成了一种核壳结构的 ZnCoFe2O4@ZnMnFe2O4 磁性纳米粒子 MRT,该粒子用 RGD 和 TPP 修饰,具有双重靶向性()。这种纳米粒子可特异性靶向肿瘤细胞线粒体,在交变磁场下通过线粒体热应力损伤诱导肿瘤细胞免疫性细胞死亡。这种免疫原性细胞死亡可激活肿瘤相关巨噬细胞并使其重新极化为 M1 表型,从而诱导促炎细胞因子的释放并增强吞噬作用,抑制肿瘤生长()。这种将磁性纳米粒子和免疫性细胞死亡(ICD)相结合的创新方法为癌症治疗提供了新的见解和方法。
Shen等人设计并合成了用环金属化铱复合物修饰的锰铁氧化物纳米粒子--Ir@MnFe2O4 NPs,它将磁性热疗和FENTON反应驱动的化疗结合在一起。铱复合物可以特异性地靶向线粒体,使纳米粒子在肿瘤细胞的线粒体中聚集。当置于交变磁场中时,Ir@MnFe2O4 NPs 可产生局部热量,导致细胞凋亡。同时,过量的谷胱甘肽会将纳米粒子表面的 Fe3+ 还原为 Fe2+,进一步推动FENTON反应产生羟自由基,破坏细胞的氧化还原平衡。两种疗法的协同作用使 Ir@MnFe2O4 NPs 表现出显著的抗肿瘤活性。这项研究为开发癌症治疗的多模式组合策略提供了新的视角。
机械力在调节细胞命运和行为方面起着至关重要的作用。Chen 等人报告了一种磁力学抗癌方法,即使用经 TPP 修饰的 20 nm 锌掺杂氧化铁纳米立方体。这些纳米立方体能有效地靶向癌细胞的线粒体。在 40 mT 的 15 Hz 旋转磁场下,纳米立方体产生的机械力能损伤癌细胞。体外和体内研究都表明,纳米立方体与旋转磁场相结合,可以通过破坏线粒体功能来损伤癌细胞并抑制肿瘤生长。作者揭示了纳米立方体与外部磁场对齐并在目标线粒体上产生局部机械力,从而导致线粒体功能障碍和癌细胞凋亡的机制。这种磁力学策略为癌症治疗提供了一种极具吸引力的非侵入性物理方法。
3.7.2. 用活性氮化物治疗肿瘤
活性氮物种(RNS)是一类包含过氧亚硝酸阴离子、硝酸根阴离子、亚硝酸根阳离子、亚硝酸根离子以及其他更高阶氮氧化物的氮基氧化物化合物。因其强大的氧化和亚硝酸化能力,RNS能够诱导生物大分子变性和触发细胞凋亡。其中,过氧亚硝酸阴离子(ONOO-)作为RNS的典型代表,可以通过一氧化氮(NO)与超氧化物(O2·-)的反应而生成。值得注意的是,一氧化氮比大多数活性氧物质(ROS)更具毒性,因为它能与多种生物分子反应,造成细胞损伤。
一项研究构建了一种基于超分子识别的纳米载体 T-NPCA/NO,用于协同递送肉桂醛和一氧化氮供体,实现过亚硝酸盐增强的氧化疗法()。该系统通过α-环糊精衍生物与线粒体靶向肽改性聚乙二醇之间的主客体相互作用制备而成,并能在低pH值和高谷胱甘肽浓度的肿瘤微环境中释放药物。T-NPCA/NO能够促进一氧化氮与活性氧反应生成过亚硝酸盐,并且通过线粒体靶向基序在细胞线粒体中有效聚集,从而诱导线粒体介导的细胞凋亡()。此外,一氧化氮还能消耗细胞内的谷胱甘肽,削弱细胞的抗氧化能力,进而增强肉桂醛引起的氧化损伤。
3.7.3. 一氧化碳疗法
一氧化碳(CO)作为一种能够帮助维持细胞平衡并提供细胞保护的分子,其潜在的抗菌、抗炎、抑制细胞增殖及促进细胞凋亡的作用备受关注。Huang等人设计并合成了一种特殊的纳米复合材料,该材料由铂纳米颗粒构成,表面涂覆有羰基锰,并负载了3-氨基-1,2,4-三唑,同时还与葡萄糖氧化酶进行了共轭结合。
这种纳米复合材料能够在肿瘤微环境的酸性条件和过氧化氢的存在下响应,使葡萄糖氧化酶得以暴露,并释放一氧化碳、3-氨基-1,2,4-三唑和锰离子。纳米铂酸具有催化活性,可以分解过氧化氢并生成氧气,进而促进葡萄糖氧化酶介导的肿瘤细胞内葡萄糖耗竭。释放的锰离子则能够通过FENTON反应产生羟基自由基,进而诱导化学动力学治疗(CDT)。同时,3-氨基-1,2,4-三唑可以抑制内源性的过氧化氢酶,提供额外的反应物来补充治疗过程中消耗的过氧化氢。
综上所述,该系统实现了肿瘤代谢抑制、一氧化碳治疗和化学动力学治疗的协同效应,有效地抑制了肿瘤的生长。
3.7.4. 肿瘤组织钙化
肿瘤组织钙化是一种非药物性的饥饿疗法,它通过螯合剂在肿瘤细胞表面形成钙化层来阻止营养物质的吸收,从而抑制肿瘤的生长和增殖。这种方法无需使用有毒药物,提供了一种低毒且前景广阔的癌症治疗方法。
Chang 等人研发了一种新型多功能金纳米粒子(SFT-Au),用于精准靶向肿瘤线粒体并实现钙化(图 4j)。该纳米粒子表面修饰了硅酸(SA)、叶酸(FA)和三苯基膦(TPP)。其中,硅酸具有螯合钙离子的能力;叶酸赋予了纳米粒子肿瘤靶向性;而 TPP 则让纳米粒子能够靶向线粒体。借助 FA 和 TPP 的双重靶向作用,纳米粒子能够集中分布在线粒体中。随后,硅酸迅速捕获线粒体中过量的钙离子,造成钙离子失衡并促使纳米粒子聚集()。这些聚集的纳米粒子进一步吸引周围的钙离子,促进线粒体钙化的发生,并在 808 nm激光照射下产生光热效应,加速这一过程。线粒体的钙化可以抑制肿瘤细胞的能量代谢,实现有效的饥饿治疗。此外,光热转换还能够直接损害肿瘤细胞()。这一策略促进了可控钙化作为饥饿疗法在肿瘤治疗中的应用。
3.7.5. 线粒体吞噬疗法
有丝分裂是一种特殊的自我保护过程,通常涉及降解受损或功能失调的线粒体,通常认为这会降低线粒体靶向疗法的效果。Zhu 等人报告了一种通过过度的线粒体吞噬作用消耗肿瘤细胞能量的抗癌策略。他们设计的 TPGS/dc-IR825 聚合物细胞能特异性地聚集在肿瘤细胞的线粒体中,并造成线粒体损伤。为了自我保护,肿瘤细胞激活了有丝分裂和 AMPK 触发的自噬,以清除受损的线粒体,弥补 ATP 的不足。然而,产生的大量自噬体远远超过了自溶酶体的降解能力,导致溶酶体功能障碍和自噬过程受阻。最终,细胞 ATP 被过度消耗,导致细胞死亡。聚合物纳米细胞还显示出良好的肿瘤靶向性和体内抑制功效。这项研究阐明了有丝分裂在癌症治疗中的重要作用,并通过调节肿瘤细胞的自噬过程提供了一种新的抗癌策略。
Sun等人构建了一种靶向线粒体的聚赖氨酸基纳米药物载体,实现了代谢和自噬的协同抑制,用于治疗耐药肿瘤()。该系统通过在聚赖氨酸上共轭三苯基膦和洛尼达明,实现了线粒体归巢和代谢抑制()。随后,葡萄糖氧化酶和二茂铁复合物被载入,以提供额外的化疗功能。结果表明,该系统能有效抑制肿瘤细胞呼吸和关键代谢酶,并通过葡萄糖氧化酶和二茂铁产生过量活性氧,增加线粒体通透性以释放细胞色素 c,从而诱导高水平自噬()。
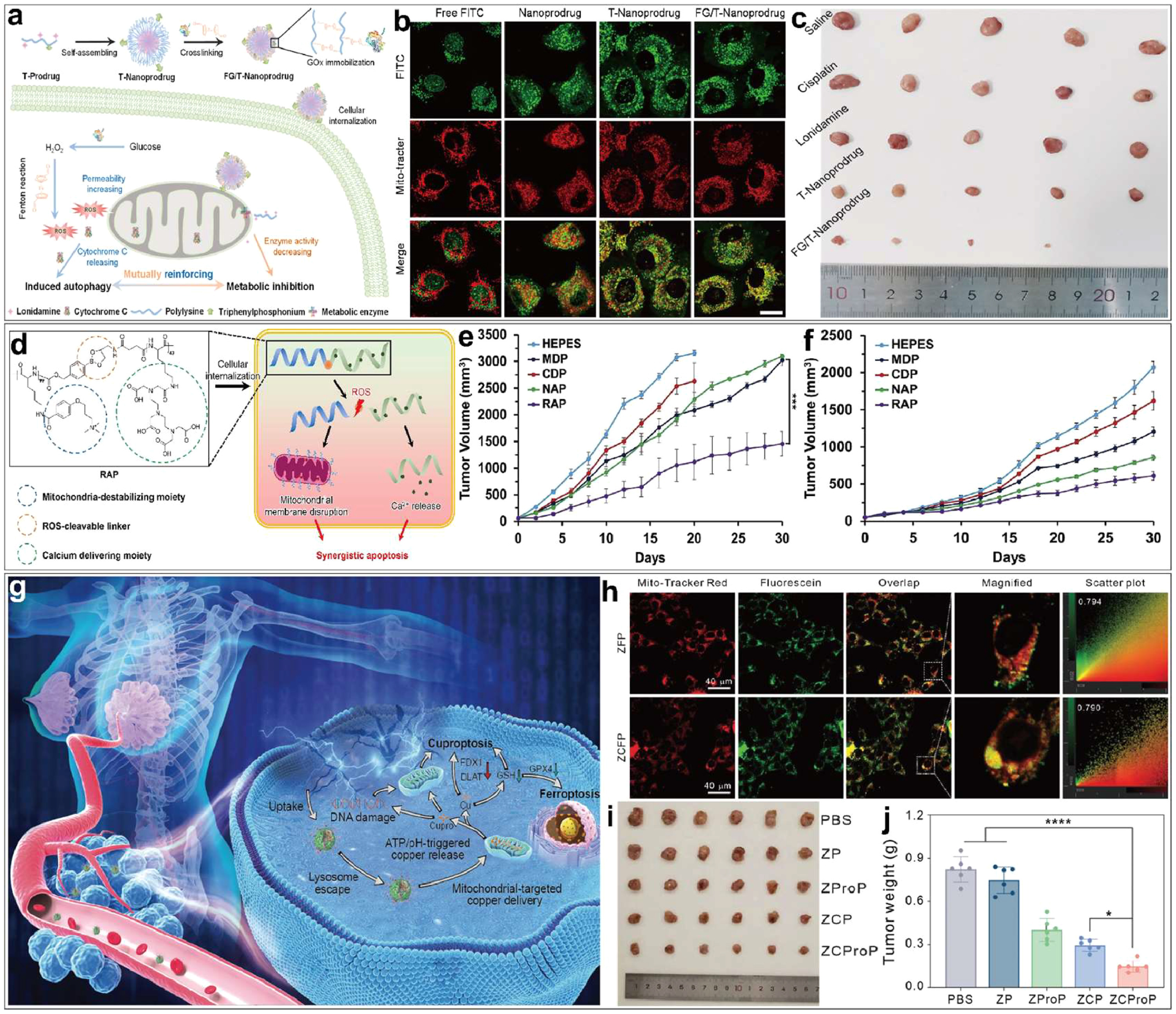
图5.(a)二茂铁和葡萄糖氧化酶交联的线粒体靶向 FG/T nm药物的制备,以及自噬和代谢抑制相互促进以抗击癌症的图示。(b)用 FITC 标记的nm药物处理后的 CLSM 图像(c)治疗一周后所有肿瘤的照片。(d) RAP 的结构和 RAP 诱导细胞凋亡的机制示意图,(e)NCI-H460 移植物在 BALB/c 小鼠体内的肿瘤生长动力学。(f)MDA-MB-231异种移植物在 BALB/c 小鼠体内的肿瘤生长动力学。(g)基于线粒体靶向杯突酶作用的乳腺癌协同治疗 ZCProP 纳米平台示意图。(h)4T1 细胞经 ZFP 和 ZCFP 处理 4 小时后的 CLSM 图像,然后用 Mito-Tracker Red 染色进行线粒体标记。(i,j)切除肿瘤的照片(i)和重量(j)
3.7.6. 针对线粒体诱导的细胞凋亡进行肿瘤治疗
过去几十年来,人们开发了多种策略来激活线粒体凋亡途径以治疗癌症。这些策略包括钙(Ca2+)超载、线粒体膜电位降低、线粒体裂变和线粒体 ROS 水平升高。钙离子超载被认为是诱导癌细胞凋亡的有效方法之一,它涉及上调细胞内 Ca2+ 浓度,进而触发一系列线粒体事件,包括线粒体膜电位下降、ATP 水平耗竭、线粒体形态变化和线粒体呼吸中断。
Huang等人设计了一种凋亡诱导多肽,该多肽能够同时破坏线粒体外膜和细胞内钙平衡()。该多肽由破坏线粒体的分子、输送钙离子的分子和可清除 ROS 的连接体组成。它可以穿过细胞膜,并在 ROS 环境下被裂解为两部分。线粒体干扰分子靶向破坏线粒体外膜,而钙离子输送分子则将细胞外的钙离子输送到细胞膜。线粒体外膜的破坏和钙离子平衡的紊乱协同产生了过多的活性氧,并激活了细胞凋亡信号通路。体外和体内实验均表明,该多肽能显著诱导肿瘤细胞凋亡并抑制肿瘤生长()。
细胞内 K+ 平衡在生物过程中发挥着重要作用。近年来,干扰细胞内 K+ 平衡已成为一种癌症治疗策略。Ma等人开发了一种利用人工离子通道分子破坏癌细胞线粒体离子平衡来克服多药耐药性的策略。他们设计并合成了 MPTPP,这是一种含有 TPP 的两亲嵌段共聚物,能够自组装成纳米胶囊。这种载体可以包含高选择性人工 K+ 离子通道分子 5F8,并实现其高效溶解和线粒体靶向递送。一旦 MPTPP@5F8 纳米颗粒进入癌细胞线粒体,5F8 分子就能在线粒体膜上自组装形成人工 K+ 离子通道。由于细胞质和线粒体之间存在浓度梯度差,细胞质中的大量 K+ 离子会流入线粒体,从而破坏线粒体的离子平衡。这会导致一系列线粒体功能障碍,如线粒体膜电位降低、ATP 合成减少、ROS 增加、抗凋亡蛋白 BCL-2 和 MCL-1 下调,最终诱发细胞凋亡。该策略的优势在于不受癌细胞存在泵和非泵耐药机制的影响,能有效诱导多药耐药癌细胞凋亡。体外和体内实验也证实了 MPTPP@5F8 纳米粒子的有效抗肿瘤活性。这种在线粒体中精确构建人工离子通道的策略为治疗耐多药癌症提供了一种潜在的新方法。
3.7.7. 以线粒体诱导的铜中毒为靶点治疗肿瘤
铜诱导的细胞死亡,或称“铜死亡”现象,是一种新提出的细胞死亡机制,与线粒体密切相关。以线粒体为靶点诱导铜中毒是一种很有前景的癌症治疗策略。Deng 等人开发了一种金属有机框架纳米平台(ZCProP)来实现癌细胞的铜突变,从而促进肿瘤治疗()。该纳米平台由掺铜的 ZIF-90 纳米粒子和负载的质子(Prodigiosin)组成,并通过 PEG 修饰赋予其良好的生物相容性。在肿瘤微环境(低 pH 值和高 ATP 浓度)中,ZCProP 被降解,释放出铜离子和质子。释放出的铜离子可靶向线粒体中与三羧酸循环相关的蛋白质(),并诱导杯突症。ZCProP 还能清除 GSH 并抑制 GPX4 的活性,从而导致铁突变。此外,铜离子和质子的协同作用也会导致线粒体功能障碍和 DNA 损伤,并促进细胞凋亡。体外和体内实验表明,ZCProP 纳米平台可有效靶向肿瘤部位,通过上述机制诱导肿瘤细胞死亡,从而显著抑制肿瘤生长,具有良好的生物安全性(图 5i)。
Xu 等人开发了一种三苯基膦修饰的铜(I)复合物——Cu(I)Br(PPh3)3 (CBP)。与临床研究的铜离子载体药物依来氯莫尔(ES)将细胞外铜(II)离子输送到线粒体不同,CBP 直接将铜(I)离子输送到线粒体。通过一系列体外和体内实验,研究人员发现 CBP 能有效地在肿瘤部位积聚,特异性地靶向线粒体,并诱导线粒体功能障碍,导致 “铜死亡”。
4. 以线粒体为靶点的纳米成像探针
鉴于线粒体在疾病进展中的关键作用,线粒体状态或内容的成像尤为重要。这可以加深对线粒体状况的了解,从而根据线粒体状态制定更有效的治疗策略。本章重点介绍各种针对线粒体设计的生物材料,主要用作探针。这些材料形态各异,有些不仅可用作探针,还具有治疗特性。这种双重功能使它们在积极参与疾病治疗过程的同时,还能提供重要的生物学见解。()
Table 2. Nanomaterials target mitochondria as probes and imaging
| Materials/Names | Application | Effect | Targeting strategy |
|---|---|---|---|
| TPE-2SP/CB/HA-CD | Mitochondrial imaging | Two-photon supramolecular near-infrared emission nanoparticles for targeted imaging of mitochondria in tumor cells | TPE-2SP/CB |
| Cy-3-TPP/Ff and Cy-5-TPP/FF | Mitochondrial imaging | Targeted tumor cell mitochondrial imaging and monitoring | TPP |
| PLCy | Mitochondrial imaging | Targeting imaging and therapy of tumor mitochondria using enzymatic activation | CyNH2 |
| TBET-SO2 | SO2 monitor | Targeted living cells and brain mitochondria monitoring SO2 | Positive Charge |
| MLD-SO2 | SO2 monitor | Two-color visualization of mitochondria and LDs and monitoring of SO2 | Cationic Group |
| Mito-Cy | MMP monitor | Targeted mitochondria sensitive monitoring of mitochondrial membrane potential | Positive Charge |
| Iridium(III) Complex Dye | mitochondrial dynamics | Targeting mitochondria to monitor mitochondrial dynamics under SIM | iridium(III) |
| HDCAβ-actin@BP-PEI | mtDNA monitor | Targeting mitochondrial quantitative target expression levels of mtDNA in living cells | TPP |
| PD-mUC | Imaging of Mito miRNA | imaging of mitochondrial miRNA in living cells through the spatiotemporally-controlled delivery and activation | TPP |
| MitoTCD | Long-Term Tracking | Long-term imaging and monitoring of the mitochondria | Rhodamine Structure |
| TPA-Mit | monitor cell apoptosis | Targeting mitochondria and sensitively responding to viscosity changes that occur with changes in fluorescence lifetime to monitor cell apoptosis | TPP |
| Ir(ppy-CHO)2(dppe)]PF6 (Ir6) | Monitoring bviscosity | Targeting tumor mitochondria to exert anticancer effects and monitoring mitochondrial viscosity under TPPLIM | Iridium(III) |
| MitoH202 | H2O2 Monitor | Targeting mitochondria to detect changes in hydrogen peroxide | P-pinacolborylbenzyl moiety |
| TPAQ-H2O2 | H2O2 Monitor | In vitro and in vivo assays of H2O2 | Quinolinate Cations |
| RhB/ZIF-90 | ATP imaging | Targeting mitochondria for ATP imaging in living cells | Rhodamine B |
| CVS | HOCL Monitor | Targeting mitochondria to monitor HOCL in living cells | Thioether group |
| JZ-1 | Mercury Monitor | Targeting mitochondria to monitor exogenous mercury | Rhodamine-like structure |
肿瘤细胞中的线粒体通常表现出功能障碍,其特征是形态、结构和代谢与正常细胞不同。捕捉肿瘤细胞线粒体特征的成像技术可为了解肿瘤细胞的发育和代谢状况提供有价值的信息。Shen 等人设计并合成了一种以四苯基乙烯为基础的衍生物 TPE-2SP,该衍生物含有一个电子供体甲氧基和一个电子受体乙烯基吡啶鎓盐,呈现出供体-π-共轭桥-受体(D-π-A)结构。利用超分子主-客体化学,TPE-2SP 可以与大环化合物 cucurbit[8]uril (CB[8]) 自组装,形成具有近红外发射(650 nm)的纳米方块。通过与β-环糊精修饰的带负电的透明质酸(HA-CD)进一步组装,制备出了直径约为 200 nm的近红外发射(680 nm)纳米粒子。密度泛函理论计算显示,TPE-2SP 分子中的甲氧基和乙烯基吡啶分子之间存在分子内电荷转移,这有利于其双光子吸收性能。令人兴奋的是,这些自组装的近红外发光纳米粒子不仅具有双光子激发(750-950 nm)特性,而且还由于表面 HA-CD 的靶向能力,实现了 A549 癌细胞的线粒体成像。这项工作为近红外发射和双光子吸收团簇的构建提供了新的见解,在生物靶向成像和其他领域的应用前景广阔。
Saha 等人设计合成了两种可见光和近红外荧光自组装肽 Cy-3-TPP/FF 和 Cy-5-TPP/FF,可选择性地靶向肿瘤细胞线粒体并实现成像。这两种分子可以自组装成荧光纳米管,并迅速进入肿瘤细胞,在线粒体中聚集,达到临界聚集浓度后形成荧光纳米管,实现线粒体靶向成像。其机理是,它们的正电荷可被肿瘤细胞线粒体的过负电位吸引,进入线粒体并达到自聚集临界浓度形成纳米管,从而实现对肿瘤细胞线粒体的选择性靶向成像。此外,在高浓度下,这些自组装肽还能诱导细胞早期凋亡。因此,这些自组装荧光肽纳米管在肿瘤诊断成像和治疗方面具有广阔的应用前景。
Di Ma 等人设计了一种肿瘤线粒体靶向诊疗一体化探针 PLCy,该探针可被组蛋白去乙酰化酶(HDACs)和酪蛋白酶 L(CTSL)依次激活,用于选择性的癌细胞线粒体靶向成像和治疗()。为了实现探针的遮蔽和顺序激活,CyNH2 与乙酰化赖氨酸肽共轭,并用聚乙二醇修饰,得到探针 PLCy。由于特殊的分子设计,PLCy 的荧光和细胞毒性最初被有效掩盖。活化的 CyNH2 能够降低癌细胞线粒体膜电位,增加活性氧水平,从而对癌细胞产生杀伤作用()。这项研究提供了一种通过酶介导的顺序激活和细胞器靶向实现肿瘤精确成像和治疗的通用策略()。
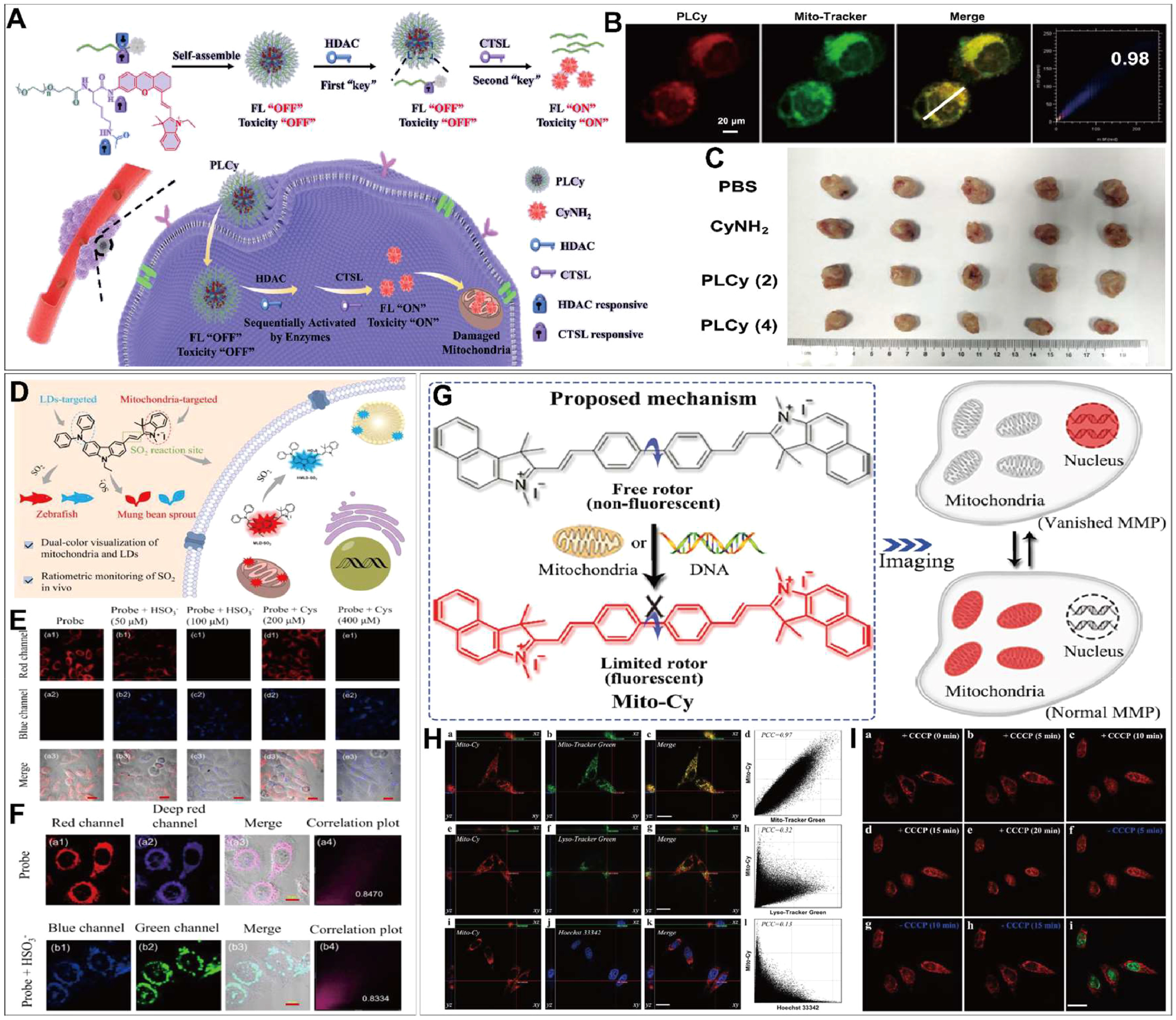
图6.(A)用于选择性肿瘤线粒体靶向成像和治疗的 HDAC 和 CTSL 顺序酶活化 PLCy 的示意图。(B) PLCy 在 4T1 细胞中的亚细胞定位。(C)不同治疗后的肿瘤图像。(D) MLD-SO2 探针的设计策略和作用机制示意图。(E) MLD-SO2 检测细胞中外源性和内源性 SO2 的荧光图像。在加入 MLD-SO2 之前,先用外源 50 μM 和 100 μM HSO3- 预孵育 HeLa 细胞。在加入 MLD-SO2 之前,HeLa 细胞还与 200 μM 和 400 μM Cys 预孵育。(F)HeLa 细胞的共染色图像(G)Mito-Cy 转子跟踪线粒体膜电位的理论基础。(H)MCF-7 细胞的三维共聚焦荧光图像。(I) 共焦荧光图像显示不同时间 CCCP 处理后 MCF-7 细胞中 Mito-Cy 的变化。
4.1. 针对线粒体进行二氧化硫监测
二氧化硫(SO2)是一种广泛存在于大气中的污染物,其神经毒性被认为是引发神经炎症并导致抑郁症、缺血性中风、认知功能障碍和神经退行性疾病的重要风险因素。线粒体是神经系统中高度敏感的细胞器,容易受到二氧化硫的氧化损伤。二氧化硫的溶解形式 HSO3- 的毒性与线粒体损伤密切相关。然而,目前缺乏一种可靠的工具来监测二氧化硫诱导的神经元线粒体损伤,而线粒体损伤对于二氧化硫诱导的神经退行性疾病的早期诊断至关重要。Hu 等人开发了一种基于TBET机制的双光子可激发比率荧光探针 TBET-SO2,用于可靠地检测二氧化硫。该探针在单一激发下产生两个基线分辨发射带,从而消除了光谱重叠,确保了测量的可靠性。在近红外脉冲激光(810 nm)的激发下,探针进行 TBET,产生远红外发射(611 nm)。该探针的能量传递效率高达 90.5%,两个峰值之间的光谱间隙达 118 nm。在与二氧化硫反应时,由于基线分辨发射,TBET-SO2 的比率测量信号增强了 30 倍。检测限低至 0.09 μM。此外,TBET-SO2 还成功地用于观察活细胞和小鼠脑组织在二氧化硫污染诱发神经炎症时的线粒体二氧化硫。这项工作表明,基于 TBET 的探针有可能应用于体内二氧化硫相关生理和病理过程的研究。
Wang 等人设计并合成了一种荧光探针 MLD-SO2,用于线粒体和脂滴的双色成像以及体内二氧化硫的监测()。在正常生理条件下,探针的阳离子结构使其能够靶向线粒体并发出红色荧光。在二氧化硫存在的情况下,探针发生迈克尔加成反应,转变为中性亲脂结构,从而靶向脂滴并发出蓝色荧光()。基于这一机制,研究人员在适当的 SO2 条件下实现了线粒体(红色)和脂滴(蓝色)的同步成像。此外,他们还利用双色荧光强度的比率变化来检测内源性和外源性 SO2。最后,该探针被应用于斑马鱼和绿豆芽,证明了其监测不同生物体内 SO2 变化的能力。该研究提供了一种依靠 SO2 驱动的可逆反应实现探针功能转换的策略,为线粒体成像和 SO2 检测的同步进行开辟了新途径。
4.2. 线粒体膜成像
线粒体膜电位(MMP)是细胞活动中一个极其重要的参数,因为即使是轻微的波动也会对生物体的生物功能产生重大影响。因此,由于传统的线粒体膜电位探针往往受到光漂白、不便使用和不可逆等因素的限制,人们对方便、准确的线粒体膜电位检测方法有着强烈的需求。Tan 等人设计了一种新型荧光分子转子探针 Mito-Cy,它能够准确、可逆地追踪不同的 MMP 状态()。该探针能够根据线粒体和细胞核的粘度限制其分子内旋转,从而在线粒体和细胞核中发光()。在 MMP 正常状态下,Mito-Cy 主要聚集在线粒体中,并发出强烈的荧光。当 MMP 降低时,它可以逐渐从线粒体迁移到细胞核()。在 MMP 完全消失的状态下,它只聚集在细胞核中。这种探针具有高灵敏度和光稳定性,可以动态观察不同 MMP 状态的变化。此外,作者还利用该探针构建了 "AND" 和 "OR" 逻辑门,实现了对 MMP 的逻辑控制,从而对 MMP 的变化进行可编程调节。这种荧光探针为深入研究与生物膜粘度相关的生物过程以及线粒体与细胞核之间的关键信息传递提供了强有力的工具,为线粒体相关疾病的研究和诊断提供了新的视角。
4.3. 线粒体动态监测
最新的超分辨率荧光显微技术,如 STED、SIM 和 STORM,以及其他单分子超分辨率成像技术,已成为研究亚细胞结构动态的强大工具。然而,这些技术对荧光染料提出了高要求,必须具备低细胞毒性和高光稳定性。遗憾的是,常用的荧光蛋白、有机染料和量子点由于光稳定性差、易受光漂白影响,在跟踪亚细胞动态方面存在局限性。
鉴于这些局限性,Chen 等人开发了一种铱复合物染料,专门用于在 SIM 条件下跟踪线粒体动态(),以满足对改良染料的需求。这种染料具有细胞渗透性、光稳定性和线粒体特异性。通过利用 SIM 成像,他们实现了约 80 nm的分辨率,从而能够清晰地观察线粒体嵴结构()。开发的染料可用于监测和量化线粒体与溶酶体之间的动态相互作用,包括有丝分裂过程中的融合事件。
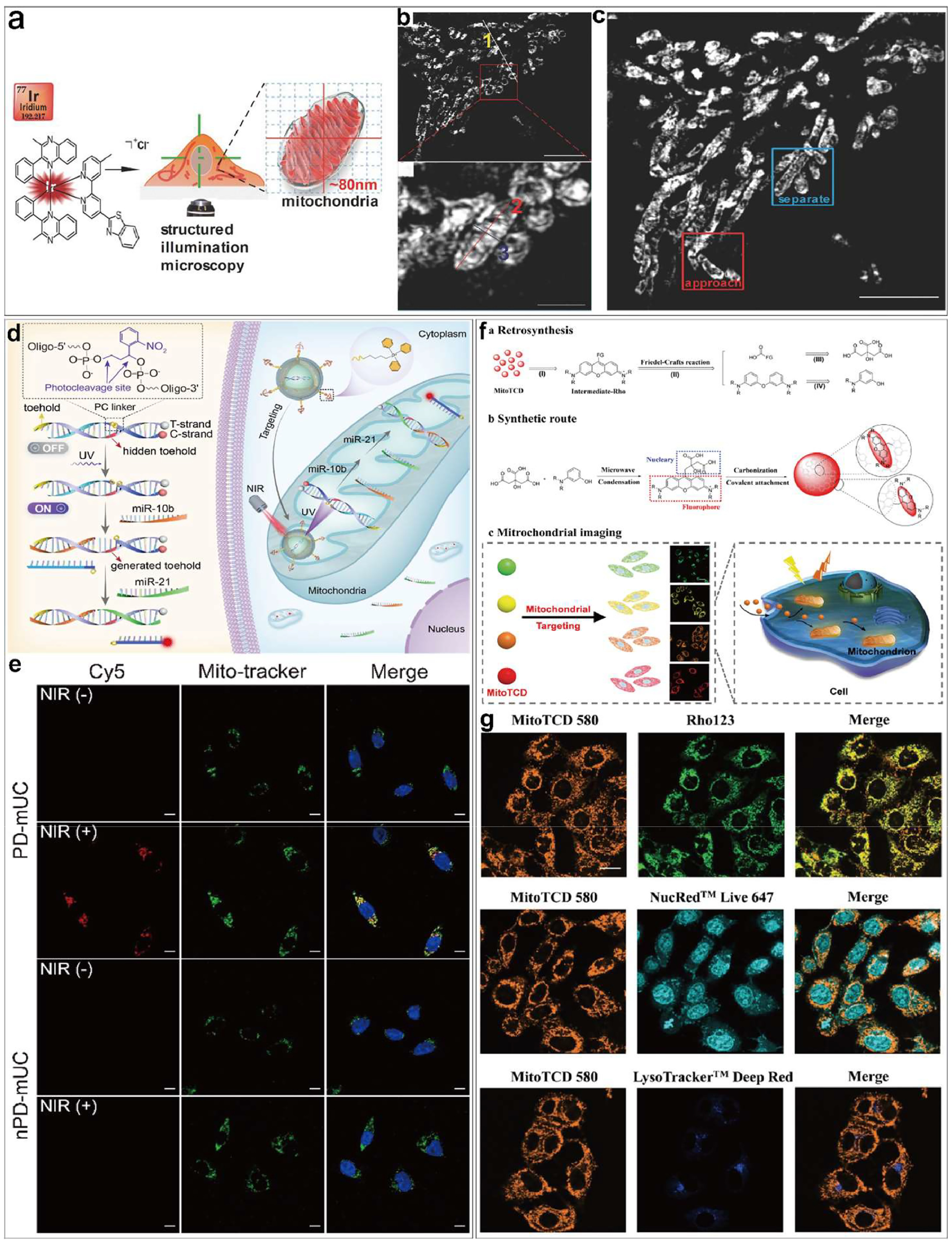
图7.(a)铱(III)络合染料在 SIM 下对线粒体成像时的示意图。 (b) 线粒体在 1 × 10-6 m 浓度下的铱(III)络合染料三维 SIM 和单个线粒体局部放大成像。(c) SIM 条件下线粒体的铱(III)复合物染料图像。(d) 通过近红外光控 SDR 进行线粒体成像的 DNA nm传送器技术示意图。(e)用 PD-mUC 和 nPD-mUC 处理 MCF-7 细胞,然后用或不用近红外光照射的 CLSM 图像。(f) MitoTCD 的逆合成、合成路线及在线粒体成像中的应用。(g) MitoTCD 580 用于线粒体成像。用 Rho123、NucRed Live 647 和 LysoTracker Deep Red 染色的 HeLa 细胞的共焦荧光图像和合并图像。
有趣的是,他们的研究结果表明,敲除五种有丝分裂受体(p62、NDP52、OPTN、NBR1 和 TAX1BP1)并不影响线粒体和溶酶体之间的接触,这表明这些过程是独立的。该染料的铱配位结构具有稳定的光物理特性,可以长期跟踪亚细胞动态。这项研究弥补了传统荧光染料的局限性,满足了精确可靠地跟踪亚细胞结构的需要。
4.4. 线粒体 RNA 成像
人类线粒体包含一个紧凑的环状DNA基因组,编码对能量产生至关重要的成分,其中包括2个mt-rRNA、22个mt-tRNA以及13个蛋白质。这些蛋白质是氧化磷酸化系统的关键部分,负责细胞能量产生的最终步骤,涉及电子传递链及ATP合成。线粒体RNA(mtRNA)的精确量化及其动态表达谱对于揭示其在细胞中的功能至关重要。然而,目前缺乏一种精确的mtRNA原位检测方法,这主要是由于mtRNA的运输难题和复杂的细胞内干扰。为此,Chen等人开发了一种双色成像系统,用于高精度定量分析活细胞中的mtRNA。
他们将特异性识别mtRNA ND6的无酶发夹DNA级联放大器(HDCA)整合到线粒体靶向配体修饰的可生物降解黑磷纳米片(BP-PEI-TPP)中,用于mtRNA ND6的成像。同时,他们还将针对β-actin mRNA的HDCA装载到BP-PEI中,作为内参物质输送到细胞质中。这一双色系统通过将目标mtRNA的荧光信号与β-肌动蛋白mRNA的荧光信号进行归一化处理,实现了与RT-qPCR相当的mtRNA定量水平。这种可生物降解的纳米载体可以保护核酸探针,并实现高效的亚细胞递送。此外,HDCA的级联信号放大提高了检测的灵敏度。这种方法是非侵入性的,且具有高精度,能够对不同亚细胞区域内的mRNA进行定量测量,为生物医学研究提供了探索RNA时空分布的新手段。
另外,Zhao等人开发了一种光学控制的DNAnm探针,用于线粒体miRNA的空间选择性成像。他们设计了一种光溶性连接体修饰的DNA探针,结合上转换纳米颗粒(UCNPs)后形成nm探针。该nm探针能特异性地靶向线粒体,并在近红外光照激发下产生紫外光发射,激活DNA探针的传感功能,从而实现对线粒体miRNA的成像(图 7e)。这种光学控制的“开关”设计确保探针在靶向过程中保持非活性状态,直至被光激活后才以更高空间精度特异性成像线粒体miRNA。这项技术为研究miRNA在多种生物学过程中的时空动态变化提供了一个强大的工具。
4.5. 线粒体长期追踪
准确且持续地监测线粒体的状态和活动对于调控细胞命运和治疗线粒体相关的疾病至关重要。然而,开发出具备光稳定性、适用于长期跟踪并且具有可调谐长波长荧光的线粒体靶向探针一直是一项艰巨的任务。耿等人采用罗丹明分子作为碳点的核心发光单元,通过逆向合成策略成功制备了一系列可调荧光线粒体追踪碳点(MitoTCD)()。
由于这些 MitoTCD 具备光稳定性、优良的荧光性能和良好的生物相容性,它们可以有效应用于 HeLa 细胞的线粒体靶向成像,并且能够在细胞分裂过程中追踪长达六个世代,非常适合进行长期的细胞成像()。除此之外,MitoTCD 还可以用于体内成像应用,例如斑马鱼模型的成像。这些 MitoTCD 能够定位在线粒体内部,而且其定位不受线粒体膜电位的影响。它们的工作原理类似于罗丹明分子,这类分子含有亲脂性阳离子,能够在线粒体中积累。MitoTCD 的开发为实时监测线粒体的状态和行为提供了有力的工具,这对于深入了解线粒体在调控细胞命运中的作用以及推动线粒体相关疾病的治疗具有重要意义。
4.6. 线粒体凋亡监测
细胞凋亡,也称为程序性细胞死亡,是一种先天性防御机制,在生物体的正常发育和抗病能力方面发挥着至关重要的作用。细胞凋亡过程和途径的失调可导致包括癌症在内的多种疾病。由于细胞凋亡检测是评估癌症治疗效果的重要指标,因此可靠的细胞凋亡检测方法在癌症治疗中至关重要。
Zou 等人开发了一种双光子线粒体靶向探针 TPA-Mit,用于荧光寿命成像检测细胞凋亡()。该探针可以特异性靶向线粒体,并通过改变其荧光寿命对微环境粘度变化做出反应。作者使用紫杉醇诱导卵巢癌细胞 SKOV-3 凋亡,并使用 TPA-Mit 探针监测线粒体微粘度的变化。实验结果显示,随着细胞凋亡程度的增加,线粒体中 TPA-Mit 的平均荧光寿命从 550 ps 增加到 800 ps,表明线粒体微粘度增加()。这是因为,在细胞凋亡早期,线粒体内膜的通透性增加,导致大量酶和其他蛋白质在线粒体基质中积累,从而使微粘度增加。与仅检测线粒体膜电位变化的方法相比,这项利用荧光寿命成像的研究能够更精确地检测早期细胞凋亡。这种方法为检测细胞活力和衡量肿瘤治疗效果提供了新的视角。
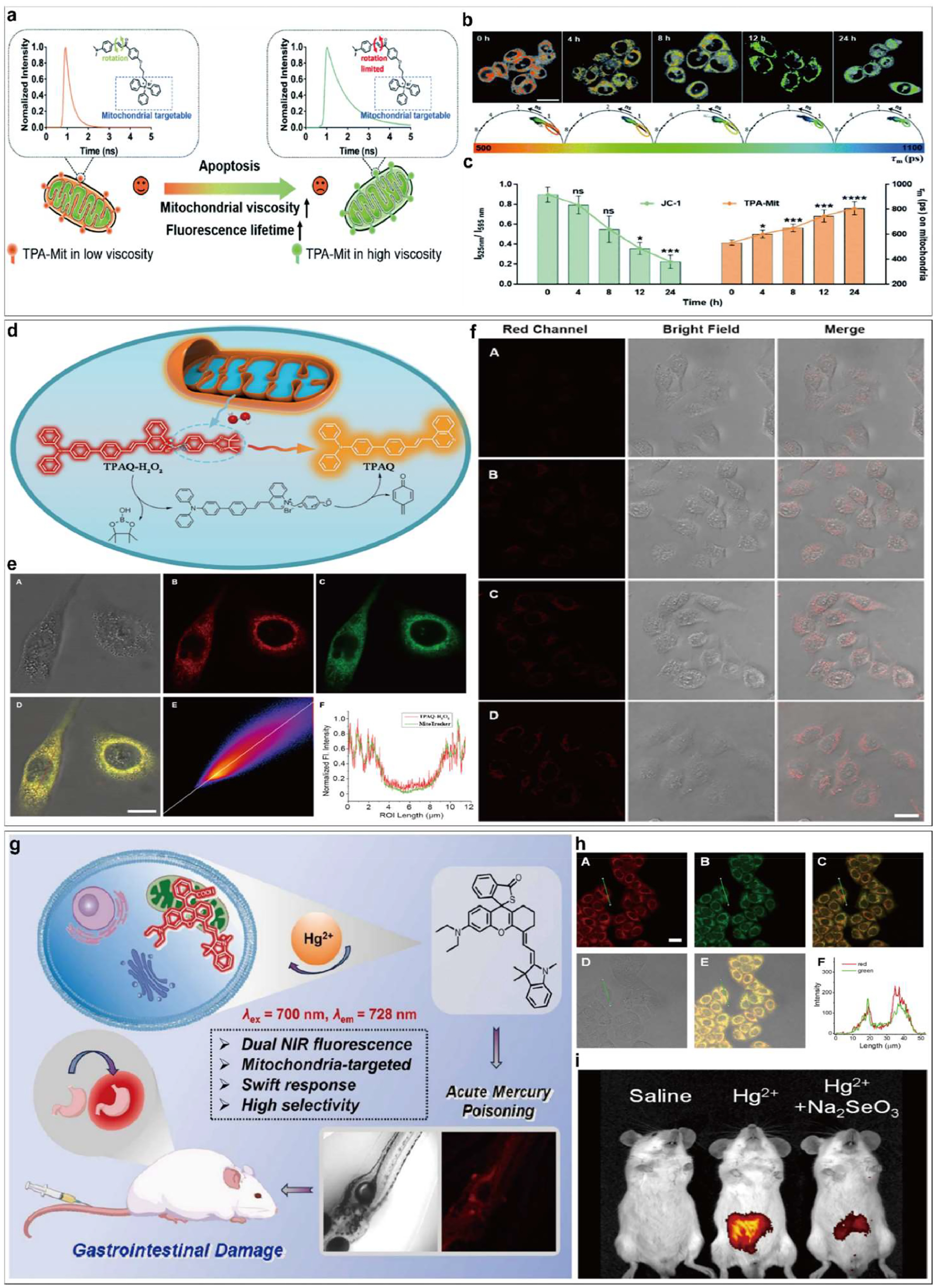
图8. (a) 利用 TPA-Mit 在细胞凋亡过程中探测粘度的方案。(b) 不同时间间隔对应的分离线粒体区域的相位图和 FLIM 图像。缩放条: 10 μm。(c) JC-1 线粒体膜电位探针的荧光强度 I525 nm/I595 nm(左柱图)与相位图-FLIM 测量的线粒体平均荧光寿命(右柱图)之比。经参考文献许可转载。版权 2021 年,RSC 出版社。(d) TPAQ-H2O2 检测 H2O2 的传感机制。 (e) TPAQ-H2O2 与 50 μM H2O2 和 Mito-Tracker Deep Red FM 在 HeLa 细胞中的共定位荧光成像。尺度条,20 μm (f) 不同浓度 H2O2(0、20、40、60 μM)作用 30 分钟,TPAQ-H2O2 (5 μM)在 HeLa 细胞中的成像。刻度线,20 μm。经参考文献许可转载。Copyright 2022 Elsevier Ltd. All Rights Reserved. (g)用于汞荧光检测的活化探针 JZ-1 方案。(h)Heg2+预处理 30 分钟后,用 10 μM JZ-1 和 200 nM 罗丹明 123 处理 30 分钟的 HeLa 细胞的共聚焦成像。刻度线,20 微米。(i) AMP 模型小鼠的_体内_近红外成像。小鼠连续 3 天分别灌胃 (I) 生理盐水(0.2 mL)、(II) Hg2+ 溶液(0.2 mL,18 mg/kg)、(III) Hg2+ 溶液(0.3 mL,18 mg/kg)+ Na2SeO3 溶液(0.3 mL,0.5 mg/kg),静脉注射 100 μL JZ-1(100 μM)溶液,然后在相同时间点成像。转载自参考文献 Copyright 2024 Elsevier Ltd.
4.7. 线粒体粘度监测
细胞内粘度是影响物质质量和信号传输以及生物大分子间相互作用的关键因素。实际上,它已被证实是动脉粥样硬化、糖尿病、阿尔茨海默病乃至恶性肿瘤等多种疾病的一个重要因素或指标,因为它能够影响细胞膜内蛋白质间的相互作用。此外,线粒体基质的粘度与线粒体的呼吸状态密切相关,并受机械或渗透压变化所引起的线粒体网络组织变化的影响,这些变化具有分子层面的后果。这表明线粒体基质粘度的变化可能会调节代谢物的扩散,进而调节线粒体的新陈代谢。
Hao等人设计并合成了一系列以二膦配体为桥接配体的环金属化 Ir(III) 配合物。其中,Ir(ppy-CHO)2L3(Ir6)表现出高度依赖于粘度的荧光反应。实验结果显示,Ir6 可以选择性地定位于线粒体,并通过诱导 Caspase 介导的细胞凋亡来发挥抗癌活性。Ir6 能够损害线粒体的能量代谢,并在线粒体中产生过量的活性氧。同时,Ir6 可通过双光子荧光寿命成像技术实时定量监测受损线粒体粘度的变化。
4.8. 线粒体 H2O2 水平监测
过氧化氢(H2O2)作为活性氧的一种,在有氧呼吸过程中由线粒体电子传递链内源性产生,并参与多种生理过程。然而,能够特异性检测活细胞中线粒体H2O2的荧光探针的设计与合成相对较少。Xu等人设计并合成了一种名为Mito-H2O2 的线粒体靶向荧光探针,用于检测活细胞内的过氧化氢。该探针包含一个咔唑基团作为荧光部分,一个对频哪醇苄基作为H2O2的反应位点,以及一个季铵盐化的喹啉单元作为线粒体靶向载体。Mito-H2O2 显示出对H2O2的高度选择性,而非其他活性氧。与H2O2的反应引发氧化还原过程,导致荧光显著增强,呈现出“开启”式的荧光响应。实验结果证实,Mito-H2O2 能够有效进入HeLa细胞的线粒体,并能监测及成像线粒体内源性H2O2的生成。
另一方面,Wang等人设计并合成了一种名为TPAQ-H2O2 的线粒体靶向三苯胺基荧光化学传感器,用于快速检测活细胞中的H2O2。TPAQ-H2O2 对于H2O2具有较高的选择性和灵敏度,与其他活性氧/氮物种相比。其反应机制涉及H2O2触发的喹啉盐基裂解,导致239nm波长处强烈的斯托克斯偏移。TPAQ-H2O2 能在3分钟内迅速响应,检测限低至2.5 μmol。细胞成像实验显示,TPAQ-H2O2 能够有效地跟踪活细胞线粒体中外源性和内源性H2O2的生成。综上所述,这些合理设计的荧光探针能够快速、选择性地检测H2O2,并具备生物成像能力,为H2O2相关的活细胞生物学研究提供了有效的工具。
4.9. 线粒体 ATP 水平波动跟踪
三磷酸腺苷(ATP)是由腺嘌呤、核糖和三个磷酸基团组成的分子。在水解过程中,它释放大量的能量,为细胞的新陈代谢和各种活动提供直接的能量来源。线粒体是细胞中合成ATP的主要场所。Deng等人报告了一种基于ZIF-90的nm探针,用于活细胞中线粒体ATP的荧光成像。该探针的设计原理是利用ATP能够竞争性地螯合ZIF-90中的金属中心这一特性。通过将荧光染料罗丹明B封装在ZIF-90的纳米结构中,制备了荧光探针RhB/ZIF-90。该探针能高效地进入细胞并在线粒体中释放荧光物质,实现对线粒体ATP的高度选择性检测。实验结果显示,RhB/ZIF-90nm探针可用于监测细胞过程中线粒体ATP水平的变化,为研究细胞代谢机制提供了一种强有力的手段。
4.10. 线粒体次氯酸检测
次氯酸(HOCl)是人体内产生的一种重要的活性氧物质(ROS)。它在免疫系统中发挥作用,并参与调节细胞的氧化还原平衡。然而,过高的HOCl水平会导致组织损伤并引发多种疾病。实时检测HOCl对于了解健康状况及其在生理和病理过程中的作用具有重要意义。Zheng等人设计并合成了一种线粒体靶向的近红外荧光探针CVS,用于活体系统中HOCl的成像。该探针具有快速反应、高选择性和高灵敏度的特点,是检测HOCl的有效工具。其工作机制是CVS中的硫醚分子与HOCl发生反应,被氧化成亚砜,从而中断了荧光团的PET(光诱导电子转移)过程,导致荧光显著增加。该探针能够实时监测细胞中HOCl的动态变化,为研究HOCl的生理和病理功能提供了可能性。
4.11. 线粒体外源汞监测
Zhou 等人开发了一种具有双近红外激发发射的荧光探针 JZ-1,用于检测和成像急性汞中毒中的汞离子(Hg²⁺)和胃肠道损伤(图 8g)。探针 JZ-1 是根据罗丹明荧光团和硫内酯的结构设计合成的,能够快速(30 分钟内)、高选择性地响应 Hg²⁺,从而产生近红外荧光增强(激发波长 700 nm,发射波长 728 nm)。JZ-1 具有良好的生物相容性,无细胞毒性,并且可以特异性靶向线粒体,为线粒体中 Hg²⁺ 的成像提供了便利。细胞水平实验表明,JZ-1 能够有效进入 HeLa 细胞和斑马鱼体内,荧光信号强度与 Hg²⁺ 浓度呈现良好的线性关系。使用商业探针的共聚焦成像结果进一步证实了 JZ-1 能够有效靶向线粒体(图 8h)。更重要的是,作者利用 JZ-1 建立了急性汞中毒(AMP)小鼠模型,并通过近红外全身成像发现 Hg²⁺ 主要集中在小鼠的胃和小肠区域,这与随后的器官成像和组织病理学结果(Hg²⁺ 导致胃肠道充血和炎症细胞浸润)高度一致(图 8i)。在加入 Hg²⁺ 抑制剂 Na₂SeO₃ 后,相关荧光信号明显减弱。
5. 以线粒体为靶点的疾病治疗
线粒体靶向纳米材料的应用已经超越了癌症治疗、成像和探针开发的范畴,标志着在多种系统性疾病的治疗领域取得了重要进展(方案 1)。这些疾病不仅限于阿尔茨海默病、心肌损伤和糖尿病,它们与线粒体平衡有着内在联系,因此线粒体靶向疗法在治疗这些疾病方面的潜力尤为突出。在本章中,我们将根据不同的人体系统疾病进行分类,概述线粒体靶向材料的应用。这种方法凸显了专为线粒体干预而设计的纳米材料的广泛适用性和尚未开发的潜力,强调了它们在不同治疗领域的重要意义。
方案 1. 用纳米材料处理人体的**示意图。**病体(左)经针对线粒体的纳米材料处理后变成健康的(右)人体
5.1. 泌尿系统
急性肾损伤(AKI)的特点是肾功能的突然急剧下降。AKI 是急性肾脏疾病(AKD)的一种表现形式,其中肾功能逐渐恶化或持续受损与肾细胞和肾小球的不可逆损伤有关。AKI 的特征之一是肾小管,特别是近端肾小管的严重损伤,这是由于肾小管区域的活性氧(ROS)大量爆发所致。通过使用纳米粒子来消耗 ROS 可以有效预防 AKI。线粒体是 ROS 的主要来源,因为在 AKI 期间,线粒体电子传递链容易受到各种因素的破坏。过量的 ROS 会破坏生物膜,降低膜的流动性,增加膜的通透性,导致细胞膜破裂、线粒体肿胀和溶解等功能障碍。过量的 ROS 还会诱导有丝分裂,但会抑制溶酶体降解,影响对功能障碍线粒体的清除,最终导致肾功能迅速下降。
Table 3. Table of Nanomaterials target mitochondria for treat diseases of various systems
| Materials/Names | Application | Effect | Targeting strategy |
|---|---|---|---|
| TWNDs | AKI treatment | To treat AKI by reducing mitochondrial ROS and increasing mitophagy in renal tubular cells | Intrinsic targeting capacity |
| Nanopolyplexes(SS-31, anionic HA and cationic chitosan(CS)) | AKI treatment | CD44 and PH responsive nanocarriers for the delivery of SS-31, a drug with mitochondrial targeting capabilities, | SS-31 |
| PISP | AKI treatment | Early detection and dynamic tracking of AKI, targeting mitochondria to remove excessive reactive oxygen species in mitochondria, and reducing oxidative stress damage of AKI. | SS-31 |
| CT-NM/Res | Alzheimer's disease | Alleviate oxidative stress in neuronal cells, stabilize mitochondrial dynamics, and reverse neuronal mitochondrial dysfunction to delay the progression of AD | TPP |
| TPP-MoS2 QDs | Alzheimer's disease | With SOD-and CAT-like activities and effective mitochondria-targeting QDS, direct protection of neurons is achieved by scavenging ROS | TPP |
| Nanomotor-based H2S donor | Parkinson's disease | Targeting nerve cell mitochondria to deliver H2S to repair damaged neurons and treat Parkinson's disease | L-cysteine |
| TPP@(CeO2+ROF) | Ischemic Stroke | Targeting mitochondria of brain-damaged neurons for ischemic stroke | TPP |
| TPP-rHuHF-LYC | Memory decline | The ability to cross the blood-brain barrier and target neuronal mitochondria was used to alleviate memory decline in aging mice. | TPP |
| Nano-Mito-PBN | Type2 diabetes | By influencing the mechanism of liver glucose metabolism, nanoparticles target liver mitochondrial antioxidant to treat diabetes | TPP |
| Nf-ABT-199 | Asthma Therapy | Targeting airway mitochondria to inhibit bcl-2 to increase inflammatory cell apoptosis to alleviate asthma | Positive Charges |
| DS/TPP-MMSP | Osteoarthritis | Mitochondrial metabolism of M1 macrophages was reprogrammed by clearing mitochondrial reactive oxygen species and inhibiting mitochondrial NO synthase | TPP |
| LM@Co-Q10 | IVDD | Enhance the vitality of BMSCs, restore mitochondrial structure and function, promote the production of ECM components, and alleviate IVDD | Co-Q10 |
| PGA-Mn-TP04 | IVDD | Effectively target and rejuvenate mitochondria in nucleus pulposus cells, reducing mitochondrial ROS damage, enhancing mitochondrial function, and preserving disc structure in IVDD | TP04 |
| PG@Cu-FP | IVDD | PG@Cu-FP nanoparticles target and mitigate intervertebral disc degeneration by scavenging reactive oxygen species, inhibiting inflammatory pyroptosis, and preserving disc structure and function. | Cu2+/Pentapeptide |
| CD-PB-TPP | IVDD | Targeting mitochondria to exert antioxidant activity is used to alleviate intervertebral disc degeneration. | TPP |
| Mito-Fenozyme | IRI | Nanozymes with SOD-like and CAT-like activities, scavenging mitochondrial ROS and protecting mitochondria from ROS damage, enhanced cardiac functional recovery in an IRI model | TPP |
| PTPTSC | IRI | It can reduce the level of mtROS and cell ROS, improve mitochondrial function and inhibit cardiomyocyte apoptosis | SS-31 |
Huang 等人报道了一种利用磷钨酸和单宁酸合成的超小型钨基nm点,用于治疗急性肾损伤。这种nm点带有负电荷,能够清除活性氧。它们可以通过肾小球过滤进入肾小管,并被动地靶向肾小管细胞中丰富的线粒体。研究证实,nm点可以清除线粒体中的活性氧,保护线粒体功能,增加有丝分裂,从而减轻氧化应激和肾小管上皮细胞的凋亡。此外,钨基nm点还能减少巨噬细胞浸润和炎症细胞因子的产生,从而显著恢复肾功能。
SS-31 是一种特异性靶向线粒体的多肽,具有很强的抗氧化活性,因此是治疗急性肾损伤的理想候选药物。然而,由于 SS-31 在体内的特异性分布不理想且给药效率低,需要频繁给药才能有效治疗急性肾损伤。为了解决这些问题,Liu 等人设计了一种用于治疗急性肾损伤的肾保护肽 SS-31 nm复合物给药系统。该系统由电荷反转的透明质酸和壳聚糖通过静电相互作用组装而成,具有 CD44 靶向和 pH 响应释放的双重功能。体外和体内研究结果表明,与游离 SS-31 相比,该nm系统增强了肾脏靶向性和肾小管上皮细胞的摄取能力,并在酸性溶酶体中释放 SS-31,从而发挥线粒体靶向抗氧化作用。
Yao 等人开发了一种nm药物系统 PISP,用于急性肾损伤(AKI)的无创诊断和治疗。PISP 由涂有血小板膜的纳米颗粒组成,这些颗粒靶向肾脏损伤部位,并含有吲哚菁绿(ICG)和抗氧化剂 SS31(图 9a)。在诊断 AKI 方面,PISP 利用近红外吲哚菁绿的特性,实现对肾脏病变的无创成像和监测。研究表明,PISP 在 AKI 小鼠模型的肾脏中高度富集,吲哚菁绿信号的强度与 AKI 的严重程度呈正相关,从而实现了对 AKI 的早期检测和动态跟踪。在治疗方面,PISP 中的 SS31 具有靶向线粒体抗氧化活性,可清除线粒体中过多的活性氧,减轻 AKI 的氧化应激损伤。研究结果表明,PISP 能显著改善 AKI 小鼠的肾功能,减少肾小管坏死、炎症和细胞凋亡,促进肾脏修复。PISP nm药物系统集无创影像诊断和靶向抗氧化治疗于一体,在 AKI 的早期检测和精准治疗方面具有重要的临床转化前景。这项工作为 AKI 的个体化诊断和治疗提供了一种新的nm医学策略。
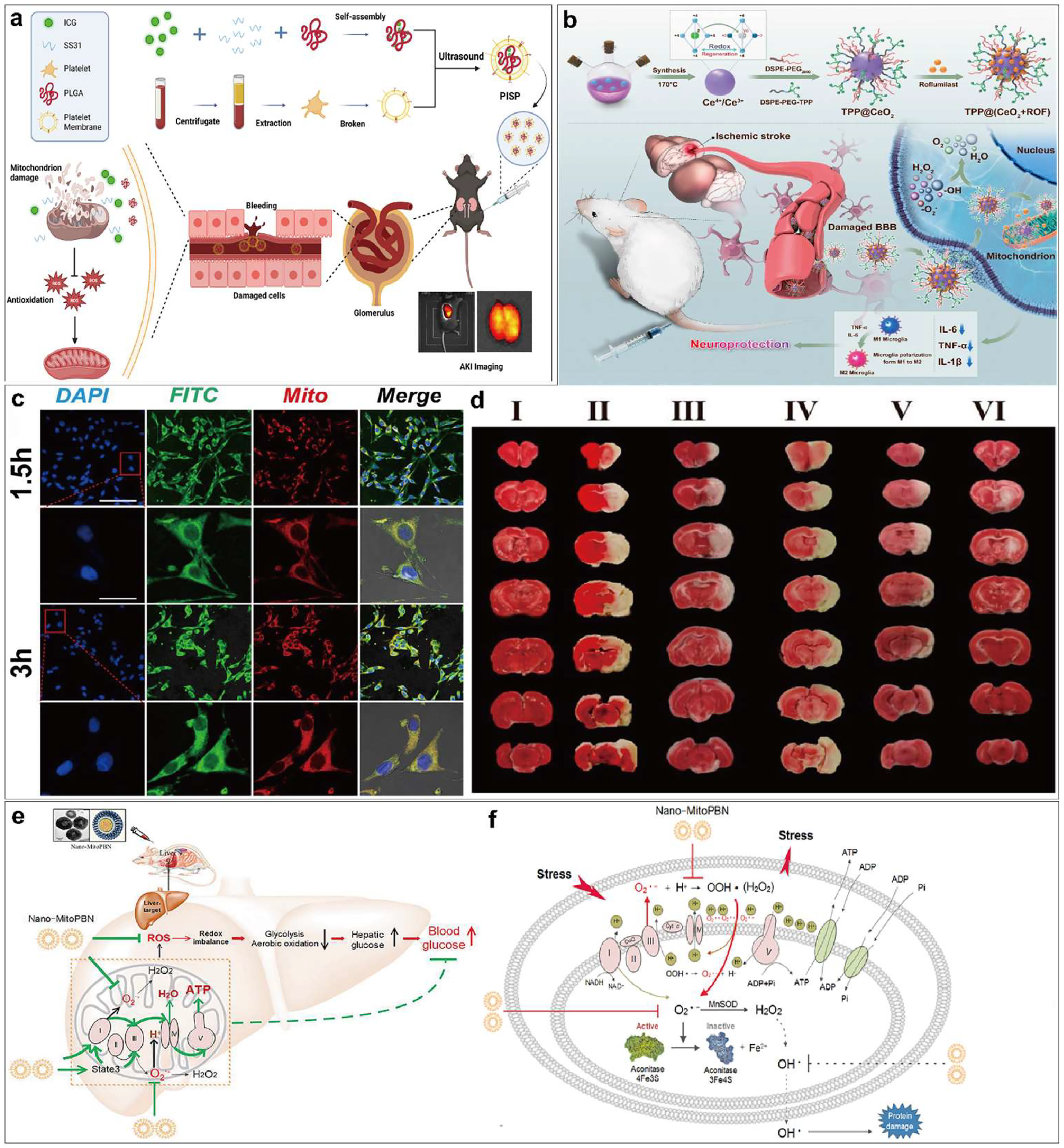
图 9:(a)小鼠近红外诊断/治疗的分步靶向策略示意图。经参考文献许可转载。Copyright 2023 Elsevier Ltd. (b) 以线粒体为靶点的nm酶作为缺血性中风治疗方法的示意图。静脉注射 TPP@(CeO2+ROF)靶向线粒体,使药物优先输送到脑缺血病灶,减轻氧化应激,调节小胶质细胞表型,从而发挥对缺血性中风的保护作用。(c) PC12 细胞在 1.5 小时和 3 小时后对 FITC 标记的 TPP@(CeO2+ROF)(绿色,5 μg mL-1)的细胞摄取,显示与线粒体(红色)和细胞核(蓝色)共定位。插图显示了红框内区域的放大图。标尺=100/20 μm。(d)卒中后 24 小时,假手术大鼠和各治疗组缺血 2 小时的 MCAO 大鼠的典型 TTC 染色脑切片,显示治疗组缺血面积显著缩小。经参考文献许可转载。Copyright 2024 American Chemical Society. (e) 以肝脏线粒体为靶点的 Nano-MitoPBN 治疗糖尿病示意图。(f) Nano-MitoPBN 对抗 ROS 和保护线粒体的机制示意图。经参考文献许可转载。2019 爱思唯尔有限公司版权所有。
5.2. 神经系统
阿尔茨海默病(AD)是一种与年龄相关的复杂神经退行性疾病,其特点为认知功能逐渐下降,最终导致死亡。越来越多的证据表明,线粒体功能障碍是阿尔茨海默病发病过程中的早期事件。线粒体损伤和氧化应激导致了β-淀粉样蛋白(Aβ)级联的激活,而β-淀粉样蛋白级联是AD的标志性病理特征。杨等人开发了一种靶向神经细胞线粒体的壳聚糖nm胶囊,用于治疗阿尔茨海默病。该nm囊由聚乙二醇-聚乳酸(PEG-PLA)组成,表面装饰有神经细胞粘附分子(NCAM)模拟肽 C3 和 TPP。NCAM 在神经元表面高表达,用于脑神经元靶向。TPP 可使nm胶囊进入线粒体。研究表明,靶向nm胶囊显著增强了白藜芦醇在大脑和线粒体中的定位,从而有效清除线粒体中的 ROS,减轻氧化应激,稳定线粒体动态。在 APP/PS1 转基因小鼠中,靶向nm胶囊上调了 SIRT1 的表达,抑制了蛋白沉积,缓解了神经纤维变性,促进了突触传递,改善了学习和记忆。这项研究提供了一种创新的阿尔茨海默病治疗策略,通过靶向递送抗氧化剂恢复神经元线粒体功能。
实现药物跨血脑屏障(BBB)递送一直是一项重大挑战。然而,纳米颗粒已经成为一种很有前景的方法,它有可能克服这一屏障,将药物有效地输送到大脑中。任等人设计并合成了线粒体靶向的 MoS2 量子点nm酶,它可以穿过血脑屏障进入大脑。通过 DSPE-PEG-TPP 对 MoS2 量子点进行表面修饰,使其具有很强的亲油性,能与血脑屏障的细胞膜相互作用并穿过血脑屏障。MoS2 量子点还具有模拟超氧化物歧化酶和过氧化氢酶的双重酶活性,能快速清除活性氧。研究发现,MoS2 量子点能有效激活小胶质细胞,诱导其从促炎 M1 表型向抗炎 M2 表型转变。M2 小胶质细胞可以吞噬淀粉样蛋白-β聚集体,抑制神经炎症,保护神经元。因此,MoS2 量子点nm酶通过调节小胶质细胞的 M1/M2 极化,对阿尔茨海默病大鼠模型具有显著的治疗效果。
Zhao 等人开发了一种用于治疗帕金森病(PD)的nm机器人 H₂S 供体。该nm机器人通过自由基聚合制备而成,主要由聚乙二醇(PEG)、L-半胱氨酸衍生物和 2-甲基丙烯酰氧乙基膦酰胆碱(MPC)组成。nm机器人 H₂S 供体结构中的 MPC 可与脑血管内皮细胞表面的乙酰胆碱受体或胆碱转运体相互作用,使其具有穿越血脑屏障并在脑内富集的能力。在神经元细胞中,由于半胱氨酸与线粒体特异性酶 3-MST 的相互作用,nm机器人可以产生运动效应,从而实现对线粒体的精确靶向。在线粒体区域,nm机器人可在 CBS 和 3-MST 的选择性催化下产生 H₂S 气体,有效清除 ROS,降解 α-突触核蛋白聚集,减轻神经炎症,从而修复受损神经元。在 MPTP 诱导的帕金森病小鼠模型中,nm机器人 H₂S 供体能显著改善小鼠的自发运动、运动协调和记忆功能,促进受损神经元的修复,证实了其良好的治疗效果。
Xia 等人开发了一种双靶向溶酶体纳米粒子(TPP-rHuHF-LYC NPs),具有穿越血脑屏障和靶向神经元线粒体的能力,可缓解衰老小鼠的记忆衰退。该纳米粒子由两部分组成:一是通过使用含有溶酶体激素的重组人血红蛋白 H 链(rHuHF)nm包,使其具有穿越血脑屏障的能力;二是在 rHuHF 表面偶联 TPP 基团,使纳米粒子能够靶向线粒体。体外和体内实验表明,TPP-rHuHF-LYC NPs 能有效抵抗衰老小鼠记忆力衰退的各种症状:1)通过靶向神经元线粒体,改善线粒体功能障碍,维持正常的能量代谢和形态结构;2)保护神经元兴奋性,激活 PKA/CREB/BDNF 长期增强通路,增强突触可塑性;3)缓解小鼠海马神经元功能障碍和神经胶质细胞炎症反应。综上所述,TPP-rHuHF-LYC NPs 作为一种天然抗氧化nm药物,通过双靶向策略实现了跨血脑屏障递送和神经元线粒体靶向,从而保护神经元线粒体,激活突触功能,最终缓解衰老小鼠的记忆衰退。
为了治疗缺血性中风,廖等人开发了一种基于nm酶的药物输送系统 TPP@(CeO₂+ROF),以减轻缺血性中风后的再灌注损伤(图 9b)。该纳米平台由三苯基膦修饰的氧化铈纳米颗粒(CeNZs)组成,内含第四代磷酸二酯酶 4 抑制剂罗氟司特。TPP@(CeO₂+ROF) 不仅具有更强的生物相容性和线粒体靶向能力(图 9c),还能清除过量的活性氧(ROS),恢复线粒体功能,抑制炎症反应,并通过协同效应发挥抗氧化活性。体外和体内实验表明,TPP@(CeO₂+ROF) 能有效缓解线粒体损伤、氧化应激和细胞凋亡,从而减少小脑梗死体积和血脑屏障损伤(图 9d),并显示出良好的生物安全性。转录组分析进一步阐明了 TPP@(CeO₂+ROF) 的神经保护机制。
5.3. 内分泌系统
2 型糖尿病是一个重大的全球公共卫生问题,其在儿童和青少年中的发病率正在上升。2 型糖尿病具有慢性且使人衰弱的特点,需要有效且持久的药物治疗。然而,目前有效降低高血糖的治疗方案有限,这凸显了开发治疗方法的迫切需求。2 型糖尿病患者会出现高血糖,而目前的药物治疗效果并不理想。氧化应激被认为是导致 2 型糖尿病发病的主要因素之一。虽然抗氧化疗法在动物模型研究中显示出良好的前景,但在人体研究中的效果有限。这主要是由于传统抗氧化剂的生物利用度较低,影响了其治疗效果。
Wu 等人的研究表明,基于α-苯基-N-叔丁基硝酮设计的线性硝酮共轭物 Nano-MitoPBN 可特异性地靶向肝脏线粒体,清除呼吸链复合物 I 和 III 电子泄漏产生的超氧化物和过氧化氢(图 9e)。nm线粒体氮化硼能明显降低糖尿病小鼠肝脏线粒体的 ROS 水平,改善线粒体结构,减少有丝分裂,提高线粒体氧化磷酸化和 ATP 合成。这种线粒体靶向抗氧化机制不同于其他抗氧化剂,它可以提高线粒体氧化磷酸化的偶联效率,刺激肝细胞线粒体氧化磷酸化,从而加速葡萄糖分解,促进葡萄糖利用,降低外周血糖水平,改善糖耐量(图 9f)。
5.4. 呼吸系统
哮喘是一种影响全球数百万人的严重疾病,其患病人数仍在不断增加。全球确诊的成人哮喘发病率为 4.3%,这一比例还在不断上升。大多数哮喘患者对吸入皮质类固醇反应良好,通常与长效或短效支气管扩张剂(LABA 或 SABA)以及白三烯受体拮抗剂联合使用,作为控制哮喘的一线策略。然而,即使使用了最大剂量的口服皮质类固醇,一些哮喘患者的哮喘控制仍然不佳。值得注意的是,这部分患者占哮喘相关医疗费用的 60% 以上。除了吸入皮质类固醇外,针对特定细胞因子/凝血因子的人源化单克隆抗体和拮抗剂也被用于治疗中度至重度难治性哮喘。然而,由于哮喘的异质性,这些策略的成功率有限。
Tian 等人利用 Bcl-2 抑制剂 ABT-199 通过诱导炎症细胞凋亡来缓解哮喘的气道炎症。他们设计了一种对 pH 值敏感的纳米颗粒——nm制剂 ABT-199(Nf-ABT-199),可将 ABT-199 特异性地输送到支气管炎症细胞的线粒体。他们发现,与游离 ABT-199 相比,Nf-ABT-199 能更有效地缓解哮喘小鼠模型的气道炎症,包括诱导嗜酸性粒细胞凋亡、抑制炎症细胞浸润和粘液分泌过多。其机理是 Nf-ABT-199 在炎症细胞的线粒体中积聚,并作用于过度表达的 Bcl-2 蛋白,从而诱导炎症细胞凋亡,继而减少活化的炎症细胞浸润。这项研究为nm技术和 Bcl-2 抑制疗法联合治疗气道疾病提供了可行性证据。
5.5. 运动系统
骨关节炎是一种进行性退行性关节疾病,其进展与滑膜中 M1/M2 型巨噬细胞的失衡密切相关。将促炎的 M1 型巨噬细胞重编程为抗炎的 M2 型巨噬细胞正成为缓解骨关节炎进展的一种策略,但转换效率并不理想。研究表明,M1 滑膜巨噬细胞存在线粒体功能障碍,这可能是导致 M1/M2 失衡的原因。
张等人开发了一种具有双重靶向能力的纳米载体,可以改善骨关节炎患者滑膜 M1 巨噬细胞的线粒体功能障碍(图 10a)。该纳米载体表面经过硫酸葡聚糖和三苯基膦修饰,可特异性识别补体受体和 M1 巨噬细胞上的线粒体(图 10b),实现滑膜组织靶向。载体可同时携带二氧化锰纳米粒子和一氧化氮合酶抑制剂,进入 M1 巨噬细胞线粒体,清除过量的活性氧,抑制一氧化氮合酶的异常表达,从而缓解线粒体功能障碍,降低氧化应激水平,促进 M1 向 M2 巨噬细胞的转化。动物实验表明,nm药物能有效缓解滑膜炎症和骨关节炎症状(图 10c)。这一策略为线粒体重编程提供了一种早期治疗骨关节炎的有效方法。
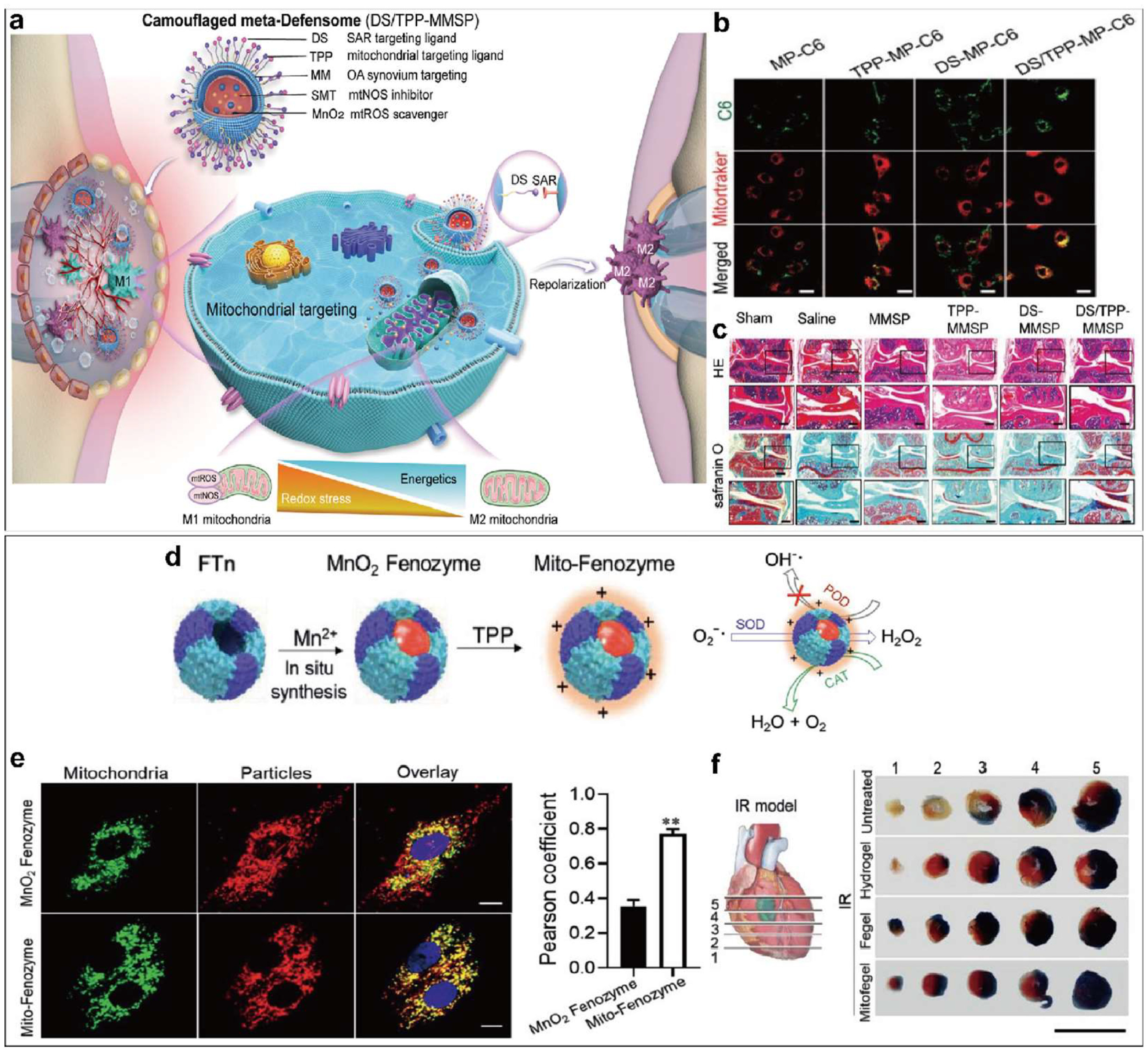
图 10 (a) M1 滑膜巨噬细胞线粒体代谢定向重编程示意图。(b) 共聚焦激光扫描显微镜图像,显示分化的 M1 巨噬细胞中 C6 标记的多级制剂(绿色)与线粒体(红色)共定位。标尺:20 μm。(c)H&E 和黄芩苷 O 染色显示组织学变化。比例尺: 50 μm。经参考文献许可转载。版权 2022 年,Wiley-VCH。 d)米托-费诺酶制备示意图。在 H2O2 的存在下,通过 Mn2+ 氧化在 FTn 核心内_原位_合成 MnO2,然后 TPP-NHS 酯与蛋白质的游离 NH2 基团共轭,从而制备出 Moto-Fenozyme。生成的 MnO2 Fenozyme 可模仿不同酶的级联反应,将 O2- 转化为无毒的 H2O 和 O2。(e)颗粒与线粒体共定位的典型共焦图像(中)和量化分析(右)。缩放条 = 10 μm。**P < 0.01. (f) 红外手术 24 小时后用于粗略评估梗死大小的心脏切片。(左)示意图显示从心尖到结扎水平切取的五个切片。(右图)一个心脏的五个切片的代表性图像,该心脏接受了红外治疗或未接受不同治疗(每组 n = 4),随后进行了伊文思蓝和 TTC 双染。心脏切片呈现的不同区域由颜色决定: 蓝色:非缺血区域;红色:危险区域;白色:梗塞大小。比例尺 = 1 厘米。经参考文献许可转载。版权 2022 年,Wiley-VCH。
椎间盘变性(IVDD)是导致下背部疼痛的主要原因,可产生大量医疗费用。椎间盘(IVD)的基本组成部分包括髓核(NP)、纤维环和终板。其中,髓核是一种胶状、纤维增强、各向同性且富含水分的核心,构成了 IVD 的主要结构,有助于抗压,并为旋转运动提供中轴。遗传、衰老、创伤或其他外部刺激等各种病理因素都会导致 IVDD。此外,IVDD 的特征还包括结构和组织学变化,以及细胞外基质(ECM)和炎症标志物表达的改变。
孙等人设计并合成了磷脂包被的辅酶 Q10 胶束,以实现疏水性辅酶 Q10 在水溶液中的稳定分散。该系统能对过氧化氢做出反应,释放辅酶 Q10,在椎间盘退变的微环境中发挥抗氧化作用。实验表明,CoQ10 胶束能有效进入椎间盘干细胞并定位到线粒体,抑制过氧化氢引起的线粒体损伤、膜电位降低和氧化应激。此外,CoQ10 胶束还能调节 NF-κB 通路的活性,抑制椎间盘细胞中炎性因子的释放,减少氧化应激诱导的细胞凋亡。在大鼠椎间盘退变模型中,辅酶 Q10 胶束与干细胞的结合治疗效果最佳,能显著抑制椎间盘高度的降低、组织破坏和细胞凋亡。
在处理髓核细胞中的 ROS 领域,Chen 等人开发了一种多功能金属酚纳米粒子(PGA-Mn-TP04)。他们利用没食子酸(GA)与锰离子结合,并通过希夫碱反应引入线粒体靶向肽(TP04),通过自组装合成了这种纳米粒子。因此,它们的线粒体靶向能力得到了增强。PGA-Mn-TP04 纳米粒子不仅具有 pH 缓冲能力,避免了溶酶体结合,还能通过静电相互作用选择性地在线粒体中聚集。研究表明,纳米颗粒能有效减少线粒体活性氧(mROS)的产生,从而缓解线粒体活性氧引起的线粒体功能障碍。
Zhou 等人开发了一种多功能金属多酚纳米粒子(PG@Cu-FP),具有显著的线粒体靶向性和高生物相容性。PG@Cu-FP 具有抗氧化、抗凋亡和抗炎特性,因此特别适用于椎间盘细胞的多功能应用。在细胞水平上,PG@Cu-FP 能有效靶向线粒体,修复氧化应激引起的线粒体损伤,并通过清除线粒体中的 ROS 来维持髓核细胞的正常形态。同样,Shi 等人开发了一种具有线粒体靶向抗氧化活性的碳点支撑普鲁士蓝nm酶(CD-PB-TPP),以缓解椎间盘退变。作者用 TPP 修饰了 CD-PB,使其具有靶向线粒体的能力。研究发现,CD-PB-TPP 能有效逃逸溶酶体,准确定位到线粒体,并通过超氧化物歧化酶、过氧化氢酶和其他类似酶的活性在清除过量 ROS 方面发挥作用。这些靶向线粒体的纳米粒子具有良好的治疗效果和较高的临床应用价值。
5.6. 循环系统
缺血再灌注损伤(Ischemia-reperfusion injury,I/R 损伤)是指血流中断造成的缺血和血流恢复后的再灌注引起的组织损伤。它包括缺血本身造成的损伤以及再灌注过程中激活的一系列病理机制造成的损伤。I/R 损伤的机制复杂多样,主要包括钙超载、氧化/亚硝基应激、线粒体功能障碍、细胞凋亡和自噬激活、蛋白激酶激活、表观遗传学改变、炎症反应等。不同器官对 I/R 的敏感性不同,大脑最为敏感,其次是心脏和肾脏。肝脏和肠道等其他器官也会受到 I/R 损伤。氧化应激反应和再灌注过程中产生的大量活性氧(ROS)是 I/R 损伤的重要机制。ROS 可氧化和损伤细胞中的各种生物大分子。线粒体功能障碍,如线粒体通透性转换孔的打开,是 I/R 损伤的关键事件。它导致线粒体膜电位耗散、ATP 合成失败,并进一步加剧 ROS 的产生。
张等人设计了一种人工级联nm酶,由蛋白nm壳和锰基纳米粒子核心组成(图 10d)。这种nm酶可以靶向心肌细胞线粒体(图 10e),模拟超氧化物歧化酶和过氧化氢酶的级联反应,将线粒体中过多的超氧阴离子转化为无毒的 H₂O 和 O₂,避免产生剧毒的羟自由基,从而清除氧化自由基,保护线粒体。研究人员通过不同的给药途径将这种nm酶应用于小鼠心肌缺血再灌注模型。静脉注射增加了nm酶在缺血区域的积累,改善了心脏功能。与组织粘合剂水凝胶结合制成贴片植入心外膜表面,可以使nm酶持续释放到心肌组织中,显著缩小梗死面积,促进功能恢复(图 10f)。这项研究为开发治疗心肌缺血再灌注损伤的靶向nm药物提供了一种策略。
环孢素 A(CsA)是一种有效的免疫抑制剂,已获得美国食品药品管理局(FDA)批准。由于环孢素 A 具有阻止免疫反应的活性,它既是器官移植的免疫抑制剂,也是治疗干眼症的药物。Zhang 等人设计了一种治疗心肌缺血再灌注损伤的多功能nm系统。该系统通过芳香族硫脲键和 PEG 的自组装获得 pH/ROS 双响应性;SS31 肽具有线粒体靶向能力;水凝胶网络中的苯硼酸基团可清除活性氧。研究人员将环孢素 A nm胶囊装入这种双重响应水凝胶,并直接注入缺血心肌。在缺血心肌的低 pH 值和高 ROS 微环境下,nm胶囊从水凝胶中释放出来,积聚在线粒体中,通过抑制线粒体通透性转换孔的开放发挥保护作用;同时,水凝胶支架消除了心肌局部的氧自由基。该系统实现了对心肌缺血再灌注损伤的多靶点治疗。
6. 挑战与前景
癌症治疗
所有肿瘤靶向治疗纳米材料都是通过诱导癌细胞产生细胞毒性来发挥作用的,因此肿瘤靶向治疗至关重要。减少非肿瘤组织对这些纳米材料的吸收仍是一项重大挑战。尽管肿瘤中较低的线粒体膜电位在一定程度上区别于非肿瘤组织,但纳米材料在输送过程中的泄漏问题不容忽视。这种泄漏对临床转化构成了巨大障碍。因此,尽量减少纳米材料的非特异性分布是一个需要关注的关键领域。虽然刺激响应释放机制已被广泛用于缓解这一问题,但非特异性释放仍然存在。因此,开发能够完全区分肿瘤和正常组织的高选择性纳米粒子仍是未来研究的一大挑战。
线粒体在细胞功能中发挥着关键作用,而高尔基体和溶酶体等其他细胞器也是自噬和细胞凋亡等过程不可或缺的组成部分。因此,探索具有靶向多种细胞器能力的纳米材料是未来研究的一条大有可为的途径。
尽管各种线粒体靶向纳米材料具有良好的治疗效果,但其复杂的成分和结构往往带来巨大的挑战。肽等成分容易降解,很难合成和保存。这种复杂性阻碍了临床转化。因此,开发结构更简单且能保持高疗效的纳米材料是未来研究的另一个关键领域。
探针
近年来,以线粒体为靶点的纳米材料成像探针的开发速度加快,并逐渐发展成为复杂的模块化设计。通过整合不同的荧光团、靶向配体和检测分子,并利用检测物种的固有特性,研究人员现在可以很容易地设计出新的探针。
近年来开发的靶向癌细胞线粒体探针大多具有双重功能,既能成像,又能治疗。成像技术从近红外 I 型发展到近红外 II 型,大大提高了成像性能,同时降低了背景信号。针对癌细胞的线粒体探针的未来发展可能会结合其他成像模式,如正电子发射断层扫描(PET)和放射性核素治疗。通过整合临床上常用的成像技术,这些探针的转化潜力将大大提高。
对于癌症以外的疾病,已开发的大多数探针都是纯成像探针,用于监测疾病的进展阶段。这些探针有助于更深入地了解线粒体功能与疾病进展之间的关系。展望未来,可以想象,针对各种非癌症疾病设计的多功能探针将同时具有成像和治疗功能。这种探针将能在临床环境中更有效地监测疾病的进展和预后。
其他疾病
在治疗癌症以外的疾病时,靶向线粒体的纳米材料通常通过恢复线粒体活性而不是诱导细胞死亡来发挥作用。因此,这些纳米材料面临更严格的毒理学要求。常用的一种分子 TPP 如果过度累积,会诱发线粒体毒性,导致线粒体膜去极化并引发细胞凋亡。因此,精确控制 TPP 的浓度至关重要,这反过来又限制了其临床转化潜力。虽然多肽类线粒体靶向配体的细胞毒性较低,但其固有的不稳定性和易降解性大大影响了其靶向功效。此外,基于多肽的配体成本高昂,进一步阻碍了其临床应用。因此,开发更稳定、低毒性、高靶向效率的线粒体靶向方法已成为研究的重点。
最近,DNA 折纸技术在 DNA nm技术领域引起了广泛关注。DNA 折纸技术以其高传递精度和安全性而著称,已被广泛研究。未来,可以利用这一技术创造出能够靶向线粒体的 DNA 折纸纳米材料,从而提高线粒体靶向纳米材料的临床转化价值。
7. 结论
线粒体作为细胞内的重要细胞器,在维持细胞健康方面发挥着关键作用。线粒体的功能和存活异常与多种疾病的发生和发展有关,包括癌症、神经退行性疾病和心血管疾病。这些疾病中线粒体的损伤可导致能量代谢紊乱、氧化应激增加和细胞死亡途径的异常激活,从而对健康产生不利影响。近年来,针对线粒体的靶向治疗策略取得了很大进展,各种线粒体靶向纳米材料也应运而生。
本文综述了线粒体纳米材料在多个领域的最新应用进展,包括肿瘤治疗、生物探针和成像、神经退行性疾病、肾损伤、阿尔茨海默病、缺血再灌注损伤、骨关节炎和椎间盘变性。这些纳米材料主要通过靶向传输系统、抗氧化特性和线粒体功能调节发挥治疗效果。研究人员利用纳米材料的独特特性,巧妙地设计了线粒体纳米颗粒,并对线粒体与不同疾病之间错综复杂的关系进行了广泛的研究。他们敏锐地利用这些关系来发挥纳米材料的治疗潜力。例如,在肿瘤治疗应用中,纳米材料被用作靶向传输系统,以激活氧化应激,从而选择性地消除肿瘤细胞。此外,研究人员还对 PDT、PTT、CDT 的单独应用或联合应用进行了研究,以提高治疗效果。此外,研究人员还利用对线粒体 ROS 与阿尔茨海默病等疾病之间联系的了解,开发了利用纳米材料有效缓解 ROS 产生的策略,以治疗相关疾病。总之,近年来线粒体纳米材料在不同领域的应用取得了重大进展。这些研究为揭示线粒体与疾病之间错综复杂的关系提供了重要见解,同时也展示了利用纳米材料进行临床治疗的巨大潜力。进一步的研究工作无疑将推动这一领域向前发展,带来更多突破性发现,并对临床应用产生重大影响。