【JACS】用于NIR-IIbc区高分辨率深层组织成像的超亮可降解有机发光体
近红外II区(NIR-II)的长波段,特别是NIR-IIbc窗口(1500-2000 nm),因其能够最大限度地减少生物组织的光散射和自发荧光干扰,为实现深层组织、高分辨率的活体荧光成像提供了独特的优势。 然而,该领域的进展长期受制于高性能荧光探针的缺乏。 现有的探针中,无机材料存在潜在的长期生物毒性问题 3,而大多数有机荧光团则面临发射波长短于1500 nm、荧光亮度不足以及体内清除缓慢等瓶颈。
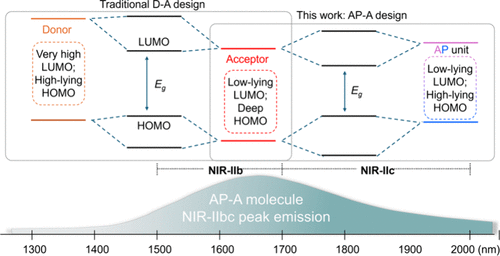
本项研究报告了一种创新的分子设计策略,成功开发了一款在水相中发射峰值约为1650 nm的超亮、可生物降解有机半导体聚合物(PTZ)纳米探针。 该探针基于一种新颖的平面化“两亲性单元-受体”(AP-A)分子架构,旨在解决传统荧光团在光吸收效率与量子产率之间的固有矛盾,为深层组织的高分辨率成像提供了强大的工具。
一、 分子工程策略与光物理特性
传统D-A结构的局限性
传统上,用于近红外区域的有机荧光分子多采用“给体-受体”(D-A)结构。 在此类结构中,获得长波长发射通常需要强的分子内电荷转移(ICT)效应,但这往往导致荧光量子产率(QY)的严重猝灭。 采用平面化的D-A骨架虽能获得较高的摩尔消光系数(ε),但会加剧ICT效应,导致QY极低。 相反,通过扭转分子骨架来抑制ICT可以提升QY,却会牺牲ε值并导致发射光谱蓝移,最终使得整体荧光亮度(ε × QY)的提升有限。
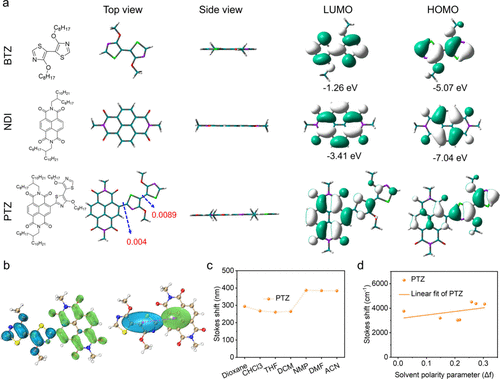
创新的AP-A设计原理
为突破上述局限,本研究提出了一种全新的“两亲性单元-受体”(AP-A)设计范式。 该设计采用具有低LUMO能级和高HOMO能级的两亲性(AP)单元(dialkoxybithiazole, BTZ)与强受体(A)单元(naphthalenediimide, NDI)结合。 在此AP-A框架中,AP单元能够同时对聚合物的最高占据分子轨道(HOMO)和最低未占分子轨道(LUMO)产生显著贡献,从而有效降低带隙,实现NIR-IIbc区的长波长发射。 同时,该设计能够抑制过度的ICT效应,结合其近乎平面的分子构象(二面角为0.004°和0.0089°),协同实现了高的QY和巨大的ε值。
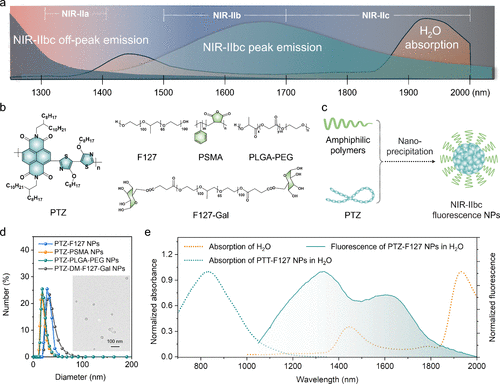
光物理性能表征
通过将PTZ聚合物与两亲性共聚物(如F127)进行纳米沉淀,制备了水分散性良好的PTZ-F127纳米颗粒(NPs)。 在水溶液中,PTZ-F127 NPs的吸收峰位于830 nm,发射峰值在1650 nm,发射尾迹延伸至2000 nm以上。 其ε值高达2.92×105M−1cm−1,NIR-IIbc区的荧光量子产率为0.021%。 由此计算得到的荧光亮度为61.32M−1cm−1,相较于当时已报道的有机NIR-IIbc材料提升了一个数量级。
二、 高分辨率与深层组织活体成像应用
高分辨率血管成像
在活体小鼠血管成像中,通过使用1500 nm长通(LP 1500)滤光片,PTZ-F127 NPs能够提供极高的图像清晰度和对比度。 断面荧光强度分析显示,LP 1500成像的血管半峰全宽(FWHM)为56.62μm,信噪比(SBR)为2.49,显著优于LP 1000(FWHM 115.52μm,SBR 1.22)和LP 1300(FWHM 83.31μm,SBR 1.39)滤光片下的成像效果。 该探针能够清晰分辨体内直径约100μm 的微小血管。
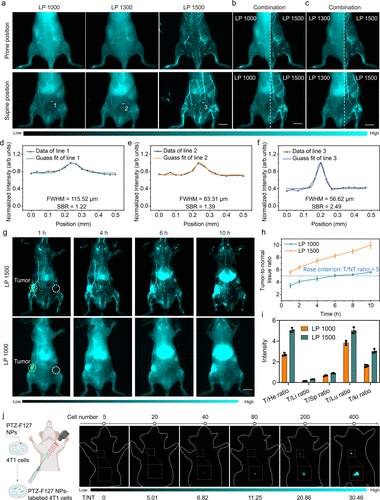
近单细胞级肿瘤探测
在4T1乳腺癌荷瘤小鼠模型中,PTZ-F127 NPs在注射后1小时即表现出高的肿瘤/正常组织比(T/NT),LP 1500滤光片下的T/NT值为5.62±0.31。 尤为重要的是,该探针展现了近单细胞水平的探测灵敏度,在小鼠乳腺脂肪垫中,少至约20个被标记的癌细胞即可被清晰检出,此时的T/NT比值超过5。
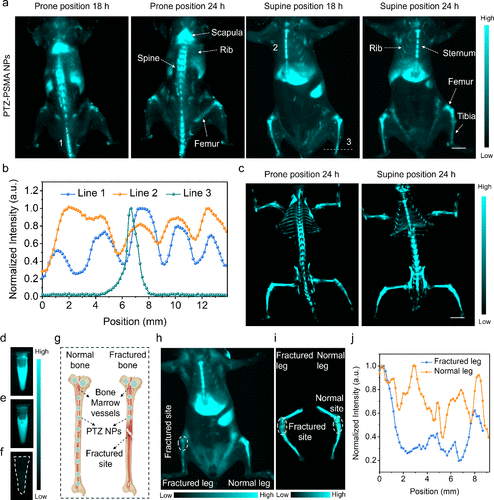
深层组织骨髓成像
利用表面经羧基修饰的PTZ-PSMA NPs,研究成功实现了对活体小鼠深部骨髓的无创成像。 注射后24小时,小鼠的肩胛骨、脊柱、肋骨和股骨等骨骼结构被清晰地可视化,荧光信号被证实主要源于骨骼内部的骨髓细胞。 该技术还成功应用于骨折模型的诊断,骨折部位因血液循环中断而显示出显著减弱的荧光信号。
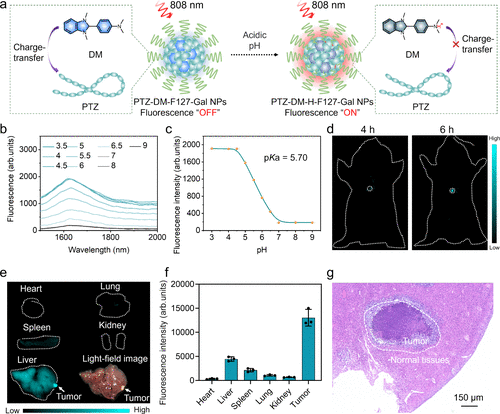
早期原位微小病灶成像
为探测深部微小肿瘤,研究人员构建了一种pH响应型探针(PTZ-DM-F127-Gal NPs)。 该探针在正常生理pH下荧光处于“关闭”状态,但在肿瘤的酸性微环境(pKa = 5.70)中被激活,“点亮”肿瘤区域。 在原位肝癌小鼠模型中,该探针成功实现了对小至1.5 mm的深部肝脏肿瘤的高对比度成像,肿瘤区域信号强度比周围正常组织高出3.02倍。
三、 生物降解性与体内生物安全性
对于临床转化而言,成像探针的生物安全性与代谢清除能力至关重要。 本研究通过将PTZ封装于可生物降解的PLGA-PEG中,系统评估了其体内降解与清除特性。
体外与体内降解:在与巨噬细胞共培养48小时后,PTZ-PLGA-PEG NPs在~830 nm处的特征吸收峰强度下降了70%,表明其π-共轭骨架发生了降解。 活体研究追踪了其降解产物的荧光信号,结果表明探针主要经由肝胆和肾脏双重途径清除。
清除动力学与安全性:荧光信号在血液、尿液和粪便中依次达到峰值,并在18天内基本恢复至注射前水平,表明探针可被高效、完全地清除。 在为期30天的体内安全性评估中,对小鼠进行的血液学、血生化及主要器官的组织病理学分析均未发现任何显著异常或毒性反应,证实了PTZ聚合物优异的生物相容性。
结论
本研究成功构建了一种具有1650 nm峰值发射的超亮、可生物降解有机荧光探针。 通过创新的平面化AP-A分子设计策略,该探针克服了传统有机荧光团在亮度和发射波长上的限制,其荧光亮度较同类材料提升了一个数量级。 其在活体成像中展现了前所未有的性能,包括对约100μm 血管、约20个细胞团、深部骨髓以及1.5 mm早期原位肝癌的高分辨率成像能力。 此外,该探针优异的生物降解性(18天内完全清除)和生物安全性解决了长期以来限制同类材料临床应用的瓶颈。 这项工作不仅提供了一种高性能的NIR-IIbc成像工具,也为开发用于前沿生物医学应用的新一代可降解光功能材料提供了普适性的设计准则。