【JACS】纳米-LYTAC逆转肿瘤免疫抑制微环境:癌症免疫治疗的新突破
总结
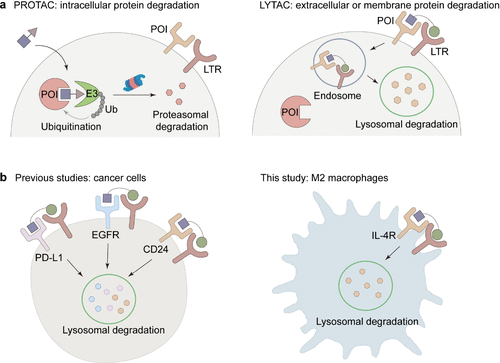
研究开发了一种基于纳米-LYTAC的声动力免疫治疗方法,通过降解M2巨噬细胞上的IL-4R蛋白,逆转肿瘤免疫抑制微环境(TIME),显著抑制肿瘤生长、肺转移和复发。
摘要
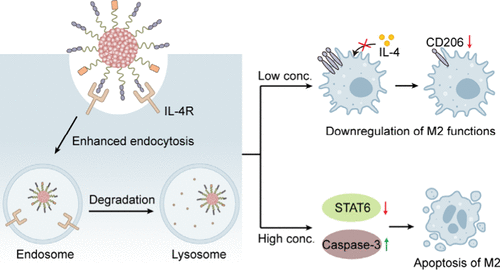
本研究提出了一种新型的聚合物纳米溶酶体靶向嵌合体(nano-LYTAC),用于降解M2巨噬细胞上的膜蛋白IL-4R,并产生声动力效应以实现联合癌症免疫治疗。研究发现,nano-LYTAC对IL-4R的降解效率高于传统抑制剂,并且其对M2巨噬细胞功能的影响具有浓度依赖性:在低浓度下下调CD206表达和IL-10分泌,而在高浓度下触发M2巨噬细胞的凋亡。此外,nano-LYTAC在肿瘤中的滞留时间超过48小时,允许单次给药进行多次声动力治疗。通过抑制M2巨噬细胞和调节性T细胞(Tregs)的功能,并促进树突状细胞(DCs)的成熟和效应T细胞(Teffs)的肿瘤浸润,nano-LYTAC介导的协同声动力免疫治疗在小鼠模型中完全抑制了肿瘤生长,抑制了肺转移,并防止了复发。
研究结果分类展示
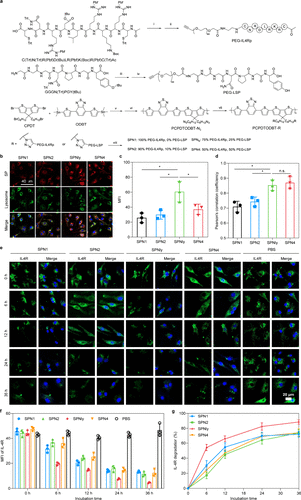
组成筛选
- 最佳成分:SPNly(75% PEG-IL4Rp和25% PEG-LSP)
- 细胞摄取和溶酶体运输:SPNly在M2巨噬细胞中表现出最高的细胞摄取和溶酶体运输能力
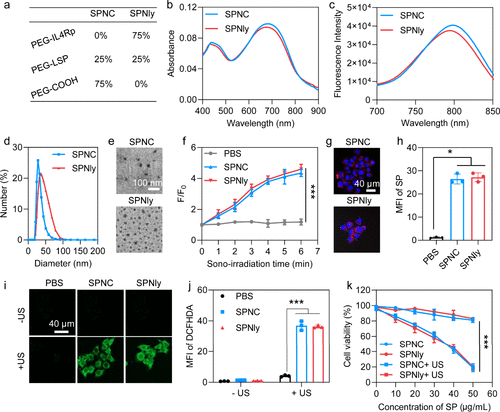
体外表征
- 光学性质:SPNly和SPNC在425 nm和680 nm处具有相似的吸收峰,荧光发射峰在810 nm
- 1O2生成能力:SPNly和SPNC在声辐照下均能有效生成1O2
- 细胞毒性:SPNly和SPNC在无声辐照下对4T1细胞无明显毒性,但在声辐照下表现出浓度依赖的细胞毒性
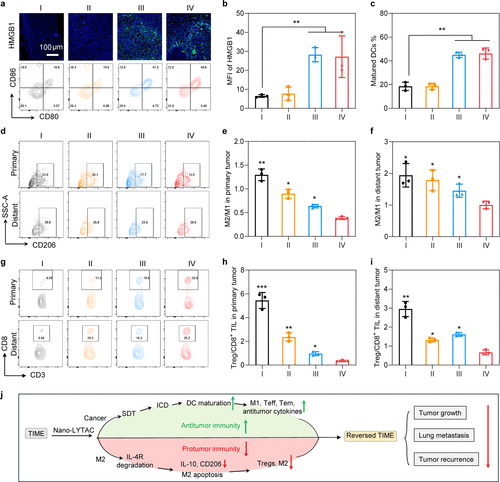
体外机制研究
- 肿瘤免疫原性细胞死亡(ICD):SPNly和SPNC在声辐照下均能有效诱导4T1细胞的ICD
- 树突状细胞(DCs)成熟:SPNly和SPNC在声辐照下均能显著促进DCs的成熟
- M2巨噬细胞功能抑制:SPNly通过降解IL-4R显著下调M2标志物CD206和IL-10分泌,并在高浓度下诱导M2巨噬细胞凋亡

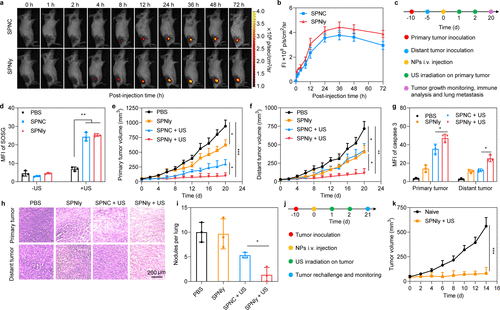
体内声动力免疫治疗
- 肿瘤积累和滞留:SPNly和SPNC在肿瘤中的滞留时间超过48小时
- 肿瘤生长抑制:SPNly在声辐照下完全抑制了原发性和远处肿瘤的生长
- 肺转移抑制:SPNly在声辐照下显著抑制了肺转移
- 抗复发效果:SPNly在声辐照下展示了显著的抗复发效果
这项研究展示了纳米-LYTAC在逆转肿瘤免疫抑制微环境中的巨大潜力,为癌症免疫治疗提供了新的思路和方法。
参考文献
Xu, M.; Hu, Y.; Wu, J.; Liu, J.; Pu, K. Sonodynamic Nano-LYTACs Reverse Tumor Immunosuppressive Microenvironment for Cancer Immunotherapy. J. Am. Chem. Soc. 2024, jacs.4c13022. https://doi.org/10.1021/jacs.4c13022.