【JACS】铁死亡or焦亡?铁基纳米催化剂调控细胞死亡模式,增强肿瘤免疫疗法
总结
这篇研究报告了一种基于铁的纳米催化药物,它能够通过调节肿瘤细胞的铁死亡(ferroptosis)和焦亡(pyroptosis)来增强肿瘤免疫疗法。 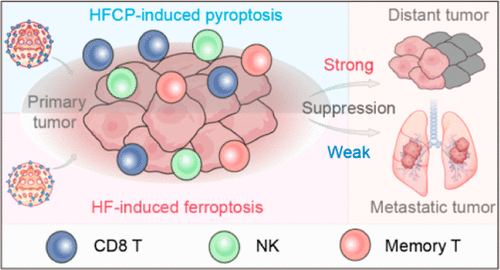
摘要
在这项研究中,研究者们设计并合成了一种新型的铁基纳米催化剂,用于调控肿瘤细胞的死亡模式,从而增强肿瘤免疫疗法。该纳米剂可以在肿瘤细胞的酸性溶酶体环境中释放铁离子和细胞毒性药物(CP),从而在细胞内部激活特定的死亡途径。研究发现,与单纯引发铁死亡的纳米剂相比,结合铁离子和CP的纳米剂能够更有效地诱导焦亡,这种死亡模式通过释放促炎细胞因子(如IL-1β和IL-18)和损伤相关分子模式(DAMPs),如HMGB1,从而激活更强烈的免疫反应。实验结果表明,该纳米剂不仅在细胞水平上显示出对肿瘤细胞的强大毒性,而且在小鼠模型中显示出对主要肿瘤和远处肿瘤的抑制作用,同时还能激活机体的免疫记忆,减少肿瘤转移。此外,研究还揭示了铁离子和CP在细胞死亡途径中的作用机制,即通过调控蛋白质Tom20的氧化修饰和Caspase-3/GSDME信号通路来激活焦亡。这一发现为肿瘤治疗提供了新的策略,通过调控细胞死亡模式来提高免疫疗法的效果。 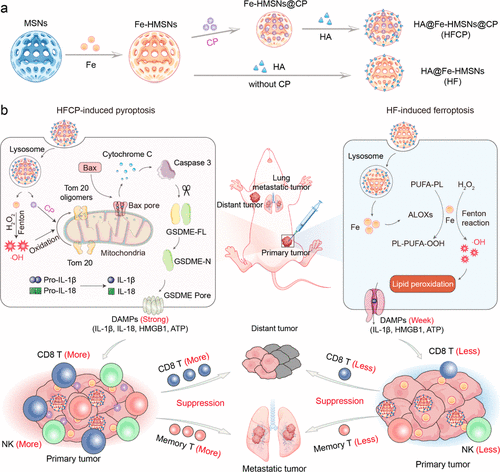
细节
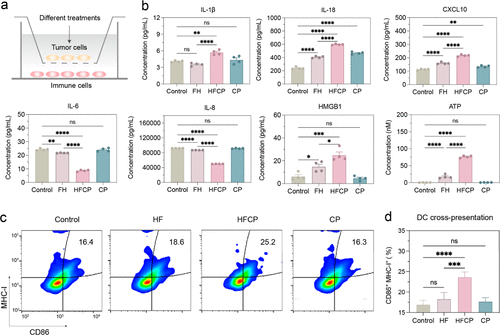
铁基纳米催化剂可以在肿瘤细胞内部调控铁死亡和焦亡,通过诱导焦亡来增强肿瘤的免疫原性。
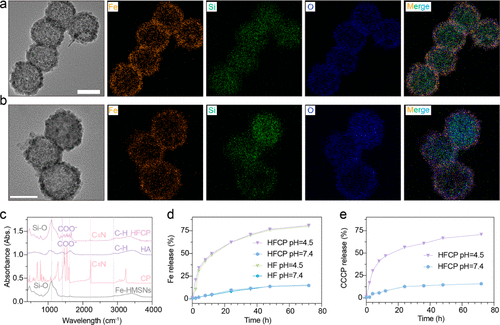
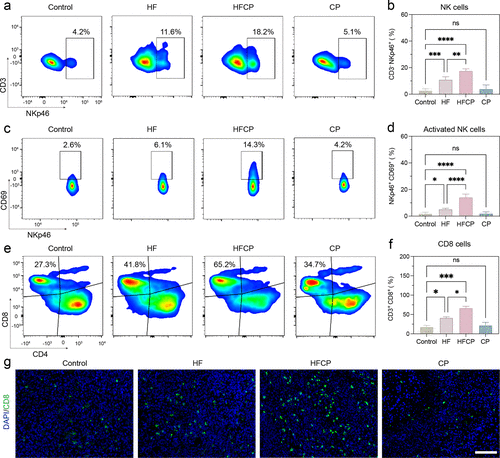
焦亡相比铁死亡,能够更有效地激活免疫系统,通过释放促炎细胞因子和DAMPs来促进抗肿瘤免疫反应。
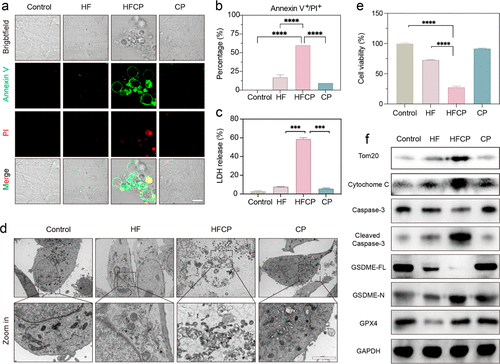
纳米剂中的CP与铁离子的协同作用能够增强细胞内ROS的产生,进而通过Tom20-Caspase-3-GSDME信号通路激活焦亡。
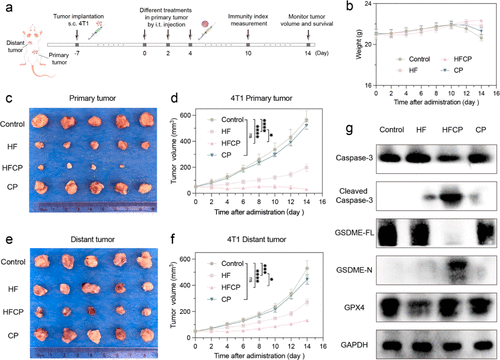
在小鼠模型中,该纳米剂不仅能够抑制主要肿瘤的生长,还能有效地减少远处肿瘤的生长,显示出其在治疗肿瘤转移方面的潜力。
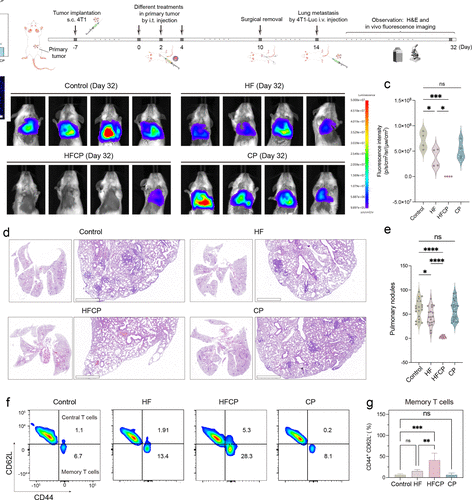
该纳米剂还能激活免疫记忆,提高机体对肿瘤的长期免疫监视能力,从而减少肿瘤复发和转移的风险。
研究中使用的纳米平台对于开发新型肿瘤治疗策略具有重要意义,特别是在提高免疫疗法效果方面。
参考文献
Feng, Q.; Qi, F.; Fang, W.; Hu, P.; Shi, J. Ferroptosis to Pyroptosis Regulation by Iron-Based Nanocatalysts for Enhanced Tumor Immunotherapy. J. Am. Chem. Soc. 2024, jacs.4c08304. https://doi.org/10.1021/jacs.4c08304.