【Adv. Mater.】近红外II区,微环境激活,新型荧光探针助力类风湿性关节炎的协同治疗
总结
本研究开发了一种用于类风湿性关节炎(RA)精确近红外-II 监测和协同免疫疗法的平台。该平台基于一种新型的分子探针,能够在RA的炎症微环境中响应活化,同时释放治疗性的一氧化碳(CO)气体,实现精确的RA诊断和疗法。 
摘要
在本研究中,研究者们设计并合成了一种新型的NIR-II荧光探针TTCO,该探针结合了近红外(NIR-II)荧光成分和羰基锰化合物结构,能够在RA炎症微环境中被激活,同时释放治疗性的CO气体。TTCO分子通过自组装形成了纳米探针,并通过抗IL-6R抗体的修饰,赋予了探针针对RA的主动靶向能力。实验结果显示,该纳米探针能够在RA病灶处显示出明显的NIR-II荧光信号,实现了RA的精确诊断和实时治疗监测。此外,该探针的ROS清除、CO气体的按需释放以及IL-6信号阻断的综合作用,显示出对RA症状的显著缓解和联合免疫调节效应,有效抑制了RA相关的炎症因子,促进了巨噬细胞从M1型向M2型的极化转换,从而显著减轻了RA症状和关节破坏。此外,该研究还对TC@AI NPs在细胞和动物水平上的疗效进行了深入评估,并通过转录组分析揭示了其治疗机制。
观点
微环境活化的NIR-II探针
研究者们开发了一种能够在RA炎症微环境中响应ROS并激活NIR-II荧光成分的探针TTCO,该探针还能释放治疗性的CO气体,为RA的精确诊断和治疗提供了新的可能性。 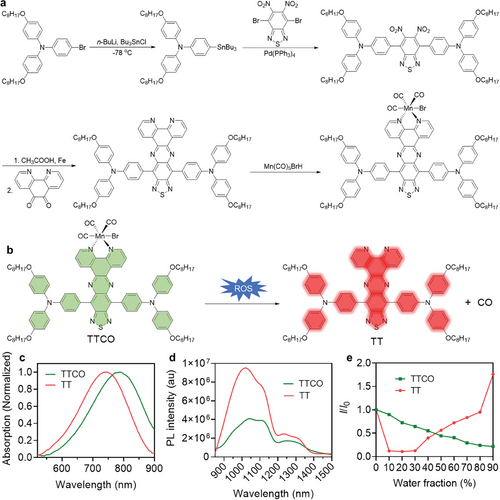
主动靶向和实时监测
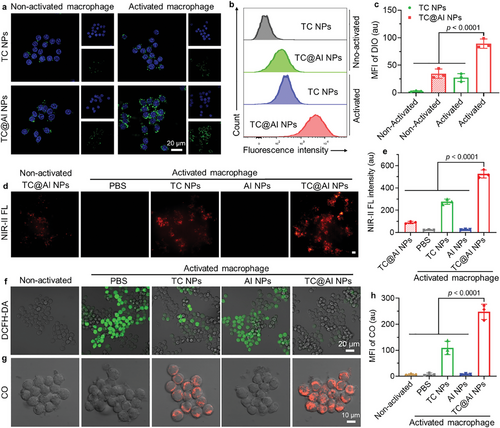
通过将抗IL-6R抗体修饰到纳米探针上,TC@AI NPs能够特异性靶向RA病灶,并在NIR-II波长范围内提供实时的荧光图像,实现了精确的疾病定位和治疗效果评估。 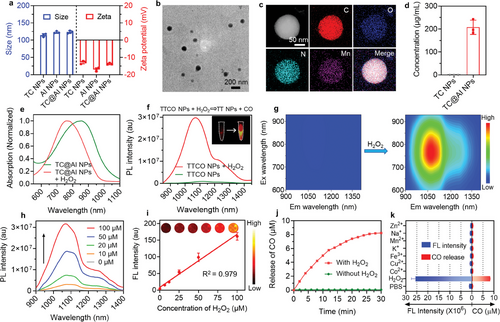
多靶点疗法的综合效应
TC@AI NPs通过清除ROS、释放CO气体以及阻断IL-6信号路径,实现了对RA的多靶点治疗,显著抑制了炎症因子的产生,并促进了免疫调节,从而提供了有效的RA治疗策略。
免疫调节和炎症缓解
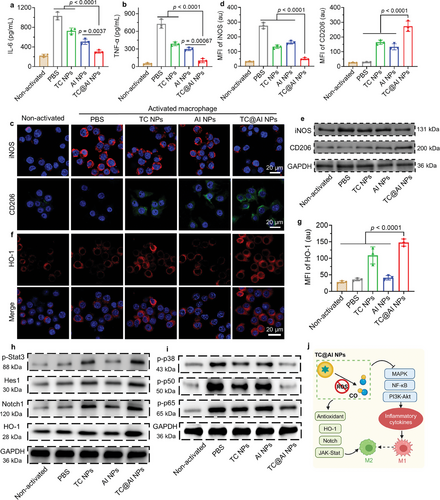
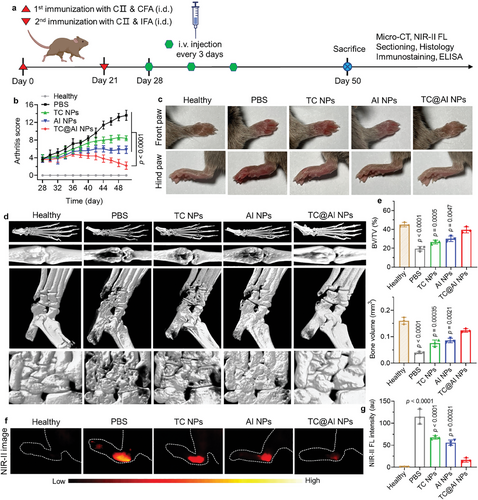
研究结果表明,TC@AI NPs能够有效地调节巨噬细胞的极化状态,促进M1型向M2型的转换,减少了炎症细胞的浸润,抑制了骨骼和笛状体的破坏,证明了其在RA治疗中的潜在应用。
生物相容性和安全性
TC@AI NPs在体内外的实验中表现出良好的生物相容性和低毒性,且在动物模型中的应用未显示出明显的系统毒性,为其临床应用提供了安全性基础。 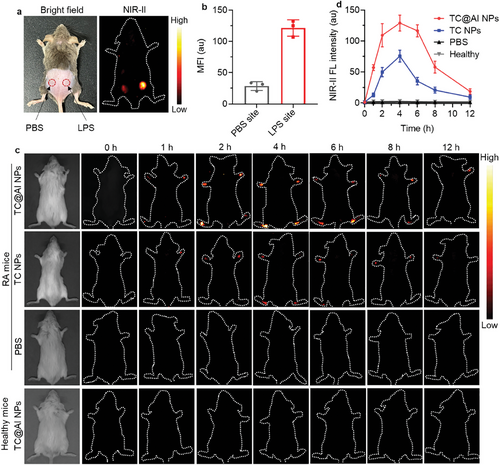
转录组分析揭示治疗机制
通过转录组分析,研究者们揭示了TC@AI NPs治疗RA的潜在分子机制,包括抑制炎症和免疫相关的信号通路,如MAPK、PI3K-Akt和NF-κB等,为进一步的研究和临床应用提供了理论基础。 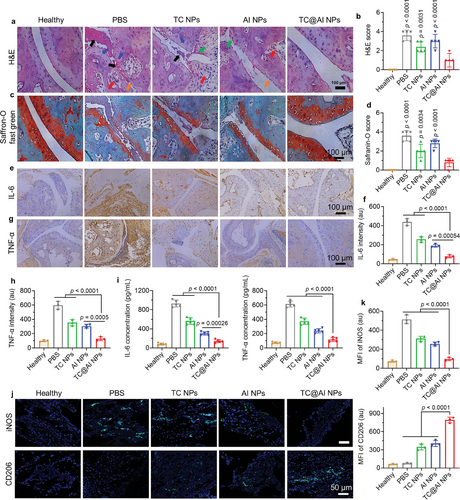
参考文献
Zhang, Y.; Liu, D.; Chen, W.; Tao, Y.; Li, W.; Qi, J. Microenvironment‐Activatable Probe for Precise NIR‐II Monitoring and Synergistic Immunotherapy in Rheumatoid Arthritis. Advanced Materials 2024, 2409661. https://doi.org/10.1002/adma.202409661.