【Biomaterials】新型pH-响应材料,增强胶质母细胞瘤(GBM)对化疗和免疫治疗的敏感性
总结
本研究发展了一种靶向肿瘤相关巨噬细胞(TAMs)的pH-响应分层脑靶向胶束复合物,用于增强胶质母细胞瘤(GBM)对化疗和免疫治疗的敏感性。 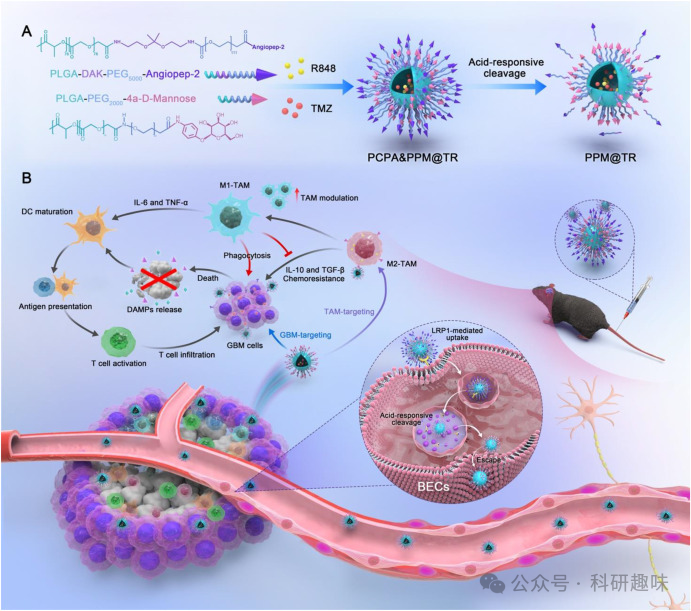
摘要
研究人员设计并合成了一种pH-响应分层脑靶向胶束复合物,载有TMZ和R848,用于结合化疗和免疫治疗对抗GBM。该复合体PCPA&PPM@TR采用了Angiopep-2和甘露糖类似物(MAN)的双层修饰策略,其中Angiopep-2通过pH-响应的链接基团在外层装饰,而MAN在中层。实验结果表明,PCPA&PPM@TR能有效地跨越血脑屏障(BBB),并且在GBM和TAMs中具有同时靶向作用的能力。在体内实验中,PCPA&PPM@TR显著提高了药物在GBM组织中的累积,并且通过重编程TAMs从M2型到M1型,减少了GBM对TMZ的耐药,增强了抗肿瘤免疫反应。进一步的研究表明,PCPA&PPM@TR治疗后,GBM动物的生存期显著延长,GBM的增殖得到了有效抑制,同时也改善了肿瘤免疫微环境。此外,该复合体具有良好的生物相容性和低毒性。这项研究提供了一种新的GBM治疗策略,通过靶向TAMs来增强化疗药物的疗效,并激活抗肿瘤免疫反应。
观点
GBM对化疗和免疫治疗的耐药主要是由TAMs在GBM微环境中的存在引起的。 TAMs,特别是M2型TAMs,支持GBM的生长、血管生成和免疫抑制,对GBM的化疗耐药和进展起到关键作用。因此,通过调控TAMs可能是克服GBM耐药的有效策略。
设计了一种pH-响应分层脑靶向胶束复合物PCPA&PPM@TR,用于靶向TAMs和GBM细胞。 该复合体通过Angiopep-2与BBB上的受体相互作用,实现有效的脑靶传递。在酸性肿瘤微环境中,Angiopep-2可以脱落,从而实现逃逸酸性内吞体并达到GBM和TAMs的靶向投递。
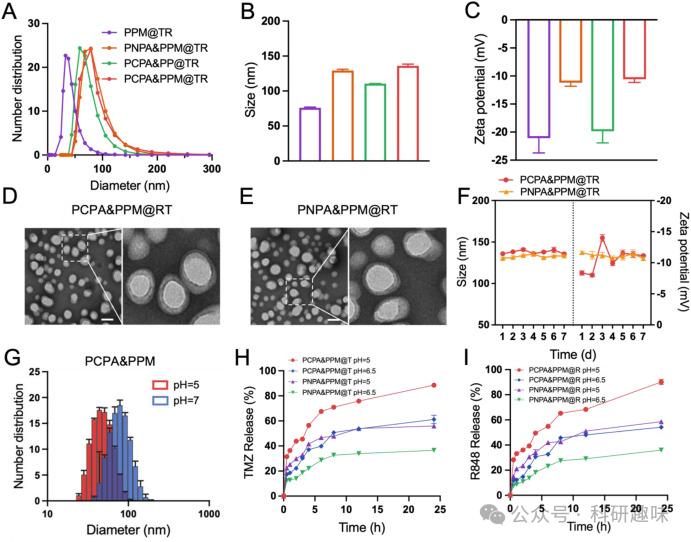 图1. PCPA&PPM@TR 的制备和表征
图1. PCPA&PPM@TR 的制备和表征 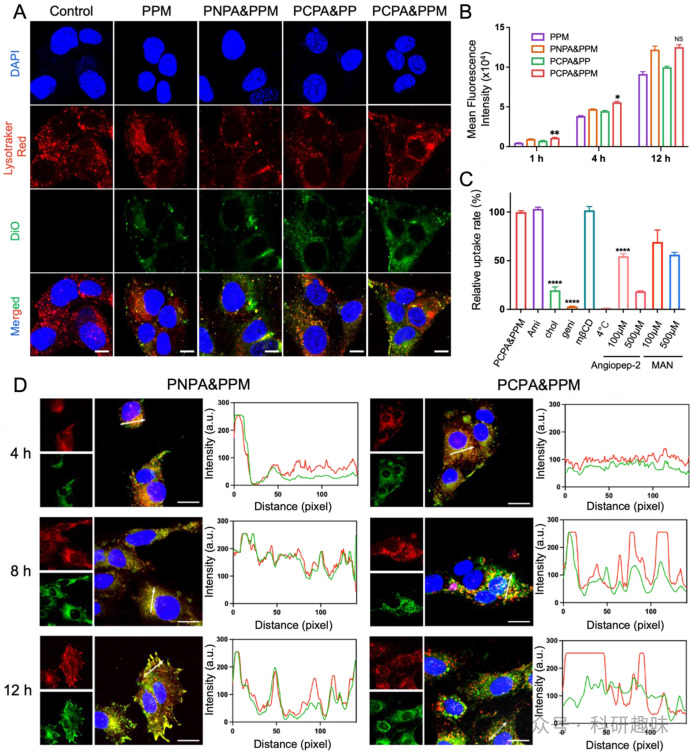 图2. 细胞摄取和溶酶体逃逸
图2. 细胞摄取和溶酶体逃逸PCPA&PPM@TR能够有效地重编程M2型TAMs为M1型TAMs,从而减少GBM的化疗耐药。 R848的投递能够激活TAMs,促使其从促炎的M1型向抗炎的M2型转化,这不仅减少了对TMZ的耐药性,还增强了免疫死亡细胞的免疫原性。
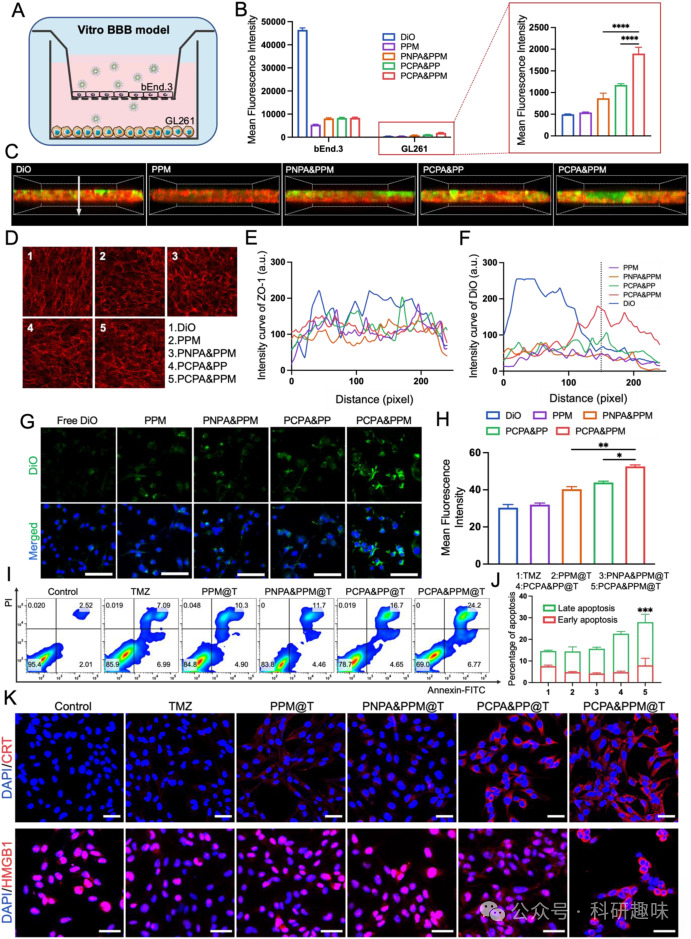 图3. 体外 BBB 渗透性、细胞毒性和 ICD 效果评估
图3. 体外 BBB 渗透性、细胞毒性和 ICD 效果评估在体内实验中,PCPA&PPM@TR显著提高了药物在GBM组织中的累积,并延长了动物的生存期。 与其他对照组相比,PCPA&PPM@TR治疗组显示出更好的抗GBM效果,包括生存期的显著延长和GBM增殖的抑制。
PCPA&PPM@TR改善了肿瘤免疫微环境,促进了效应T细胞的浸润。 治疗后,CD4和CD8 T细胞在GBM组织中的比例显著增加,而Treg细胞的比例则显著降低,表明PCPA&PPM@TR能够促进抗肿瘤免疫反应。
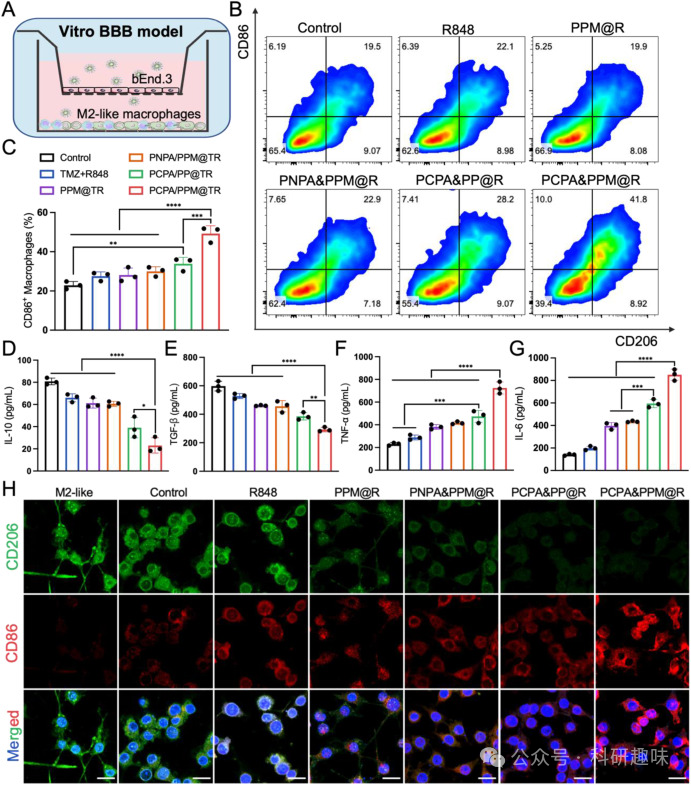 图4. PCPA&PPM@R 在 Transwell 模型中的巨噬细胞重编程能力
图4. PCPA&PPM@R 在 Transwell 模型中的巨噬细胞重编程能力PCPA&PPM@TR具有良好的生物相容性和低毒性。 实验结果表明,PCPA&PPM@TR的治疗并没有显著改变动物的体重或主要器官的比例,也没有引起显著的组织损伤。
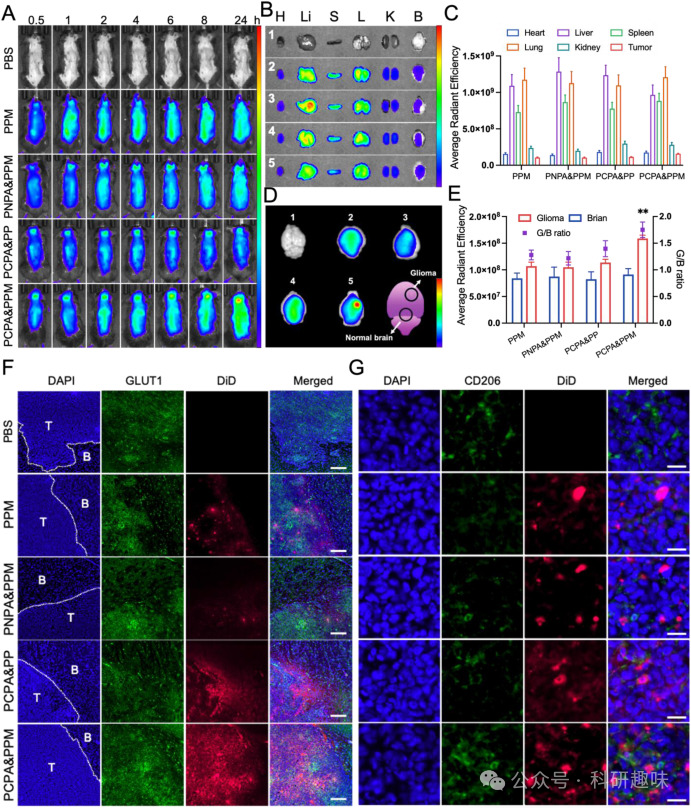 图5. 生物分布和体内靶向 GBM 输送
图5. 生物分布和体内靶向 GBM 输送该研究提供了一种新的GBM治疗策略,通过靶向TAMs来增强化疗药物的疗效,并激活抗肿瘤免疫反应。 通过特异地靶向和重编程TAMs,PCPA&PPM@TR为GBM的治疗提供了新的思路,可能在未来的临床应用中发挥重要作用。
参考文献
Li, J.; Yang, J.; Jiang, S.; Tian, Y.; Zhang, Y.; Xu, L.; Hu, B.; Shi, H.; Li, Z.; Ran, G.; Huang, Y.; Ruan, S. Targeted Reprogramming of Tumor-Associated Macrophages for Overcoming Glioblastoma Resistance to Chemotherapy and Immunotherapy. Biomaterials 2024, 122708. https://doi.org/10.1016/j.biomaterials.2024.122708.