【Nature】发现!缺氧诱导癌症炎症细胞死亡的机制
总结
本研究发现了一种在缺氧环境下导致炎症性细胞死亡的机制,该机制通过蛋白酪酶PTP1B和RNF213对CYLD/SPATA2的调控以及NF-κB信号通路的激活,最终引发促炎性细胞死亡,这一发现对于理解和治疗癌症具有潜在的重要意义。
摘要
在这项研究中,研究者们发现了一种在缺氧环境下导致炎症性细胞死亡的机制,这一机制在人类乳腺癌细胞中得到了证实。研究表明,蛋白酪酶PTP1B和E3泛素连接酶RNF213之间的相互作用对于调控RNF213的多聚体形成和RZ域的活化至关重要。RNF213通过K63连接的多聚体化作用对CYLD/SPATA2进行泛素化和降解,进而激活NF-κB信号通路,诱导NLRP3炎症体的形成和促炎性细胞死亡。此外,缺氧环境下的内质网应激提供了引发死亡的“第二信号”。研究人员还在动物模型中验证了这一机制,证明了PTP1B、RNF213和CYLD/SPATA2在调控肿瘤生长和死亡中的作用。这些发现不仅揭示了癌症细胞在缺氧环境下的死亡机制,而且可能对于开发新的治疗策略具有重要意义。
观点
PTP1B和RNF213在缺氧环境下调控炎症性细胞死亡的过程中起着关键作用。PTP1B通过调控RNF213的酪磷酸化状态来影响其活性,而RNF213的RZ域对CYLD/SPATA2的泛素化至关重要。
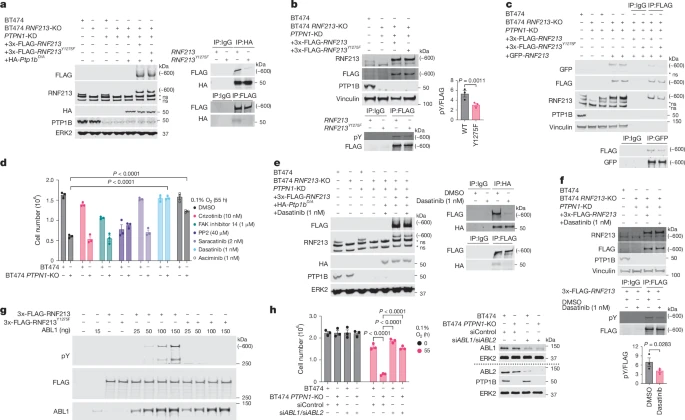
CYLD和SPATA2的降解导致NF-κB活性增加,进而诱导了NLRP3炎症体的形成和pyroptosis的发生。这一过程在缺氧环境下被内质网应激所加强,内质网应激提供了引发pyroptosis的“第二信号”。
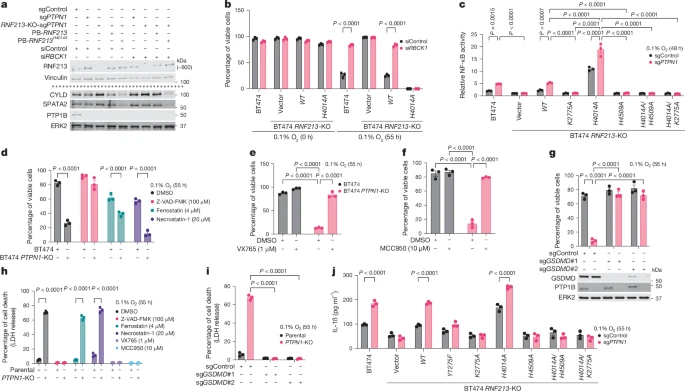
通过动物实验,研究者们证明了PTP1B、RNF213和CYLD/SPATA2在调控肿瘤生长和死亡中的作用。在缺乏PTP1B或CYLD的情况下,肿瘤生长受到抑制,而NLRP3的缺失则阻止了这一效应,表明NLRP3炎症体对于pyroptosis至关重要。
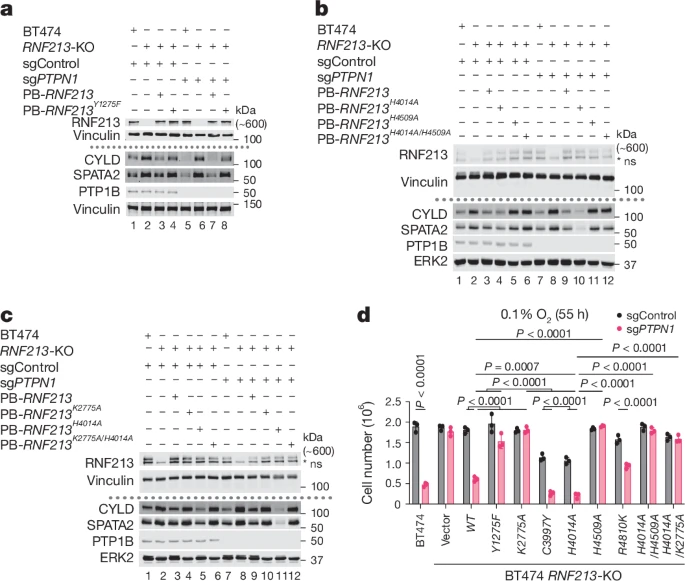
RNF213的RZ域对于细胞死亡至关重要,而RING域则对RZ域的活性产生负性调控。RING域突变的RNF213显示出RZ域增益功能,这可能解释了Moyamoya病(MMD)的遗传传递模式。
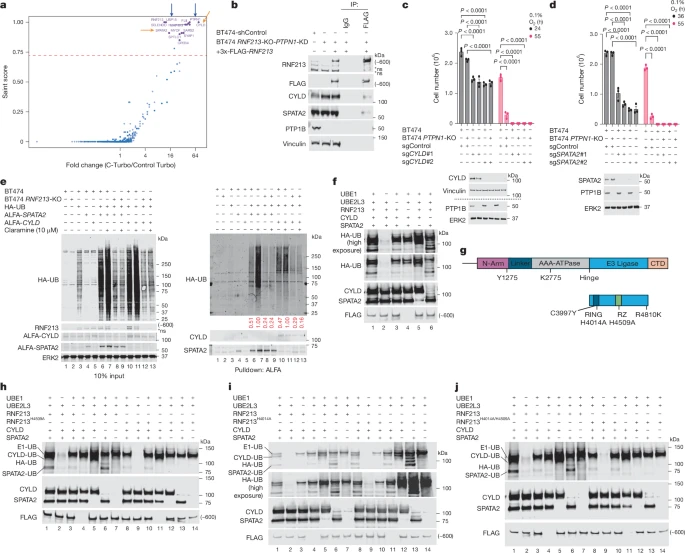
研究还表明,LUBAC复合体对于RNF213介导的CYLD/SPATA2的泛素化和降解至关重要。在LUBAC成分缺失的情况下,WT-RNF213介导的CYLD/SPATA2降解被阻断,但RING域突变的RNF213则不需要LUBAC即可促进CYLD/SPATA2的降解。
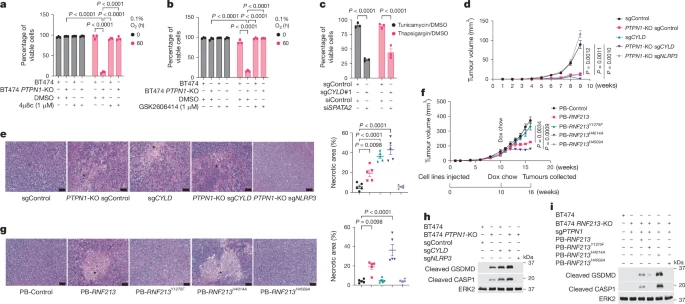
缺氧环境下的内质网应激是引发pyroptosis的关键因素之一。研究发现,在缺氧环境下,内质网应激标志物的表达增加,而CHOP的敲减部分逆转了缺氧环境下的细胞死亡敏感性,表明CHOP在缺氧环境下引发的细胞死亡中起着作用。
研究人员通过生物信息学分析和实验验证了RNF213与其他蛋白质的相互作用,包括CYLD和SPATA2,以及与炎症和内源性免疫反应相关的蛋白质。这些发现有助于深入理解RNF213的生物学功能和调控机制。
参考文献
Bhardwaj, A., Panepinto, M.C., Ueberheide, B. et al. A mechanism for hypoxia-induced inflammatory cell death in cancer. Nature (2024). https://doi.org/10.1038/s41586-024-08136-y