【Biomaterials】通过限制巨噬细胞的拦截,有效改善纳米粒子的肿瘤积累和癌细胞靶向性
总结
本研究开发了三种不同靶向功能的纳米粒子,通过限制肺肿瘤中的巨噬细胞拦截,用于改善肺癌治疗中的肿瘤聚集和癌细胞靶向。 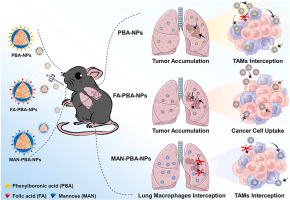
摘要
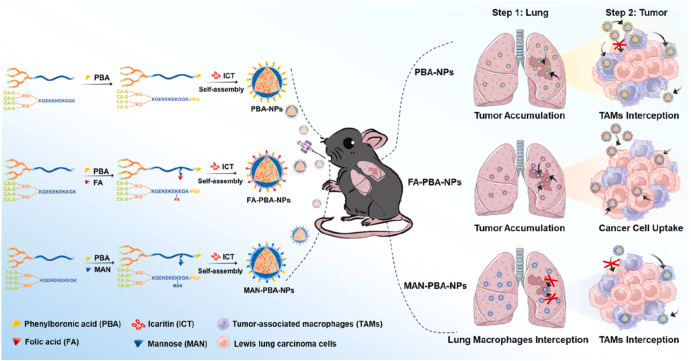
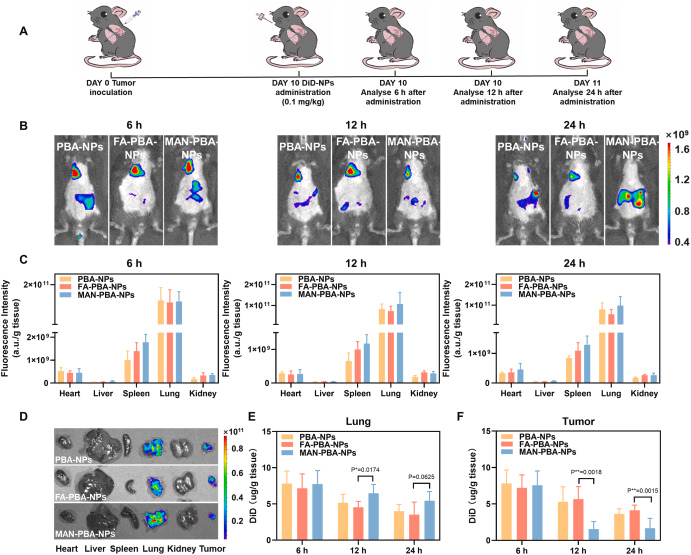
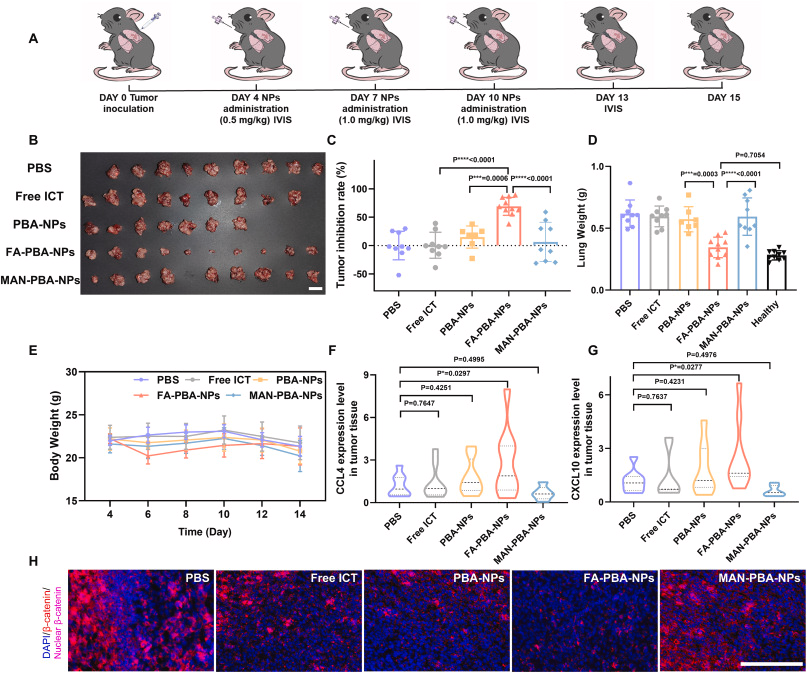
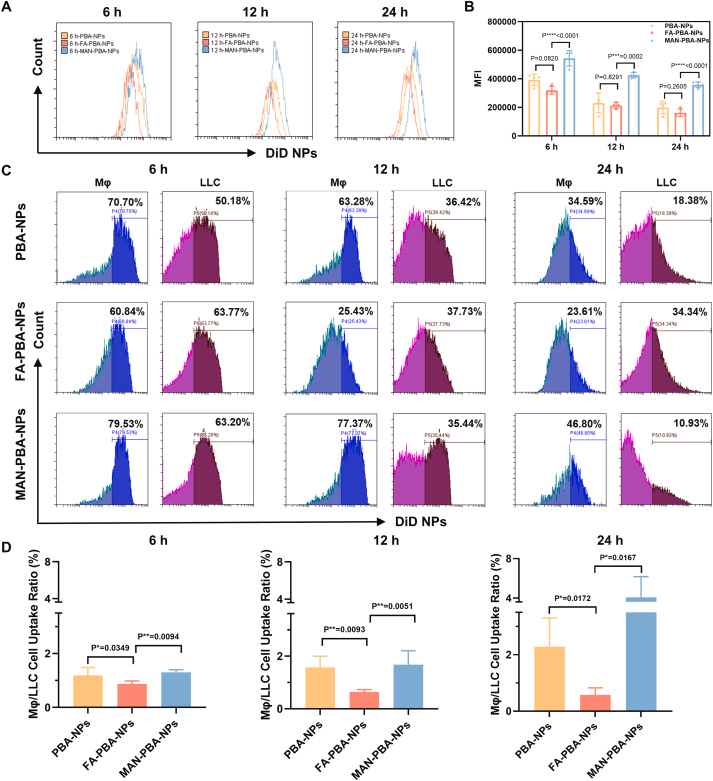
研究人员设计并综合了三种具有不同靶向配体的纳米粒子,分别是苯硼酸(PBA)修饰的纳米粒子(PBA-NPs)、PBA与叶酸(FA)结合的纳米粒子(FA-PBA-NPs)以及PBA与甘露糖(MAN)结合的纳米粒子(MAN-PBA-NPs)。这些纳米粒子具有相似的物理化学性质,但在与癌细胞和巨噬细胞的竞争性内化方面表现出不同的行为。In vitro实验结果表明,MAN-PBA-NPs更倾向于被巨噬细胞内化,而FA-PBA-NPs在癌细胞中的内化效率显著高于巨噬细胞。在小鼠肺癌模型中,经过内吸后,所有三种纳米粒子在肺部的保留量相似,但MAN-PBA-NPs更容易被肺部巨噬细胞拦截,从而限制了它们在肿瘤组织中的积累。相比之下,PBA-NPs和FA-PBA-NPs在肿瘤中的积累量高(约11.3%的剂量),其中FA-PBA-NPs在癌细胞中的内化率约为30%,显著高于PBA-NPs(约10-18%)。此外,载有淫羊藿苷(icaritin,ICT)的FA-PBA-NPs通过抑制Wnt/β-连蛋白信号通路,有效抑制了肿瘤生长,显示出优于其他纳米粒子的治疗效果。
观点
肺部直接投递的纳米粒子可以实现高肺部保留量和有效的肿瘤聚集,这一点在FA-PBA-NPs和PBA-NPs中得到了证实,它们在肺部的保留量达到了约63.5%的给药剂量。
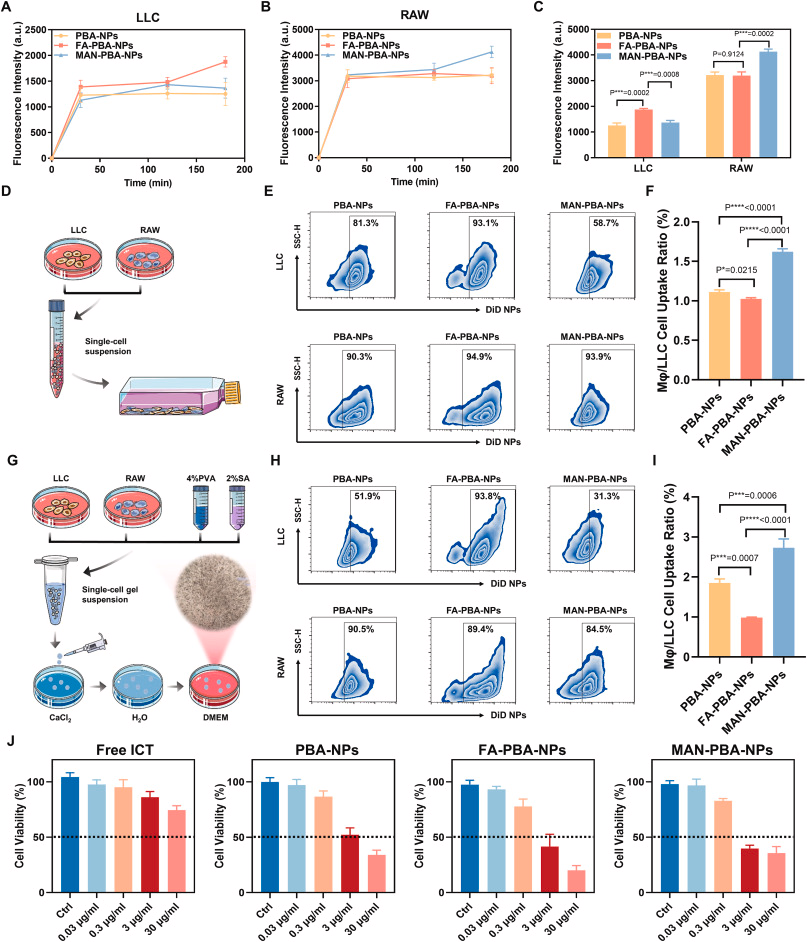
纳米粒子的靶向配体在竞争性内化中起关键作用,FA-PBA-NPs通过特异性靶向癌细胞表面的叶酸受体,显著提高了癌细胞的内化效率,而减少了巨噬细胞的拦截。
巨噬细胞在纳米粒子的肿瘤聚集和癌细胞靶向中扮演了双刃剑的角色,一方面它们可以作为纳米粒子的清除机制,减少了纳米粒子到达肿瘤组织的数量;另一方面,它们也可能作为药物的储存和释放部件,影响治疗效果。 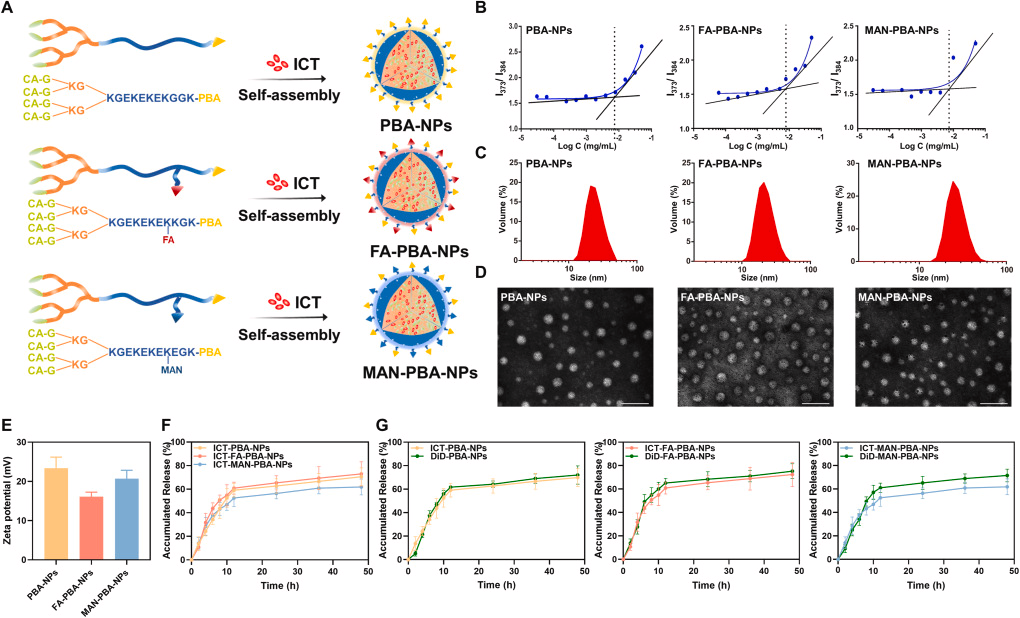
FA-PBA-NPs在抗肿瘤治疗中显示出优越的疗效,这得益于它们在癌细胞中的高效内化和对Wnt/β-连蛋白信号通路的抑制作用,从而有效抑制了肿瘤生长。
纳米粒子的设计和优化需要考虑到它们在体内的竞争性内化和药物释放特性,这对于提高治疗效果和减少副作用至关重要。
参考文献
Ge, D.; Ma, S.; Sun, T.; Li, Y.; Wei, J.; Wang, C.; Chen, X.; Liao, Y. Pulmonary Delivery of Dual-Targeted Nanoparticles Improves Tumor Accumulation and Cancer Cell Targeting by Restricting Macrophage Interception in Orthotopic Lung Tumors. Biomaterials 2025, 315, 122955. https://doi.org/10.1016/j.biomaterials.2024.122955.