【Biomaterials】金纳米点搭载VEGF开辟糖尿病周围神经病变治疗新途径
总结
该研究开发了一种载有VEGF的ROS响应型金纳米点,用于改善糖尿病II型外周神经病变(DPN)的结构和功能,并通过动物实验验证了其有效性。
摘要
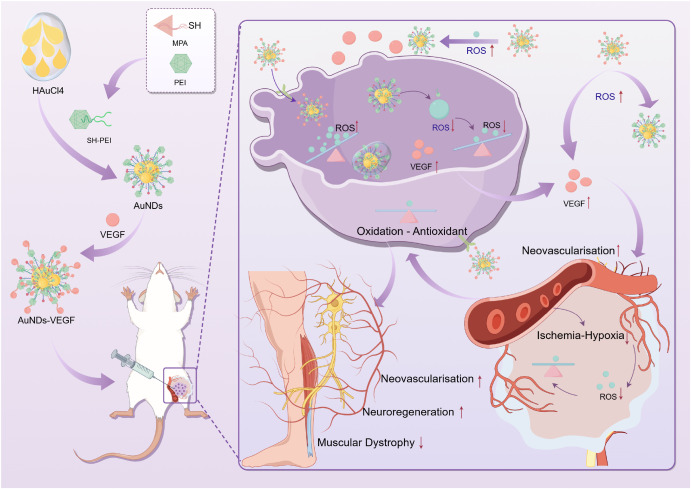
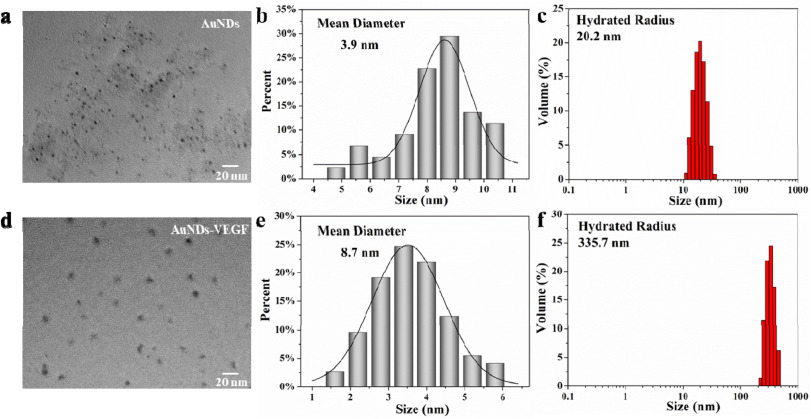
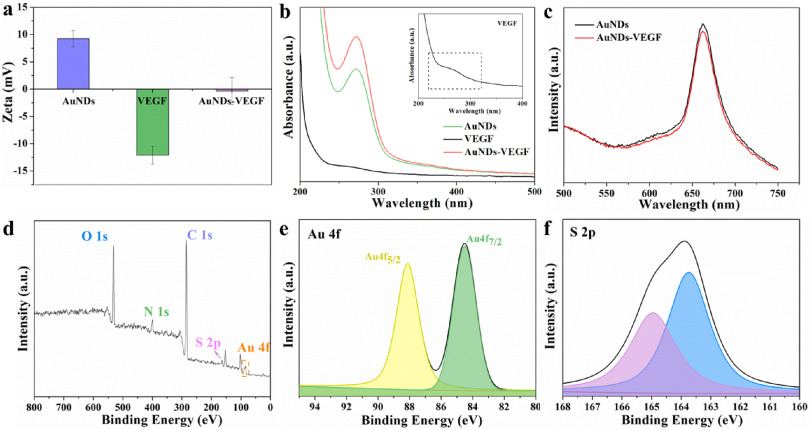
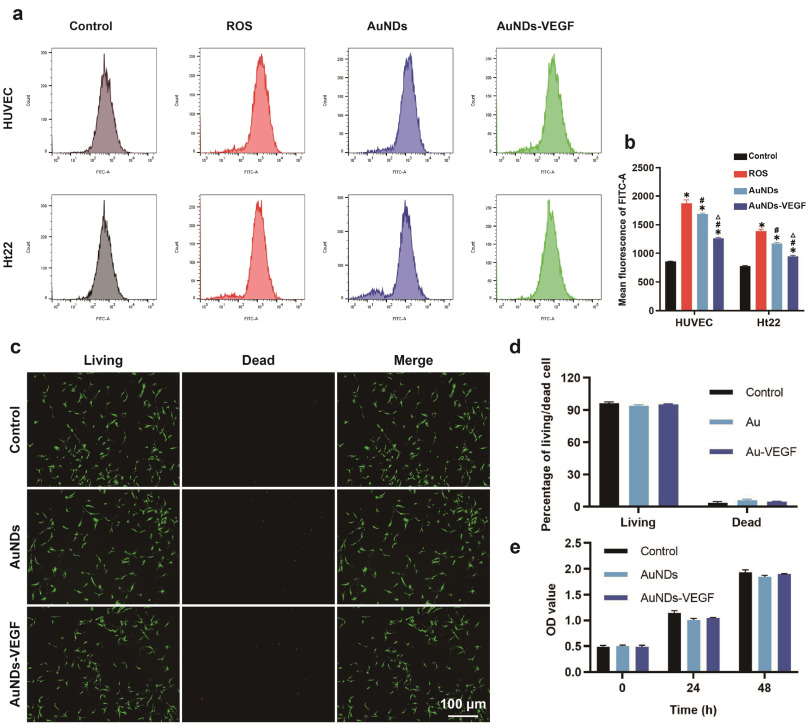
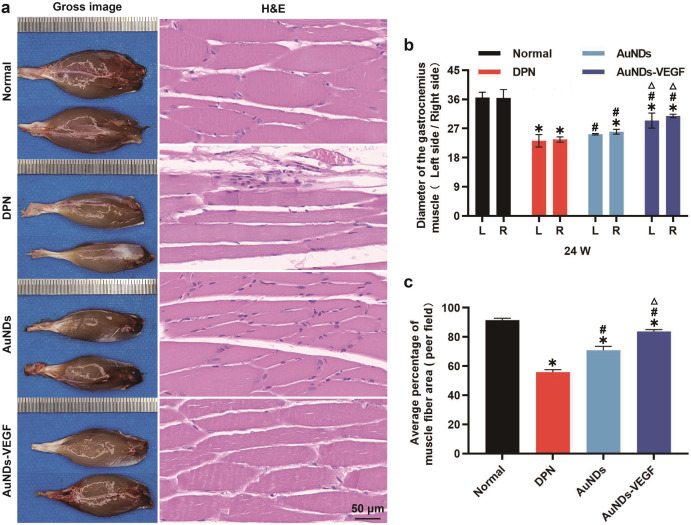
在这项研究中,研究者们成功合成了一种功能化的金纳米点(AuNDs),通过共价键合3- mercaptopropionic酸(MPA)与聚乙二醇烯(PEI)制备了SH-PEI配体,并通过氢氧化铵还原法将其与金离子反应,制备出ROS响应型的AuNDs。基于电静作用,研究者们将血管内皮生长因子(VEGF)负载到AuNDs上,形成了AuNDs-VEGF纳米复合物。实验结果表明,AuNDs和AuNDs-VEGF都具有良好的生物相容性和抗氧化能力,能够有效消耗过氧化物(ROS),并且在动物实验中显示出对DPN的改善作用。通过对糖尿病II型型的实验性大鼠模型的研究,发现AuNDs和AuNDs-VEGF能够提高神经传导速度,缩短神经传导延迟时间,促进神经肥大细胞血管的再生,改善腓神经的结构和功能,减少神经细胞的凋亡,并减轻腓肠肌的萎缩。其中,AuNDs-VEGF的效果更为显著,这可能是因为它不仅增加了对ROS的消耗,还通过改善微循环促进了神经再生。这些发现为糖尿病神经病变的治疗提供了新的理论基础和策略。
观点
ROS在DPN的病理生理过程中起着关键作用,过度的ROS会直接损害细胞,导致神经损伤,并激活炎症小体,介导囊裂。
VEGF在促进血管生成和改善微循环中发挥重要作用,它可以刺激血管内皮细胞的增殖,促进新血管的形成,提高神经组织的血液和氧气供应。
AuNDs和AuNDs-VEGF具有良好的抗氧化能力和生物相容性,能够在不引起细胞毒性的情况下,有效地消耗ROS,减轻其对细胞的损害。
AuNDs-VEGF在治疗DPN方面显示出更大的潜力,因为它能够在ROS的微环境中释放VEGF,不仅增加了对ROS的消耗,还改善了神经的血供和氧气供应,减少了ROS的产生,促进了受损神经的再生。
动物实验结果证实了AuNDs和AuNDs-VEGF在改善DPN方面的有效性,包括提高神经传导速度,缩短传导延迟,增加传导波纹幅度,以及改善腓神经的结构和功能。
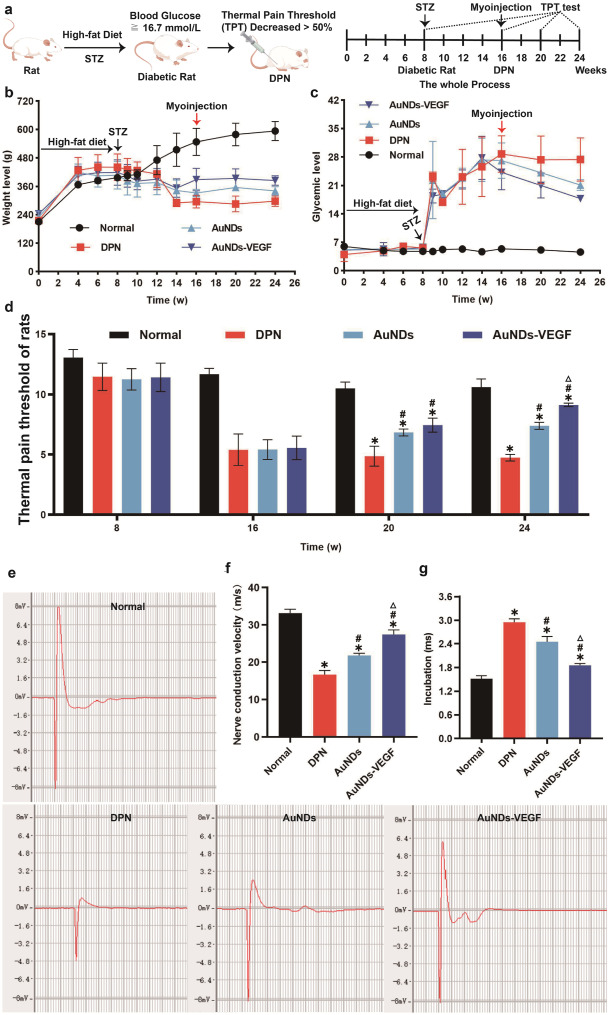
AuNDs-VEGF能够减少神经细胞的凋亡和腓肠肌的萎缩,这表明这种纳米复合物不仅能够改善神经功能,还能够改善神经对肌肉的驱动和稳态。
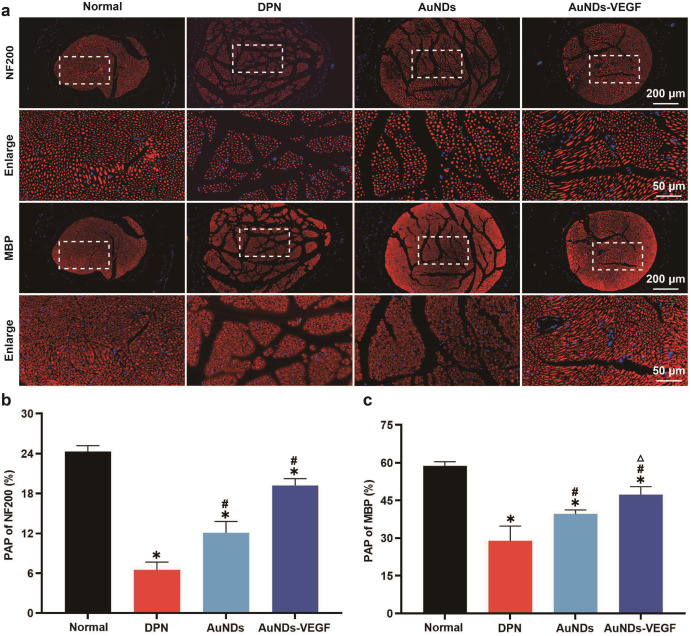
研究成果为糖尿病相关神经病变的治疗提供了新的策略,并且可能在治疗其他类型的神经损伤中也有应用前景。
参考文献
Ou, X.; Wang, Z.; Yu, D.; Guo, W.; Zvyagin, A. V.; Quan Lin; Qu, W. VEGF-Loaded ROS-Responsive Nanodots Improve the Structure and Function of Sciatic Nerve Lesions in Type II Diabetic Peripheral Neuropathy. Biomaterials 2024, 122906. https://doi.org/10.1016/j.biomaterials.2024.122906.