【Biomaterials】超深层肿瘤递送,高靶向性,新型药物递送系统促进药物深层渗透,放大抗肿瘤疗效
总结
这篇研究开发了一种基于膜融合和细胞外颗粒(EVs)技术的新型抗肿瘤药物递送系统,通过使用AS1411 aptamer和髓膜病毒糖蛋白(VSV-G)增强的细胞膜包裹的纳米光敏剂,能够有效地锚附到肿瘤细胞膜上,随后利用EVs的分泌过程将药物深入肿瘤组织中,从而增强光疗效果,提高抗肿瘤疗效。
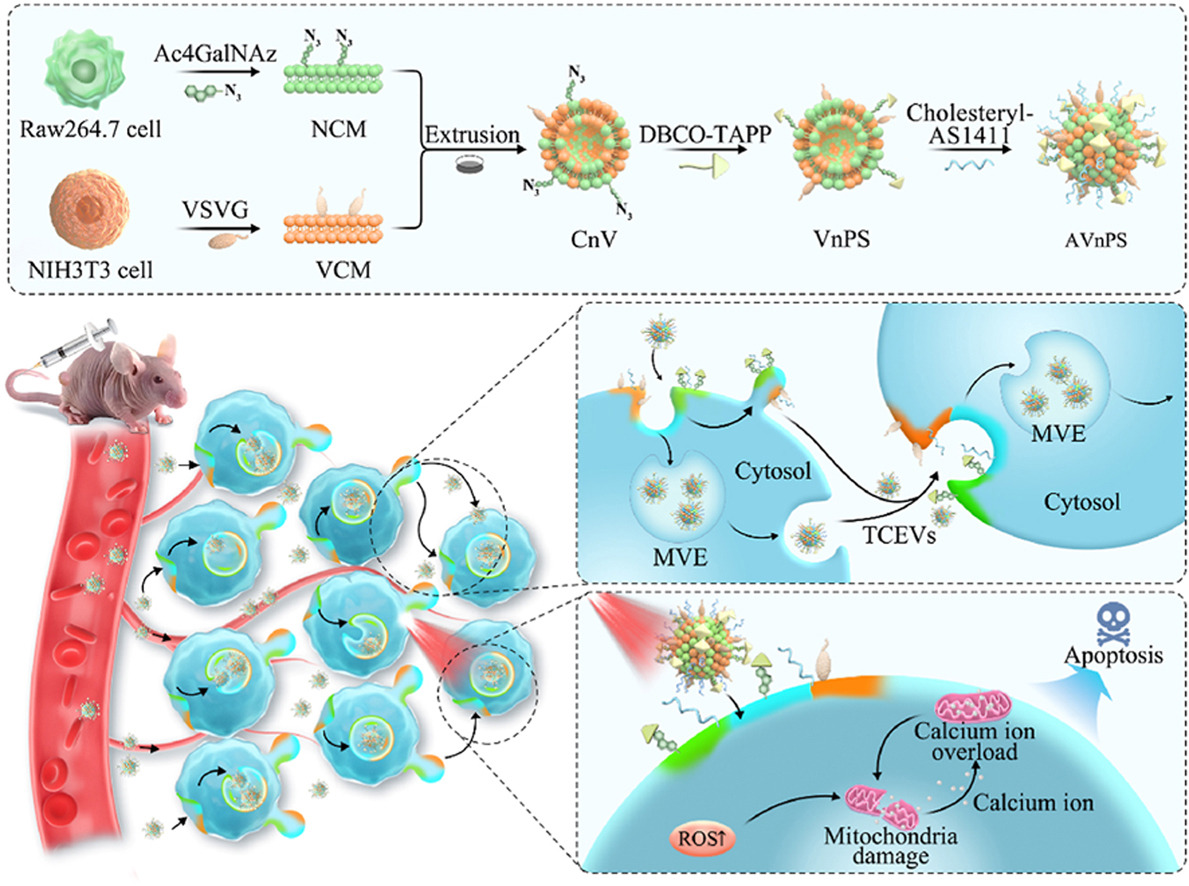
摘要
在这项研究中,研究者们构建了一种新型的纳米膜药物递送系统,利用AS1411 DNA aptamer进行肿瘤特异性靶向,以及VSV-G蛋白促进的细胞膜融合能力,将光敏剂有效地锚定到肿瘤细胞膜上。这种系统能够利用EVs的自然分泌过程,将药物深入肿瘤组织中,实现深度渗透。研究者们通过体外和体内实验验证了该系统在提高光疗效果和抗肿瘤疗效方面的潜力。首先,他们合成了DBCO-TAPP光敏剂,并通过点击反应将其修饰到细胞膜纳米颗粒(CnV)上,形成了含有VSV-G的纳米光敏剂(VnPS)。随后,通过脂质插入方法将AS1411 aptamer连接到VnPS上,形成了具有靶向和膜融合能力的APT-VnPS(AVnPS)。研究者们通过SDS-PAGE、TEM、DLS等技术对AVnPS进行了物理和化学性质的特征化。通过细胞实验和3D多细胞球实验,研究者们证明了AVnPS在提高肿瘤靶向和深度渗透方面的能力。此外,研究还揭示了EVs在药物递送和深度渗透中的关键作用,通过抑制EVs分泌的方式进一步证实了其在药物递送中的重要性。最后,通过动物实验,研究者们证明了AVnPS在体内的安全性和显著的抗肿瘤效果。这项研究的成果为肿瘤深度渗透型药物递送系统的设计和应用提供了新的思路和方法。
观点
基于EVs的药物递送系统能够实现肿瘤深度渗透:
研究者们利用EVs的自然分泌过程,设计了一种能够将药物深入肿瘤组织中的递送系统,这种系统通过AS1411 aptamer和VSV-G蛋白的共同作用,使得光敏剂能够有效地锚附到肿瘤细胞膜上,并随EVs的分泌而逐层深入肿瘤组织。 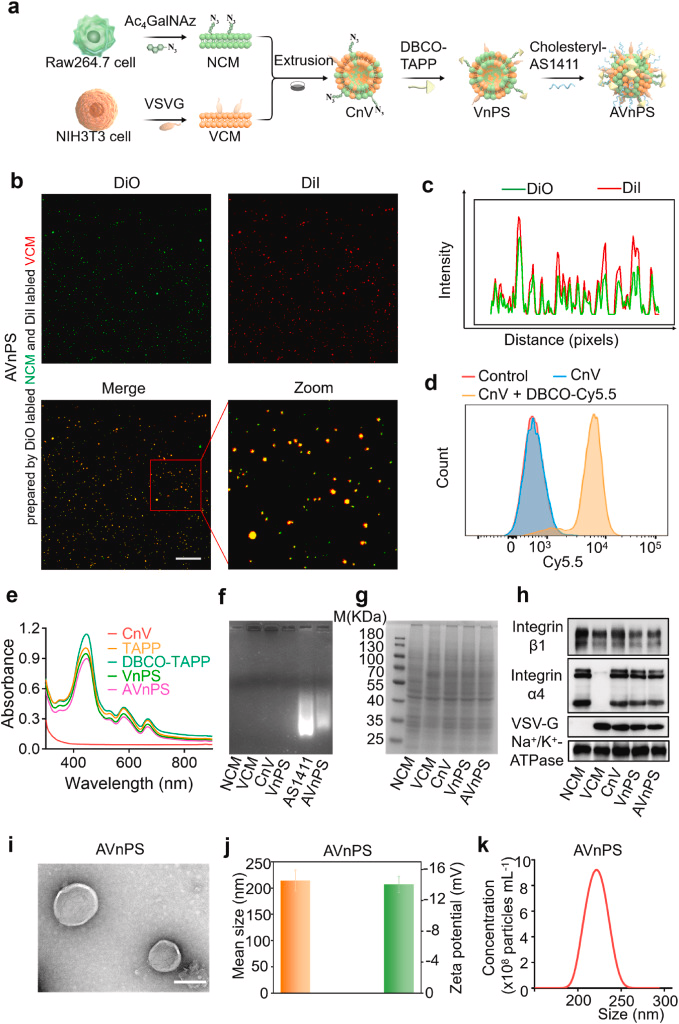
AS1411 aptamer和VSV-G蛋白在递送系统中的作用:
AS1411 aptamer负责肿瘤特异性靶向,而VSV-G蛋白则通过促进细胞膜融合,增强了药物的锚定效率。这种双重作用的结合,提高了药物递送系统的精准性和效率。 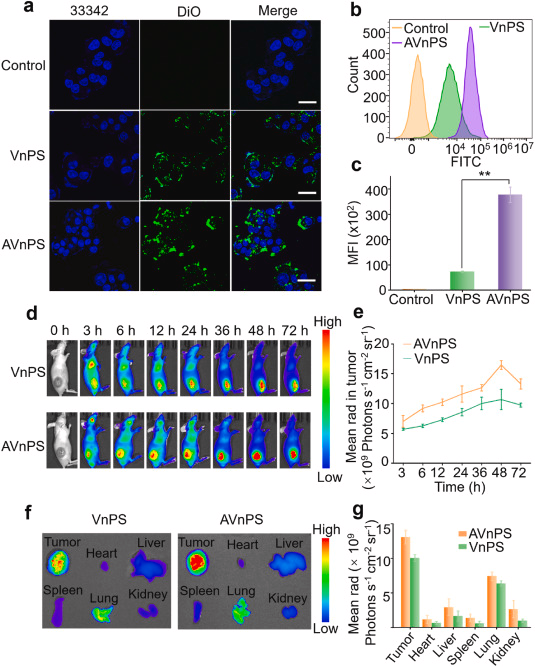
AVnPS的物理和化学性质特征化:
研究者们通过一系列的实验技术,包括SDS-PAGE、TEM和DLS,对AVnPS进行了详细的性质特征化,确保了其在体外和体内的稳定性和一致性。 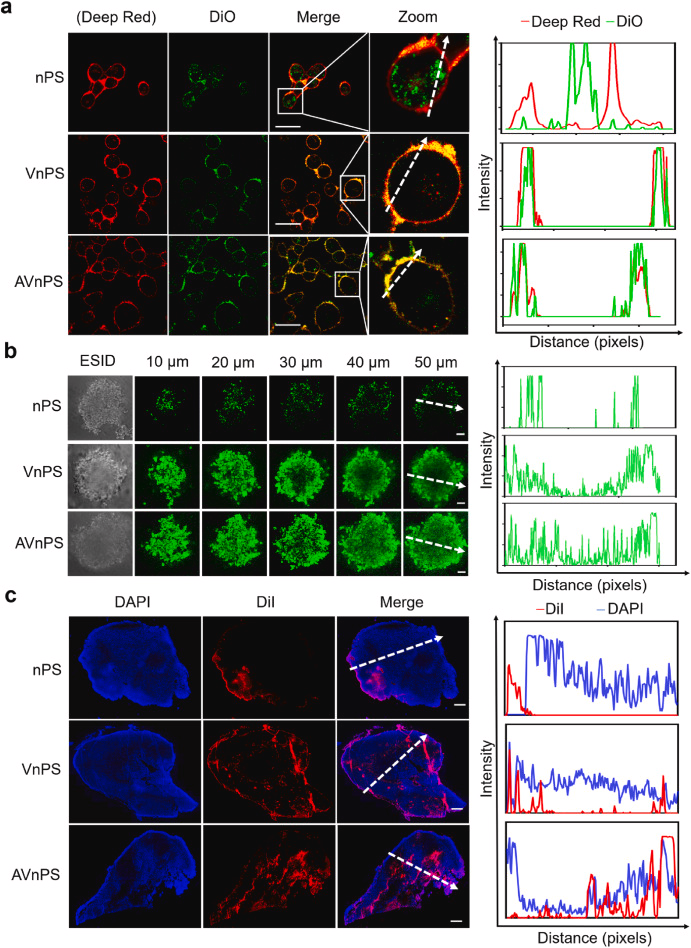
体外实验验证了AVnPS的肿瘤靶向和深度渗透能力:
通过细胞实验和3D多细胞球实验,研究者们证明了AVnPS在提高肿瘤靶向和深度渗透方面的能力,这为进一步的体内实验和临床应用奠定了基础。
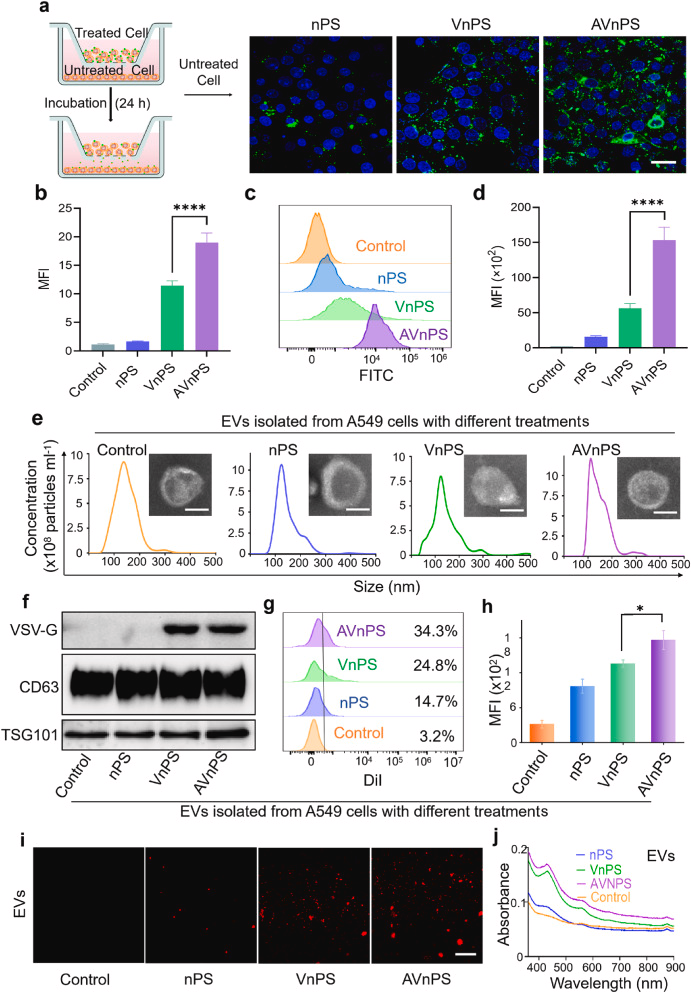
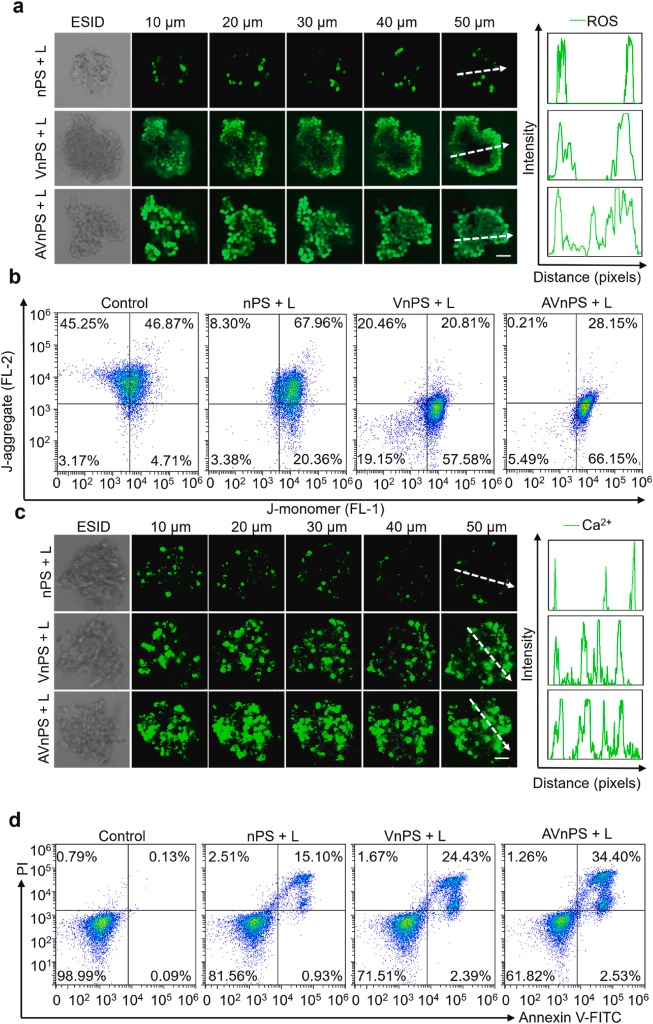
EVs在药物递送中的关键作用:
研究中通过抑制EVs分泌的方式,显示了EVs在药物递送和深度渗透中的重要性。这一发现为EVs的药物递送机制提供了新的见解。
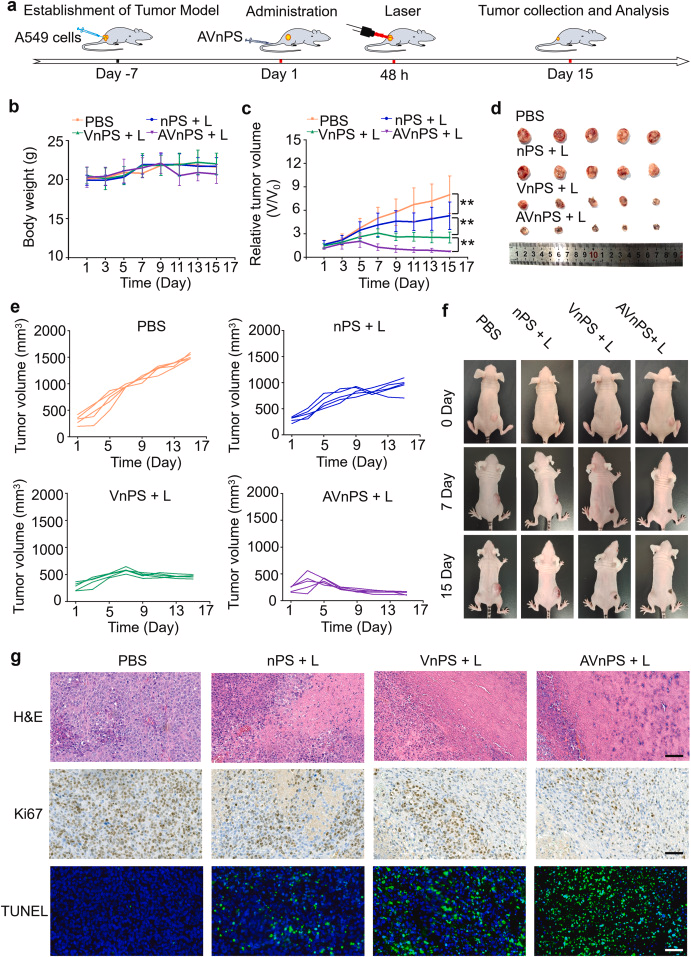
体内实验证实了AVnPS的安全性和显著的抗肿瘤效果:
在动物实验中,AVnPS展现了良好的生物相容性和显著的抗肿瘤效果,这表明了该系统在潜在的临床应用中的巨大潜力。
参考文献
Gao, M.; Sun, Q.; Zhang, R.; Shan, G.; Zhang, H.; Peng, R.; Liu, M.; Sun, G.; Qiao, L.; Li, Y.; He, X. Extracellular Vesicles-Hitchhiking Boosts the Deep Penetration of Drugs to Amplify Anti-Tumor Efficacy. Biomaterials 2025, 314, 122829. https://doi.org/10.1016/j.biomaterials.2024.122829.