【Adv. Mater.】什么原子这么神奇,只用一个就可以调控材料的抗菌性能。
总结
本研究发现,通过将锰离子固定在氮掺杂石墨烯酸(NGA)上形成的单原子锰材料(NGA-Mn)能够克服细菌耐药性,展现出广谱的抗菌活性,并且对人类细胞具有高度的生物相容性。
摘要
在这项研究中,研究者们通过将锰离子固定在氮掺杂石墨烯酸(NGA)上,成功开发了一种新型的单原子抗菌材料(NGA-Mn)。这种材料不仅能够有效抑制多种耐药细菌的生长,包括大肠杆菌、金黄色葡萄球菌和铜绿假单胞菌等,而且在体内外实验中都表现出强大的抗菌活性。NGA-Mn的最小抑菌浓度(MIC100)值介于4-16 mg Mn/L之间,这些值与现有抗生素相当或更低。更重要的是,NGA-Mn在连续传代30代细菌后仍然能够保持其抗菌活性,没有出现明显的耐药性发展,这表明它能够规避细菌的耐药机制。此外,NGA-Mn对人类细胞的毒性极低,即使在高达2200 mg/L的浓度下,也对人类细胞的生长和代谢活动没有显著影响。研究人员进一步探讨了NGA-Mn的抗菌机制,发现NGA-Mn通过与细胞膜外的多个碳水化合物生物分子形成多点结合,从而阻断了细胞壁的合成过程,导致细胞死亡。这一发现为克服细菌耐药性提供了新的策略,并可能为未来的抗菌药物开发提供新的思路。
细节
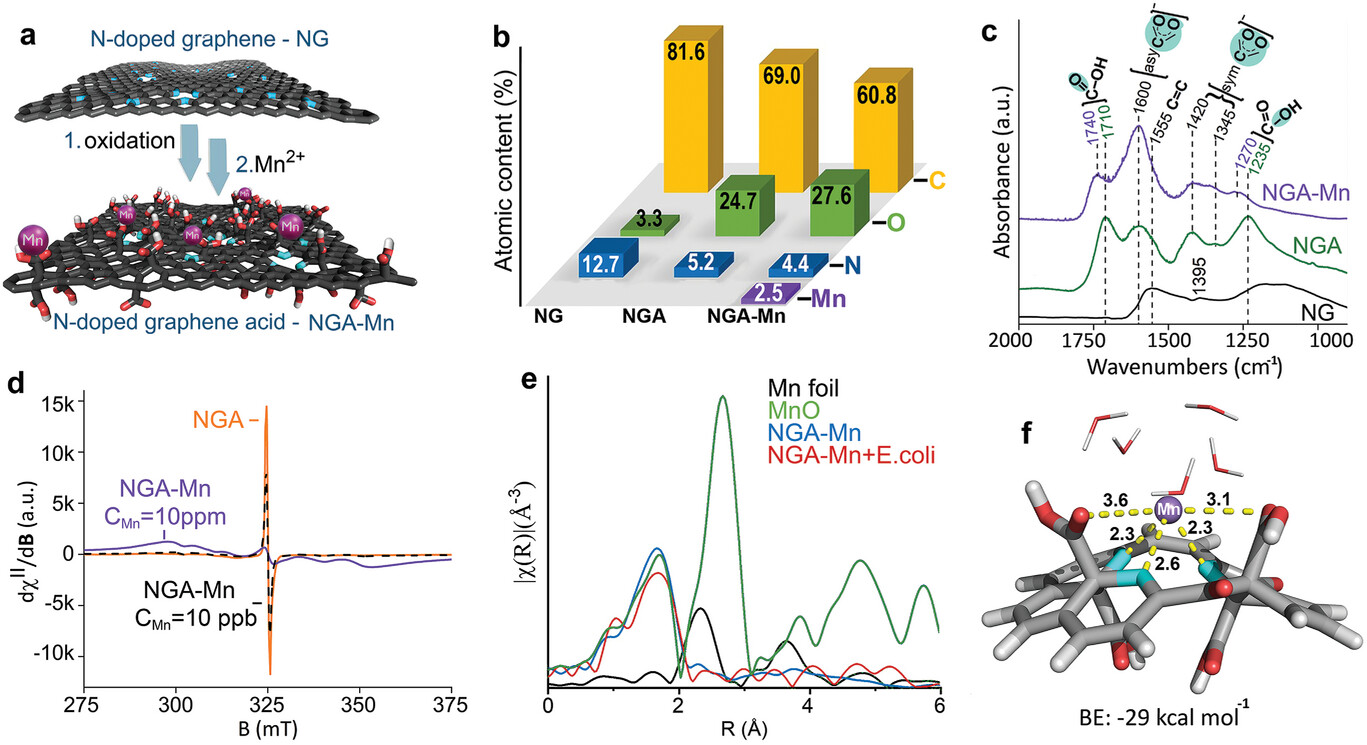
材料的合成及表征
通过高分辨率透射电子显微镜(HR-TEM)和扫描电子显微镜(SEM)对 NG、NGA 和 NGA-Mn 的分析表明,NG 由尺寸≈600 nm 的少层石墨烯薄片组成(图 a),而 NGA 薄片较小,约为 150 nm,这是由其合成过程中的氧化切割造成的(图 b)。 NGA 的元素化学图谱证实,薄片上的氮和氧覆盖均匀,与碳的空间分布一致(图 c-f)。 高角度环形暗场扫描透射电子显微镜(HAADF-STEM,图 g)证实,NGA 与 Mn2+ 离子相互作用后,NGA 表面没有观察到锰基 NPs,这与 EXAFS 的结果相吻合。 元素化学图谱(图 h、i)显示石墨烯薄片上均匀地覆盖着锰阳离子以及 NGA 羧基上的氧原子。

抗菌特性
NGA-Mn 针对革兰氏阳性和革兰氏阴性抗生素易感细菌以及多种对抗生素高度耐药的细菌进行了评估,这些细菌包括耐甲氧西林金黄色葡萄球菌、耐万古霉素粪肠球菌、耐多药大肠埃希菌和铜绿假单胞菌、广谱β-内酰胺酶或产碳青霉烯酶的泄殖腔肠杆菌(AmpC)、耐多药大肠埃希菌和铜绿假单胞菌、广谱β-内酰胺酶或产碳青霉烯酶的泄殖腔肠杆菌(AmpC)、 耐多药大肠杆菌和铜绿假单胞菌、产广谱β-内酰胺酶或碳青霉烯酶的泄殖腔肠杆菌(AmpCβ-内酰胺酶)、肺炎克雷伯菌(KPC-3 碳青霉烯酶)、肺炎克雷伯菌(NDM-1)、鲍曼不动杆菌(OXA-23、OXA-51-like)和耐可乐定大肠杆菌(mcr-1)。 MIC100 值范围极低,为 4-16 mgMn L-1(或相对于 NGA-Mn 总质量为 90-355 mg L-1,图 a),而纯 NGA 和 Mn2+ 盐在浓度高达 1500 mg L-1 时没有显示出任何抗菌活性。 有趣的是,NGA-Mn 的 MIC100 值与最先进抗生素的 MIC100 值相似甚至更低,同时,正如后面所讨论的,NGA-Mn 对细菌的耐药性具有持久性。此外,与时间相关的杀菌活性表明,NGA-Mn 在培养 1 小时后就能完全消灭大肠杆菌,在培养 12 小时后就能完全消灭金黄色葡萄球菌。 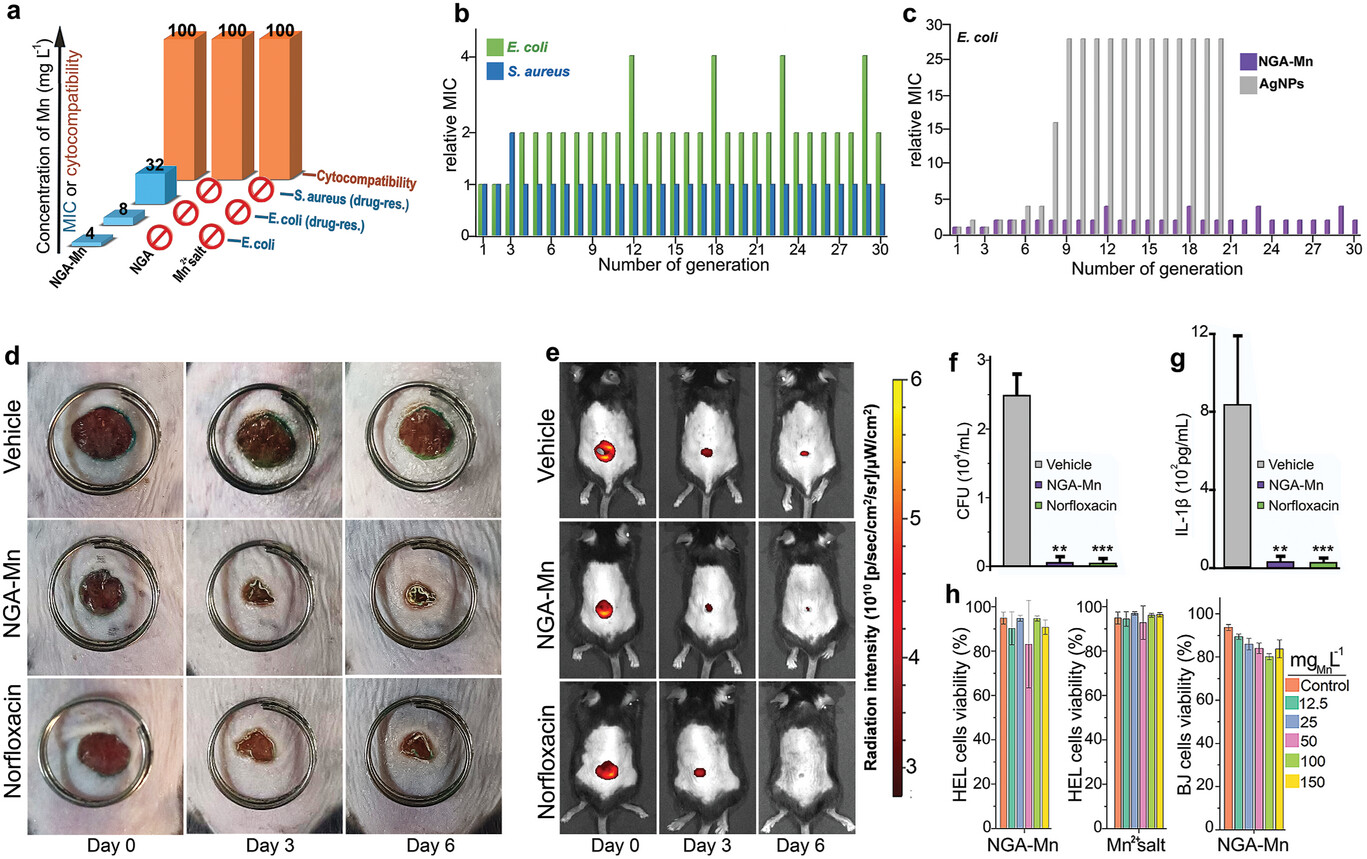
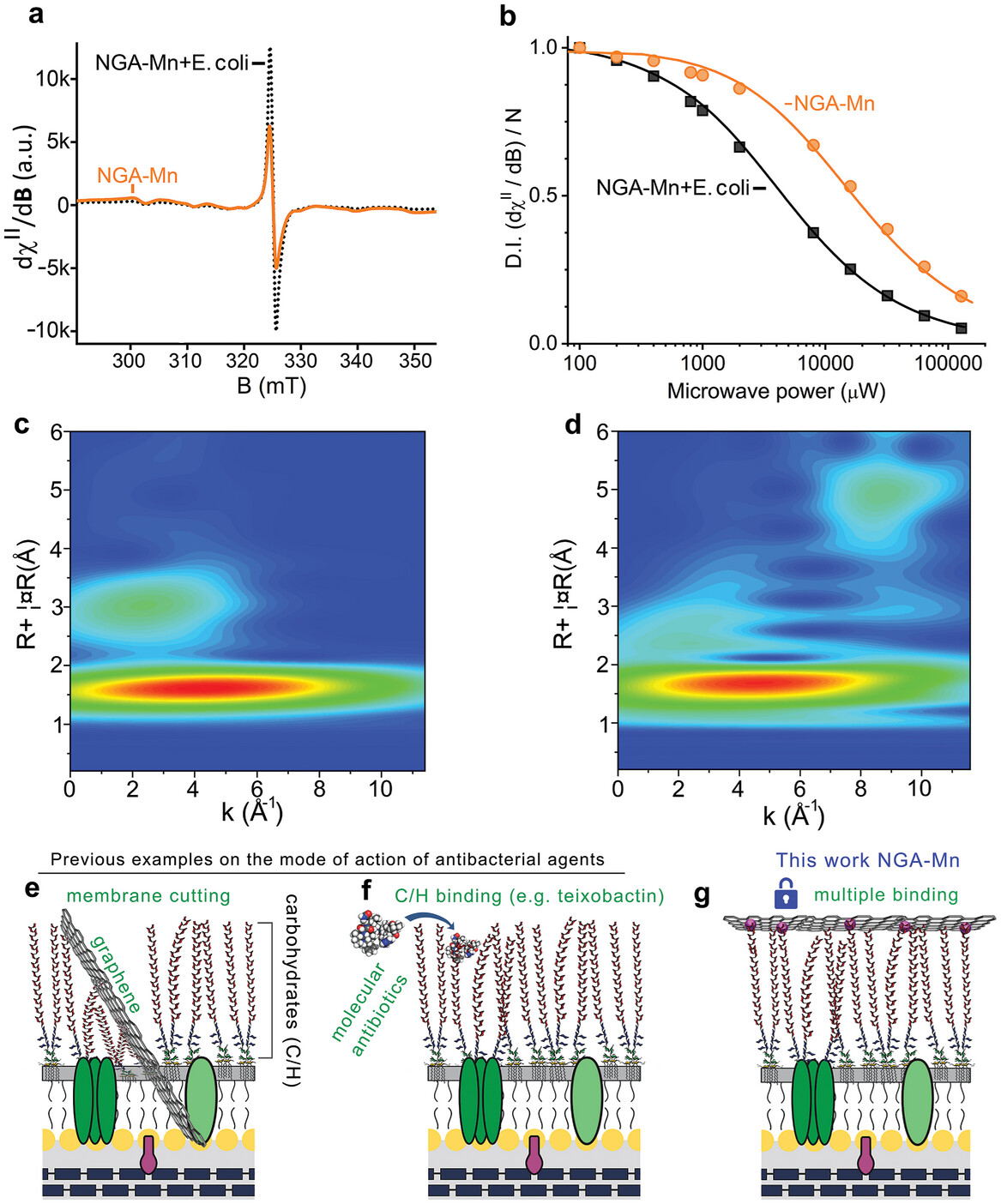
抗菌机理
NGA-Mn 功能的可能机制:i)由于游离 Mn2+ 阳离子和游离 NGA 都不产生任何抗菌效果;ii)NGA-Mn 不会穿透细胞膜;iii)NGA-Mn 与细菌混合后立即与细菌结合,因此抗菌作用显然来自 150 nm-NGA 片上的大量固定 Mn2+ 离子与多种外膜碳水化合物生物大分子的集体结合。
参考文献
D. Panáček, J. Belza, L. Hochvaldová, Z. Baďura, G. Zoppellaro, M. Šrejber, T. Malina, V. Šedajová, M. Paloncýová, R. Langer, L. Zdražil, J. Zeng, L. Li, E. Zhao, Z. Chen, Z. Xiong, R. Li, A. Panáček, R. Večeřová, P. Kučová, M. Kolář, M. Otyepka, A. Bakandritsos, R. Zbořil, Single Atom Engineered Antibiotics Overcome Bacterial Resistance. Adv. Mater. 2024, 2410652. https://doi.org/10.1002/adma.202410652