【Biomaterials】不仅pH响应,还能增强Fenton反应、促进铜死亡,这款仿生纳米材料能够有效缓解骨髓炎
总结
本研究开发了一种基于骨髓源性间充质膜包裹的纳米酶载体,用于治疗脊椎炎,该载体能够在酸性微环境下释放铜和铁离子,通过增强Fenton反应和促进铜死亡来有效消除细菌,并通过mRNA测序揭示了其在细菌中扰乱的生物学机制。 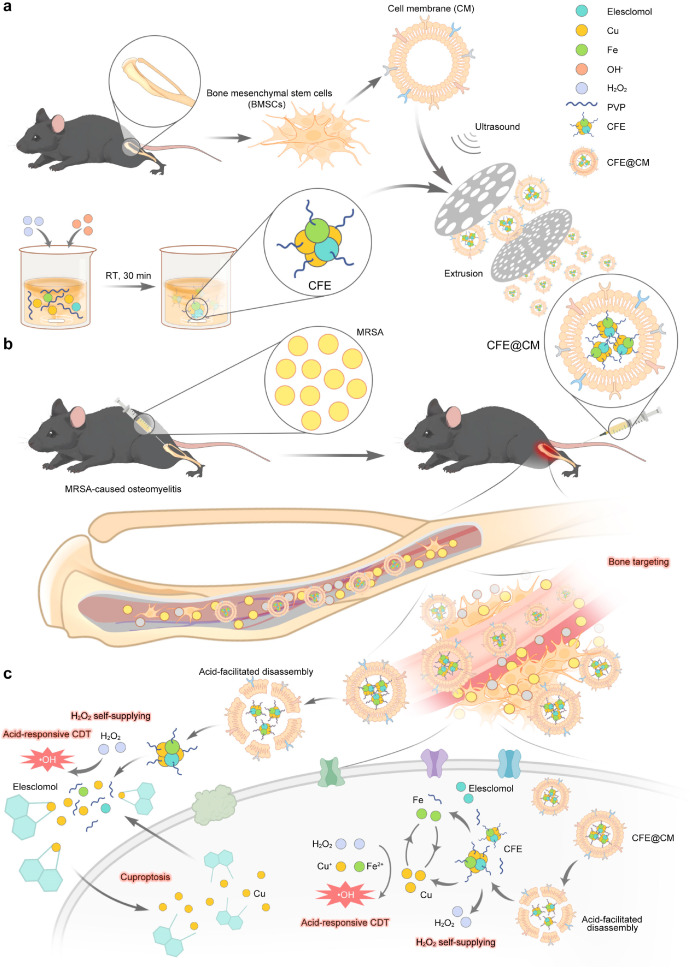
摘要
在这项研究中,研究者们构建了一种骨髓源性间充质膜包裹的纳米酶载体(CFE@CM),用于治疗脊椎炎。这种载体具有酸性响应和自我供应羟基化物的特性,能够在脊椎炎的酸性感染环境中释放铜和铁离子,以及Elesclomol(ELC),从而增强化学动力疗法(CDT)的疗效,并诱导铜死亡。研究发现,CFE@CM纳米载体能够有效抑制金黄色葡萄球菌(S. aureus)和耐甲氧西林金黄色葡萄球菌(MRSA)的生长,尤其是在酸性条件下。此外,该载体还能够抑制细菌生物膜的形成,并通过提高细菌内的活性氧(ROS)水平来增强其抗菌作用。在体实验中,CFE@CM展现了优异的生物相容性和骨髓靶向性,能够有效减轻MRSA引起的脊椎炎。通过RNA测序,研究者们发现CFE@CM对MRSA的抗菌机制可能与扰乱细菌中的铜离子结合、氧化磷酸化、肽聚合和代谢等生物学过程有关。这一发现为脊椎炎的临床治疗提供了一种新的无抗药物的治疗策略。
观点
- 脊椎炎是一种主要影响儿童和老年人的骨骼感染性疾病,传统的治疗方法包括长期使用高剂量的抗生素和去菌术,但这些方法存在药物抗性和严重副作用的问题。因此,开发新的无抗药物的治疗方法对于克服这些问题至关重要。
- 铜是一种必需的微量元素,对于人体的多种生物学功能至关重要,它可以增强传统的Fe基Fenton反应,并通过Fenton样反应产生高度生物毒的羟基自由基(•OH)。此外,过量的铜参与也可以诱导铜死亡,进一步扩大了其生物毒性。
- 铜死亡是一种新近发现的铜依赖性死亡形式,它通过破坏铁硫(Fe-S)簇蛋白并促使三羧酸循环中的脂肪酸化合物聚集来发挥作用。虽然铜死亡在癌症治疗中的潜力已被报道,但其在消除脊椎炎感染中的可能性尚未得到充分探索。
- Elesclomol(ELC)是一种已经进入临床评估的铜离子载体,它能够稳定地与Cu(1:1比例)结合并将铜离子运输到细胞内部。ELC能够显著增强铜的生物毒性,因此,集成了铜和ELC的纳米平台对于治疗MRSA引起的脊椎炎具有很大的临床转化价值。
- 细胞膜伪装是一种有前途的生物模拟策略,它可以赋予纳米系统特定的组织靶向能力,并提供可接受的生物相容性、延长的系统循环时间以及降低的免疫原性。
- CFE@CM纳米载体的合成和特性表明,它们具有在感染部位释放Cu和Fe离子以及ELC的能力,并且能够在酸性条件下自我供应羟基化物,从而在脊椎炎的感染部位发生增强的Fenton反应和铜死亡。
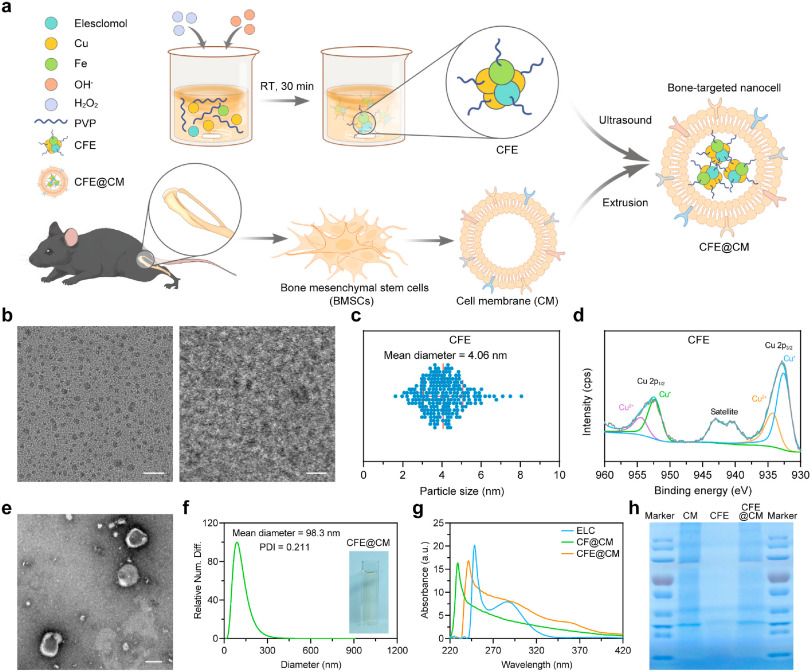 图 1. BMSC 膜构建的 CFE@CM 纳米材料的合成与表征。
图 1. BMSC 膜构建的 CFE@CM 纳米材料的合成与表征。
 图 2. CFE@CM 纳米细胞的 H2O2 自供能力和 pH 响应性 Fenton 反应的表征。
图 2. CFE@CM 纳米细胞的 H2O2 自供能力和 pH 响应性 Fenton 反应的表征。
- 在体实验中,CFE@CM纳米载体展现了优异的生物相容性和骨髓靶向性,能够有效减轻MRSA引起的脊椎炎,并且其治疗效果与抗生素糖皮质酮类药物相当。
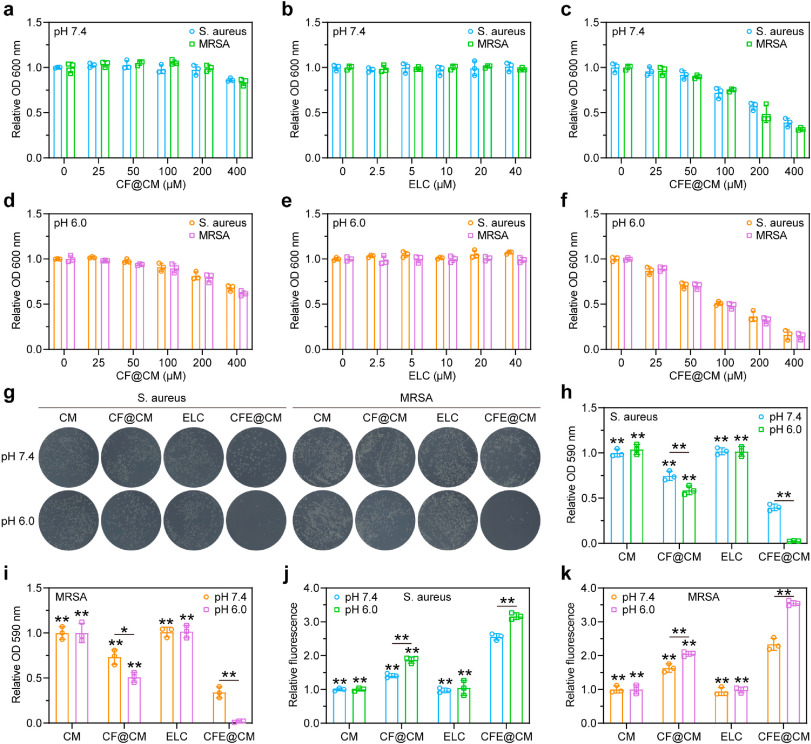 图3. CFE@CM 纳米细胞的体外抗菌效果
图3. CFE@CM 纳米细胞的体外抗菌效果 - mRNA测序结果揭示了CFE@CM纳米载体对MRSA的抗菌机制,即通过扰乱与铜离子结合、氧化磷酸化、肽聚合和代谢等生物学过程相关的基因表达,进一步解释了体内外实验结果。
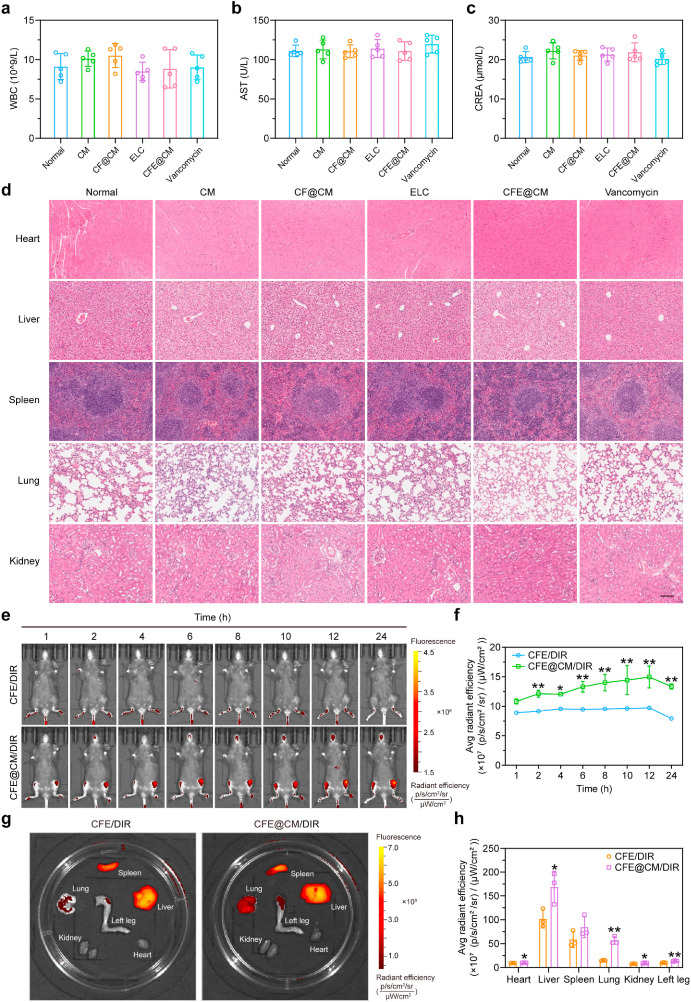 图4. CFE@CM 纳米细胞在体内的生物相容性和生物分布
图4. CFE@CM 纳米细胞在体内的生物相容性和生物分布  图5. CFE@CM 纳米细胞对体内骨髓炎的疗效
图5. CFE@CM 纳米细胞对体内骨髓炎的疗效
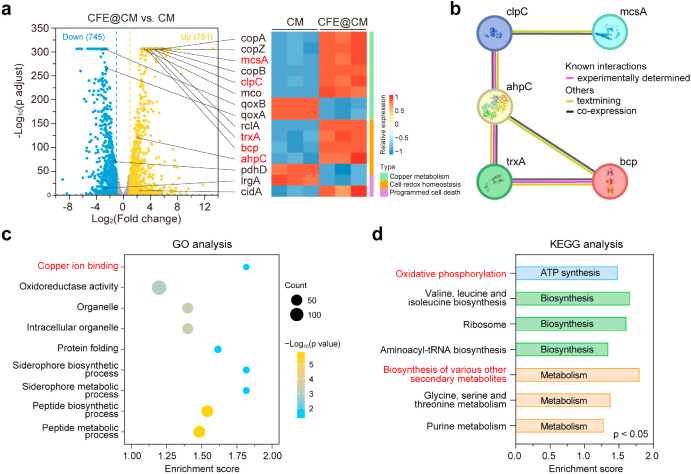 图6. RNA-seq揭示的CFE@CM纳米细胞抑制骨髓炎的分子机制(n = 3)
图6. RNA-seq揭示的CFE@CM纳米细胞抑制骨髓炎的分子机制(n = 3)
参考文献
Li, Y.; Li, J.; Zhong, Y.; Zhang, Q.; Wu, Y.; Huang, J.; Pang, K.; Zhou, Y.; Xiao, T.; Wu, Z.; Sun, W.; He, C. pH-Responsive and Nanoenzyme-Loaded Artificial Nanocells Relieved Osteomyelitis Efficiently by Synergistic Chemodynamic and Cuproptosis Therapy. Biomaterials 2024, 122762. https://doi.org/10.1016/j.biomaterials.2024.122762.