【Biomaterials】一种携带级联铂纳米酶的多功能纳米平台,可重塑肿瘤微环境,增强甲状腺癌的声动力/化疗扩增疗法
总结
本研究合成了一种多功能的生物模拟纳米载体,用于同时进行化疗和超声动力疗法(SDT),以治疗甲状腺癌,特别是非常恶性的肿瘤类型,即无差别化瘤细胞。

摘要
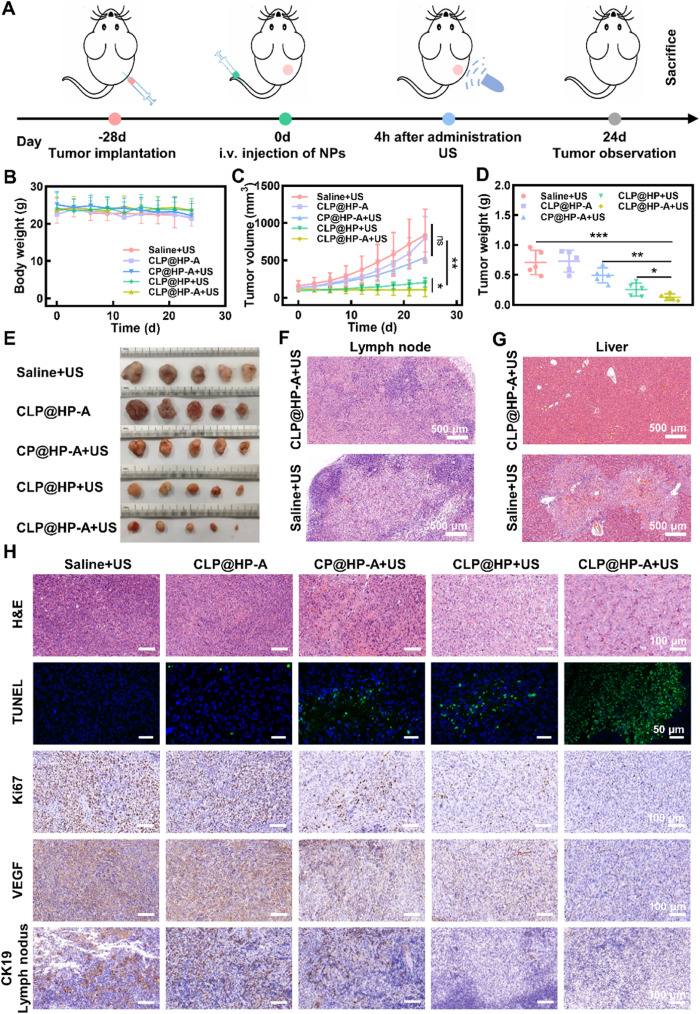
研究人员通过将光敏剂/Ce6和多靶点激酶抑制剂(Len)嵌入到带有铂纳米酶的ZIF-8纳米粒中,合成了一种名为CLP@HP-A的生物模拟纳米载体。CLP@HP-A载体具有靶向性,能够特异性结合甲状腺癌细胞表面的Galectin-3受体,通过受体介导的内吞作用进入细胞。在超声波激发下,Ce6能够产生大量的活性氧物种(ROS),导致肿瘤细胞死亡。此外,铂纳米酶能够通过催化H2O2分解为氧气(O2),缓解肿瘤微环境中的低氧状态,并增加ROS的产生,从而提高SDT的效率。Len在细胞内释放后,通过诱导细胞凋亡来杀死甲状腺癌细胞。实验结果表明,CLP@HP-A载体能够有效地内化到甲状腺癌细胞中,并在体内外都显示出对甲状腺癌的治疗效果,能够抑制肿瘤的生长和转移,同时具有良好的生物相容性。此外,研究还通过转录组学分析揭示了CLP@HP-A载体在治疗过程中可能涉及的多条信号通路,包括抗凋亡和抗炎反应等。
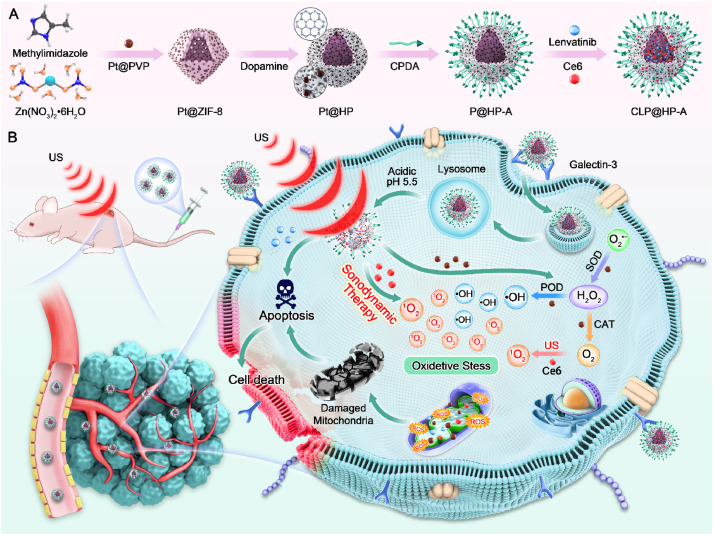
观点
- CLP@HP-A纳米载体的设计和合成:研究设计并合成了一种多功能的纳米载体CLP@HP-A,用于联合化疗和SDT治疗甲状腺癌。该载体由ZIF-8、铂纳米酶、Ce6和Len组成,具有靶向性和可响应性特点。
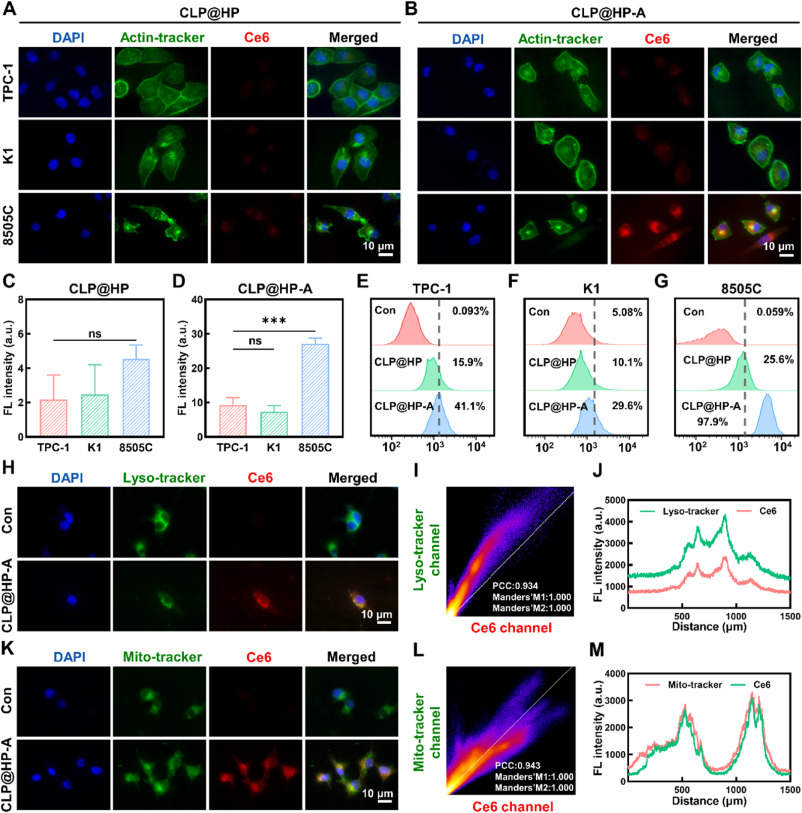
- Galectin-3受体的靶向性:CLP@HP-A载体通过特异性结合Galectin-3受体,利用受体介导的内吞作用有效进入甲状腺癌细胞,这一靶向性是通过载体表面的CPDA修饰实现的。
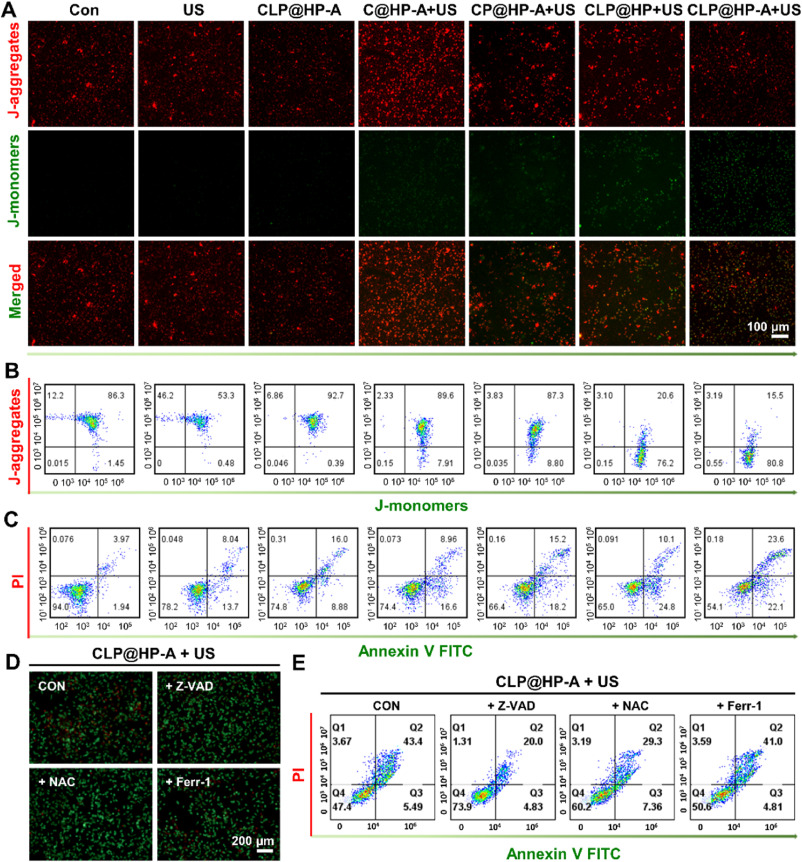
- 超声动力疗法(SDT)的作用机制:在超声波激发下,Ce6能够产生大量的ROS,这些ROS对肿瘤细胞具有毒性,能够诱导细胞凋亡。同时,铂纳米酶的CAT-like和POD-like活性有助于缓解肿瘤微环境中的低氧状态,并增加ROS的产生,从而提高SDT的效率。
- Len的抗肿瘤作用:Len在细胞内释放后,能够通过诱导细胞凋亡来杀死甲状腺癌细胞,这一效果与SDT作用相协同,共同提高了治疗效果。
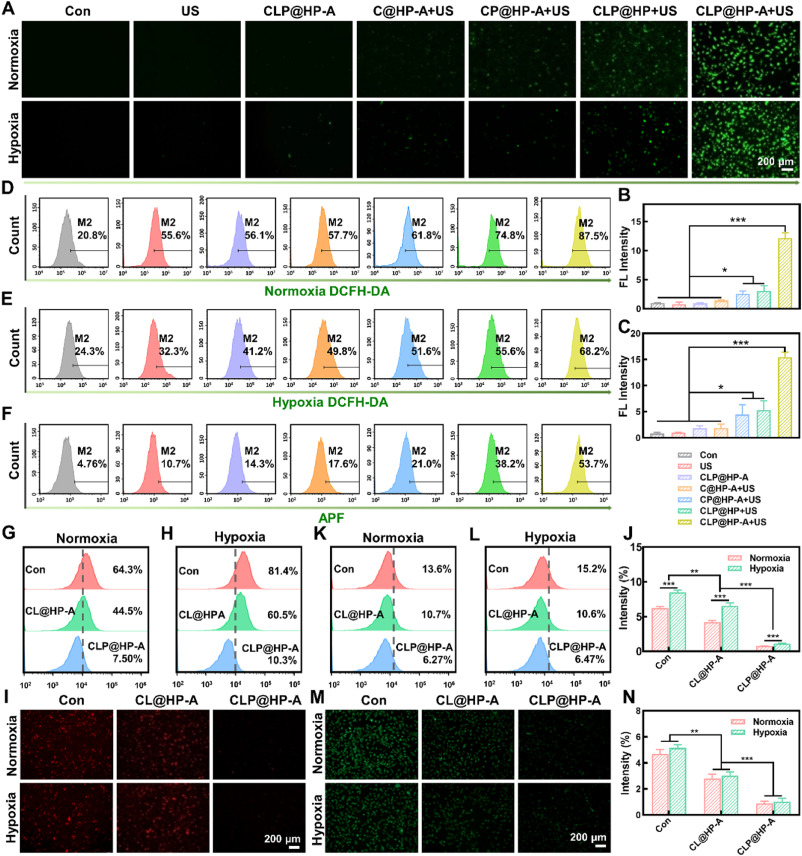
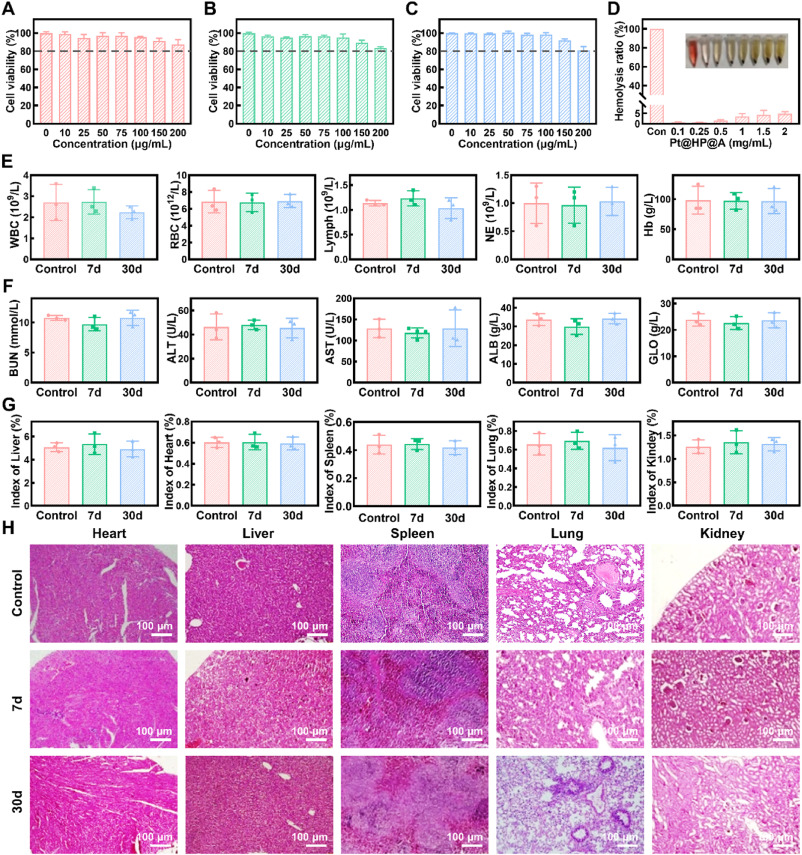
- CLP@HP-A载体的生物相容性和安全性:实验结果显示,CLP@HP-A载体在体内外都具有良好的生物相容性,没有显著的毒性,这为其临床应用提供了可能性。
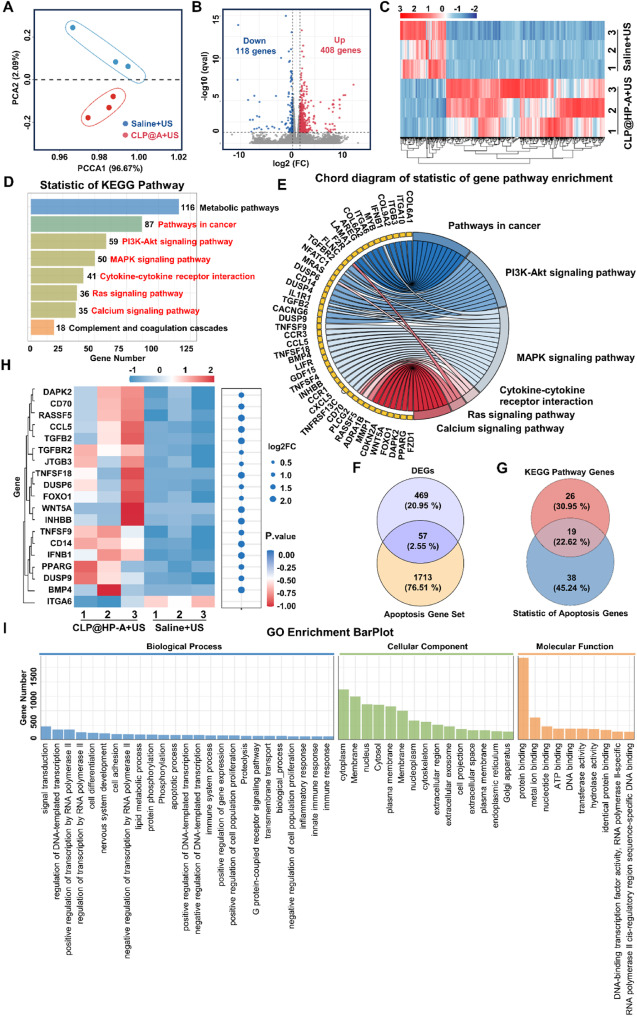
- 转录组学分析揭示的治疗机制:通过转录组学分析,研究人员发现CLP@HP-A载体在治疗过程中可能通过调控多条信号通路,如抗凋亡和抗炎反应等,来发挥其抗肿瘤效应。
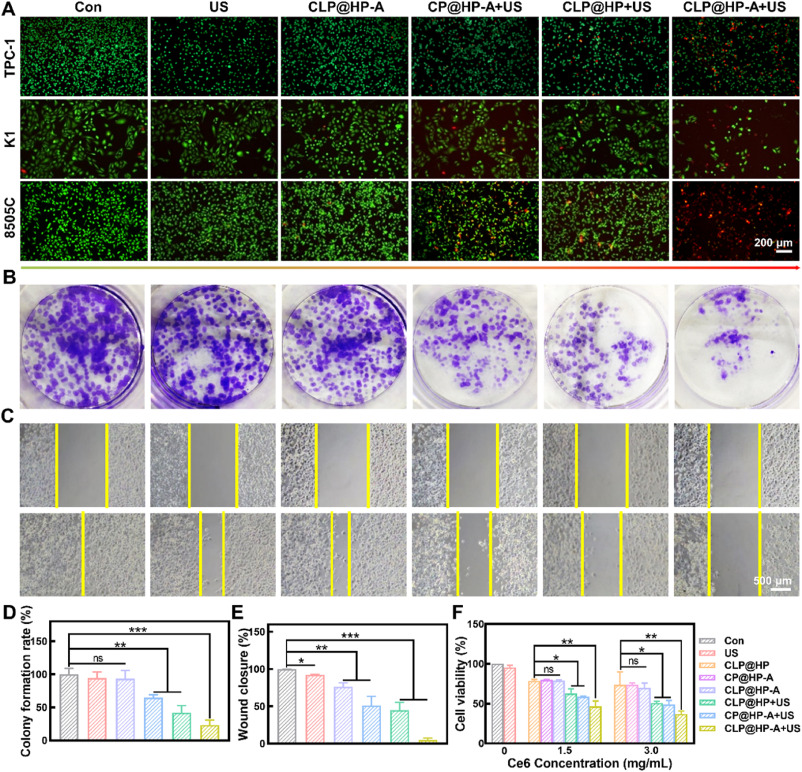
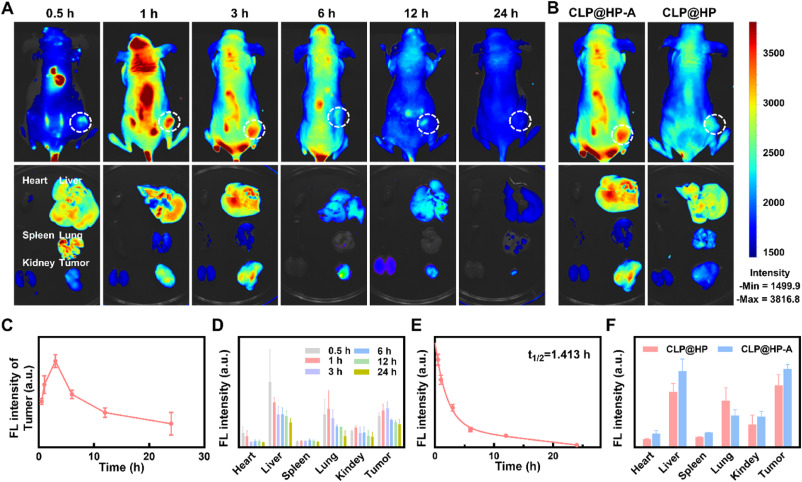
- CLP@HP-A载体的治疗效果:在体内外的实验中,CLP@HP-A载体显示出对甲状腺癌的显著治疗效果,能够有效抑制肿瘤的生长和转移。
参考文献
Wang, D.; Ma, W.; Zhang, Y.; Wang, Y.; Sun, L.; Jiang, J.; Jiao, L.; Li, R.; Zhang, Y.; Zhang, M.; Zhou, Q. A Versatile Nanoplatform Carrying Cascade Pt Nanozymes Remodeling Tumor Microenvironment for Amplified Sonodynamic/Chemo Therapy of Thyroid Cancer. Biomaterials 2024, 122778. https://doi.org/10.1016/j.biomaterials.2024.122778.