【Biomaterials】炎症刺激响应性,抑制糖酵解途径,新型多聚体缓解类风湿性关节炎
总结
该研究开发了一种能够同时抑制糖酵解途径和炎症信号的应激响应多聚体,用于治疗风湿关节炎(RA),并通过靶向多种炎症细胞类型实现精准治疗。
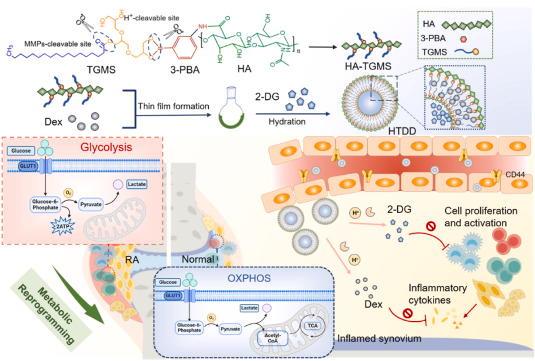
摘要
风湿关节炎(RA)是一种系统性自身免疫性疾病,以关节炎和骨质侵蚀为特征。研究表明,RA的关键事件是过度激活的免疫反应和炎症级联反应,以及炎症细胞在能量代谢方面的转变,即从氧化磷酸化(OXPHOS)向糖酵解途径的转换。2-去氧脱氧核糖(2-DG)作为一种安全有效的糖酵解抑制剂,能够抑制高能需求细胞的ATP生成,从而抑制细胞的过度增殖和激活。然而,单独使用2-DG可能导致RA缓解不佳,因为它会引起内源性应激反应,即细胞内ROS的爆发。因此,将2-DG与抗炎药物去甲肾上腺素(Dex)的有理组合可能会产生协同效应,减少2-DG引起的氧化应激,并抑制RA。研究人员设计了一种响应炎症刺激的肝化酸-三糖基单脂酸多聚体(HTDD ),用于共同将2-DG和Dex分子靶向至RA病变部位。HTDD 多聚体在血液循环中稳定,并在炎症部位特异性分布,其中过表达的金属蛋白酶(MMPs)和酸性pH触发药物的释放。实验结果表明,2-DG可以抑制细胞的过度增殖和激活,并提高Dex的生物利用度,而Dex则可以抑制炎症信号并防止2-DG引起的氧化应激。因此,这种组合策略最终通过抑制糖酵解和炎症信号传导,减轻了RA的症状。此外,研究还揭示了HTDD 多聚体在RA治疗中的潜力,并提供了新的治疗视角。
观点
RA的发展与炎症细胞的能量代谢密切相关,糖酵解途径的抑制可能是一种有效的治疗策略。
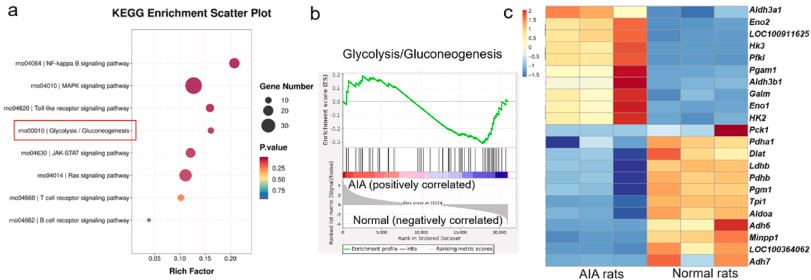 图 1. 关节炎模型中糖酵解水平的升高。 (a) 利用 AIA 和正常大鼠滑膜组织的 RNA 测序进行 KEGG 通路富集分析。 (b) AIA 和正常大鼠滑膜组织中糖酵解基因特征的基因组富集分析(GSEA)。 (c)糖酵解相关差异表达基因的热图分析。
图 1. 关节炎模型中糖酵解水平的升高。 (a) 利用 AIA 和正常大鼠滑膜组织的 RNA 测序进行 KEGG 通路富集分析。 (b) AIA 和正常大鼠滑膜组织中糖酵解基因特征的基因组富集分析(GSEA)。 (c)糖酵解相关差异表达基因的热图分析。
2-DG可以抑制糖酵解,但单独使用可能会引起ROS的爆发,不利于RA的缓解。
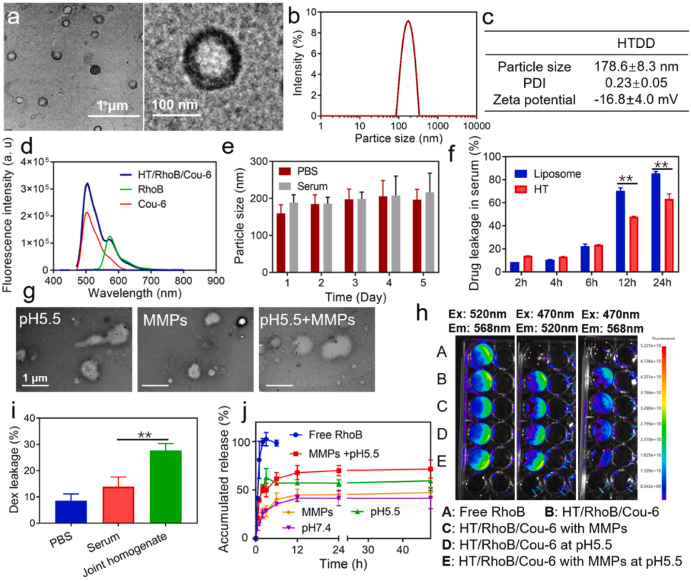 图 2. HTDD 聚合体的表征。 (a) HTDD 的 TEM 图像。 (b) 通过 DLS 测量 HTDD 的粒度分布。 (c) 通过 DLS 测量 HTDD 的 PDI 和 Zeta 电位。 (d)Cou-6 和 RhoB 之间的 FRET 效应分析,无论是游离的还是共负载在 HT 聚合体中的。 (e) HTDD 与 PBS 或 10 % 血清培养时的尺寸变化。 (f) HT/RhoB 聚合体和脂质体在不同时间点与血清培养时的药物泄漏率。 (g) 使用 TEM 观察 HT 聚体在酸性 pH 和 MMPs 存在下的形态变化。 (h) HT/RhoB/Cou-6 聚合体在酸性 pH 和 MMPs 存在下利用 FRET 效应的药物渗漏行为。 (i) 在 AIA 大鼠关节匀浆存在的情况下,HT/Dex 聚合体的 Dex 泄漏情况。 (j)HT/RhoB/Cou-6 在酸性 pH 和 MMPs 存在下的药物释放曲线。
图 2. HTDD 聚合体的表征。 (a) HTDD 的 TEM 图像。 (b) 通过 DLS 测量 HTDD 的粒度分布。 (c) 通过 DLS 测量 HTDD 的 PDI 和 Zeta 电位。 (d)Cou-6 和 RhoB 之间的 FRET 效应分析,无论是游离的还是共负载在 HT 聚合体中的。 (e) HTDD 与 PBS 或 10 % 血清培养时的尺寸变化。 (f) HT/RhoB 聚合体和脂质体在不同时间点与血清培养时的药物泄漏率。 (g) 使用 TEM 观察 HT 聚体在酸性 pH 和 MMPs 存在下的形态变化。 (h) HT/RhoB/Cou-6 聚合体在酸性 pH 和 MMPs 存在下利用 FRET 效应的药物渗漏行为。 (i) 在 AIA 大鼠关节匀浆存在的情况下,HT/Dex 聚合体的 Dex 泄漏情况。 (j)HT/RhoB/Cou-6 在酸性 pH 和 MMPs 存在下的药物释放曲线。
结合使用2-DG和Dex可以产生协同效应,2-DG通过抑制糖酵解来减少Dex的效률,而Dex则可以减少2-DG引起的氧化应激。
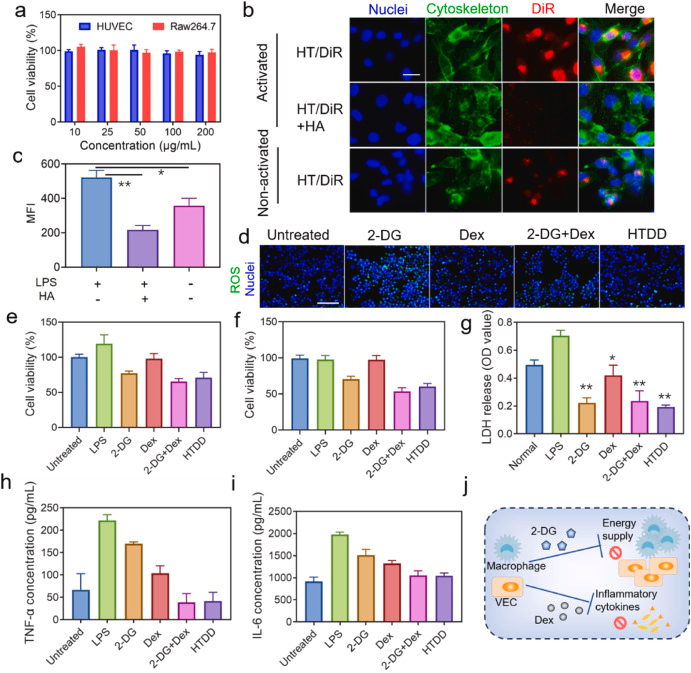 图 3. 细胞共定位、细胞增殖和抗炎功效。 (a) HT 多聚体在 HUVEC 和 Raw264.7 中的细胞活力。 (b) 活化或未激活 HUVEC 中细胞摄取 HT/DiR 的代表性荧光图像,比例尺 = 20 μm。 细胞核: 细胞骨架:DAPI FITC-phalloidine. (c) 使用流式细胞仪定量分析 HT/DiR 多聚体在 HUVEC 中的吸收效率。 (d) 以 DCFH-DA 为探针,各处理组 ROS 水平的代表性荧光图像: 细胞核:DAPI,比例尺 = 100 μm。 LPS 激活的 (e) Raw264.7 和 (f) HUVEC 经不同药物处理后的细胞增殖情况。 (g) 不同药物处理后 LPS 激活的 Raw264.7 的 LDH 水平。 不同药物处理后 LPS 激活的 Raw264.7 中的炎症细胞因子水平,包括 (h) TNF-α 和 (i) IL-6。
图 3. 细胞共定位、细胞增殖和抗炎功效。 (a) HT 多聚体在 HUVEC 和 Raw264.7 中的细胞活力。 (b) 活化或未激活 HUVEC 中细胞摄取 HT/DiR 的代表性荧光图像,比例尺 = 20 μm。 细胞核: 细胞骨架:DAPI FITC-phalloidine. (c) 使用流式细胞仪定量分析 HT/DiR 多聚体在 HUVEC 中的吸收效率。 (d) 以 DCFH-DA 为探针,各处理组 ROS 水平的代表性荧光图像: 细胞核:DAPI,比例尺 = 100 μm。 LPS 激活的 (e) Raw264.7 和 (f) HUVEC 经不同药物处理后的细胞增殖情况。 (g) 不同药物处理后 LPS 激活的 Raw264.7 的 LDH 水平。 不同药物处理后 LPS 激活的 Raw264.7 中的炎症细胞因子水平,包括 (h) TNF-α 和 (i) IL-6。
HTDD 多聚体能够在血液循环中保持稳定,并在炎症部位响应特定的刺激释放药物,这种靶向性能够提高治疗效果并减少副作用。
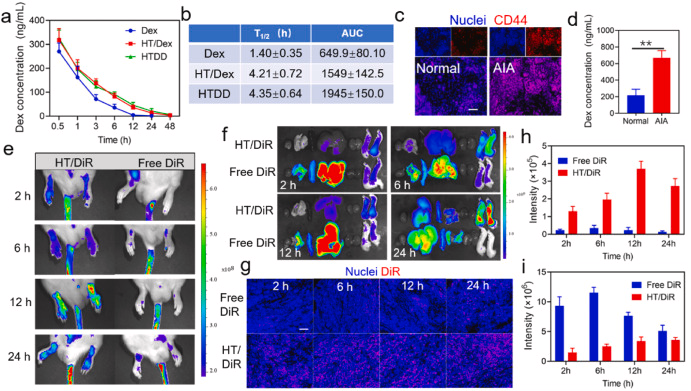 图 4. AIA 大鼠的体内药代动力学和生物分布曲线。 (a) 静脉注射游离 Dex、HT/Dex 和 HTDD 后血浆中 Dex 的药代动力学研究。 (b) 静脉注射游离 Dex、HT/Dex 和 HTDD 后 Dex 的主要药代动力学参数,n = 6。 (c) 正常大鼠和 AIA 大鼠滑膜组织中 CD44 表达的荧光染色,细胞核: DAPI, 比例尺 = 20 μm。 (d)静脉注射 HTDD 4 小时后,正常大鼠和 AIA 大鼠关节中 Dex 的含量。 (e) AIA 大鼠在不同时间点接受游离 DiR 和 HT/DiR 处理后的体内荧光图像。 (f) 大鼠在不同时间点接受游离 DiR 和 HT/DiR 治疗后的主要器官,包括心脏、肝脏、脾脏、肺脏、肾脏和关节(从左到右)的体外图像。 (g) AIA 大鼠滑膜组织中游离 DiR 和 HT/DiR 分布的代表性荧光图像,比例尺 = 20 μm。 注射后不同时间点(h)关节炎关节和(i)肝脏中游离 DiR 和 HT/DiR 的平均荧光强度定量
图 4. AIA 大鼠的体内药代动力学和生物分布曲线。 (a) 静脉注射游离 Dex、HT/Dex 和 HTDD 后血浆中 Dex 的药代动力学研究。 (b) 静脉注射游离 Dex、HT/Dex 和 HTDD 后 Dex 的主要药代动力学参数,n = 6。 (c) 正常大鼠和 AIA 大鼠滑膜组织中 CD44 表达的荧光染色,细胞核: DAPI, 比例尺 = 20 μm。 (d)静脉注射 HTDD 4 小时后,正常大鼠和 AIA 大鼠关节中 Dex 的含量。 (e) AIA 大鼠在不同时间点接受游离 DiR 和 HT/DiR 处理后的体内荧光图像。 (f) 大鼠在不同时间点接受游离 DiR 和 HT/DiR 治疗后的主要器官,包括心脏、肝脏、脾脏、肺脏、肾脏和关节(从左到右)的体外图像。 (g) AIA 大鼠滑膜组织中游离 DiR 和 HT/DiR 分布的代表性荧光图像,比例尺 = 20 μm。 注射后不同时间点(h)关节炎关节和(i)肝脏中游离 DiR 和 HT/DiR 的平均荧光强度定量
HTDD 多聚体的设计和应用表明,通过靶向多种炎症细胞类型,可以实现对RA的精准治疗,从而有望实现长期缓解。
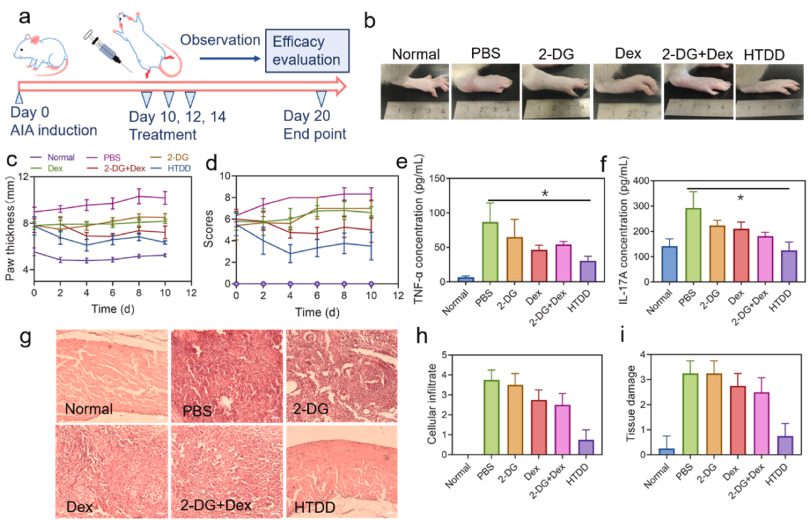 图 5. HTDD 在 AIA 模型中的疗效。 (a) HTDD 治疗的实验时间表示意图。 (b) 各种治疗后关节外观的代表性照片。 治疗过程中各组(c)爪子厚度和(d)关节评分的变化。 各组在不同治疗后的炎症细胞因子,包括(e)TNF-α 和(f)IL-17A。 (g)通过 HE 染色对各组不同处理后的炎性滑膜进行组织病理学检查,刻度线 = 20 μm。 基于 HE 染色的(h)细胞浸润和(i)软骨侵蚀的平均得分。
图 5. HTDD 在 AIA 模型中的疗效。 (a) HTDD 治疗的实验时间表示意图。 (b) 各种治疗后关节外观的代表性照片。 治疗过程中各组(c)爪子厚度和(d)关节评分的变化。 各组在不同治疗后的炎症细胞因子,包括(e)TNF-α 和(f)IL-17A。 (g)通过 HE 染色对各组不同处理后的炎性滑膜进行组织病理学检查,刻度线 = 20 μm。 基于 HE 染色的(h)细胞浸润和(i)软骨侵蚀的平均得分。
研究的结果和方法为RA的治疗提供了新的策略和理论基础,为未来的临床应用开辟了道路。
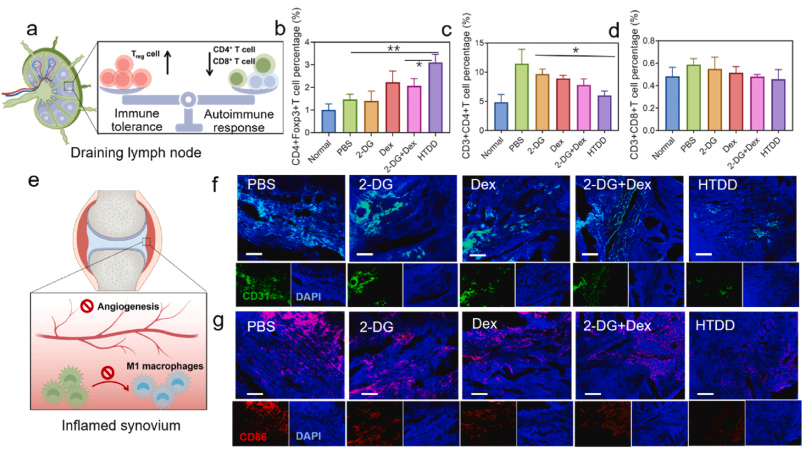 图 6. 炎症部位的自身免疫激活和炎症细胞过度增殖。 (a) 引流淋巴结中免疫耐受和自身免疫反应之间的平衡示意图。 (b) 各种治疗后引流淋巴结中的 Treg 细胞群。 (c)不同治疗后引流淋巴结中的 CD4+ T 细胞数量和(d)CD8+ T 细胞数量,n = 5。 e)炎症滑膜中滑膜血管生成和巨噬细胞再极化示意图。 (f)不同治疗后关节炎症中滑膜血管生成的代表性荧光图像,CD31:血管内皮细胞。 (g)不同治疗后关节炎症中 M1 巨噬细胞浸润的代表性荧光图像。
图 6. 炎症部位的自身免疫激活和炎症细胞过度增殖。 (a) 引流淋巴结中免疫耐受和自身免疫反应之间的平衡示意图。 (b) 各种治疗后引流淋巴结中的 Treg 细胞群。 (c)不同治疗后引流淋巴结中的 CD4+ T 细胞数量和(d)CD8+ T 细胞数量,n = 5。 e)炎症滑膜中滑膜血管生成和巨噬细胞再极化示意图。 (f)不同治疗后关节炎症中滑膜血管生成的代表性荧光图像,CD31:血管内皮细胞。 (g)不同治疗后关节炎症中 M1 巨噬细胞浸润的代表性荧光图像。
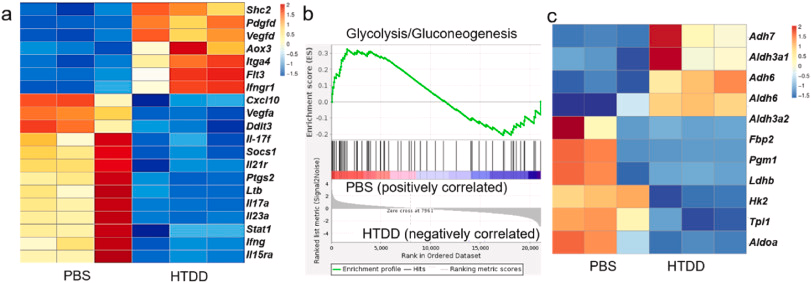 图 7. HTDD 处理后的糖酵解水平。 (a) PBS 和 HTDD 治疗的 AIA 大鼠炎症反应相关基因的差异表达热图分析。 (b) 接受 PBS 和 HTDD 治疗的 AIA 大鼠滑膜组织中糖酵解基因特征的 GSEA。 (c)接受 PBS 和 HTDD 治疗的 AIA 大鼠体内参与糖酵解的差异表达基因的热图分析。
图 7. HTDD 处理后的糖酵解水平。 (a) PBS 和 HTDD 治疗的 AIA 大鼠炎症反应相关基因的差异表达热图分析。 (b) 接受 PBS 和 HTDD 治疗的 AIA 大鼠滑膜组织中糖酵解基因特征的 GSEA。 (c)接受 PBS 和 HTDD 治疗的 AIA 大鼠体内参与糖酵解的差异表达基因的热图分析。
参考文献
Wang, Q.; Ren, J.; Lin, X.; Zhang, B.; Li, J.; Weng, Y. Inflammatory Stimulus-Responsive Polymersomes Reprogramming Glucose Metabolism Mitigates Rheumatoid Arthritis. Biomaterials 2025, 312, 122760. https://doi.org/10.1016/j.biomaterials.2024.122760.