【Angew.Chem.】突破182倍信噪比:深度组织内NMDA受体化学发光成像新策略
文章标题:Bioorthogonally Activatable Chemiluminescence for the N‐Methyl‐d‐aspartate Receptors Intravital Imaging
通讯作者:Prof. Dr. Bo Tang
文章链接:https://doi.org/10.1002/anie.202523648
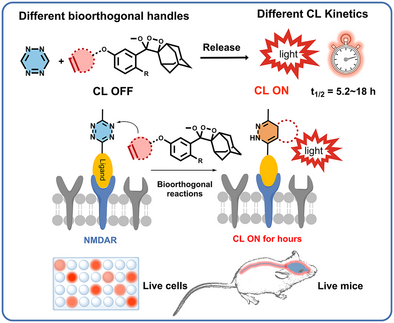
文章概要
引言
中枢神经系统中的受体蛋白是神经信号传导和调控的关键分子,其表达和分布异常与多种神经退行性疾病密切相关。作为典型代表,N-甲基-D-天冬氨酸受体(NMDARs)在突触可塑性和记忆形成中发挥重要作用,其失调被认为与阿尔茨海默病等疾病相关。然而,现有的成像技术在穿透深度和信噪比方面存在显著不足。荧光成像受限于光子衰减,正电子发射断层扫描依赖放射性标记物,均存在局限性。化学发光因无需外部激发而具备深度组织穿透优势,但传统的1,2-二氧杂环体系受限于短半衰期和依赖活性分子触发,难以用于非反应性受体蛋白的成像。
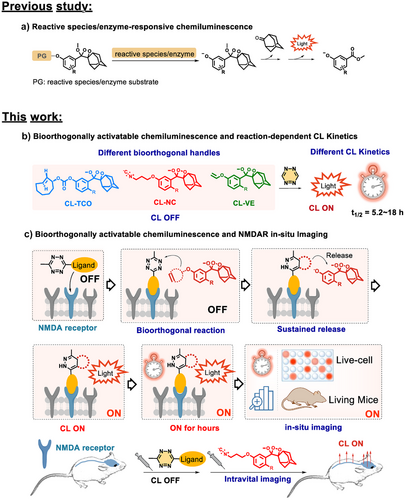
主要实验及结论
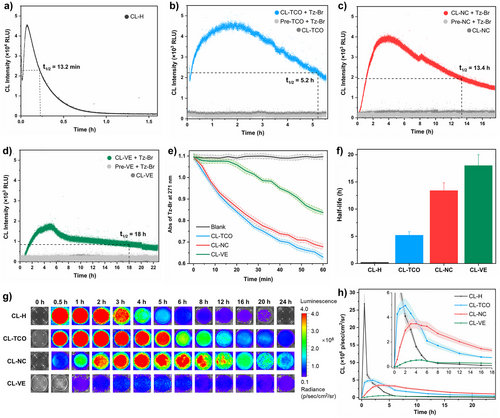
研究团队提出了生物正交可激活化学发光(BACL)策略,将“点击释放”反应与1,2-二氧杂环发光体结合,实现了四嗪触发的“关—开”信号,并可调控发光半衰期在5.2至18小时之间。通过设计三种探针(CL-TCO、CL-NC、CL-VE),研究者验证了其在体外和体内的发光动力学特性,证明了不同生物正交触发机制可实现可控的发光持续时间。尤其是CL-NC探针在与四嗪衍生物结合后,展现出强烈且持久的发光信号。
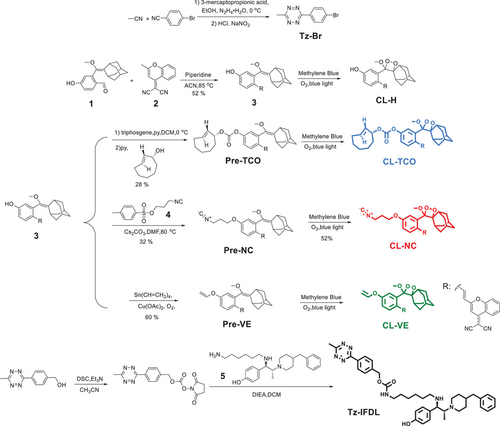
在细胞实验中,研究者合成了四嗪修饰的选择性配体Tz-IFDL,可特异性结合NMDAR的NR2B亚基。该体系在细胞和脑片中实现了高特异性成像,信号与受体表达水平高度相关。在动物实验中,BACL实现了小鼠脑和脊髓中NMDAR的在体成像,穿透深度可达6厘米,信噪比最高达到182倍。更重要的是,该方法能够清晰区分阿尔茨海默病模型小鼠与正常对照小鼠的受体表达差异,揭示了疾病相关的分子机制。
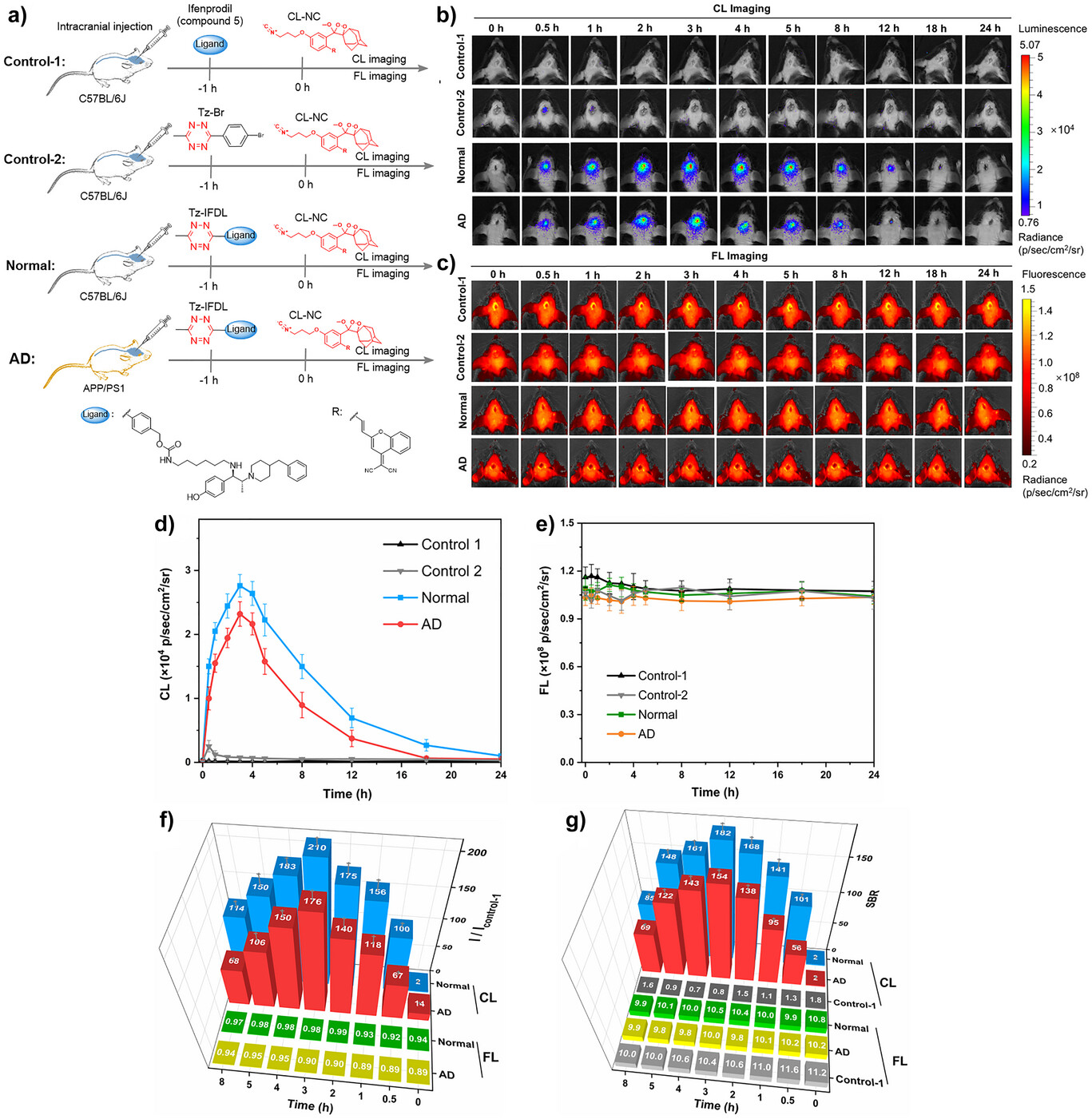
总结及展望
本研究提出的BACL策略突破了传统化学发光成像的局限,实现了深组织内受体蛋白的高保真成像。其可调控的发光持续时间和极高的信噪比,为在体研究神经受体的动态变化提供了全新工具。更为重要的是,BACL不仅可用于成像,还具备作为内源性光源的潜力,有望推动深组织精准光治疗的发展。未来,该策略可通过更换特异性配体扩展至其他受体蛋白的成像与治疗,为神经科学和分子医学提供广阔的应用前景。