【Angew.Chem.】10.3倍选择性提升:质子激活人工通道的抗癌新策略
文章标题:Proton‐Activated Artificial Channels for pH‐Selective Cancer Therapy
通讯作者:Changliang Ren
文章链接:https://doi.org/10.1002/anie.202525440
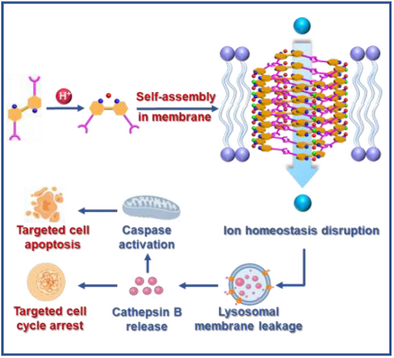
文章概要
引言
质子激活离子通道是一类特殊的跨膜蛋白,能够在酸性环境下调控离子运输,帮助细胞适应缺血、炎症或肿瘤等病理状态。天然的酸敏感离子通道(ASICs)和质子激活氯离子通道(PACs)在神经信号传递、免疫功能和细胞死亡中发挥重要作用。然而,人工通道的研究大多依赖外部刺激(电压、光、化学试剂),难以在临床环境中实现精准应用。肿瘤组织普遍存在酸性微环境,这为开发能够在低pH下选择性激活的人工通道提供了独特机会。本文提出了一类基于自组装肽链与2,2′-联吡啶骨架的质子激活人工通道,旨在实现对癌细胞的选择性杀伤。
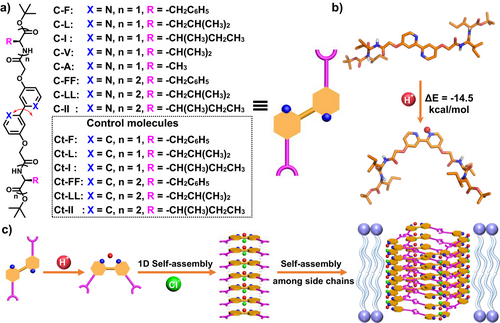
主要实验及结论
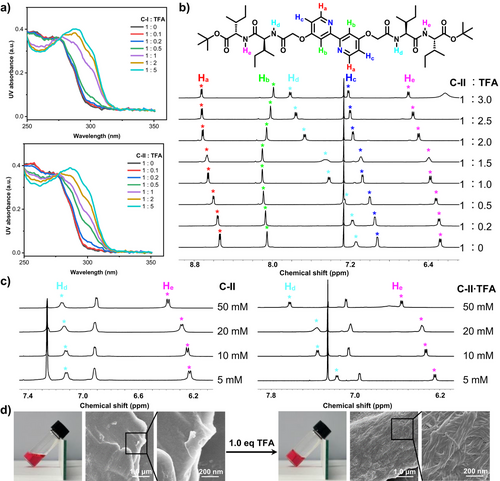
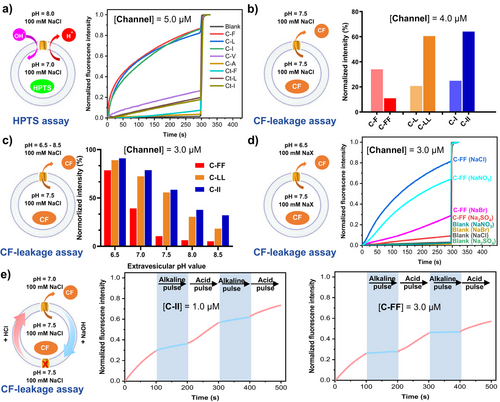
研究团队设计了带有肽链的2,2′-联吡啶单体,利用其在质子化后由线性I型构象转变为折叠V型构象的特性,驱动分子通过氢键和静电作用自组装为一维柱状结构,并进一步形成跨膜通道。光谱与核磁实验表明,酸性条件显著促进了分子的构象转变与自组装。荧光探针泄漏实验和单通道电流测试证实,这些通道在pH 6.5下表现出强烈的跨膜运输能力,且可实现可逆的pH依赖性开关。
在生物学实验中,C-FF通道在结直肠癌细胞(HCT-116)中表现出显著的pH依赖性抗癌活性:当外部pH由7.4下降至6.5时,其细胞毒性增强了10.3倍,IC₅₀降低至2.8 µM。同时,C-FF对正常肠上皮细胞的毒性较低,选择性指数达到8.5,远高于传统化疗药物阿霉素。机制研究显示,C-FF在酸性环境下可形成跨膜孔道,破坏细胞膜和溶酶体功能,导致自噬过程受阻,进而诱导细胞凋亡和细胞周期阻滞。进一步的免疫印迹和荧光分析揭示了其通过激活caspase级联反应和线粒体通路实现细胞死亡。
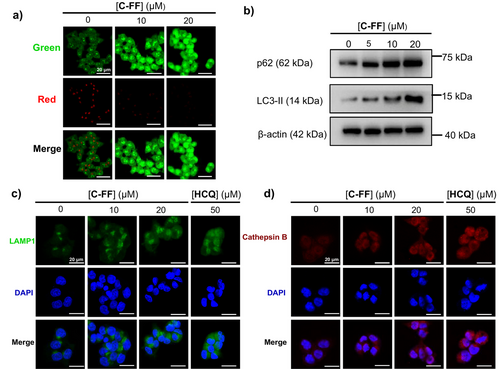
总结及展望
该研究首次构建了能够在酸性环境下被激活的人工离子通道,并验证了其在癌细胞中的选择性杀伤作用。C-FF通道不仅在体外实验中展现出与阿霉素相当的抗癌效力,还具备更高的选择性和更低的副作用风险。这一成果为开发基于肿瘤微环境特征的精准治疗策略提供了新思路。未来的研究将聚焦于结构优化、质子化平衡调控以及动物模型中的验证,以推动质子激活人工通道向临床应用迈进。
这篇论文展示了人工通道在肿瘤治疗中的巨大潜力,为“酸性微环境靶向”这一方向提供了坚实的实验依据。