【Angew.Chem.】高对比度活体成像新突破:红氧化激活探针实现原生突触后支架的实时可视化
文章标题: Redox-Activated Probes Enable High-Contrast Live Imaging of Native Postsynaptic Scaffolds
通讯作者: Hans M. Maric
文章链接: https://doi.org/10.1002/anie.202519933
文章概要
引言
突触后致密区(PSD)是神经元信息处理的核心结构,其由高密度的支架蛋白、受体及信号分子组成。要理解突触可塑性与神经疾病机制,直接在活体神经元中可视化这些内源性支架蛋白至关重要。然而,现有方法存在明显局限:
基因编码荧光标签需要转染或病毒递送,可能改变细胞生理;抗体体积大且难以进入活细胞;小分子探针多针对受体而非稳定的支架蛋白,导致成像对比度不足。
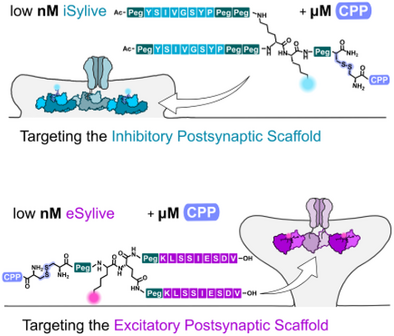
为解决这些问题,作者开发了 Sylives ——一类紧凑、可逆递送、可在活体神经元中高对比度标记抑制性(gephyrin)与兴奋性(PSD‑95)突触后支架的合成荧光肽探针。
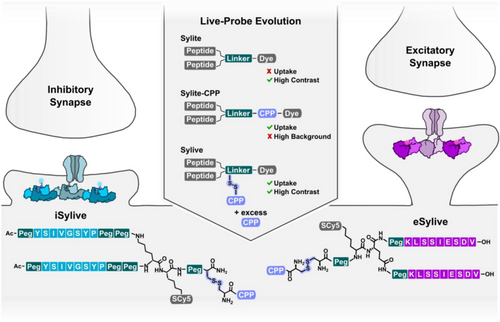
主要实验及结论
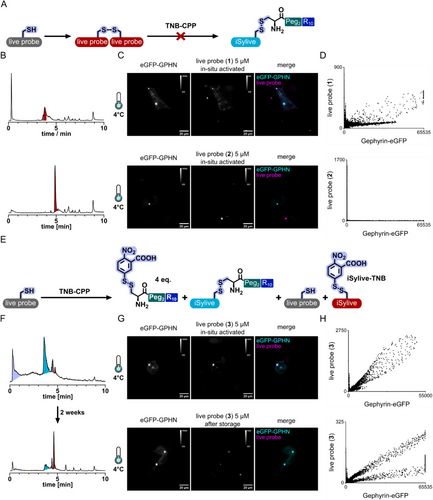
研究首先基于已用于固定样本的 iSylite/eSylite 结构,设计可与细胞穿透肽(CPP)通过可逆二硫键连接的活体探针。作者发现传统的 in situ 偶联方式存在氧化敏感、生成副产物、递送效率不稳定等问题,导致成像背景高、对比度低。
为此,研究团队 预先纯化 了 CPP‑probe 二硫键偶联物,避免副产物生成,并利用细胞内还原环境实现 CPP 的“无痕释放”,恢复探针对支架蛋白的高亲和力。
在 HEK293 细胞与小鼠原代神经元中,作者系统优化了探针浓度、CPP 比例、温度与孵育时间,明确了实现高对比度成像的参数窗口。
最终结果显示:
- iSylive 可在活体神经元中高特异性标记内源性 gephyrin,且与抗体染色高度共定位;
- eSylive 成功扩展至兴奋性突触,能够标记内源性 PSD‑95;
- 两类探针均无需基因操作,且背景低、对比度高,可用于实时观察突触结构。
研究还指出,兴奋性突触的结构特性导致 eSylive 的最佳参数窗口更窄,但不影响其作为通用策略的可行性。
总结及展望
Sylives 的出现为活体神经元突触后结构的高对比度成像提供了全新工具。其核心优势包括:
- 无需基因操作,适用于多种实验系统;
- 可逆 CPP 递送实现高效进入细胞且无残留;
- 探针小、扰动低,适合实时动态研究;
- 可模块化扩展至其他胞内蛋白靶点。
未来,Sylives 有望应用于脑片、体内成像及突触可塑性研究,并进一步探索其对神经生理的潜在影响。该策略为研究神经系统结构与功能的关联提供了强有力的工具平台。