【激活型癌症荧光探针】FRET、PET、波长变化等可激活荧光探针
Activity-Based Fluorescence Diagnostics for Cancer
激活型癌症诊疗探针
为实现术中癌症成像,科研人员已致力于开发多样化的功能性荧光探针。自早期阶段,常亮对比荧光团如ICG和亚甲基蓝便成为成像的关键工具。随后,通过荧光团与针对癌细胞中生物标记蛋白的抗体或小分子配体的偶联设计,功能性“常亮”探针应运而生。尽管这些探针设计简单,但非特异性染料在非癌组织中的积累成为其应用的挑战。
自20世纪90年代末以来,可激活荧光探针崭露头角,它们能在癌症组织中产生特异性荧光。尽管设计更具挑战性,但这些探针通过减少正常组织中的背景信号,显著提高了癌症成像的灵敏度和特异性。近二十年来,化学荧光控制机制如FRET、PeT、分子内螺环化和波长转移等不断涌现,为开发可激活荧光探针提供了精确且多样的荧光切换手段。这些机制可根据成像生物标记物和所需的光学特性进行灵活选择。
特别值得一提的是,以生物标记酶活性为目标的可激活荧光探针在癌症成像中展现出巨大潜力。它们能被癌症特异性酶选择性激活,并在病变部位通过酶催化翻转实现荧光强力放大。
在临床应用中,可激活癌症成像探针主要通过系统用药和局部用药两种方式实现。系统用药旨在全面观察癌症病灶,包括组织深处的病灶。近红外探针(650-900纳米)因其能避免自发荧光干扰、减少光子散射并实现深层组织穿透而备受青睐。尽管其荧光量子产率较低,但术前给药给予足够时间通过酶催化转换放大信号,从而弥补这一不足。为提升水溶性并控制药代动力学,常需对近红外探针进行化学和分子修饰,这无疑增加了探针设计与开发的复杂性。
在局部用药方面,通过局部喷洒探针溶液可观察癌症组织,主要用于检测手术边缘的残留癌。由于术中实时荧光成像的需求,具有高荧光量子产率和高可见度的探针成为首选。这些探针通常采用在500-600纳米范围内发出明亮荧光的荧光团,并可用于辅助术中病理诊断。因此,根据临床应用需求开发适当的荧光探针至关重要。
可激活荧光探针最初基于FRET机制开发,主要针对某些癌症特异性生物标记酶如螯合酶和MMPs。然而,癌症的高度异质性使得仅针对几种酶活性难以全面观察各类癌症。近年来,随着荧光控制机制的进步和新生物标记酶的发现(如氨基肽酶、羧肽酶、糖苷酶和醌氧化还原酶),癌症成像的有效靶标范围得以扩大。研究表明,不同癌症类型的有效生物标记酶活性存在差异,因此确定每种癌症的有效成像靶点至关重要。研究团队坚信,利用人类手术标本直接筛选探针库将是实现高灵敏度和特异性癌症成像的关键。
过去二十年中,多种可激活荧光探针已问世,部分正在进行临床试验。此外,还开发了针对不同生物标记物或基于不同检测机制的荧光探针,如聚集诱导发光(AIE)和激发态分子内质子转移(ESIPT)。同时,基于化学发光、光声成像和拉曼成像等技术的可激活探针也相继报道。这些技术的引入使得造影探针的设计更加复杂。展望未来,随着可激活造影剂探针和检测设备的不断进步,术中癌症成像有望成为癌症手术中广泛应用的重要选择。
【激活型癌症荧光探针】-基于FRET机制的可激活荧光探针
Activity-Based Fluorescence Diagnostics for Cancer
激活型癌症诊疗探针
2.1.1. 基于 FRET 的蛋白酶活性荧光探针
根据FRET机制,一系列蛋白酶反应型癌症成像探针得以设计。1999年,Weissleder团队基于染料-染料FRET机制,研制出一种近红外荧光探针,专用于溶酶体蛋白酶的癌症特异性成像(图8)。这种探针,即C-PGC,利用Cy5与聚赖氨酸和甲氧基聚乙二醇琥珀酸酯长循环接枝共聚物的连接,通过EPR效应选择性积聚于癌组织。在初始状态下,C-PGC的荧光因FRET而淬灭;然而,与溶酶体蛋白酶反应后,聚赖氨酸裂解,从而激活荧光。体外LX-1细胞观察及裸鼠体内近红外荧光成像均证实其有效性。 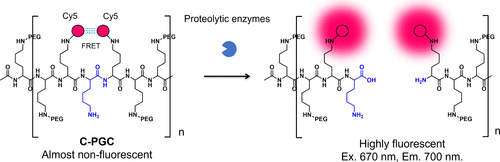 图 8.基于染料 FRET 的蛋白酶活化近红外探针。
图 8.基于染料 FRET 的蛋白酶活化近红外探针。
鉴于半胱氨酸酪蛋白酶在多种肿瘤细胞中的过度表达,它们成为癌症成像的理想靶点。Weissleder团队进一步利用染料-染料FRET机制,开发出针对酪蛋白酶D、B和K的近红外荧光探针,实现更特异的酶激活荧光。
2013年,Verdoes等人提出基于染料淬灭剂FRET的qABP(淬灭荧光活性探针)BMV-109(图9(a))。该探针由Cy5荧光团与磺基QHY淬灭剂组成,通过可被蛋白酶破坏的PMK连接体相连。凝血酶反应后,淬灭剂与Cy5分离,荧光激活。BMV-109显示出广泛的半胱氨酸酪蛋白酶标记特性,并成功应用于小鼠乳腺癌模型的癌组织可视化(图9(b))。此外,为适应临床滤光片设置,他们开发了以ICG为荧光团、QC-1为淬灭剂的VGT-309(图9(a)),可有效标记各种小鼠模型中的癌组织(图9(c))。2022年,Kennedy等人使用VGT-309对人类肺癌进行可视化研究,这表明其已经进入了临床二期。 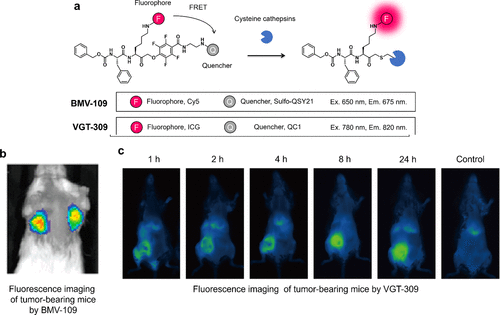 图 9.与胰蛋白酶反应的 qABP、BMV-109 和 VGT-309
图 9.与胰蛋白酶反应的 qABP、BMV-109 和 VGT-309
虽然ABPs如BMV-109和VGT-309能在荧光团与酶活性位点间形成共价键,实现荧光团在靶细胞中的保留,但酶活性位点的阻断限制了信号的酶催化放大,从而影响了其在癌症成像中的亮度和T/N比。
为克服这一限制,Ofori等人于2015年报道了一种新型酪蛋白反应探针,利用潜在阳离子溶酶体定位效应(LLE)增强细胞保留(图10(a))。他们设计的6QC-NIR探针含有一个可被酪蛋白酶裂解的酰胺键,而非ABPs中的PMK分子。裂解后产生的荧光片段因游离氨基的质子化作用而在溶酶体中蓄积,从而实现癌症特异性保留(图10(b))。由于没有形成共价键,荧光信号得以通过酶催化周转放大,实现了高亮度的癌症成像(图10(c))。 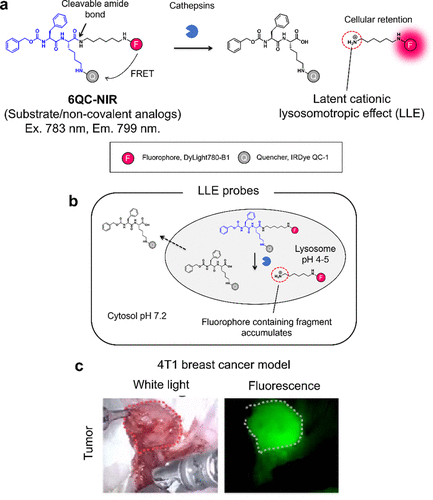 图 10.用于癌症成像的潜溶酶体效应(LLE)探针。
图 10.用于癌症成像的潜溶酶体效应(LLE)探针。
为进一步提高癌症检测的灵敏度和特异性,Widen等人于2021年报道了AND 逻辑门光学探针,这种探针需要两种底物同时被癌症特异性酶处理(图11(a))。他们通过连接cathepsin和caspase-3底物,将荧光团与两种淬灭剂相连(图11(b))。例如,DEATH-CAT-FNIR仅在cathepsin和caspase-3同时存在时激活,与6QC系列相比,其荧光信号对癌症组织的敏感性和特异性显著提高。 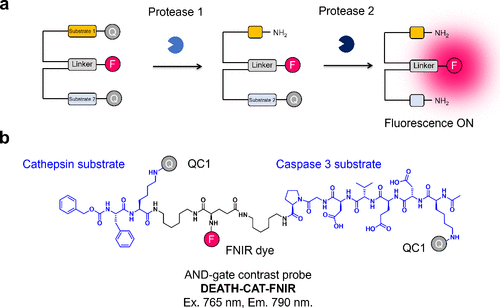 图 11.用于癌症成像的 AND 逻辑门对比探针。
图 11.用于癌症成像的 AND 逻辑门对比探针。
2017年,Miampamba等人开发出针对基质金属蛋白酶(MMPs)的比率荧光探针AVB-620(图12(a))。他们利用PLGC(Me)AG MMP底物连接体,将Cy5修饰的聚-d-精氨酸8-mer细胞穿透肽(CPP)与Cy7修饰的聚-d-谷氨酸5-mer相连。探针设计中,不对称肽骨架的荧光染料标记提高了水溶性。在完整分子状态下,AVB-620展现出从Cy5供体到Cy7受体的FRET,导致Cy5荧光淬灭。 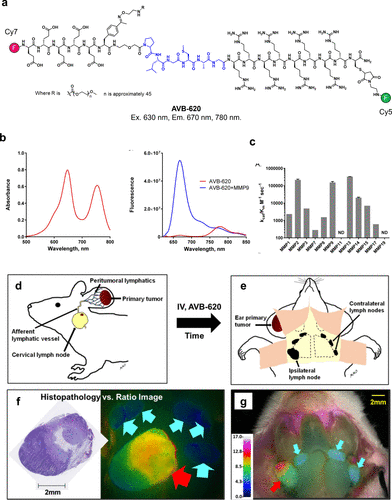 图 12.使用针对 MMPs 的比率荧光探针对乳腺癌进行灵敏的体内可视化。
图 12.使用针对 MMPs 的比率荧光探针对乳腺癌进行灵敏的体内可视化。
2023年,Faucher等人提出了一种创新的策略,成功将淬灭荧光探针转变为比率对比探针(如图13(a)所示)。在这项研究中,他们利用特定的技术将cathepsin反应探针6QC-Cy5改造为双荧光团探针6QC-RATIO,这一改造使得探针能够在小鼠皮下乳腺癌模型中实现对cathepsin L活性的比率测量成像,从而显著提升了T/N值(如图13(b)-(e)所示)。此外,他们还成功将AND门探针Death-Cat-NIR转化为比率型探针Death-Cat-RATIO,并证实这种转化能够进一步提升癌症检测的灵敏度(如图13(f)-(h)所示)。这些令人振奋的结果预示着,这些比率测量探针在改善癌症手术切除方面将发挥重要作用。 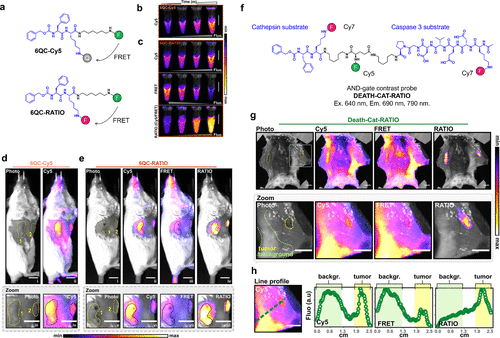 图 13.针对蛋白酶活性的比率荧光探针。
图 13.针对蛋白酶活性的比率荧光探针。
2.1.2. 基于 FRET 的糖苷酶活性荧光探针
基于FRET机制设计的探针常用于蛋白酶活性检测,但针对糖苷酶的FRET探针设计更具挑战性,这主要源于糖苷酶活性位点的独特口袋状拓扑结构,与蛋白酶中常见的裂隙状结构迥异。2006年,研究团队成功开发了一种β-半乳糖苷酶反应型FRET探针CMFβ-gal,具备蛋白质标记能力(图14(a))。在400纳米波长激发下,探针通过香豆素与荧光素间的FRET作用发出515纳米绿色荧光。然而,当荧光素分子被β-半乳糖苷酶去除后,仅余香豆素分子发出蓝色荧光,从而实现β-半乳糖苷酶活性的比率检测(图14(c))。在活细胞成像中,通过显微注射探针,可将β-半乳糖苷酶活性以比率图像形式可视化(图14(d))。尽管标记能力可能受蛋白质结构,特别是目标亲核氨基酸位置的影响,但研究团队仍利用醌甲酰胺化学反应,成功用香豆素荧光团标记了β-半乳糖苷酶(图14(b))。 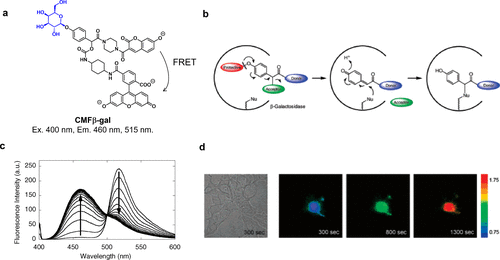 图 14.基于 FRET 的 β-半乳糖苷酶反应荧光探针。
图 14.基于 FRET 的 β-半乳糖苷酶反应荧光探针。
2015年,Yadav等人基于葡萄糖6位修饰对人类溶酶体β-葡萄糖苷酶1(GBA1,GCase)的耐受性,设计出一种GBA1荧光淬灭底物(图15(a))。他们在葡萄糖6位引入了BODIPY荧光团,并通过烷基连接物在异构中心连接淬灭剂。该探针可用于观察溶酶体中内源性GBA1的活性水平(图15(b))。加入抑制剂环氧缩酮B(CBE)可有效抑制荧光(图15(c))。尽管GBA1尚未确立为癌症成像的生物标记酶,但如果发现癌症特异性糖苷酶具有不同的允许糖化学修饰位点,则糖苷酶反应型FRET探针的设计思路可望得以应用。其他类型的糖苷酶反应型FRET探针亦有所报道。 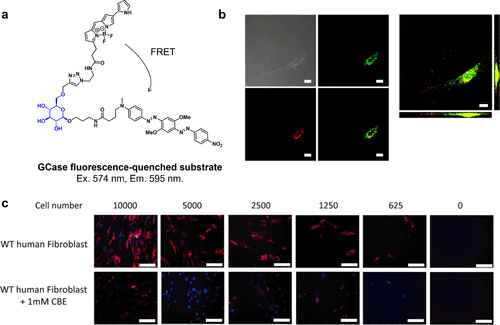 图 15.基于 FRET 的荧光淬灭底物的 GCase 依赖性处理。
图 15.基于 FRET 的荧光淬灭底物的 GCase 依赖性处理。
酶激活FRET探针的实例如图16所示。尽管近红外荧光团共轭体系长度给荧光分子设计带来挑战,但FRET机制可有效且轻松淬灭近红外荧光团。因此,基于FRET的癌症成像探针常采用在670-850纳米范围内发射荧光的近红外荧光团设计,以提供高组织穿透性。然而,基于FRET的探针因分子结构庞大,可能导致溶解度降低和细胞膜渗透性差。为解决此问题,常在FRET探针中引入水溶性磺酸基团、PEG链或细胞穿透肽(CPP)等修饰物。 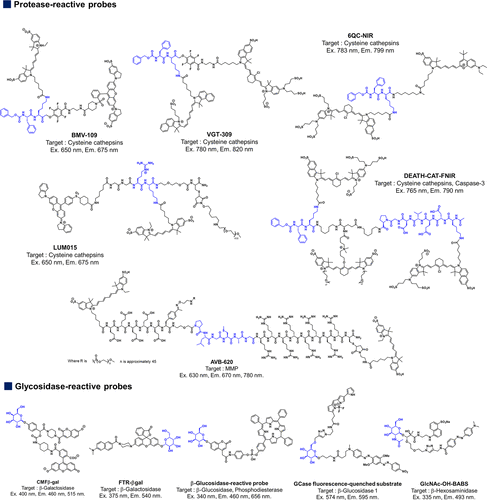 图 16.已报道的基于 FRET 的酶激活型荧光探针的化学结构、光学特性和成像目标
图 16.已报道的基于 FRET 的酶激活型荧光探针的化学结构、光学特性和成像目标
鉴于近红外荧光团的荧光量子产率(Φfl)通常较低,提高病变部位亮度以实现高灵敏度癌症成像至关重要。这可通过酶转换或增强所产生荧光团在细胞内的保留来实现。由于这些探针在短时间内产生足够信号较为困难,因此已开发出多种全身用药的探针。患者酶活性的异质性给确定探针给药与手术开始之间的最佳时机带来了挑战。尽管针对蛋白酶已开发出有效的基于FRET的癌症成像探针,但针对其他生物标记酶(包括糖苷酶)的高效FRET探针仍显匮乏,这仍是该领域面临的重要挑战。不过,一些近红外FRET探针已进入临床试验阶段,预示着适合临床术中成像的探针有望在不久的将来问世。
【激活型癌症荧光探针】-基于PET机制的可激活荧光探针
Activity-Based Fluorescence Diagnostics for Cancer
激活型癌症诊疗探针
荧光素衍生物由呫吨荧光团和垂直排列的苯分子组成(图 17(a))。2005年,研究团队发现,苯分子的电子密度决定了其荧光是否通过PeT途径被调控。PeT涉及单激发荧光团的非辐射去活化过程,即激发的荧光团与附近电子供体或受体间的电子转移导致荧光淬灭(图 17(b))。根据电子转移方向,PeT可分为两类:受体激发型PeT(a-PeT),即激发态荧光团作为电子受体;供体激发型PeT(d-PeT),激发态荧光团充当电子供体。当PeT发生速度足够快时,荧光团的荧光会被有效淬灭。 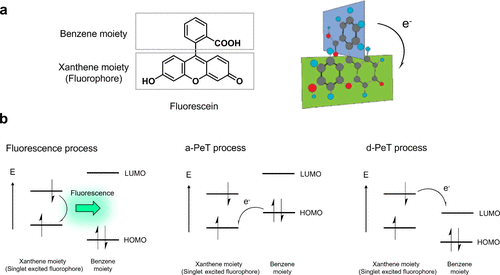 图 17.PeT 机制示意图。
图 17.PeT 机制示意图。
研究团队深入研究了TokyoGreen (TG)衍生物的荧光特性与氧化电位,发现其Φfl值受氧化电位和苯分子最高占位分子轨道(HOMO)能级影响。同时,研究团队观察到在不同pH值下的Φfl值变化:阴离子形式(pH 13)与中性形式(pH 3.4)的Φfl值存在显著差异(图 18(a))。当苯分子氧化电位高于1.7 V(相对于SCE)时,阴离子形式的Φfl值异常高。而在中性形式中,阈值则转向更高的氧化电位。当氧化电位低于1.7 V(相对于SCE)时,中性形式的Φfl几乎为零,这归因于苯分子与呫吨分子间的a-PeT反应(图 18(a))。特别地,2-Me-4-OMe TG在阴离子和中性形式间Φfl差异最大,因为其间甲氧基甲苯的氧化电位约1.7 V(相对于SCE)。 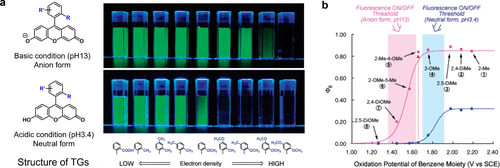 图 18.TGs 荧光量子效率(Φfl)的动态变化取决于其苯分子的氧化电位和 HOMO 能级
图 18.TGs 荧光量子效率(Φfl)的动态变化取决于其苯分子的氧化电位和 HOMO 能级
为了将TGs的这些光学特性转化为可激活探针的设计,研究团队聚焦于阴离子与中性形式间荧光发射阈值的差异。研究团队认为这种差异源于氧杂蒽分子的还原电位。鉴于TG O-甲基酯的还原电位与中性形式相近,研究团队提出通过在TG的羟基上引入如糖等底物分子来设计可激活荧光探针。在目标酶裂解这些底物分子后,这些探针将转变为高荧光阴离子形式,此时a-PeT途径受到抑制。
2.2.1. 基于 PeT 的糖苷酶活性荧光探针
研究团队利用a-PeT途径成功设计了一系列糖苷酶反应型癌症成像探针。采用a-PeT荧光控制策略,研究团队首创了TG-βGal作为高灵敏度的β-半乳糖苷酶反应性荧光探针。初始状态下,TG-βGal的荧光因a-PeT效应而熄灭,类似于中性形式的2-Me-4-OMe TG。然而,当其与β-半乳糖苷酶发生酶促反应后,荧光得以激活,转变为高荧光阴离子形式的2-Me-4-OMe TG,此时a-PeT途径受到抑制(图19(a))。值得注意的是,TG-βGal的荧光增强仅在β-半乳糖苷酶活性存在时显著,且其反应速度远超著名的β-半乳糖苷酶底物荧光素二-O-β-半乳糖苷(FDG)(图19(b))。此外,TG-βGal在β-半乳糖苷酶阳性细胞中表现出良好的可视化效果(图19(c))。然而,该探针的一个主要局限在于生成的荧光团在细胞内的保留能力较差,容易扩散至周围细胞,因此难以实现高对比度的癌症组织成像。 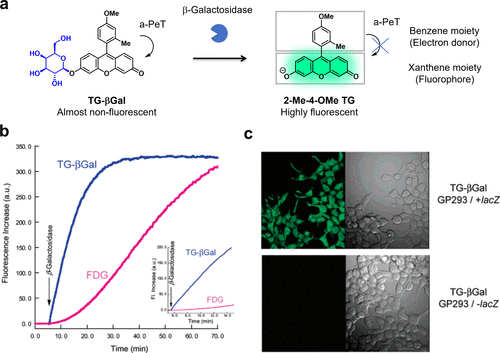 图 19.基于 PeT 机制的靶向 β-半乳糖苷酶的荧光探针。
图 19.基于 PeT 机制的靶向 β-半乳糖苷酶的荧光探针。
为了解决上述问题,研究团队于2007年对TG-βGal结构进行了优化,开发出AM-TG-βGal。该探针在与β-半乳糖苷酶反应时荧光显著增强,其独特之处在于酯分子能被细胞内广泛存在的酯酶水解,生成具有良好亲水性和荧光稳定性的产物,从而有效保留在细胞内(图20(a))。通过使用阿维丁-β-半乳糖苷酶偶联物作为报告酶对SHIN3肿瘤细胞进行预标记,研究团队成功地在小鼠模型体内观察到癌症病灶(图20(b)和(c))。与TG-βGal相比,AM-TG-βGal的细胞保留率显著提高,即使在PBS冲洗后依然如此(图20(d))。此外,基于其他TG衍生物的PeT探针也已得到开发,并成功应用于多种酶活性的检测。 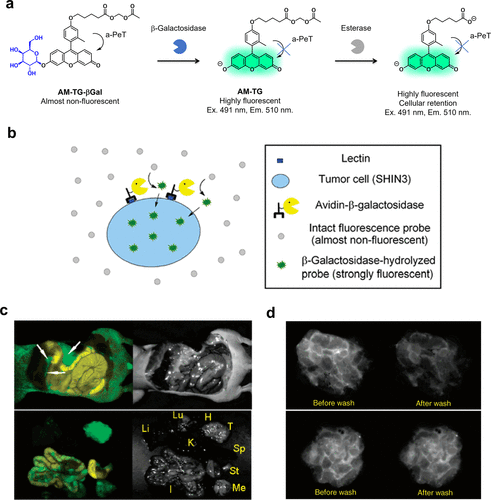 图 20.利用 a-PeT 的 β-半乳糖苷酶反应荧光探针对 SHIN3 肿瘤进行荧光成像。
图 20.利用 a-PeT 的 β-半乳糖苷酶反应荧光探针对 SHIN3 肿瘤进行荧光成像。
2.2.2. 基于 PeT 的蛋白酶活性荧光探针
2018年,Xiao等人针对APN在癌症中的活性,成功开发出治疗原药NBFMel。由于a-PeT的存在,NBFMel初始状态下几乎无荧光,但与APN反应后,会转化为高荧光的尼罗河蓝荧光团和美法仑(图21(a)和(b))。这一特性使得NBFMel能够报告肿瘤的存在,并实时追踪肿瘤小鼠模型中的药物释放情况(图21(c)和(d))。此外,由于美法仑具有抗癌作用,通过小鼠静脉注射NBFMel可有效抑制肿瘤生长。 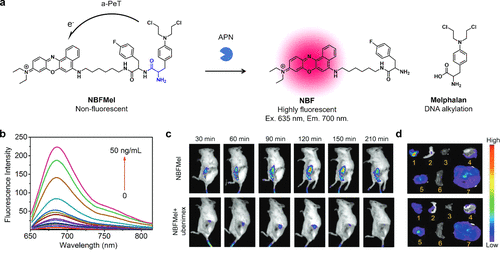 图 21.基于 PeT 的 APN 反应荧光探针。
图 21.基于 PeT 的 APN 反应荧光探针。
2019年,研究团队精确调控红色荧光骨架SiR600的a-PeT过程,开发出一种可激活DPP-IV的红色荧光探针。研究团队合成了多种SiR600和Ac-SiR600衍生物,并深入研究了苯分子的HOMO能级与SiR600和Ac-SiR600荧光量子产率(Φfl)之间的关系(图22(a)和(b))。研究结果表明,Φfl与苯分子的HOMO能级密切相关。脱乙酰化触发荧光转换的阈值水平约为-0.215 hartree。SiR600氨基上脱乙酰化引起的Φfl值变化,归因于最低未占分子轨道(LUMO)能量的降低和蒽分子激发能量的增加,这两个因素共同决定了PeT驱动力。这些发现表明,SiR600衍生物的荧光特性受PeT过程调控。在众多SiR600衍生物中,研究团队选择了2OMe SiR600作为荧光团骨架,因其具有高荧光性(Φfl = 0.32),而其乙酰化衍生物几乎无荧光(Φfl = 0.001)。基于这一骨架,研究团队成功开发出用于检测DPP-IV活性的EP-2OMe SiR600(图22(c))。EP-2OMe SiR600具有极低的背景信号,在与DPP-IV反应时,不仅吸收光谱发生红移,而且由于a-PeT过程受到抑制,展现出显著的荧光活化,从而实现对食管癌临床标本的高灵敏度和高T/N检测(图22(d)-(f))。 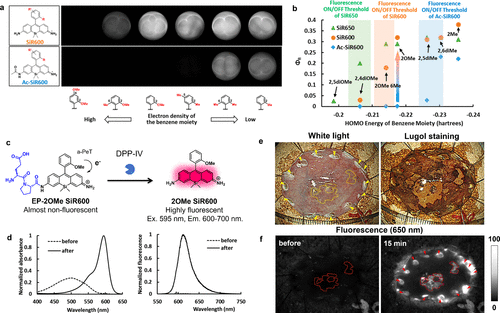 图 22.基于 a-PeT 和波长偏移的靶向 DPP-IV 的红色荧光探针。
图 22.基于 a-PeT 和波长偏移的靶向 DPP-IV 的红色荧光探针。
同年,基于d-PeT工艺,研究团队还开发了首个以2MeTG为核心荧光团的PSMA羧肽酶反应荧光探针。通过评估芳基谷氨酸偶联物与PSMA的反应性,研究团队发现Phe-AF-Glu因含有偶氮甲酰基连接体,可被PSMA有效识别和水解(图23(a))。研究团队重点研究了这种偶氮甲酰基底物,认为PSMA介导的水解会导致芳基电子密度显著变化,进而通过PeT过程转化为荧光激活。基于这一机制,研究团队设计并合成了5GluAF-2MeTG,其在2MeTG的苯基上引入了偶氮甲酰基-Glu分子作为底物。该探针初始荧光被d-PeT抑制,但在与PSMA反应后,由于d-PeT受到抑制,荧光得以激活(图23(b)和(c))。该探针能够选择性检测PSMA阳性的LNCaP前列腺癌细胞,而在PSMA阴性的PC3前列腺癌细胞中则无荧光信号(图23(d)和(e))。此外,在PSMA阳性的人类前列腺癌组织中,该探针显示出明显的荧光增强(图23(f)-(h))。然而,该探针的一个限制是,由于PSMA在正常前列腺组织中的非特异性表达,它可能在某些标本中显示出背景荧光。 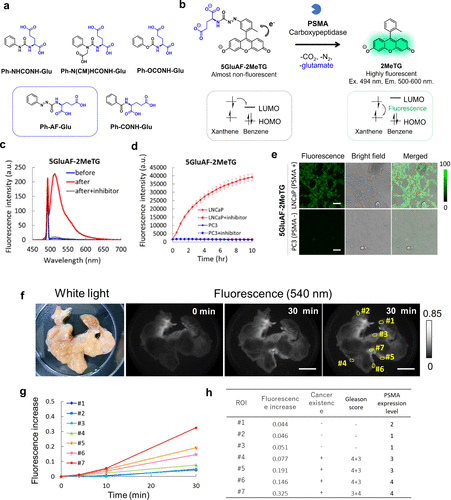 图 23.使用基于 d-PeT 工艺的 PSMA 反应荧光探针对前列腺癌进行荧光检测。
图 23.使用基于 d-PeT 工艺的 PSMA 反应荧光探针对前列腺癌进行荧光检测。
2021年,研究团队采用d-PeT工艺,以荧光素为荧光团核心,开发出碱性羧肽酶反应型荧光探针5ArgAF-FI。该探针初始荧光被d-PeT抑制,但在与碱性羧肽酶反应后,由于d-PeT受到抑制,荧光得以显著激活(图24(a))。尽管该探针能够在体外检测碱性羧肽酶的活性,但由于其膜渗透性较差,无法有效观察到碱性羧肽酶阳性细胞。为了优化细胞成像探针,研究团队在荧光素分子中引入了乙酰基,合成了5ArgAF-FDA。该探针的设计思路是在与细胞外羧肽酶M(CPM)反应后,生成膜渗透性良好的荧光素二乙酸酯(FDA),随后FDA在细胞内酯酶的作用下进一步反应,产生荧光素,从而实现对CPM阳性MDCK细胞的选择性可视化(图24(b)和(c))。鉴于CPM是某些类型癌症的生物标志物,这种探针在癌症特异性成像方面具有潜在应用价值。 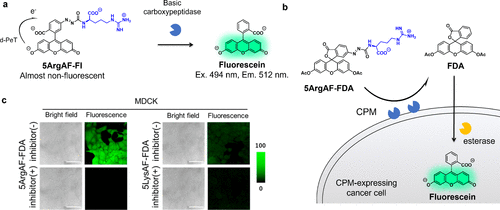 图 24.基于 PeT 的 CPM 反应荧光探针。
图 24.基于 PeT 的 CPM 反应荧光探针。
2.2.3. 基于 PeT 的醌氧化还原酶活性荧光探针
2013年,Silvers等人成功开发出首个基于d-PeT机制的NQO1反应荧光探针(图25(a)),这一创新为化学与材料学领域带来了新突破。他们所设计的Q3NI探针,其荧光原初因d-PeT与醌丙酸分子相互作用而淬灭。一旦底物分子被移除,荧光团NI便完全去淬,并在约470纳米波长处呈现出强烈的荧光信号。借助此探针,研究人员成功地在体外对HT-29和A549细胞中的NQO1活性进行了检测(图25(b))。 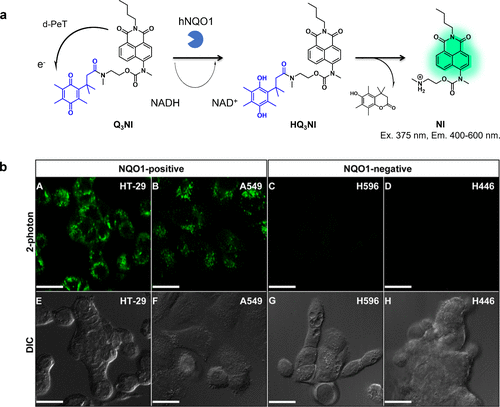 图 25.基于 d-PeT 的 NQO1 反应荧光探针。
图 25.基于 d-PeT 的 NQO1 反应荧光探针。
2017年,Shen等人进一步研发了一种针对hNQO1的波长可移动近红外荧光探针Q3STCy(图26(a)),为癌症成像提供了新的手段。在与hNQO1反应后,TCy中位的氨基甲酸酯键发生裂解,导致吸收和荧光的最大波长出现了显著的蓝移现象(图26(b))。鉴于Q3STCy的量子产率(0.0046)远低于TCy报告物的量子产率(Φ = 0.063),研究团队深入探讨了其淬灭机制。他们利用雷姆-韦勒方程、伏安半波电位以及光谱数据进行分析,得出结论:从TCy激发态至缺电子醌分子的电子转移(d-PeT)在热力学上具备可行性。因此,Q3STCy的荧光被认为是通过d-PeT过程受到抑制。值得一提的是,在腹腔注射Q3STCy后,研究人员成功观察到SHIN3腹膜转移灶(图26(c)),这进一步验证了该探针在癌症成像中的潜在应用。 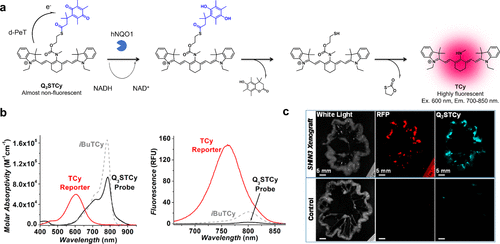 图 26.基于 d-PeT 和波长偏移的 hNQO1 近红外荧光探针。
图 26.基于 d-PeT 和波长偏移的 hNQO1 近红外荧光探针。
基于PeT的酶促活化探针在癌症成像领域具有广泛应用前景。如图27所示,本文介绍的TG衍生物中,荧光量子产率(Φfl)受到苯分子的氧化电位和HOMO能级,以及呫吨分子的还原电位的影响,因此这些基于PeT的探针的荧光可以实现精确控制。利用雷姆-韦勒方程和马库斯的电子转移反应理论,可以预测PeT的速率,从而合理设计PeT探针。迄今为止,PeT途径已成功应用于设计各种荧光探针,用于检测金属离子、H2O2和NO等生物分析物。尽管可以开发出具有高Φfl的小分子探针,但在反应前完全淬灭荧光需要对决定PeT驱动力的多个因素进行精细调整。不完全淬灭可能导致本底荧光,这在癌症成像中可能引发问题,特别是针对波长较长的可激发荧光团。 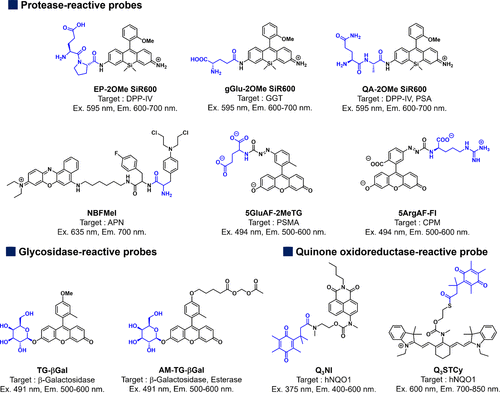 图 27.已报道的基于 PeT 的酶促活荧光探针的化学结构、光学特性和成像目标。
图 27.已报道的基于 PeT 的酶促活荧光探针的化学结构、光学特性和成像目标。
正如EP-2OMe SiR600和Q3STCy所展示的那样,部分基于PeT的荧光探针在酶反应后会发生吸收波长的偏移,这与2.4节所述的吸收波长偏移探针具有相似的荧光开启机制。这些基于波长偏移的可激活荧光探针需根据其吸光度或荧光光谱选择适合的带通滤波器。然而,由于光谱分离不足或缺乏合适的滤光片设置,这些探针有时会出现较高的背景信号。相对而言,无论滤光片如何设置,基于PeT工艺的可激活荧光探针的初始荧光都能得到很好的淬灭。这一优势使得PeT工艺成为体内外癌症成像的理想淬灭机制。结合使用PeT过程和波长偏移技术,可以实现更高的激活倍数。
近年来,随着相关生物标记酶的发现,基于PeT荧光转换机制的PSMA反应探针已相继问世。这些创新性的荧光探针有望为癌症成像提供重要的选择。
2.2.4. 基于分子内螺环化的可活化荧光探针
2011年,研究团队通过精准调控罗丹明分子的螺环化平衡,成功开发出一种用于酶活性检测的可激活荧光探针。传统的罗丹明绿(RG)荧光特性并不受pH值影响。然而,通过羧基转化为更具亲核性的羟甲基,研究团队制备了羟甲基罗丹明绿(HMRG),其在碱性pH值(>9)下以无色、无荧光的螺环形式存在(图28(a))。值得一提的是,在HMRG的一个氨基上引入酰胺键,会显著改变其螺环化平衡常数。例如,Ac-HMRG仅在酸性环境(pH<6)中展现出荧光开环状态,而在生理pH值下则保持无色、无荧光的封闭状态。 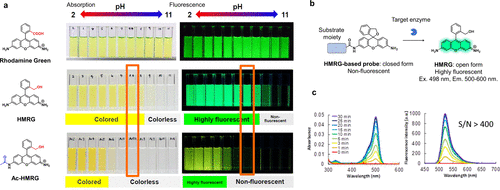 图 28.基于分子内螺环化的荧光探针的开发。
图 28.基于分子内螺环化的荧光探针的开发。
基于这种pKcycl的变化,研究团队设计了一种可激活荧光探针。在没有目标酶存在时,探针保持无色、无荧光状态;而当癌症特异性氨肽酶水解底物肽时,会产生高荧光强度的HMRG,其量子产率高达0.81(图28(b))。以亮氨酸氨肽酶(LAP)为例,LAP反应的Leu-HMRG在LAP活性作用下,荧光增强超过400倍(图28(c))。这一成果为酶活性检测提供了新的有力工具。
2.2.5. 基于螺环化的蛋白酶活性荧光探针
基于分子内螺环化设计策略,研究团队成功开发出一种癌症成像专用的氨肽酶反应性荧光探针。GGT作为一种标志性的生物标志物氨肽酶,在癌细胞中的表达水平显著上升。2011年,研究团队验证了螺环化设计可激活探针的实用性,通过合成具有GGT反应性的gGlu-HMRG,利用γ-谷氨酰分子作为底物氨基酸,实现了对表达GGT的癌细胞的体外选择性检测。同年,研究团队在腹膜转移小鼠模型中验证了该探针的效用,结果显示,给药后短时间内即可观察到微小癌结节。为验证探针在实际人体癌症组织中的效用,研究团队进一步在各种人体癌症手术标本上评估了gGlu-HMRG。然而,由于正常组织与癌症组织间GGT活性的差异不足,部分标本呈现出背景荧光。因此,研究团队将目光转向其他酶靶标。 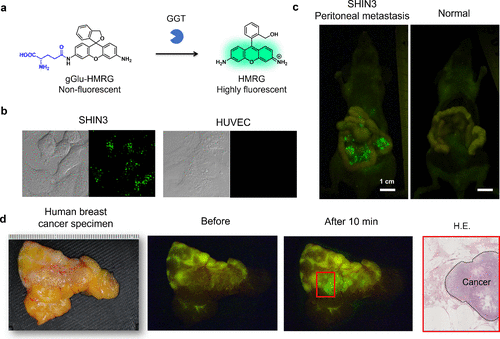 图 29.利用螺环化设计策略的 GGT 反应荧光探针
图 29.利用螺环化设计策略的 GGT 反应荧光探针
2016年,鉴于癌症中氨肽酶活性的普遍升高,研究团队利用手术切除的人类食管鳞状细胞癌(ESCC)标本评估了多种氨肽酶反应探针,发现DPP-IV在ESCC中活性特异性增强,进而开发出适用于ESCC荧光成像的DPP-IV反应性EP-HMRG。 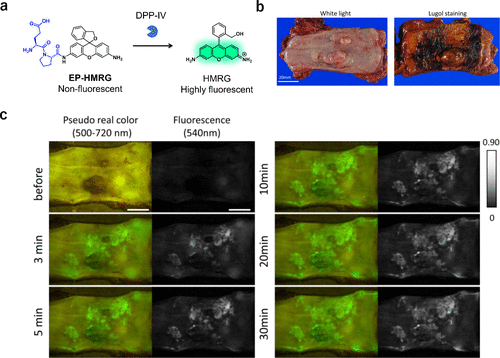 图 30.使用 DPP-IV 反应荧光探针对 ESCC 进行荧光成像
图 30.使用 DPP-IV 反应荧光探针对 ESCC 进行荧光成像
2014年,研究团队专注于半胱氨酸蛋白酶cathepsin家族的研究,特别是cathepsin B和cathepsin L,并成功合成了具有cathepsin底物分子的荧光探针Z-Phe-Arg-HMRG和Z-Arg-Arg-HMRG。鉴于Z-Phe-Arg-HMRG展现出更高的酪蛋白酶特异性,研究团队对其在癌症成像中的应用进行了评估。由于SKOV-3细胞缺乏显著的GGT活性,gGlu-HMRG对其检测效果不佳。2017年,研究团队进一步研究了在前列腺癌中过度表达的2型跨膜丝氨酸蛋白酶家族成员hepsin和matriptase,通过在HMRG中引入它们的底物分子,成功开发出hepsin和matriptase反应探针Ac-KQLR-HMRG。小鼠腹腔注射该探针后,成功观察到PC3前列腺癌。 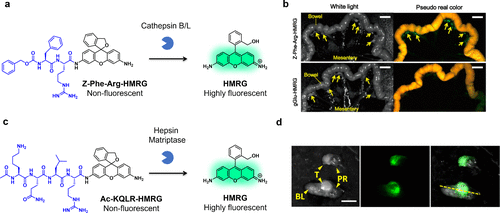 图 31.使用基于 cathepsin 反应的 HMRG 探针对 SKOV-3 模型小鼠进行荧光成像。
图 31.使用基于 cathepsin 反应的 HMRG 探针对 SKOV-3 模型小鼠进行荧光成像。
此外,研究团队还基于分子内螺环化设计策略,开发了红色发光和黄色发光的蛋白酶反应型荧光探针。通过合成多种单久留利定融合类似物并测量其pKcycl值,研究团队筛选出HMJSiR和HMJCR作为有效的荧光团 骨架,它们具有最佳的pKcycl值,可用于开发检测GGT活性的红色或黄色发光荧光探针,进而实现癌症组织的多色成像。 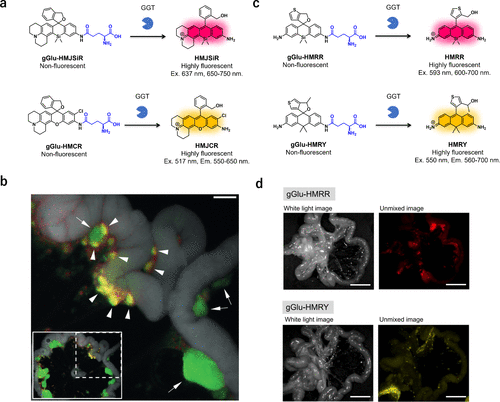 图 32.针对 GGT 的红色或黄色荧光探针。
图 32.针对 GGT 的红色或黄色荧光探针。
2020年,研究团队提出了一种基于量子化学计算的新颖方法,旨在精确预测羟甲基罗丹明(HMR)探针的pKcycl值。通过深入的计算分析,研究团队发现,在估算荧光开环与非荧光封闭形式间的自由能差时,考虑水分子的影响至关重要。利用此方法,研究团队成功预测了未知HMR衍生物的pKcycl值,并成功开发出了用于GGT活性检测的红色发光gGlu-HMRR和黄色发光gGlu-HMRY探针(图32(c))。这些探针在癌症成像领域具有广泛应用(图32(d)),显著减少了设计荧光探针时合成一系列HMR衍生物的需求。 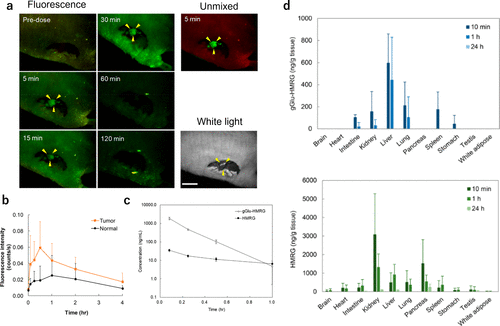 图 33.通过静脉注射 gGlu-HMRG 对小鼠模型中的 A549 肿瘤进行荧光成像。
图 33.通过静脉注射 gGlu-HMRG 对小鼠模型中的 A549 肿瘤进行荧光成像。
在荧光成像实验中,研究团队采用了局部喷洒探针溶液或腹腔给药的方式。2022年,研究团队进一步探索了通过静脉注射基于HMRG的探针对深部肿瘤进行染色的可能性。令人欣喜的是,通过静脉注射1 mg/kg gGlu-HMRG,研究团队成功观察到了小鼠皮下A549肿瘤(图33(a))。然而,研究团队也注意到非肿瘤组织的本底荧光有所增强。给药30分钟后,肿瘤部位的荧光强度达到峰值(图33(b))。此外,研究团队观察到gGlu-HMRG在血浆中的清除速度较快(t1/2 = 0.114 h),而HMRG的清除速度相对较慢(t1/2 = 0.548 h)(图33(c))。组织分布实验结果显示,gGlu-HMRG在肾脏、肝脏和胰腺等正常器官中也有激活现象(图33(d)),这可能是非肿瘤组织本底荧光增强的原因。此外,研究团队还验证了通过静脉注射gGlu-HMRG可以观察到小鼠模型中的A549肺癌(图34)。 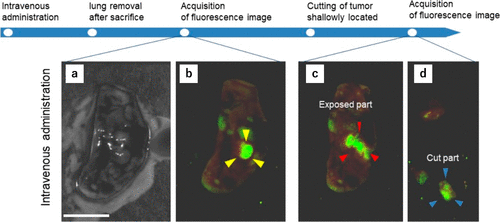 图 34.给 A549 肿瘤小鼠静脉注射(0.33 毫克/千克)gGlu-HMRG 后,浅层和深层肺肿瘤的体内外荧光成像。
图 34.给 A549 肿瘤小鼠静脉注射(0.33 毫克/千克)gGlu-HMRG 后,浅层和深层肺肿瘤的体内外荧光成像。
螺环化设计策略不仅局限于氨基肽酶,同样适用于羧肽酶等其他蛋白酶。2018年,研究团队建立了一种基于分子内螺环化的羧肽酶反应性荧光探针的多功能设计策略,通过羧肽酶催化的脂肪族羧酰胺到脂肪族羧酸盐的结构转换实现荧光活化。基于此设计,研究团队成功开发出针对羧肽酶A(CPA)的荧光探针diClHMRBC-CONH-Phe和针对羧肽酶B(CPB)的荧光探针diClHMRBC-CONH-Arg(图35(a))。在CPA存在下,diClHMRBC-CONH-Phe的荧光增强了23倍;而在CPB存在下,diClHMRBC-CONH-Arg的荧光增强了80倍。值得一提的是,diClHMRBC-CONH-Arg还能通过可视化羧肽酶活性来检测小鼠体内外的胰液渗漏(图35(b))。尽管激活倍数不高,但这些探针在胰瘘的术中诊断中具有潜在应用价值。鉴于不同癌症中羧肽酶的表达水平存在差异,这种设计方法有望为癌症诊断领域开发一系列羧肽酶反应探针提供新思路。 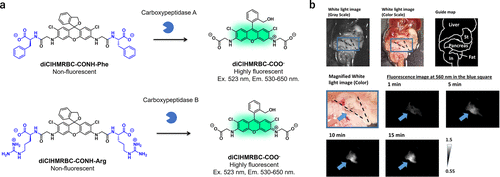 图 35.基于螺环化设计策略的羧肽酶荧光探针。
图 35.基于螺环化设计策略的羧肽酶荧光探针。
2.2.6. 基于螺环化的糖苷酶活性荧光探针
2011年,研究团队研究团队成功研发了一种新型 骨架——羟甲基N,N-二甲基荧光染料(HMDER),用于开发β-半乳糖苷酶反应探针。通过在HMDER的氧杂蒽分子羟基上引入底物半乳糖,研究团队合成了HMDER-βGal(图36(a))。在酶促反应前,HMDER-βGal呈无荧光螺环形式,但与β-半乳糖苷酶作用后,其荧光强度提升76倍(图36(b))。该探针能够监测培养癌细胞中的β-半乳糖苷酶活性。然而,受正常组织背景荧光影响,小鼠模型中微小癌组织的β-半乳糖苷酶活性难以特异性观察。这主要源于HMDER-βGal的螺环化平衡pKcycl值为6.9(图36(c))。 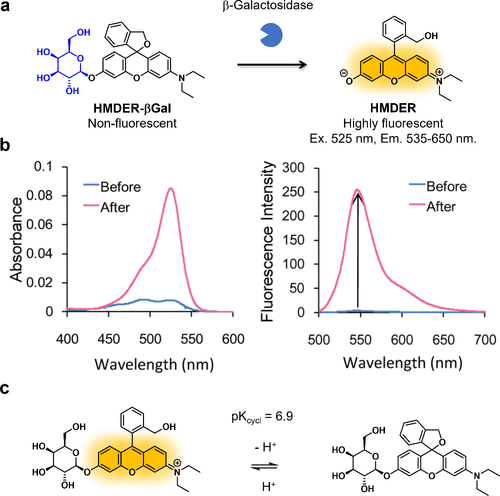 图 36.基于螺环化设计策略的针对 β-半乳糖苷酶的荧光探针。
图 36.基于螺环化设计策略的针对 β-半乳糖苷酶的荧光探针。
为降低探针在生理pH下的荧光背景,研究团队于2015年对HMDER化学结构进行了优化。发现在rhodol的的N原子上引入三氟乙基可使pKcycl值向酸性pH移动。基于这一发现,研究团队成功开发了一种高灵敏度的β-半乳糖苷酶反应荧光探针——羟甲基N-三氟乙基rhodol (HMRef)-βGal,其pKcycl值为5.4,意味着在生理pH下,该探针以非螺环形式存在的比例超过99%(图37(a)和(b))。此外,荧光产物HMRef的荧光量子产率(Φfl = 0.78)远高于HMDER(Φfl = 0.14)。得益于优化的pKcycl值和增强的荧光量子产率,HMRef-βGal的荧光增强倍数超过1400倍,成功在小鼠模型中观察到小于1毫米的腹膜卵巢癌。因此,HMRef 骨架在检测具有增强糖苷酶活性的微小癌症组织方面展现出巨大潜力(图37(c))。此外,HMRef 骨架还被广泛应用于各种糖苷酶活性荧光探针的开发。 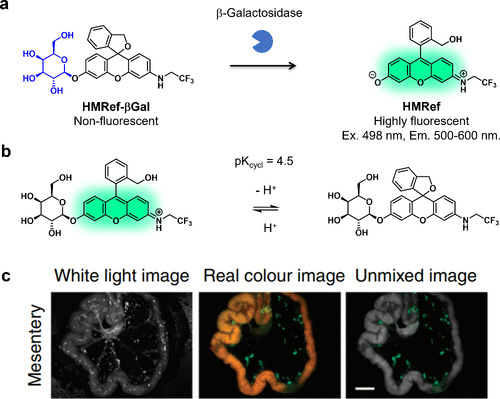 图 37.基于 HMRef 骨架的高灵敏度 β-半乳糖苷酶反应荧光探针。
图 37.基于 HMRef 骨架的高灵敏度 β-半乳糖苷酶反应荧光探针。
2016年,研究团队专注于结肠癌中β-己糖胺酶活性的研究,利用HMRef成功开发了一种β-己糖胺酶反应探针HMRef-βGlcNAc(图38(a))。研究团队通过HEXA和HEXB验证了该探针的活化能力,并成功应用于HEX阳性的人类结直肠癌标本的观察(图38(b))。荧光区域与病理确定的癌症病灶及HEXA过表达区域高度吻合。2020年,研究团队还报道了一种基于HMRef骨架的硅糖苷酶反应探针HMRef-S-Neu5Ac。 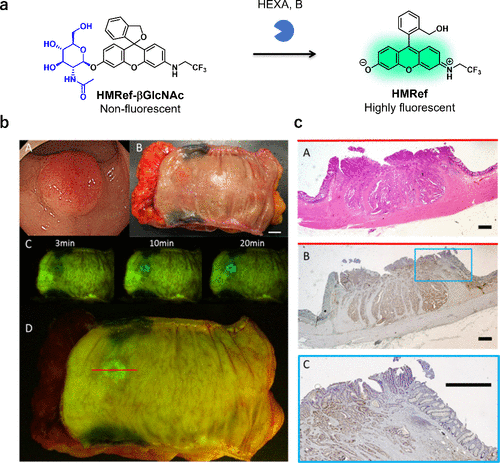 图 38.使用 β-己糖胺酸酶反应荧光探针对人类结直肠癌进行荧光成像。
图 38.使用 β-己糖胺酸酶反应荧光探针对人类结直肠癌进行荧光成像。
同年,研究团队开发了多种糖苷酶反应探针,并通过第4节所述的人体手术标本直接筛查方法,确定MAN2C1为乳腺癌的潜在生物标志酶。以α-甘露糖为底物的探针HMRef-αMan在α-甘露糖苷酶活性存在时表现出显著的荧光增强,为乳腺癌组织的高灵敏度和特异性观察提供了有力工具(图39)。荧光区域与病理确定的癌症病灶及MAN2C1基因缺失区域高度一致。 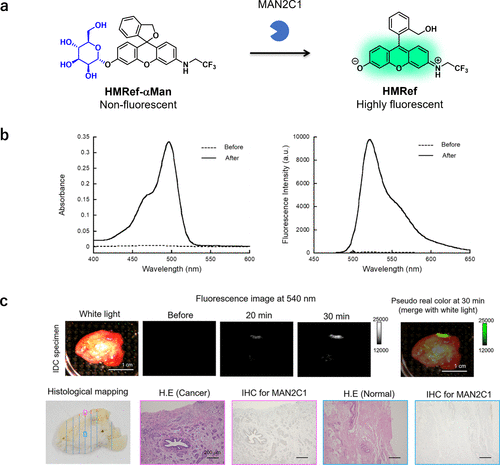 图 39.使用 MAN2C1 反应荧光探针在术中快速观察乳腺癌。
图 39.使用 MAN2C1 反应荧光探针在术中快速观察乳腺癌。
在最近的研究中,研究团队还探索了利用酶活化荧光探针组合对肿瘤类型进行光学鉴别的可能性。有趣的是,研究团队发现纤维腺瘤(FA)的MAN2C1活性通常高于恶性乳腺癌。与浸润性导管癌(IDC)或导管原位癌(DCIS)等乳腺癌组织相比,HMRef-αMan在纤维腺瘤组织中展现出更高的荧光增量,而GGT反应探针在恶性和良性组织中的激活情况相似。因此,研究团队提出结合使用绿色发光的α-甘露糖苷酶反应型HMRef-αMan和红色发光的GGT反应型gGlu-2OMe SiR600来区分癌症和良性病变(图40(a))。实际上,在绿色通道中,FA组织比癌症组织显示出更高的荧光激活度,而在红色通道中,癌症组织和FA组织的荧光激活度相似。另一方面,正常乳腺组织在两个通道中几乎无荧光激活。在合成图像中,正常区域无荧光,癌症组织显示为红色,FA组织显示为黄色,从而实现了基于特定酶活性的正常组织、乳腺癌和良性病变的光学鉴别(图40(b))。 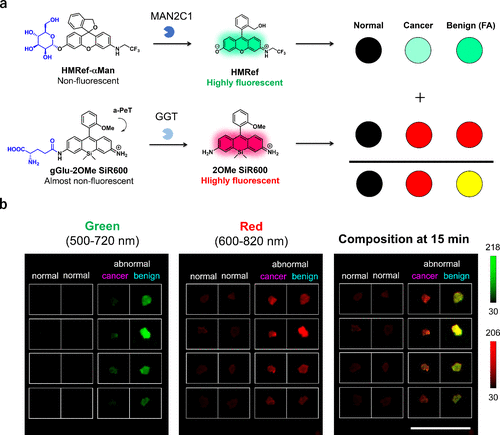 图 40.应用荧光探针对乳腺癌和乳腺良性病变进行光学鉴别。
图 40.应用荧光探针对乳腺癌和乳腺良性病变进行光学鉴别。
2.2.7. 基于螺环化的醌氧化还原酶活性荧光探针
2017年,Best等人发表了关于以HMRG为骨架荧光团的hNQO1反应荧光探针Q3HMRG的研究报告(图41)。当存在hNQO1时,Q3HMRG的荧光强度显著提升。此外,他们还成功利用Q3HMRG对hNQO1阳性的HT29和OVCAR-3细胞进行了观察。 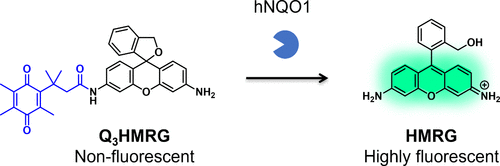 图 41. 基于螺环化设计的 hNQO1 反应荧光探针。
图 41. 基于螺环化设计的 hNQO1 反应荧光探针。
2.2.8. 具有细胞保留能力的功能化荧光探针
2016年,研究团队借助甲脒醌化学手段,设计出了一种功能化荧光探针SPiDER-βGal,其能以单细胞分辨率精准检测β-半乳糖苷酶活性。该探针的结构灵感来源于HMDER,当其底物分子遭遇酶裂解时,不仅荧光激活,同时获得与细胞内蛋白质结合的能力,确保荧光产物稳固地留存在活细胞中(图42(b))。基于这一特性,研究团队成功实现了β-半乳糖苷酶lacZ阳性HEK细胞的单细胞分辨率标记(图42(c)),且这种标记与免疫组化染色兼容,使得lacZ阳性组织的选择性荧光标记成为可能(图42(d))。 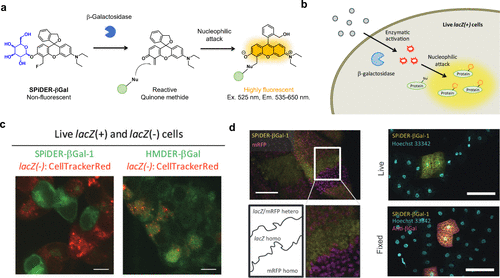 图 42.能以单细胞分辨率检测 β-半乳糖苷酶活性的功能化荧光探针。
图 42.能以单细胞分辨率检测 β-半乳糖苷酶活性的功能化荧光探针。
至2021年,研究团队进一步评估了SPiDER-βGal在胃癌转移观察方面的应用潜力,结果表明该探针能够精准检测小鼠模型中胃癌细胞系的腹膜转移(图43(a)),甚至在新鲜切除的人体手术标本中也能观察到胃癌的踪迹(图43(b))。 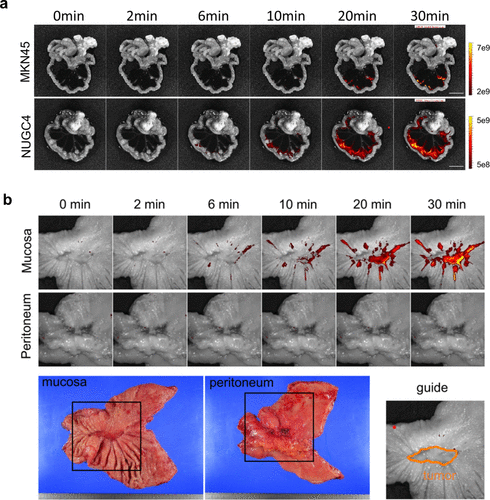 图 43.用 β-半乳糖苷酶反应荧光探针 SPiDER-βGal 观察胃癌腹膜转移。
图 43.用 β-半乳糖苷酶反应荧光探针 SPiDER-βGal 观察胃癌腹膜转移。
同年,研究团队深入研究了偶氮醌甲醚的反应特性,并据此开发出一款具备细胞保留能力的功能化GGT反应荧光探针4-CH2F-HMDiEtR-gGlu(图44(a))。与SPiDER-βGal相似,该探针在GGT活化过程中生成甲氧基偶醌中间体,该中间体进一步与细胞内亲核物(如半胱氨酸和谷胱甘肽GSH)反应,使探针牢固锚定于细胞内,有效标记表达GGT的细胞(图44(b)和(c))。此外,该探针还成功应用于病人异种移植(PDX)小鼠的癌症成像,且兼容癌症组织的固定和免疫组化染色(图44(d))。 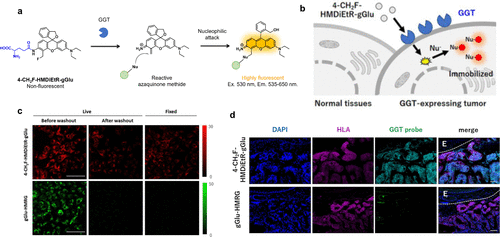 图 44.用于持久肿瘤成像的功能化 GGT 反应荧光探针。
图 44.用于持久肿瘤成像的功能化 GGT 反应荧光探针。
螺环化设计为研究团队提供了开发可激活酶探针的灵活框架。通过在氧杂蒽分子的羟基或氨基上引入不同底物分子,研究团队可以定制针对各种酶活性的荧光探针。同时,螺环化设计也适用于开发光敏剂。借助量子化学计算预测罗丹明衍生物的pKcycl值,研究团队得以理性设计用于癌症成像的骨架荧光团。这些基于螺环化的探针在反应前荧光几乎被完全淬灭,与目标酶反应后则展现出高倍荧光增强和极低背景,大大提高了检测灵敏度和特异性。 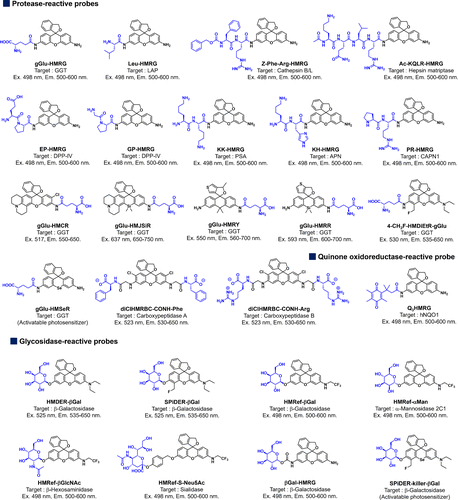 图 45.已报道的螺环化酶促荧光探针的化学结构、光学特性和成像目标。
图 45.已报道的螺环化酶促荧光探针的化学结构、光学特性和成像目标。
HMRG和HMRef等荧光团在可见光范围内(500-600纳米)具有高荧光量子产率,使得这些探针能够高灵敏、高可见度地检测癌症。因此,它们成为快速检测和术中实时使用的理想选择,通过局部喷洒探针溶液,即可迅速识别手术边缘的微小癌结节。此外,结合内窥镜检查,这些探针还可用于食道癌、胃癌和结肠癌等的检测,但前提是开发能够检测500-600纳米波长范围内荧光发射的内窥镜。目前,研究团队正利用各种人体外科癌症标本筛选荧光探针,已发现多种适用于不同癌症的有效成像探针。这些探针未来或可用于系统用药,但其在癌症组织中的保留能力和血液半衰期尚需进一步优化。值得一提的是,部分基于螺环化设计的探针已进入临床试验阶段,展现了良好的应用前景。
【激活型癌症荧光探针】-基于波长变化的可激活荧光探针
Activity-Based Fluorescence Diagnostics for Cancer
激活型癌症诊疗探针
据报道,存在多种可激活荧光探针,它们基于吸收或荧光波长偏移的原理设计。这些探针在初始状态下,通过底物与荧光团羟基或氨基的结合,有效地抑制了荧光的发射。然而,当这些探针遭遇酶反应时,会引发波长偏移现象,进而激活荧光。这种波长偏移现象可归因于多种机制,包括简单的分子结构变化、分子内电荷转移(ICT)和分子内重排,或是这些机制的协同作用。这些机制的运用,使得这类探针在化学和生物探测领域具有广阔的应用前景。
2.3.1. 基于波长偏移的蛋白酶活性荧光探针
2022年,研究团队成功研发了基于非对称Si-罗丹明(SiR)的LAP或DPP-IV靶向近红外荧光探针。在研究中,研究团队观察到,当蒽分子上的氨基转化为酰胺基时,部分Si-罗丹明染料的吸收最大值会发生显著的蓝移(超过110纳米)。基于这一特性,研究团队成功开发出LAP反应型Leu-SiR640和DPP-IV反应型EP-SiR640荧光探针(图46(a))。在637纳米波长激发下,Leu-SiR640在665纳米波长处的荧光强度提升了669倍,而EP-SiR640则增强了220倍(图46(b))。这些探针在小鼠癌症模型以及人体ESD标本的局部应用中均展现出良好的癌症检测效果(图46(c)和(d))。此外,研究团队依据SiR衍生物的吸收波长偏移机制,进一步开发了一系列2Me SiR600荧光探针,用于蛋白酶的检测。通过局部喷洒探针溶液,研究团队成功地观察到人类肺癌和胆管癌的病灶,相关研究成果详见第4节。 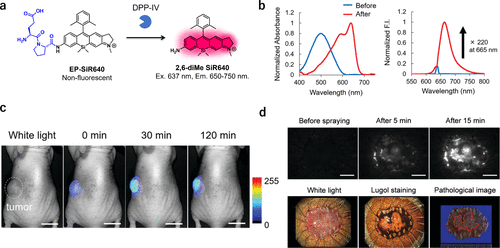 图 46.针对 DPP-IV 的近红外荧光探针。
图 46.针对 DPP-IV 的近红外荧光探针。
2021年,Mukaimine等人成功研制出首个基于不对称铋-罗丹明的GGT反应探针BiRGlu(图47)。他们证实,在红色激发光下,BiRNH表现出优异的发射和光敏特性,而N-乙酰化衍生物BiRAc则显示出较低的吸收波长色移以及发射和光敏能力的减弱。在GGT活性存在的情况下,BiRGlu能够选择性地生成BiRNH,并在A549细胞中实现荧光增强和光毒性。 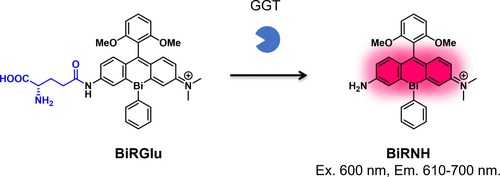 图 47.基于不对称铋-罗丹明的含氟光敏剂
图 47.基于不对称铋-罗丹明的含氟光敏剂
2018年,Li等人以二氰异佛尔酮为核心近红外荧光团,开发出一种GGT反应探针NIR-SN-GGT(图48(a))。该探针在初始状态下近红外区域的荧光较弱,但在GGT的作用下,由于荧光波长的红移,其近红外荧光显著增强(图48(b)和(c))。与GGT反应后,荧光强度提升了21.8倍,这主要归因于ICT的恢复。在小鼠模型中,通过瘤内注射该探针,研究团队成功观察到GGT阳性的癌症病灶(图48(d))。该探针具有210纳米的大斯托克斯偏移,有效避免了自吸收。然而,这种荧光团的本底荧光较高,导致其折叠激活性相对较低。 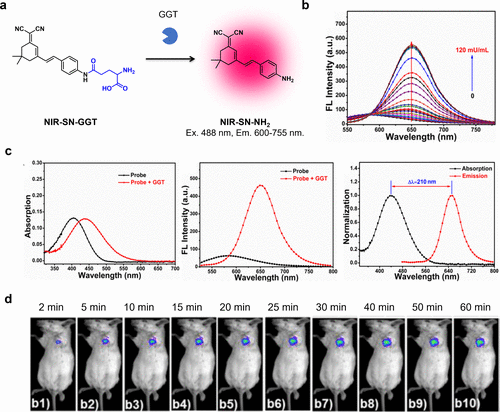 图 48.基于二氰异佛尔酮的 GGT 反应近红外探针。
图 48.基于二氰异佛尔酮的 GGT 反应近红外探针。
2020年,Li等人聚焦于癌症中的APN活性,以二氰异佛尔酮为荧光团核心,开发出一种近红外荧光探针YH-APN,用于检测APN活性(图49(a))。与NIR-SN-GGT类似,该探针在初始状态下近红外区域的荧光较弱,但在APN的作用下,其荧光显著增强(图49(b))。计算结果显示,该探针对APN的检测限达到0.13纳克/毫升。通过局部喷洒该探针,研究团队成功观察到具有高信噪比的HepG-2异种移植肿瘤(图49(c)和(d))。 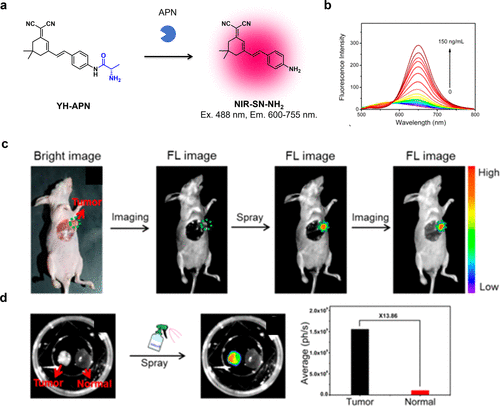 图 49.基于二氰异佛尔酮的 APN 反应近红外探针
图 49.基于二氰异佛尔酮的 APN 反应近红外探针
2016年,Gu等人设计了一种以二氰基亚甲基-4H-吡喃为核心荧光团的近红外荧光探针,专门用于检测LAP活性(图50(a))。(136)当该探针与LAP发生反应后,不仅出现了显著的斯托克斯偏移(达到205纳米),其吸收光谱和荧光光谱也呈现出了红色偏移的特征(图50(b) 和 (c))。这种荧光增强的现象主要归因于ICT的恢复。此外,该探针成功实现了对活体HeLa细胞中LAP活性的比率成像(I660nm/I535nm),为相关研究提供了有力工具(图50(d))。 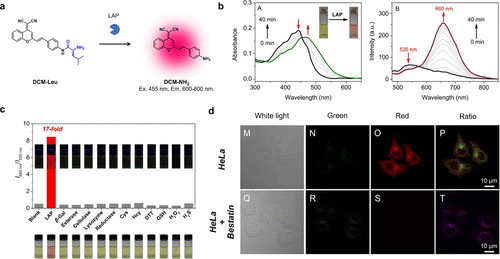 图 50.基于二氰亚甲基-4H-吡喃荧光团的 LAP 反应型近红外荧光探针。
图 50.基于二氰亚甲基-4H-吡喃荧光团的 LAP 反应型近红外荧光探针。
2017年,Luo等人研发了一种基于美罗青荧光团(mCy-Cl)的GGT反应性近红外荧光探针GANP(图51(a))。他们巧妙地利用自巯基连接体将GGT的底物分子与mCy-Cl的羟基相结合。在GGT的作用下,GANP的荧光强度显著提升了100倍(图51(b)),并在近红外区域展现出了高量子产率(Φfl = 0.3)。这一特性使得GANP能够在小鼠模型的HCT116肿瘤中实现高效的荧光成像,为肿瘤检测提供了新方法(图51(c))。 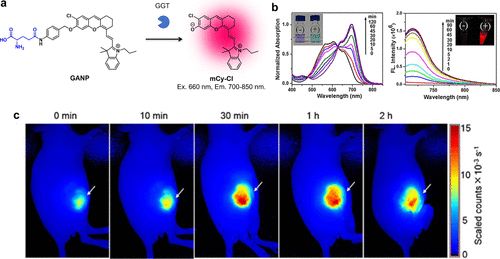 图 51.基于美蓝荧光团的 GGT 靶向近红外荧光探针。
图 51.基于美蓝荧光团的 GGT 靶向近红外荧光探针。
2019年,Zhou等人以GSH基团为反应基团,以Pyronin B为荧光团,开发了一种GGT反应比率荧光探针Py-GSH(图52(a))。GGT能够裂解Py-GSH中的γ-谷氨酰基,进而触发快速的分子内重排反应。由于Py-GSH和转化后的Py-CG在发射波长上存在75纳米的差异,因此该探针能够实现对GGT活性的比率荧光检测(图52(b))。此外,Py-GSH在小鼠腹膜转移的小肿瘤检测中表现出了良好的应用前景(图52(c)和(d))。 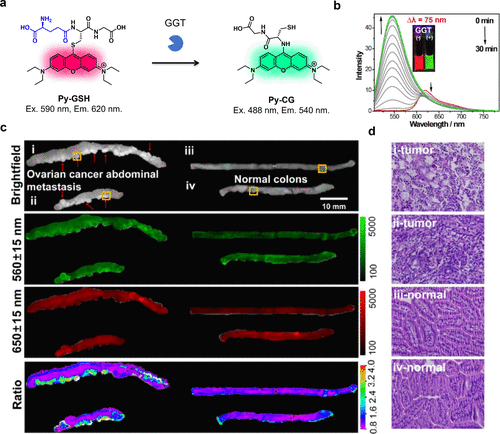 图 52.基于分子内重排的 GGT 比率荧光探针。
图 52.基于分子内重排的 GGT 比率荧光探针。
同年,Ou-Yang等人成功研制出首个以GGT为靶标的零交叉比度近红外荧光探针Cy-GSH(图53(a))。(221)在GGT的作用下,Cy-GSH展现出了从805纳米到640纳米的大幅发射偏移(图53(b))。这种转变同样归因于快速的分子内重排反应,导致Cy-GSH转化为Cy-N结构。通过小鼠模型中的肿瘤和转移灶成像实验,他们验证了Cy-GSH在荧光成像引导手术中的潜在应用价值(图53(c))。这些基于分子内重排原理的探针因其光学特性的显著变化而实现了高对比度成像。然而,目前这些探针的应用范围仍受限于GGT,因为它们的底物分子需要具备GSH结构。 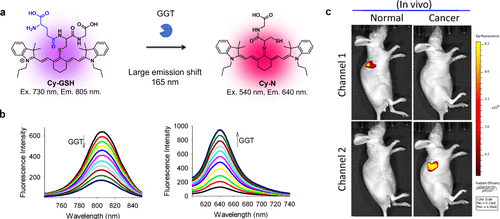 图 53.使用基于分子内重排的 GGT 靶向零交叉比值近红外探针进行癌症成像。
图 53.使用基于分子内重排的 GGT 靶向零交叉比值近红外探针进行癌症成像。
2.3.2. 基于波长偏移的糖苷酶活性荧光探针
2011年,研究团队以TokyoMagenta(TM)骨架为基础,成功开发出一种具备高关断/开启比的β-半乳糖苷酶靶向红色荧光探针2-Me TM βgal(图54(a))。通过利用2-Me TM在羟基去质子化时吸收光谱发生大幅蓝移的特性,研究团队实现了高关/开比率的糖苷酶红色荧光探针的开发。这一特性使得2-Me TM βgal成为β-半乳糖苷酶的优异荧光探针。在β-半乳糖苷酶的作用下,该探针的荧光强度显著增强(图54(b)),并能够选择性地在lacZ阳性的HEK293细胞中发光(图54(c))。 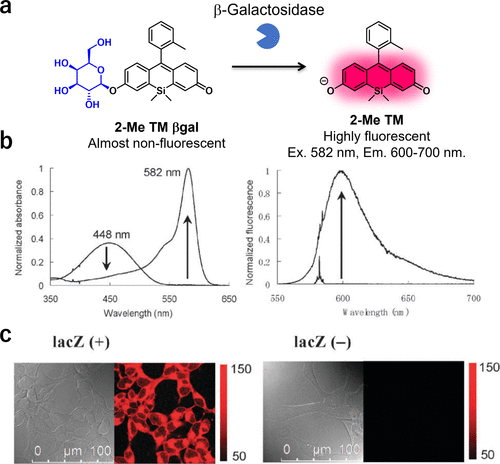 图 54.基于 TM 荧光团的靶向 β-半乳糖苷酶的红色荧光探针。
图 54.基于 TM 荧光团的靶向 β-半乳糖苷酶的红色荧光探针。
2016年,Gu等人以二氰基亚甲基-4H-吡喃(DCM)为核心荧光团,成功开发出一种靶向β-半乳糖苷酶的近红外荧光探针(图55(a))。(154) 该探针DCM-βgal在440纳米波长处呈现出典型的宽吸收带,这归因于其固有的分子内电荷转移(ICT)特性。在β-半乳糖苷酶的作用下,DCM-βgal在440nm处的吸收峰降低,同时伴随着ICT的恢复,在约535nm处出现了一个新的吸收峰。当使用535nm的光激发时,该探针在685nm处展现出强烈的近红外荧光,从而实现了对β-半乳糖苷酶活性的高效荧光检测(图55(b))。他们进一步证实了这种探针在临床前应用中的实用性,能够以低背景信号特异性地观察到小鼠的肿瘤病灶(图55(c)-(f))。 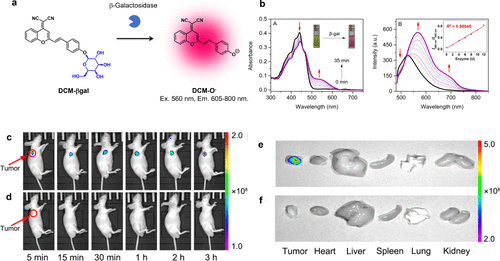 图 55.基于 DCM 荧光团的β-半乳糖苷酶反应型近红外荧光探针。
图 55.基于 DCM 荧光团的β-半乳糖苷酶反应型近红外荧光探针。
2022年,Wu等人以CS-OH(Cl)为核心荧光团,开发出一种灵敏的近红外荧光探针NIR-βGal-2,用于靶向β-半乳糖苷酶(图56(a))。NIR-βGal-2的近红外荧光在初始状态下受到抑制,但在与β-半乳糖苷酶反应后,其吸收光谱发生显著的红移,并伴随近红外荧光的增强,从而实现对β-半乳糖苷酶活性的检测(图56(b))。通过在底物与荧光团CS-OH(Cl)之间引入自巯基连接体,促进了探针与β-半乳糖苷酶的反应。这种探针在培养的癌细胞中成功观察到β-半乳糖苷酶的活性(图56(c)),并在肿瘤模型中通过局部应用展示了其在荧光引导手术方面的潜力(图56(d))。 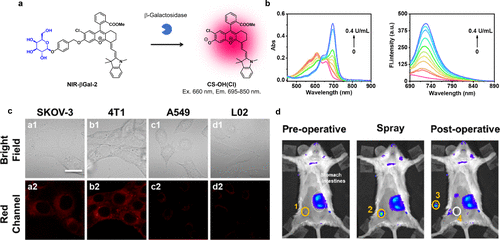 图 56.基于 CS-OH(Cl)荧光团的灵敏近红外 β-半乳糖苷酶反应荧光探针。
图 56.基于 CS-OH(Cl)荧光团的灵敏近红外 β-半乳糖苷酶反应荧光探针。
2023年,Pan等人开发出近红外荧光探针HCyXA-βGal,用于快速精确成像卵巢癌细胞和衰老细胞中β-半乳糖苷酶的活性。与NIR-βGal-2类似,HCyXA在羟基上引入的β-半乳糖底物导致近红外荧光淬灭(图57(a))。(224) 在与β-半乳糖苷酶反应后,探针展现出近红外荧光,从而实现对SKOV-3癌细胞和WI-38衰老细胞中β-半乳糖苷酶活性的荧光成像(图57(b))。 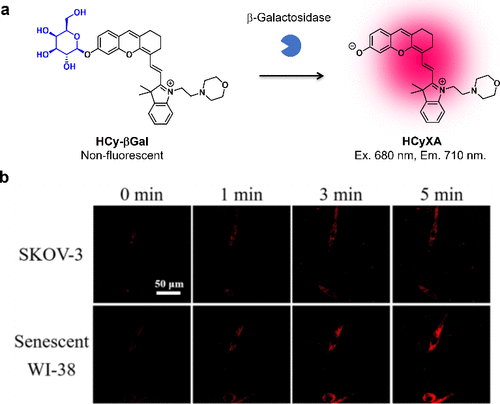 图 57.基于 HCyXA 荧光团的靶向 β-半乳糖苷酶的快速近红外荧光探针。
图 57.基于 HCyXA 荧光团的靶向 β-半乳糖苷酶的快速近红外荧光探针。
2020年,Chen等人以BODIPY为核心荧光团,开发出针对β-半乳糖苷酶的荧光探针BOD-M-βGal。他们通过引入乙烯单元,延长了BODIPY 3位上的π-共轭,从而获得了在第二个近红外窗口区(NIR-II,1000-1700纳米)具有荧光响应性的探针(图58)。与β-半乳糖苷酶反应后,BOD-M-βGal在近红外区域的荧光显著增强,并伴随着130nm的较大斯托克斯位移。这种近红外-II(1000-1200 nm)区域的荧光发射尾迹对于体内癌症成像尤为有利。在小鼠模型中,通过瘤内注射探针,可观察到β-半乳糖苷酶阳性的SKOV-3衍生皮下肿瘤。此外,在存在d-半乳糖的情况下,荧光激活受到抑制。值得注意的是,BOD-M-βGal的近红外-II信号即使在2毫米的组织深度下也能被有效检测到。 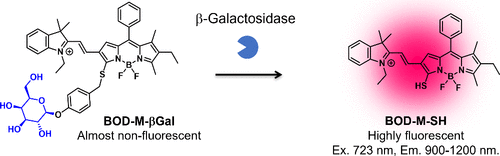 图 58.β-半乳糖苷酶的近红外-II 荧光探针。BOD-M-βGal 与 β-半乳糖苷酶发生酶促反应后的活化情况。
图 58.β-半乳糖苷酶的近红外-II 荧光探针。BOD-M-βGal 与 β-半乳糖苷酶发生酶促反应后的活化情况。
Zhang等人则开发了一种基于1,8-萘二甲酰亚胺骨架的β-半乳糖苷酶反应荧光探针NI-βGal(图59)。(226) 在β-半乳糖苷酶的作用下,NI-βGal会表现出黄蓝发射比的变化。通过瘤内注射,该探针可用于观察体内表达LacZ的U87肿瘤。然而,目前尚不清楚该探针与原生人类β-半乳糖苷酶的反应性如何,因此还需要进一步的研究来阐明其在临床成像方面的潜力。 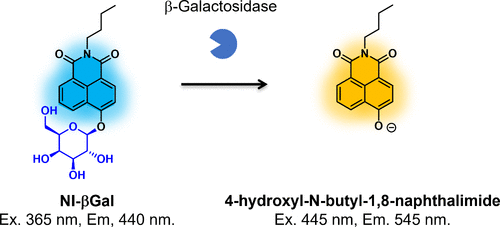 图 59.基于 1,8-萘二甲酰亚胺的 β-半乳糖苷酶反应荧光探针。
图 59.基于 1,8-萘二甲酰亚胺的 β-半乳糖苷酶反应荧光探针。
综上所述,近年来在荧光探针领域的研究取得了显著的进展。通过精心设计和优化荧光团及其与目标酶的相互作用,研究人员成功开发出了一系列针对β-半乳糖苷酶的灵敏且特异的荧光探针。这些探针不仅能够在体外有效检测酶的活性,还能够在体内实现对特定组织的荧光成像,为疾病诊断和治疗提供了有力的工具。然而,尽管取得了一些重要的成果,但仍然存在许多挑战和未解决的问题,需要进一步的研究和探索。未来,随着材料科学和荧光技术的不断发展,相信研究团队能够开发出更加高效、稳定和可靠的荧光探针,为医学研究和临床应用提供更强大的支持。
2.3.3. 基于波长偏移的碱性磷酸酶活性荧光探针
2017年,Liu等人成功研发出一种针对ALP活性的近红外荧光探针(图60(a))。起初,该探针NALP在近红外区域并不展现荧光特性,然而在与ALP发生反应后,由于分子内电荷转移(ICT)的恢复,其产物展现出了显著的荧光性质(图60(b))。为了验证其实际应用效果,他们进一步检测了细胞内的ALP活性,并通过在小鼠模型中实施肿瘤内注射探针,成功观察到癌症组织的荧光信号(图60(c)和(d))。 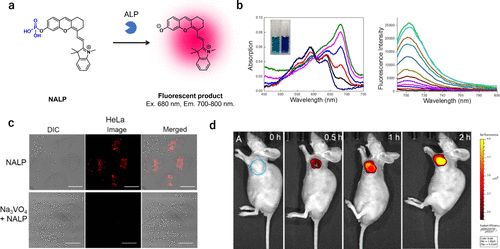 图 60.基于信息和通信技术的体内肿瘤可视化 ALP 靶向近红外荧光探针。
图 60.基于信息和通信技术的体内肿瘤可视化 ALP 靶向近红外荧光探针。
到了2020年,Zhang等人又开发出一种新型的近红外比率荧光探针APT,专门针对ALP活性进行设计(图61(a))。这种探针APT具有快速检测ALP活性的能力,其光谱从580纳米显著转移到650纳米,实现了高灵敏度的荧光响应。更值得一提的是,荧光比值F650/F580增加了高达14倍,显示了其出色的比率荧光特性(图61(b))。通过应用该探针,研究人员成功观察到HeLa细胞中的ALP活性(图61(c)),为ALP相关研究提供了新的有力工具。 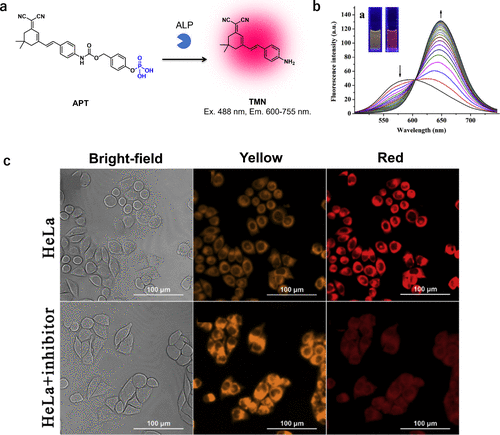 图 61.针对 ALP 的比率法近红外探针。
图 61.针对 ALP 的比率法近红外探针。
2.3.4. 基于波长偏移的醌氧化还原酶活性荧光探针
2014年,Hettiarachchi等人报道了一种基于萘二甲酰亚胺荧光团的hNQO1反应荧光探针(图62(a))。在hNQO1的存在下,底物分子发生裂解,产生了一种由于分子内电荷转移(ICT)恢复而引发荧光红移的产物。利用该探针,研究者成功观察到了HT29细胞中hNQO1的活性(图62(b))。 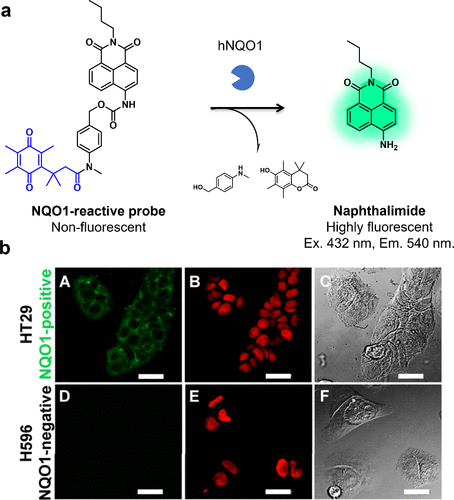 图 62.基于 ICT 的 NQO1 反应荧光探针。
图 62.基于 ICT 的 NQO1 反应荧光探针。
2018年,Punganuru等人基于二氰异佛尔酮荧光团(图63(a))开发出了一种hNQO1反应型近红外荧光探针NQ-DCP。与hNQO1反应后,NQ-DCP在近红外区域展现出显著的荧光增强,并伴随着巨大的斯托克斯位移(145 nm)(图63(b))。令人瞩目的是,该探针在静脉注射后仅10分钟内便能观察到小鼠模型中的U87MG肿瘤(图63(c))。由于hNQO1在肿瘤组织中的选择性活性,该探针在其他器官中并未显示明显的背景荧光(图63(d)),从而提高了成像的准确性和特异性。 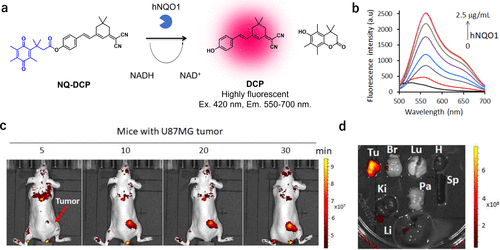 图 63. 基于二氰异佛尔酮的 hNQO1 反应荧光探针。
图 63. 基于二氰异佛尔酮的 hNQO1 反应荧光探针。
综上所述,基于波长偏移的可激活荧光探针已经得到了广泛开发。这类探针采用了多种骨架荧光团,如罗丹明、二氰基异佛尔酮和萘二甲酰亚胺衍生物等。与FRET探针相比,这类探针能够设计相对较小的近红外荧光探针,适用于各种活性酶的检测。尽管这些探针需要合适的滤光片设置以实现光谱分离,但许多探针已展现出高活化性,并显示出在临床癌症成像中的潜在应用价值。此外,还有其他基于波长偏移的可激活荧光探针的报道,这些探针在化学和材料学领域的研究中发挥着重要作用。图64 收集了基于波长偏移的可激活探针的研究进展。 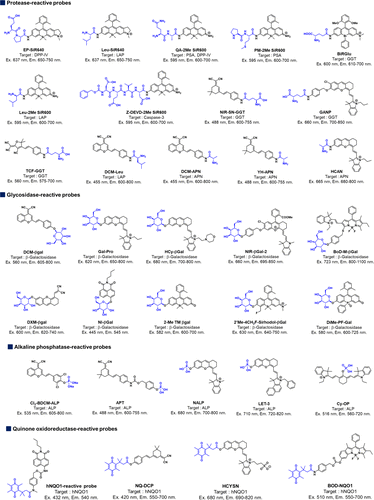 图 64.基于波长偏移的可激活荧光探针的化学结构、光学特性和成像目标。
图 64.基于波长偏移的可激活荧光探针的化学结构、光学特性和成像目标。
【激活型癌症荧光探针】-基于库的可激活荧光探针
Activity-Based Fluorescence Diagnostics for Cancer
激活型癌症诊疗探针
在某些复杂的生物学场景中,由于肿瘤组织与非肿瘤组织的生物标志物酶活性差异并不显著,针对某些知名生物标志物酶(例如GGT)设计的荧光探针,在非肿瘤组织中可能展现出强烈的背景荧光,从而干扰了肿瘤组织的准确识别。此外,不同癌症类型所展现出的最有效生物标记酶活性往往存在异质性,这种差异使得单一荧光探针很难实现对所有类型癌症的高灵敏度和特异性检测。因此,研究团队亟需寻找一种更为灵敏且特异的酶生物标记物,并发展出一种能够针对每种癌症进行有效检测的策略或方法,以提高癌症诊断的准确性和可靠性。
3.1. 筛选各种糖苷酶活性荧光探针
鉴于糖苷酶在癌症诊断中的潜在价值,研究团队于2020年成功合成了一系列包含12种不同荧光探针的集合,旨在检测多种糖苷酶的活性(图 65(a))。这些探针展现出了在活癌细胞中检测糖苷酶活性增强的能力,为癌症研究提供了有力的工具(图 65(b))。 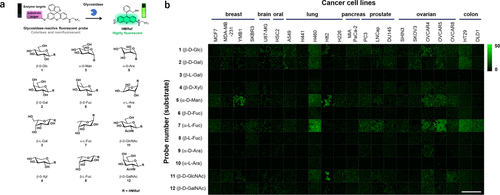 图 65.糖苷酶荧光探针
图 65.糖苷酶荧光探针
进一步地,研究团队直接在人体手术标本中对这些探针进行了筛选。结果显示,糖苷酶的活性确实因肿瘤类型的不同而有所差异,其中部分探针在癌症特异性成像方面表现出色(图 66(a))。值得一提的是,α-甘露糖苷酶反应荧光探针 HMRef-αMan 在乳腺癌成像中展现出了极高的灵敏度和特异性,灵敏度达到90%,特异性更是高达100%(AUC = 0.985),为乳腺癌的早期诊断提供了有力的支持(图 66(b))。 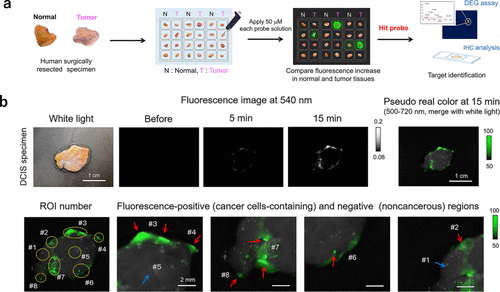 图 66.识别和利用生物标记糖苷酶,实现术中癌症的快速可视化
图 66.识别和利用生物标记糖苷酶,实现术中癌症的快速可视化
通过粒状电泳凝胶(DEG)检测,研究团队进一步确定了MAN2C1为靶酶,并验证了其在多种乳腺肿瘤中的过表达现象。这种直接利用手术标本筛选荧光探针的方法不仅为发现各种肿瘤中酶活性的增强提供了便捷的途径,而且筛选出的探针在开胃和内窥镜手术中具有广阔的临床应用前景。
3.2. 筛选蛋白酶活性荧光探针库
2022年,研究团队致力于探索癌症的有效生物标记蛋白酶。通过固相合成技术,研究团队将一系列单肽或二肽底物与HMRG荧光基团相结合,成功构建了一个包含380个荧光探针的库(图 67(a) 和 (b))。为了验证这些探针的实用性,研究团队利用手术切除的癌症和正常组织裂解物对这380个探针进行了初步筛选。结果表明,部分探针在癌症组织中表现出显著的荧光增强现象,显示出其作为特异性探针的潜力。随后,研究团队根据探针与底物肽的结构相似性进一步筛选,并通过体外荧光成像技术评估了这些筛选出的探针(图 67(c))。其中,KK-HMRG在肺癌组织检测中展现出84.8%的灵敏度和84.2%的特异性(AUC = 0.727),成为肺癌诊断的有力工具(图 67(d))。此外,通过DEG检测技术,研究团队确定了PSA为KK-HMRG的靶酶。在胃癌病例的研究中,研究团队发现KH-HMRG能够特异性地增加非癌区的荧光,实现对癌症病灶的阴性染色,为胃癌的精准诊断提供了新的思路(图 67(e))。同时,APN被证实为KH-HMRG的靶酶。对于胶质母细胞瘤,研究团队从筛选中挑选出8个候选探针,其中PR-HMRG以100%的灵敏度和58.5%的特异性(AUC = 0.794)成功检测出胶质母细胞瘤组织(图 68),钙蛋白酶1(CPN1)被确定为PR-HMRG的靶酶。此外,研究团队还发现GP-HMRG在胰腺癌成像中表现出优异的性能,并确定DPP-IV为其靶酶(图 69(a)-(c))。这些研究成果充分证明,研究团队基于文库的方法在发现用于癌症选择性成像的新型荧光探针/生物标记酶活性对方面具有广泛的应用前景。 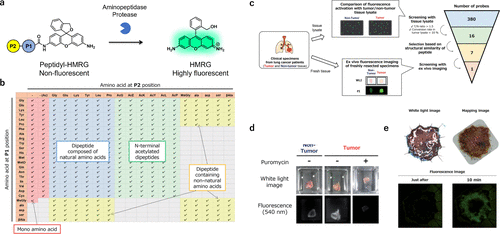 图 67.用于检测蛋白酶活性的荧光探针库
图 67.用于检测蛋白酶活性的荧光探针库 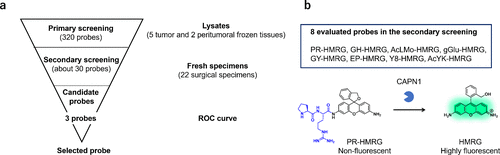 图 68.发现用于检测胶质瘤的生物标记物/探针对
图 68.发现用于检测胶质瘤的生物标记物/探针对 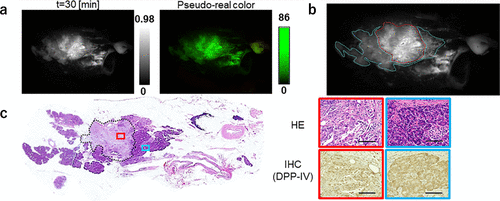 图 69.发现用于检测胰腺癌的生物标记物/探针配对。
图 69.发现用于检测胰腺癌的生物标记物/探针配对。
同年,研究团队还报道了通过筛选包含400个蛋白酶红色荧光探针的库,成功发现了一种高效的肺癌成像探针(图 70(a)和(b))。在实验中,研究团队发现QA-2Me SiR600在人类肺癌组织中的荧光强度显著高于正常肺组织(图 70(c))。与QA-2Me SiR600相比,QA-2OMe SiR600的背景荧光更低,其在肺癌检测中展现出96.3%的灵敏度和85.2%的特异性(AUC = 0.962),显示出更高的诊断价值(图 70(d))。进一步的研究揭示,PSA和DPP-IV是QA-2OMe SiR600的双靶酶,为肺癌的精准治疗提供了新的靶点。 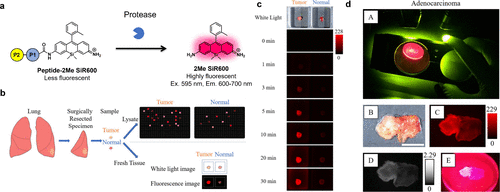 图 70.用于检测蛋白酶活性的红色荧光探针库。
图 70.用于检测蛋白酶活性的红色荧光探针库。
2023年,研究团队进一步扩展了研究范围,在人类胆管癌标本中筛选了包含糖苷酶和蛋白酶绿色荧光探针库以及蛋白酶红色荧光探针库在内的共800个探针(图 71(a))。经过严格的筛选和评估,研究团队发现PM-2Me SiR600在胆管癌检测中表现出色,其灵敏度为80.0%,特异性为94.4%(AUC = 0.860),成为胆管癌诊断的有力工具(图 71(b)-(d))。同时,研究团队确定了PSA为PM-2Me SiR600的靶酶,为胆管癌的治疗提供了新的思路。这些研究成果不仅丰富了研究团队对癌症生物标记物的认识,也为癌症的精准诊断和治疗提供了有力的支持。 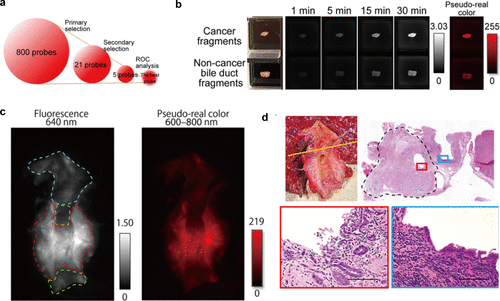 图 71.通过对 800 种荧光探针的筛选,发现了一种用于检测胆管癌的高效荧光探针。
图 71.通过对 800 种荧光探针的筛选,发现了一种用于检测胆管癌的高效荧光探针。
3.3. 筛选多种底物库
2020年,Tholen等人报道了利用组织提取物筛选多种底物库以设计荧光探针的方法。在他们的研究中,他们利用小鼠肿瘤病变的裂解液对混合组合底物库(HyCoSuL)进行了定位扫描。为了降低混合物复杂性,他们巧妙地将直接邻近裂解位点的P1残基固定为精氨酸,因为许多蛋白酶对碱性氨基酸具有P1特异性(图 72(a))。随后,在酸性pH条件下,他们对P2扫描和P3扫描HyCoSuL文库进行了筛选。这两个子文库的P2和P3位置残基均经过精心设计,变化范围涵盖了所有天然氨基酸(除半胱氨酸和蛋氨酸外)以及一组110个非天然氨基酸。 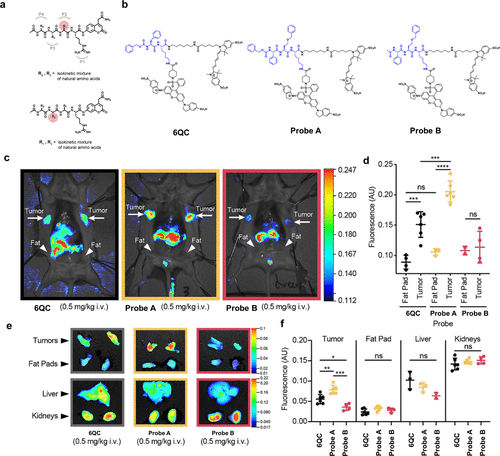 图 72.利用组织提取物筛选各种底物库,开发荧光探针。
图 72.利用组织提取物筛选各种底物库,开发荧光探针。
在筛选非天然氨基酸的过程中,他们惊喜地发现了一些比最佳天然残基活性更高的氨基酸。基于这些筛选结果,他们成功开发了FRET型荧光探针,例如基于6QC设计的探针A和B(图 72(b))。尽管探针B在裂解物实验中展现出高效的性能,但在癌症模型小鼠的成像实验中却未能显著增加荧光,这很可能是由于其细胞膜渗透性不佳所致。然而,与他们之前报道的6QC相比,探针A在周围正常组织和器官中展现出更显著的荧光增幅和更低的背景荧光(图 72(c)-(f))。
综上所述,他们通过筛选多种底物库找到了一种高效底物,并开发出一种新型癌症成像探针,而无需事先了解酶的靶标。正如本节所述,最近开发的基于文库的方法为获取各种生物标记物/探针对信息或针对不同类型癌症的有效底物序列提供了有力工具。与传统方法相比,基于文库的方法无需事先获得靶标信息,即可无偏见地开发探针,具有广阔的应用前景。因此,这种方法有望成为未来开发高效癌症成像探针的既定方法。
参考文献
Fujita, K.; Urano, Y. Activity-Based Fluorescence Diagnostics for Cancer. Chem. Rev. 2024, 124 (7), 4021–4078. https://doi.org/10.1021/acs.chemrev.3c00612.