【Chem.Soc.Rev】可以观测细胞凋亡的荧光探针
摘要
细胞凋亡,作为I型程序性细胞死亡的一种形式,是一个高度受基因调控的主动细胞自杀过程,它在维持生物体稳态及调控多种生理活动中扮演着核心角色。近年来,科学研究不断深化了对细胞凋亡与多种疾病关联性的认识,包括但不限于癌症、自身免疫性紊乱、病毒性感染及神经退行性病变等,这些疾病或直接或间接地受到细胞凋亡异常的影响。然而,细胞凋亡的复杂内在机制尚未完全揭示,部分归因于当前技术手段在无损且实时监测复杂生物体系内细胞凋亡动态方面的不足,尤其是缺乏高效的化学探针工具。
过去十五年间,小分子荧光探针(SMFPs)在细胞凋亡的体外与体内成像领域取得了显著进展,为相关疾病的诊断与治疗策略的开发提供了重要助力。本综述旨在系统性地回顾并探讨基于细胞凋亡关键事件(如酶活性变化、质膜完整性丧失、活性氧/硫水平波动、微环境酸碱度变化等)设计的SMFPs的最新研究成果。我们将深入剖析这些探针的设计原理与机制,特别是那些旨在精准捕捉细胞凋亡过程中特定分子事件的SMFPs,以展现其在科学研究中的广泛应用潜力。
1. 引言
细胞凋亡,作为生命科学领域一个核心的生物过程,对于维持个体发育进程、促进组织稳态以及保障机体健康具有不可替代的生理功能。这一程序性细胞死亡机制在防止疾病发生、促进细胞更新与修复中扮演着关键角色。然而,凋亡的失衡是现代医学面临的重大挑战之一,其失调与一系列威胁人类健康的疾病紧密相关。凋亡不足可诱发肿瘤形成和自身免疫性疾病,而凋亡过度则与神经退行性疾病如阿尔茨海默病、心血管急症如心肌缺血及再灌注损伤等病症的病理进程密切相关。
细胞死亡的模式多样,既包括非受控的意外细胞死亡,即细胞坏死,也涵盖受调控的细胞死亡途径,如细胞凋亡、热凋亡和铁死亡,这些途径在形态学、生物化学及分子特征上各具特色。近年来,细胞凋亡的调控机制日益受到关注,其中Caspase家族成员,作为一类特异性的半胱氨酸天冬氨酸蛋白酶,被广泛认同为细胞死亡通路的关键调控因子。Caspase家族蛋白通过级联激活机制,精确调控细胞凋亡的进程,对于理解疾病机理、指导临床诊断与治疗具有重要意义。
识别并确定细胞死亡的具体类型,对于疾病诊疗策略的制定及新药研发具有深远影响。然而,由于不同细胞死亡途径间存在复杂的交互作用,精确区分各生化过程的界限构成了科学研究的重大难题。除Caspase介导的经典凋亡途径外,近年来,一系列与细胞凋亡相关的新颖生物标志物逐渐浮出水面,如miRNA、外泌体及特定蛋白质等,它们在细胞凋亡调控中的潜在作用引起了广泛关注。不过,这些新兴生物标志物与细胞凋亡机制之间的内在联系仍需深入探究,以期揭示更为精细的凋亡调控网络,为疾病防治提供新的理论依据与干预靶点。
Table 1 Comparison of cell death in terms of cell characteristics and biochemical pathways
| Types | Cell characteristics | Biochemical pathways |
|---|---|---|
| Necrosis | Cell swelling, flocculent or clustered nuclear chromatin, dissolution and rupture of cell membranes and organelle membranes, and cell autolysis | Non-energy consuming passive process, independent of ATP, no new protein synthesis, irregular DNA degradation |
| Apoptosis | Nuclear rupture, cell shrinkage, formation of apoptotic bodies, adjacent cell phagocytosis | Proapoptotic Bcl-2 family, caspase activation, phosphatidylserine exposure, ROS production |
| Pyroptosis | Plasma membrane rupture, release of cellular contents and inflammatory factors | Activation of caspase1 and caspase11, generating active IL-1β, protein hydrolysis activation of IL-18 and GSDMD (basic effector of pyroptosis) |
| Ferroptosis | Mitochondria shrink, cristae decrease, mitochondrial membrane ruptures, but the nucleus is normal | Fe accumulation, cysteine deprivation, inactivation of GSH peroxidase, and lipid peroxidation |
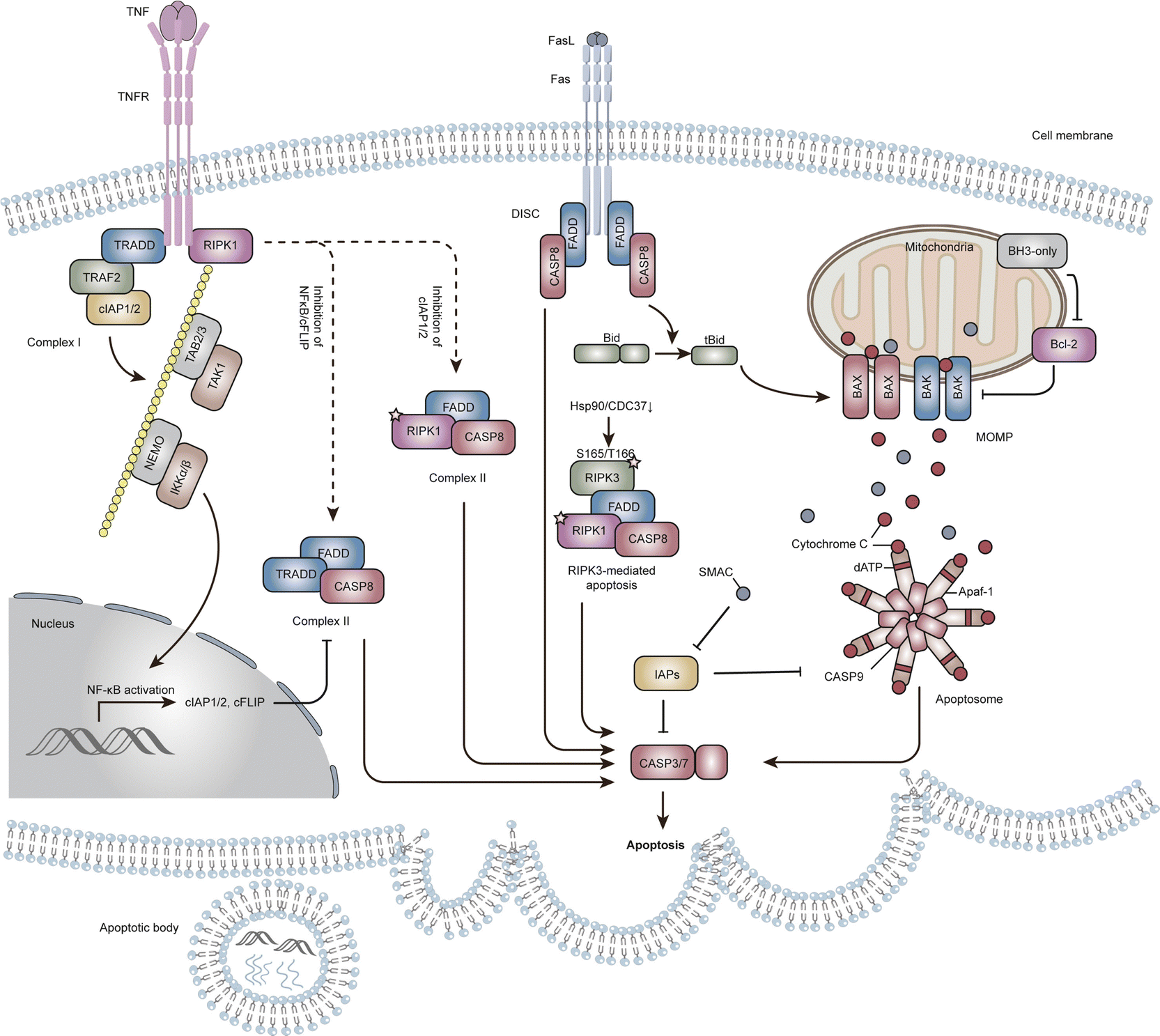
示意图1. 细胞凋亡的生化途径
随着人们对细胞凋亡与健康密切相关的认识不断加深,基于结构和功能方面的考虑,人们开发出了监测细胞凋亡的方法。光学显微镜(Light Microscopee,LM)主要用于识别细胞凋亡过程中的形态变化。由于染色质凝集,细胞凋亡过程中最显著的特征就是细胞凋亡,而这种方法既可靠又便宜。然而,LM 的结果缺乏客观性和可重复性,因为在如此低的放大倍率下只能检测到较少的凋亡细胞。此外,光镜下通过形态学观察到的凋亡细胞数量只是冰山一角。电子显微镜(Electron Microscope,EM),尤其是 TEM 成像是一种首选工具,可为后续的生化研究提供大量信息。但其缺点是耗时、昂贵、费力且难以量化。凝胶电泳(Gel Electrophoresis,GE)被认为是检测细胞凋亡过程中 DNA 断裂的有效方法,尽管其结果是定性而非定量的。原位末端转移酶标记技术(in situ End Labelling,ISEL)可通过对 DNA 自由端的标记,更早地识别单个凋亡细胞。在整个过程中,不充分的多重因素会影响灵敏度和特异性。免疫组织化学(IHC)通过使用针对多种底物(如 caspase 3、p53、annexin V 和 M30)的抗体更有效。虽然这些技术有很多优点,但仍存在一些问题。因此,可靠、高灵敏度和高选择性的细胞凋亡检测方法仍然亟待开发。基于小分子荧光探针的荧光成像(FI)是生物化学领域的最新趋势。由于具有高信噪比、无创成像和更深的组织穿透性等优点,它是对细胞凋亡过程进行超分辨率成像的理想选择。例如,流式细胞术是一种简便、快速、准确的方法,可通过 DNA 染色(如碘等荧光染料)来区分凋亡细胞和非凋亡细胞。
Table 2 Various technical approaches for detection of apoptotic cells
| Methods | Principle | Advantage | Disadvantages |
|---|---|---|---|
| Light microscopy | Cell shrinkage and pyknosis are visible in early apoptosis | Reliable and inexpensive | Lacks objectivity and reproducibility |
| Electron microscopy | Subcellular change is conspicuous | Provided extensive information and preferred for analyzing tissues | Time consuming, expensive, laborious, difficult-to-quantify |
| Gel electrophoresis | DNA fragments are reliable in apoptosis | Easy, sensitive, quantitative, precise, feasible | Tedious, qualitative rather than quantitative results |
| In situ 3-end labelling method | Radioactive or non-radioactive labeled DNA free ends | Identifiable at the molecular level, identify earlier | Multiple factors can affect the sensitivities and specificities |
| Immunohistochemistry | Use antibodies such as caspase 3, p53, annexin V, and M30 | Simpler, easier, and less prone to artifacts | Might damage cell membranes and is time consuming |
| Fluorescence imaging | Special biomolecules or microenvironmental parameters | High signal-to-background ratio, non-invasive and deeper tissue penetration | Reduced lifespan, limited tissue penetration, self-fluorescence |
Table 3 A summary and comparison of SMFPs for apoptosis
| No. | Targets | Sensing mode | Detection condition | λex/em | LOD | Time | Location | Biological Sample | Ref. |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Caspase-3/-7 | AIE | DMSO/water (v/v = 1/199); PIPES buffer (pH = 7.2), 37 °C | 312/470 | — | 60 min/100 min | — | MCF-7 cells | |
| 2 | Caspase-3 | AIE | DMSO/water (v/v = 1/199); PIPES buffer (pH = 7.2), 37 °C | 360/∼490 | — | 16 min | — | U87MG, MCF-7 cells, 293 T cells | |
| 3 | Caspase-3/7 | AIE | PIPES buffer (pH = 7.2), 37 °C | 405/610 | — | ∼40 min | — | MCF-7 cells, mice | |
| 4 | Caspase-3 | FRET/AIE | DMSO/PBS buffer (v/v = 1/99) | 405/465, 665 | — | ∼80 min | — | HeLa and MDA-MB-231 cells | |
| 5 | Caspase-3/8 | AIE | DMSO/PBS buffer (v/v = 1/99) | 360/480 | 60 min | — | HeLa cells | ||
| 430/650 | 75 min | ||||||||
| 6 | Caspase-3 | AIE | HEPES buffer (100 mM, pH 7.4, 0.3 M NaCl), 37 °C | 450/541, 660 | 5.1 pg mL−1 | ≤5 min | — | HeLa cells | |
| 7 | Caspase-3 | Ratiometric | PIPES buffer (pH 7.4), 37 °C | 528/582, 628 | 5.3 pM | 30 min | — | HeLa cells | |
| 8 | Caspase-3 | — | PBS (10 mM, pH 7.4) at 37 °C | 675/720 | — | — | Kidney | Mice | |
| 9 | Caspase-3 | — | HEPES buffer (pH = 7.4) | 675/685–900 | 0.01 μg mL−1 | 30 min | — | E0.5 embryos, C57BL/6N and ICR mice | |
| 10 | Caspase-3 | FRET/AIE | PBS (pH = 7.4), 37 °C | 520/∼580 | — | ∼4 h | — | HeLa cells | |
| 11 | Caspase-3 | FRET/AIE | PBS (pH = 7.4), 37 °C | 520/∼580 | — | ∼4 h | — | HeLa cells | |
| 12 | Caspase-3 | AIE | PIPES buffer | — | 0.54 pM | — | HeLa cells, A549 cells | ||
| 13 | Caspase-3 | AIE | PIPES buffer | — | 3.50 pM | — | HeLa cells, A549 cells | ||
| 16 | Caspase-3 | FRET | PBS (pH = 7.4), 37 °C | 380/520 | — | ∼10 min | — | U87MG cells, mice | |
| 17 | Caspase-9 | — | — | 650/729 | — | — | — | DU145 cells | |
| 18 | Caspase-3 | AIE | DMSO/PIPES (v/v = 1/199) | 365/480 | 1 pM | 60 min | αvβ3 integrin | U87-MG cells, MCF-7, 293T | |
| 19 | Caspase-3/-7 | AIE | DMSO/PBS (v/v = 1/199) | 365/480 | 2.3 × 10−12 M | 60 min | αvβ3 integrin | MDA-MB-231 cells, MCF-7 cells, 293T cells | |
| 21 | Caspase-3 | FRET | 50 mM HEPES (pH 7.4) | 550/610, 680 | — | ∼90 min | — | HT-29 | |
| 22 | Caspase-3 | FRET | PBS (pH = 7.4), 37 °C | 465/520 | — | ∼6 h | Lyso | U87 cells, COS7 cells | |
| 23 | Caspase-3 | AIE | DMSO/PBS (1/199, v/v) | 320/480 | — | 60 min | — | BxPC-3 cells | |
| 24 | AChE | — | PBS (pH = 7.4), 37 °C | 680/745 | 0.2 mU mL−1 | <30 min | — | HeLa cells, MCF-7 cells, mice | |
| 25 | BChE | ICT | PBS buffer (10 mM, pH 7.4). | 343/430 | 0.07969 U mL−1 | 5 min | — | LO2 cells | |
| 26 | AChE/BChE | ICT | PBS (pH 7.4, 20 mM, 50% DMSO) | 545/654 | 0.127 U mL−1; 0.0117 U mL−1 | ❤️ s | — | NHA cells, U87 cells, zebrafish, mice | |
| 27 | ATPase | ICT | PBS, pH 7.4, 37 °C | 520/565 | 15.77 U | — | Mito | Different cancer cells | |
| 570/590 | |||||||||
| 28 | PS | AIE | THF/hexane; DMSO/water | 325/478 | — | — | — | HeLa cells, HepG2 cells | |
| 29 | PS | — | Methanol/glycerol, 20 °C; PBS (pH 7.4, 20 mM) | 480/514 | — | — | — | HeLa cells | |
| 30 | PS | — | HEPES buffer pH 7.4 | 405/530 | — | 1 min | — | HeLa cells, HCC-1806 cells, MCF-7 cells | |
| 31 | ATP | — | Glycerol/Krebs buffer solution (60/40, pH 7.8), 25 °C | 510/590 | — | <20 s | Mito | OSCC cells | |
| 32 | ATP | ICT | HEPES buffer pH = 7.4, 25 °C | 400/500 | 8.4 × 10−9 mM | ∼3.8 min | Mito | RAW 264.7 | |
| 33 | ATP | — | 10 mM HEPES buffer solution of pH 7.4 | 410/524 | 27 nM | — | Plasma membrane | HepG2 cells, HeLa cells, HL 7702 cells, mice | |
| 34 | Thiol disulfide exchange | FRET | Methanol, DMSO, phosphate buffer (pH = 7.0) | 460/504, 580 | — | ∼30 min | Plasma membrane | Various cell lines | |
| 35 | Morphological changes of PM | — | Different solvents | 584/602(CH2Cl2) | — | — | Plasma membrane | MCF-7 cells, RAW 264.7, HeLa cells | |
| 36 | Morphological changes | AIE/TICT | Ethyl acetate/ethanol; glycerin/ethanol | 373/567 | — | — | Cell membrane and mitochondria | HeLa, HepG2, MCF-7 cells | |
| 500/650 | |||||||||
| 39 | ΔΨm | ICT | PBS (pH 7.4, 10 mM) | 500/630 | — | — | Mitochondria, nucleolus | HepG 2 cells | |
| 40 | ΔΨm | — | PBS | 460/640(PBS) | — | — | Mitochondria, nucleolus | HeLa cells | |
| 41 | ΔΨm | AIE/ICT | Water–glycerin system | 445/675 | — | — | Mitochondria | LoVo cells, MCF-7 cells | |
| 42 | ΔΨm | FRET | Methanol/glycerol | 400/455, ∼612 | — | — | Mitochondria | P36 cells | |
| 43 | ΔΨm | FRET | Methanol/glycerol | — | — | — | — | — | |
| 44 | HClO | AIE | PBS buffer | 430/620 | 30.8 nM | <100 s | — | MCF-7 cells | |
| 45 | HClO | — | DMF–PBS (1 : 9, v/v; 10 mM PBS, pH 7.4) | 480/542 | — | 1 min | — | HeLa cells, RAW 264.7 | |
| 46 | H2O2 | ICT | 10 mM PBS, pH 8.0 | 525/555 | 80 nM | — | Mitochondria | HepG2 cells, 4T1 cells | |
| 47 | H2O2 | ICT | 10 mM PBS, pH 7.4 | 400/458, 558 | 120 nM | — | Endoplasmic reticulum | HepG2 cells, 4T1 cells | |
| 48 | H2S | ESIPT | PBS (20 mM, pH 7.4, 5% DMSO), 37 °C | No/550 | 64 nM | 30 min | — | MCF-7 cells | |
| 49 | H2S | ICT | Tris–HCl (0.05 M, pH = 7.4, 37 °C) | 425/556 | 1.9 × 10−2 mM | — | Nucleus | HepG2 cells, CHO cells | |
| 50 | H2S | ICT | Tris–HCl (0.05 M, pH = 7.4, 37 °C) | 410/565 | 2.7 × 10−2 mM | — | Mitochondria | HepG2 cells, CHO cells | |
| 51 | SO2 | ICT | DMSO/PBS (9/1, v/v, pH = 7.4), 37 °C | 460/560 | 13.1 nM | <60 s | Mitochondria | HeLa cells, Zebrafish | |
| 52 | SO2 | ICT/FRET | Methanol, glycerol and PBS (25 mM, pH 7.4) | 405/472, 600 | 6.6 × 10−5 M; 7.9 × 10−5 M | <5 min | Mitochondria | HeLa cells | |
| 53 | Cys | ICT | PBS/DMSO (5 : 5, v/v, pH = 7.4) | 345/402, 521 | 111 nM | ∼15 min | Mitochondria | HeLa cells | |
| 54 | Cys | — | PBS/DMSO (9/1 (v/v), 200 mM, pH 5.0) | 430/498 | 1.2 μM | ∼60 min | Lyso | A549 cells, zebrafish | |
| 55 | GSH | FRET | PBS buffer, 25 °C | 450/520, 592 | 2.02 nM | — | Mitochondria | HepG2 cells | |
| 56 | Hcy | — | Acetonitrile/PBS (5 : 95, v/v, 10 mM, pH 7.4) | 405/523, 548 | 0.8 ± 0.2 μM | <50 s | Cytoplasm | HeLa Cells, mice | |
| 57 | Polarity | ICT | THF and methanol/glycerol; H2O/THF | 360/430, 589 | — | — | Mitochondria | HeLa cells, | |
| 58 | Polarity | ICT | Water/DMSO | 535, 565/580, 600 | Δf = 0.018 | — | Lysosome | HepG2 cells, CHO cells | |
| 59 | Polarity | FRET | 1,4-Dioxane/H2O | 400/500, 662 | — | — | Lysosome, plasma membrane | HeLa cells | |
| 60 | Viscosity | ICT | Water–glycerol; ethanol–glycerol | 410/467, 658 | — | — | Mitochondria | HeLa cells, MCF-7 cells | |
| 61 | Viscosity | — | Water/glycerol system (3 : 7, v/v, 10 mM PBS) | 400/470 | — | — | — | HeLa cells, zebrafish | |
| 62 | Viscosity | — | Water/glycerol | 840/580 | — | — | Mitochondria | SKOV-3 cells | |
| 63 | Viscosity | — | Water/glycerol | 405/560 | — | — | Mitochondria | HepG2 cells, mice | |
| 64 | Viscosity | TICT | Gly/PBS | 488/650 | — | — | Mitochondria | A549 cells | |
| 65 | Viscosity | TICT | Methanol/glycerol; 10 mM PBS (pH = 7.4), 30 to 45 °C | 680/731 | — | — | Mitochondria | HeLa cells, HT-1080 cells | |
| 66 | Viscosity | TICT | H2O/glycerol | 488/607 | — | — | Mitochondria | MCF-7 cells, MCF-10A cels, A549 cells, Beas-2B cells tissue, | |
| 67 | Viscosity | — | Glycerol/methanol; PBS buffer at pH 7.4 | 510/513 | — | — | Mitochondria | COS-7 cells | |
| 68 | Viscosity | PET | Methanol/glycerol | 501/518(glycerol) | — | — | — | C6 glioma cells | |
| 69 | Viscosity | — | Methanol/glycerol | 405/474, 520 | — | — | — | HeLa cells | |
| 70 | Viscosity | ESIHB | glycerol/water | 355/No | — | — | — | U-87 cells |
Table 4 A summary and comparison of SMFPs based on pH
| No. | Targets | Sensing mode | Detection condition | λex/em | pKa | Φ | Location | Biological sample | Ref. |
|---|---|---|---|---|---|---|---|---|---|
| 71 | pH | PET | Various pH values in Britton Robinson buffer solution | 525/578 | 5.47 | — | Lysosome | MCF-7 cells, Raw 264.7 cells, HeLa cells | |
| 72 | pH | — | Different pH buffers | 480/∼580 | — | 0.16 | Lysosome | RBE cells, HeLa cells, tissue | |
| 73 | pH | — | Different pH buffers | 480/∼580 | — | 0.53 | Lysosome | RBE cells, HeLa cells, tissue | |
| 74 | pH | — | Different pH buffers | 480/∼580 | — | 0.64 | Lysosome | RBE cells, HeLa cells, tissue | |
| 75 | pH | — | Different pH buffers | 480/∼580 | — | 0.52 | Lysosome | RBE cells, HeLa cells, tissue | |
| 76 | pH | — | Different pH buffers | 480/∼580 | — | 0.89 | Lysosome | RBE cells, HeLa cells, tissue | |
| 77 | pH | — | Different pH buffers | 480/∼580 | — | 0.93 | Lysosome | RBE cells, HeLa cells, tissue | |
| 78 | pH | — | Potassium phosphate–citric acid buffer with various pH values | 480/584 ± 5 nm | — | — | Lysosome | HeLa cells, HGC-27 cells, CW-2 cells, MCF-7 cells, RBE cells | |
| 79 | pH | — | Potassium phosphate–citric acid buffer with various pH values | 480/584 ± 5 nm | — | — | Lysosome | HeLa cells, HGC-27 cells, CW-2 cells, MCF-7 cells, RBE cells | |
| 80 | pH | — | Potassium phosphate–citric acid buffer with various pH values | 480/584 ± 5 nm | — | — | Lysosome | HeLa cells, HGC-27 cells, CW-2 cells, MCF-7 cells, RBE cells | |
| 81 | pH | — | Potassium phosphate–citric acid buffer with various pH values | 480/584 ± 5 nm | — | — | Lysosome | HeLa cells, HGC-27 cells, CW-2 cells, MCF-7 cells, RBE cells | |
| 82 | pH | — | Various pH values in Britton Robinson buffer solution | 574/590 | 5.42 | 0.12 | Lysosome | HeLa cells | |
| 83 | pH | ICT | Different pH values (30% DMSO) in B–R buffer solution | 390/480, 560 | 5.2 | 0.135 | Lysosome | MCF-7 cells, HeLa cells | |
| 84 | pH | PET | Various pH values in PBS buffer | 400/535 | 6.24 ± 0.02 | 0.39 | Lysosome | SMMC-7721 cells, mice | |
| 85 | pH | ICT | Different pH conditions in 20 mM PBS | 510/545 | 4.6 | — | — | HeLa cells, RAW 264.7 cells, Escherichia coli | |
| 86 | pH | — | B–R buffer solution with various pH values | 400/528 | 5.88 | 0.0584 | Mitochondria | HeLa cells, 293T cells | |
| 467/606 | |||||||||
| 87 | pH | ICT | B–R buffer 40 mM, 2% DMSO at different pH values | 405/550 | 5.87 | — | Nuclei and Mitochondria | SiHa cells | |
| 543/605 | |||||||||
| 88 | pH | — | Different pH solution | 405/460 | 6.4 | — | Nuclei and Mitochondria | HepG2 cells | |
| 561/625 | |||||||||
| 89 | pH | ICT | PBS buffer at different pH values | 460/560 (H2O) | 6.2 ± 0.03 | 0.08 | — | A549 cells |
Table 5 A summary and comparison of other SMFPs for apoptosis
| No. | Targets | Sensing mode | Detection condition | λex/em | LOD | Time | Location | Biological sample | Ref. |
|---|---|---|---|---|---|---|---|---|---|
| 90 | Caspase-3/-7(MR/FI) | AIE | H2O/DMSO | — | — | 1 h | — | HeLa cells | |
| 91 | mtDNA | TICT | Tris–HCl (0.05 M, pH = 7.4) | 435/640 | 71 ng mL−1 | 1.3 min | Mitochondria | HepG2 cells | |
| 92 | Caspase-3; H2O2 | FRET | PBS, pH 7.2, 37 °C | 450/555, 663 | 0.43 nM | 60 min | — | HeLa cells | |
| 450/663 | 1.54 μM | 90 min | |||||||
| 93 | O2˙−; pH | — | 30 mM PBS buffer, pH 7.4; pH 9.0 PBS buffer | 400/450 | 2.8 nM; — | — | Mitochondria | 4T1 cells | |
| 400/520 | |||||||||
| 94 | O2˙−/caspase-3 | — | PBS (10 mM, pH = 7.4), 37 °C | 640/710 | — | — | — | AmL-12 cells, mice | |
| 95 | GSH; viscosity | ICT | 10 mM PBS buffer solution (50% DMSO, v/v), 37 °C; water with various glycerol proportions at 25 °C | 500/535650 | 0.2 μM; — | 30 min; — | Mitochondria | MCF-7 cells; HeLa cells | |
| 510/627 | |||||||||
| 96 | SO2; viscosity | — | Glycerol: PBS = 6 : 4, v/v, pH =7.4; PBS/glycerol | 320/476 | 0.24 μM; — | <4 min; — | Mitochondria | A549 cells; zebrafish | |
| 550/623 |
SMFP的设计原理融合了多种精妙的化学机制,包括分子ICT、佛斯特共振能量转移(FRET)、激发态分子内质子转移(ESIPT)、光诱导电子转移(PET)以及AIE。ICT机制下,特定光照条件下,探针内的电子从供体(Donor, D)跃迁至受体(Acceptor, A),触发分子内部的电荷重分布。这一过程调整了最高占据分子轨道(HOMO)与最低未占据分子轨道(LUMO)间的电荷分布和能隙,进而影响探针的吸收特性、荧光行为、荧光寿命等物理化学性质。
FRET,作为一种非辐射能量转移过程,当供体(D)与受体(A)之间存在能级重叠时,能量可在二者间传递。当供体分子吸收特定波长的光子并跃升至激发态后,通过偶极-偶极相互作用,能量被传递给邻近的受体分子,而非以光子形式释放。为实现FRET过程中的高效能量转移,精心设计的供体荧光团是决定性因素。
ESIPT机制基于独特的四级光化学过程,光照射下,激发态分子内部相邻的质子供体与受体之间发生质子转移反应。简言之,烯醇(E)态的电子分布,在光激发下发生变化,促使激发态烯醇态(E*)快速转化为激发态酮态(K*)。随之,K* 通过辐射衰变回到基态酮态(K)。最终,K通过反向质子转移(Reverse Proton Transfer, RPT)恢复至烯醇态(E),形成可逆循环。
PET机制涉及荧光团与受体间的电子转移。在与目标分子结合前,探针分子的荧光信号微弱或不存在。一旦受体与目标分子结合,光诱导电子转移效应被抑制,甚至完全阻断,此时荧光团恢复强烈的荧光发射。
传统有机发光材料受聚集导致荧光淬灭(ACQ)限制,其发光性能在高浓度下显著下降,影响了实际应用。然而,2001年,Tang领导的团队首次报道了与ACQ相反的AIE现象。AIEgens在稀溶液中因芳香侧链的自由旋转,几乎不显示荧光。但在聚集状态下,分子内旋转受到空间限制,非辐射衰变路径受阻,导致荧光强度显著提升,这归因于受限分子内旋转(RIR)机制的作用。
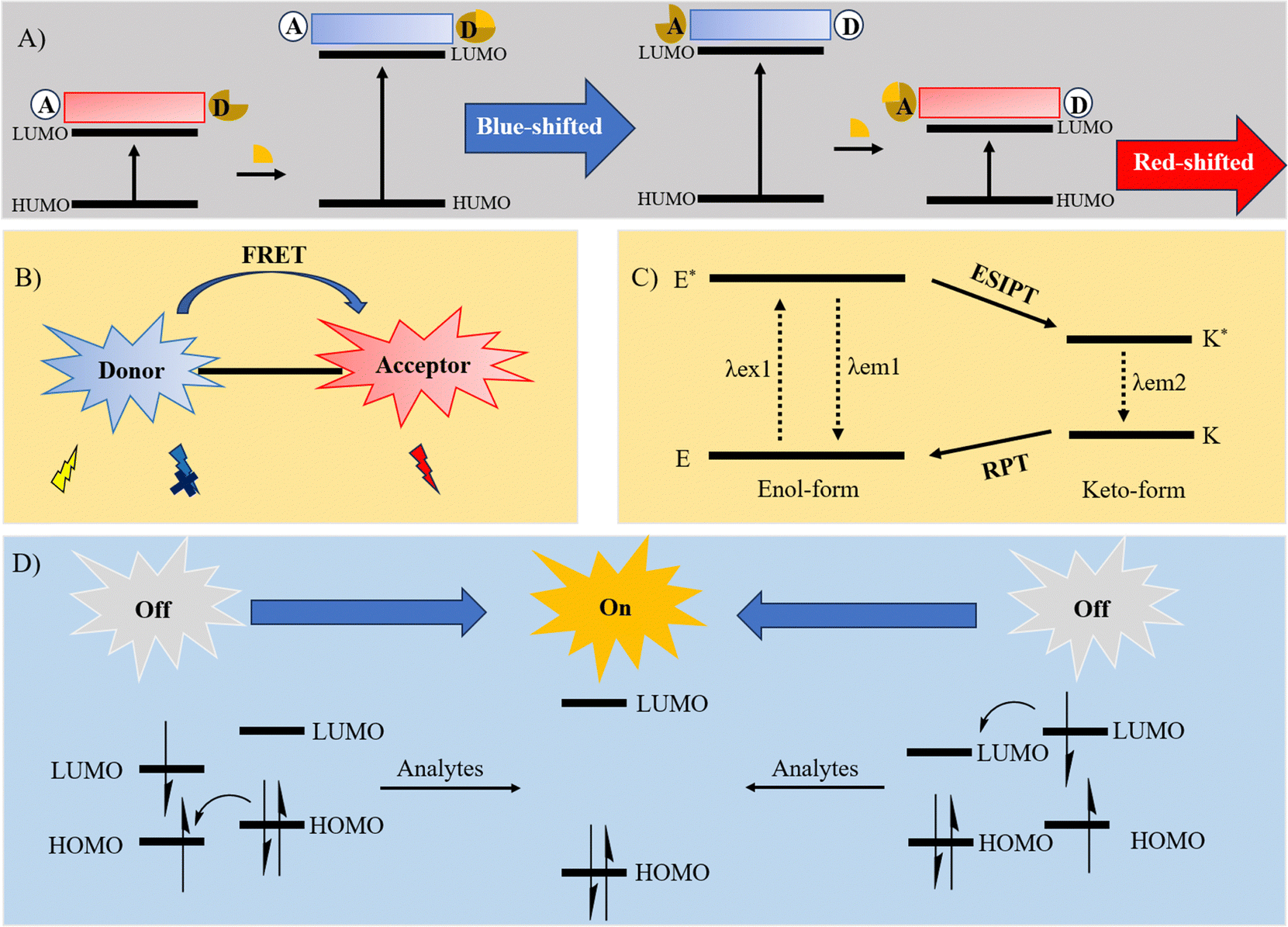
示意图 2. (A) ICT 过程图解;(B) FRET 过程图解;(C) ESIPT 过程图解;(D) PET 过程图解。
深入探索细胞凋亡与人类疾病之间的关联,实现细胞凋亡过程的可视化,并精确区分其与其他细胞死亡模式,已成为当前生命科学领域的前沿课题。近年来,荧光探针技术的革新,为这一目标的达成提供了有力工具。特别地,一些荧光探针能够响应caspase 3与caspase 7活性变化,从而有效识别细胞凋亡与坏死,因为这两种酶在凋亡过程中呈现显著上调。另有荧光探针通过监测粘度变化揭示铁死亡的特异性机制,还有些探针依据细胞极性与线粒体膜电位的差异,精准区分健康细胞、早期凋亡细胞及晚期凋亡细胞状态。
生物标志物的研究进一步细化了细胞死亡过程的时空特性。例如,细胞凋亡与自噬早期阶段的pH值下调,而O2·-水平在细胞凋亡早期上升,相比之下,在自噬初期则保持稳定。鉴于此,针对细胞凋亡特化的SMFPs设计面临四大核心挑战:一是如何围绕特定生物标志物构建高效SMFPs,以精准区分细胞凋亡与其它死亡模式;二是如何依据生物标志物的变化趋势,设计SMFPs来辨识早期与晚期凋亡细胞;三是探究潜在生物标志物与细胞凋亡机制之间的内在联系;四是评估SMFPs在细胞凋亡可视化中的生物学价值。
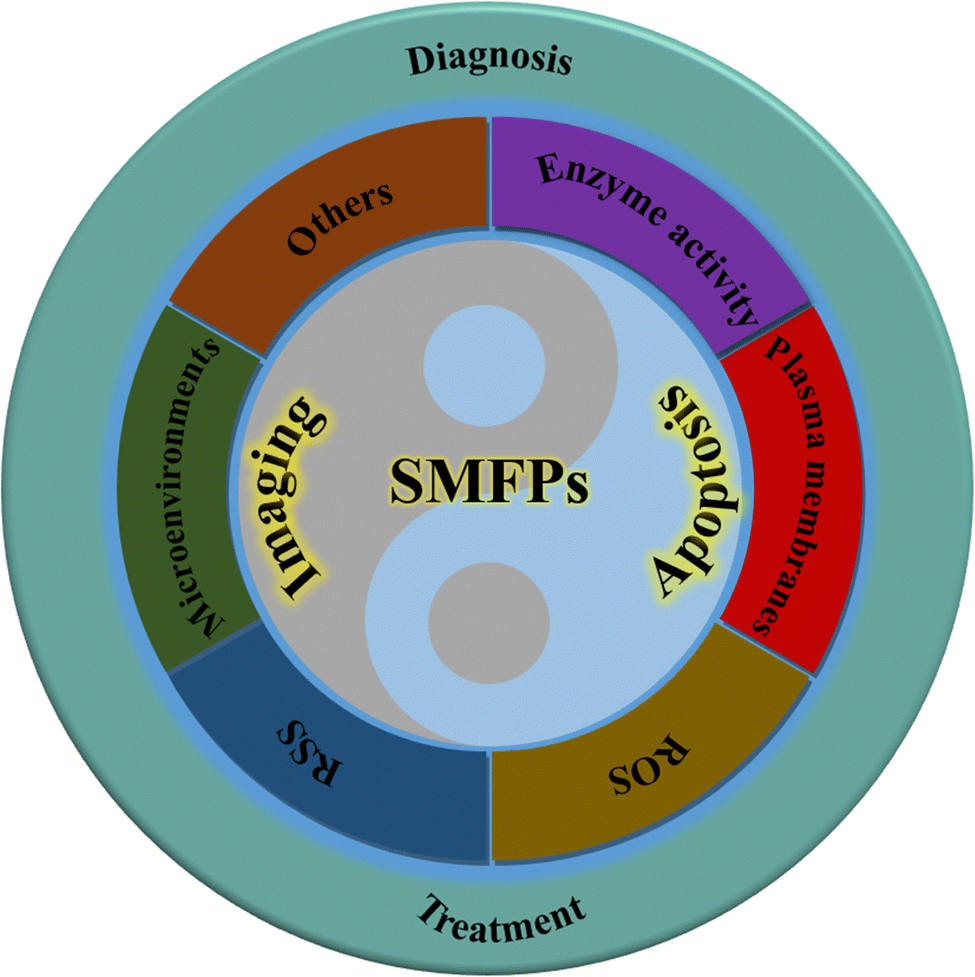
示意图3. 用于研究细胞凋亡的小分子荧光探针
2. 用于监测细胞凋亡过程中酶活性的 SMFP
酶,作为生物体内不可或缺的催化剂,扮演着调控代谢途径和生化反应速率的关键角色。细胞凋亡,作为细胞生命周期中的一种高度有序且程序化的死亡形式,其复杂性在于它受到多维度遗传信息和酶促活动的精细调控。运用SMFPs进行精密检测,特别是针对那些在凋亡进程中起核心作用的酶,如caspase-3和caspase-7,成为揭示这些酶在细胞凋亡中动态角色的关键途径。
细胞凋亡的早期阶段,caspase-3作为执行者caspase的一员,被激活并参与下游信号的级联放大,而到了凋亡晚期乃至细胞死亡阶段,caspase-3的活性则显著减弱。这一动态变化不仅是细胞凋亡进程中的标志性事件,也是区分凋亡与其他形式细胞死亡的特征指标。通过SMFPs检测这些特异性酶的活性,能够为我们提供关于细胞命运走向的即时反馈,进而深入理解凋亡机制。
此外,细胞凋亡过程中,乙酰胆碱酯酶(AChE)和丁酰胆碱酯酶(BChE)的活性上调,反映了细胞内信号传导和神经递质分解的调节变化。与此同时,ATP合成酶F1单元的活性降低,暗示了细胞能量代谢的衰退,这是细胞凋亡过程中能量需求减少的一个重要表征。因此,对细胞凋亡期间酶活性状态的全面掌握,对于解析生理平衡与病理紊乱背后的分子机制至关重要。
2.1. 用于监测细胞凋亡过程中 caspase 活化的 SMFPs
Caspase,作为一类专一性半胱氨酸蛋白酶,能够在细胞接收到促凋亡信号后被激活,扮演着细胞凋亡机制中的执行角色。迄今为止,Caspase家族已知包含至少13个成员,依据其结构与功能特性,大致可分为两大类:促炎性Caspase,包括caspase-1、4、5、11、12和13;以及促凋亡性Caspase,如caspase-2、3、6、7、8、9和10。在细胞凋亡进程中,Caspase家族成员的相互激活作用尤为关键,例如,caspase-9的激活能够触发caspase-3的活化,进而启动细胞凋亡程序。
caspase-3在细胞凋亡中的核心功能在于使Bcl-2等细胞凋亡抑制蛋白失效,同时催化多种细胞内蛋白的水解,包括核蛋白与细胞骨架成分,导致细胞结构解体并形成凋亡小体(ApoBDs)。这些观察结果凸显了Caspase在细胞凋亡过程中的中心地位,使其成为细胞凋亡研究中的关键生物标志物。尤其值得一提的是,caspase-3的活性成像能够特异性地区分细胞凋亡与其他类型的细胞死亡,因而成为细胞凋亡检测的理想生物标志物。高效的SMFPs不仅能够揭示相关病理机制,还可用于筛选新型细胞凋亡诱导剂,评估药物的治疗效果,展现出巨大的应用潜力。
研究指出,Asp-Glu-Val-Asp(DEVD)肽序列是caspase-3偏好性切割的底物。基于这一发现,众多以DEVD为基础的SMFPs相继问世,用于实时监测细胞凋亡的动态变化。
Liu的团队长期专注于开发亲水性、Caspase特异性的DEVD肽序列荧光AIE探针,用于细胞凋亡的成像研究。2012年,他们设计并报告了一种AIE探针1,该探针在未与caspase-3/-7作用时荧光信号微弱(量子产率 Φ = 0.001),而一旦与caspase-3/-7反应,荧光强度显著增强(量子产率 Φ = 0.2)。这种高信噪比的荧光变化,为细胞凋亡相关酶抑制剂的筛选和药物诱导细胞凋亡的评估提供了有力工具。尽管如此,作为自由分子,探针1的靶向性尚有提升空间。
为改善靶向性,研究团队进一步设计了靶向AIE探针2,在其中引入了环Arg-Gly-Asp(cRGD)序列和N端可裂解的DEVD序列,与四苯基硅烷基(TPS)单元相连。cRGD序列能够特异性结合αvβ3整合素,而后者在多种肿瘤细胞表面过表达。为了验证探针2在监测肿瘤细胞凋亡过程中的效能,研究者将其与过表达αvβ3整合素的U87-MG细胞共同孵育。实验结果显示,探针2在STS处理的U87MG细胞中产生显著荧光,而在健康U87MG细胞和抑制剂组中荧光信号较弱,在凋亡MCF-7细胞中则观测到微弱荧光。这些数据证实了cRGD单元能够促进探针在U87MG癌细胞内的积累,有效监测细胞凋亡进程。此外,随着细胞凋亡的进展,荧光强度在45分钟内逐渐上升,证明探针2是实时监测细胞凋亡过程的高效化学工具。
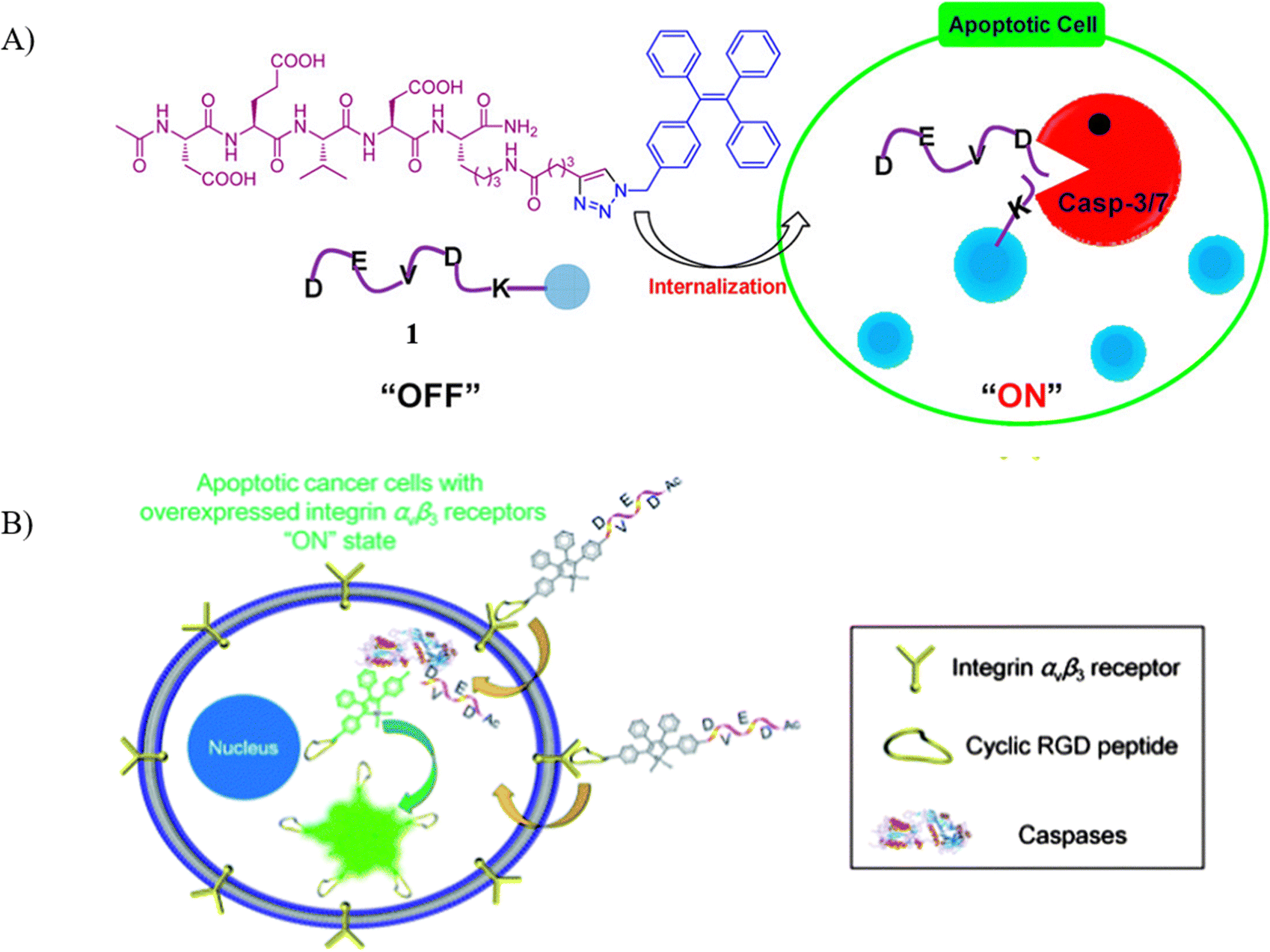
图 1. (A) 探针1的示意图;(B) 探针2的原理
值得注意的是,若能将AIEgens的发射光谱精细调谐至红色乃至近红外光谱区域,将极大拓展其在生物医学成像领域的应用范围,同时有效规避生物样本固有的自发荧光干扰,提升成像特异性和穿透深度。2013年,Liu教授及其研究团队报道了一款创新性的凋亡探针3,该探针巧妙融合了DEVD肽段与疏水性的四苯基乙烯吡啶鎓单元,不仅展现出显著的斯托克斯位移,还具备长波长发射特性,使之成为体内细胞凋亡监测与药物筛选的理想工具。
为了验证探针3在活体条件下的优越性能,研究者在小鼠模型上进行了深入探索。具体而言,通过对小鼠注射STS,并在肿瘤部位观察荧光信号的变化。实验结果显示,经STS处理的肿瘤区域,探针3的荧光信号显著增强,而未经STS处理的对照组,荧光信号则相对较弱。
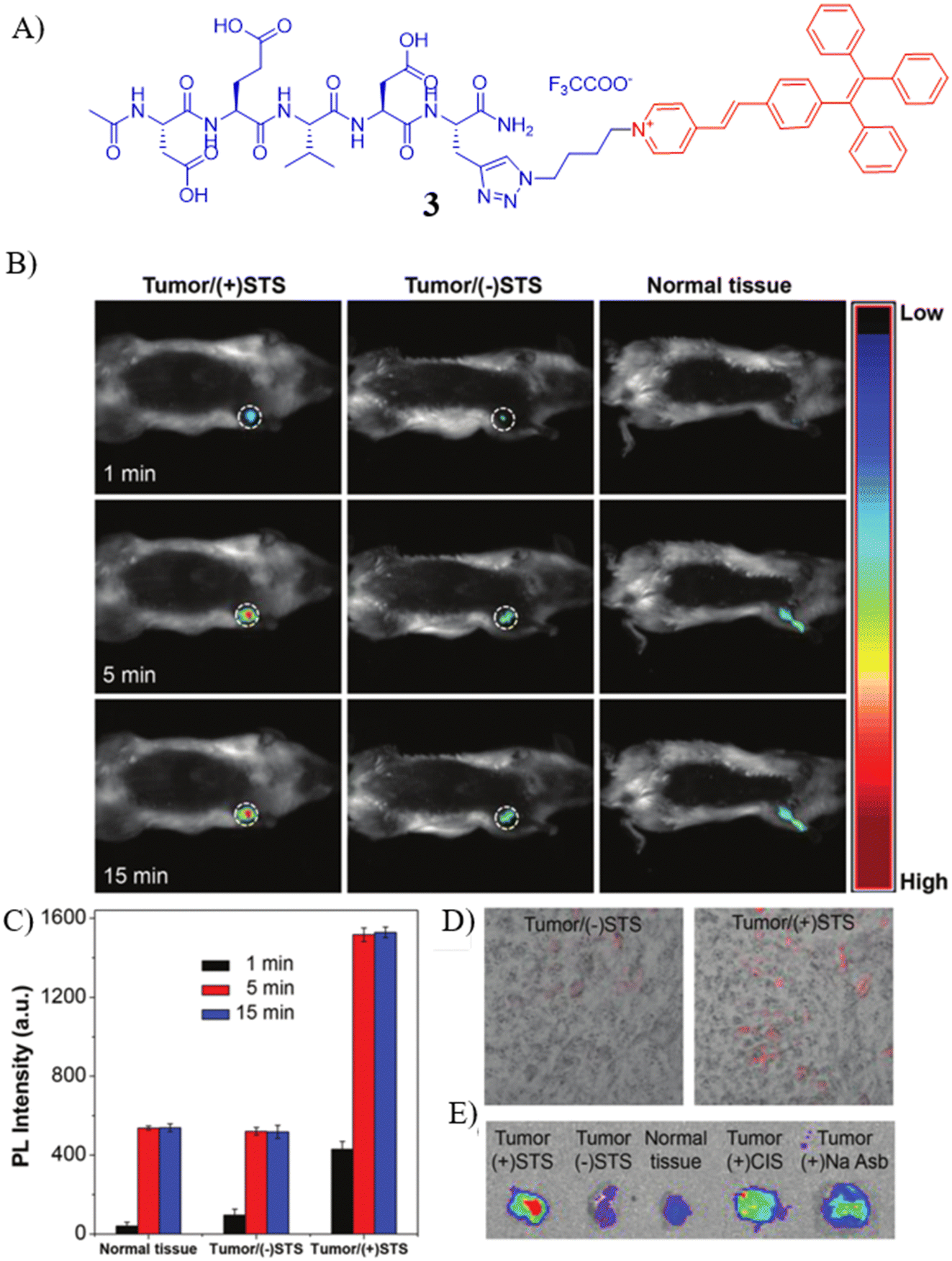
图 2. (A)探针3的化学结构;(B) 探针3的活体荧光图像;(C) 不同时间的定量图像分析;(D) 不同处理下切除组织的荧光图像;以及 (E) 筛选。
同样地,Liu教授及其研究团队设计并合成了一种双通道FRET凋亡探针4,该探针巧妙地结合了绿色荧光供体——香豆素(Coumarin)与红色荧光淬灭剂——AIEgen,二者与前述的DEVD肽序列共轭,专门用于检测caspase-3的活性。有趣的是,得益于AIEgen的能量转移与耗散机制,所设计的FRET探针在未激活状态下展现出极为微弱的荧光。然而,一旦与caspase-3发生反应,探针便展现出显著增强的绿色与红色荧光信号,通过计算得出其Michaelis常数(KM = 7.70 μM)和最大反应速率常数(k cat = 2.69 s-1)。这种双信号开关机制不仅被成功应用于体外Caspase-3活性检测,为FRET探针的设计提供了创新策略,同时也为筛选高效抗癌药物,特别是那些能够诱导细胞凋亡的化合物,提供了实验平台。
2017年,Liu教授团队进一步报道了一种新颖的荧光探针5,该探针能够特异性地靶向并监测活细胞凋亡过程中caspase-3和caspase-8的活性。如图所示,探针5由两个分别发射不同颜色荧光信号的AIEgens组成,这两个AIEgens与一个亲水性肽段连接,能够在过氧化氢(H2O2)诱导的凋亡HeLa细胞中被激活。具体而言,在与caspase-8反应60分钟后,探针在480nm波长处呈现出增强的绿色荧光信号;而在与caspase-3反应75分钟后,则在650nm波长处观察到红色荧光信号的增强。这种双通道荧光探针的设计策略具有广泛的适用性,可以扩展到其他类型的探针开发中,为疾病的早期诊断和药物筛选提供了强大工具。
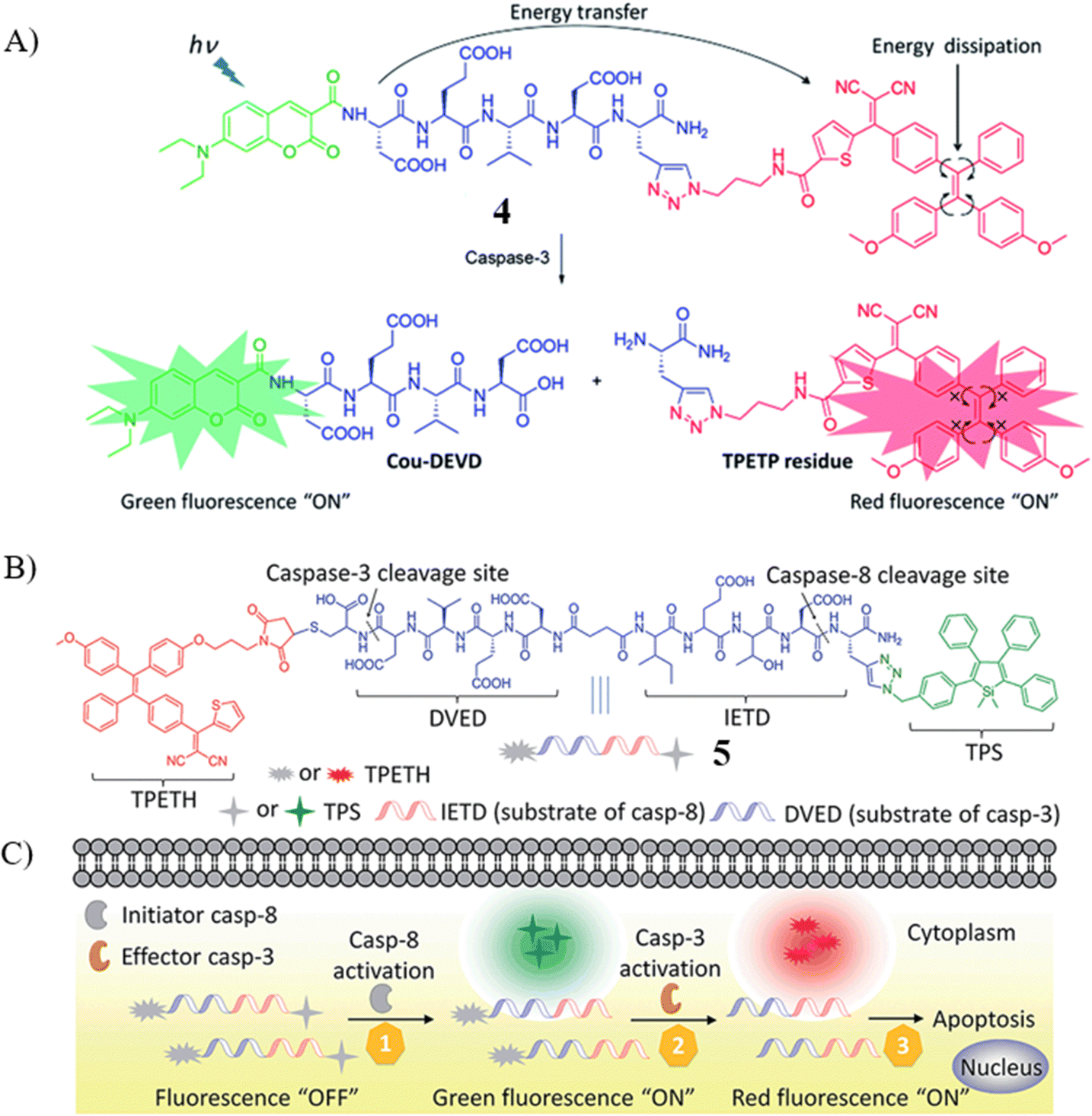
图 3 (A) 探针 4 的示意图;(B) 探针5的化学结构;(C) caspase 级联活化示意图。
近期,Kim教授及其研究团队开创性地合成了一种新型的荧光探针6,该探针基于苯并噻唑-氰基亚乙烯基(CV)结构,通过巧妙地将DEVD肽序列与疏水性的CV-NH2单元相连,实现了在聚集状态下形成高发射效率的红色准分子,进而有效监测细胞凋亡进程中caspase-3的活性。这一探针不仅展现出显著的斯托克斯位移,还具备长波长发射特性,极大提升了其在复杂生物环境下的检测灵敏度和穿透能力。更引人注目的是,该探针在短短5分钟内即可实现对caspase-3的快速、准确检测,检测限(LOD)低至5.1 pg mL-1 (0.17 pM),为体内外caspase-3活性的实时监测提供了前所未有的便捷与精确。
为了进一步增强探针的细胞穿透性和生物相容性,Zhao教授团队设计了一款基于细胞穿透肽RKKRRORRR和DEVD肽序列的比率型凋亡传感器7。在未激活状态下,该探针在582nm波长处展现出强烈的荧光信号(量子产率 Φ = 0.4),而当其与caspase-3发生反应后,一个新的荧光信号在628nm波长处逐渐增强(量子产率 Φ = 0.33),形成了明显的比率荧光响应。根据计算,caspase-3的Michaelis常数 Km为24.9 μM,最大反应速率常数kcat为10.6 s-1,表明探针7与caspase-3之间具有优异的亲和力与反应动力学。尤为重要的是,探针7在被细胞内化并经caspase-3水解后,呈现出清晰的比率荧光变化特征,实现了对细胞凋亡进程中caspase-3活性的实时定量监测,为深入理解凋亡机制及评估疾病状态提供了有力工具。
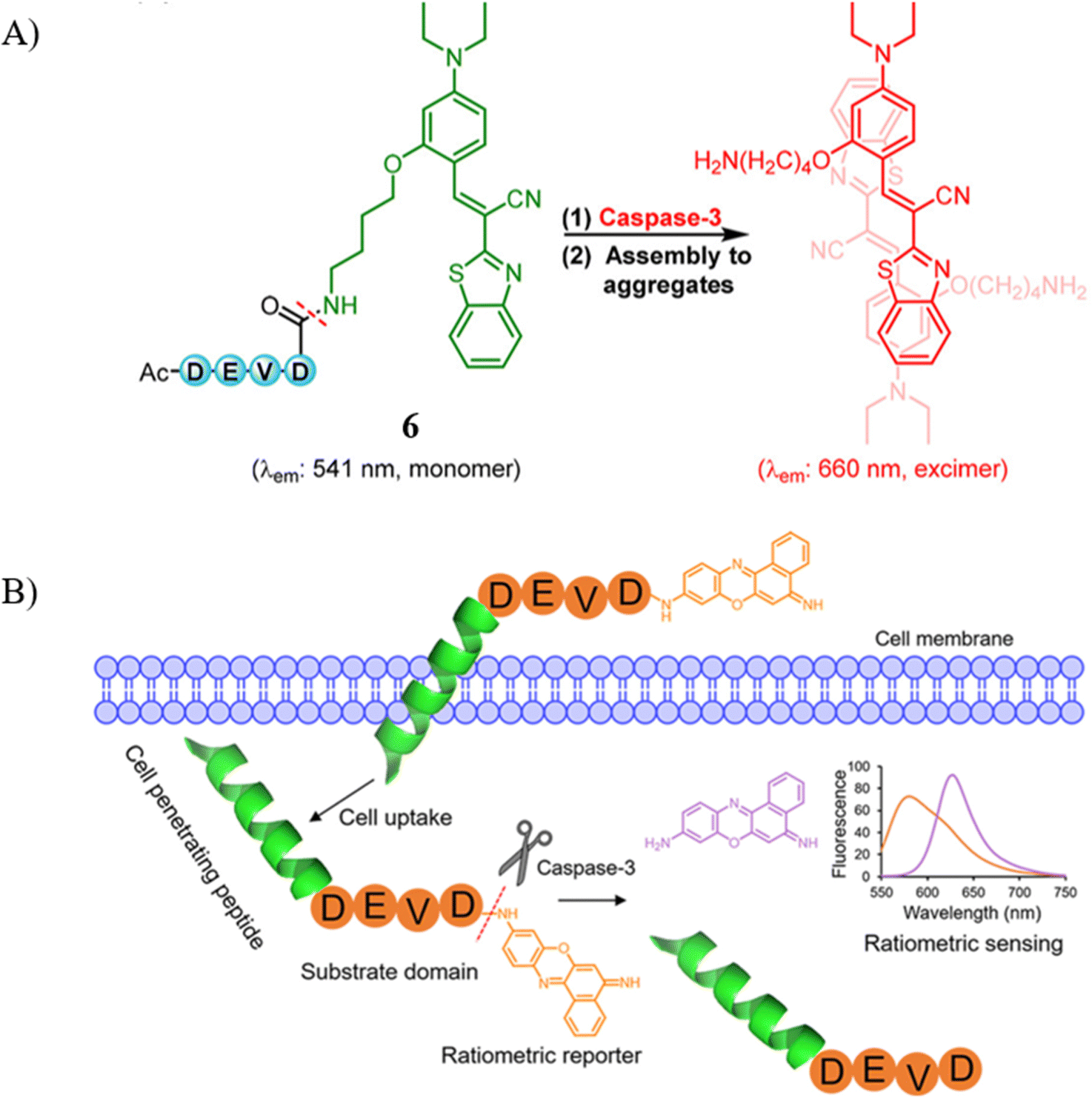
图 4 (A) 6探针的拟议传感;(B)探针7的结构和设计策略。
在此基础上,Pu教授领导的研究团队精心设计并合成了一系列新型肾脏探针,这些探针的肾脏清除率得到了显著提升,为AKI研究领域带来了创新突破。该团队着重研究了探针在药物诱导AKI进程中,对几种关键早期生物标志物的检测能力,包括caspase-3、N-乙酰-β-D-氨基葡萄糖苷酶(NAG)以及超氧阴离子(O2·-),旨在揭示AKI早期阶段的分子病理学特征。
探针8,作为这一系列创新成果的代表作,其结构由三部分构成:(2-羟基丙基)-β-环糊精(HPβCD),这一组分赋予了探针卓越的肾脏清除性能;近红外荧光分子CyOH,确保了深部组织成像的高穿透性和低背景干扰;以及特异性可裂解片段DEVD,使得探针能够响应caspase-3的活性。研究发现,探针8对caspase-3的kcat/Km值达到了0.86 μM-1 s-1,这一数值表明探针与caspase-3之间拥有出色的亲和力与反应动力学,预示着其在AKI早期检测中的巨大潜力。
通过实时成像技术的应用,研究团队观察到,在肾毒性物质暴露后,氧化应激、溶酶体损伤与细胞凋亡等分子事件按序发生,揭示了细胞凋亡与AKI发病机制之间的密切关联。探针8不仅成功捕捉了这一系列早期病理变化,还进一步证实了细胞凋亡在AKI进展中的关键作用,为AKI的早期预警与干预策略提供了有力的科学依据。
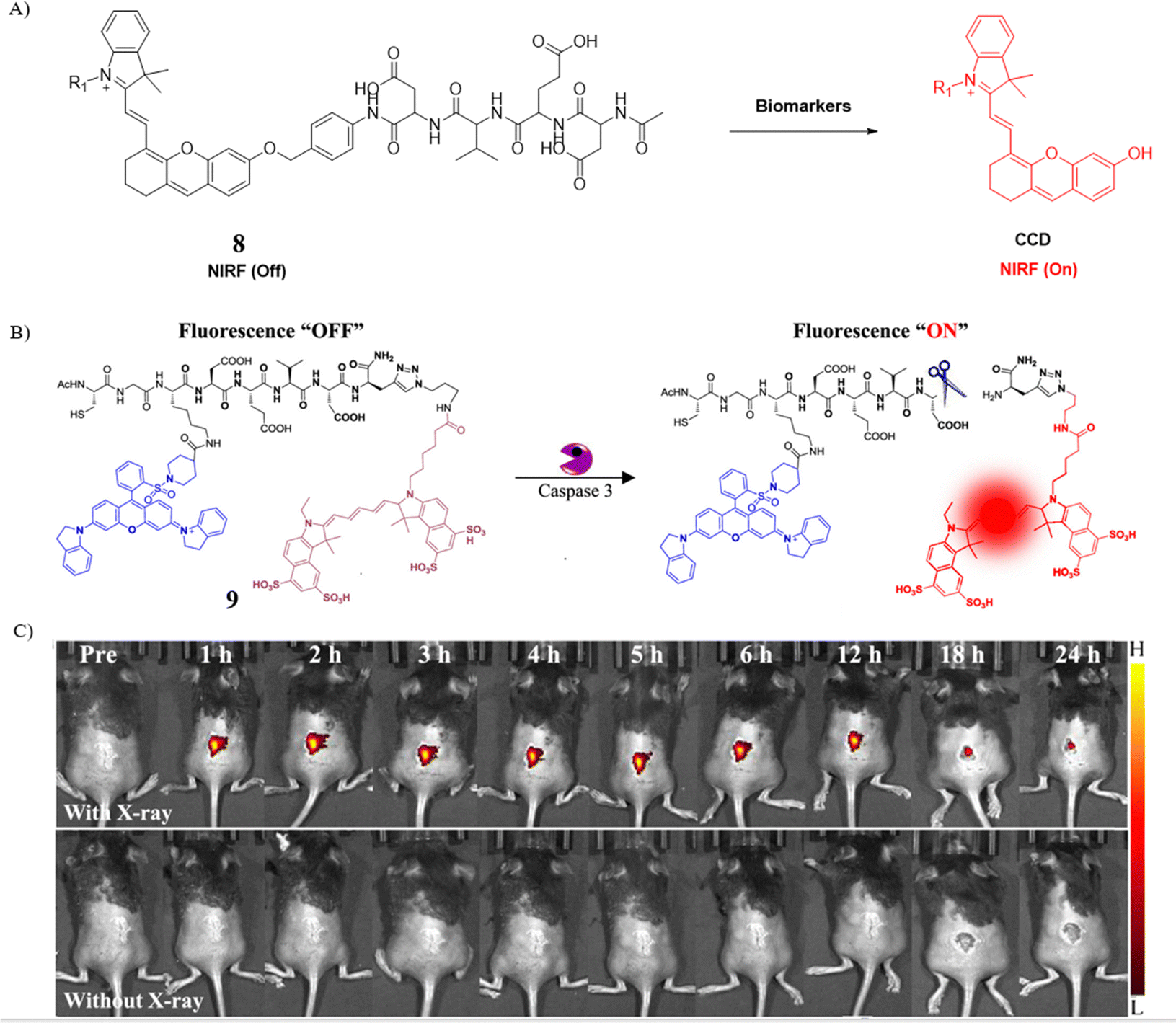
图 5 (A) 探针8的机理; (B) 探针9的结构和机理; (C) 探针9在活体小鼠体内的图像。
Shi及其研究团队在2021年设计了一款创新的近红外荧光探针9,用于胚胎凋亡过程的实时成像。这款探针巧妙地集成了三个关键组成部分:荧光染料Cy5.5,负责提供近红外荧光信号;荧光淬灭剂,用于在未激活状态下抑制荧光信号;以及DEVD肽,作为特异性识别细胞凋亡标志酶Caspase-3的识别单元。正如预期,探针在水溶液中处于非激活状态时,几乎不显示荧光,但一旦与Caspase-3接触并被激活,便会迅速释放强烈的近红外荧光信号。这一特性得益于探针的出色光学性能,使其成为首个应用于胚胎凋亡中Caspase-3活性实时成像的工具。在活体检测实验中,实验小鼠的子宫区域相较于对照组展现了显著更强的荧光信号,有力证明了探针9在胚胎凋亡活体检测领域的巨大潜力。
分子自组装技术作为一种提升凋亡传感器检测性能的有效手段,通过调整氨基酸和肽的数量,能够增强自淬灭效应,从而有效降低荧光背景,实现更高灵敏度的检测。Yang研究团队正是运用这一技术,设计了一系列用于Caspase-3高灵敏度成像的荧光探针。2015年,他们合成了一系列标记有荧光素异硫氰酸酯(FITC)或罗丹明(Rho)的探针,旨在探究这些荧光基团对淬灭效应增强的贡献。研究发现,含有更多4-氟苯丙氨酸(fF)的探针展现出更佳的自组装性能。探针10与探针11,在酶切后释放红色荧光,被成功应用于STS诱导的细胞凋亡成像。正如预期,与探针共孵育后,凋亡细胞呈现出明显的红色荧光信号,而正常细胞的信号则十分微弱,这为生物环境中实现高信噪比检测提供了一种有效的凋亡传感器。
此外,该研究团队还报道了一系列具有AIE特性的荧光探针,用于体外和体内细胞凋亡的更灵敏检测。值得一提的是,探针12的检测限(LOD)低至0.54 pM,显著低于探针13的3.50 pM。这一发现不仅凸显了AIE探针在细胞凋亡检测中的优势,更为基于自组装的AIE荧光探针高灵敏度检测细胞凋亡提供了一种通用方法,为未来生物医学研究与临床应用开辟了新的可能性。
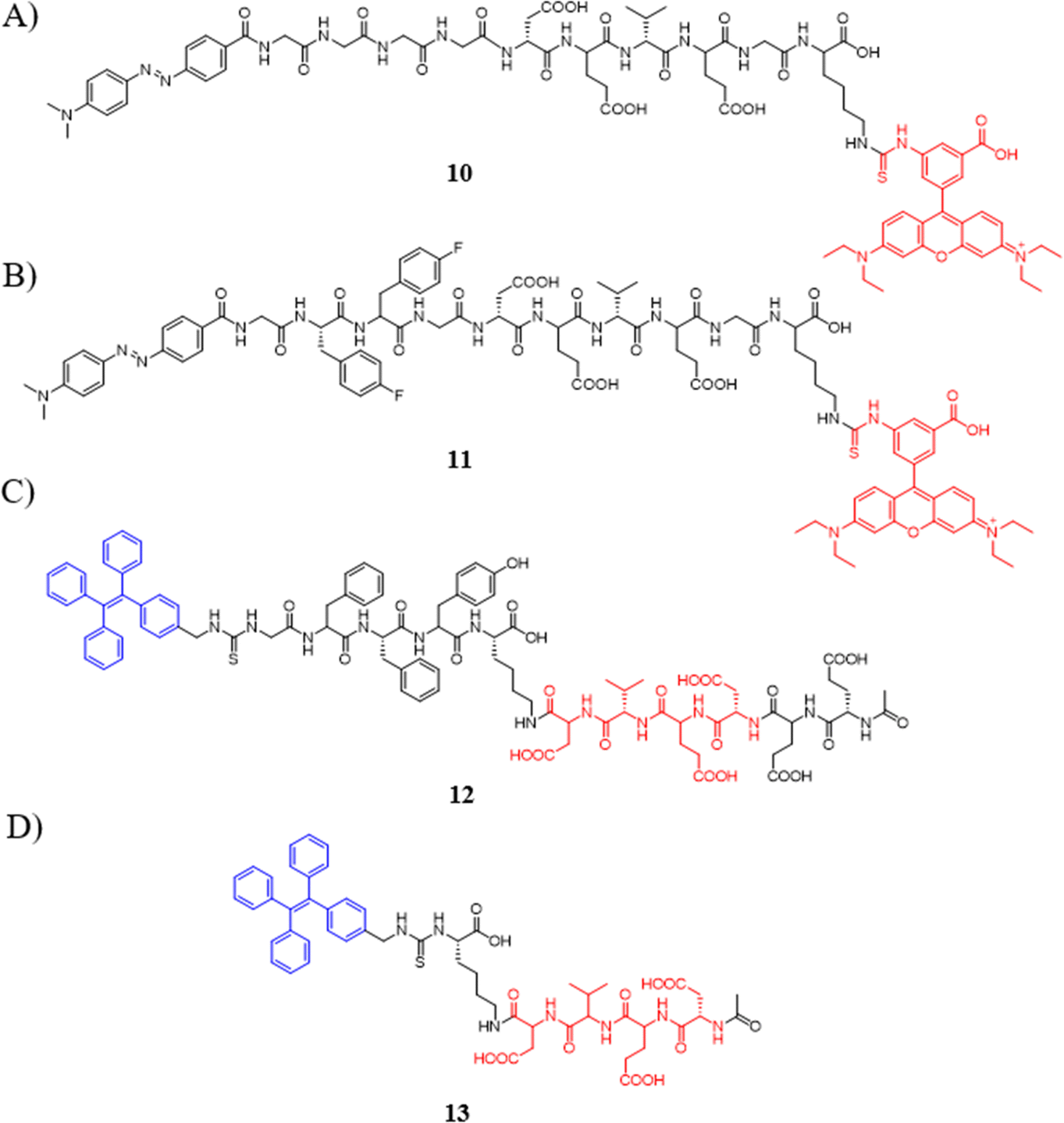
图 6 (A) 探针 10 的化学结构; (B) 探针11的化学结构; (C) 探针12的化学结构; (D) 探针13的化学结构。
双光子(TP)荧光成像技术因其能够实现深层组织成像、背景信号低以及光损伤小等优势,近年来备受科研界青睐,成为细胞凋亡研究中的新兴工具。Zhang研究团队在这一领域取得了突破性进展,他们首次设计并合成了一系列基于萘取代吡唑啉的光点击反应的TP荧光探针,这些探针不仅能够深入组织内部,还能有效避免生物样本中自发荧光的干扰,为细胞凋亡的实时监测提供了前所未有的可能性。
在这一系列探针中,研究团队首先筛选出了一种适配于TP成像的荧光团,确保了探针在双光子激发下的高效发光性能。随后,他们进一步开发了两种特异性靶向亚细胞器的探针,其中探针14能够精准定位线粒体,而探针15则专一性地与溶酶体结合。这些探针的开发不仅丰富了细胞凋亡研究的工具箱,还为深入了解凋亡过程中线粒体和溶酶体的功能变化提供了关键手段。
特别值得关注的是,探针16的设计巧妙地结合了环状RGD肽c(RGDyK)与富马酸单甲酯,实现了肽靶向配体与肽底物的双重功能。通过光点击反应,探针16能够特异性识别并进入肿瘤细胞,实现对Caspase-3表达的TP成像,尤其在深部组织中展现出优异的成像效果。这一成果为肿瘤凋亡过程的可视化研究提供了强有力的技术支持。
Caspase-9作为应激诱导和线粒体介导凋亡途径中的关键生物标志物,能够激活下游的Caspases-3/6/7,进而引发细胞凋亡。Forrest团队报告了一种创新的凋亡探针17,该探针融合了近红外荧光染料IR780与肽酰氟甲基酮(FMK)结构,专为监测凋亡过程中caspase-9的活性而设计。实验结果表明,即使在极低浓度(0.1 μM)下,探针17 仍能有效成像凋亡的DU145细胞,展现出79 nm的斯托克斯位移和高达0.75的量子产率,充分证明了其在细胞凋亡实时监测中的巨大潜力。
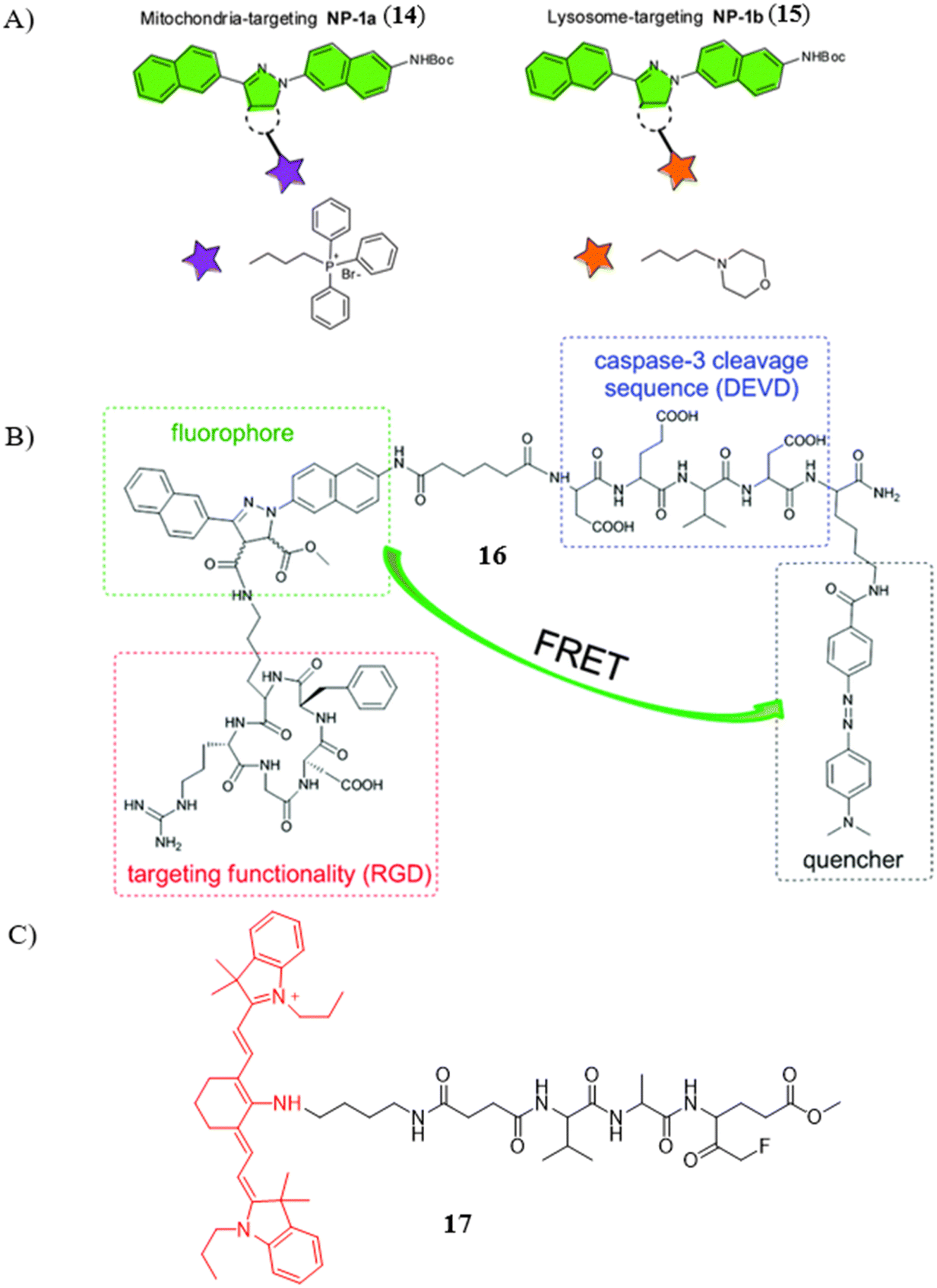
图 7 (A) 探针14(NP-1a)和探针15(NP-1b)的化学结构和设计策略; (B) 探针16的化学结构。 (C) 探针17的化学结构。
精准医疗的核心诉求在于实现靶向给药,以最大化治疗效果,并能在疾病微环境中实时监测药物的疗效。目前,已有若干颇具前景的治疗原药通过与活性荧光染料的共轭制备,被开发用于即时跟踪药物作用及细胞凋亡的进程。2013年,Liu研究团队设计了一种用于靶向化疗的铂(iv)原药18,该原药独具创新地融入了环状cRGD三肽,能够特异性地识别并结合肿瘤细胞表面的αvβ3受体,同时配备凋亡传感器,以便于现场评估药物诱导的细胞凋亡效果。
与单纯的游离药物相比,铂(iv)原药18展现出显著的无毒性特点,在αvβ3整合素过表达的U87-MG细胞膜上被激活,从而确保了药物的高安全性和靶向特异性。实验数据显示,在293T和MCF-7细胞中,即使在第Ⅳ期,荧光信号依旧微弱,而同期的U87-MG细胞则呈现出强烈的荧光信号,这一现象明确指示,在复杂生物环境中,激活后的药物能够有效释放,进而使U87-MG细胞成为一个高灵敏度的发光凋亡传感器,能够在原位准确反映药物诱导凋亡的过程。
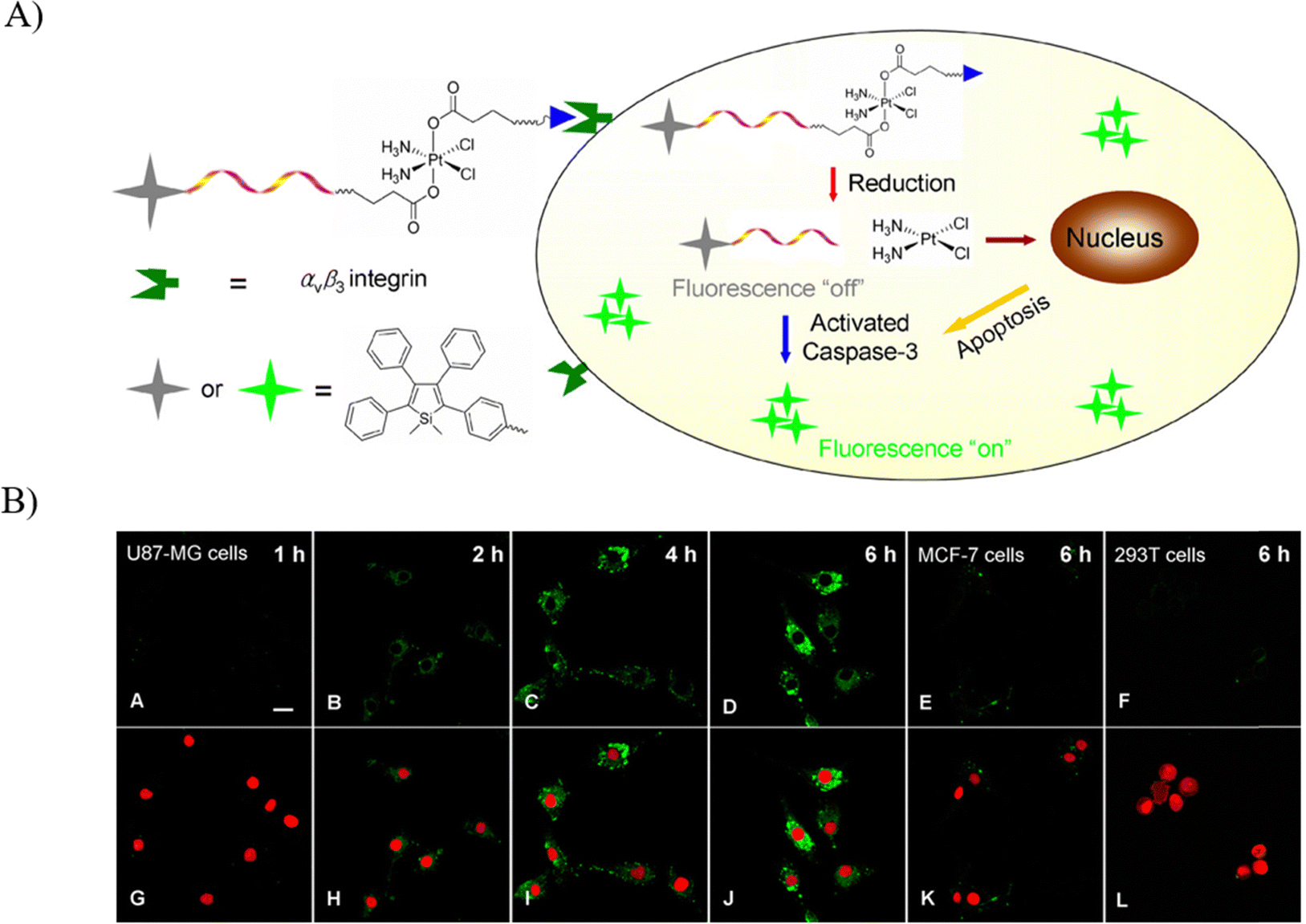
图 8 (A) 探针 18 的示意图; (B) 不同细胞中探针18的实时 CLSM 图像。
2015年,Liu团队进一步研发了一款用于光动力疗法(Photodynamic Therapy, PDT)评估的创新发光探针19。该探针集成了红色发射的光敏剂(Photosensitizer, PS),在光照作用下生成具有细胞毒性的活性氧物种(Reactive Oxygen Species, ROS),有效杀伤癌细胞。同时,探针内含可激活的绿色凋亡传感器,基于AIE特性,能够在复杂肿瘤微环境中实时监测PS的激活状态。在与谷胱甘肽(GSH)共孵育90分钟后,探针于650nm波长处的荧光强度提高了14倍,并在MDA-MB-231细胞吸收后,展现出优异的红色荧光信号,成功实现了细胞成像与PS激活的双重检测。更有甚者,经GSH预处理的探针与caspase-3/-7共同孵育后,由于四苯基硅烷(TPS)残基的聚集,绿色荧光强度显著提升,便于直观监测caspase-3/-7的活性及评估治疗效果。与探针20相比,探针19兼具治疗与检测的双重特性,极大地促进了该研究领域的进步。
与此同时,Zheng研究团队设计并应用了一款有效探针21,该探针结合了红移荧光供体与卟啉受体,能够产生ROS并按比例感知细胞凋亡过程。由于探针与caspase-3共孵育后,FRET比值提升了约20倍,使得探针的裂解部分易于区分。此外,探针21能够被激活用于PDT,仅需微量光照即可诱导细胞凋亡,而非坏死或其他非凋亡状态,这一特性显著提升了治疗的精确度与效率。这些创新成果不仅丰富了细胞凋亡检测与治疗手段,还为精准医疗领域的深入研究与应用开辟了新途径。
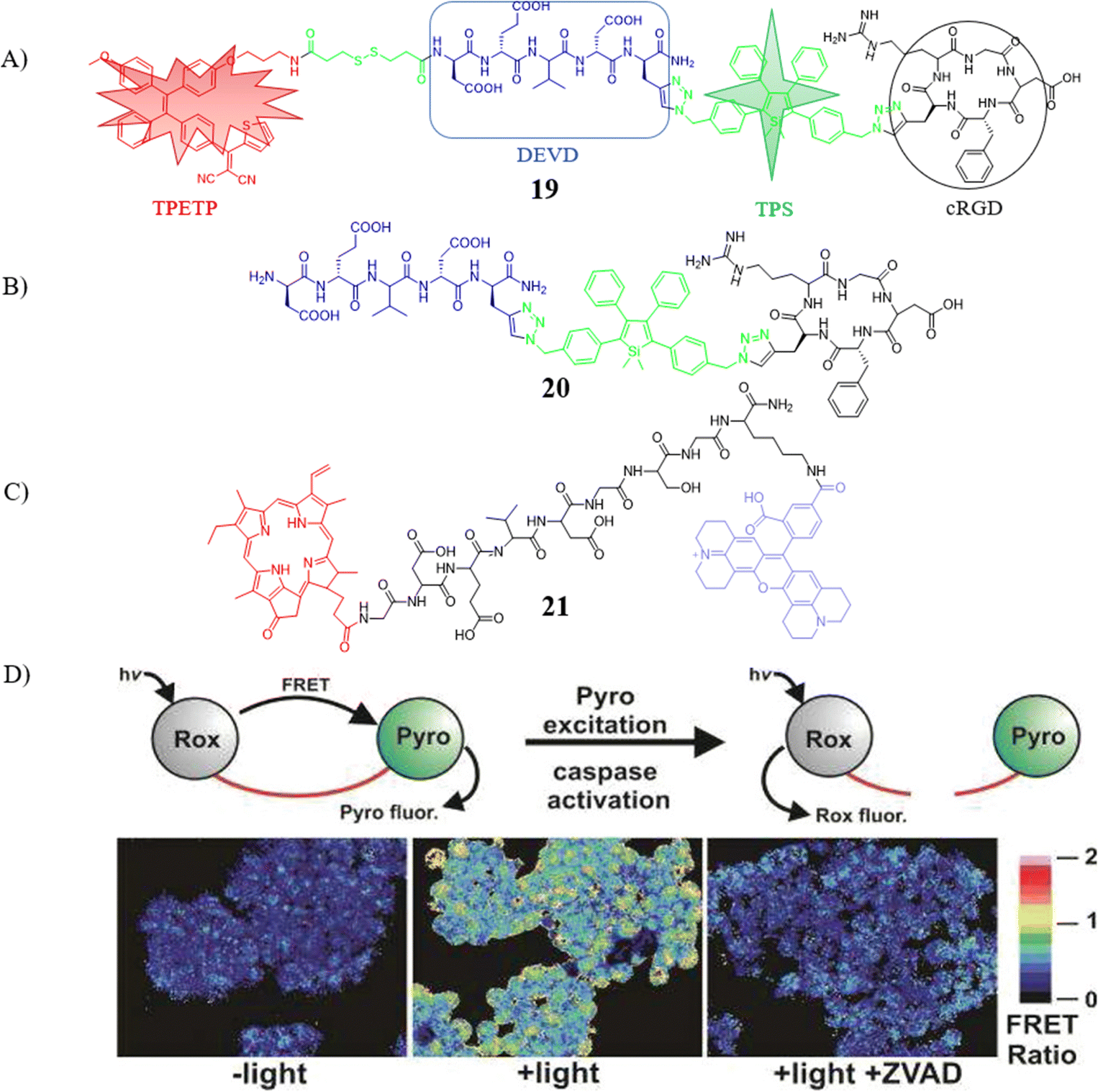
图 9 (A) 探针 19 的化学结构; (B) 探针20的化学结构; (C) 探针21的化学结构; (D) 探针21的示意图和 CLSM 图像
受到先前研究成就的启示,科研人员持续探索用于癌症治疗的靶向药物递送体系。其中,Zhang实验室研发了一款基于FRET机制的多功能前药22。这款前药包含了腙修饰的多柔比星(DOX),一种著名的荧光性抗癌药物,它能在肿瘤特有的低pH环境下被激活,从而发挥其抗肿瘤作用。前药中还融入了FAM作为可淬灭荧光团,与Caspase-3酶可裂解的DEVD肽序列相结合,这一设计使得前药能作为细胞凋亡的实时监测器,通过FAM的荧光变化反映凋亡进程。
为了实现对特定癌细胞的靶向递送,前药还配备了精确定位的RGD三肽序列,这有助于U87细胞特异性地摄取前药分子。在初始阶段,由于4-(二甲基氨基偶氮)苯-4-羧酸(Dabcyl)的存在,DOX或FAM的荧光信号几乎被完全淬灭。然而,随着孵育时间的延长,DOX的红色荧光和FAM的绿色荧光信号均逐渐增强,这不仅指示了DOX的逐步释放,同时也揭示了U87细胞内部Caspase-3酶的激活状态。
为了验证前药是否具备在细胞内实时监测Caspase-3活性的能力,研究者使用了Caspase-3抑制剂Ac-DEVD-CHO(浓度为50 μM)对U87细胞进行预处理2小时,随后与前药进行孵育。实验结果表明,即使在Caspase-3被抑制的情况下,DOX的红色荧光强度依旧呈现上升趋势,说明药物的释放并未受到影响;然而,FAM的绿色荧光信号却显著减弱直至消失,这直接归因于Caspase-3活性的阻断。这一发现不仅确认了前药作为高效细胞凋亡传感器的潜力,也为癌症治疗策略的优化提供了有力的监测工具。
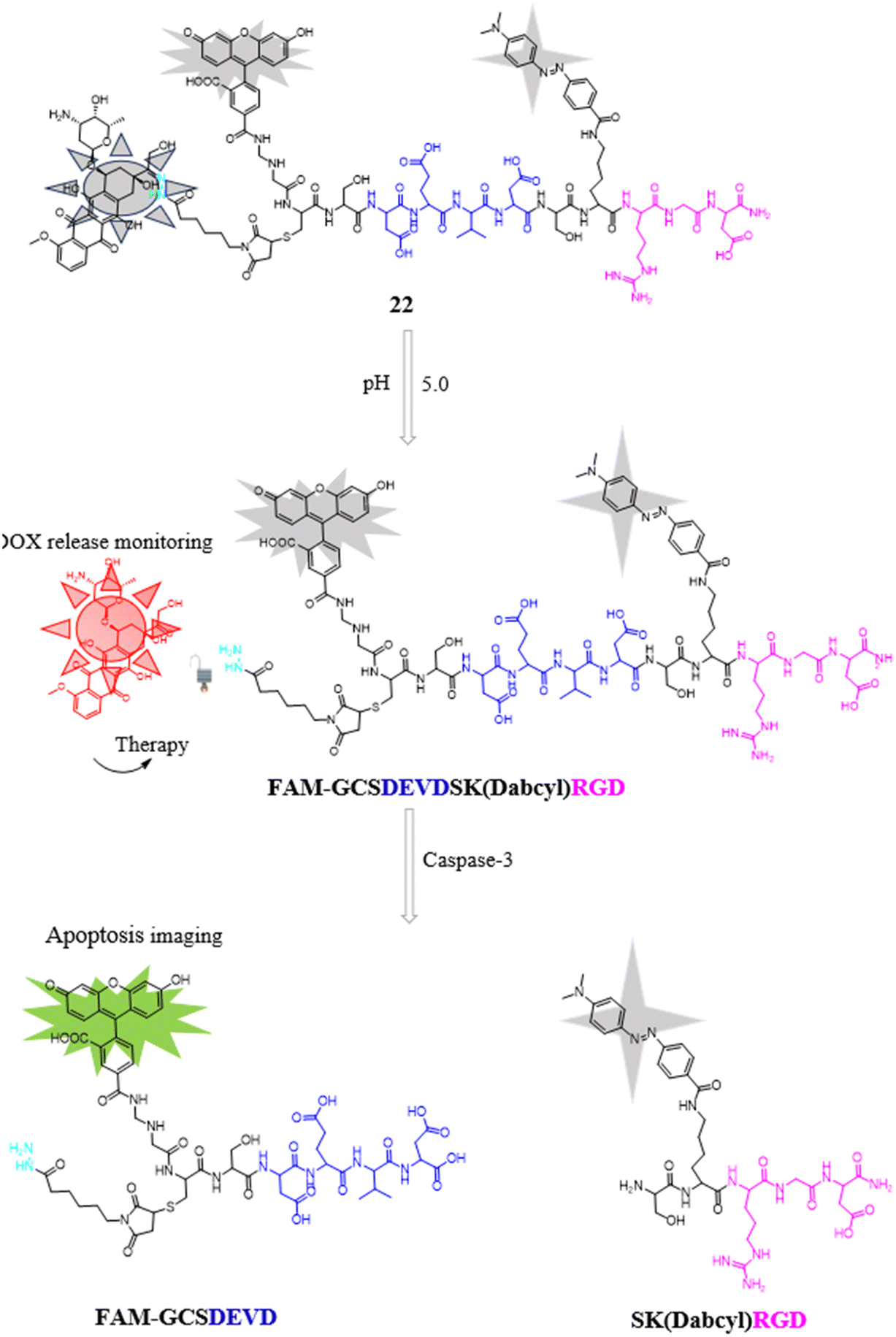
图 10 探针22的化学结构和拟议过程。
Ji团队精心设计了一款靶向递送吉西他滨(GEM)的药物载体23,旨在实现对胰腺癌细胞治疗效果的评估。在细胞摄取后,GFLG肽序列能够被BxPC-3细胞中过表达的cathepsin B酶高效裂解,这一过程促使吉西他滨从药物载体中释放,进而诱导细胞凋亡。紧接着,过量表达的caspase-3酶作用于特定的DEVD序列,促使AIE凋亡传感器的释放,为实时监测药物诱导的胰腺癌细胞凋亡过程提供了精准的成像平台。这一设计不仅确保了药物的靶向递送,还通过AIE传感器的荧光信号变化,直观地反映了细胞凋亡的动态进展,为胰腺癌的治疗与疗效评估提供了有力的工具。
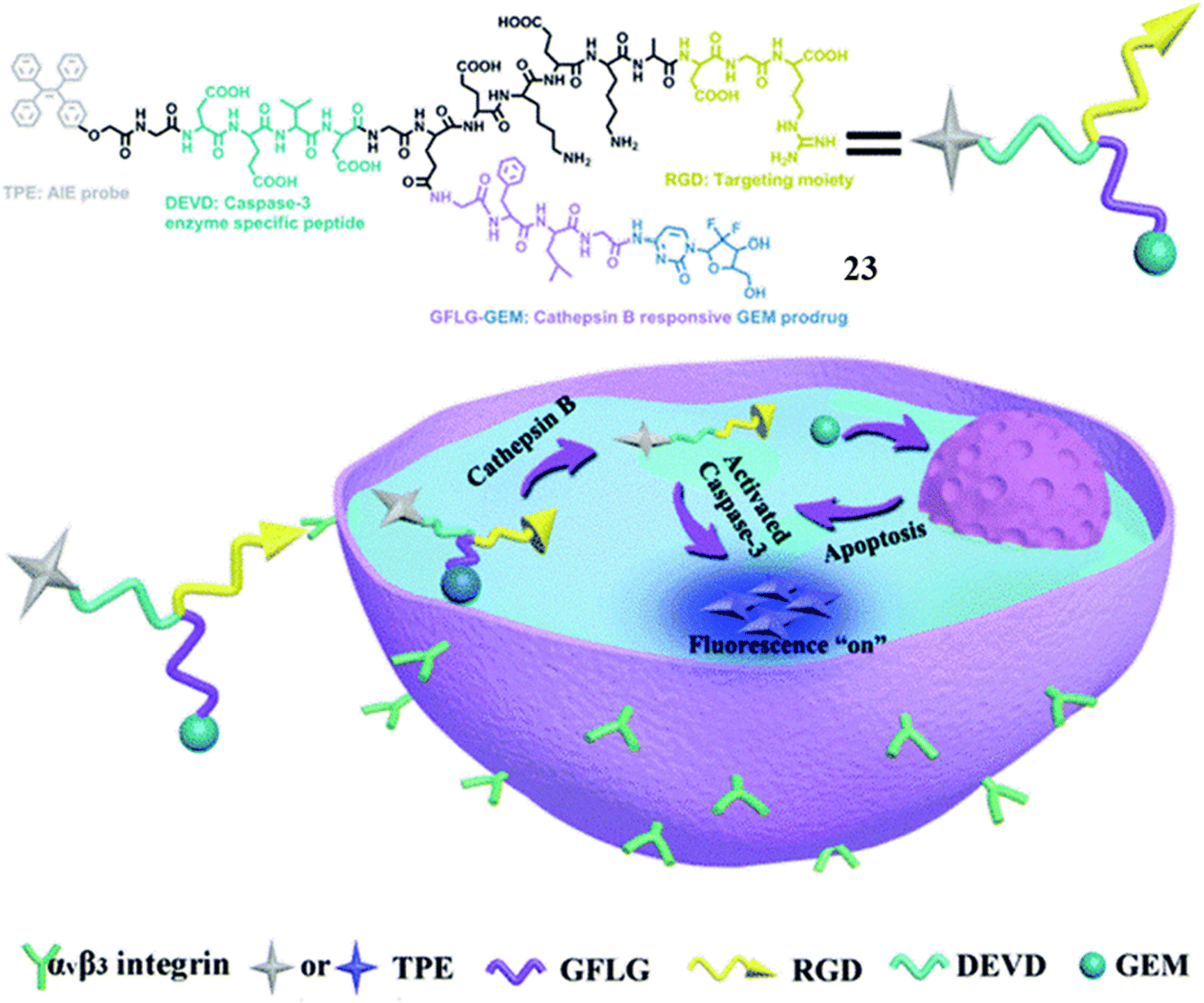
图 11 探针 23 的示意图。
在细胞凋亡成像领域,基于DEVD序列的Caspase-3/7响应型SMFPs的研发已经取得了显著进展。这些SMFPs的应用可归纳为三个方面:一是实现细胞凋亡过程的实时成像,二是评估凋亡诱导药物的治疗效果,三是助力治疗系统的效能实现。值得一提的是,除了Caspase-3/7,细胞凋亡过程中还涉及其他Caspase家族成员,如Caspase-8、Caspase-9和Caspase-10,因此,开发针对这些Caspase的高效SMFPs同样具有重大意义。
DEVD序列作为Caspase-3的特异性识别序列,在SMFP设计与合成中发挥了关键作用,其应用已相当广泛。然而,寻找并优化更具识别效率的多肽序列,仍然是未来研究的一个重要方向,旨在进一步提升SMFPs在细胞凋亡检测中的灵敏度与特异性。这一领域的持续探索将为深入理解细胞凋亡机制、开发新型诊断工具和优化治疗策略提供强大的技术支持。
2.2. 用于监测细胞凋亡过程中胆碱酯酶活化的 SMFPs
乙酰胆碱酯酶(AChE)是一种在多种肿瘤细胞中过量表达的关键酶,其参与调控肿瘤细胞的生长与分裂,并在细胞凋亡进程中于细胞核中显现,表明它在化疗诱导的细胞死亡中扮演核心角色。鉴于此,能够实时监测AChE水平的成像技术对于准确诊断疾病及评估药物治疗效果至关重要。与此同时,丁酰胆碱酯酶(BChE)水平的异常变化也与一系列神经退行性疾病相关联,故而对凋亡细胞中BChE动态的实时成像亦具有临床研究价值。
Liu的研究团队开发了一种近红外荧光探针24,用于实时追踪AChE的活性。该探针由近红外染料NFL-OH与识别基团2-噻吩甲酰氯结合而成。当AChE催化下产生的硫代胆碱攻击探针中的特异性酯键时,会在30分钟内引发745nm波长的近红外荧光信号显著增强。此探针展现出低检测限(LOD),仅为0.2 mU mL-1,适用于成像外源与内源AChE活性。荧光信号约在60分钟后达到最高点,而在抑制条件下,荧光信号则显著减弱。这表明,探针24可能为AChE相关疾病中的细胞凋亡现象提供一种可行的影像学检测手段。
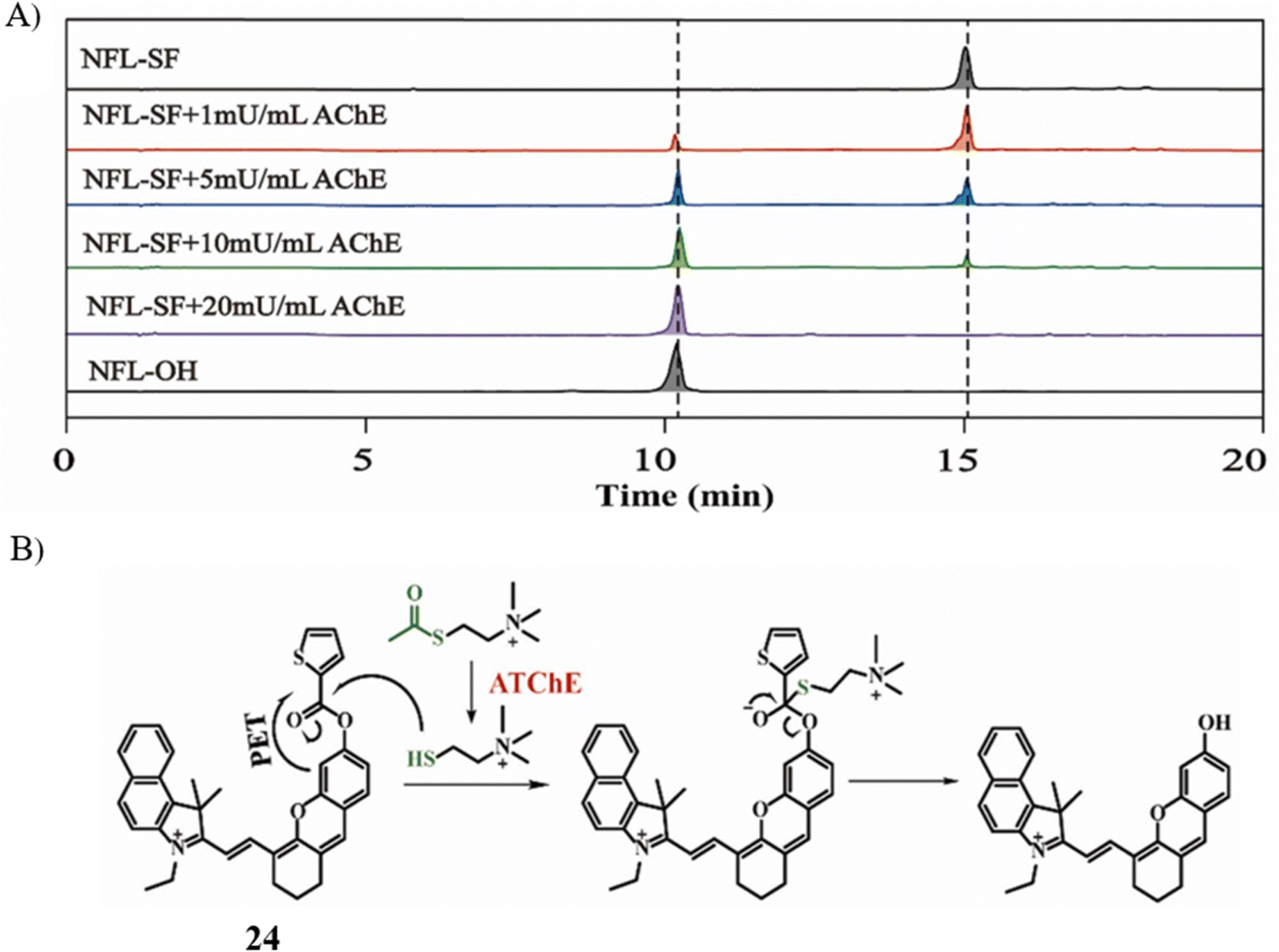
图 12 (A) 探针24(NFL-SF)在不同 AChE 和 ATCh 处理下的 HPLC 图谱; (B) 探针24的作用机理。
丁酰胆碱酯酶(BChE)作为关键酶,在多种神经退行性病变的进展中发挥着核心作用,并被视为此类疾病诊断中细胞凋亡的重要生物标记。2022年,Guo的科研团队介绍了一款新颖的荧光探针,旨在实现BChE活性的实时监测。这款被命名为探针25的工具,具备卓越性能,包括极低的检测阈值(0.07969 U mL-1)、快速响应时间(仅5分钟)以及显著的斯托克斯位移(113 nm)。利用这些优势,研究人员采用该探针对过氧化氢处理下的LO2细胞进行了可视化实验。实验结果表明,经H2O2 处理的细胞相较于未处理的对照组,展现出更为强烈的荧光信号,这有力地证实了探针25在BChE体内成像应用上的潜力。
同样地,2020年,Lin的研究团队率先提出了一种专门设计用于肿瘤细胞及脑胶质瘤胆碱酯酶(ChE)活性成像的近红外荧光探针。探针26不仅对AChE和BChE展现了极低的检测限(分别为0.127 U mL-1和0.0117 U mL-1),而且具备超速响应特性(小于3秒)及在654 nm处的大斯托克斯位移(110 nm)。值得注意的是,原位成像分析确认了ChEs在肿瘤细胞和脑胶质瘤中表现出更高活性的事实。此外,探针26还在活细胞与斑马鱼模型中成功实现了ChE水平在凋亡进程中的动态监测,进一步彰显了其在生命科学领域的广泛应用前景。
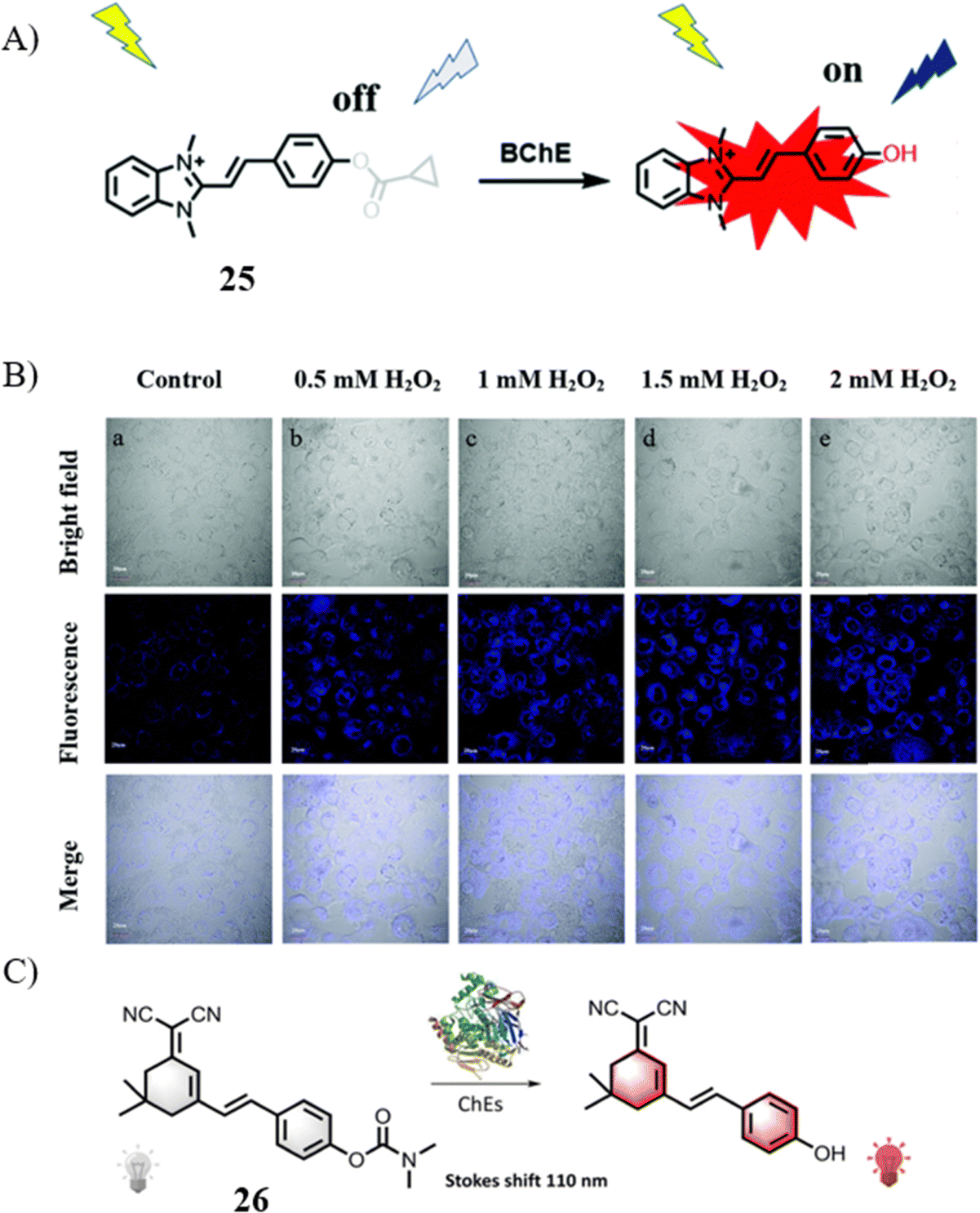
图 13 (A) 探针 25 的结构和传感机制; (B) 25在不同浓度 H2O2 的 LO2 细胞中的荧光图像。 (C) 探针 26 的结构和传感机制。
2.3. 用于监测细胞凋亡过程中 ATP 酶活化的 SMFPs
ATPase,作为细胞能量代谢的关键酶,亦是细胞凋亡进程中不可忽视的生物标志物。近年来,多项研究指出,线粒体ATP酶在癌症凋亡机制中扮演着至关重要的角色,因其直接关乎ATP的合成。为此,Fan研究团队精心设计了一款ICT探针27,旨在实现对癌症细胞凋亡过程中ATP酶活性的精准监测。
该探针针对HepG2细胞中的ATP酶展现出了高信噪比的荧光响应(I590 nm/I565 nm),这意味着它能够有效区分ATP酶活性的变化。在凋亡的癌细胞内,ATP酶的活性通常会有所下降。通过实时成像技术,研究者观察到随着绿色荧光信号强度的提升,ATPase中的F1单元水解功能相对增强,而红色信号的强度则相应减弱,这直观地反映了ATP酶活性与细胞凋亡状态之间的关联。
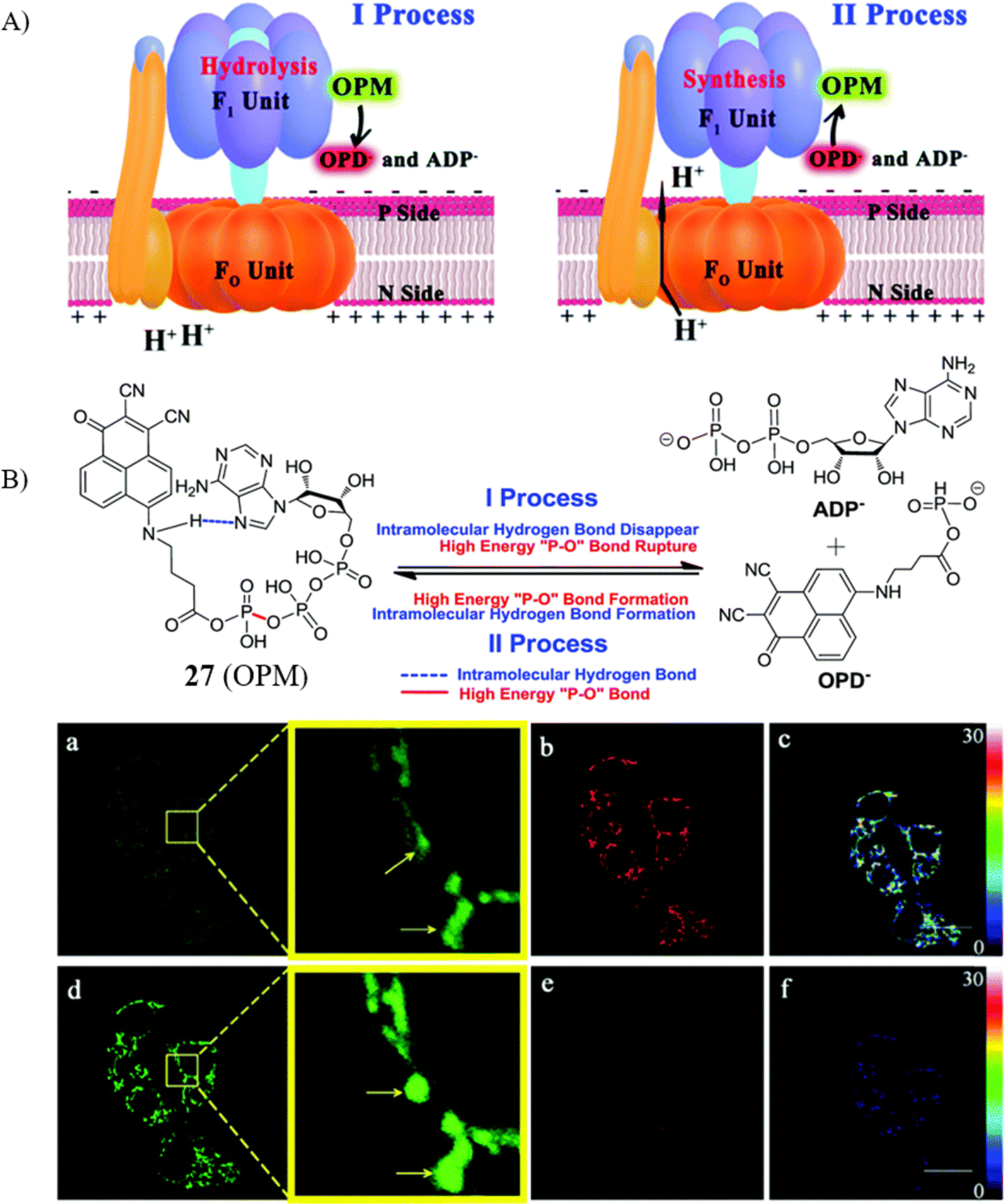
图 14 (A) 线粒体 ATP 酶探针 27(OPM)的识别过程; (B) 利用探针27对线粒体 ATPase 活性的实时成像。
尽管有大量的临床数据支持线粒体ATP酶水平的异常与癌症凋亡以及其他疾病存在关联,但迄今为止,关于ATP酶在调控细胞凋亡中作用的SMFPs研究仍较为有限。这一现状显著制约了将ATP酶作为癌症治疗潜在靶点的开发利用。为了深入解析ATP酶在细胞凋亡机制中的确切角色,迫切需要开展更多基于高度特异性和灵敏度的SMFPs的探索性研究,以填补当前知识空白,推动ATP酶相关治疗策略的进展。
3. 用于感知细胞凋亡过程中质膜变化的 SMFPs
质膜(PM),作为细胞的边界,由异质性的蛋白、糖类与脂质构成,其形态、结构与组成成分的变化能够迅速响应细胞微环境的波动,直接映射出细胞凋亡的状态。特别是在凋亡早期,细胞表面出现的磷脂酰丝氨酸无序分布即是典型的形态变化之一。尽管监测细胞凋亡进程中微粒动态已有多种成熟技术,但SMFPs因其独特的成像优势,正逐渐成为观察细胞凋亡微观演变的有力工具。
本章节将系统梳理用于细胞凋亡过程中胞体变化成像的SMFPs,依据其探测机制的不同,我们将这些探针划分为四大类别:一是针对磷脂酰丝氨酸分布变化的探针;二是监测细胞膜成分动态调整的工具;三是捕捉膜形态学变异的传感器;四是探测膜电位波动的分子标识。通过这些精心设计的SMFPs,研究者能够更深入地洞察细胞凋亡的复杂过程,为理解细胞命运调控机制提供新的视角。
3.1. 在细胞凋亡过程中感知磷脂酰丝氨酸的 SMFPs
磷脂,作为细胞膜的基本组成成分,常规分布于膜的内层,对维持细胞膜的正常功能至关重要。然而,在细胞凋亡的早期阶段,磷脂酰丝氨酸(PS)异常地外翻至细胞膜外表面,这一特征变化成为细胞凋亡早期识别的标志。因此,能够成像PS动态变化的荧光探针,成为了直观揭示细胞凋亡进程的有力工具。
Tang团队研发了一款创新的荧光探针28,该探针兼具AIE特性,不仅能够区分细胞凋亡的早晚期,还能实现对H2O2诱导下细胞凋亡过程的连续监测。探针28由两部分组成:一是具备AIE效应的四苯基噻吩染料,可在细胞凋亡时亮化细胞膜;二是靶向PS的2,6-双(锌(ii)-二二乙醇胺)氧化酚复合物。在正常细胞中,探针的荧光信号极为微弱。然而,随着细胞凋亡的启动,锌离子复合物与外翻的PS结合,导致荧光信号逐渐增强。特别地,在细胞凋亡晚期,由于细胞膜受损加剧,荧光信号强度显著高于早期凋亡细胞,这使得探针28能够有效地区分凋亡的早晚期阶段。

图 15 探针 28(TPE-Zn2BDPA)的化学结构和传感机制。
2019年,Klymchenko团队报道了一款与上述原理相似的荧光探针29,同样用于识别和区分细胞凋亡的早晚期阶段。这款探针由三个关键功能组件构成:(i)基于BODIPY的转子,作为对粘度敏感的荧光团,在498和514nm波长处呈现吸收和发射特性;(ii)DPA-Zn作为磷脂酰丝氨酸(PS)的识别单元;(iii)PEG-12单元作为水溶性链接,用于连接荧光团与识别单元。如同之前所述的探针,29在健康细胞中几乎不发出荧光信号,但在早期凋亡细胞中,因探针与外翻的PS结合并锚定于细胞膜上,从而产生显著的绿色荧光信号。在晚期凋亡细胞中,由于PS过量外翻及细胞膜通透性增加,绿色荧光信号更加强烈。由此,探针29能够通过不同强度的荧光信号来辨别细胞凋亡的早晚期。
Jolliffe研究团队则设计了一款基于分子内指示剂位移(IID)机制的荧光探针30,用于感应细胞表面的PS并实现对细胞凋亡的延时成像。该探针的多肽骨架包含:(i)ZnDPA作为PS的结合分子;(ii)6,7-二羟基香豆素作为荧光指示剂,与ZnDPA的一部分配位,在非激活状态下造成荧光淬灭;(iii)硬脂酸膜锚,用以减缓细胞对探针的吸收速度,避免对细胞膜内侧PS的成像造成干扰。作为首款IID探针,30已成功应用于利用共聚焦显微镜与流式细胞仪监测细胞表面PS,且无需Ca2+或洗涤步骤,这在同类探针中实属首创。此外,探针与PS的结合时间仅需1分钟,相比之下,Annexin V需要15分钟,这一特点在区分活细胞、凋亡细胞和坏死细胞方面展现出显著优势。
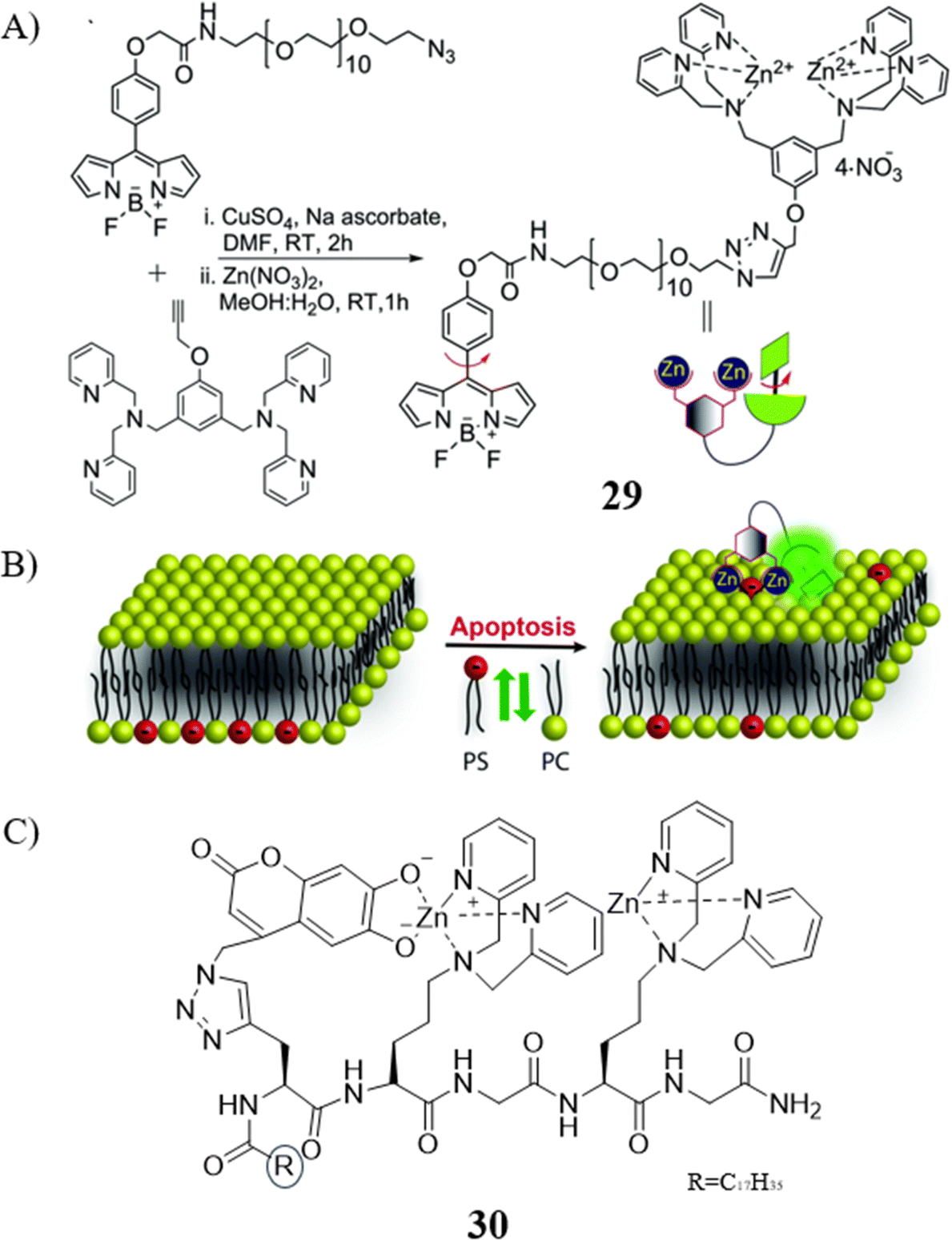
图 16 (A) 探针29的合成; (B) 探针29的示意图; (C) 探针30的化学结构。
3.2. 用于感知细胞凋亡过程中成分变化的 SMFPs
三磷酸腺苷(ATP),作为细胞内普遍的能量货币,主要在线粒体中生成,并分布于包括基质和质膜在内的多个细胞区域,为各类细胞活动提供动力。其中,质膜中的ATP浓度与细胞凋亡的进程息息相关。为了深化对这一关键生物分子的理解,开发基于SMFPs的成像工具显得尤为重要。
Chang和Das的研究团队分别设计了荧光探针31与32,旨在监测细胞凋亡过程中线粒体中ATP水平的变化。探针31,作为一款多位置结合的可切换凋亡传感器,能够快速并选择性地检测细胞内的ATP。研究中,他们证实了线粒体ATP浓度在氰化钾(KCN)处理和营养饥饿条件下逐渐下降,但在细胞凋亡初期反而有所上升,这表明探针31在研究ATP相关生物过程方面具有潜在的应用价值。
Das研究团队报道的开启型凋亡传感器32,则用于以超分辨率监测活细胞中细微的ATP变化。凭借其优异的线粒体定位特性,该探针能够有效感知细胞外多磷酸核苷的释放和线粒体中ATP浓度的波动。
Wang团队则开发了一款新型水溶性荧光探针33,用于检测细胞膜中的ATP水平。该探针由聚噻吩骨架与三苯基膦组成,作为一款Turn-Off型荧光探针,它在水溶液中因良好的水溶性和分散状态而展现出显著的荧光。与ATP相互作用后,探针通过静电和疏水作用聚集,伴随聚合物构象从无规转变为聚集体,其荧光信号随之被淬灭。值得注意的是,探针33在检测质膜中ATP时表现出高灵敏度、光稳定性以及低检测限(27 nM)。最终,该探针成功应用于感知活体小鼠凋亡过程中ATP水平的动态变化。
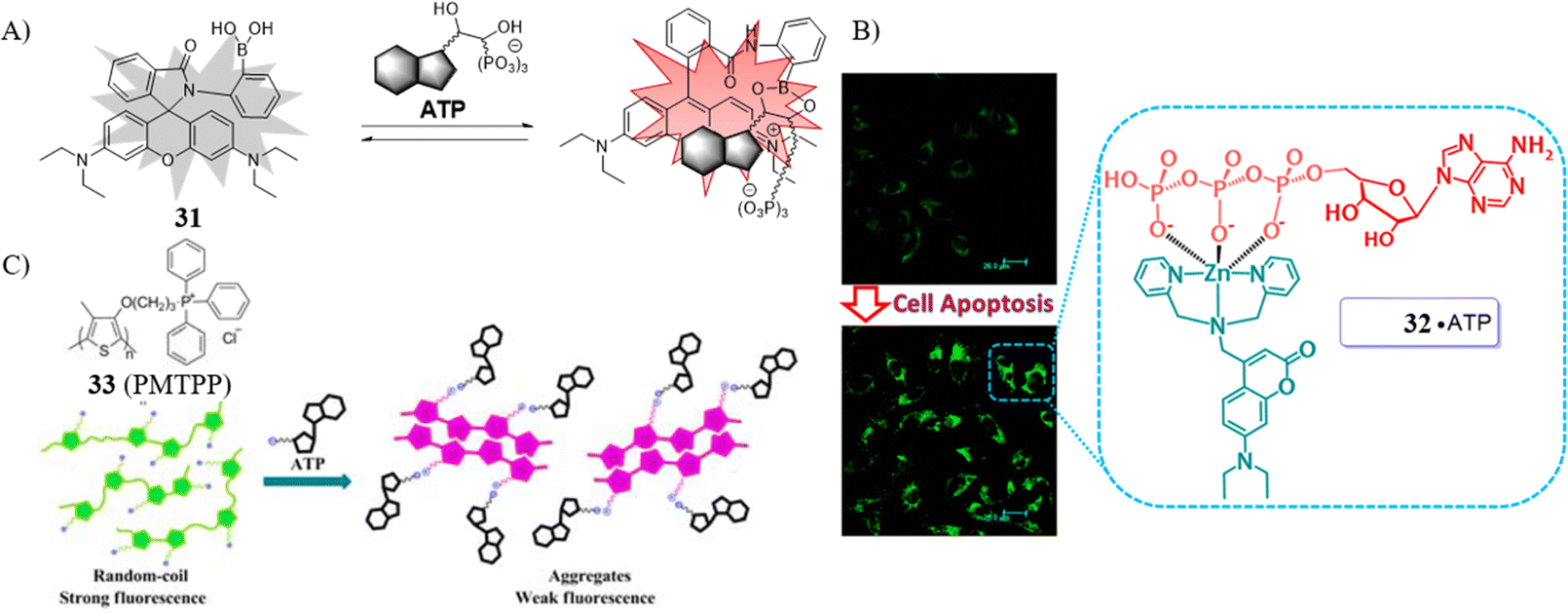
图 17 (A) 探针31的结构和拟议的感应 ATP 的机制; (B) 探针32的结构和提议的感应 ATP 的机制; (C)探针33的结构以及所提出的感应ATP的机制。
硫醇-二硫化物交换(TDE)作为潜在的关键机制,其还原生物硫醇的过程与病毒感染及肿瘤细胞增殖紧密关联,主要是因为TDE在调控细胞膜功能上扮演着重要角色。通过对TDE活性的成像分析,可以揭示细胞膜状态及细胞凋亡进程。尽管如此,利用SMFPs来检测TDE活性的研究相对较少,这一领域值得进一步探索和关注。
Collot研究小组介绍了一种基于FRET效应的比率型荧光探针34,该探针能有效监测细胞凋亡阶段的TDE活性。此探针结构包含四个关键部分:(i) 以BODIPY染料作为供体的荧光单元;(ii) 以罗丹明B染料作为受体的荧光单元;(iii) 一个二硫键,作为TDE反应的敏感位点,可在TDE过程中断裂;(iv) 两个两亲性齐聚物锚,这些锚定结构与BODIPY单元连接,确保探针能够靶向细胞膜。
在水溶液中,由于聚集导致的猝灭(ACQ)效应,探针几乎不发出荧光。然而,当探针嵌入细胞膜后,高效的FRET过程使得红色荧光发射显著增强。在细胞膜模型中,FRET过程被抑制,转而产生清晰的绿色荧光信号。借助探针34,研究人员能够通过比率信号的变化观测到细胞凋亡或过氧化氢刺激下TDE活性的提升。
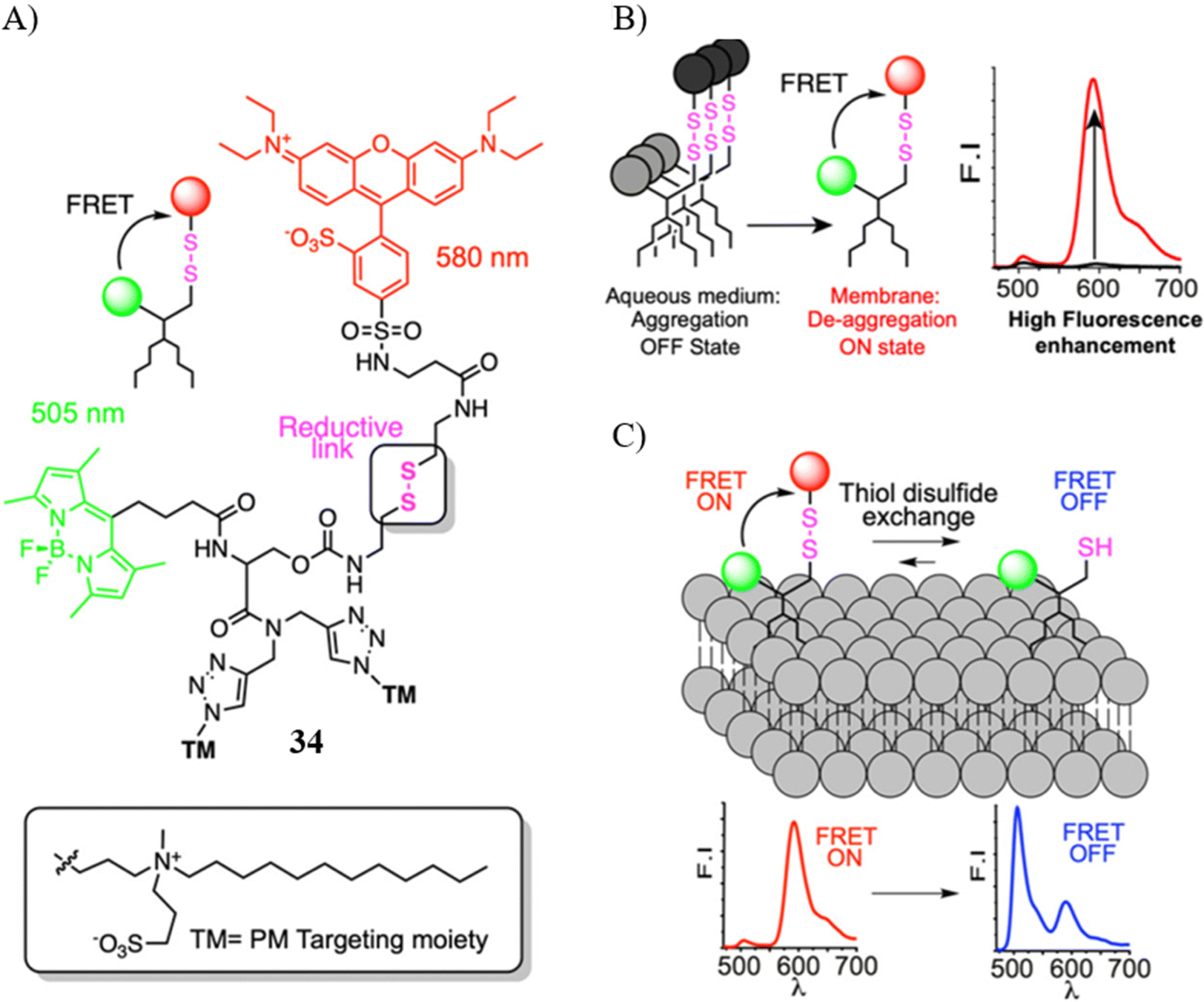
图 18 (A) 探针 34 的化学结构; (B) 探针34的拟议机制; (C) 探针34的 FRET 信号
3.3. 用于感知细胞凋亡过程中形态变化的 SMFPs
细胞颗粒的稳定形态作为细胞健康状态的直观指标,在诸如内吞作用、外排作用及信号传导等生理过程中扮演着重要角色。然而,在药物诱导的细胞凋亡进程中,细胞颗粒的形态将经历显著变化。因此,能够感知并监测这些形态学变化的工具,对于评估细胞凋亡的程度具有至关重要的意义。
Xiao研究团队报道了一款创新的双极性荧光探针35,该探针融合了亲脂性的BODIPY-咔唑染料与亲水性的季铵盐基团,展现出优异的光稳定性、较大的双光子吸收截面以及长波长荧光特性。尤为关键的是,探针35能够稳定地嵌入细胞质膜,并持续监测细胞凋亡进程,其在膜上的保留时间超过30分钟。在探针35的辅助下,研究者观察到MCF-7细胞在遭受重金属毒害或药物作用后,其质膜形态发生了显著变化。作为区分不同细胞损伤类型的有效指标,探针35能够展现出多样化的响应特征。例如,当MCF-7细胞暴露于地塞米松环境中时,其质膜呈现出不规则的波浪状形态。因此,探针35提供了一种可靠的荧光传感手段,能够长时间追踪细胞凋亡过程中质膜形态的动态变化。
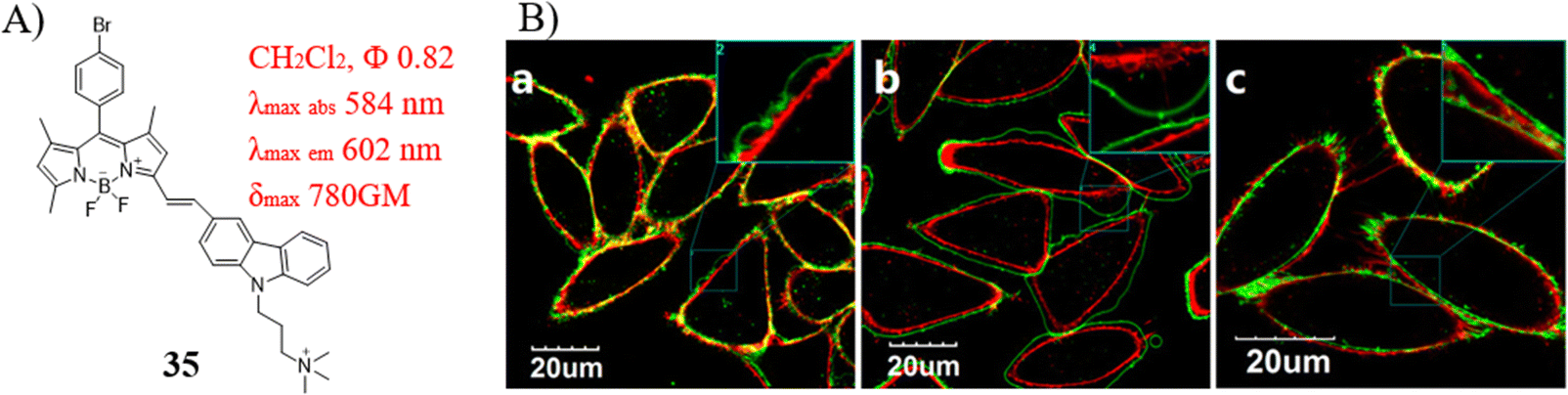
图 19 (A) 探针 35 的结构; (B) 不同条件下细胞被35染色后的荧光图像。
Tong团队设计了一款独特的双色AIE荧光探针36,该探针具备两亲性与正电荷特性,能够通过扭曲内电荷转移(TICT)效应,同时对同一细胞的细胞膜和线粒体进行成像分析。探针36由四个关键功能单元构成:(i) 季铵盐作为亲水头部;(ii) 吡啶鎓盐作为电子受体;(iii) 三苯胺作为电子供体;(iv) 长烷基链作为疏水尾部。
作为一款双色传感器,探针36在线粒体中因正电荷与AIE效应而发出明亮的黄色荧光,同时,在细胞膜中由于两亲性相互作用与分子旋转受限,展现出红色荧光。值得一提的是,该探针成功应用于监测活性氧(ROS)诱导细胞凋亡过程中线粒体与细胞膜的同步变化。当向用探针标记的HeLa细胞加入过氧化氢(H2O2,5 mM)后,观察到线粒体中的黄色信号基本保持稳定,而细胞膜中的红色信号却逐渐减弱,并在30分钟内几乎完全消失。这一结果有力地表明,在ROS诱导的细胞凋亡进程中,细胞膜的快速破坏先于线粒体损伤,揭示了细胞凋亡机制的初始阶段特征。
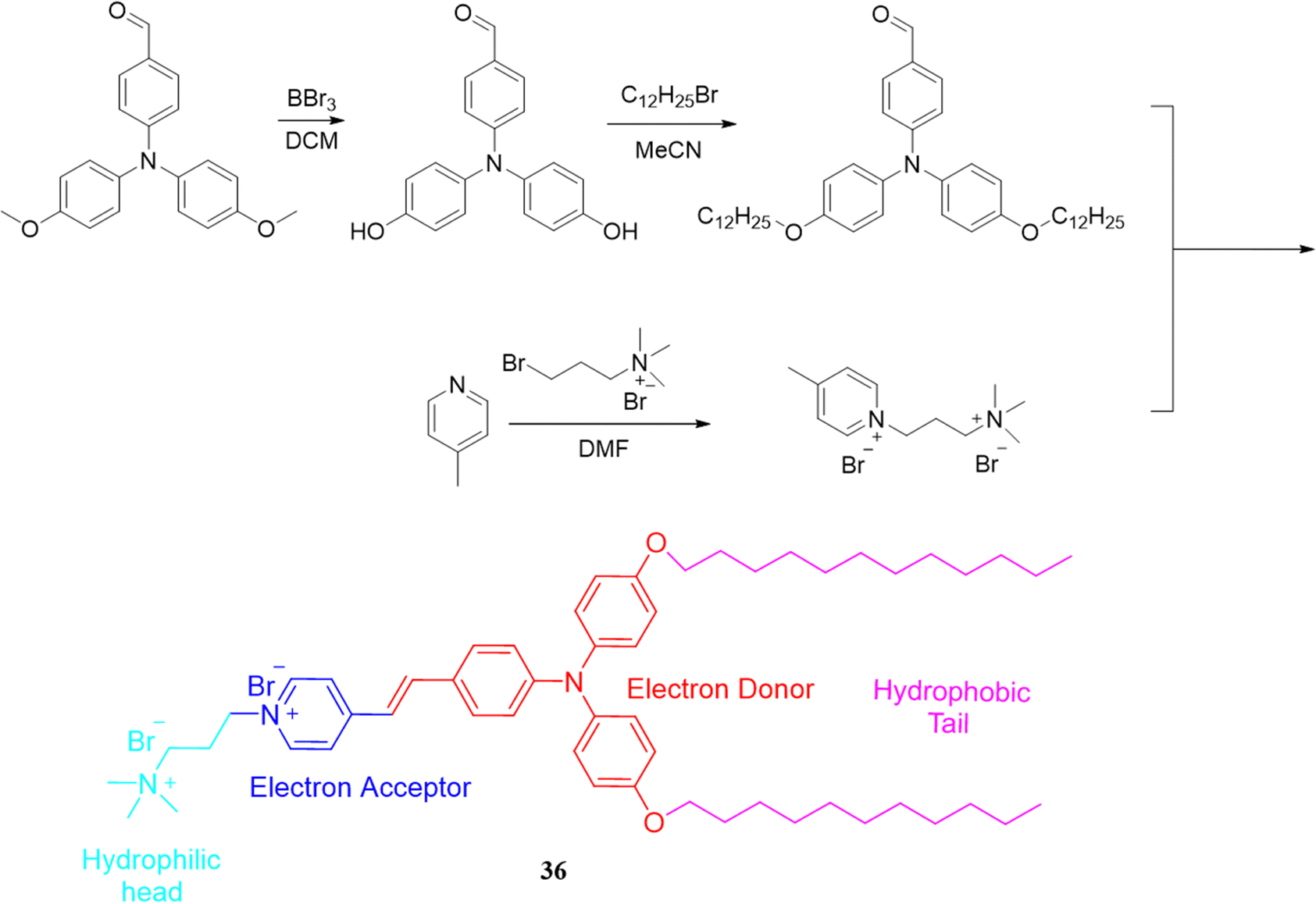
图 20 探针合成路线 36.
3.4. 用于感知细胞凋亡过程中膜电位的 SMFPs
线粒体在细胞呼吸作用中的克雷布斯循环中扮演着核心角色,通过将内膜产生的能量转化为电化学势能,驱动质子和离子的不对称分布,进而形成线粒体膜电位(MMP,ΔΨm)。这一电位梯度在众多生命活动中起着至关重要的作用,而其下降被认为是细胞凋亡早期的标志性事件。
Lin研究团队报道了三种荧光探针37、38和39,用于监测ΔΨm的动态变化。这些探针能够在细胞内实现线粒体与核仁之间的迁移。在200 nM浓度下,经过15分钟的孵育,探针产生了高品质的荧光信号。值得注意的是,探针39倾向于靶向具有较高ΔΨm值的线粒体,但随着ΔΨm值的下降,会移位至核仁。在过氧化氢(H2O2)处理后,由于ΔΨm值的降低,原本定位在线粒体的荧光信号逐渐向核仁转移。此外,探针39也被用于监测秋水仙碱、紫杉醇、紫外线照射以及鱼藤酮诱导的细胞中ΔΨm值的波动。
同样地,Yu团队开发了一款荧光探针40,用于追踪细胞凋亡进程中ΔΨm值的改变,该探针具有出色的光稳定性和显著的斯托克斯位移。实验结果显示,加入H2O2或顺铂后,由于ΔΨm值的下降,原本在线粒体的荧光信号逐渐迁移到核小体中。由此可见,探针40作为细胞凋亡研究中检测细胞状态变化的潜在传感器,展现出巨大应用前景。
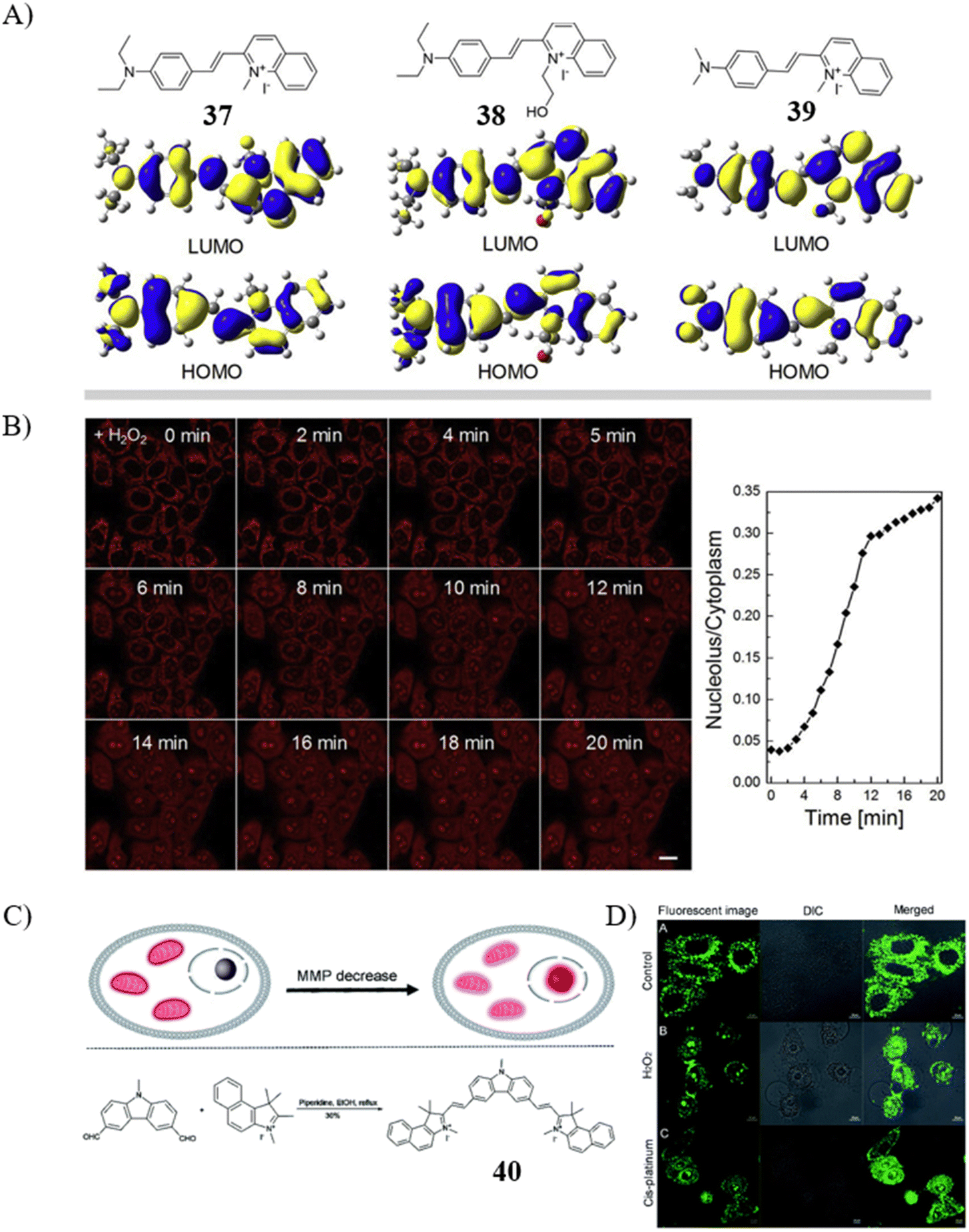
图 21 (A) 探针 37、38、39 的结构和前沿轨道; (B) 探针39与 H2O2 的荧光图像。 (C) 探针40的传感机制; (D) HeLa 细胞在无试剂、H2O2 和顺铂预处理下的荧光图像。
Wang团队报道了一款基于AIE与ICT效应的亲脂性阳离子荧光探针41,用于实现对线粒体膜电位(ΔΨm)的成像。由于ΔΨm呈负值,探针41特异地在负电位的线粒体内膜表面聚集,这一特性有效地避免了非特异性信号的干扰,确保了检测的准确性。此外,该探针还具备对粘度的敏感响应、优秀的光稳定性、显著的斯托克斯位移(大于200nm)以及近红外发射特性(约675nm),这些优势使其在活体系统中能够实时监测ΔΨm值的动态变化。
实验结果显示,在10 μM浓度的CCCP处理45分钟后,由于线粒体膜去极化,探针41的荧光强度显著下降。而在寡霉素诱导下,荧光强度则逐渐恢复,整个过程持续约8分钟。此外,探针41在多种模型中均成功检测到了ΔΨm的下降,验证了其在细胞凋亡及线粒体功能研究中的实用性与可靠性。
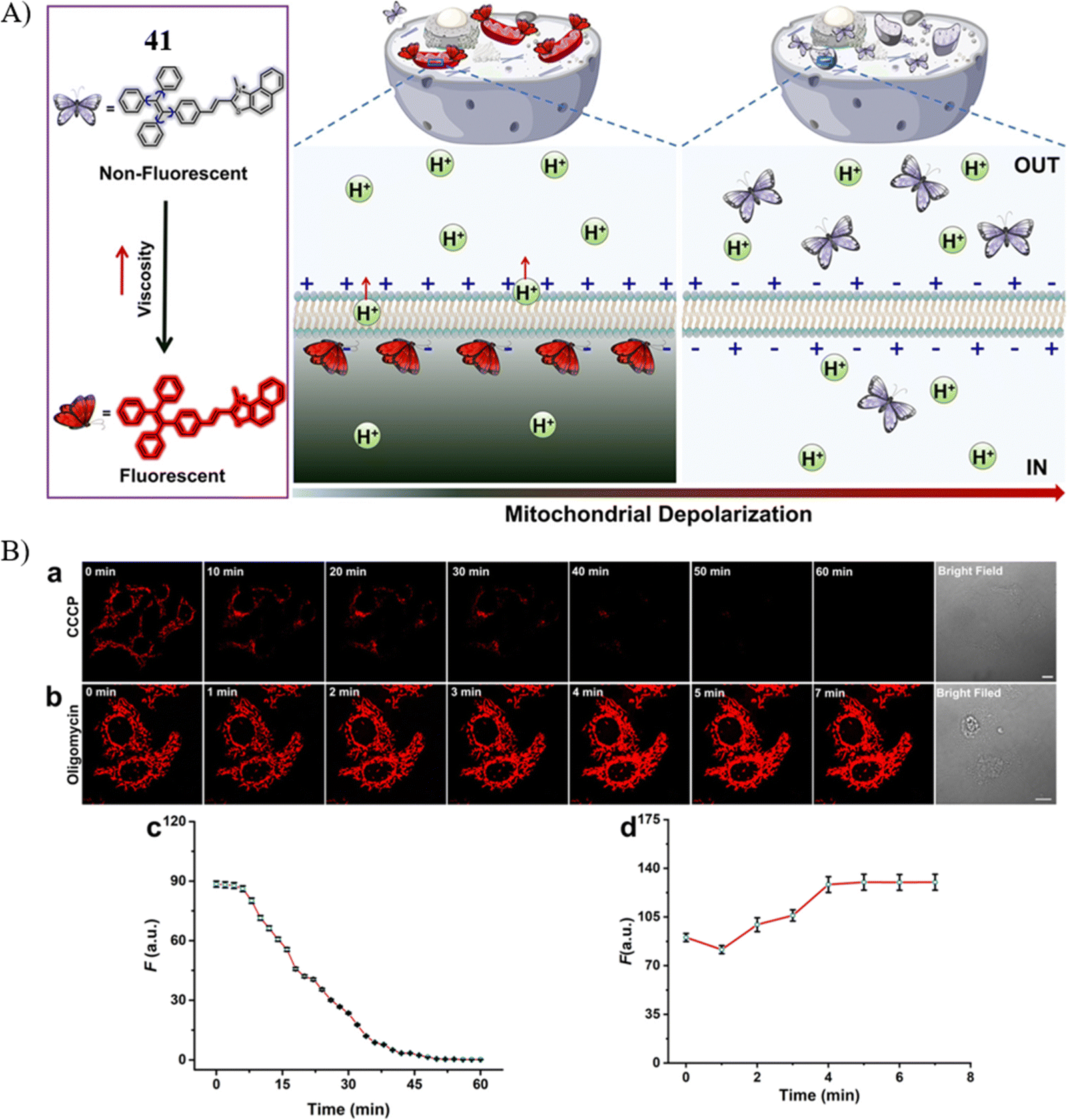
图 22 (A) 探针 41 的结构和示意图; (B) 探针41与 CCCP 的共聚焦荧光成像。
近期,Tian研究团队报道了两款双色荧光探针42和43,这两款探针基于亚细胞器迁移与极性敏感机制,旨在用于监测线粒体膜电位(ΔΨm)。探针42能够特异性地定位至线粒体,得益于线粒体内膜的低极性环境,同时展现出蓝色与红色的双色荧光信号。然而,探针43由于在细胞内产生的荧光信号过于微弱,无法有效用于活细胞中ΔΨm的检测。
探针42的独特之处在于,当ΔΨm值下降时,它可以从线粒体迁移至RNA丰富的区域,此时蓝色荧光强度减弱,而红色荧光强度增强。这一变化源于RNA较高的极性,限制了分子内的旋转自由度,从而影响了荧光信号的色彩平衡。更重要的是,探针42已成功应用于监测由氧化损伤及鱼藤酮、秋水仙碱和紫杉醇诱导的细胞凋亡过程中ΔΨm的动态变化,彰显了其在细胞凋亡研究中的实用价值。
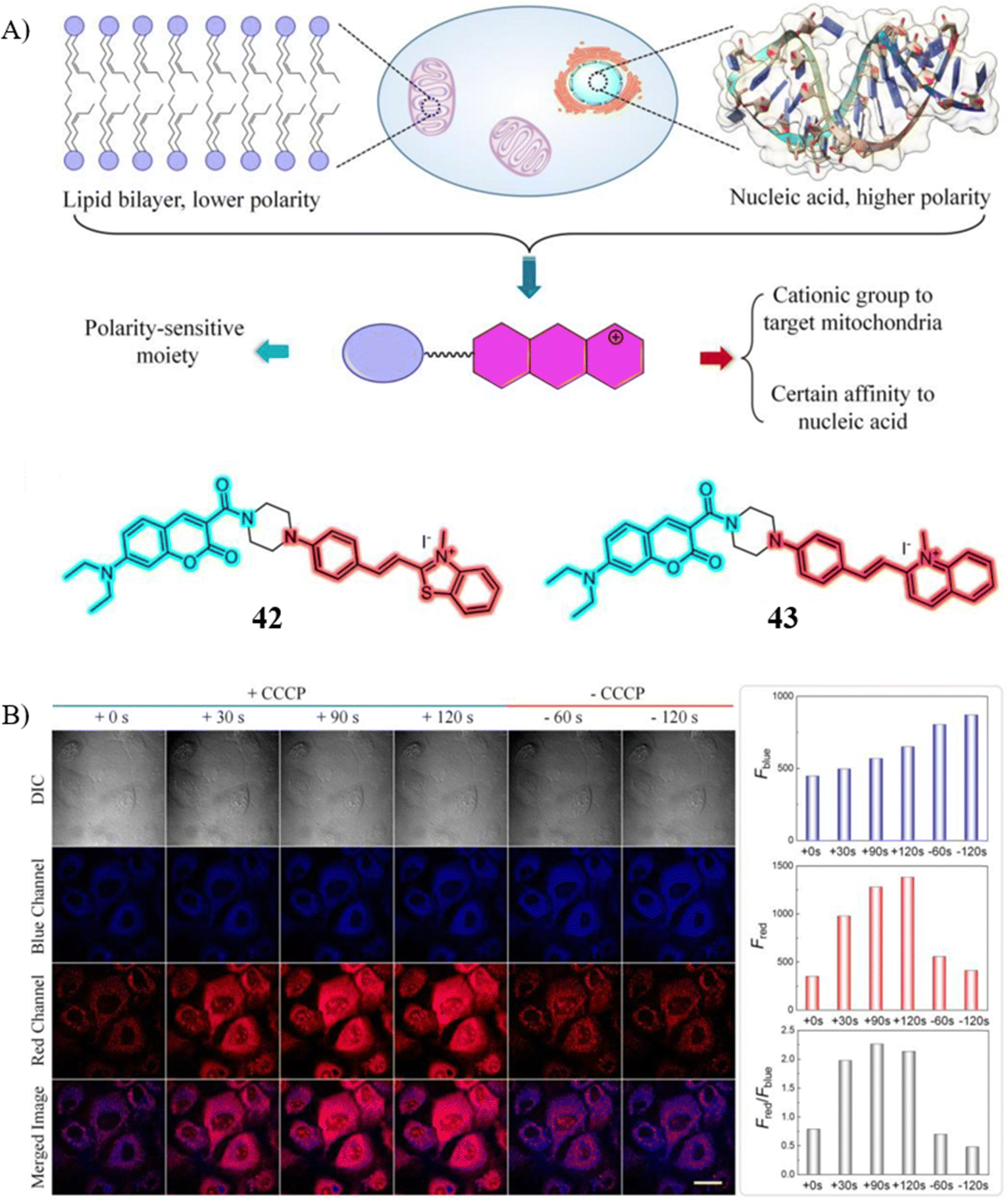
图 23 (A) 探针42和探针43的结构示意图; (B) 不同时间后探针 42 与 CCCP 的荧光图像。
4. 用于观察细胞凋亡过程中活性氧(ROS)的 SMFPs
活性氧物种(ROS),涵盖过氧化氢(H2O2)、超氧阴离子自由基(O2·-)、羟自由基(·OH)、次氯酸/次氯酸盐(HOCl/ClO-))以及过氧亚硝酸盐(ONOO-))等,它们在生理与病理信号转导过程中扮演着关键角色。早期的研究揭示,ROS能够对蛋白质、脂质和核酸等生物大分子造成损害,进而诱发细胞凋亡。鉴于此,开发能够特异性响应特定ROS的高效荧光探针,对于深入探究细胞凋亡机制而言,显得尤为重要且有益。
4.1. 用于观察细胞凋亡过程中次氯酸(HClO)的 SMFPs
次氯酸(HClO)作为生物体内活性氧物种(ROS)的关键成员,其生成源自免疫细胞中髓过氧化物酶(MPO)催化下过氧化氢(H2O2)与氯离子(Cl-)的反应。正常水平的HClO对维护氧化还原稳态至关重要,而其浓度失衡则关联至组织损害及多种病症,包括心血管疾病、炎症相关疾病乃至肿瘤发展。鉴于此,深入探究HClO在细胞凋亡进程中确切功能显得尤为必要。
Ye团队开发了一款基于喹啉-丙二腈荧光团与二甲基硫代氨基甲酸乙酯(DMTC)相结合的AIE(聚集诱导发光)细胞凋亡传感器44,具备实时追踪HClO的能力。该传感器展现出低检出限(30.8 nM)、显著的斯托克斯位移(190 nm)及宽pH范围内的稳定性,这些特性确保了它在复杂生理环境中监测HClO的适用性。实验显示,随着CCCP浓度提升,红色荧光强度随之增强,这直接反映了传感器监测细胞凋亡进程的效能。
另据报道,Lv的研究团队构建了一种即时响应型荧光探针45,能够在一分钟内特异地检测HeLa细胞中的外源性ClO-及RAW 264.7细胞内的内源性HClO。这一探针不仅提供了高灵敏度与选择性,还预示着一个潜力巨大的平台,可用于流式细胞仪中精确测定HClO,从而增进对炎症反应与细胞凋亡机理的理解。
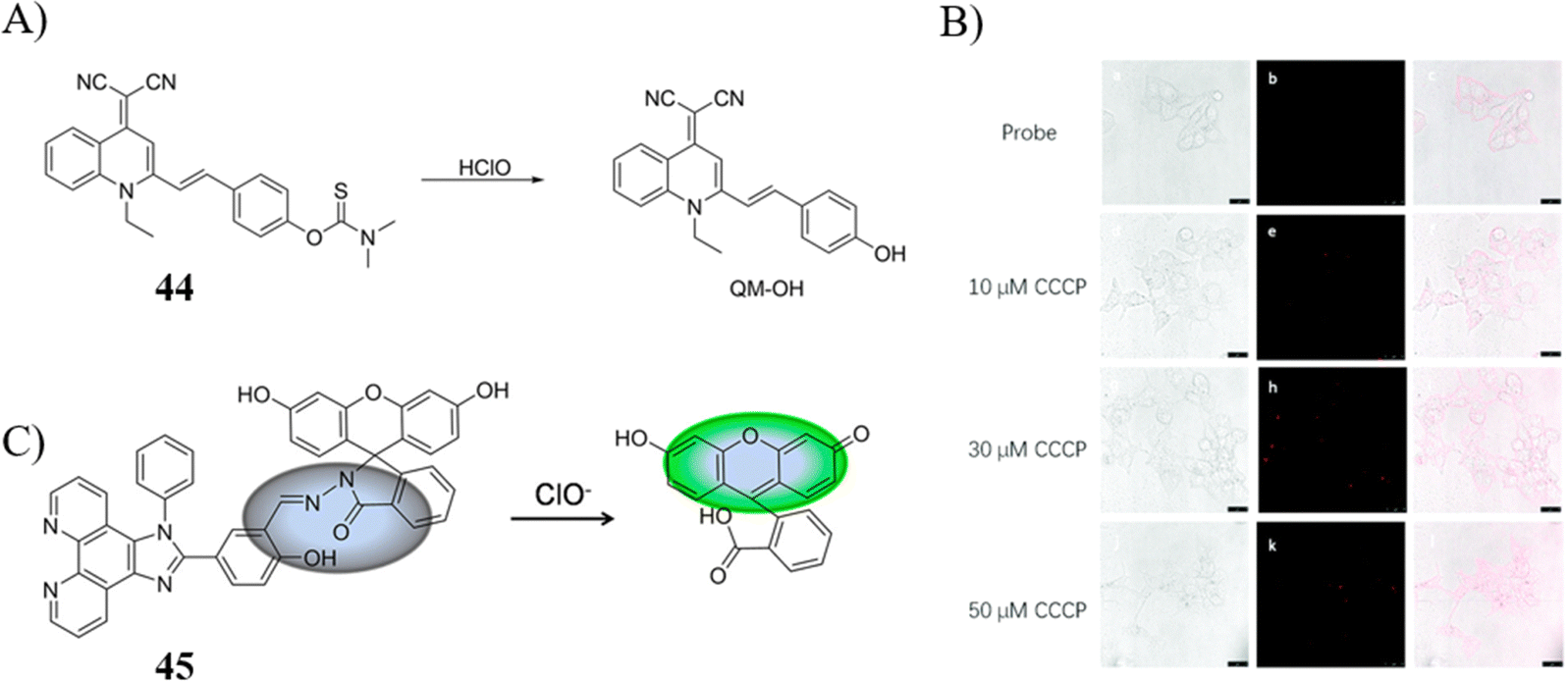
图 24 (A) 探针 44 的结构和检测 HClO 的机制; (B) 不同浓度 CCCP 的 CLSM 图像。 (C) 探针 45 的结构和检测 HClO 的机制。
4.2. 用于观察细胞凋亡过程中过氧化氢(H2O2)的 SMFPs
作为活性氧物种(ROS)中的关键指标,过氧化氢(H2O2)因普遍对多类细胞展现细胞毒性,常被采纳为诱导细胞凋亡的试剂。鉴于其在细胞死亡模式,诸如铁凋亡和热诱导凋亡中的检测应用,诸多H2O2响应性探针已被开发。值得注意的是,H2O2亦被视为启动细胞凋亡的早期重要信号。因此,对比分析这些探针的特性对于深化理解凋亡机制颇具价值。
Tang的科研团队推出了两款创新的、定位特定细胞器的SMFP探针——46与47,能够独立或同步追踪细胞凋亡进程中线粒体与内质网(ER)内H2O2浓度的动态变化。其中,46作为线粒体靶向探针,在555nm处的荧光发射峰值显著提升,量子产率由0.0087跃升至0.11,且检出限低至80 nM。而47,专为内质网设计,呈现出约100nm的红移现象,即从458nm移至558nm,并在H2O2存在下,量子产率从0.161激增至3.639,检测限为120 nM。凭借这些优异属性,两探针已成功应用于对外源与内源H2O2以及多种凋亡触发因素的实时成像。
研究发现,线粒体与内质网中的H2O2产量在与BSO共孵育后明显升高。然而,当与CCCP或鱼藤酮共同处理时,线粒体内的H2O2水平相较于内质网持续显著上升;反之,在曲古抑菌素A的作用下,内质网中H2O2的浓度较线粒体更早且更大幅度地增加。上述观察为探索不同细胞器在凋亡调控中的分子机制开辟了新的研究途径。

图 25 (A) 探针46的结构和检测 H2O2 的机制; (B) 探针47的结构和检测 H2O2 的机制; (C) 在 BSO 存在下,46 和47 在不同时间的共聚焦荧光图像。
5. 用于观察细胞凋亡过程中活性硫物种(RSS)的 SMFPs
RSS,如二氧化硫(SO2)、硫化氢(H2S)、Cys 和 GSH,是维持生理平衡的重要抗氧化剂和信号物质。目前认为,一些 RSS 与细胞凋亡直接相关,可视为细胞凋亡的早期标记。
5.1. 用于观察细胞凋亡过程中硫化氢(H2S)的 SMFPs
硫化氢(H2S),作为还原性硫化物(RSS)的一员,主要源自胱氨酸在胱硫醚-β-合成酶(CBS)和胱硫醚-γ-裂解酶(CSE)的催化作用下内源性合成。作为继一氧化氮(NO)和一氧化碳(CO)之后的第三种气体信号分子,H2S在生理与病理过程中扮演着关键调节者的角色。尤为引人注目的是,H2S被认为在细胞凋亡检测中扮演着重要还原剂的角色。
Liu团队设计了一款高灵敏度与高稳定性的荧光探针48,能够实现对H2S的快速检测,并通过ESIPT效应,深入探讨了H2S诱导MCF-7乳腺癌细胞凋亡的分子机制。该探针由3-羟基黄酮(3-hydroxyflavone)荧光团与NBD-Cl识别基团构成。尽管H2S水平与癌症关联性的科学界仍有争议,该团队的研究证实了H2S在MCF-7细胞中的抗肿瘤作用,即H2S水平的提升可通过p53/mTOR/STAT3信号通路诱导细胞凋亡。由此,探针48展现出作为生物系统中有效癌症筛查工具的潜力。
值得注意的是,H2S的过表达能够破坏线粒体DNA(mtDNA),而mtDNA被认为是区分健康细胞与凋亡细胞的敏感生物标记。这一发现进一步强调了H2S在细胞凋亡研究中的重要地位。

图26. (A) 探针 48 的结构及其识别H2S的机制. (B) H2S在细胞凋亡中的角色。
近期,Zhang团队研发了两款双锁荧光探针49和50,它们通过H2S反应与DNA结合被激活。双萘二甲酰亚胺作为DNA特异性结合单元,而-N3基团负责识别H2S。探针结构中,两种长度各异的二胺(分别是0碳和6碳)充当连接基团。
探针50与探针49在检测H2S(浓度≥2.7×10-2 mM)和DNA(浓度≥8.2×10-2 μg mL-1)时,展现出优秀的线性响应及高灵敏度的荧光特性,这一点与探针49(H2S≥1.9×10-2 mM,DNA≥2.2×10-2 μg mL-1)的表现一致。尤为关键的是,这些探针能够通过实时监测H2S诱导的mtDNA损伤,评估细胞凋亡进程,为细胞凋亡研究提供了即时的评价工具。
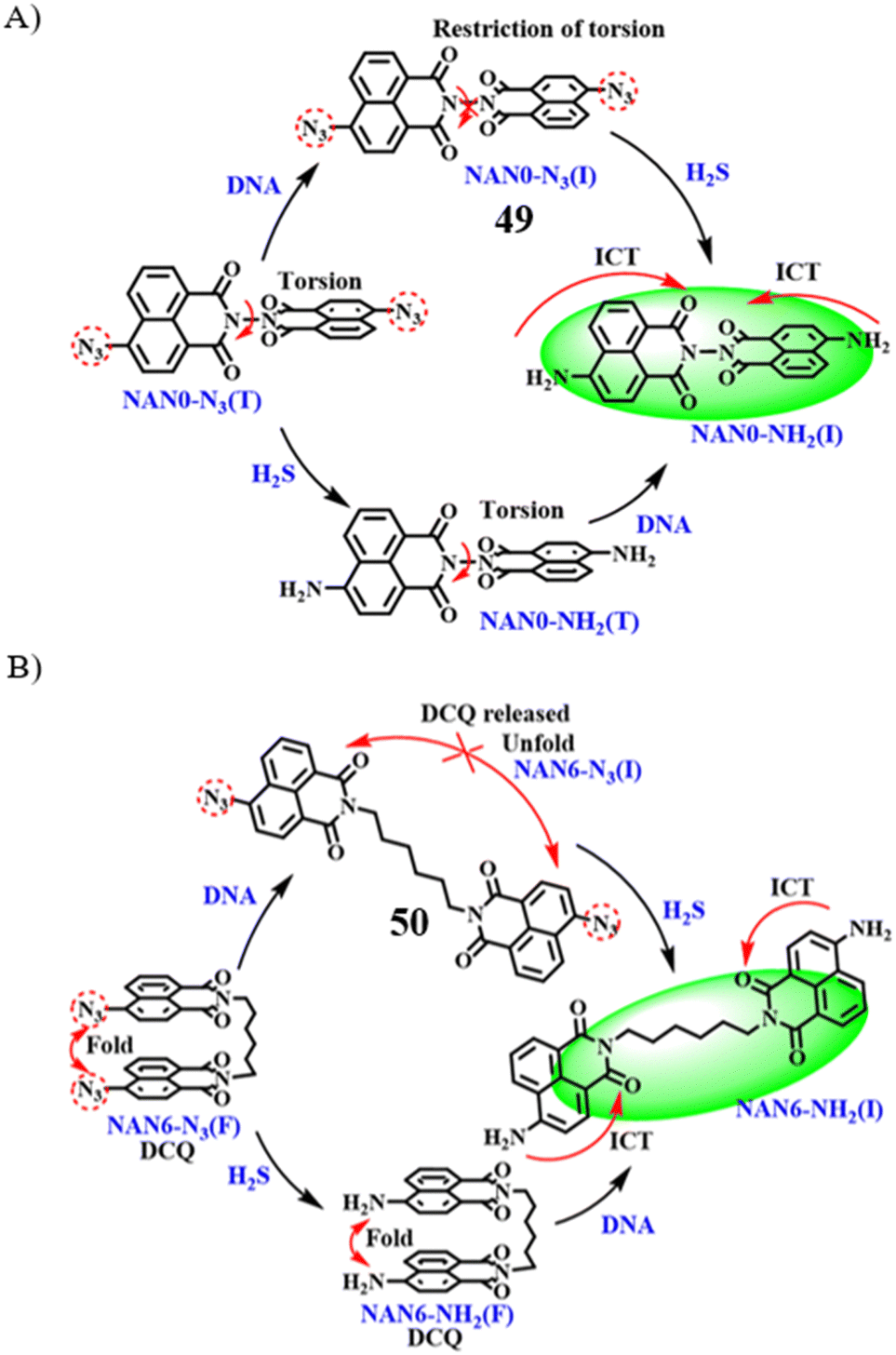
图 27 (A) 探针 49(NAN0-N3)对 H2S 和 DNA 检测的响应机制; (B) 50(NAN6-N3)对 H2S 和 DNA 的响应机制。
5.2. 用于观察细胞凋亡过程中二氧化硫(SO2)的 SMFPs
二氧化硫(SO2)主要由线粒体内的天冬氨酸氨基转移酶2(AAT-2)催化生成。近年来,越来越多的研究指出,SO2可能作为第四种气体信使,在包括细胞凋亡在内的多种生理进程中扮演重要角色。
Tang研究团队基于ICT效应,开发了一款新型荧光探针51,旨在评估SO2在线粒体特定凋亡类型中的作用与机制。探针设计中引入的醛基既作为荧光淬灭剂又充当报告基团,这一创新设计打破了传统框架,赋予探针显著的荧光信号与显著的红移特征。重要的是,探针51成功揭示了线粒体SO2在细胞凋亡中的双重效应,即通过降低线粒体膜电位调控HeLa细胞早期凋亡进程,凸显了线粒体SO2的调控作用。
近期,Lin研究小组报告了一款比率型荧光探针52,能够在细胞凋亡过程中以高信噪比(S/B)检测黏稠环境中的SO2。探针中吲哚单元的自由旋转导致微弱的蓝色信号,随后,随着SO2的释放,荧光信号恢复,因为FRET过程随着共轭结构的破坏而中断。与非黏稠环境相比,黏稠环境中的荧光信号显著增强(高达71.5倍)。值得注意的是,探针在早期凋亡细胞中的S/B比(51.2倍)远高于晚期凋亡细胞(37.1倍),表明其在线粒体中累积。这项研究的设计策略不仅证实了SO2作为细胞凋亡过程中的关键生物标志物的地位,同时也推动了高S/B比比率荧光探针的进一步发展。
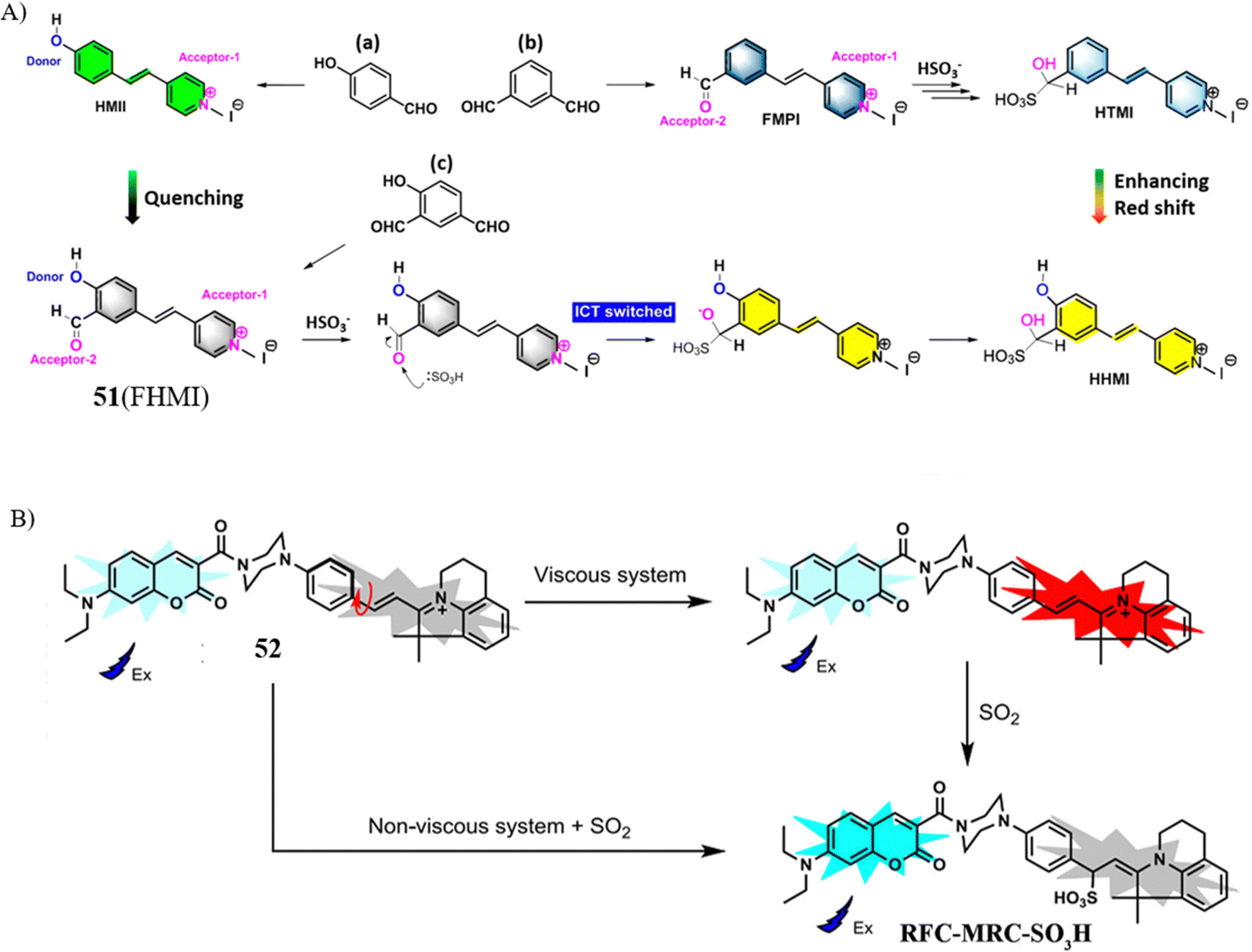
图 28 (A) 探针 51(FHMI)的拟议响应机制; (B) 建议的探针52的响应机制。
5.3. 用于观察细胞凋亡过程中生物硫醇的 SMFPs
多项研究确认,生物硫醇,如半胱氨酸(Cys)、谷胱甘肽(GSH)和同型半胱氨酸(Hcy),在解毒、新陈代谢、细胞信号传导及蛋白质与肽链合成等关键生理进程中扮演核心角色。这些分子还对维护生物体内的氮平衡和氧化还原稳态至关重要,从而确立了它们作为监测细胞凋亡状态的生物标志物的地位。
Meng的研究团队利用二维ICT体系,构建了一款具备双通道的TP荧光探针53,能够实现实时监测线粒体凋亡初期的Cys浓度变化。动力学测试表明,探针与Cys的反应速率(15分钟)远超于与Hcy的反应速率(180分钟),并且展现出更大的发射位移(119nm)。相比之下,使用一维ICT体系的Mito-SCHO探针则无法有效区分Cys与Hcy。该探针因其高特异性、稳定的pH响应和低至111纳摩尔的检测限,使其在生理环境下对Cys进行成像成为可能。
尤其值得一提的是,对脂多糖(LPS)诱发的HeLa细胞凋亡过程中实施的双色成像分析显示,随着LPS作用时间的延长,绿色荧光强度逐渐升高,同时蓝色荧光强度相应下降,这与细胞凋亡率从最初的0.15%在2.5小时内稳步增长至14.04%的趋势一致。这一发现无疑提供了精确且成本效益高的手段,用于实时评估细胞早期凋亡状态。对溶酶体中Cys含量在细胞凋亡期间的动态监测,将有助于深入理解Cys在此过程中的独特功能。
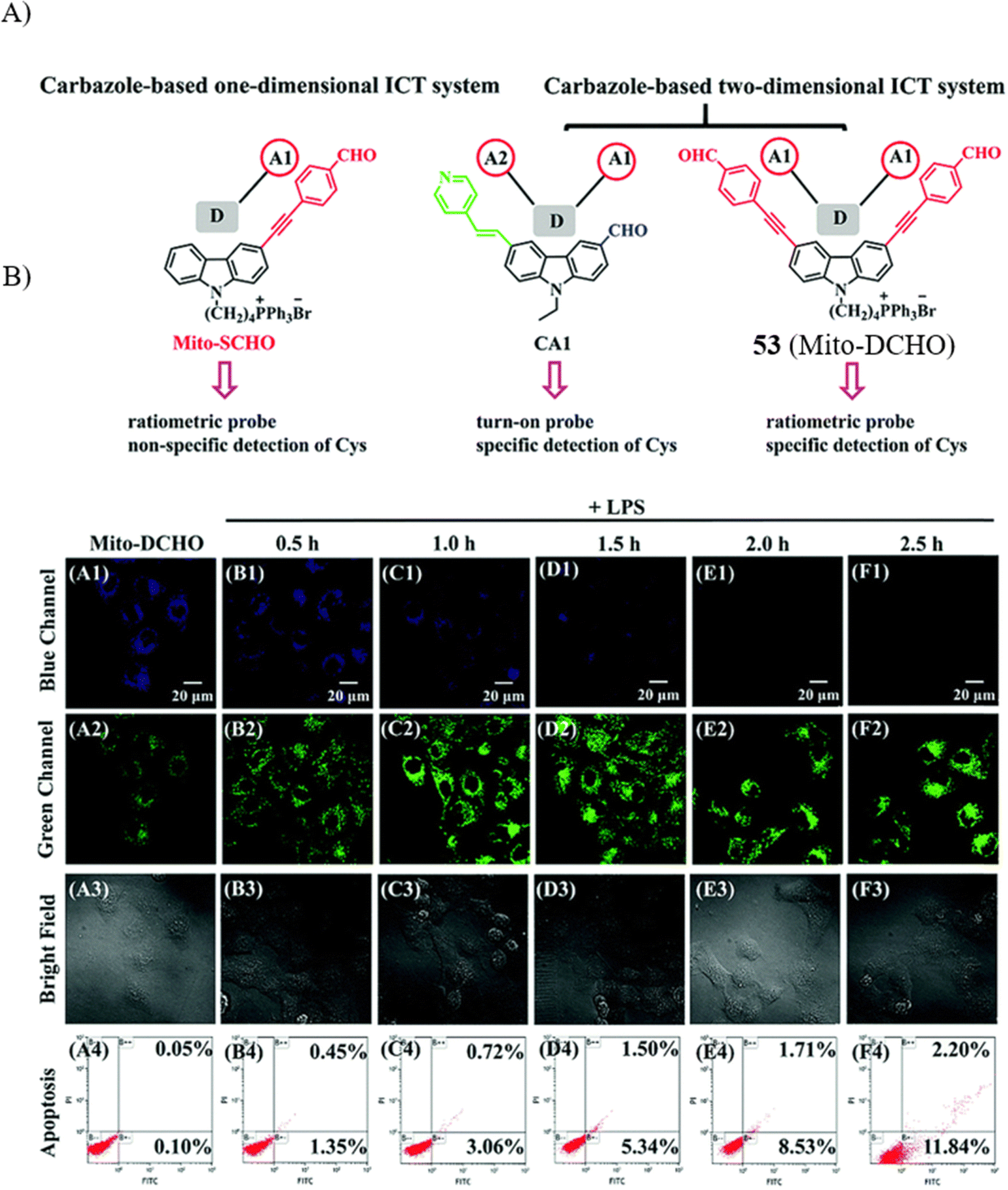
图 29 (A)探针 53(Mito-DCHO)的图解; (B) 使用探针 53对细胞凋亡进行双色实时成像。
近期,Yi研究团队选取α,β-不饱和酮作为Cys(半胱氨酸)的反应基团,并融入了溶酶体靶向分子,设计出一款新型荧光探针54。该探针在pH值为5.0的酸性环境下,能在一小时内对Cys展现出高选择性反应,检测限低至1.2μM。后续实验中,他们利用该探针探究了地塞米松诱导细胞凋亡进程中溶酶体Cys水平的动态变化。
通过荧光共聚焦显微成像技术,研究者们观察到,在地塞米松作用下40分钟后,装载有探针与溶酶体追踪红染料的A549细胞体积显著缩小,这一现象直观地反映了细胞正在经历凋亡过程。值得注意的是,由于探针的光漂白效应,地塞米松处理组与对照组的绿色荧光信号同时减弱,这提示地塞米松诱导的细胞凋亡与溶酶体Cys水平之间可能不存在直接关联。此外,探针54还成功实现了对活体斑马鱼体内内外源性Cys的精准成像,进一步验证了其在生物体内应用的潜力与价值。
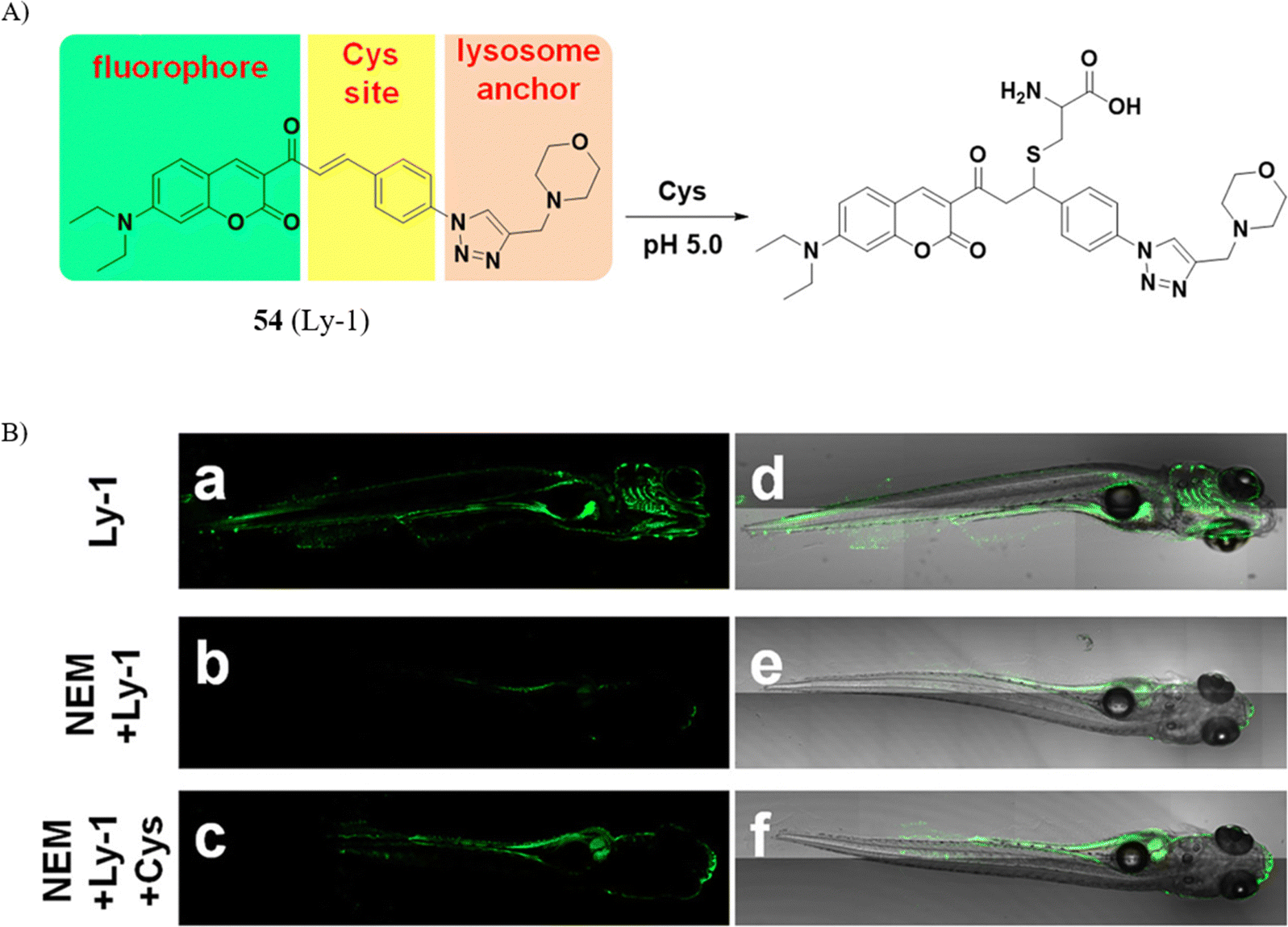
图 30 (A) 探针 54(Ly-1)的结构和 Cys 检测机制; (B) 54在斑马鱼体内的共聚焦荧光图像。
Jiang研究团队开发了一款基于FRET机制的高特异性荧光探针55,用于精准捕捉细胞凋亡早期阶段中谷胱甘肽(GSH)的微小波动。探针设计中巧妙地融合了两个特定荧光团,它们通过磺酰胺基团相连,分别扮演能量供体与受体的角色,能够通过双荧光通道实时监测GSH水平的变化。
在与GSH共同孵育后,探针在520nm和592nm波长处分别产生差异化的荧光信号,从而实现了对GSH微量波动的比率式检测。尤为突出的是,该探针的检测下限(LOD)仅为2.02纳摩尔每升(nM),远低于生物系统中内源性GSH浓度的千分之一比例。此外,探针的对数P值适中,确保了其能够特异性地定位至线粒体。
更重要的是,通过共聚焦显微镜成像技术,研究者发现探针在HepG 2、MCF-7和HeLa等癌细胞系中展现出卓越的GSH识别性能,而这一表现显著优于在正常CHO和NIH3T3细胞中的检测效果。这一突破性进展标志着探针55首次实现了对癌细胞凋亡进程中GSH超微量变化的精准监测,为深入了解细胞凋亡机制及癌症生物学研究提供了有力工具。
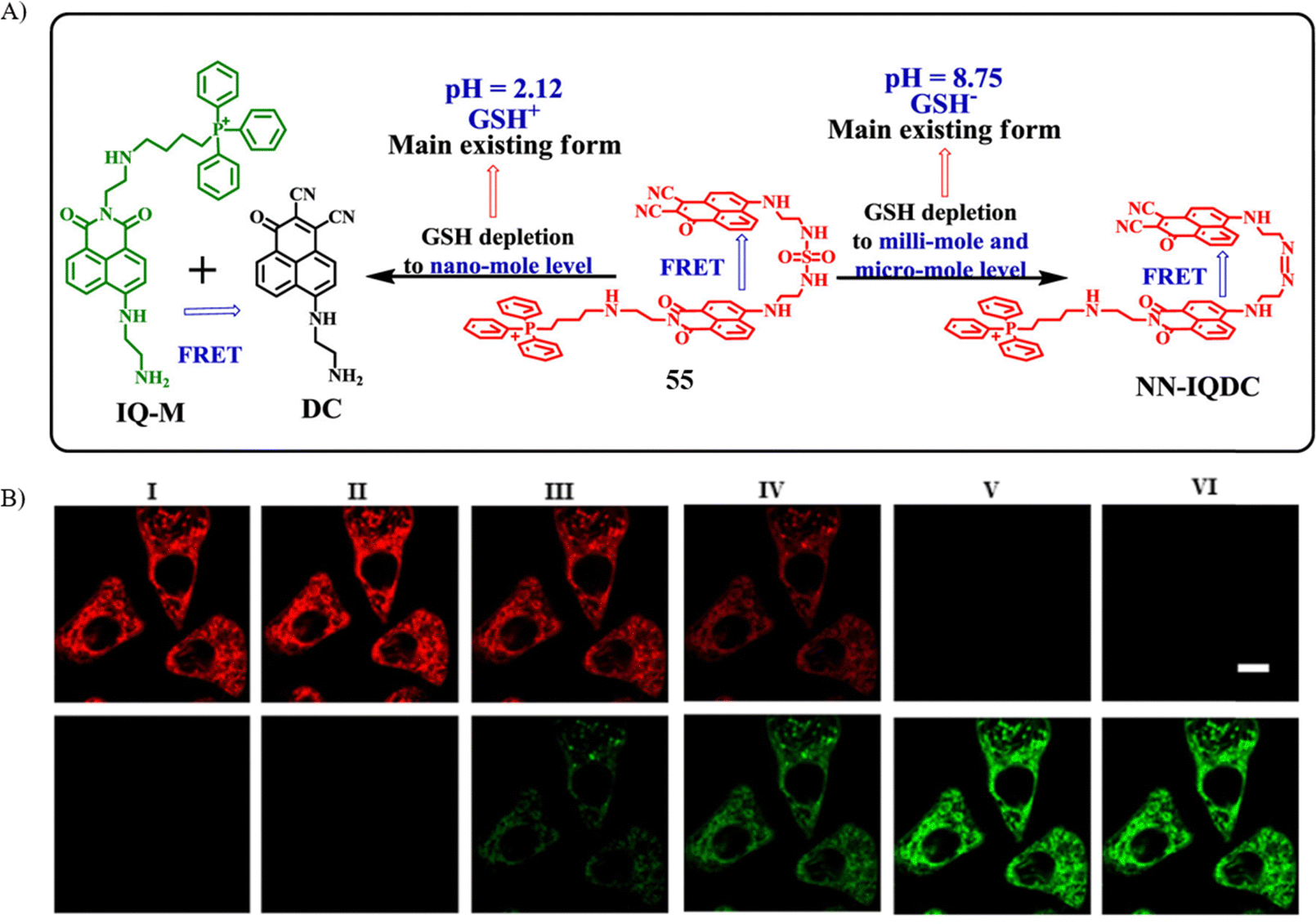
图 31 (A) 探针55对 GSH 的结构和识别机制; (B) 探针55在活细胞中的识别过程。
考虑到同型半胱氨酸(Hcy)在生物体内的含量相对较低,且其结构与半胱氨酸(Cys)极为相似,目前市面上缺乏能够特异且灵敏地在生理条件下检测Hcy的优质SMFPs。近期,Tian研究团队设计了一款基于新型BODIPY荧光团的比率型荧光探针56,该探针能够在短短50秒内精准区分活体神经元中的Hcy与Cys以及谷胱甘肽(GSH)。
根据密度泛函理论(DFT)计算结果,在反应初始阶段,Hcy的反应能垒(40.93 eV)明显低于Cys(45.34 eV),这表明Hcy与探针的反应更加容易发生。依托这一特性,探针56被成功应用于实时追踪在淀粉样蛋白-β(Aβ)肽聚集或缺血治疗情景下Hcy浓度的动态变化。实验数据揭示,高水平的Hcy在神经元凋亡进程中扮演着关键角色,这是首次直接实验证据,证明了Hcy代谢在阿尔茨海默病和缺血性脑卒中的脑神经元损伤中具有重要影响。这一发现为理解相关疾病机制提供了新的视角,并为潜在的治疗策略奠定了基础。
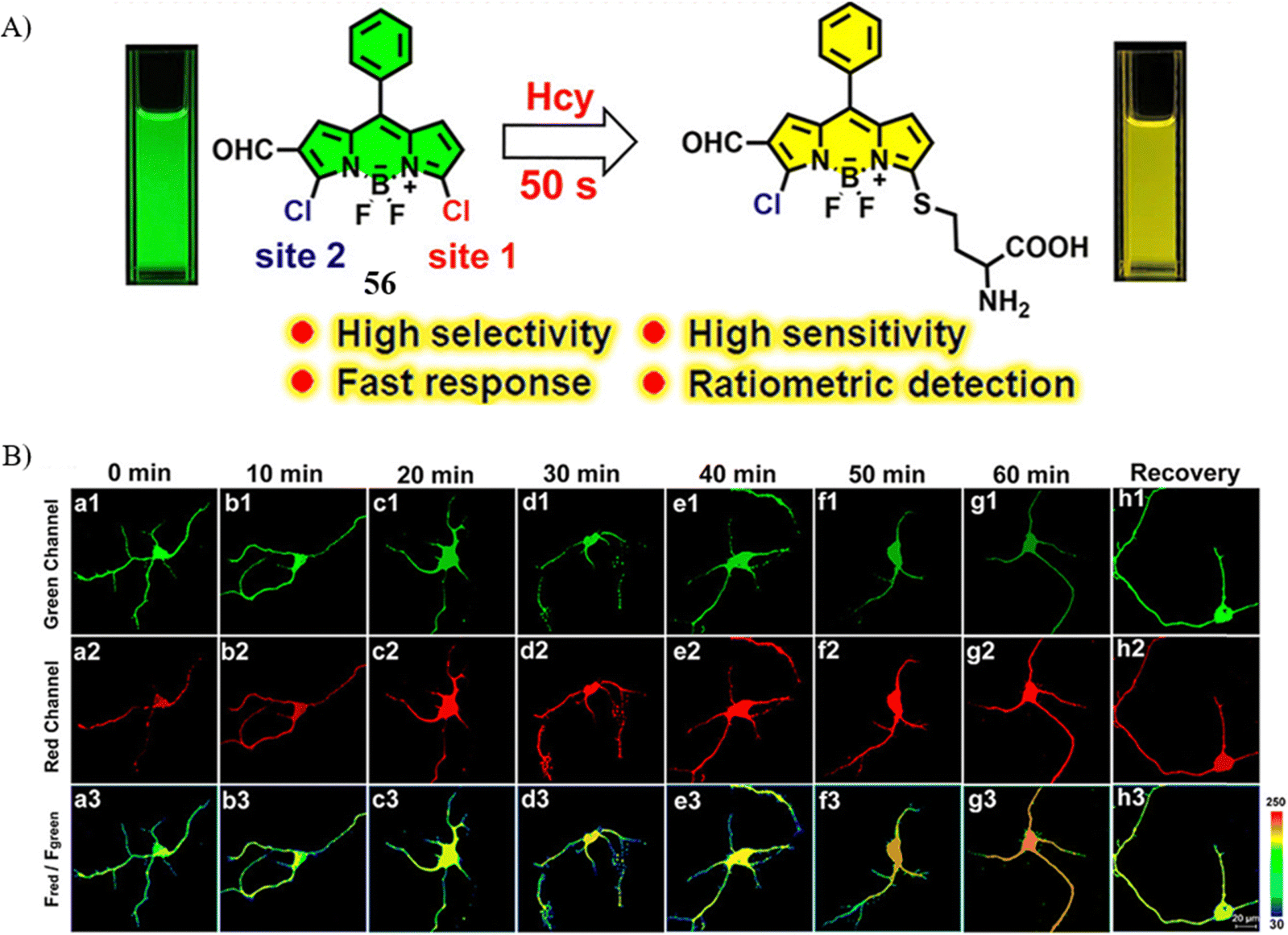
图 32 (A) 探针 56对 Hcy 的结构和作用机制; (B) 不同时间的共聚焦荧光图像。
6. 用于描述细胞凋亡过程中病理生理微环境特征的 SMFPs
不可否认,病理生理微环境(极性、粘度、pH 值等)与蛋白质表达、信号转导和细胞增殖等各种生物过程的调控密切相关。大量研究表明,许多疾病的发生与病理生理微环境的破坏直接相关。
6.1. 用于描述细胞凋亡过程中极性特征的 SMFPs
生物学领域中的极性概念,涉及细胞、细胞群体、组织乃至个体在特定方向上展现出的形态或生理属性差异。而在化学范畴内,极性则指代电荷的分离现象,导致分子或其组成部分形成电偶极矩。极性,作为一个错综复杂的因素,囊括了氢键形成、极化性、偶极性以及水合作用等多重非共价作用力。细胞凋亡进程中,极性的变化被视为一个显著特征,促使近年来检测细胞凋亡期间极性波动的荧光探针数量显著增长。
近期研究揭示,线粒体的极性与形态学特征可能构成识别线粒体相关细胞凋亡事件的关键生物标记。Koner研究团队设计了一系列兼具大斯托克斯位移、高量子产率以及良好pH稳定性的多功能荧光探针,适用于线粒体极性的成像,展现出在多种生化应用中的潜力。孟晓明实验室则报道了一款线粒体靶向的TP荧光探针57,该探针能够充当多功能平台,不仅用于量化检测线粒体极性的动态变化,同时还能实现对线粒体形态学转变的可视化。
探针57在THF/H2O混合溶剂中进行的光谱分析表明,随着溶剂化因子Δf由0.2556升至0.3103,探针在436nm处的荧光信号强度降至原先的约三分之一,而589nm处的信号则维持稳定。值得注意的是,特定样本的极性可通过监测荧光强度比、量子产率及寿命得以量化。显然,探针57实现了依托泊苷及H2O2诱导的线粒体相关凋亡事件的实时成像。此外,研究中还发现双过氧化氢钾(1,10-菲罗啉)能够通过线粒体途径激发细胞凋亡过程。
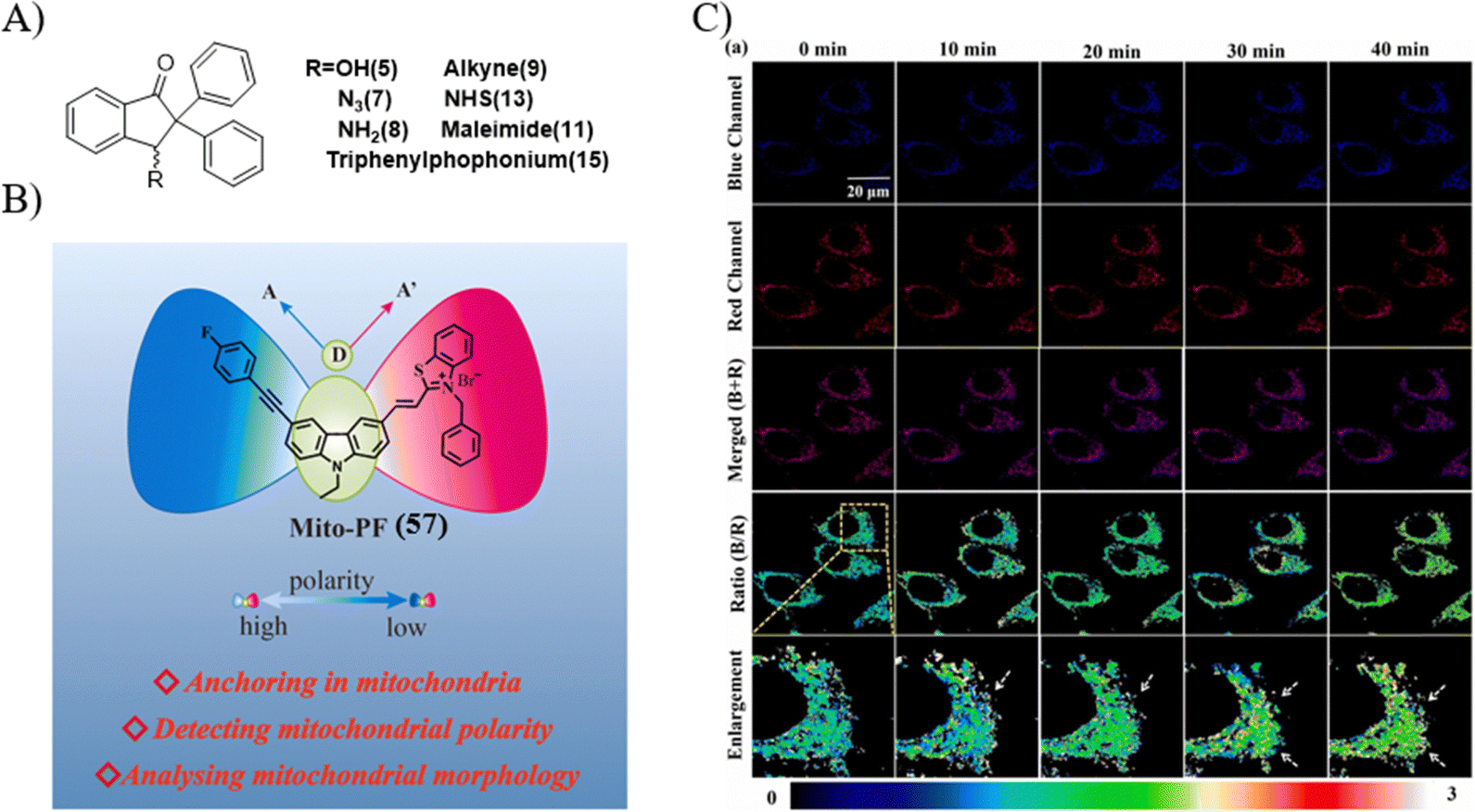
图 33 (A) 科纳研究小组设计的探针结构; (B) 57探针的设计; (C) 依托泊苷诱导 HeLa 细胞凋亡的结果。
溶酶体的极性特征在细胞层面乃至整个生物体内对底物与酶之间的相互作用产生显著影响,是细胞凋亡及死亡进程中不可忽视的关键要素之一。Zhang团队报道了一款基于分子ICT机制的比率型TP荧光探针58,用于实现溶酶体微极性的实时成像。探针58在DMSO-H2O混合溶液中进行了详细的光谱分析。从激发光谱中可以看出,随着微极性参数(Δf)从0.2230上升至0.3274,535nm处的荧光强度呈现减弱趋势,而565nm处的荧光强度则逐渐增强。与此相呼应,580nm波长的荧光发射强度逐步上升,600nm波长的荧光发射强度则递减,检测限达到最低值(Δf = 0.018)。尤为关键的是,探针58能够通过流式细胞术与显微成像技术评估HepG 2细胞的凋亡状态,为溶酶体相关细胞凋亡进程的实时监测提供了化学分析工具。
另一方面,Lin研究小组基于FRET机制设计了一款创新的荧光探针59,用于追踪细胞极性的动态变化。探针59在1,4-二氧六环-H2O混合溶液中的光谱测试表明,随着混合溶剂比例从0%变化至90%,其发射颜色明显从红色过渡至青色。引人注目的是,该探针在活细胞的溶酶体中展现出强烈的蓝色信号,而在药物诱导的细胞凋亡过程中,探针能够聚集在细胞质膜上并发出显著的红色信号,从而以双色模式检测凋亡进程。这一特性为细胞凋亡研究提供了直观且有效的监测手段。
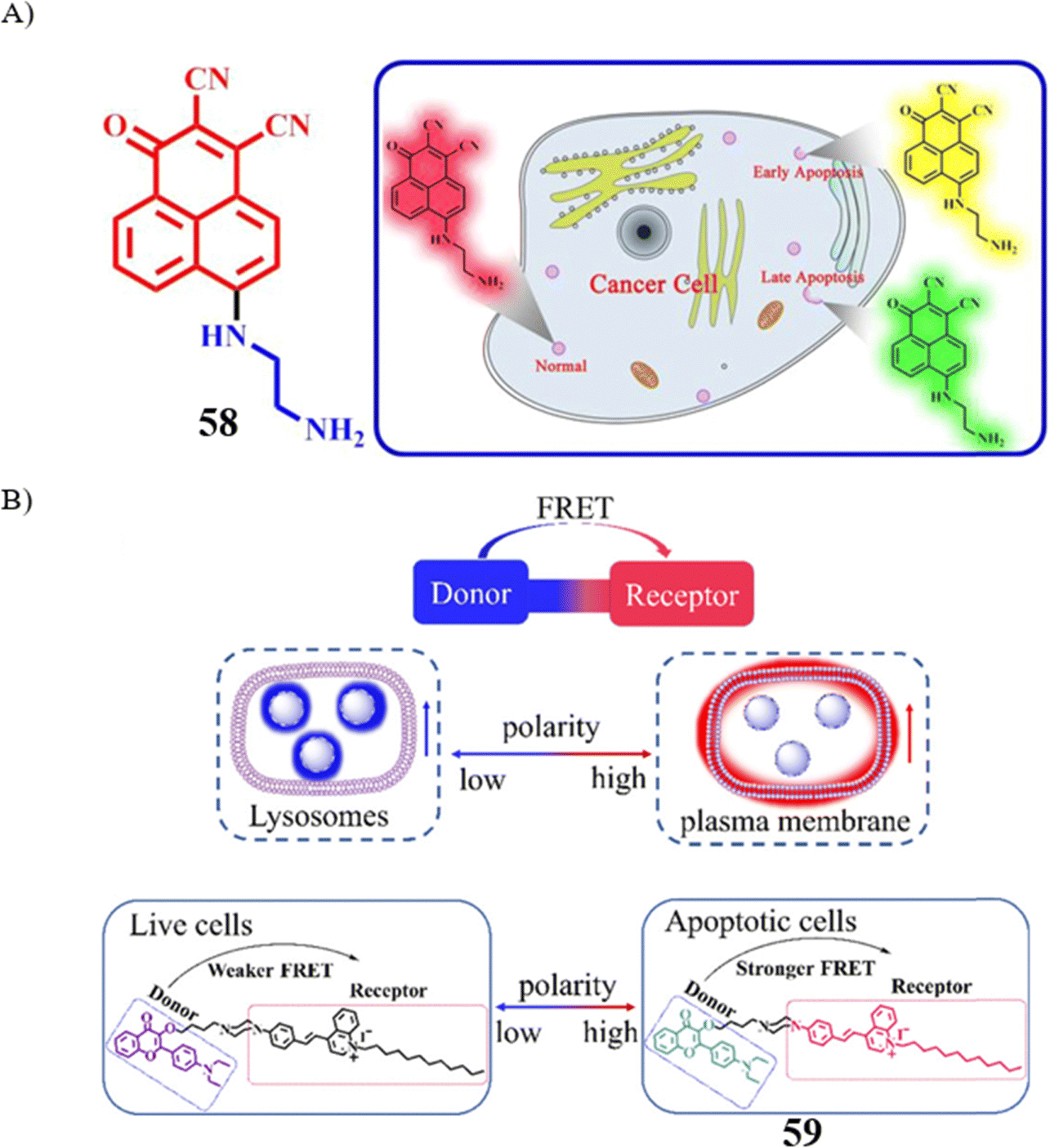
图 34 (A) 探针 58 的结构和图示。 (B) 探针59的设计策略。
6.2. 表征细胞凋亡过程中粘度的 SMFPs
粘度作为细胞微环境的核心参数,对生命系统中生物大分子的转运及相互作用起着关键作用。异常的微粘度变化与动脉粥样硬化、阿尔茨海默病及癌症等疾病的关联性已得到广泛认可。鉴于此,运用SMFPs进行细胞层级粘度成像,尤其是针对细胞凋亡进程中不同细胞器的粘度变化监测,显得尤为必要。在低粘度条件下,分子内激发态能量的旋转释放通常导致荧光减弱或淬灭;而在高粘度环境下,这种旋转运动受到抑制,减少了非辐射跃迁的可能性,从而增强了荧光信号。
线粒体粘度作为评判细胞状态的重要指标,相较于形态学检测,提供了定量评估细胞凋亡的新途径。Peng团队通过在噻唑-Cy5染料的meso位引入醛基,设计了一款TP荧光探针60,能够以双模式精确测量细胞凋亡期间线粒体粘度的动态变化。探针60在去离子甘油-H2O与乙醇-H2O混合溶液中的光谱测试显示,随着甘油含量的增加,658nm处的荧光强度增幅约为62.6倍,而467nm处的荧光强度仅提升3.8倍。此外,探针60在467nm处的量子产率为0.0004,660nm处为0.01,加之在水中的高摩尔消光系数(ε,410nm处为0.16 × 105 mol cm-1 L-1,610nm处为0.43 × 105 mol-1 cm-1 L-1),确保了低背景荧光。值得一提的是,无论在有无CCCP的情况下,荧光强度变化不大,表明探针60不受线粒体膜电位的影响。
为了监测细胞凋亡过程中的粘度变化,研究者采用依托泊苷诱导HeLa细胞凋亡。实验结果表明,随着细胞凋亡程度的加深,线粒体粘度从12 cP逐步上升至140 cP,荧光比值亦随之增加。这一发现为研究与线粒体粘度相关疾病提供了简便快捷的分析手段。
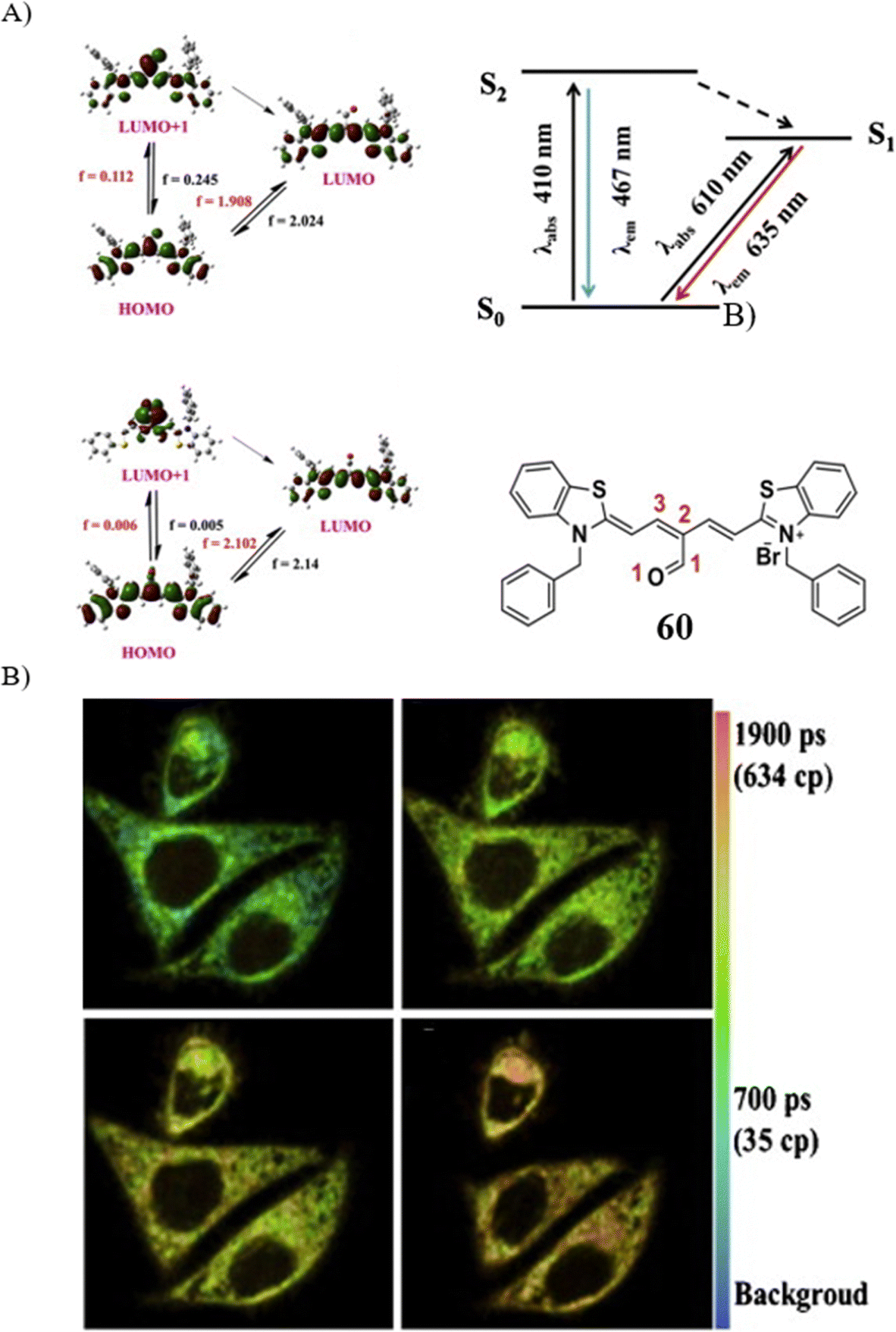
图 35 (A) 探针 60(Mito-V)的理论计算模型和结构; (B) 探针 60的荧光寿命图像。
双光子激发下,采用TP探针对活细胞进行染色并通过荧光寿命成像(FLIM)技术,能够揭示深层组织中粘度与细胞凋亡之间的内在联系。2017年,Meng团队研发了一款高性能的离通探针61,专门用于甘油-水体系的粘度检测。该探针展现出对粘度变化的高度敏感性(R2 = 0.98,x = 0.65),适用于在FLIM模式下实时监测细胞凋亡过程中微粘度的动态变化。
刘晓明研究小组则报道了一种线粒体靶向的TP探针62,该探针能够在荧光寿命成像显微镜下敏锐地捕捉粘度波动,从而在评估细胞凋亡进程时提供更为精确的数据。在SKOV-3细胞的实验中,紫杉醇(PTX)诱导细胞凋亡后24小时内,细胞内荧光寿命从550皮秒显著增加至800皮秒,直观地反映出细胞凋亡过程中粘度变化的细节,为深入理解细胞凋亡机制提供了有力工具。
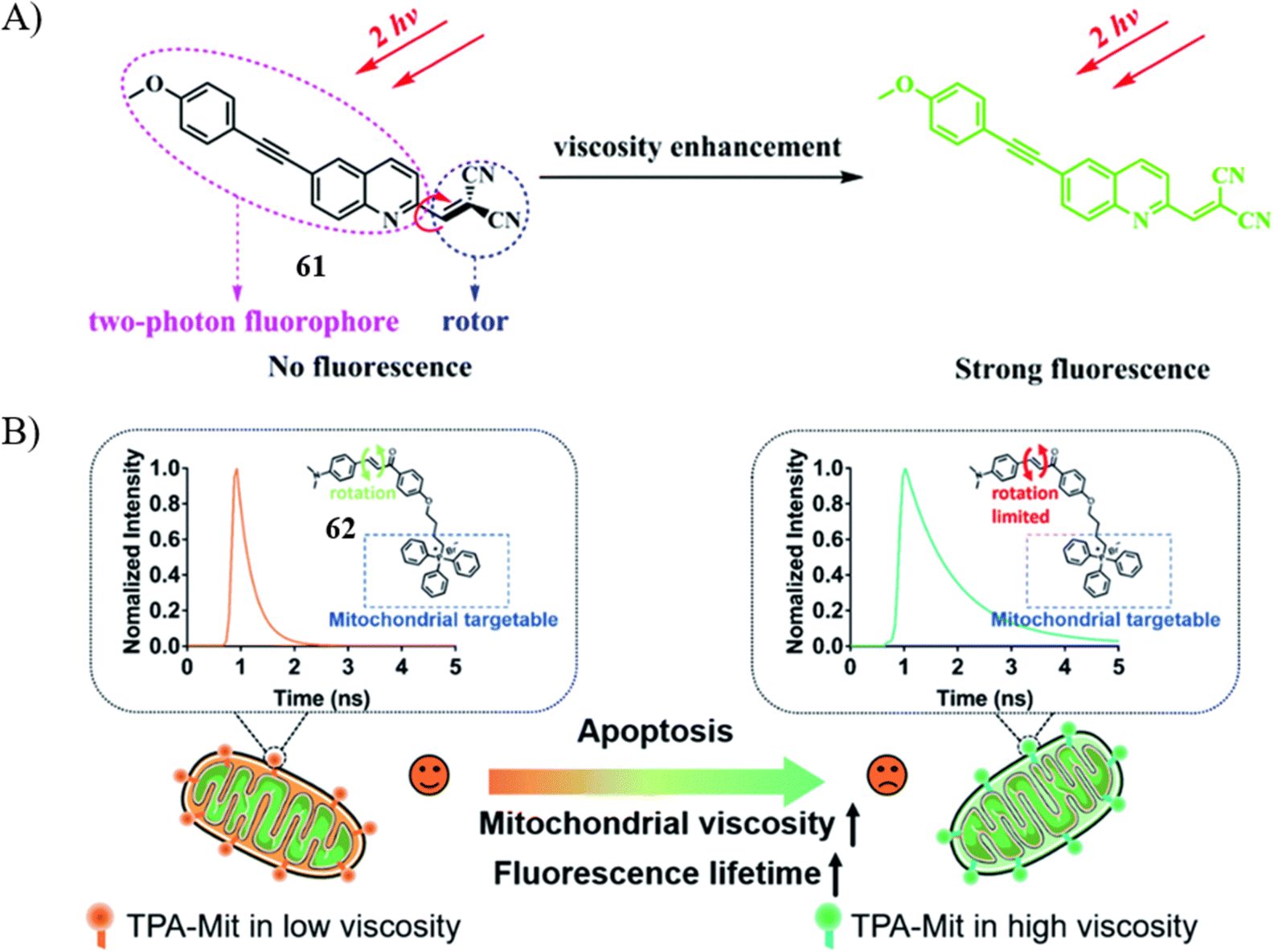
图 36 (A) 用于粘度响应的探针 61 的结构和拟议机制; (B)62(TPA-Mit)在细胞凋亡过程中用于粘度探测的结构和使用方案。
同样,Tian课题组和Mao课题组也报道了线粒体靶向 TP 探针 63和 64,它们基于荧光寿命成像显微镜检测细胞凋亡,为在细胞水平直接成像细胞凋亡过程提供了新的可能。
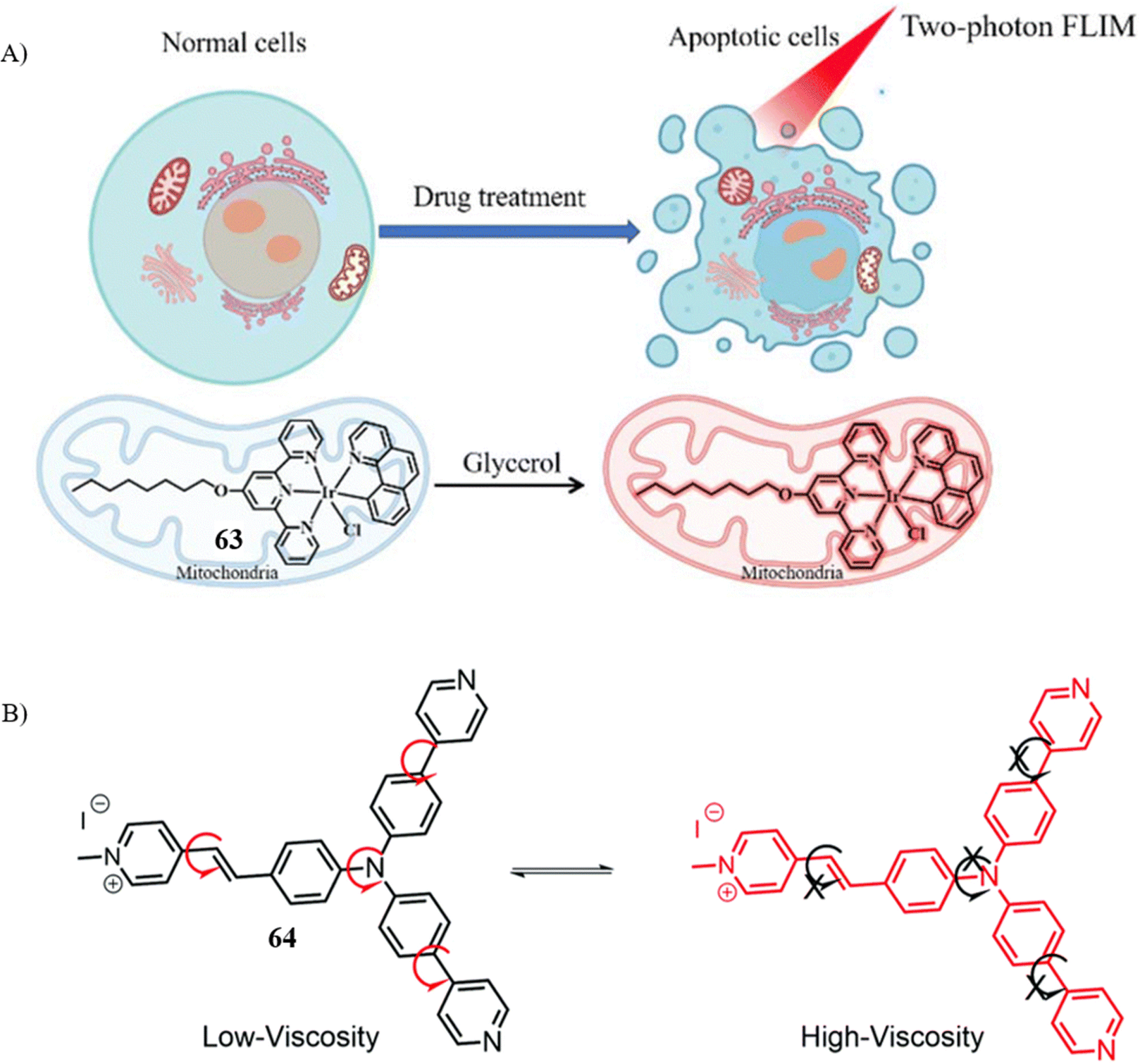
图 37 (A) 描述探针 63 监测细胞凋亡过程的示意图。 (B) 描述探针64凋亡监测过程的示意图。
近期,Li研究团队开发了一款基于旋转黄素染料TICT机制的线粒体靶向荧光探针65,该探针能够实现实时监测细胞死亡进程中微粘度的变化。在731nm波长下,随着微粘度从0.59 cP逐步增至945 cP,探针展现出显著的荧光增强现象。尤为关键的是,这款探针不仅适用于监测线粒体在凋亡、坏死、自噬以及铁变性过程中的粘度变化,而且实验发现,在铁变性之外的所有细胞死亡模式中,线粒体的粘度均呈现明显上升趋势。
与此同时,Yu课题组也设计了一种TICT机制的线粒体靶向荧光探针66,该探针具有较高的摩尔消光系数和显著的斯托克斯位移。在20 μM紫杉醇(PTX)处理的凋亡MCF-7细胞中,探针66展现出更加明显的荧光增强效果。更重要的是,通过监测线粒体粘度导致的不同荧光信号,该探针能够有效区分MCF-7细胞与MCF-10A细胞,为相关领域的科学研究提供了强有力的生物分析工具。
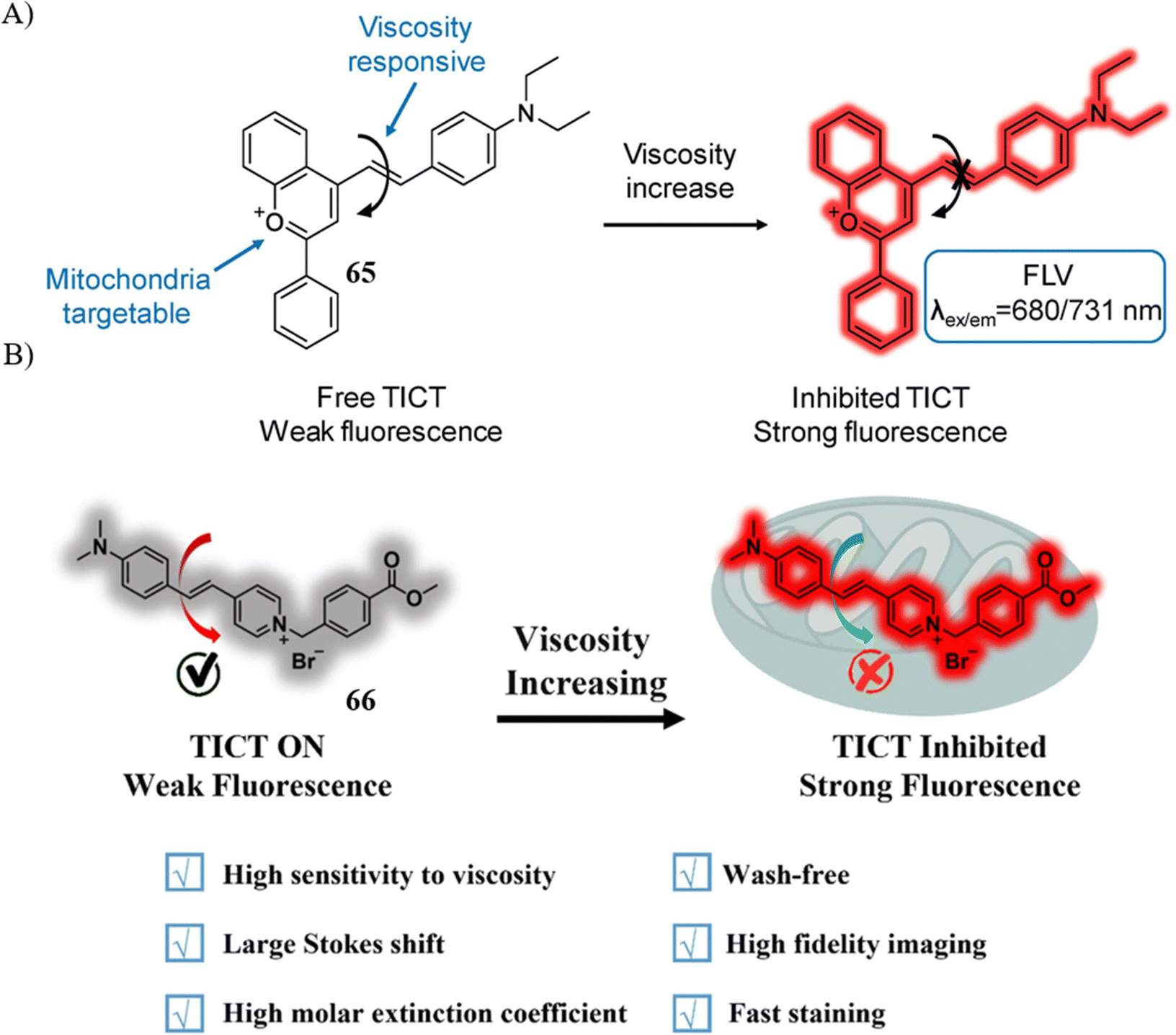
图 38 (A) 用于测量粘度的探针65(FLV)的结构和机理; (B) 66的结构和粘度监测机制。
Xiao团队研发了一款创新的粘度敏感探针67,该探针由BODIPY单元与O6-苄基鸟嘌呤构成,旨在通过双光子激发荧光寿命成像(FLIM)技术,实现对SNAP标签融合蛋白局部微粘度的精确检测。实验结果显示,当SNAP-tag融合组蛋白H2B分别与三溴化锡(TSA)、依托泊苷及顺铂共同孵育并在细胞凋亡进程中,其局部粘度出现显著下降,这一变化进一步导致DNA与H2B形成的紧密复合物结构发生紊乱。由此,该探针策略能够以高分辨率在亚细胞层面捕捉特定蛋白质局部微观粘度及其动态变化,为深入理解细胞内部精细机制提供了有力工具。
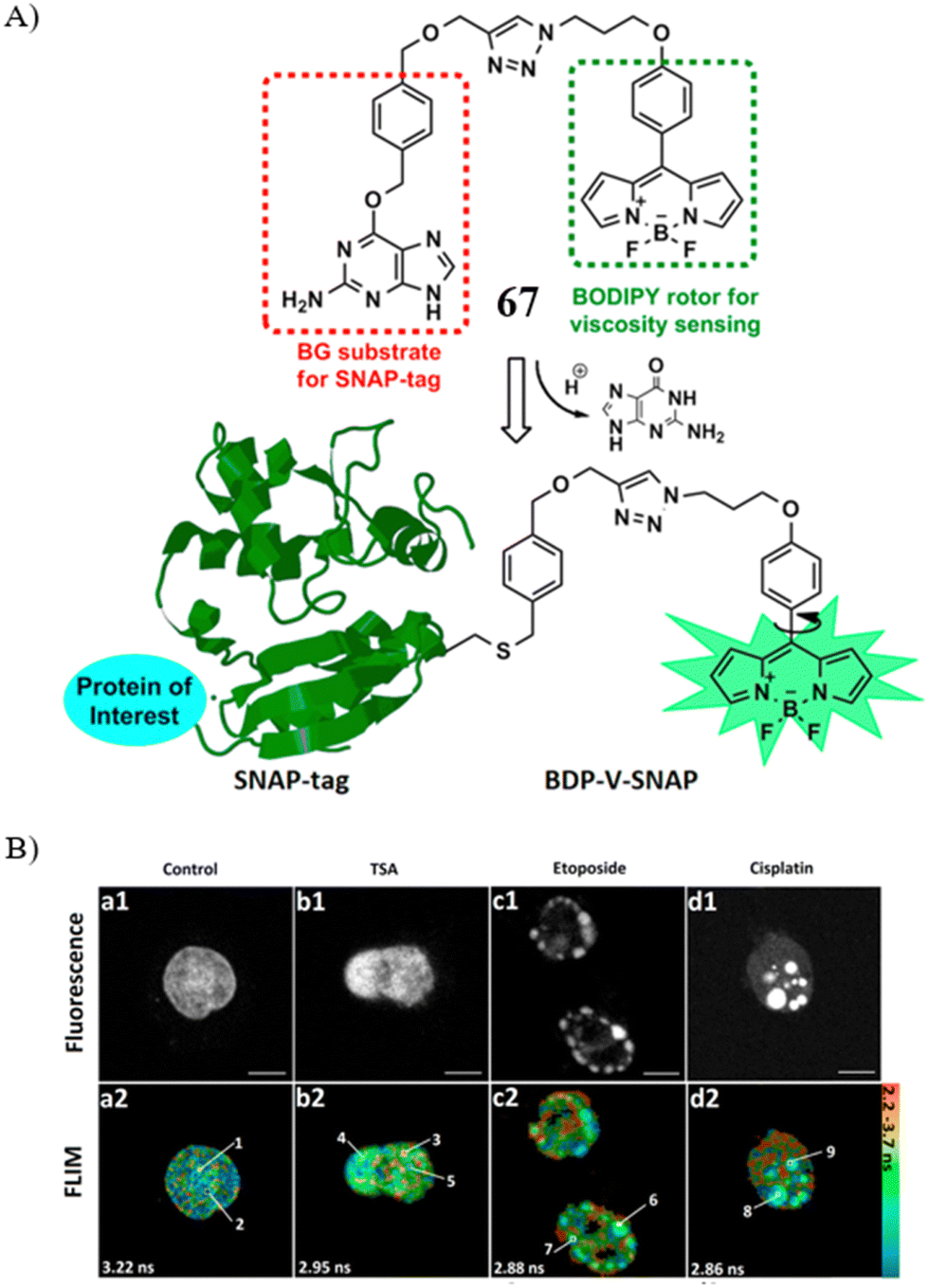
图 39 (A) 探针 67的结构和机理; (B) 荧光和寿命成像结果。
以往,鲜有SMFPs能够通过监测微粘度差异来有效区分同源癌细胞与正常细胞。2016年,库马尔团队率先报道了一款粘度敏感探针68,该探针首次实现了对由未分化、分化及处于凋亡状态的C6胶质细胞构成的复杂细胞模型系统中微粘度的定量荧光寿命成像(FLIM)。不仅如此,探针68还进一步被应用于量化喜树碱诱导的C6胶质细胞凋亡过程中的粘度变化。此外,通过流式细胞术、免疫细胞荧光(ICC)以及Western印迹分析等多种技术手段的综合应用,研究团队对这一凋亡过程进行了全面验证,证实了探针68在细胞微环境粘度检测中的可靠性和有效性。
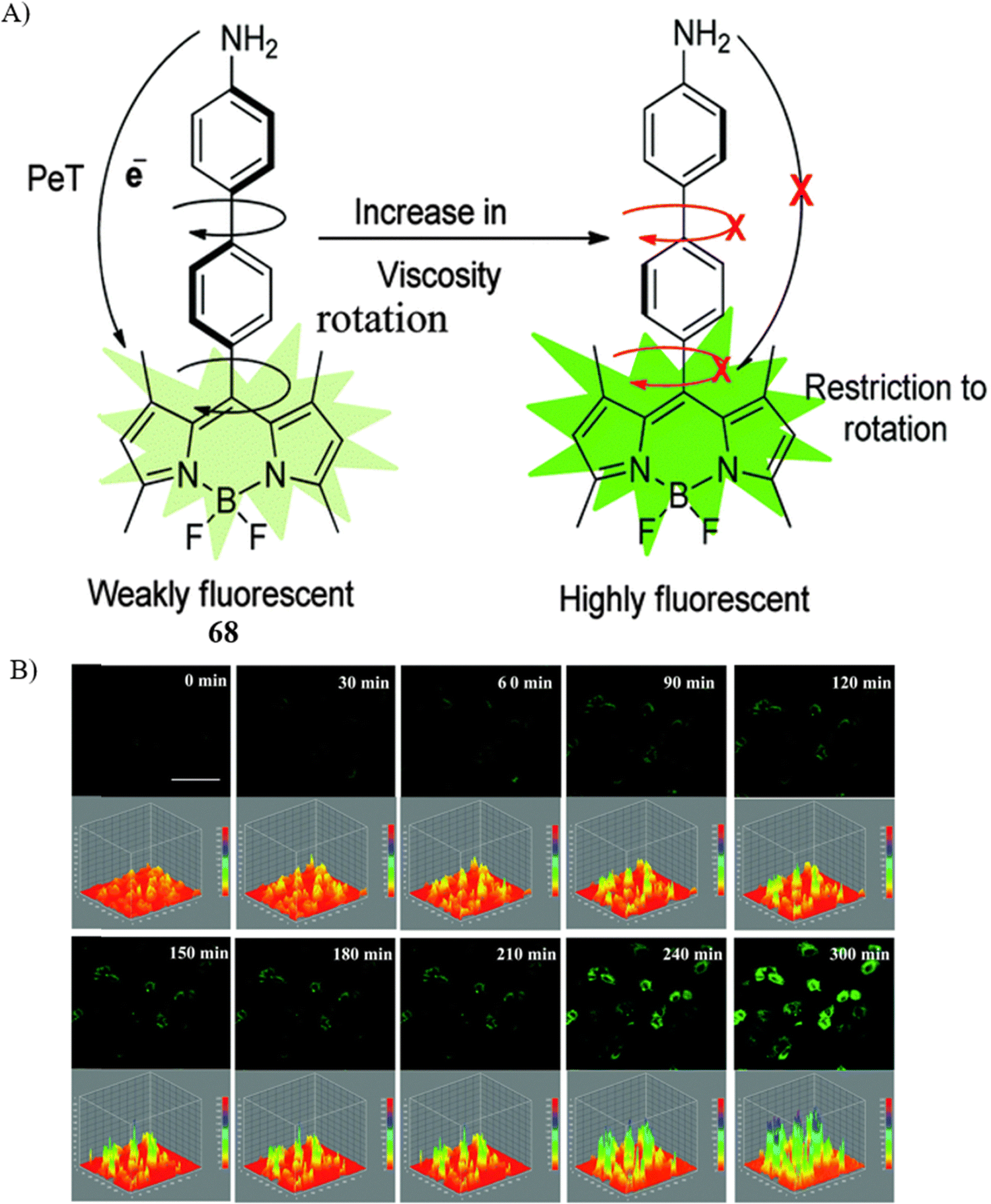
图 40 (A) 探针 68 的结构和机理; (B) 荧光图像和三维交互强度分析。
Shan团队在2021年发表了一系列基于苯甲酸吖啶酯的比率型SMFPs,专注于细胞粘度的检测。其中,探针69因对粘度变化展现出高度敏感性而脱颖而出,成功应用于癌细胞与正常细胞之间的精确区分。
同样在2021年,Singh研究组报道了一款基于ESIHB机制的荧光探针70,该探针能够通过活细胞成像技术高效地区分恶性、分化及凋亡状态的癌细胞。探针70不仅成本低廉,合成步骤简单,更重要的是,研究证实凋亡细胞展现出最高粘度,分化细胞的粘度介于两者之间,而恶性细胞则表现出最低的细胞内粘度。这些发现为通过细胞粘度变化研究细胞状态提供了新的视角和工具。
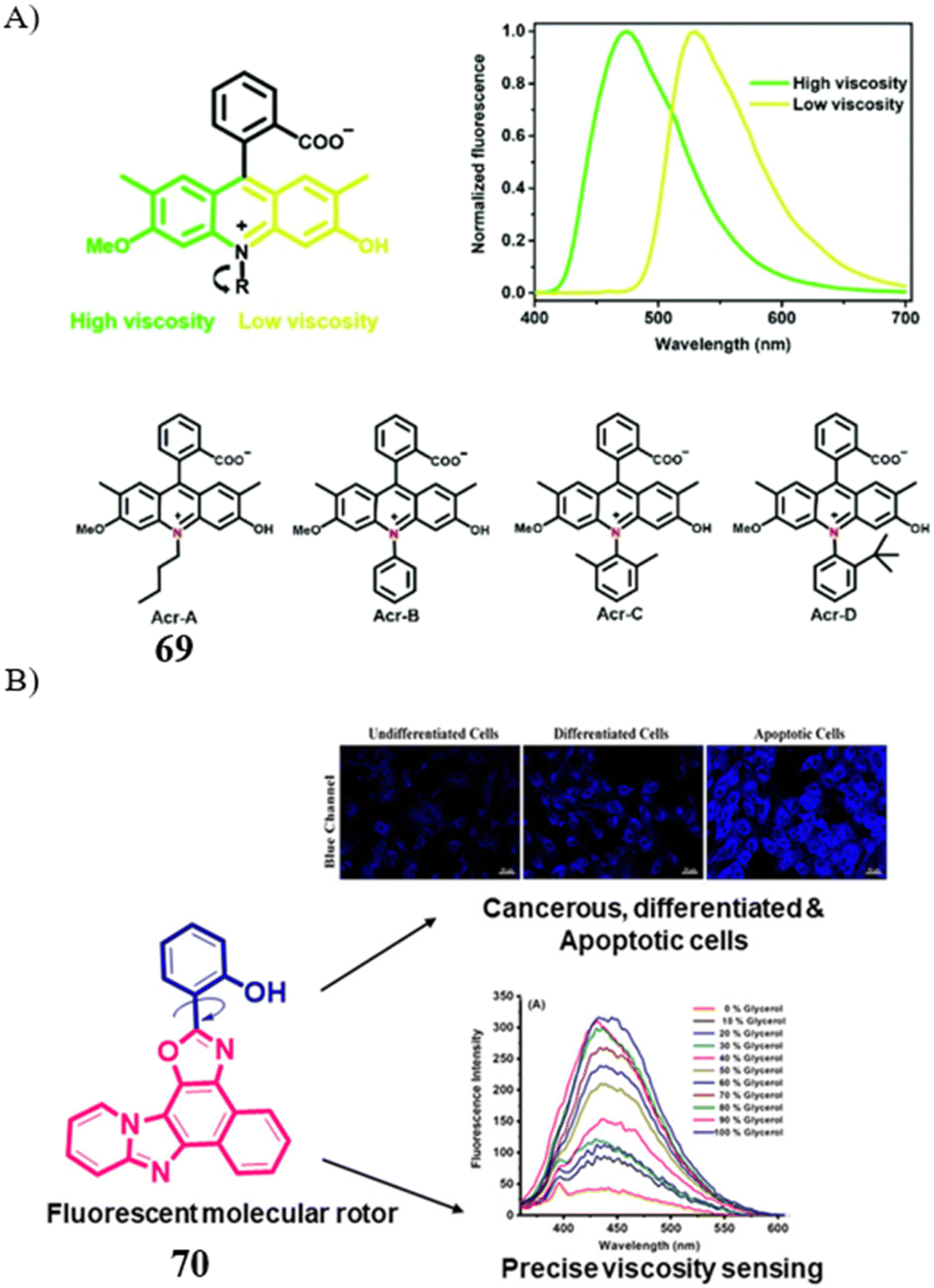
图 41 (A) 探针 69(Acr-A)、Acr-B、C、D 的结构和荧光光谱; (B) 探针70的结构。
6.3. 用于表征细胞凋亡过程中 pH 值的 SMFPs
在真核细胞中,各细胞器拥有独特的酸碱环境,比如溶酶体内部维持酸性条件(pH值大约在4.0至6.0之间),容纳了超过50种降解酶,而线粒体基质则呈轻微碱性(pH值约为8)。鉴于此,实时监测不同细胞器pH值的动态变化对于深入理解它们在细胞凋亡进程中扮演的角色至关重要。
罗丹明染料作为经典的荧光基团,以其对pH变化的敏锐响应而著称。在未与H+接触的“闭环”状态下,罗丹明染料几乎不发光,但一旦与H+共孵育,其螺内酰胺环开环,随即引发显著的荧光增强。基于这一特性,Peng研究团队开发了一款高选择性与高灵敏度的荧光探针71,该探针融合了一个新颖的溶酶体靶向基团。在pH值从7.4降至4.5的过程中,探针在578nm波长处的荧光发射强度提升了逾50倍。更值得一提的是,探针71的pKa值为5.47,这意味着它能够有效监测从4.5至6.0pH范围内溶酶体的正常与异常酸度波动。实验结果证实,该探针不仅能定量追踪氯喹诱导的溶酶体pH变化,还能捕捉活细胞凋亡过程中溶酶体酸度的细微波动,为细胞凋亡研究提供了有力的分析工具。
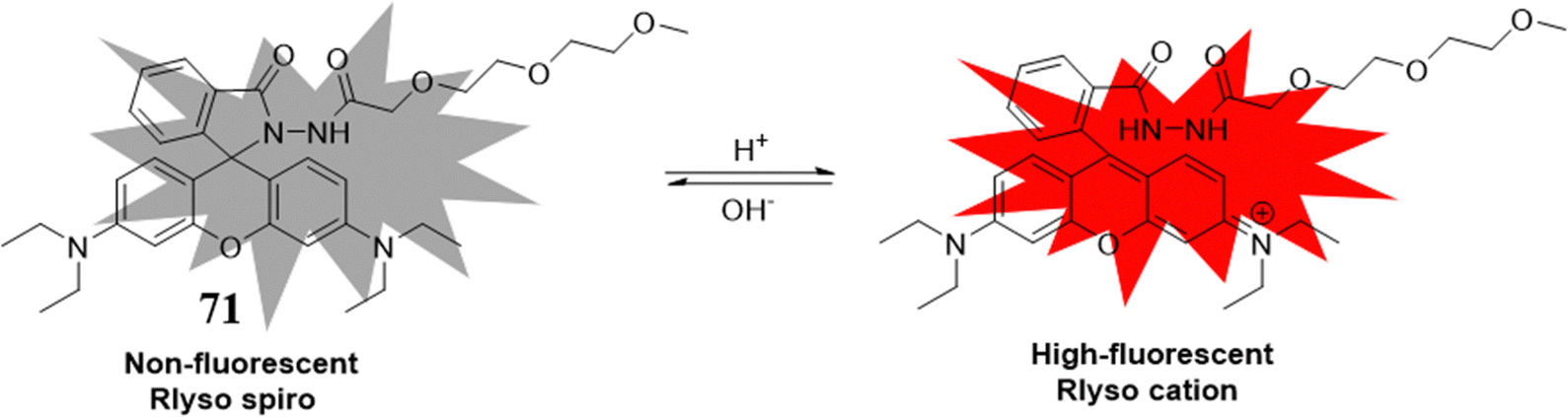
图 42 探针 71(Rlyso)的结构和机制。
毕研究团队近期报道了一系列创新荧光探针72-77,这些探针巧妙地融合了pH响应结构域与溶酶体靶向模块,基于罗丹明染料设计而成,旨在监测溶酶体内的pH值变化,并评估溶酶体依赖型细胞凋亡过程。与先前设计的探针相比,这批新型探针更侧重于识别溶酶体膜上的糖基化蛋白,这类蛋白富含多种N-连接的糖基,包括但不限于甘露糖、岩藻糖、半乳糖、N-乙酰葡糖胺以及硅藻酸等分子。尤为引人注目的是,这些荧光探针兼具低细胞毒性、高细胞渗透能力、较长的荧光寿命以及在酸性细胞器中特异性富集的特点,展现了在细胞凋亡研究中的巨大潜力。
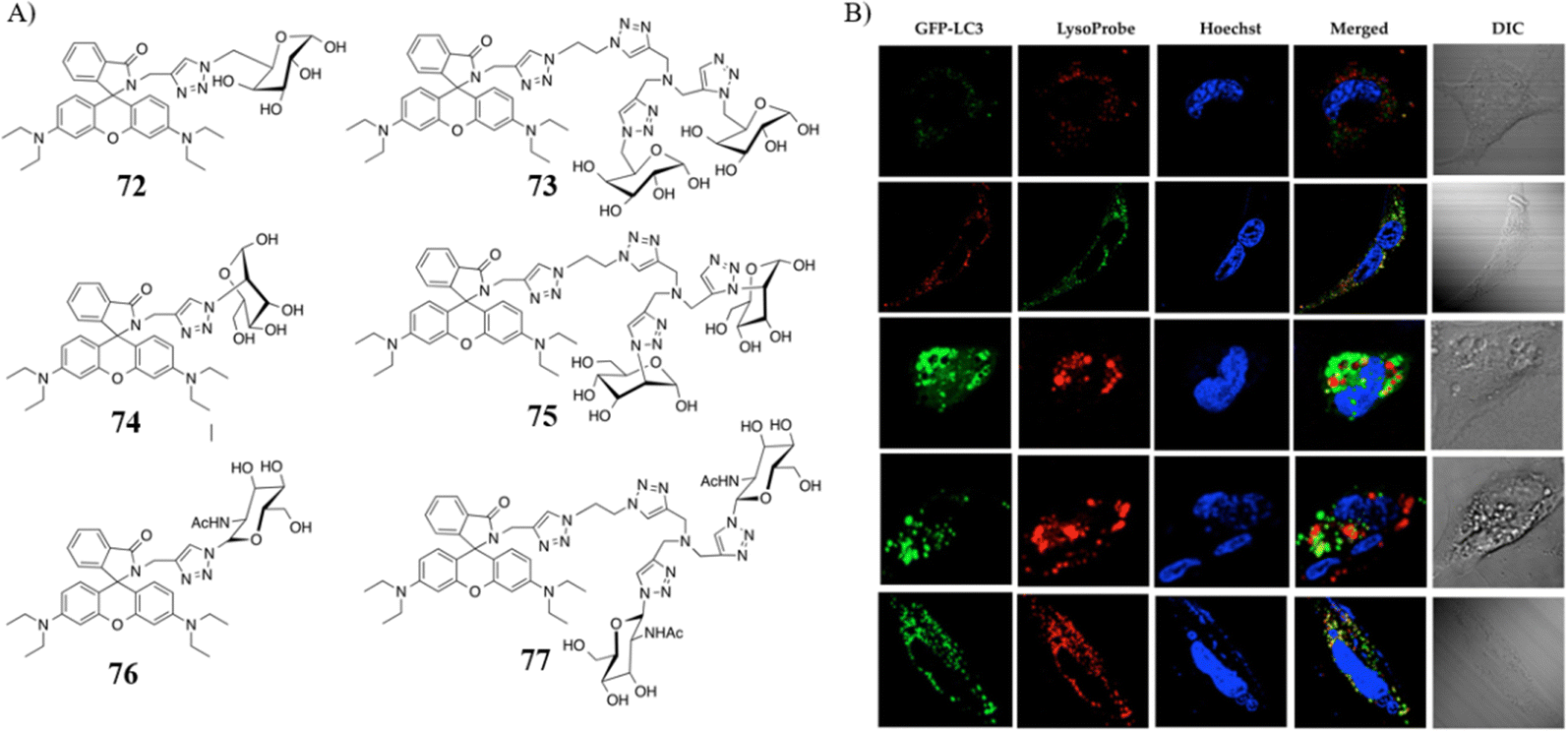
图 43 (A) 探针 72-77 的化学结构; (B) RBE 细胞凋亡过程中73的 CLSM 图像
近期的研究揭示,溶酶体可通过释放特定因子,如俘获素,来调控细胞凋亡信号路径。氯喹(CQ),作为一款抗疟疾药物,已被证实能够诱导癌细胞凋亡,同时增强人胆管癌(CCA)细胞系RBE对葡萄糖氧化的敏感性。利用荧光探针对CQ处理和营养剥夺下的溶酶体凋亡过程进行成像,结果显示,随着CQ剂量的增加,酸性囊泡的数量呈现浓度依赖性增长。
与此同时,科研人员还开发了一系列高稳定性的糖基化探针78-81,这些探针富含大量的N-连接糖基,有效提升了对溶酶体的靶向识别能力。为了实现细胞内pH值的实时成像,研究人员首先将ARPE-19细胞与尼格列汀(一种H+/K+拮抗剂)共同孵育,随后再与凋亡传感器孵育。实验图像清晰地展示了在细胞边缘区域,酸性细胞外pH值显著增强,而溶酶体则主要集中在接近中性pH值(约为7.4)的核周部位。此外,研究还进一步证实,通过氯喹干预溶酶体功能,可能为癌症治疗提供一种潜在的治疗策略,展现出干预溶酶体活动在癌症疗法中的应用前景。
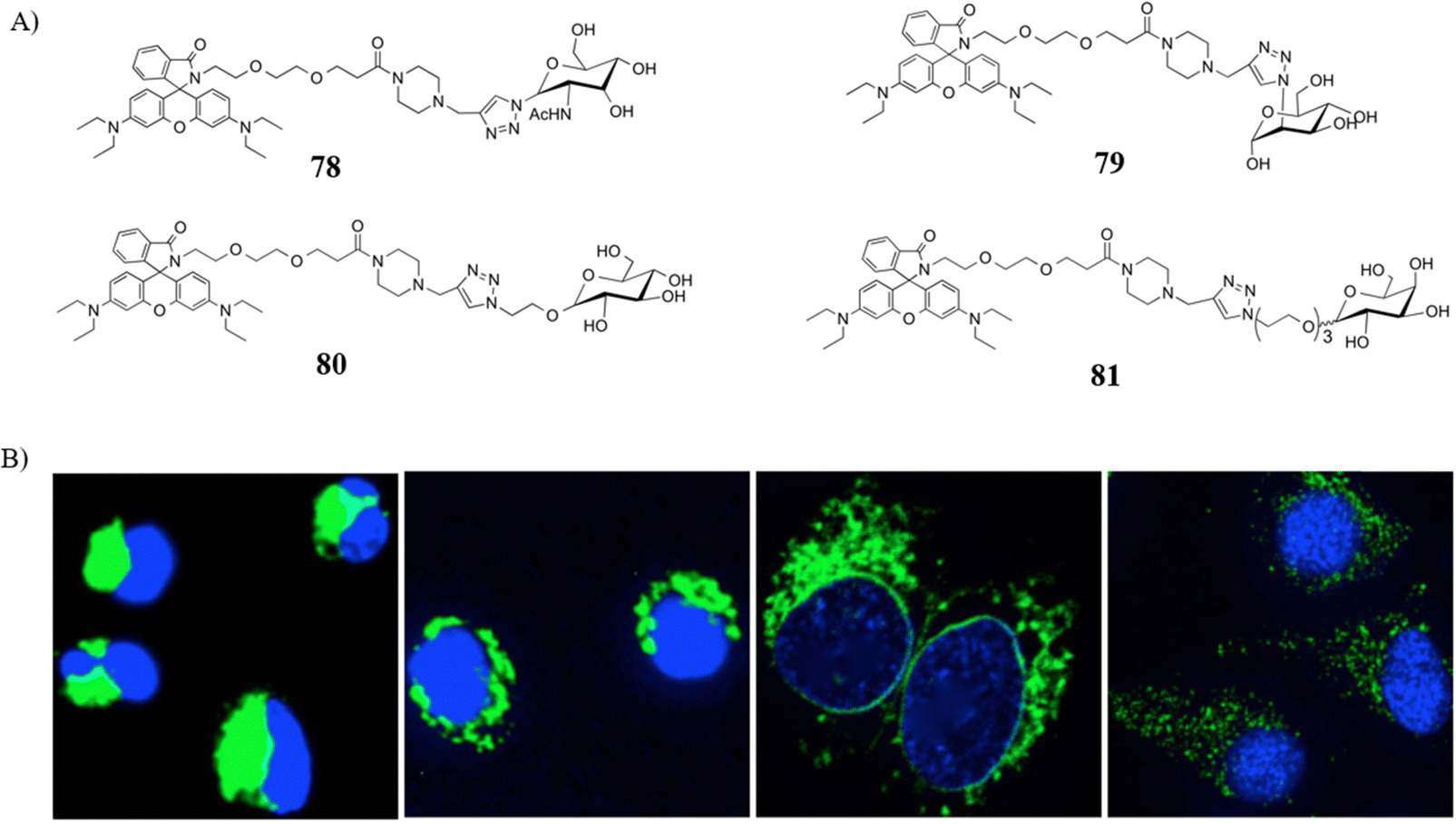
图 44 (A) 78-81的化学结构; (B) 用探针 81 在 ARPE 细胞中测量细胞内 pH 值
Dong研究团队近期报道了一款高选择性的红色荧光探针82(图45A),专门用于实时追踪细胞凋亡期间溶酶体pH值的动态变化。这款探针的设计巧妙结合了pH响应性分子与溶酶体靶向结构——吗啉。实验结果表明,在pH值从8.00下调至4.80的过程中,探针在590nm处的荧光强度提升了超过120倍,其pKa值被确定为5.42,同时,荧光量子产率从0.009显著增强至0.12。
为了监测细胞凋亡进程中溶酶体pH值的实时变化,研究者将探针与HeLa细胞共同培养10分钟后,紧接着用地塞米松(DEX,一种凋亡诱导剂)处理细胞。实验观察到,在DEX处理后的20分钟内,细胞的荧光信号呈现出逐渐减弱的趋势,这一结果直观地揭示了在DEX诱导的细胞凋亡过程中,溶酶体内部的pH值出现了上升。因此,探针82在研究亚细胞器功能及溶酶体相关疾病机制方面展现出巨大的潜力,为深入解析细胞凋亡的复杂机制开辟了新的研究路径。
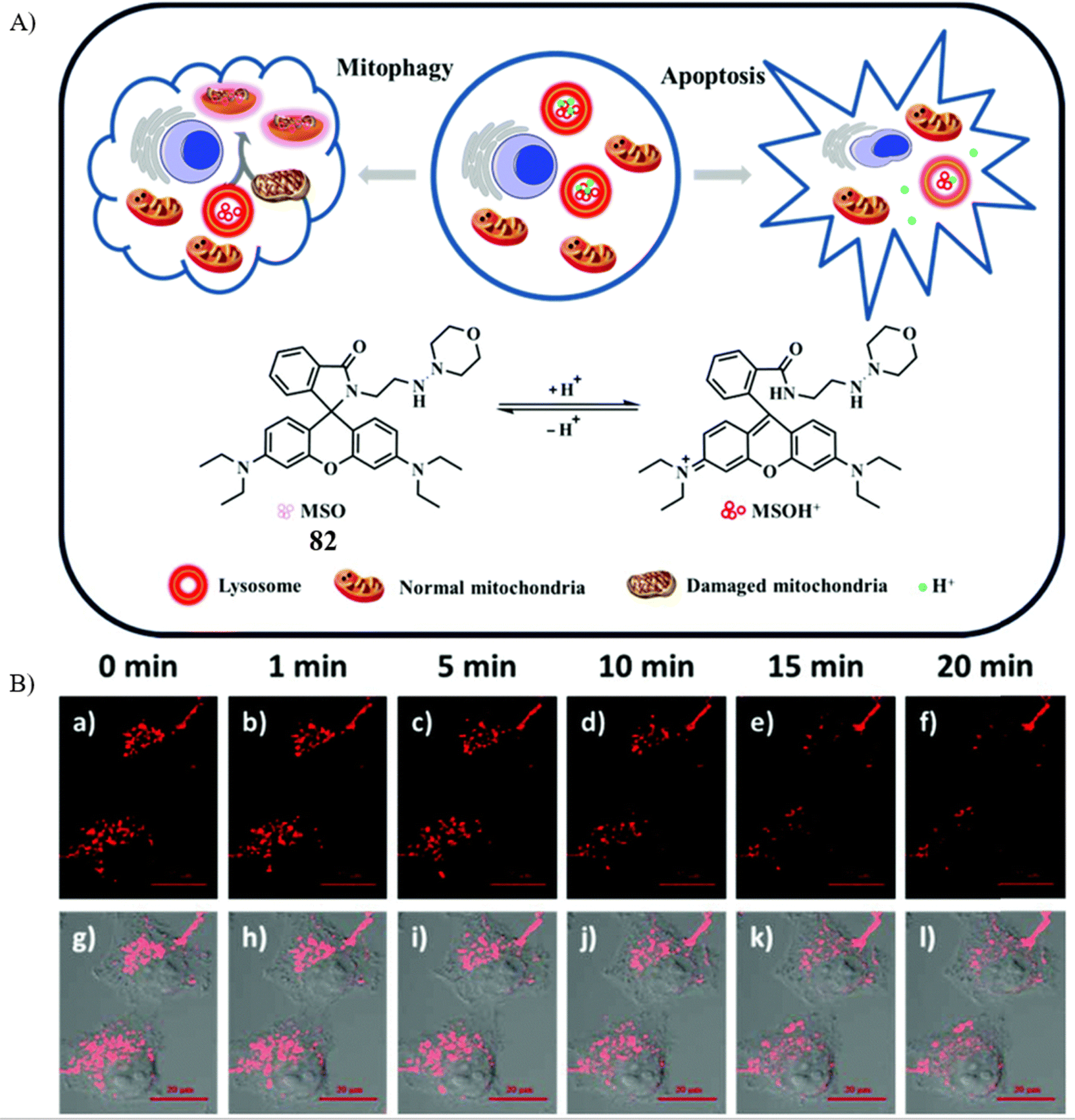
图 45 (A) 探针 82(MSO)的结构和机理; (B) 探针 82(10 μM)在 HeLa 细胞中的实时图像。
Meng研究团队开发了一款双功能吡啶基TP荧光探针83,该探针不仅能靶向溶酶体,还具备响应pH值变化的能力。在pH值从9.5至2.6的范围内,探针展现出80nm的显著红移,荧光强度比(I560 nm/I480 nm)从0.48稳步增长至38.89。同时,荧光量子产率从0.0039提升至0.135,计算得出的pKa值为5.20。此外,探针在820nm波长处的最大TP作用截面达到26 GM。这些优异的荧光特性表明,探针83能够实现对溶酶体酸碱度的高效、定量成像。
Li课题组也报道了一款新型TP细胞凋亡传感器84,用于在热休克、有丝分裂及细胞凋亡等不同细胞应激条件下实现溶酶体pH值的可视化。该探针由萘二甲酰亚胺染料作为报告分子,结合了哌嗪和吗啉作为靶向与pH响应基团,以及氯化苄作为溶酶体定位单元。Suresh团队则研究了紫素染料的光谱特性,发现探针85具备高pH敏感性、卓越的抗干扰能力、良好的稳定性(pKa为4.6)以及明显的颜色变化。特别地,研究证实探针85能够对药物诱导的细胞凋亡在酸性环境(如溶酶体)中的pH变化进行成像,为细胞凋亡研究提供了有力工具。
图 46 (A) 探针83(溶菌酶-PCE)的结构和机理; (B) 探针84(l-pH)的结构和建议的反应机制; (C) 85的拟议反应机制。
线粒体作为细胞内关键的能量生产中心,在生命系统代谢过程中,特别是在碱性基质(pH值约为8)环境下,扮演着不可或缺的角色。线粒体pH值的异常波动能够直接影响包括细胞凋亡在内的各项生化活动,因此,实时监测线粒体pH值的动态变化变得尤为重要。
Yu研究团队首次推出了一款线粒体靶向荧光探针86,专门用于成像细胞凋亡过程中pH值的变化情况。通过对荧光发射光谱的分析,从pH值4.0到10.0的范围内,528nm处的荧光峰值显著下降,而606nm处的荧光峰值则呈现上升趋势。同时,探针的量子产率从pH4.0时的0.0584降至pH9.0时的0.0159,计算得出的pKa值为5.88。在HeLa细胞与293T细胞中的共定位实验表明,探针86能够特异性地靶向线粒体结构。研究者通过使用不同浓度的CCCP刺激HeLa细胞,随后与5.0 μM的探针共同孵育30分钟。实验结果显示,与对照组细胞相比,经CCCP处理的细胞在绿色和红色荧光通道的信号均有显著降低,这表明CCCP可能诱导了线粒体凋亡过程,进一步验证了探针86在监测线粒体pH值变化及细胞凋亡研究中的应用潜力。
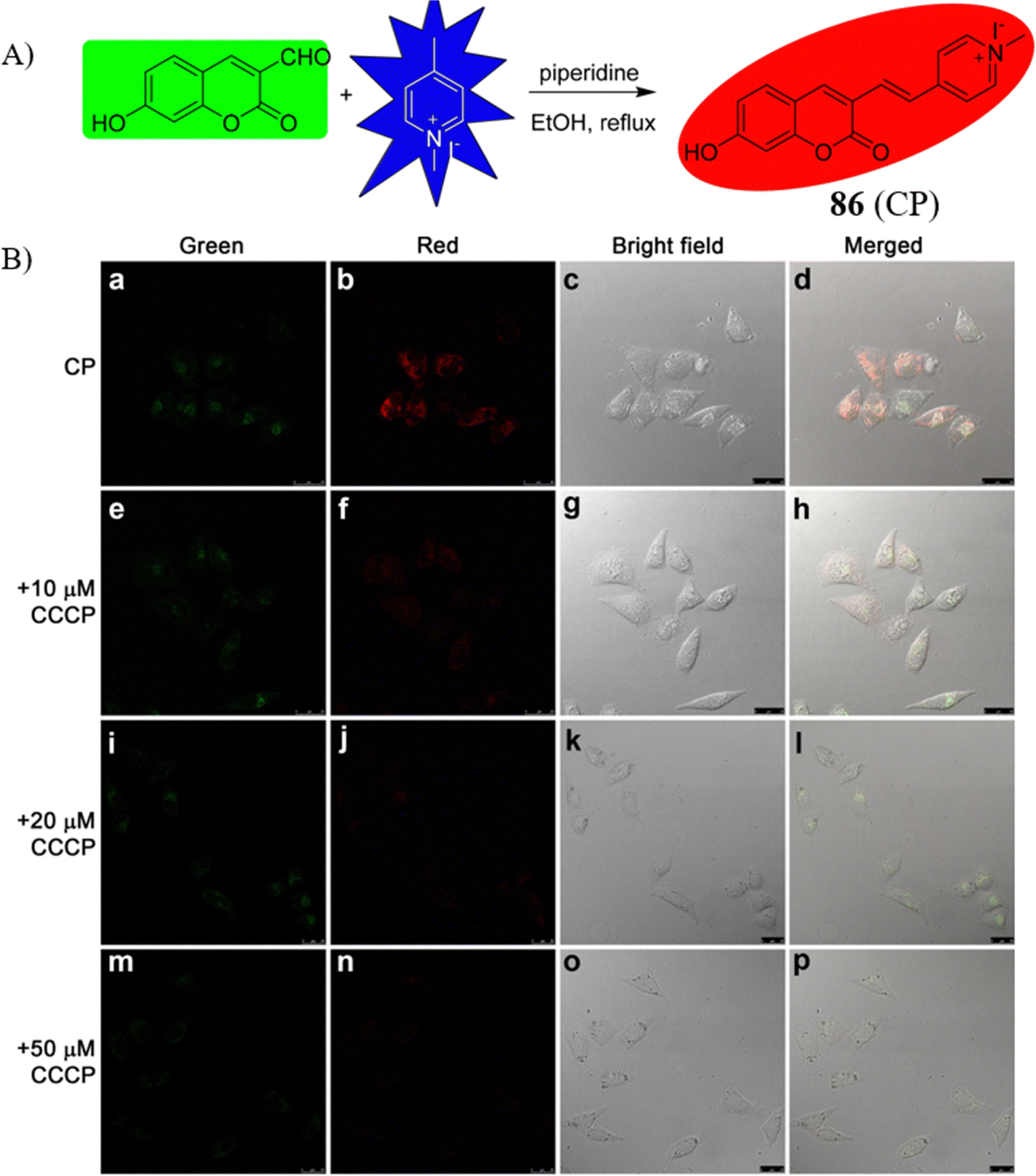
图 47 (A) 探针 86(CP)的合成。 (B) 探针 86(5.0 mM)与 0、10、20 和 50 mM CCCP 培养的共焦图像。
Yu研究团队精心设计了一款pH敏感的比率荧光探针87,旨在实现线粒体与细胞核的同时成像,进而评估细胞凋亡进程。探针87的结构由两部分构成:苯并噻唑盐作为线粒体和细胞核的靶向单元,以及羟基半氰胺作为pH响应分子。与先前的探针设计不同,87在不同激发波长下展现出对pH值变化的差异化荧光响应。在405nm波长激发下,荧光信号随pH值从4.0至9.0逐渐减弱;而在543nm波长激发下,荧光强度则随着pH值的同一范围变化显著增强。尤为关键的是,当pH值从8.0降至4.0时,荧光强度比(I550 nm/I605 nm)大幅提升了约350倍,计算得出的pKa值约为5.87,这表明探针87能够通过红色和绿色发射同时检测线粒体与细胞核的状态。
为进一步验证探针的实用性,研究者将SiHa细胞与紫杉醇和鱼藤酮分别孵育36小时和24小时,随后与探针共同孵育,以评估其在细胞凋亡检测中的效能。实验结果表明,对照组细胞展现出明显的绿色与红色荧光信号。而与之形成鲜明对比的是,在紫杉醇或鱼藤酮处理组中,尽管细胞核内的绿色荧光信号依然显著,线粒体区域的红色荧光信号却急剧下降。这一发现证实了探针87作为双色凋亡传感器在监测紫杉醇或鱼藤酮诱导细胞凋亡方面的有效性和实用性,为细胞凋亡研究提供了一个创新的工具平台。
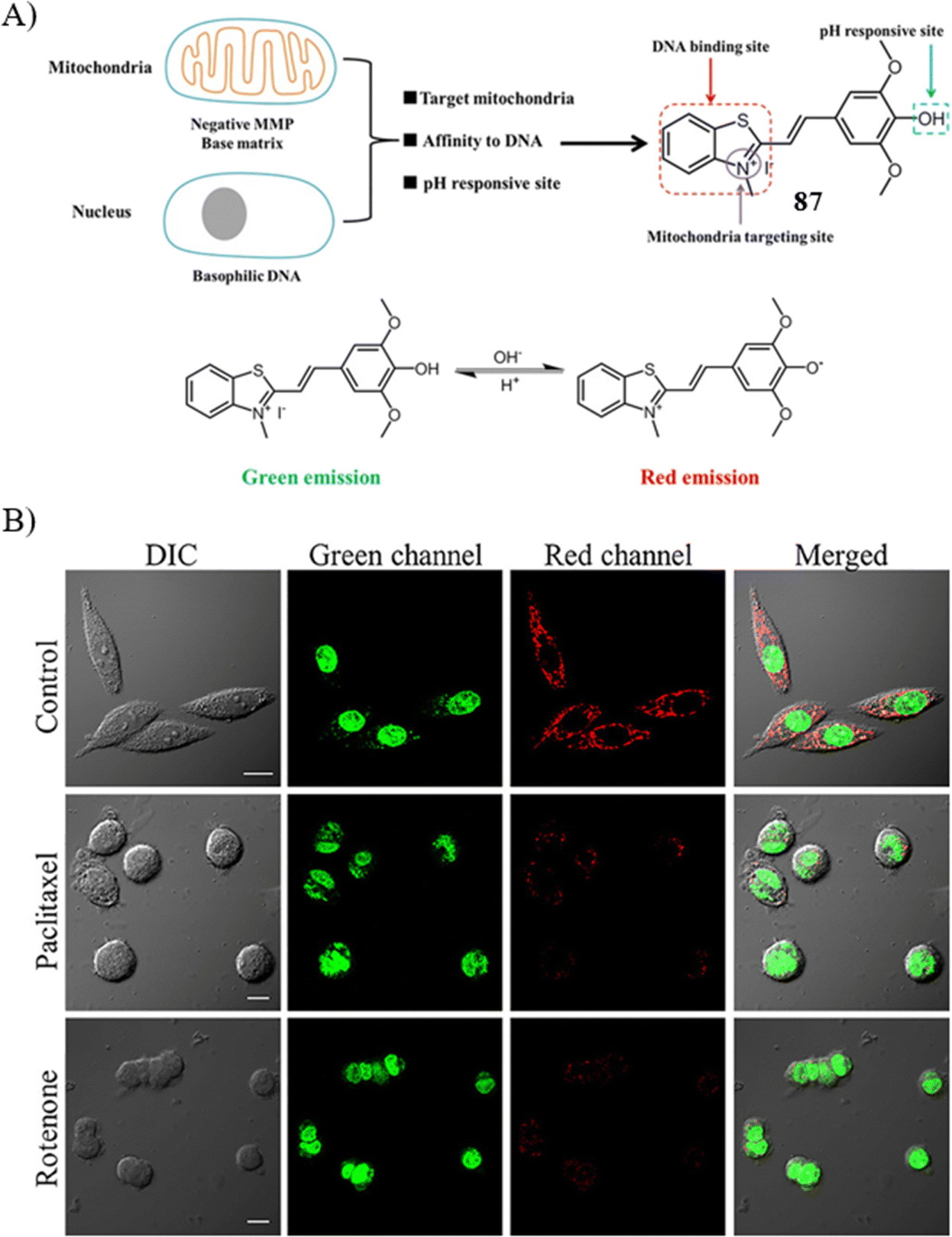
图 48 (A) 探针 87(HMBI)的策略和结构; (B) 探针87(5 μM,30 分钟)在不同条件下的共聚焦荧光图像。
同样地,Lin团队设计了一款对pH值敏感的荧光探针88,该探针能够与RNA结合,通过比率法监测细胞凋亡过程中的变化。在活的HepG2细胞中,探针因高膜电位差(ΔΨm)和线粒体内的碱性环境而聚集,此时会同时显示蓝色和红色荧光信号。然而,在细胞凋亡进程中,探针从线粒体中释放,转而与RNA结合,导致明显的红色信号出现。尤为关键的是,该比率荧光探针已被成功应用于紫杉醇和鱼藤酮诱导的细胞凋亡过程的实时成像,为细胞凋亡研究提供了有力工具。
另一方面,Ajayaghosh研究小组报道了一款基于改进的Vilsmeier-Haack反应设计的新型刚性五环吡咯烷探针89。这款pH响应性探针被开发用作一种潜在的化学传感器,旨在为肿瘤治疗方案的筛选、药物发现及剂量优化提供支持,展现了在精准医疗领域的广阔应用前景。
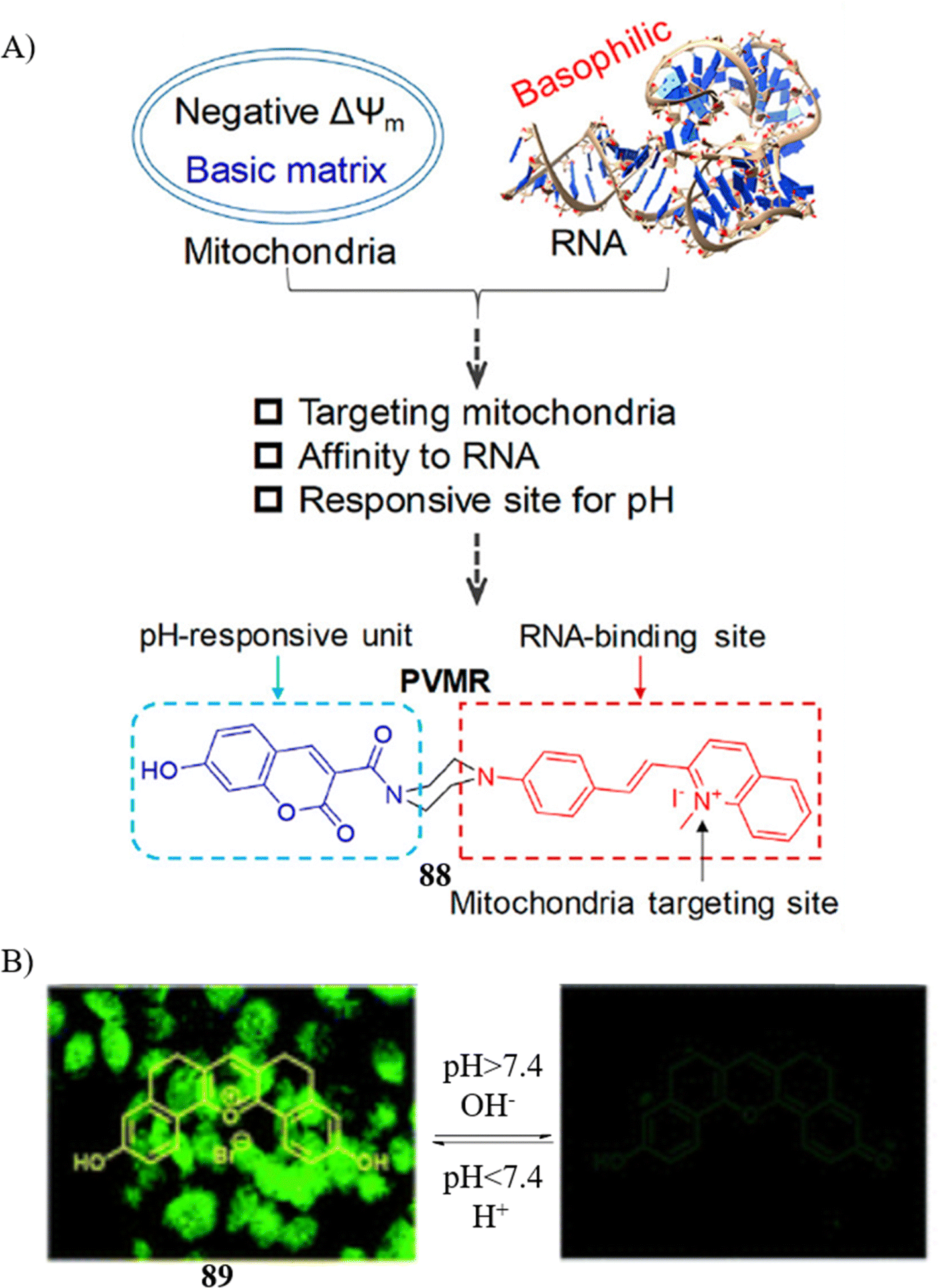
图 49 (A) 探针 88(PVMR)的结构和设计。 (B) 用于 pH 值的89的结构和机理。
7. 用于凋亡过程成像的其他 SMFPs
多模态分子成像技术作为一种既能提供空间又能提供时间分辨率的成像信号方法,近年来备受关注,尤其在提升成像信号的检测灵敏度和准确性方面展现出了巨大潜力。近期,Meade研究团队报道了一款用于细胞凋亡检测的双模态荧光-磁共振(FL-MRI)探针90,该探针能够实现对caspase-3/7酶活性的同步响应,从而在细胞凋亡过程中提供FL-MR成像信号。
探针90的设计巧妙地集成了三个关键部分:DOTA-Gd(iii)作为磁共振信号增强剂,AIEgen作为荧光信号增强剂,以及DEVD肽作为caspase-3/7酶可裂解的活性链接。这一设计使得探针在caspase-3/7酶的作用下,能够同步触发荧光和磁共振信号的变化。尤为关键的是,荧光信号可以用于精确量化探针在caspase-3检测过程中的活性状态,进而显著提升体外磁共振成像反应的预测精度,为细胞凋亡研究提供了更为精准和全面的分析手段。
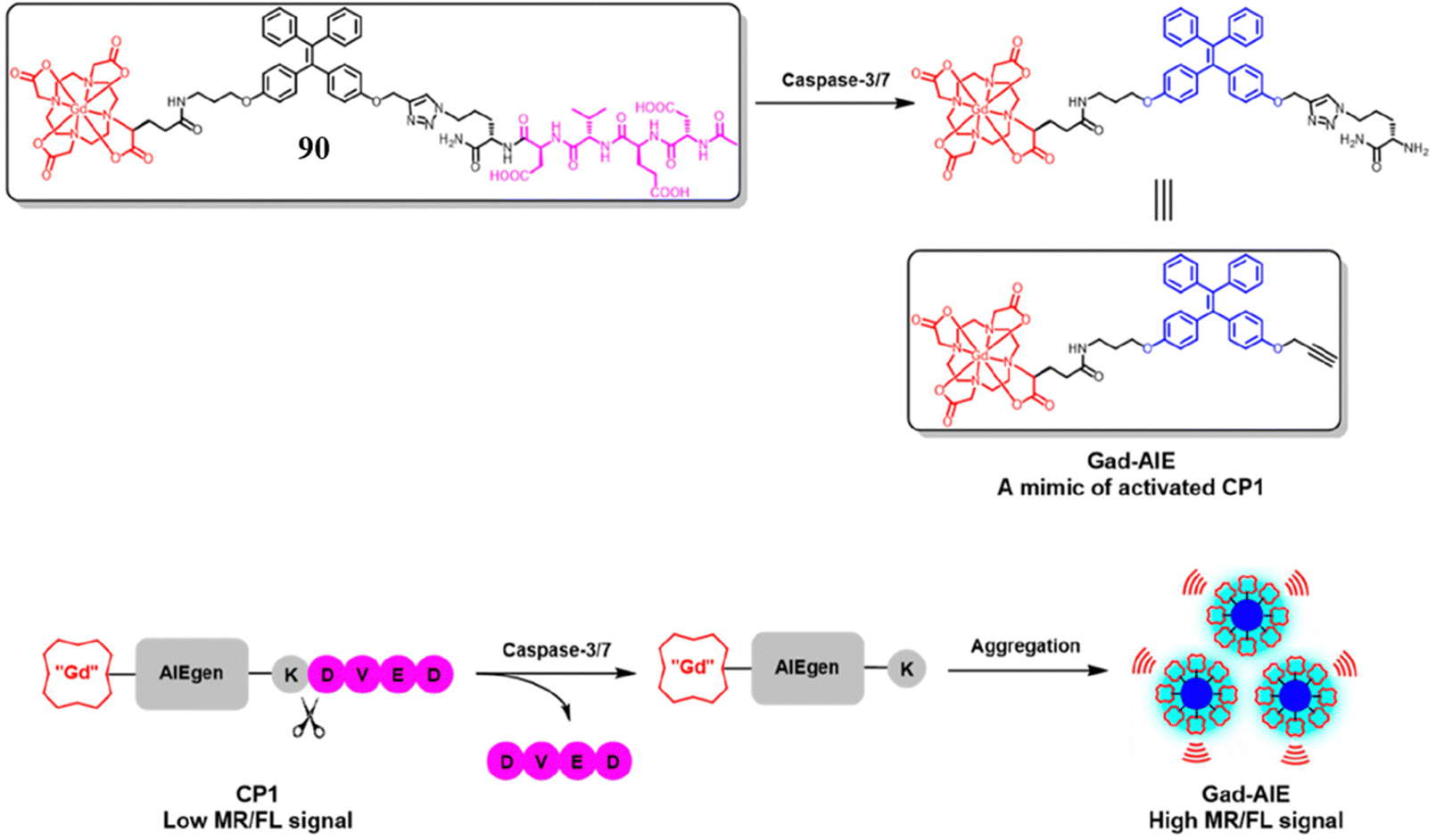
图 50 探针 90(CP1)的设计策略和机理。
线粒体DNA(mtDNA)作为细胞内关键的遗传信息载体,其损伤与多种疾病状态下的细胞凋亡密切相关。Zhang课题组近期报道了一款基于二氰异佛尔酮荧光团的分子内电荷转移(TICT)探针91,该探针具备在1.3分钟内对微量mtDNA进行超灵敏检测的能力。探针91不仅展现出极低的检测限(71 ng mL-1),还拥有显著的斯托克斯位移(205 nm),这使得其成为对mtDNA进行“零干扰”成像的理想选择。
尤为关键的是,实验结果证实,线粒体的状态变化并不会干扰探针91对mtDNA的监测效能,这一特性确保了在细胞凋亡进程中,探针能够持续、准确地反映细胞的健康状况,为实时评估细胞凋亡过程提供了有力的工具。

图 51 (A) 91的结构和 mtDNA 检测机制; (B) 不同线粒体膜电位下的 CLSM 图像。
采取“一举两得”的创新策略,能够让我们深入探索细胞凋亡进程中不同生物标志物间的内在关联。Yi研究团队开发了一款多功能FRET探针92,该探针由三个关键部分组成:NP1作为H2O2的荧光报告单元,Cy5作为荧光染料,以及一段特异性识别caspase 3的肽链,旨在同时监测细胞凋亡中的H2O2与caspase 3活性。
在正常细胞中,由于H2O2的积累,探针在663nm波长处发出红色通道信号;而在凋亡细胞中,过量表达的caspase-3对特异性识别序列的裂解,则主要导致555nm波长处的绿色通道信号增强。此外,探针92在检测H2O2(1.54 μM)和caspase-3(0.43 nM)时展现出极低的检测限(LOD)。研究还揭示,内源性活性氧物种(ROS)的产生并非仅局限于细胞凋亡情境下。
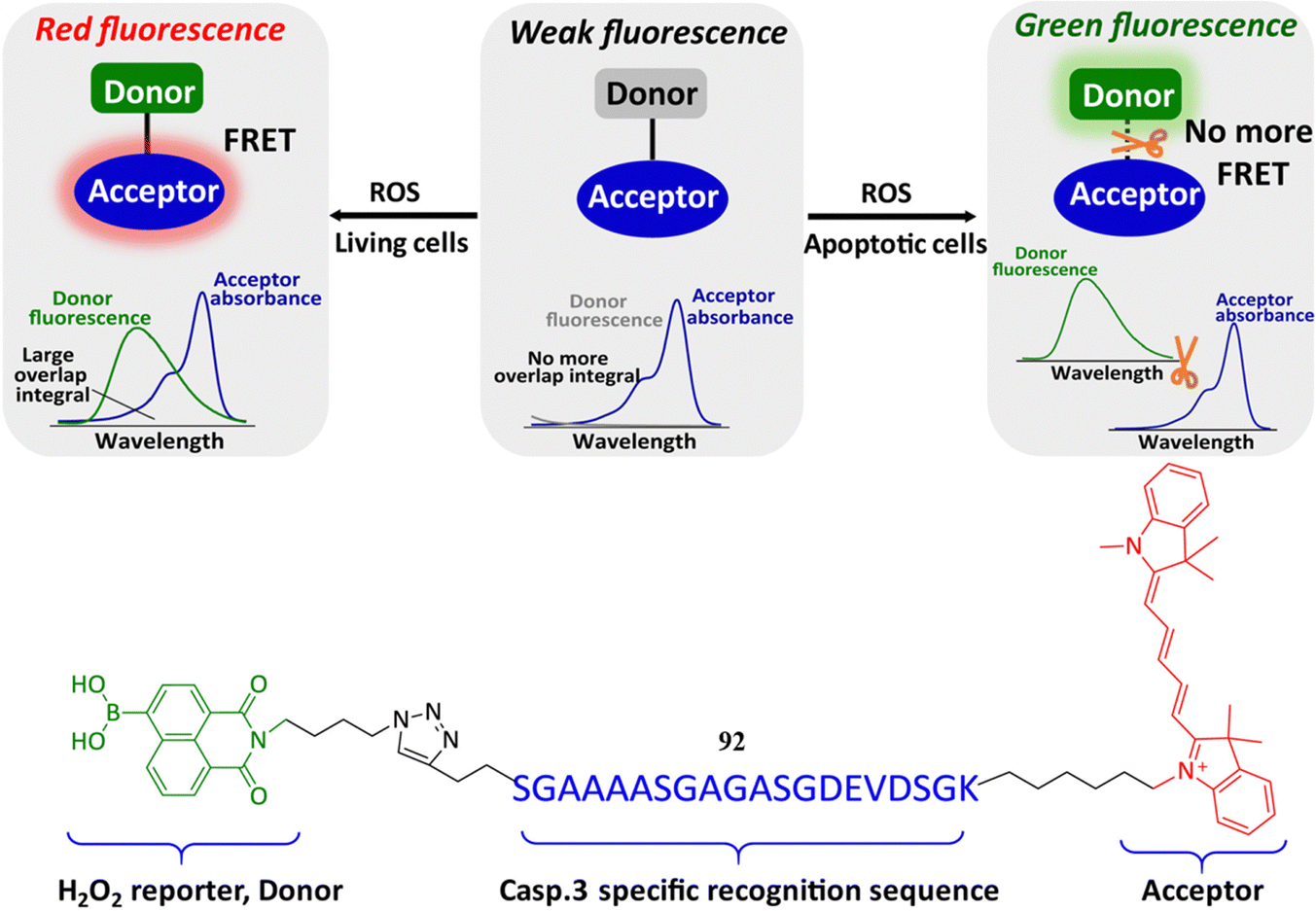
图 52 探针 92的化学结构以及对 H2O2 和 Caspase-3 的反应机制。
为了深入探究超氧化物(O2·-)与pH值在线粒体功能异常及关联细胞凋亡过程中的关键作用,Tang研究团队研发了一款新型荧光探针93,能够实现对O2·-与pH值的同步成像。在相同的TP激发条件下,探针93能够针对O2·-和pH值产生两种截然不同的荧光信号。此外,该探针还展现出出色的选择性、优异的光稳定性和良好的生物兼容性。尤为关键的是,借助探针93,研究团队发现线粒体复合物I和II能够调控Drp1缺陷细胞中的O2·-和pH水平,进而触发线粒体过度充盈及细胞凋亡过程。
另一方面,Pu等人报道了一款无交叉干扰的双通道荧光近红外探针94,该探针基于相同的近红外荧光染料CyOH,用于实现药物诱导肝毒性(DIH)中O2·-与caspase-3的多重成像。探针94由O2·-可裂解片段与caspase-3激活序列DEVD组成,通过CyOH与近红外荧光发射的连接,旨在探讨氧化应激与细胞凋亡之间的相互作用。在与caspase-3体外孵育后,探针在710nm波长处的近红外荧光信号显著增强,强度约是背景信号的12倍。对药物诱导肝毒性小鼠进行实时近红外荧光与CHL成像的结果显示,O2·-水平的升高远早于细胞凋亡事件的发生,这一发现强调了氧化应激在DIH早期诊断中的重要性。

图 53 (A) 探针 93 的结构和机制。 (B) 探针94的结构和机理; (C)探针94在活体小鼠体内的图像。
Feng研究团队在2021年报道了一款创新的双响应荧光探针95,该探针能够同时检测线粒体内的谷胱甘肽(GSH)水平和微环境粘度。正如预期,探针95在535/650nm波长处对线粒体GSH呈现显著的绿色荧光增强,而在627nm波长处对线粒体粘度则表现出红色荧光增强。鉴于其高选择性、高灵敏度、低细胞毒性和特异的线粒体靶向能力,该探针得以应用于生物系统中。通过探针95的应用,研究人员成功验证了线粒体内的内源性与外源性GSH以及粘度的存在。此外,探针还检测到了在顺铂诱导的细胞凋亡过程中GSH与粘度的升高,这一发现深化了对线粒体GSH水平与微环境变化在细胞凋亡进程中作用的理解。
2022年,Zhou及其合作者基于精心设计的分子结构,开发了一系列双响应荧光探针,旨在亚细胞器水平上同时监测二氧化硫(SO2)与微环境粘度。其中,探针96在与SO2和粘度反应后,展现出更长的发射波长和更强的荧光信号。探针96同样具备良好的选择性、灵敏度和特异的线粒体靶向能力。尤为重要的是,探针96成功应用于线粒体功能障碍及细胞凋亡过程中线粒体SO2与微环境粘度的成像,揭示了两者之间可能存在内在联系,为理解线粒体在细胞凋亡机制中的作用提供了新视角。
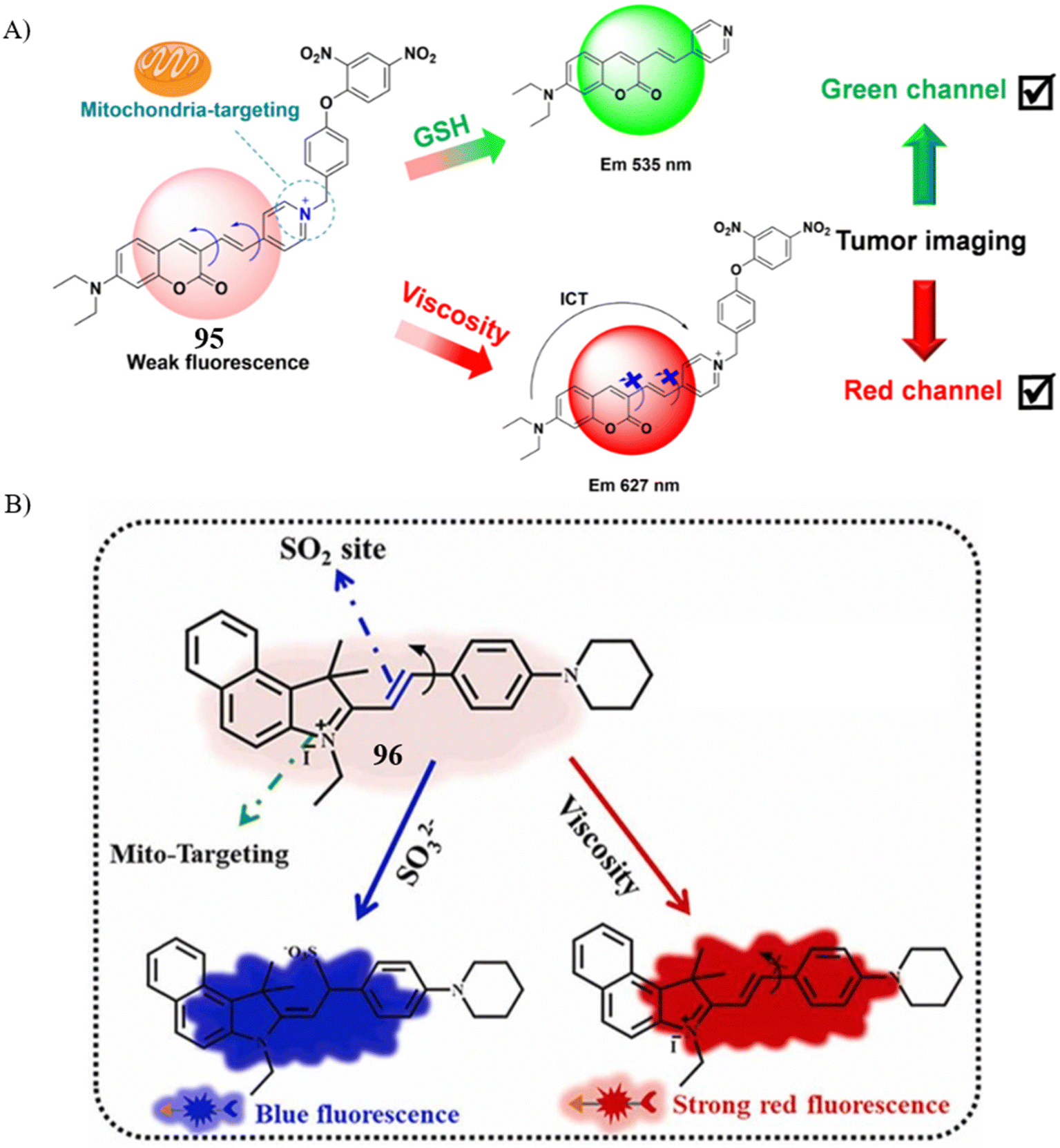
图 54 (A) 探针 95 的结构和机理;(B)96 的结构和机理。
8. 结论与展望
细胞凋亡作为一项受严格基因调控的死亡程序,与生理及病理条件均息息相关。鉴于凋亡路径间复杂的交互作用,辨识特定生化过程的路径构成了重大挑战。深入了解细胞凋亡的分子机制及其病理学意义,对于疾病机制的阐明、健康与凋亡细胞的区分以及基于凋亡途径的药物筛选和疗效评估至关重要。
鉴于其高信噪比、实时无创可视化及超高的空间分辨率优势,SMFPs已成为研究细胞凋亡过程的理想选择。在过去15年间,凋亡成像SMFP在开发对各类指标响应的探针方面取得了显著进展。本文综述了文献中代表性案例,依据凋亡进程中不同的检测目标,大致分为酶活性、质膜变化、活性氧(ROS)波动、活性硫物种(RSS)波动及病理生理微环境变化五大类。SMFP主要分为两大类:一类基于特定生物标志物变化设计,用以检测细胞凋亡进程;另一类则基于凋亡过程中可能变动的生物标志物设计,同样用于监测细胞凋亡。Caspase-3/7作为细胞凋亡的特异性生物标志物,SMFPs如2、5、6等含DEVD肽序列,用于实时检测凋亡进程及揭示疾病机制。探针1、3和4可用作筛选潜在凋亡诱导药物的化学工具,而18、19等探针则可能作为治疗前体,对与凋亡相关疾病诊断及药物疗效评估具有重要意义。其他重要酶活性,如胆碱酯酶响应的24、ATPase成像的27等,也受到关注。磷脂酰丝氨酸水平变化的探针28、细胞颗粒变化区分凋亡与坏死的36、监测膜电位变化的37至43等,为凋亡机制研究提供了新视角。HClO水平监测凋亡程度的44和45、揭示过氧化氢与凋亡关联的46、二氧化硫作为潜在标志物的51和52等,均扩展了凋亡研究的深度。基于极性、粘度、pH值变化的SMFP,如线粒体凋亡成像的57、溶酶体凋亡的58和59,以及粘度变化监测凋亡模式的65,为凋亡研究提供了有力工具。pH值响应的SMFP,如78-81、82、85、87、88和89,在药物发现中应用广泛。多功能SMFP如93揭示O2·-与pH值在线粒体功能障碍及凋亡中的作用,94展示O2·-比caspase-3更早上调的现象。
尽管领域内取得显著进步,挑战依然存在:特异性生物标志物如caspase-3/7之外的标志物识别、可见光谱内发射波长的限制、识别基团选择性不足、针对不同细胞器探针的缺乏、以及缺乏明确生物标志物来区分凋亡与其他死亡方式。未来研究需优化SMFP,提高其监测能力,如设计更高效的caspase-3识别单元、优化荧光团结构以实现近红外-I/II区发射、提高识别单元特异性或开发多指标SMFP、丰富靶向性能以追踪不同细胞器、以及开发多模态成像SMFP以提高检测灵敏度和准确性。
总之,SMFP作为细胞凋亡检测的关键化学工具,其未来研究应聚焦于追踪更特异、更分化的生物标志物。开发高选择性、多功能的SMFP对于药物筛选和疾病诊断具有重要意义。回顾过去15年,基于特定与潜在生物标志物的SMFP研究为细胞凋亡机制的深入理解奠定了基础,期待未来优秀SMFP的应用将进一步推动人类健康事业的发展。