【癌症荧光探针】用于癌症诊断的荧光探针
Fluorescent Probes for Disease Diagnosis
疾病诊断荧光探针
恶性肿瘤,作为人类生命健康的重大威胁,每年在全球范围内新增病例和死亡人数高达数千万。其中,乳腺癌、肺癌和结肠直肠癌是最常见的几种类型,它们的产生往往受到环境和遗传因素的共同影响。据世界卫生组织(WHO)的预测,到2035年,全球每年新增的癌症病例将突破2000万例,而癌症导致的死亡人数也将超过1400万。
然而,值得欣慰的是,近年来社会与科技的飞速发展极大地提升了癌症的存活率。特别是在肿瘤早期发现的情况下,患者的存活率可达到三分之一。这一进步主要得益于癌症酶、小分子生物标记物等关键指标的发现,它们为癌症的快速诊断提供了有力支持。
本节将深入探讨这些生物标记物以及荧光成像工具在癌症诊断领域的最新进展(如表2所示)。我们特别关注乳腺癌、肝癌、肺癌、卵巢癌和宫颈癌等常见癌症类型,并研究如何通过荧光成像技术实时监测这些癌症中的关键和常见生物标记物,以期为癌症的早期诊断与治疗提供更为精准和有效的手段。
| probe | λex /λem (nm) | LOD | bioactive molecule | biological model |
|---|---|---|---|---|
| Breast Cancer | ||||
| 56 | 365/532 | 1O2 | MDA-MB-468 cells | |
| 57 | 480/505 | 0.56 nM | HClO | MCF-7 cells |
| 58 | 781/800 | hydroxyapatite (HA) | rat breast cancer microcalcification | |
| 59 | 646/664 | cysteine protease activity | 4T1 syngeneic orthotopic mouse breast tumors | |
| 60 | 690/710 | GGT and caspase-1 | 4T1-tumor-bearing Balb/c mice | |
| 61 | 530/600 | phosphatidylserine (PtdSer) | MMTV-PyMT breast cancer mice | |
| 62 | 675/710 | granzyme B | 4T1 tumor-bearing Balb/c mouse | |
| 63 | 465/665 | GSH | BCap-37 tumor xenograft mice | |
| 64 | 650/725 | 1.5 × 10–5 U/mL | urokinase-type plasminogen activator (uPA) | MDA-MB-231- and MCF-7- tumor-bearing mice |
| 65 | quiescent cancer stem cells (CSCs) | AS-B145-1R cells | ||
| Liver Cancer | ||||
| 66 | 445/650 | 0.13 ng/mL | CD13/aminopeptidase N (APN) | Balb/c mice bearing HepG-2 xenograft tumor |
| 67 | 406/532 | phosphatase | HepG2 cells | |
| 68 | 428/540 | 50 nM | mitochondrial thioredoxin (Trx) | HepG2 cells, HeLa cells |
| 69 | 438/538 | thioredoxin reductase (TrxR) | HepG2 cells | |
| 70 | 450/564 | 0.02 nmol/mL (CYP1A2) 0.05 nmol/mL (CYP1A1) | cytochrome P450 1A (CYP1A) | rat liver slice, HepG2 cells, A549 cells |
| 71 | 405/519, 558, 593 | N/A | HepG2 cells, LO2 cells, 7721 cells | |
| Lung Cancer | ||||
| 72 | 620/680 | 10.6 nM (HClO), 7.9 nM (ONOO–), 0.14 μM (HO·) | hROS: HClO, HO, and ONOO– | A549 cells, HeLa cells tumor-bearing mouse xenograft mice |
| 73 | 769/788 | nitroreductase (NTR) | A549 cells, A549 tumor mouse | |
| 74 and 75 | 675/710 | pH | A549 tumor mouse | |
| Ovarian Cancer | ||||
| 76 | 510/582, 450/556 | GGT | OVCAR5 and SKOV-3 cells, HUVEC cells | |
| 77 | 498/518 | β-galactosidase | ovarian cancer cells and tumor-bearing mice (SHIN3, SKOV3, OVK18, OVCAR3, OVCAR4, OVCAR5 and OVCAR8) | |
| 78 | 300/546, 616 | lysophosphatidic acid (LPA) | ||
| Cervical Cancer | ||||
| 79 and 80 | Probe1: | Hcy, Cys, GSH, SO2 | HeLa tumor-bearing mice | |
| 380/480, 625 | ||||
| 450/545, 625; | ||||
| Probe2: | ||||
| 380/465, 635; | ||||
| 380/450, 635 | ||||
| 450/540, 635; | ||||
| 450/535, 635 | ||||
| 81 | 403/557 | lysosomal ATP | HeLa cells | |
| 82 | 457/547 | 0.11 μg/mL | COX-2 | HeLa, MCF-7, and HEK293 cells |
| 83 | caspase-3/7 | HeLa tumor-bearing mice | ||
| 84 | 674/694 | caspase-3/7 | HeLa cells | |
| Other | ||||
| 85 | 510/590 | ATP | OSCC cells | |
| 86 | 405/540 | senescence-associated βgal (SAβgal) | SK-MEL-103 tumor-bearing mice | |
| 87 | 450/500, 685 | 1.7 × 10–4 U mL–1 | β-galactosidase (β-gal) | LoVo tumor-bearing mice |
| 88 | 463/555,615 | COX-2 | tumors in mice (MKN45, BEL7402, MDA-MB-231) | |
| 89 | 783/840 | Monoamine oxidase A (MAOA) | C4–2B tumor xenografts in mice | |
| 90 | 620/665 | matrix metalloproteinases (MMPs) | HT-1080 tumor-bearing nude mouse | |
| 91 | 490/545 | acylprotein thioesterases (APTs) | HEK293T, A431, MDA-MB-231 and MCF-7 cells | |
| 92 | 410/550 | 1.36 U/L | alkaline phosphatase (ALP) | U-2OS and Saos-2 cells, HeLa and HepG2 cancer cells |
| 93 | 675/694 | matrix metalloproteinase (MMP) | HT1080 tumors mice and BT-20 tumors mice | |
| 94 | 455/500, 650/680 | 0.74 nM | pH and matrix metalloprotease-9 (MMP-9) | LS180 tumor-bearing mice |
【癌症荧光探针】用于乳腺癌诊断的荧光探针
Fluorescent Probes for Disease Diagnosis
疾病诊断荧光探针
乳腺癌,作为全球范围内最为普遍的恶性肿瘤之一,平均每十名女性中就有一人在其生命旅程的某个阶段面临罹患的风险。尽管近年来,得益于早期诊断技术的进步和有效治疗策略的实施,乳腺癌的死亡率已显著下降,但这一领域仍有待于进一步的优化和提升(如图24所示)。  图 24.部分乳腺癌荧光探针。
图 24.部分乳腺癌荧光探针。
在癌症的复杂机制中,与神经系统疾病相似,ROS(以及RNS)和更广泛的氧化应激扮演着核心角色。2017年,Boyle等人基于BODIPY-anthracene的二体结构设计出荧光探针56,用于细胞内单线态氧(^1O₂)的实时监测。该探针在激发状态下,通过光诱导电子转移(PeT)产生局部激发的三重态,进而与分子氧反应生成^1O₂。随后,^1O₂与蒽反应,依次生成蒽过氧化物、蒽环氧化物和多环乙醛,从而释放出明亮的荧光信号。
在癌症环境中,HClO同样普遍存在。2014年,Peng等人报道了一种高灵敏度的荧光探针57,专门用于监测癌细胞中HClO的生成。该探针以BODIPY荧光团为基础,通过吡咯基团实现对HClO的特异性识别。在无分析物存在时,由于PeT效应,荧光被淬灭;而当遇到强氧化性的HClO时,吡咯基团被氧化,阻断PeT过程,荧光随即”点亮”。探针57具有极低的检测限(0.56 nM)和快速的响应时间(<1秒),使其成为监测肿瘤细胞中HClO水平变化的理想工具。通过此探针,研究人员成功对依来氯莫尔诱导的MCF-7细胞中HClO随时间变化的升高进行了成像,为实时监测肿瘤中HClO浓度提供了有力的技术支撑。
2008年,Frangioni小组成功设计并合成了SPECT/NIR双模式荧光探针58,用于羟基磷灰石(HA)的成像研究。该探针以氰基为荧光团,通过双磷酸盐实现对HA的特异性识别。与其他钙盐相比,探针58对HA的反应速度快了8倍。通过荧光成像和SPECT分析,研究团队在乳腺癌大鼠模型中成功观察到骨形态发生蛋白-2(BMP-2)的异位表达。
半胱氨酸蛋白酶家族在细胞生理及包括乳腺癌在内的多种人类疾病中发挥着重要作用。2013年,Bogyo小组报道了一类新型淬灭荧光探针(如探针59),这些探针通过高度亲电的苯氧甲基酮亲电“弹头”与被分析物的活性位点亲核物发生反应。该研究团队通过改进的连接剂,将具有光活性的Cy5和QSY21连接起来,实现了无目标分子时的高效佛斯特共振能量转移(FRET)荧光淬灭。当半胱氨酸蛋白酶存在时,多肽序列被裂解,释放出淬灭剂,导致荧光信号的恢复。与先前探针相比,探针59在溶解性和体内特性上均有所改进,对更多半胱氨酸螯合蛋白具有更广泛的反应活性,显著提高了标记和肿瘤成像的效果。在活体荧光成像实验中,该探针成功区分了乳腺癌小鼠与正常小鼠之间半胱氨酸蛋白酶活性的差异,为开发此类淬灭荧光探针提供了重要的工具和思路,并在传感领域得到广泛应用。
程序性细胞死亡(PCD)的实时成像对于癌症发展、治疗、抗药性机制及个性化治疗方案的监测至关重要,因为PCD逃避是癌症的典型特征。因此,2023年,Pu等人研发了一种双锁串联激活的近红外荧光探针60,用于小鼠肿瘤细胞热凋亡的监测。 该探针以Cy5为荧光团,并通过改性PEG增强其水溶性。通过连接γ-谷氨酰转肽酶(GGT)和Casp1的多肽序列,形成探针60。在肿瘤细胞内,探针依次被Casp1和GGT酶切割,恢复分子内电荷转移(ICT)并在710纳米波长处恢复荧光。利用探针60,研究人员成功观察了乳腺癌的热休克水平,并对癌症免疫疗法进行了实时评估。此外,该探针还能区分肿瘤内和正常的热蛋白沉积,为利用光学成像评估潜在抗癌药物的热原活性提供了有力工具。
2022年,Vendrell等人针对PCD的另一重要方面进行了深入研究,他们开发了荧光探针61,用于快速检测化疗诱导的细胞凋亡。该探针采用对环境敏感的BODIPY作为荧光单元,结合先前开发的凋亡肽作为靶向单元。其中,环肽能够高效结合凋亡细胞膜,而不与健康细胞结合。一旦结合,周围环境的极性发生显著变化,导致BODIPY荧光团发出以600纳米为中心的亮红色荧光。探针61在体外和体内均能以良好的选择性快速识别凋亡细胞与健康细胞。探针60和61均为细胞死亡成像提供了卓越的显像效果,为区分健康细胞与凋亡/猝死细胞提供了有力工具,并为研究癌症中不同的PCD机制及更好地理解治疗效果的本质提供了重要手段。
免疫激活的实时成像在癌症免疫疗法和药物发现中扮演着举足轻重的角色。然而,当前多数应用于此领域的探针均基于持续发光的荧光团设计,导致荧光反应与免疫反应之间的关联性不佳。为克服这一局限,Pu等人于2020年成功研发出一种针对颗粒酶B的近红外大分子荧光探针62,特别适用于癌症免疫疗法的实时评估。该探针巧妙结合了青色荧光团与颗粒酶B特异性多肽,其荧光变化与肿瘤组织中细胞毒性T淋巴细胞(CD8+)和T辅助细胞(CD4+)的活性密切相关。这种探针不仅能通过被动靶向方式渗透小鼠肿瘤细胞,且展现出了极高的肾清除效率,24小时内清除率高达60%。这一创新探针为监测肿瘤免疫疗法效果提供了强有力的工具,有望推动免疫疗法的进一步发展。
在药物开发中,了解原药的生物分布和体内活化机制至关重要。为此,Zhu等人于2014年设计了一种针对乳腺癌研究的探针63。他们通过二硫键将二氰基甲基-4H-吡喃衍生的近红外荧光团与抗癌剂喜树碱(CPT)相连,并巧妙地将此系统嵌入纳米颗粒之中。当肿瘤细胞内的GSH浓度升高时,连接体会被裂解,从而释放抗癌剂CPT并激活荧光信号,实现药物分布的实时监测。体内实验证实,探针63不仅展现出与CPT药物本身相当的治疗效果,还具备通过近红外荧光追踪药物释放的能力。
针对浸润性和非浸润性乳腺癌的区分问题,Pu和Miao等人于2020年设计出一种特异性响应浸润性乳腺癌中过表达尿激酶型纤溶酶原激活剂(uPA)的荧光探针64。该探针在酰胺键裂解去除靶向肽后,通过激活ICT机制,触发近红外荧光和PA信号。值得一提的是,探针64采用了葡聚糖骨架设计,不仅提升了溶解性,还确保了化合物能够顺利通过肾脏清除,从而极大降低了潜在毒性。葡聚糖骨架及其在传感和治疗学中的应用将在后续部分进行深入探讨。
尽管识别和分离癌症干细胞(CSC)在癌症治疗中具有重要意义,但受限于当前成像技术的局限性,这一目标尚未得到有效实现。2015年,Chang和Yu等人成功研发出一种名为荧光纳米金刚石(FND)的材料(探针65),旨在追踪和定位缓慢增殖/静止的癌干细胞(如图25所示)。该探针由具有高发光性能的CuInSe2/ZnS核/壳量子点和肿瘤靶向肽(Cys-Gly-Lys-Arg-Lys,CGKRK)组成。体外实验表明,探针65不仅具有优异的光稳定性和良好的生物相容性,还能准确量化乳腺癌细胞系的干细胞频率,为分离这些关键干细胞提供了重要支持。 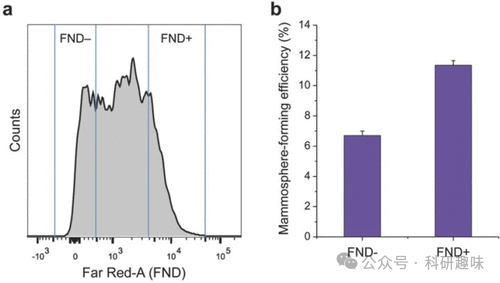 图 25.荧光纳米钻石阳性细胞(FND+)和荧光纳米钻石阴性细胞(FND-)的流式细胞分析(a)和乳球形成效率(b)。
图 25.荧光纳米钻石阳性细胞(FND+)和荧光纳米钻石阴性细胞(FND-)的流式细胞分析(a)和乳球形成效率(b)。
【癌症荧光探针】用于肝癌诊断的荧光探针
Fluorescent Probes for Disease Diagnosis
疾病诊断荧光探针
肝癌,作为全球面临的重大健康挑战,不仅是第四大死因,更是第六大常见癌症。其中,肝细胞癌(HCC)以其超过80%的诊断比例,成为了肝癌中发病率最高的类型。肝癌的形成往往与肝脏的损伤和疤痕紧密相关,这些损伤可能源于慢性炎症、酗酒、肝炎或脂肪肝等多种因素。由于肝癌的早期症状往往难以察觉,许多患者往往在病情发展到中期或晚期时才被确诊,这无疑为治疗带来了极大的困难,进而影响了患者的预后效果。因此,肝癌的早期检测显得尤为重要,这为实现早期干预提供了可能。例如,通过荧光检测技术来识别与癌症相关的生物标记物,已成为一种有效的肝癌早期诊断方法(如图26所示)。  图 26.肝癌、肺癌和卵巢癌的部分荧光探针。
图 26.肝癌、肺癌和卵巢癌的部分荧光探针。
癌症治疗中的一大难题在于复发风险,这往往源于手术切除的不完全性。因此,开发一种能够精准、快速地识别正常组织与肿瘤组织的工具显得尤为重要,因为它能有效降低癌症复发的风险。在胶质瘤的治疗中,CD13/氨基肽酶N(APN)作为一个关键的特异性标志物,因其与肝癌发展和转移密切相关而受到关注。基于此,Peng等人于2020年成功研发了APN响应型荧光探针66,旨在通过监测内源性APN活性来指导手术过程。 探针66的设计巧妙结合了二氰基异佛尔酮荧光团作为信号报告单元和l-丙氨酸元素作为识别位点。当探针与APN作用时,l-丙氨酸被特异性裂解,释放出二氰基异佛尔酮的胺基,从而触发ICT效应,在650纳米波长下发出强烈荧光。通过原位喷涂此探针,研究人员能够清晰地区分肿瘤组织与正常组织,并在皮下肿瘤、肝脏和脾脏转移瘤中分别获得了13.86、4.42和6.25的荧光强度比(肿瘤/正常,T/N)。尤为重要的是,探针66能够精确识别和切除小于1毫米的肿瘤转移灶,为癌症诊断和图像引导手术提供了新的可能。
在癌症诊断领域,Yao等人于2012年开发了一种名为TP荧光探针67的创新工具,用于内源性磷酸酶活性的成像研究。该探针通过在2-羟基-4,6-双(4-羟基苯基)嘧啶染料的两个酚羟基单元上连接吸电子的磷酸基团,实现了对荧光的抑制。当探针67与磷酸酶作用时,这些磷酸基团发生水解,从而恢复了荧光,为内源性磷酸酶活性的监测提供了直观的信号。利用这一探针,研究人员不仅成功观察到了肝癌细胞内磷酸酶活性的变化,还将其应用于果蝇大脑中100μm深度内的磷酸酶活性成像。
Kim及其团队于2012年设计了一种名为探针68的线粒体靶向荧光探针,旨在用于线粒体硫代氧化酶(Trx)活性的成像分析。该探针结合了萘二甲酰亚胺荧光团、三苯基膦线粒体靶向单元以及作为荧光开关的二硫键。在Trx的作用下,二硫键被还原性裂解,生成硫醇,进而对邻近的氨基甲酸酯进行分子内攻击,释放出荧光氨基萘二甲酰亚胺。通过这一机制,探针68能够在低至53 nM的浓度下检测到Trx,使研究者能够观察到HepG2癌细胞线粒体中Trx的活性。这一发现为深入理解Trx的生物功能提供了新的视角。
与Trx相关的研究不同,Fang等人在2014年设计了一种名为探针69的新型荧光探针,用于检测哺乳动物硫氧还蛋白还原酶(TrxR)。该探针由萘二甲酰亚胺荧光基团和1,2-二噻烷反应“传感”单元组成。在还原性条件下,二硫键被裂解,释放出游离硫醇,进而对邻近的氨基进行脱保护,从而恢复荧光氨基萘二甲酰亚胺的荧光。探针69具有高灵敏度和良好的选择性,能够区分不同TrxR活性的细胞提取物。此外,通过荧光细胞成像实验,研究人员发现荧光信号随肿瘤细胞中TrxR活性的变化而变化,为筛选TrxR抑制剂和进一步探索TrxR介导的生理过程提供了有力的工具。
在药物代谢和毒性评估方面,Yang等人于2015年报道了一种比率型TP荧光探针70,用于检测人类细胞色素P450 1A(CYP1A)。通过对萘二甲酰亚胺核心进行C-4取代基筛选,研究人员成功调节了系统的ICT荧光特性。其中,甲氧基对CYP1A具有良好的亲和力,而N-羧丙基取代基则赋予了探针对CYP1A而非其他CYP同工酶的高度选择性。在CYP1A的作用下,探针70通过甲氧基C-O键的氧化裂解转化为释放荧光的4-羟基萘二甲酰亚胺。体外实验表明,随着CYP1A浓度的增加,452纳米波长处的荧光逐渐降低,而564纳米波长处的荧光则相应增加。这一特性使得探针70能够在HepG2细胞和肝细胞等癌症相关细胞实验中按比例测定CYP1A的浓度。
2021年,Tang等人成功研发了一种基于氧化石墨烯的荧光纳米材料(探针71),专门设计用于体内肝癌的高效诊断与治疗。该创新材料由几个关键组件构成:首先,通过自组装技术,适配体修饰的ssDNA形成稳定的DNA四面体(DNA-tetra)结构;其次,该结构被赋予化疗药物多柔比星(DOX)和基于聚集诱导发光(AIE)的荧光团DSAI。这一设计中,DOX与DSAI间的荧光共振能量转移(FRET)过程显著增强了DOX的荧光信号,使得整个纳米材料在激发下发出明亮的红色荧光。
值得注意的是,ssDNA支架上的发夹型适配体修饰使其能够与氧化石墨烯表面形成紧密的氢键结合,进而有效地淬灭荧光信号。然而,当探针71进入肝脏肿瘤细胞时,由于细胞内部环境的特异性,适配体与DNA纳米材料一同从氧化石墨烯表面释放,同时释放出DOX和DSAI,不仅引发了强烈的荧光信号变化,还触发了对癌细胞的杀伤作用。
在体外和体内实验中,探针71均展现出了优异的生物相容性,这为其在肝癌成像诊断与治疗领域的应用提供了强有力的支持。这种新型多功能材料不仅为肝癌的诊断提供了高灵敏度和高特异性的工具,还通过其携带的化疗药物实现了对癌细胞的直接杀伤,展现了在癌症治疗领域的巨大潜力。此外,这种组合材料的成功开发也为未来开发用于药物输送、疾病诊断与治疗的多组分材料提供了有益的启示。 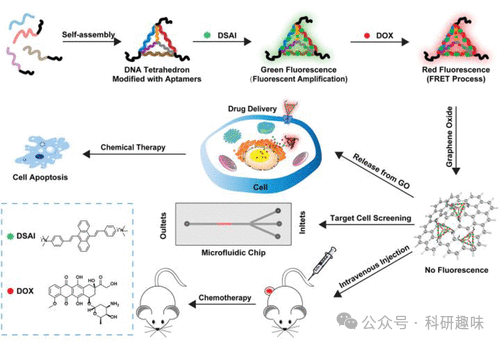 图 27.用于诊断和治疗肝癌的氧化石墨烯荧光 DNA 材料(探针 71)。
图 27.用于诊断和治疗肝癌的氧化石墨烯荧光 DNA 材料(探针 71)。
【癌症荧光探针】用于肺癌诊断的荧光探针
Fluorescent Probes for Disease Diagnosis
疾病诊断荧光探针
根据世界卫生组织(WHO)的统计数据,2020年新增肺癌患者预计将超过221万,且肺癌死亡人数将超过180万,使肺癌成为最具致命性的癌症之一。当前,肺癌的主要致病因素包括吸烟、慢性肺炎以及环境暴露。肺癌的临床表现错综复杂,其症状主要取决于肿瘤的具体位置和类型。类似肝癌,肺癌的早期症状往往轻微甚至无明显症状,因此实现早期发现成为一项重大挑战(图 26)。
在活性氧种类(ROS)研究领域,Guo等人于2017年开发了探针72,该探针被设计用于特异性成像肺肿瘤细胞溶酶体中的ROS。探针72中的Si-罗丹明荧光核心通过与之相连的吡咯的光诱导电子转移(PeT)效应被淬灭。吡咯部分易于被高活性ROS如HOCl、-OH和ONOO-等氧化(类似于乳腺癌探针60),从而中和淬灭作用,使探针在680纳米处发出强烈的红色荧光信号。探针72对自氧化和光氧化均展现出良好的稳定性。在β-拉帕酮刺激的非小细胞肺癌人体模型中,该探针成功实现了对癌细胞溶酶体中ROS变化的实时成像,有力证明了其区分正常细胞和癌细胞的能力。
Li和Feng等人于2015年开发了探针73,这是一种基于近红外波段的荧光探针,用于检测缺氧肿瘤中硝基还原酶(NTR)的活性。经过对五种不同修饰的氰基染料衍生探针的探索,作者最终选择了探针73的设计。探针73的特征结构为对硝基苯甲酸酯,该结构在NTR的作用下被还原为对氨基苯甲酸酯,从而导致荧光显著增强。体外研究表明,探针73在NTR作用下荧光增强达110倍,表现出良好的响应性。细胞和体内实验进一步证实,这种荧光探针能够特异性地成像肿瘤中的NTR,并可用于描述肿瘤部位的缺氧状态。这充分表明,许多简单合成、成本较低的传感器/化学模拟物在复杂生物分子过程的研究中能够产生卓越的效果,并为我们提供深刻的见解。
最后,鉴于pH值在肿瘤微环境中的重要性,Gao等人于2014年开发了一种对pH值敏感的纳米探针,用于检测小鼠体内的肿瘤组织(图 28)。他们的纳米探针(探针74和75)由三个关键部分组成:一个独特的pH敏感疏水胶束作为核心、RGD序列作为靶向基团以及青色荧光团。每个纳米粒子所包含的pH识别单元和荧光单元的数量均经过精确优化,以实现最佳响应性能。利用这种探针,研究人员能够准确地区分肿瘤组织和正常健康组织。 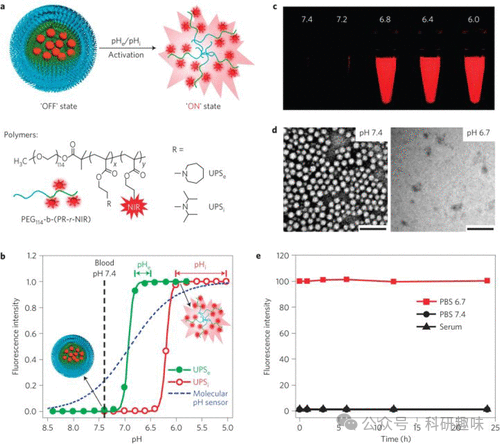 图 28.(a) UPSe(探针 74)和 UPSi(探针 75)的结构。(b) UPSe 和 UPSi 纳米探针的归一化荧光强度与 pH 值的函数关系。(c) UPSe-Cy5.5 纳米探针溶液在不同 pH 值缓冲液中的荧光图像。(d) UPSe 纳米探针的透射电子显微照。(e) UPSe 纳米探针的稳定性实验。
图 28.(a) UPSe(探针 74)和 UPSi(探针 75)的结构。(b) UPSe 和 UPSi 纳米探针的归一化荧光强度与 pH 值的函数关系。(c) UPSe-Cy5.5 纳米探针溶液在不同 pH 值缓冲液中的荧光图像。(d) UPSe 纳米探针的透射电子显微照。(e) UPSe 纳米探针的稳定性实验。
【癌症荧光探针】用于卵巢癌诊断的荧光探针
Fluorescent Probes for Disease Diagnosis
疾病诊断荧光探针
尽管卵巢癌的发病率相较于其他已讨论的癌症类型较低,但其致死率却异常高。这主要归因于卵巢癌发病机制尚不清晰,且疾病在确诊前即存在极高的转移风险,导致预后效果极差(图 26)。
在2015年,Fan等人成功研制出两种新型荧光探针76(其中R代表CO2Et或Me),这些探针旨在特异性成像肿瘤细胞中的γ-谷氨酰转肽酶(GGT)。这些探针的分子结构由GGT特异性GSH单元和BODIPY荧光团组成。当探针穿透细胞后,GGT会裂解GSH链上的谷氨酸,通过SNAr机制触发分子内的S-N重排,生成氨基取代的BODIPY-Cys,其荧光强度显著增加(约12倍)。利用这一特性,Fan等人成功地将卵巢癌细胞与正常细胞区分开来。
同年,Urano等人介绍了一种基于罗丹明的高灵敏度β-半乳糖苷酶荧光探针77,该探针的设计基于优化罗丹明核心的内酯-齐聚物平衡。通过精细的结构调整,探针的pKcycl值被精确调整至约5.4,这使得探针在pH 7.4的缓冲液中几乎完全(大于99%)以无荧光的螺环形式存在,有效降低了基于罗丹明系统的常见背景荧光问题。研究结果显示,该探针能在体外选择性地检测β-半乳糖苷酶的活性。更重要的是,作者通过开发七种卵巢转移癌小鼠模型,持续观察到癌症的转移情况。这种探针及其他类似探针有望在卵巢癌检测中找到临床应用,同时,其支架的灵活性也为多种肿瘤相关活性酶的检测提供了可能。
此外,Zaworotko等人在2015年开发了两种具有Rho拓扑结构的镧系沸石类金属有机框架(Ln-ZMOFs),具体为探针78(图 29)。这些材料通过4联镧系元素分子构建模块和联吡啶-二羧酸配体的自组装合成,展现出良好的合成便利性。通过调整Tb3+与Eu3+(会产生延迟的镧系元素中心发射)的比例,该材料能够高效检测溶血磷脂酸,这是一种血浆中卵巢癌的生物标志物。这一设计为发光混合晶体Ln-MOF的开发提供了新的思路,并有望催生一系列新的工具,在肿瘤检测领域发挥重要作用。 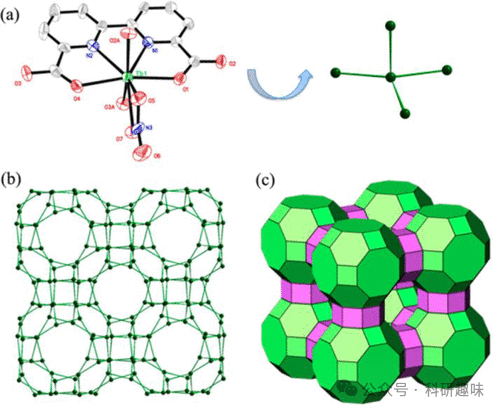 图 29.(a) Tb-ZMOF 的晶体结构(探针 78)。(b)Tb-ZMOF 中 α 笼和β笼的透视图(点 = Tb3+;线 = 羧基)。(c) Tb-ZMOF 的 rho 拓扑平铺图。
图 29.(a) Tb-ZMOF 的晶体结构(探针 78)。(b)Tb-ZMOF 中 α 笼和β笼的透视图(点 = Tb3+;线 = 羧基)。(c) Tb-ZMOF 的 rho 拓扑平铺图。
【癌症荧光探针】用于宫颈癌诊断的荧光探针
Fluorescent Probes for Disease Diagnosis
疾病诊断荧光探针
宫颈癌作为第四大常见癌症,预计在2020年将新增超过60万例病例,其发病率与高危人乳头瘤病毒(HPV)感染紧密相连。尽管宫颈癌的发病率高,但得益于现代医疗技术的进步,其治疗率也相应提升,即便是晚期宫颈癌患者,通过精心的治疗和切除手术,也能有效遏制肿瘤的生长(图 30)。
在2020年,Yin等人提出了两种新型荧光探针79和80,它们在同一通用支架上通过引入不同的反应位点,实现了对宫颈癌中硫醇和二氧化硫生物标志物的差异化监测(图 31)。这些探针的设计精妙,基于三个关键的反应位点。反应位点一作为两者的共有特征,由双芳醚连接构成,其可以通过与Cys、Hcy或GSH硫醇的相互作用进行裂解,进而产生发出红色荧光的五环吡咯荧光团。随后,这一物质会与反应位点三中的SO32-(SO2供体)发生反应,通过磺酰化作用打破共轭体系,从而抑制红色荧光。而反应位点二则是每种探针所独有的,它涉及与醚连接体裂解产生的硫醇化合物发生分子内反应,形成新的环状硫醚香豆素,并发出蓝色荧光。特别地,在第二个探针中,GSH的加入会触发一系列反应,生成一个含有噻吩和亚胺的绿色荧光物质,该物质在进一步与SO32-反应时会分解。图 31详细展示了这一复杂的级联反应过程。
基于这些独特的荧光变化,Yin等人成功地检测了硫醇及其代谢物。通过体内和体外成像实验,这些探针的实用性和对硫醇、二氧化硫分析物进行差异化检测的能力得到了充分验证。这些成果不仅展示了复杂多位点多活性探针开发的潜力,还为监测复杂和竞争性代谢过程提供了有力的工具,具有广阔的应用前景。 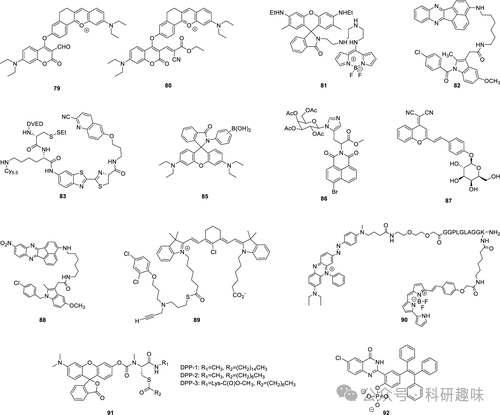 图 30.宫颈癌和其他特定癌症的荧光探针。
图 30.宫颈癌和其他特定癌症的荧光探针。 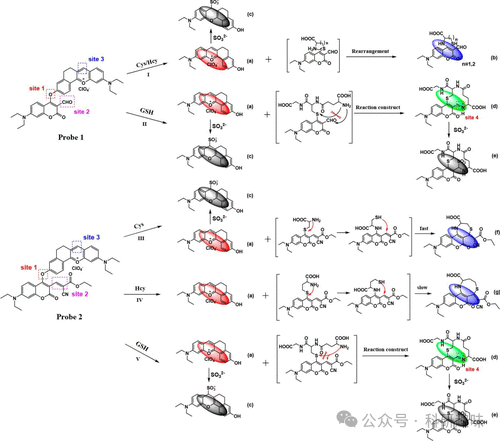 图 31.探针 79 和 80 对硫醇和二氧化硫的反应机制。这些探针会产生几种不同的产物,用小字母表示。
图 31.探针 79 和 80 对硫醇和二氧化硫的反应机制。这些探针会产生几种不同的产物,用小字母表示。
2018年,Ahn等人精心设计了TP荧光探针81,旨在实现溶酶体内ATP浓度变化的成像分析。该探针81巧妙融合了氨基-BODIPY和罗丹明6G两个荧光团,并通过四胺链连接,其中四胺链在ATP识别中扮演了核心角色。在无ATP条件下,探针在403纳米激发下发出454纳米的荧光。然而,当ATP加入时,会触发氨基-BODIPY与罗丹明6G之间的FRET效应,导致探针在557纳米处呈现黄色荧光。Ahn等人利用此探针,成功实时监测了HeLa细胞(一种宫颈癌细胞)中的接吻-奔跑和完全塌陷融合过程,并精确量化了这些过程中溶酶体内ATP浓度的变化。
2013年,Peng等人开发了一种针对癌细胞高尔基体中环氧化酶-2(COX-2)的荧光成像探针82。该探针82结合了荧光团苊[1,2-b]喹喔啉(ANQ)和吲哚美辛(一种高效的COX抑制剂)作为COX-2的靶向基团。在水溶液中,探针呈现折叠构象,ANQ与IMC单元之间的PeT效应导致ANQ荧光淬灭。然而,一旦探针与高尔基体上的COX-2结合,其构象展开,PeT淬灭受到抑制,荧光得以恢复。Peng等人利用探针82成功地对不同细胞中的COX-2活性进行了成像,并快速区分了正常细胞和癌细胞(HeLa细胞)。此外,该探针还可用于观察肿瘤细胞凋亡过程中高尔基体的动态变化。
2014年,Rao等人报道了一种能在体内自组装的小分子荧光探针83,用于caspase活性的成像。该探针83由氨基荧光素支架、连接d-半胱氨酸基团和2-氰基-6-羟基喹啉基团、以及L-DEVD(Asp-Glu-Val-Asp)封顶肽序列组成,其中二硫键用于caspase-3/7介导的裂解和细胞内硫醇介导的还原。该探针可被caspase-3/7选择性激活,进而触发生物正交大环化和纳米聚集,实现对caspase(即细胞凋亡)活性的可视化监测,从而有效评估肿瘤治疗反应。这一设计在HeLa细胞和HeLa肿瘤小鼠模型中均得到了验证。
早在2006年,Kwon等人便报道了一种基于DEVD的纳米颗粒探针84,用于凋亡成像。这些纳米颗粒融合了Cy5.5荧光团和特异性DEVD序列。由于染料与纳米颗粒紧密结合,未激活状态下荧光被淬灭。然而,与酶反应后,肽段被裂解,导致间距增大,荧光淬灭减少,近红外信号得以显现。体外实验表明,该纳米粒子对caspase-3和caspase-7的荧光强度增强了10倍。利用此探针,Kwon等人成功观察到了HeLa细胞中膜囊泡的收缩和形成,实现了对癌细胞凋亡过程的可视化分析和监测。
【癌症荧光探针】用于其他癌症癌诊断的荧光探针
Fluorescent Probes for Disease Diagnosis
疾病诊断荧光探针
在介绍了针对五种最常见癌症的结构和机理各异的荧光探针之后,本小节将介绍一些针对其他各种癌症和肿瘤开发的探针的有趣实例。
2016 年,Chang 等人展示了一种多位点结合荧光探针 85,它能对细胞内 ATP 水平的快速变化做出反应。(156) 罗丹明 B 被用作荧光单元,并引入苯硼酸基团以维持闭环无荧光状态。加入 ATP 后,多种共价和非共价相互作用会促进罗丹明转为 "开放 "形式。其中包括硼酸与 ATP 核糖之间共价形成的硼酸酯、85 的蒽与腺嘌呤 ATP 之间的 π-π 相互作用,以及探针二乙胺基团与 ATP 磷酸单元之间的静电和氢键作用。在开放构型下,探针会发出荧光,从而在与 ATP 结合时发出明亮的红光。体外实验表明,该探针能快速、特异地对 ATP 作出反应,暴露于 ATP 时荧光增强约 18 倍。细胞实验表明,该探针的生物毒性低、细胞穿透性好,并能在线粒体定位。作者利用探针 85 观察了口腔鳞状细胞癌(OSCC)和 HeLa 细胞中 ATP 水平的变化。值得注意的是,由于大多数传感相互作用的非共价性质以及硼酸酯形成的易逆性,传感事件很容易逆转,例如,加入吡咯酶(ATP水解酶)就能逆转过程,并通过从系统中去除ATP来关闭荧光,从而使探针85以封闭的螺环形式再生。
2017 年,Martinez-Manez 和 Serrano 设计了一种 TP 荧光探针 86,用于观察体内肿瘤细胞的衰老。(157)作者在 l-组氨酸甲酯的 N 端添加了荧光萘二甲酰亚胺,然后将乙酰化半乳糖连接到氨基酸的咪唑环上,得到了荧光探针。在细胞中,糖苷被β-半乳糖苷酶裂解,释放出荧光团,产生286倍的荧光增强效果。作者利用 palbociclib 诱导 SK-MEL-103(人类黑色素瘤)细胞衰老(老化),使用探针 86 可以观察到这一现象,从而证明了它能够靶向衰老细胞并对其成像。当将该探针注射到用帕博西尼诱导衰老的皮下黑色素瘤小鼠模型中时,发现探针在肿瘤部位发出荧光,从而可以识别和观察所述肿瘤。
2016年,Zhu和Guo等人精心设计了比率计量的近红外荧光探针87,旨在实时监测结直肠癌中β-半乳糖苷酶的活性。(158) 该探针的核心在于一种DCM荧光团,其独特设计的半乳糖掩蔽对羟基作为荧光掩蔽酶的可切除触发器。当探针87与β-半乳糖苷酶接触时,半乳糖单元被特异性酶解,导致在685纳米波长处产生显著增强的荧光信号,同时500纳米波长处的荧光信号减弱,从而实现了对半乳糖苷酶分析物的比率式追踪。值得一提的是,该探针展现出优异的光稳定性,并在细胞(如293T肿瘤细胞、OVCAR-3卵巢癌细胞)以及体内小鼠结直肠肿瘤模型中均成功验证了其对半乳糖苷酶的实时跟踪能力。
与这一研究紧密相关的是Scanlan和Gunnlaugsson的工作,他们开发了一系列基于萘二甲酰亚胺共轭聚糖结构的糖基化-Nap探针和原药。(159,160) 这些药物能够在不同癌细胞系中通过糖苷酶介导的活化机制释放活性成分,药物的释放速率和活性受癌细胞中过表达的酶以及糖的性质所调控,为实时监测药物的吸收和活性提供了有力工具。
2013年,Peng等人成功报道了COX-2靶向荧光探针88,该探针在癌症与炎症环境的区分上展现出显著效果。(161) 探针88的构建巧妙地将COX-2底物吲哚美辛通过线性烷基二胺间隔物与荧光团NANQ相连。在无COX-2环境下,探针呈现低能量折叠状态,导致荧光淬灭。然而,当吲哚美辛基团与COX-2特异性结合时,探针构象发生转变,展开成活性状态,同时阻断IMC对NANQ的淬灭作用,使荧光恢复。在炎症和肿瘤模型中,探针88在615纳米波长处展现出增强的荧光信号。有趣的是,随着COX-2浓度的增加(0.12-3.32 μg/mL),615纳米处的荧光信号逐渐减弱,而555纳米处的荧光信号增强。这种独特的性质源于癌症和炎症环境中COX-2表达水平的差异,使得探针88成为区分这两种病理状态的有力工具。通过简单的喷洒和手持式紫外灯照射,即可直观地识别癌症组织、正常组织和炎症组织,为肿瘤检测、识别及切除手术提供了重要的潜在临床应用。
2015年,Shih等人开发了一种针对单胺氧化酶A的近红外荧光探针89,其在前列腺癌的检测和治疗领域展现出巨大潜力。(162) 该探针以单胺氧化酶A抑制剂氯吉林为靶向基团,结合荧光庚氨羰花青染料作为荧光团。研究表明,探针89不仅能精准识别并定位前列腺癌肿瘤,还能有效抑制肿瘤的进一步生长和扩散,为前列腺癌的治疗提供了新的治疗策略。
2012年,Nagano等人提出了一种基于FRET技术的基质金属蛋白酶(MMP)可视化系统,即探针90。(163) 该探针采用暗淬灭剂BHQ-3作为FRET受体,与近红外BODIPY荧光供体通过MMP肽底物相连。在生理条件下,BODIPY与BHQ-3之间的FRET作用导致荧光淬灭。然而,在MMP的作用下,肽底物被酶切断,FRET对分离,荧光得以”点亮”。体外实验表明,探针90具有高渗透性,能有效进入靶细胞。在小鼠异种移植肿瘤模型中,荧光共聚焦成像实验成功检测到了MMP的活性。与先前的成像工具相比,探针90展现出更快的响应速度和更高的信噪比,为研究人员检测癌症中MMP活性提供了有力工具。
2017年,Dickinson等人报道了一种创新的小分子荧光探针91,用于检测细胞中半胱氨酸S-脱棕榈酰化过程。(164) 该探针巧妙利用氨基甲酸酯连接剂将棕榈酰化半胱氨酸残基与罗丹明染料相连,使罗丹明呈现内酯低荧光状态。在酰基蛋白硫酯酶(APT,一种去棕榈酰化酶)作用下,探针的硫醇酯去乙酰化,释放出硫醇,进而分子内裂解氨基甲酸酯连接体,释放出罗丹明染料,使其恢复荧光。利用探针91,作者成功地对A431细胞和HEK293T细胞中的内源性APT活性进行了成像。此外,探针所揭示的信号为动态脂质信号转导提供了新的见解,为蛋白质调控中这一鲜为人知且研究不足的领域提供了新线索。
同年,Tan等人介绍了一种基于固态ESIPT的探针92,用于活细胞中碱性磷酸酶(ALP)的可视化。(165) 在其未激活状态,探针通过添加磷酸基团掩盖氢键供体苯酚,从而抑制ESIPT能力并关闭荧光。这一设计同时使探针具有良好的水溶性。当ALP分解磷酸盐时,探针92释放并快速沉淀,产生明亮的固态荧光。研究表明,探针92能以高信噪比成功检测ALP活性,并在骨肉瘤细胞系(U-2OS和Saos-2)中成功成像内源性ALP活性。这种探针为探索ALP的生理和病理功能提供了有价值的工具,同时其新颖的设计为开发新型肿瘤生物标志物检测传感器提供了有趣的新平台。
早在2001年,Welssleder等人就报道了一种用于检测小鼠肿瘤中MMP活性的生物相容性近红外荧光探针(图32,探针93)。(166) 该探针将一种近红外染料与MMP-2多肽底物结合,并固定于非免疫原性聚合物骨架上。由于聚合物紧密堆积,初始状态下荧光被淬灭。然而,当MMP-2分解多肽时,荧光发射恢复,在肿瘤部位产生近红外信号。作者在人类纤维肉瘤细胞(HT1080)的肿瘤小鼠模型中验证了这一系统的成像能力,表明该聚合物传感系统能有效检测MMP-2活性的变化,并可用于评估肿瘤中MMP活性的动态变化。这一研究不仅为肿瘤进展的监测提供了新的视角,还为开发新的抗肿瘤药物提供了潜在的靶点。
在材料学和化学领域,这些荧光探针的设计和应用展示了精细的化学修饰和靶向策略如何实现对生物分子和生物过程的特异性识别和监测。这些研究成果不仅扩展了我们对生物过程的理解,还为疾病诊断、治疗以及药物研发提供了新的思路和方法。随着技术的不断进步和创新,预计将有更多高性能的荧光探针被开发出来,为生物医学领域带来更多的突破和进展。 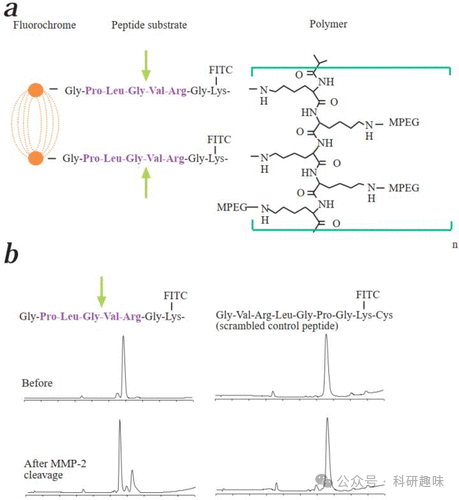 图 32.(a) MMP-2 敏感探针 93 的结构。(b) MMP-2 分解前后肽底物的 HPLC 图谱。
图 32.(a) MMP-2 敏感探针 93 的结构。(b) MMP-2 分解前后肽底物的 HPLC 图谱。
2018年,Gao等人精心构建了一种双比率荧光探针,旨在实时监测肿瘤相关蛋白酶活性和pH值的变化(如图33所示,探针94)。(167) 在这一设计中,pH敏感的荧光染料ANNA通过特定的多肽序列被锚定在Fe3O4纳米粒子表面,初始状态下,通过荧光共振能量转移(FRET)机制使得ANNA的荧光被关闭。同时,探针上还引入了Cy5.5染料,该染料在整个反应过程中保持稳定的”点亮”状态,作为荧光参照。
当肿瘤相关的蛋白酶MMP-9发生作用,特异性裂解多肽序列时,FRET机制被中断,导致ANNA的荧光得以恢复,从而指示蛋白酶MMP-9的活性。通过比较恒定发光的Cy5.5与依赖于MMP的ANNA的荧光强度,可以精确地量化MMP-9的活性。
通过体内和体外实验验证,这一双比率荧光探针成功地为肿瘤部位的MMP-9蛋白活性和pH值提供了量化的实时监测信息,为肿瘤的诊断和治疗提供了新的有力工具。 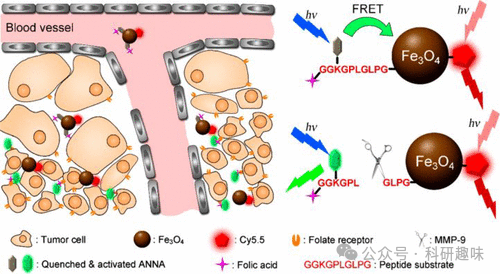 图 33.ANNA 纳米探针(探针 94)在肿瘤细胞中的作用机制。
图 33.ANNA 纳米探针(探针 94)在肿瘤细胞中的作用机制。
参考文献
Wang, X.; Ding, Q.; Groleau, R. R.; Wu, L.; Mao, Y.; Che, F.; Kotova, O.; Scanlan, E. M.; Lewis, S. E.; Li, P.; Tang, B.; James, T. D.; Gunnlaugsson, T. Fluorescent Probes for Disease Diagnosis. Chem. Rev. 2024, 124 (11), 7106–7164. https://doi.org/10.1021/acs.chemrev.3c00776.