荧光显微成像系列——荧光显微成像
光学显微镜中的对比度
人眼需要对比度 (Contrast) 才能感知物体的精细结构。为了在显微镜下看清透明的生物样本,科学家们设计了多种巧妙的方法来增强对比度,每一次技术的突破都为生物学研究开辟了全新的领域。
- 物理对比法:最简单的方法之一是“暗场 (Dark Field)”成像,它利用微小颗粒对光的散射现象(即丁达尔效应),让样本在黑暗的背景中突显出来。随后,荷兰科学家弗里茨·泽尼克(Frits Zernike)发明的相衬显微技术,使得人们首次能在无需染色的情况下观察活细胞内部的精细结构,这一革命性贡献为他赢得了1953年的诺贝尔物理学奖。在此基础上,波兰科学家乔治·诺马斯基(Georges Nomarski)发明的差分干涉对比(DIC)技术,通过偏振光干涉,创造出具有伪三维浮雕感的图像,提供了极佳的对比度。

图3.1 1953 年诺贝尔物理学奖得主弗里茨·泽尼克
- 化学染色法:通过对样本进行特异性染色,可以揭示其内部结构。染料能选择性地与特定组织或细胞结构结合,并通过吸收特定波长的光来呈现颜色。意大利的卡米洛·高尔基(Camillo Golgi)和西班牙的圣地亚哥·拉蒙-卡哈尔(Santiago Ramon y Cajal)是该领域的先驱,他们因在组织化学染色方面的杰出贡献分享了1906年的诺贝尔生理学或医学奖。

图3.2 1906 年诺贝尔生理学或医学奖得主Camillo Golgi和Santiago Ramon y Cajal
然而,迄今为止最受欢迎的对比度增强技术是荧光成像。该技术需要使用荧光素或荧光团,它们可以吸收特定波长范围的光,并重新发射能量较低的光子,即波长更长的光。如今,市场上有大量不同种类的染料,其吸收波长范围从紫外(UV)到近红外(NIR)区域,而且人们仍在不断开发具有新特性的荧光团(详见第 4 章)。这种方法的主要优势是对比度高、灵敏度高、特异性强和选择性高。最初用于荧光显微镜的染料并非专门为研究而制备,而是从用于纺织品染色的染料中选取的。荧光标记抗体的使用以及为特定生物应用合成的各种荧光杂环探针的引入,极大地推动了荧光显微镜在生物学中的应用。荧光蛋白的引入引发了显微镜技术的又一场革命,促进了众多新型显微镜技术的发展,并推动了光学显微镜和细胞生物学的飞速发展。2008 年,日本科学家下村修(Osamu Shimomura)、美国科学家马丁·查尔菲(Martin Chalfie)和钱永健(Roger Y. Tsien)因“发现并发展了绿色荧光蛋白(GFP)在生物研究中的应用”而获得了诺贝尔化学奖。
 图3.3 2008年诺贝尔化学奖得主Osamu Shimomura、Martin Chalfie及Roger Y. Tsien
图3.3 2008年诺贝尔化学奖得主Osamu Shimomura、Martin Chalfie及Roger Y. Tsien
现代荧光显微镜发展的下一个里程碑是超分辨率(或“亚衍射”分辨率)成像技术的出现。其在生物研究中的潜力和重要性很快得到了认可,2014 年诺贝尔化学奖授予了埃里克·贝齐格(Eric Betzig)、斯特凡·W·赫尔(Stefan W. Hell)和威廉·E·莫尔纳(William E. Moerner),以表彰他们“在超分辨率荧光显微镜技术的发展”方面的贡献。
 图3.4 2014年诺贝尔化学奖得主Eric Betzig、Stefan W. Hell及William E. Moerner
图3.4 2014年诺贝尔化学奖得主Eric Betzig、Stefan W. Hell及William E. Moerner
荧光团的使用需要对光学显微镜的照明和成像光路进行几项关键的改进。荧光激发需要特定的光源,其发射光通常需要通过先进的电子光检测设备进行记录。然而,荧光技术也存在重要的局限性:荧光染料的稳定性有限,即它们会发生光漂白,并可能引发光毒性效应。这需要采取特殊的预防措施。本章首先讨论荧光的物理基础,然后介绍与荧光技术相关的主要技术和方法问题。
荧光物理基础
什么是荧光?
荧光团是一种具有特殊性质的分子或纳米晶体,能够吸收特定能量的光子,并发射出能量较低的光子。从电磁光谱的角度来看,这意味着发射光的颜色相对于吸收光发生了红移。如前所述,这种效应可以巧妙地用于显微镜中以产生极佳的对比度。那么,这种效应是如何在细节上起作用的呢?在这里,我们主要关注荧光小分子,因为它们是显微镜中使用最广泛的荧光团。
吸收光的荧光分子由一组原子组成,这些原子在具有特定空间电荷分布的分子轨道中共享一定数量的离域电子。可以将电子想象成“胶水”,它们通过负电荷将正电荷的原子核紧密地结合在一起,从而稳定整个分子。电子的基态通常是单重态,记作 S0,其中两个电子的自旋方向是反平行的。当分子吸收光(即光子)时,其中一个电子会被激发到另一个轨道,通常是第一个激发态单重态 S1。由于激发过程中电子的自旋方向并未改变,因此激发态电子的自旋方向仍然与其原始轨道中留下的单个电子的自旋方向反平行。根据能量守恒定律,吸收光子的能量必须等于基态与激发态之间的能量差。
在激发态,电子围绕原子核的整体电荷分布与基态相比发生了改变。关键在于,电子改变其空间分布的过程几乎是瞬时的——仅需飞秒量级,而相对较重的原子核移动得更慢,需要更长的时间——皮秒量级——才能适应电子的新电荷分布。激发态电子被重新定位到一个距离原子核更远的更高轨道,这导致分子结构的松弛,并通常引发分子围绕原子的新平衡位置发生振动。然而,振动能量会在与周围溶剂分子的碰撞中迅速以热量的形式耗散,分子随后衰变到激发态 S1的振动基态(见图 3.1)。然而,由于分子的能量仍然高于电子基态,S1态无法长时间保持稳定,分子最终会返回到基态 S0。分子在 S1态停留的时间被称为激发态寿命𝜏。具有高荧光性的分子通过以光的形式发射多余的能量——即发射荧光光子——返回到基态。这再次改变了电子围绕原子核的配置,因此这种衰变到电子基态的过程会结束于一个振动激发态。从这里,分子再次迅速通过将振动能量耗散到周围环境中返回到 S0的振动基态。至此,荧光循环完成。
需要指出的是,从 S1到 S0的衰变也可能由于与溶剂分子的进一步碰撞而发生。在这种情况下,电子的多余能量以非辐射形式丢失,不会发射荧光光子,因此这一过程被称为非辐射衰变。此外,还存在第三种衰变路径,即通过系间穿越实现的弛豫。这是因为激发态电子有一定(但通常非常小)的概率翻转其自旋,从而进入一个能量稍低的态——所谓的三重态,记作 T1。要从 T1返回到电子基态 S0,电子需要再次翻转其自旋,因为在 S0态中,它需要与第二个电子的自旋方向反平行才能共享同一个分子轨道。这同样是一个概率极低且缓慢的过程,可能持续微秒甚至数小时。这一过程可能伴随着光子的发射,被称为磷光。然而,通常情况下,辐射衰变无法与非辐射路径竞争。激发和各种衰变路径的总结通常以贾布隆斯基图(Jablonski diagram)的形式呈现(见图 3.1)。
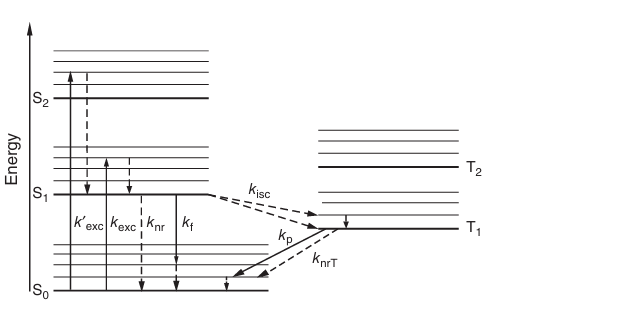
图 3.1 简化的贾布隆斯基图(分子项图)。图中用实线和虚线分别表示辐射跃迁和非辐射跃迁。“能量”指的是电子和原子核的总势能和动能。
值得注意的是,即使是最长的吸收波长(对应于从基态 S0的最低振动水平到激发态 S1的最低振动水平的跃迁)和最短的发射波长(对应于同一水平之间的去激发)也会出现在不同的波长上。这种差异的原因在于溶剂分子在激发态寿命内的重新定向。溶剂分子的重新定向会降低激发态的能量,同时提高基态的能量,从而减少发射光子的能量。这一过程被称为溶剂弛豫。
总体而言,吸收峰和发射峰波长之间的差异被称为斯托克斯位移(Stokes shift)。斯托克斯位移是由溶剂弛豫以及在激发态 S1和基态 S0中振动能量的耗散共同导致的。
荧光激发与发射光谱
为了实现分子从基态(S0)到激发态(S1)的跃迁,激发光子的能量必须足够高,以跨越两者之间的能量差。然而,由于分子通常会进入 S1的振动激发态,这一能量差相对较大。因此,只有当吸收的光子具有一定的最小能量时,分子才会发生激发。在分子集合中,许多因素会进一步略微改变光谱跃迁能量,例如额外的平动和转动能量级,以及不同的分子环境。因此,在室温下,分子吸收和发射光的能量范围是连续的,而不是集中在锐利的光谱线上。
荧光激发的能量或波长依赖性通常以荧光激发光谱的形式表示。这是一种在特定发射波长处测量的荧光强度与激发波长之间的关系图。另一方面,荧光发射光谱则是在吸收带中选定波长激发样品时,荧光强度与发射波长之间的关系图。对于单个分子而言,激发光谱和发射光谱分别代表激发和发射的概率密度。
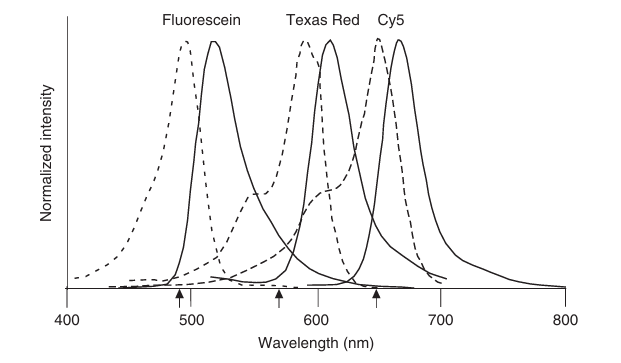
图 3.2 荧光染料(杂环化合物)荧光素、德克萨斯红和 Cy5 的激发光谱(虚线)和发射光谱(实线)。箭头表示在显微镜中常用于激发这些染料的激光波长。
图 3.2 展示了三种典型染料(荧光素、德克萨斯红和 Cy5)的荧光激发和发射光谱。每种激发光谱中都有一个特征最大值,对应于从 S0的振动基态到 S1的振动-电子能级(发生跃迁概率最高的能级)之间的能量差。这三种激发光谱在蓝光一侧都显示出一个肩峰,这是由于分子跃迁到 S1的更高振动态所致。荧光发射光谱通常是激发光谱的近似镜像,因为衰变过程是从 S1的振动基态到 S0的各级能态,而这些能态的结构与 S1相似。从光谱中可以直接推断出相应的斯托克斯位移大小。
荧光显微成像的特性
图像对比度
在阳光明媚的白天,想要在森林边缘的草丛、灌木和树木的背景下发现一只萤火虫几乎是不可能的。然而,在夜晚,同样的萤火虫会发出光芒,变得清晰可见,而同一区域内可能活跃的植物和其他昆虫则完全隐匿于黑暗之中。这个例子在一定程度上类似于在荧光显微镜下观察特定分子的情景。为了对研究人员有用,光学显微镜需要高对比度,而荧光显微镜很好地满足了这一需求。在荧光显微镜中,特定分子被激发发光,从而在黑色背景中脱颖而出,而被研究细胞中的无数其他分子则隐匿于背景之中(见图 3.3)。
荧光显微镜的应用范围最初被低估了。它曾被认为只是用于获取组织和细胞中选定结构的漂亮、多彩的图像的一种方法。然而,现代荧光显微镜以及由此发展而来的许多现代成像和分析技术的最吸引人的特点是,它们不仅能够对结构进行成像和定量研究,还能研究完整细胞在体外和原位的生理功能。
图 3.3 说明了现代荧光显微镜不应仅仅被视为一种放大细胞和亚细胞结构图像的技术,而是一种研究细胞功能的方法。图 3.3e–g 展示了细胞内的一些选定结构(如线粒体和细胞核),并证明了将生理(功能)参数——在这种情况下是线粒体膜电位——选择性地转化为特定荧光信号的能力。
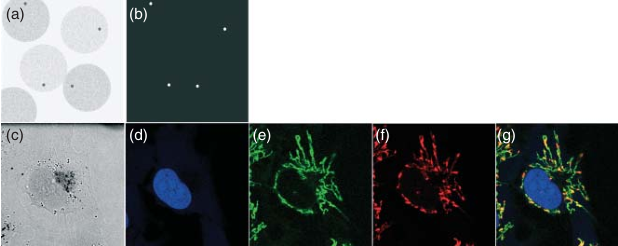
图 3.3 显微镜中图像对比度的重要性。 (a) 四个深灰色的点在浅灰色背景中几乎无法被察觉。 (b) 四个白色的点(与 a 中位置相同)在黑色背景中很容易被识别。 (c) 未使用对比技术时,培养中的活细胞的透射光图像——几乎无法区分内部结构。 (d) 用 DAPI 染色的细胞核 DNA;DAPI 是一种对 DNA 有亲和力的杂环分子。其与 DNA 的主要结合方式被认为是将 DAPI 分子定位在双螺旋的小沟中。 (e, f) 使用 JC-1 荧光标记的低(绿色,e)和高(红色,f)膜电位的线粒体。JC-1 是一种碳氰染料,能够轻松穿过细胞膜和线粒体膜,并在活性线粒体中积累。JC-1 单体发出绿色荧光。在高浓度下(溶液中浓度超过 0.1 µM),JC-1 形成所谓的 J-聚集体,发出红色荧光。线粒体膜电位的梯度促使 JC-1 分子穿过膜进入活性线粒体。具有高膜电位的线粒体积累 JC-1,染料浓度足够高以形成 J-聚集体。 (g) 线粒体和细胞核的荧光信号叠加在同一图像中。
荧光标记的特异性
让我们进一步扩展萤火虫的类比。尽管我们无法看清萤火虫的任何特征——它的大小、形状或颜色仍然未知——但有经验的观察者知道,那个微小的光点揭示了雄性萤火虫的位置。它很可能是一种欧洲常见的萤火虫,学名为 Lampyris noctiluca。在这个地区和这个季节,没有其他昆虫会在飞行中发光。尽管可能有成百上千的昆虫在该区域盘旋,但它们融入了黑色的背景中,因此无法被看见。因此,这种微小的光标记是萤火虫的特征:它是特异性的。
荧光标记对选定分子的特异性,以及将某些选定的生理和功能参数(如膜电位或酶活性)转化为细胞中特定信号的能力,是荧光显微镜的另一个重要优势(见图 3.3 和图 3.4)。目前,已有数百种荧光分子可供使用,包括小的杂环分子和蛋白质,它们可以作为固定细胞和活细胞中特定标记物和标签。此外,许多方法已经优化,用于将荧光标签连接到感兴趣的分子上,这些内容将在后续章节(荧光标记相关)中讨论。
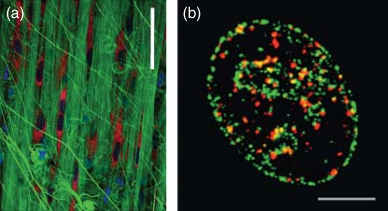
图 3.4 荧光标记的特异性。 (a) 使用三种荧光探针标记活体结缔组织片段中的不同分子类别和结构——细胞核中的 DNA(DRAQ5 ,一种深红色发射染料,此处显示为蓝色)、细胞外基质纤维(Col-F ,绿色)和活性线粒体(四甲基罗丹明,简称 TMRE,红色)。比例尺为 50 微米。DRAQ5 是一种蒽环类衍生物,对 DNA 具有高亲和力。这种染料可以轻松穿过细胞膜和核膜,并在活细胞中与 DNA 结合。它在红光激发下发出深红色光,此处显示为蓝色以便与 TMRE 区分。Col-F 是一种结合胶原蛋白和弹性蛋白纤维的染料(激发光为蓝色,发射光为绿色)。TMRE 进入细胞并被活性线粒体积累(激发光为绿色,发射光为红色)。(b) 在细胞周期的 S 期,将 DNA 前体类似物乙炔脱氧尿苷(EdU)短暂地掺入新生 DNA 中,这些细胞暴露于拓扑异构酶 I 型抑制剂喜树碱中。细胞经过固定处理后,使用“点击化学”对 EdU 进行荧光标记。因此,新合成的 DNA 被标记为绿色。在同一细胞中,使用特异性抗体标记了组蛋白 H2AX 的磷酸化形式——γH2AX,它被认为是 DNA 双链断裂(DSBs)的标记物。因此,带有 DSBs 的 DNA 区域被免疫标记为红色。当将代表 DNA 复制和 DNA 损伤的众多焦点图像叠加时,可以清楚地看到,大多数损伤发生在复制中的 DNA(复制和γH2AX 焦点显示出大片黄色区域,绿色和红色信号重叠)。
荧光标记的特异性是荧光显微镜的一个重要优势。然而,这种特异性并非绝对理想,也不应被视为理所当然。以图 3.4 中的例子为例,DRAQ5 与 DNA 的结合相对特异性较高。由于 DRAQ5 与 RNA 的结合常数较低,或者其与 RNA 复合物的荧光强度较弱,因此在低浓度下对 RNA 的染色可以忽略不计。然而,在高浓度 DRAQ5 的情况下,当所有 DNA 上的染料结合位点都被饱和时,可以检测到一些与 RNA 的结合。大多数(如果不是全部)对 DNA 具有亲和力的荧光标记都观察到了类似现象。因此,为了充分发挥 DNA 标记技术的优势,必须优化实验条件,特别是可用染料与可用结合位点的比例。
对于 Col-F 这种小分子来说,它能够结合细胞外基质的两个主要成分。在这方面,它不如针对特定物种中胶原蛋白或弹性蛋白上选定表位的抗体特异性高。然而,Col-F 的优势在于标记过程简单、能够深入组织且非特异性染色水平低。相比之下,免疫荧光在检测胶原蛋白或弹性蛋白时具有极高的特异性,但也存在局限性:组织穿透能力较浅,以及用于标记方法中的荧光标记二抗可能存在一些非特异性结合。实验者需要在低分子量标记物的优势和免疫荧光方法的局限性之间做出选择。
同样,图 3.4b 展示了两种在特异性上存在一定差异的标记方法。将乙炔基脱氧尿苷(EdU)前体掺入新生 DNA 中,并随后通过点击反应标记这些掺入的分子,可以实现对新合成 DNA 的非常特异性标记,背景染色极低甚至不存在。而使用特异性抗体标记组蛋白 H2AX 的磷酸化部分也非常特异性,但无法完全避免二抗的非特异性结合,因此通常会存在一定程度的低水平荧光背景。
检测的灵敏度
现代荧光显微镜具备极高的灵敏度,能够检测到极其微弱的荧光信号。随着高灵敏度光探测器和相机的出现,科学家们如今可以在样本中检测到单个分子的存在(见图 3.5)。这使得观察单个分子的行为(例如其闪烁特性)或通过福斯特共振能量转移(Förster Resonance Energy Transfer, FRET)检测单个分子之间的相互作用成为可能。
当我们将显微镜下观察荧光分子与夜晚观察萤火虫进行类比时,这种类比依然具有一定的合理性。尽管我们无法直接观察到分子的大小和形状,但通过显微镜看到的一个微小的荧光光点很可能代表一个单独的分子。尽管观察者可以确定分子在空间中的位置并观察其运动,但分子的具体形状和大小仍然无法直接获知(见图 3.5)。
尽管存在这一限制,单分子检测能力为许多令人兴奋的新技术铺平了道路。其中包括斑点显微镜技术,以及最重要的超分辨率成像方法(见后续章节)。这些技术的发展极大地拓展了荧光显微镜的应用范围,使其能够揭示细胞和分子层面的更多细节。

图 3.5 荧光脂质示踪剂TopFluor-PC 的单分子在脂质双层中的图像,使用电子倍增电荷耦合器件(EMCCD)相机拍摄。每个分子产生一个衍射受限的信号,相关内容已在第 2 章中讨论(视场为 10×10 μm²)。
荧光显微镜
工作原理
将萤火虫与荧光物体进行类比,虽然有助于引入基本概念,但在考虑用于显微镜中检测荧光所需的仪器时,这种类比就不再适用了。萤火虫通过一种名为生物发光的生化过程自行发光,这一过程利用三磷酸腺苷(ATP)的能量,而无需光来启动。然而,显微镜中的荧光需要通过较短波长的入射光激发。因此,荧光显微镜的构造必须能够实现荧光的激发、将相对较弱的发射光从强激发光中分离出来,以及最终检测荧光。高效地将激发光与最终到达观察者眼睛或电子探测器的荧光分离,是获得高对比度图像的必要条件。
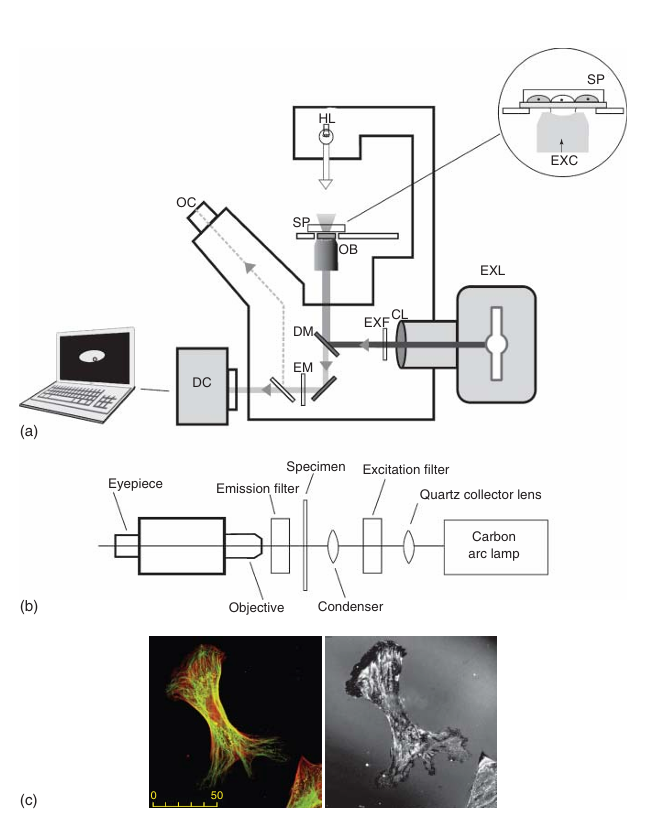
图 3.6 荧光显微镜的工作原理。 (a) 倒置荧光显微镜(落射荧光)的示意图。这种类型的显微镜能够用于研究在标准培养基中、组织培养容器(如培养皿)内维持的活细胞。图中标注如下:HL 表示卤素灯;SP 表示样本;OB 表示物镜;OC 表示目镜(目镜);DC 表示数码相机;EXL 表示激发光源;CL 表示收集透镜;EXF 表示激发滤光片;DM 表示分色镜;EM 表示发射滤光片;EXC 表示照射到样本上的激发光。 (b) 早期荧光显微镜的示意图,采用透射照明方式。 (c) 微管(绿色)和肌动蛋白纤维(红色)的荧光图像,以及同一细胞在反射光下的图像,展示了粘着斑(黑色)。
图 3.6 展示了一台标准宽场荧光显微镜的示意图。荧光是由汞灯发出的光激发的。激发光通过一个分色(双色)镜反射到样本上(见图 3.6 和图 3.7)。这种特殊的镜子以 45°角放置在入射光的路径上,能够反射特定波长的光子,同时允许更长波长的光通过。分色镜是根据具体应用选择的,即它被设计成能够反射选定的激发波长,并允许预期的荧光通过(见图 3.8)。需要注意的是,将激发光转化为荧光的效率通常很低,也就是说,只有少数激发光子会被转化为更长波长的光子,并最终被检测为荧光。此外,荧光是由样本向各个方向发射的,但只有选定的光锥,即这部分荧光的一部分,会被物镜收集。因此,荧光相对于激发光来说非常微弱,必须高效地分离和检测。高质量的光学滤光片被用来专门选择所需的激发波长(激发滤光片)和荧光发射波段(发射滤光片)(见图 3.7)。
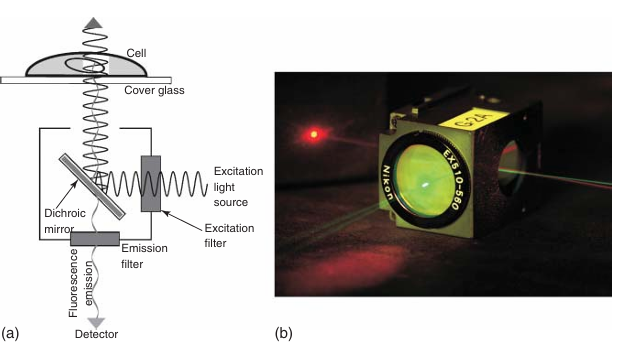
图 3.7 荧光显微镜滤光片块。 (a) 典型滤光片块的示意图,包含激发滤光片、分色镜和发射滤光片。激发光源发出的激发光被分色镜反射至样本;荧光发射光的波长比激发光长,能够透过分色镜朝向目镜或光探测器。 (b) 一张显微镜滤光片块的照片,该滤光片块反射绿色光但透过红色光。激发滤光片朝向观察者,分色镜安装在滤光片块内部;发射滤光片(位于滤光片块左侧)在这张照片中无法看到。照片中使用了激光笔发出的光束。在荧光显微镜中,红色发射光的强度会显著低于激发绿色光的强度。
值得注意的是,这里描述的这种排列方式被称为落射荧光(类似于用于研究金属表面的反射光显微镜),它使得荧光与激发光的分离相对容易,并且比最初的透射照明系统更安全。在荧光显微镜的早期,采用直接(透射)照明的方式(见图 3.6b)。通过在光路中放置一个高效的阻挡滤光片,阻止激发光到达观察者。在最初的荧光显微镜设计中,如果将激发滤光片从光路中移除,强烈的激发光就会进入目镜并照射到观察者的眼睛。即使物镜不允许紫外线通过,这仍然是非常危险的。在落射荧光设计中,激发光不会直接进入观察者的眼睛。即使移除了分色镜和激发滤光片,激发光也不会直接照射到目镜上。然而,这并不意味着在移除所有滤光片并打开激发光源的情况下,用显微镜观察是安全的。当滤光片被移除时,激发光仍然会被反射和散射,足以对观察者的眼睛造成危害。为了保护实验室的同事,如果移除了滤光片,建议在显微镜上留下适当的提示,警告其他人不要“只是快速看一下他们的样本”。
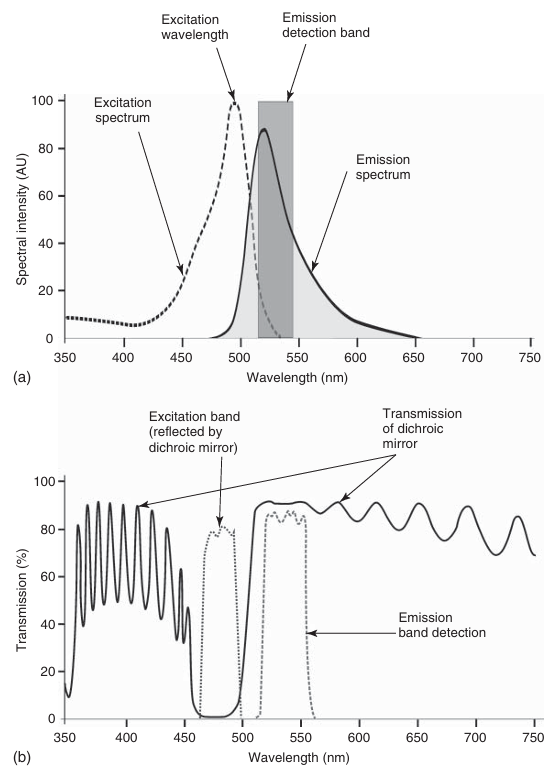
图 3.8 典型荧光标记物荧光素(a)的光谱特性,以及适合选择激发波段和检测荧光发射的滤光片组的特性(b)。
激发光源
一台典型的荧光显微镜通常配备两种光源:卤素灯和汞弧灯。卤素灯作为一种白炽灯,主要用于透射光模式下的初步样本观察,其发光原理是通过加热钨丝来发射光子。而高压汞蒸气弧光灯(HBO)则是荧光显微镜常用的激发光源。
汞弧灯的光发射强度远高于卤素灯,可达其100倍。其发射光谱覆盖紫外到红外波段,具体光谱特征取决于汞蒸气压力和灯的类型(如图3.9a所示)。通过选择合适的激发滤光片,可以从光谱中筛选出所需的激发光谱带。由于其光谱包含多个尖锐的峰值,因此激发光强度会随所选波长而显著变化。汞弧灯是许多典型荧光团的理想激发光源。
另一种常用的激发光源是氙弧灯,它在可见光波段内发射近乎连续的光谱(如图3.9b所示)。金属卤化物灯是汞蒸气灯的改良版本,其特点是在汞弧灯的主要光谱线之间具有更高的光强(如图3.9c所示),且寿命更长。这种灯的光谱特性取决于所掺杂的金属种类。
值得注意的是,灯丝发射的光子流在空间和时间上并非理想的均匀和恒定。研究表明,高温光源发射的光子呈现簇状分布,而非独立的单个光子。这种“光子簇”现象在汉布里-布朗和特维斯的经典物理实验中已有观察。此外,灯丝温度波动、电流不稳定以及外部电磁场干扰等因素也会导致发射光在空间和时间上的不均匀性。因此,汞弧灯在定量显微镜研究中存在一些问题,例如视场照明不均匀、光强在短时间内波动(与像素和图像记录时间相当)、以及随着使用时间增加(通常几天)光强逐渐减弱(由于电极腐蚀)。激发光的短期和长期稳定性不足,限制了定量荧光显微镜研究的开展。相比之下,发光二极管(LED)和激光光源则提供更高的发射稳定性。
典型的HBO灯需要精确放置在收集透镜的焦点上(更换HBO灯时,切勿用手触摸石英灯泡)。准确定位对于确保最佳照明至关重要,即实现视场内最高且对称的照明。HBO灯关闭后,应待其冷却后再重新开启。当达到制造商规定的使用寿命(通常为200小时)时,应及时更换HBO灯。超期使用不仅会导致照明强度显著降低,还会增加灯泡爆炸的风险。尽管这种事件相对罕见,但一旦发生,可能会损坏位于灯泡前方的石英收集透镜。HBO灯需要妥善处理,以避免汞对环境的污染。如今的金属卤化物灯通常已预先调整好,并固定在灯座的最佳位置。
激光发射离散波长的光,具有高空间稳定性(光束传播方向固定,即所谓的光束指向稳定性)和时间稳定性,无论是在短时间尺度还是长时间尺度上。在荧光显微镜的早期,激光尚未普及;随后,其应用主要限于比标准宽场荧光显微镜更先进、更昂贵的激光扫描显微镜(见第5章)。激光光束的稳定性和聚焦至衍射极限的能力是其相对于汞弧灯的重要优势。然而,激光的缺点是成本较高,且可用于激发常用荧光团的可用发射线数量有限。例如,早期流行的25毫瓦氩离子激光器提供488纳米和514纳米的光谱线,但这些波长并不完全匹配当时最常用的荧光染料对——荧光素和罗丹明。其他常用于共聚焦荧光显微镜的气体激光器还包括氪-氩激光器(488纳米、568纳米和647纳米)和氦-镉激光器(442纳米)。固体激光器,如倍频掺钕钇铝石榴石(Nd:YAG,532纳米)激光器,也有应用。如今,标准气体激光器的价格已大幅降低,市场上提供了多种单线激光器以及发射宽波段光谱的激光器,包括“白光激光器”。耐用的二极管激光器也已广泛应用。
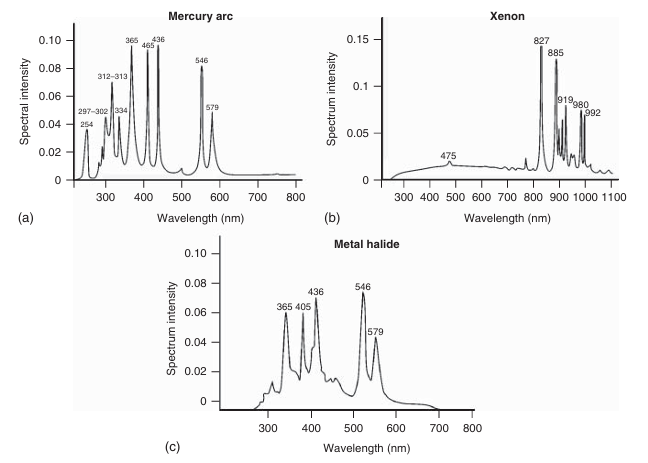
图 3.9 发射光谱的示意图:(a) 汞弧灯,(b) 氙灯,(c) 金属卤化物灯。
此外,近年来,一种新型低成本光源——发光二极管(LED)也迅速发展并得到广泛应用。LED是一种利用电致发光现象的半导体器件。起初,LED主要应用于红色激光笔等简单设备,但如今,其发射波长范围已扩展至紫外、可见光乃至近红外波段,为荧光显微镜提供了更多选择。
LED的核心组件是两种不同类型半导体材料的pn结。其中,n型半导体材料主要携带负电荷,而p型半导体材料则主要携带正电荷。当在pn结上施加正向电压时,会促使负电荷和正电荷分别向pn结区域移动。当这些电荷在pn结区域复合时,会释放出光子。所释放光子的能量(即波长)取决于LED所使用的半导体材料的能带结构。如今,通过合理选择和组合不同类型的LED,可以构建出适用于荧光显微镜的稳定激发光源。
LED具有诸多显著优势:
- 高稳定性: LED的光输出稳定,波动小,有利于实现精确的定量测量。
- 长寿命: LED的寿命远长于传统光源,减少了更换光源的频率和成本。
- 快速开关: LED能够快速响应电流变化,实现快速开关,适用于高速成像和动态观察。
- 耐用性: LED结构坚固,耐震动,不易损坏。
- 低成本: 随着技术的进步,LED的成本不断降低,使其成为一种经济实惠的光源选择。
这些优势使得LED不仅在扫描共聚焦显微镜等高端显微镜中得到了广泛应用,也在标准荧光显微镜中逐渐普及,成为一种重要的激发光源。
荧光显微镜中的光学滤光片
在荧光显微镜中,光学玻璃滤光片用于选择和分离不同波长的光束,以实现特定的荧光观测。用于从激发光源光谱中筛选所需波长的滤光片称为激发滤光片。此外,控制激发光的强度也至关重要。若光源的发射强度无法直接调节,则可通过在光路中放置中性密度滤光片来实现。
荧光以各个方向发射,而大部分激发光会直接穿过样本,但其中一部分会被细胞和亚细胞结构散射和反射。分色镜的主要作用是将大部分反射的激发光反射回光源,同时让选定波长范围内的荧光透过,并导向目镜或光探测器。在标准宽场荧光显微镜中,发射滤光片安装在滤光片块上,并放置在光路中,以选择所需的发射波段。若显微镜仅提供一组特定的激发和发射波长,其适用性将受到极大限制,因为这仅能使用光谱特性相近的一组荧光探针。因此,通常会在滑块或滤光片转轮上安装一组针对典型荧光染料设计的多个滤光片块,以便快速切换激发和发射波段,满足不同实验需求。
在荧光共聚焦显微镜中,分色滤光片通常设计为能够反射两种或三种激发波长,并允许相应的发射波段通过。额外的分色镜会将发射光分成多束,分别导向独立的光探测器,从而实现同时激发和观测多种荧光团。一些宽场荧光显微镜也配备了电子控制的激发和发射滤光片转轮,其中包含多组光学滤光片。通过驱动滤光片转轮和快门的软件包,可以快速选择所需的滤光片组合,提高实验效率。
尽管显微镜制造商为大多数常用的荧光探针提供了标准的滤光片块,但根据激发光源和用户特定的应用需求,讨论并订购定制的滤光片组合仍然非常有益。在购买新显微镜时,购置一个空的滤光片块(支架)也是明智之举,以便在需要开展新的应用时能够自行组装滤光片块。自行组装滤光片块可能需要一定的技巧和耐心,因为分色镜相对于激发光束的位置至关重要。显微镜制造商通常会提供带有已固定在最佳位置的分色镜的滤光片块。用户自行调整分色镜是可行的,但在某些显微镜中可能较为繁琐。
在购买单独的滤光片,尤其是分色镜时,选择高质量的滤光片至关重要,即选择低楔形滤光片(表面平整,两面尽可能平行)和涂层缺陷最少的滤光片。涂层缺陷会导致激发光泄漏到荧光探测器,被检测为背景信号,从而降低图像的对比度和质量。此外,在购买分色镜以自行组装滤光片组合时,必须确保滤光片的形状、直径和厚度都符合显微镜的设计要求。若分色镜的厚度不合适,可能根本无法正确对齐。分色镜相对于入射光的方向也很重要——制造商通常会指定应朝向光源的干涉滤光片表面(请注意,箭头可能表示光传播的方向或朝向光源的方向,具体取决于制造商)。
光学滤光片需要小心处理,避免在其表面留下指纹、油渍和灰尘。新型硬涂层滤光片相当坚固,也更易于清洁。若需要清洁,可先通过吹气或使用软毛刷(去除灰尘),然后使用一小块光学擦拭纸(请勿重复使用)蘸取少量纯甲醇或异丙醇进行擦拭。滤光片制造商通常会推荐适用于其产品的溶剂。确保防反射涂层不被划伤或损坏至关重要。
目前,光学滤光片的制造技术已非常先进,光学公司可以根据用户的需求定制各种光学特性的滤光片,满足不同实验的需求。
电子滤光片
近年来,一类新型多功能光电子元件——声光可调谐滤光片(AOTFs)——作为先进的滤光器件得到了广泛应用。与传统的玻璃光学滤光片相比,AOTFs在光的波长选择和强度控制方面展现出更高的灵活性和速度,这对于现代先进的荧光共聚焦显微镜而言至关重要。
AOTFs的工作原理与衍射光栅相似(但并非完全相同)。当高频声波(数百兆赫兹)被施加到一种特殊的双折射晶体(通常为二氧化碲,TeO₂)上时,会在晶体内部诱导出周期性的压缩模式(如图3.10所示)。这种周期性压缩模式会改变晶体的局部折射率,从而形成一个周期性变化的折射率分布。二氧化碲(TeO₂)在450-4000纳米的光谱范围内具有良好的透明性,因此适用于广泛的光谱范围。只有入射到晶体上的光谱中选定的波段会被偏折。与将整个波长范围的光进行衍射(在不同角度)的衍射光栅不同,晶体更像一个带通滤光片。光束偏折的方向是固定的,不随波长变化。
偏折光的波长由声波的频率决定,而偏折光的强度则可以通过调节入射到晶体上的声学机械波的振幅来控制。声波通过压电换能器施加到晶体上,这种换能器会根据施加的电压进行伸缩。通过改变驱动晶体的入射声波的频率和振幅,AOTFs能够快速改变偏折光的波长和强度。偏折光的光谱宽度可以通过向AOTF输入多个频率来控制。此外,使用多个间隔较宽的频率可以同时偏折一组波段。
这些特性使得AOTF成为荧光显微镜中极为灵活的组件。它不仅可以作为一组快速快门,还可以作为中性密度滤光片和发射滤光片,从而实现多种发射颜色的同步检测。波长及其强度的改变可以在极短的时间内完成,通常在几十微秒级别,而传统的滤光片转轮则需要数秒的时间。AOTF还可以用作分色滤光片,将激发光与荧光发射光有效分离。这些优势使得AOTFs在多色共聚焦显微镜和荧光漂白恢复(FRAP)等技术中具有极高的应用价值。
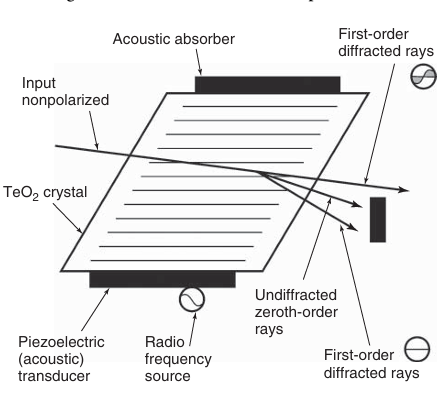
图 3.10 声光可调谐滤光片(AOTF)的结构与工作原理。
荧光显微镜中的光探测器
在大多数显微镜应用中,为了便于后续处理、分析和存档,快速记录大量荧光图像至关重要。过去,荧光图像主要通过感光胶片进行模拟记录。然而,在近二十年来,电子检测、分析和存储方法凭借其高效性得到了广泛应用。如今,荧光显微镜普遍配备了专门用于光检测、图像数字化和记录的系统。
在标准宽场荧光显微镜中,电荷耦合器件(CCD)相机是最常用的光探测器。而在激光扫描共聚焦显微镜中,光电倍增管(PMT)则更为常见。此外,增强型电荷耦合器件(ICCD)相机、电子倍增电荷耦合器件(EMCCD)相机以及雪崩光电二极管(APDs)等其他类型的光探测器,在现代荧光显微镜中的应用也日益重要。
电荷耦合器件(CCD)
在基于CCD的相机中,图像被投射到一个由半导体和光敏元件组成的阵列上,这些元件能够产生与入射光强度成正比的电荷(如图3.11所示)。目前主要生产两种传感器架构:前照式电荷耦合器件(FI CCD)相机和背照式电荷耦合器件(BI CCD)相机。在FI CCD相机中,光线首先穿过电极,然后到达感光硅层;而在BI CCD相机中,入射光则直接照射在硅层上(如图3.12所示)。值得注意的是,FI CCD的结构与人眼的解剖结构具有相似之处。在视网膜中,神经“线路”位于入射光的前方,光子必须穿过不感光的神经细胞层后,才能与感光细胞中的视紫红质发生相互作用。
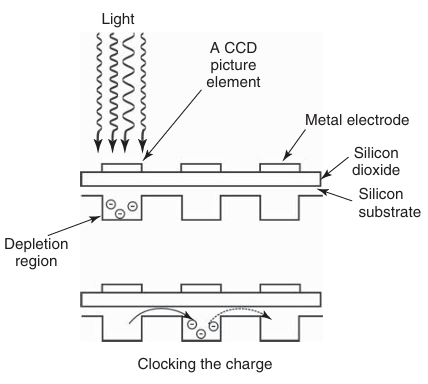
图 3.11 在 CCD 阵列中将光子转换为电荷及其传输过程。
当相机的光敏元件阵列(电容器、光电二极管;在数字显微镜中称为图像元素,即像素)暴露于光线下时,每个元件都会积累与入射光强度成正比的电荷(如图3.11所示)。这些电荷随后被逐个读取。电子控制系统将每个电荷转移到相邻的元件中,重复这一过程,直到所有电荷都被转移到电荷放大器中(如图3.13所示)。当各个电荷被转移到电荷放大器时,它们被转换为对应的电压值。这一过程不断重复,直至显微镜视场中所有像素检测到的光信号都被逐点转换为电压值。这些电压值随后被转换为离散的数字信号,并进一步映射为显示器上的亮度水平(如图3.14所示)。
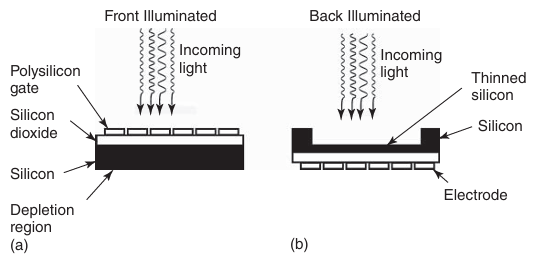
图 3.12 (a) 前照式和 (b) 背照式 CCD 的结构。
CCD相机的灵敏度及其记录强信号的能力受到多种因素的影响,包括电子噪声水平和电荷积累能力。若弱信号强度与噪声水平相当,则可能无法被有效检测。强信号也可能难以被准确记录。当CCD阵列暴露于过强光线下时,电荷可能充满电荷阱并达到最大电荷容量(饱和电荷)。这可能导致电荷溢出到相邻的电荷阱中,从而降低图像质量。理想情况下,只有击中相机光敏元件硅表面的光子才能有效积累电荷,这些电荷随后被转移和读取(如图3.14所示)。然而,即使在没有入射光的情况下,也会产生一些电子并被记录下来,这会增加显示图像的噪声(详见下文)。由于显微镜中遇到的荧光强度通常较低,荧光信号在相机噪声较高时可能难以被有效检测。
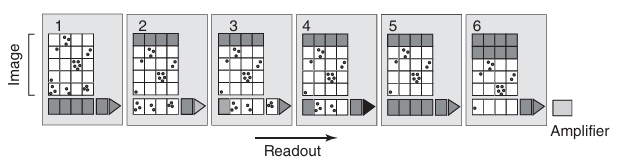
图 3.13 电荷通过 CCD 阵列传输至放大器的过程。
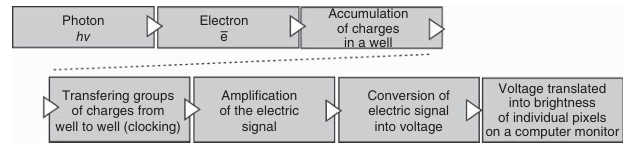
图 3.14 从光子在 CCD 阵列中的吸收,到在计算机屏幕上显示亮度的步骤的示意图。在某些数字相机中,信号的放大已经在芯片上完成(见下文相关部分)。
为了克服弱信号检测的挑战,可以将CCD阵列中相邻像素记录的光子合并,并作为一个整体进行读取。这种称为“像素合并”(binning)的技术如图3.15所示。图中,样本中的荧光结构以两条黑线表示,叠加在CCD阵列的局部区域上。在6×6的小像素阵列中,各个像素记录的弱信号在相机电子设备产生的背景噪声中显得微弱。然而,当采用3×3的大像素阵列时,四个相邻小像素区域的信号被累加。累加后的信号强度足以显著高于噪声水平,从而能够被有效检测。像素合并通过牺牲空间分辨率来提高信噪比。需要注意的是,图3.15旨在解释像素合并的原理和优势,但它是一种必要的简化,因为它没有考虑每个像素中由设备热噪声产生的暗电流噪声;这种噪声也会在像素合并过程中被累加。此外,延长曝光时间也有助于将弱信号从随机噪声中区分出来。对于低于标准CCD相机检测水平的极弱荧光信号,可以使用ICCD和EMCCD相机(详见下文)进行检测。
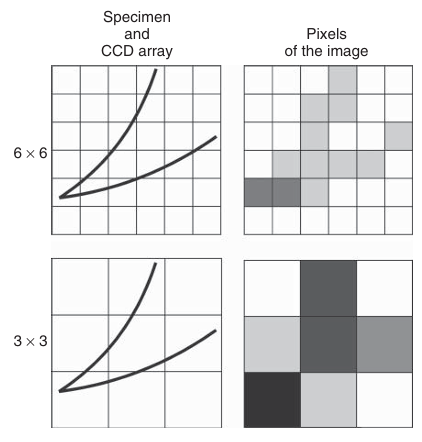
图 3.15 描述 CCD 传感器中像素合并(binning)原理的示意图。
CCD相机的光敏元件并非能够检测到所有入射光子,因为并非每个到达像素的光子都能产生一个电子。入射光子中产生电荷的比例,即探测器区域上所有入射光子中被有效转化为电荷的比例,被称为CCD相机的量子效率(Quantum Efficiency, QE)。这种效率具有波长依赖性。前照式电荷耦合器件(FI CCD)相机在可见光范围内的量子效率可达60%-70%,但在紫外光波段的检测能力几乎为零(如图3.16所示)。相比之下,背照式电荷耦合器件(BI CCD)相机的量子效率(QE)可高达95%,并且具有更宽的光谱响应范围,包括紫外光波段。这种差异源于BI CCD直接将光敏硅层暴露于入射光下,而FI CCD则需经过电极结构,从而导致部分光子损失。
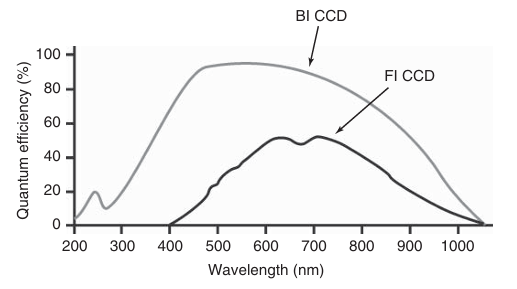
图 3.16 前照式和背照式 CCD 的量子效率与光谱响应。
增强型电荷耦合器件(ICCD)
荧光显微镜在成像过程中经常面临信号微弱的挑战,尤其是在需要快速记录数据时,图像采集尤为困难。标准的CCD相机由于读出噪声较高,往往难以有效检测到微弱的荧光信号。此外,标准CCD传感器的高灵敏度通常仅在相对较低的图像采集速率下才能实现。
相比之下,增强型电荷耦合器件(ICCD)相机提供了更高的灵敏度。标准的基于CCD的相机在接收到一个光子时只能产生一个电子,而ICCD相机则可以产生数千个电子。ICCD采用一种称为微通道板(Microchannel Plate, MCP)的放大装置,该装置置于标准CCD光传感器前方(如图3.17所示)。微通道板由光电阴极、一组微通道和荧光屏组成。入射到光电阴极上的光子通过光电效应产生一个电子,该电子在微通道内向荧光屏层移动,并在强电场作用下加速。在微通道内,电子不断撞击通道壁,产生更多的二次电子,最终到达荧光屏。在那里,每个电子都会引发一个光子的发射,这些光子随后被标准CCD相机的传感器记录。通过这种方式,微通道板放大了原本微弱的光信号,使得放大的信号能够被标准的CCD传感器有效检测。与标准CCD相机相比,ICCD可以将信噪比提高数千倍。
ICCD相机具备检测微弱荧光信号所需的高灵敏度(尽管初级光电阴极的灵敏度相对较低,量子效率通常不超过50%)。然而,其空间分辨率较低,背景噪声通常较高。此外,ICCD芯片容易因过强的光照而损坏。当需要快速记录数据且信号较弱时,电子倍增电荷耦合器件(EMCCD)相机是一个更为理想的选择。
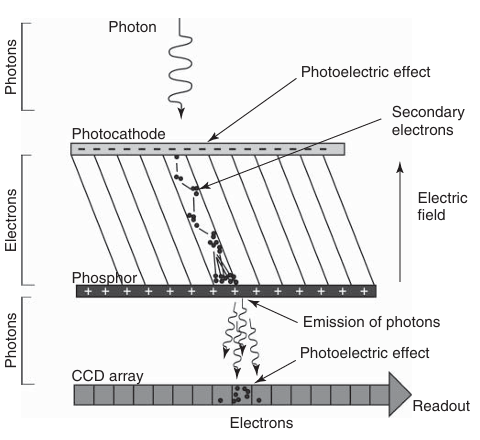
图 3.17 增强型 CCD 传感器中的信号放大过程。
电子倍增电荷耦合器件(EMCCD)
电子倍增电荷耦合器件(EMCCD)相机是检测微弱荧光信号的另一种高效选择。该设备以极低的读出噪声为特点,能够实现单光子级别的检测,具有极高的灵敏度。此外,EMCCD相机还具备高速成像、高量子效率和高数字分辨率等优势。
在EMCCD相机中,电荷信号的放大发生在电荷放大器放大之前,通过芯片内集成的电子倍增结构实现(即片上倍增)。EMCCD相机通常采用帧转移CCD架构(如图3.18所示;该技术也被应用于部分传统CCD相机),其核心组件包括一个串行(读出)寄存器和一个倍增寄存器。帧转移架构基于两个独立的传感器区域:用于捕获图像的成像区域和用于存储图像的存储区域。在图像读出之前,捕获的图像被快速转移到存储区域。存储区域通常覆盖有不透明的掩膜。在预设的图像积分时间结束后,成像区域捕获的图像被转移到存储区域,随后进行读出,同时成像区域开始下一次图像捕获。电荷通过读出寄存器和倍增寄存器被逐个转移,并在电荷放大器读出之前进行放大。
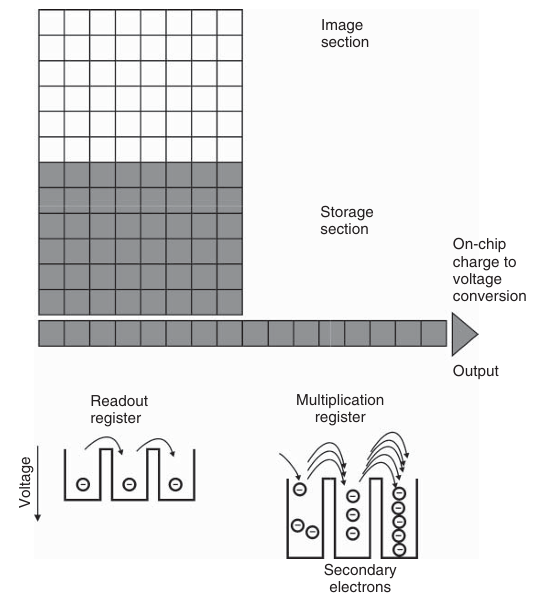
图 3.18 电子倍增电荷耦合器件(EMCCD)传感器的工作原理及信号放大过程。
读出寄存器是一种标准的CCD串行寄存器。随后,电荷被转移到倍增寄存器,这是一个通过施加远高于标准CCD串行寄存器所用电压,将电子从一个像素元件转移到下一个像素元件的区域。在高电场的作用下,会产生被称为次级电子的现象。这种由电压激活的物理过程被称为碰撞电离。随着越来越多的电子进入倍增寄存器的后续像素元件,形成一种“雪崩效应”:电压越高(即操作者设置的增益值),倍增寄存器中的像素数量越多,原始微弱荧光信号的总体倍增效果就越显著(如图3.18所示)。倍增过程非常迅速,因此EMCCD相机不仅具有极高的灵敏度,而且在保持标准CCD芯片高空间分辨率的同时,实现了高速成像。
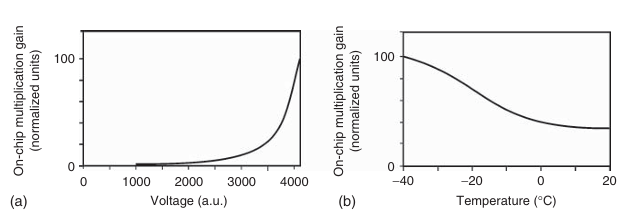
图 3.19 电子倍增电荷耦合器件(EMCCD)相机中片上倍增增益与(a)电压和(b)温度的关系。
次级电子的产生概率受到倍增时钟电压(如图3.19a所示)和传感器温度(如图3.19b所示)的影响。尽管次级电子的产生效率相对较低(每次转移约为0.01),但由于这一过程可以在较长的倍增寄存器的所有像素元件中发生,最终的倍增增益可以达到数百甚至更高。然而,这种放大并非没有代价。由于每个像素中电子的产生是一个随机过程,额外的增益会引入额外的噪声,这由所谓的噪声过剩因子F来衡量(详见第12章3.3节)。次级电子的产生概率随温度降低而减少,如图3.19所示。因此,冷却芯片在提高片上倍增增益方面具有额外优势。将芯片从室温冷却至-20°C,次级电子的产生概率可以增加一倍。一些EMCCD相机的冷却温度甚至可以达到-100°C。
较低的温度还会显著降低暗电流(详见下文)。因此,即使是非常微弱的信号也能够被有效检测,因为它能够被区分于噪声水平之上。在低温下降低噪声水平尤为重要,因为所有发生在电荷阱或串行寄存器中的非荧光信号都会与目标信号一同被放大。
CMOS 图像传感器
互补金属氧化物半导体(CMOS)图像传感器是电荷耦合器件(CCD)的一种替代选择。需要注意的是,CMOS一词实际上指的是在硅片上制造晶体管的技术,而非图像捕获的方法。与CCD类似,CMOS传感器也利用光电效应:当光子与硅半导体相互作用时,电子从价带被激发到导带。这些电子被收集在势阱中,并转换为电压。这与CCD传感器不同,后者首先将电荷转移到寄存器中,然后再转换为电压。随后,测得的电压通过模数转换器转换为计算机显示器上单个像素的亮度值。
CMOS传感器的制造过程将数字逻辑电路、时钟驱动器、计数器和模数转换器与光电二极管阵列集成在同一硅基底上。在这方面,CMOS传感器的架构与CCD器件显著不同。在CCD中,每个光电二极管的电荷首先被转移到芯片上,然后依次在芯片外读出。而典型的CMOS光电二极管结构如图3.20所示,实际的光敏元件和读出放大器被集成在一起。光电二极管积累的电荷在像素内部被转换为放大的电压,然后单独传输到芯片的模拟信号处理部分。
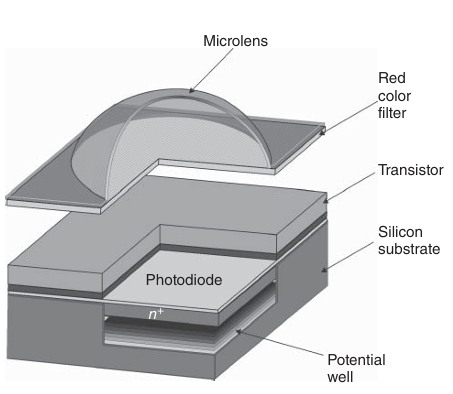
图 3.20 单个 CMOS 光电二极管的结构图。
CMOS传感器阵列中,部分区域由不参与光收集的电子元件构成,这导致可用于光收集的传感器面积受限,从而影响了设备的光灵敏度。然而,通过在传感器上方放置微透镜阵列,将入射光聚焦到每个光电二极管上,可以有效缓解这一问题。
CMOS图像传感器的独特架构使其能够独立读取整个光电二极管阵列中的单个像素数据。因此,用户可以选择传感器上的特定区域进行图像构建(即感兴趣区域读出)。这一特性使得CMOS传感器在诸多显微镜应用中极具吸引力。近年来,CMOS技术取得了显著进步,如今的CMOS传感器在许多低光照显微镜应用中,甚至能够与高端EMCCD相机相媲美。目前,市场上已涌现出像素尺寸为6.5×6.5微米、分辨率为2048×2048像素的CMOS传感器,其量子效率超过70%,读出速率高达每秒100帧。
科学级 CMOS(sCMOS)
最初,基于 CMOS 的数字相机在性能上不如高端 CCD 相机,尤其是在灵敏度、数据采集速度和数字分辨率方面,EMCCD 相机长期以来一直是最佳选择。然而,CMOS 技术近年来取得了显著进展。最新的设计——科学级 CMOS(sCMOS)——在许多高要求的显微镜应用中,甚至能够与 EMCCD 传感器相媲美。
SCMOS 传感器的优势包括:大面积阵列、小像素尺寸、低读出噪声、高帧率、高动态范围以及不存在倍增噪声。这些特性使得 sCMOS 相机在现代显微镜成像中成为一个极具吸引力的选择,尤其是在需要快速成像和高灵敏度检测的应用中。
CCD 和 CMOS 相机的特点
CMOS 和 CCD 相机本质上是单色设备,它们仅响应光电二极管中积累的电子总数,而不区分导致电子从硅基底释放的光的颜色。在荧光显微镜中,通常需要检测两种或更多颜色的光。为此,通常会使用一系列发射滤光片依次收集选定光谱带中的图像。当需要同时测量时,会在显微镜上安装两台数字相机。
尽管许多数字相机制造商使用相同类型的 CCD 芯片,但特定相机的最终噪声水平、数据采集速度和动态范围可能会有很大差异。这些差异主要源于驱动相机的电子元件和软件的不同。因此,用户应探索相机的功能和软件选项,以识别噪声来源、校准相机,并针对特定实验类型优化图像采集。
为荧光显微镜选择数字相机
乍一看,计划购买新的荧光显微镜系统的研究人员似乎应该在预算允许的情况下选择市场上最好的数字相机。然而,实际上并不存在一款“最适合荧光显微镜的数字相机”。相机的选择应根据具体应用而定。
制造商通常会提供关于芯片和软件的重要信息,包括像素大小、量子效率、满阱容量、各种噪声贡献的大小、图像采集速度,以及相应的可实现分辨率、校准工具和噪声去除功能等。仔细分析市场上各种相机的技术参数是至关重要的。然而,没有任何方法能替代使用典型样本对不同相机进行测试,因为样本才是研究人员的主要研究对象。
光电倍增管(PMT)
尽管电荷耦合器件(CCD)和互补金属氧化物半导体(CMOS)相机能够几乎同时记录整个视场的图像(并行过程),但光电倍增管(PMT)则用于点检测,即它一次仅记录图像中一个选定点的光强。因此,PMT通常不应用于标准宽场荧光显微镜,而是作为激光扫描共聚焦显微镜中的主要光探测器。
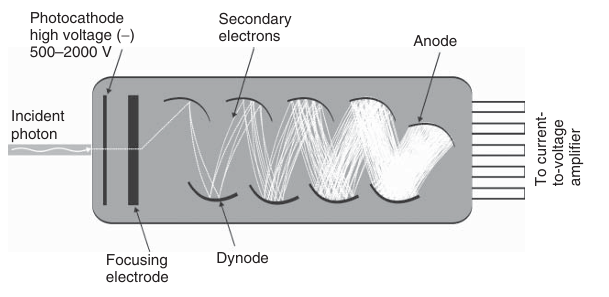
图 3.21 光电倍增管的示意图。
光电倍增管(PMT)是一种利用光电效应和二次电子发射现象(即电子在真空管中使电极释放其他电子的能力)来放大光信号的装置。光线通过石英(或玻璃)窗口进入PMT,并照射到由碱金属制成的光敏表面,即光电阴极(如图3.21所示)。光电阴极释放的电子随后撞击一系列电极,即倍增极,每个倍增极都会释放出更多的二次电子。这些二次电子又会依次撞击下一个倍增极。通过在相邻倍增极之间施加高电压(1-2千伏),电子被加速,这一过程不断重复,从而显著放大了光电阴极上产生的初始电流。在最后一个倍增极处测量的电流与照射到光电阴极上的光强度成正比。通过倍增极放大电流,可以实现高达10⁷-10⁸的增益。
然而,即使在没有光照的情况下,施加到倍增极的电压也会导致PMT中产生低水平的电子流,这在荧光图像上表现为非零的背景读数。PMT的量子效率通常不超过30%。PMT是一种能够检测单个光子的快速探测器,对紫外光和可见光具有很高的响应速度,其响应时间可低至几纳秒,因此可用于追踪极其快速的动态过程。在激光扫描共聚焦显微镜中,通常会使用2-5个PMT作为选定光谱波段的荧光探测器。
雪崩光电二极管(APD)
雪崩光电二极管(APD)是一种利用内光电效应放大光信号的半导体器件。其核心部件是p-n结(或p-i-n结,如图3.22所示)。当一个具有足够能量的光子入射到二极管时,它会激发一个电子,产生一个自由电子和一个带正电的空穴。通过在阳极和阴极之间施加高反向偏置电压,自由电子和空穴分别在电场作用下形成电子流和空穴流。电子在电场中加速运动,并与晶体硅中的原子发生碰撞,从而诱导出更多的电子-空穴对。这一过程类似于光电倍增管(PMT)中的倍增效应,但APD的量子效率可高达90%,远高于PMT,且响应时间也比PMT快数倍。然而,APD的增益相对较低,通常在500到1000之间。目前,单光子雪崩光电二极管(SPAD)已被广泛应用于荧光寿命成像显微镜(FLIM)中,作为重要的光探测器。
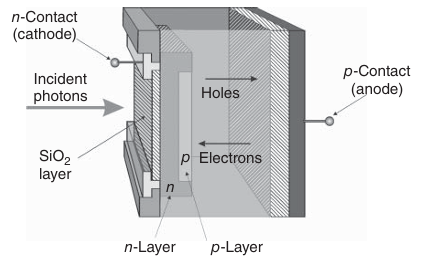
图 3.22 雪崩光电二极管的示意图。
数字显微镜图像中的噪声类型
雪崩光电二极管(APD)是一种利用内光电效应放大光信号的半导体器件。其核心部件是p-n结(或p-i-n结,如图3.22所示)。当一个具有足够能量的光子入射到二极管时,它会激发一个电子,从而产生一个自由电子和一个带正电的空穴。通过在阳极和阴极之间施加高反向偏置电压,自由电子和空穴分别在电场作用下形成电子流和空穴流。在强电场中加速运动的电子,会与晶体硅中的原子发生碰撞,进而诱导出更多的电子-空穴对。这一过程类似于光电倍增管(PMT)中的倍增效应,但APD的量子效率可高达90%,远高于PMT,且响应时间也比PMT快数倍。然而,APD的增益相对较低,通常在500到1000之间。目前,单光子雪崩光电二极管(SPAD)已被广泛应用于荧光寿命成像显微镜(FLIM)中,作为重要的光探测器。
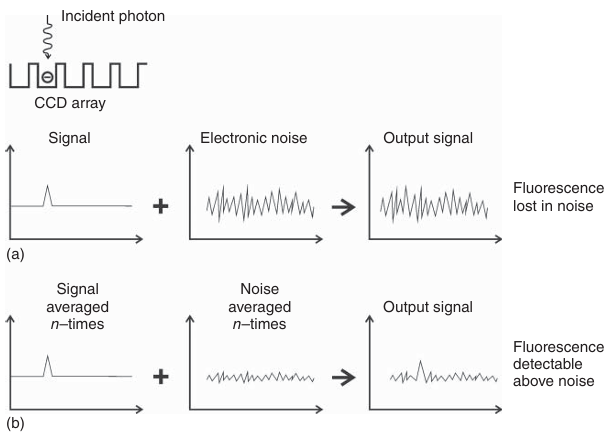
图 3.23 信号平均化与微弱荧光信号的检测。 (a) 如果信号强度与相机电子元件产生的噪声水平相当,则微弱信号无法被检测到。 (b) 当对稳定的荧光信号图像进行平均化处理时,噪声会被平均掉,从而相对于信号而言变得相对较低。需要注意的是,此简化示意图未考虑暗噪声。
通过对大量图像帧进行平均处理,可以提高信号在噪声水平之上的可检测性。然而,由于光漂白现象会不可避免地导致荧光信号减弱,而噪声水平保持相对稳定,实验人员很少有机会收集同一视场的多幅图像。能够被探测器有效记录并区分于噪声水平之上的荧光信号强度范围,被称为探测器的动态范围。更精确地说,动态范围是指可检测信号的最大值与最小值之间的比率。因此,电荷耦合器件(CCD)相机的动态范围等于饱和电荷(满阱容量)除以读出噪声(即在无光照条件下产生的噪声),两者均以电子数表示。相机的动态范围越高,意味着其能够更真实地记录更广泛的荧光强度范围(如图3.24所示)。然而,需要注意的是,以这种方式定义的探测器动态范围并不提供关于其绝对灵敏度的任何信息。
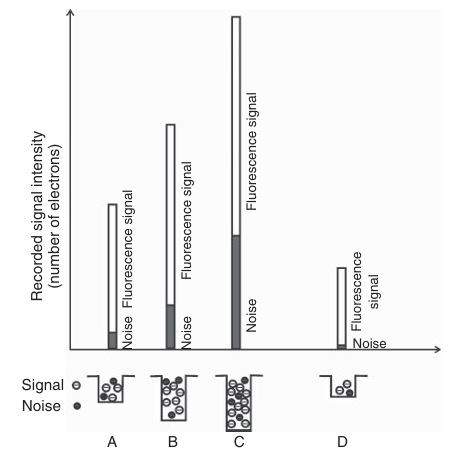
图 3.24 四种假设的数码相机动态范围和灵敏度的示意图。相机 A、B、C 和 D 接收到的输入信号足以填满其电荷阱,因此每种情况下的信号都是不同的。记录的信号由噪声贡献和荧光光子组成,如图中条形所示。噪声和荧光产生的电子填满电荷阱的最大容量,象征性地显示在条形下方。相机 A、B、C 和 D 产生不同水平的噪声,因此它们检测微弱信号的能力也各不相同。传感器 A、B 和 C 具有相似的动态范围,即最大可记录荧光信号与噪声水平的比值相似,但它们检测强信号的能力不同——相机 C 的表现最佳。相机 A 比相机 B 或 C 更灵敏。相机 D 的动态范围非常低,但其噪声水平也非常低,因此它是四台相机中最灵敏的。然而,相机 D 不适合用于检测强信号。这些相机的最大可记录信号水平不同,这是由于它们的传感器电荷阱深度不同所致。
通过增加积分时间,可以从噪声中“提取”微弱的荧光信号(如图3.25所示)。如果光漂白速率不足以抵消积分所带来的信号增强,这种方法是有效的。然而,长时间的积分过程会显著降低图像采集速度。因此,尽管电荷耦合器件(CCD)相机最终能够记录微弱的信号,但这一过程可能相对耗时。另一种检测微弱信号的有效方法是使用增强型电荷耦合器件(ICCD)或电子倍增电荷耦合器件(EMCCD)。这些设备在实际读出信号之前,即在不可避免地引入读出噪声之前,通过两种不同的方式对信号进行放大。
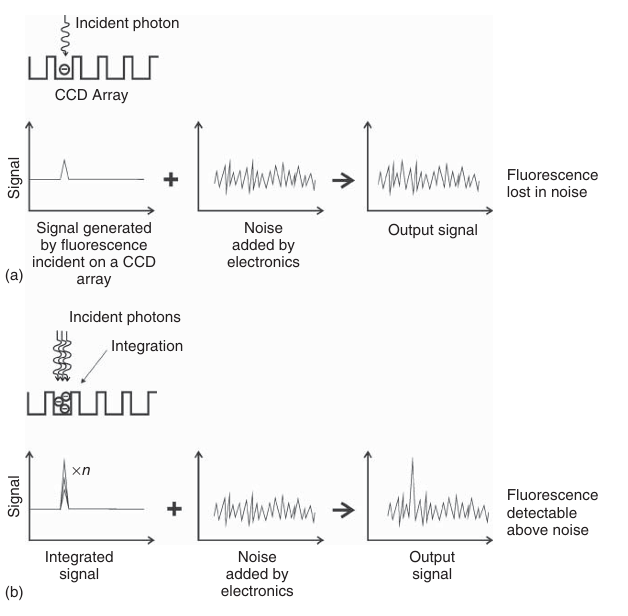
图 3.25 积分作用可将微弱信号提升至高于噪声水平。积分是将入射荧光光子相加的过程,由于积分后电子噪声的水平保持不变,因此积分可以提高信噪比。此简化示意图未考虑暗噪声。 (a) 作为单帧收集的信号,即未进行积分处理。 (b) 信号的积分处理。
为了深入理解数字相机开发人员为实现微弱信号检测所采用的各种策略,我们需要简要讨论几种常见的噪声类型。在之前的相机类型工作原理和构造讨论中,我们已经提及了部分噪声来源。一般来说,数字显微镜图像中的噪声主要来源于以下三个方面:(i)暗电流噪声,(ii)光子噪声(散粒噪声),和(iii)读出噪声。
暗电流(暗噪声)是由半导体传感器电荷阱在无外部光照条件下,因热运动导致的电子发射而产生的。随着电荷耦合器件(CCD)芯片积分时间的增加,积累的热电子数量也会增加,从而在图像中产生可检测的背景信号。有效的芯片冷却可以显著降低暗电流,因为电子发射的概率与温度密切相关。通过背景扣除的方法,可以从最终图像中有效去除暗电流。需要注意的是,暗电流噪声不应与由低水平的自发荧光或免疫荧光制备中抗体的非特异性结合所产生的荧光背景信号混淆。
光子噪声,也称为散粒噪声,源于光的量子特性,反映了到达传感器表面的光子时间分布的随机性。即使荧光发射物体是均匀染色的,到达传感器光敏元件的光子频率也具有随机性,遵循泊松统计分布。这意味着,在给定小体积的连续照明样本中,产生并到达探测器的光子数量在不同时间间隔内会有所不同(为简化起见,我们忽略光漂白)。这也意味着,当对样本中相同的(非漂白)体素进行重复成像时,如果在一次测量中检测到n个光子,后续测量的光子数量将在√n范围内波动。缺乏经验的显微镜使用者常常将图像中某些区域的颗粒状结构误认为是荧光信号的真实变化,或将局部信号强度的差异误解为荧光标记浓度的差异。然而,这些图像特征很可能仅仅是荧光显微镜研究中通常收集到的光子数量极少所致。
读出噪声产生于将传感器电荷阱中产生的电荷转换为电压并进行数字化的过程中。相机制造商通常通过指定每个像素的均方根(RMS)电子数来提供“片上”产生的噪声信息。例如,10e⁻ RMS表示每个像素的读出噪声水平为10个电子。因此,即使所有像素包含相同数量的电子,读出电荷后的信号仍将显示出10个电子的标准偏差。在低信号水平下,光子噪声是主要的噪声来源。由于供应商可能会将同一种光敏芯片与不同的电子设备连接,因此不同来源的相机中的电子噪声水平也可能存在差异。
除了上述主要噪声来源外,其他因素也可能导致信号的不可预测变化或非零背景水平。这些因素包括光响应的不均匀性(即噪声值随图像传感器位置的变化)和暗电流的不均匀性。光响应的不均匀性是由于CCD芯片中各个像素将光子转换为电子的效率存在差异。科学级相机的像素间变化通常较低,一般不超过2%。可以通过记录一个理想均匀荧光物体(例如,染料溶液)的图像,并使用标准图像处理工具创建校正掩模,来校正各个像素之间光灵敏度的差异。暗电流的不均匀性源于每个像素产生暗电流的速率略有不同。暗电流也可能因传感器温度变化等原因在较长时间内发生漂移。
总而言之,不同类型的噪声以不同的方式影响最终图像质量。增强型电荷耦合器件(ICCD)、互补金属氧化物半导体(CMOS)和电子倍增电荷耦合器件(EMCCD)数字相机所代表的片上倍增技术,为研究开辟了新的途径,使得快速且高空间分辨率地检测非常微弱的信号成为可能。
定量荧光显微成像
荧光强度与标记目标浓度的测量
荧光显微镜图像通常被用作结构信息的来源,即关于目标分子空间分布的信息。例如,观察成纤维细胞中微管的免疫荧光染色图像,研究人员可以判断细胞内特定位置是否存在微管蛋白。然而,在这种情况下,荧光信号的局部强度并未被视为微管蛋白局部浓度的量化指标。这是因为荧光信号的强度不仅取决于微管蛋白的存在与否,还受到微管相对于焦平面的位置影响。此外,免疫荧光染色本身可能存在不均匀性,例如,由于空间位阻,抗体可能无法完全接触到微管,从而导致染色不完整。因此,荧光信号的强度并不一定能准确反映微管蛋白的局部浓度。
在这种情况下,研究人员主要关注的是微管网络的结构。图像的解释基于一个基本假设:所有微管都能被抗体染色至可检测的程度。然而,在许多研究中,我们不仅关注标记蛋白或其他目标分子的存在与否,还希望了解它们的局部浓度。为了获取这类定量信息,我们需要将荧光显微镜作为一种分析工具来使用。
然而,必须明确的是,标准的宽场荧光显微镜并非直接测量样本中标记分子数量的理想分析设备。相比之下,共聚焦显微镜在定量分析方面具有更大的优势。尽管可以在宽场荧光显微镜中对局部浓度进行粗略估计,但显微镜使用者需要牢记以下几点。
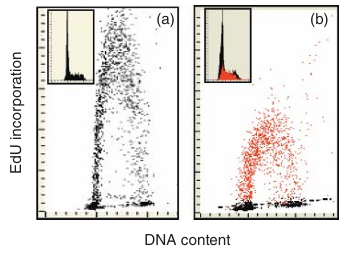
图 3.26 激光扫描细胞术(LSC)用于测定大量细胞中每个细胞的 DNA 含量以及每个细胞中新合成的 DNA 含量(在给予 DNA 前体 EdU 冲脉后;参见图 3.4)。DNA 用 DAPI 染色,EdU 则用 AlexaFluor 488 荧光标记。 (a) 未经处理的对照培养细胞;(b) 细胞暴露于过氧化氢(200μM)60 分钟,显示新合成的 DNA 含量减少。摄取 EdU 的细胞用红色标记,并在插图中的 DNA 直方图中显示。每个散点图或直方图代表在超过 3000 个细胞中测量的蓝色(DAPI)和绿色(EdU)荧光信号。(a) 和 (b) 中的插图显示了基于相应培养物 DAPI 信号的 DNA 频率直方图。
任何尝试估计荧光分子相对浓度(在同一视场内)或绝对浓度的努力,都基于一个隐含的假设:结合的荧光探针量与目标分子的量呈正相关。然而,这一假设很少能完全成立。以DNA结合荧光探针为例,在约50种能够结合DNA的荧光探针中,仅有少数几种以(近乎)化学计量比的方式结合,例如4',6-二脒基-2-苯基吲哚(DAPI)、Hoechst、碘化丙啶和DRAQ5。大多数DNA染料也会结合RNA,因此在测量DNA局部浓度之前,必须进行RNA水解。Hoechst和DAPI对RNA的亲和力较低,但碘化丙啶是一个对RNA具有较高亲和力的探针。尽管如此,碘化丙啶仍然是流式细胞术和激光扫描细胞术中测量细胞DNA含量的常用DNA探针。由于碘化丙啶和其他DNA亲和染料会与蛋白质竞争结合DNA,因此测量绝对DNA含量变得更加复杂。研究表明,碘化丙啶结合DNA的量在固定细胞中更高,因为一些与DNA结合的蛋白质被移除后,更多的结合位点被释放。这意味着,对DNA含量的评估需要在所研究的系统中进行仔细的校准,包括使用同一种细胞类型和相同的RNA去除程序等。当采取这些措施时,对DNA局部浓度的评估可以相当精确。例如,通过使用DAPI或Hoechst染色DNA,并使用激光扫描细胞仪(LSC,如图3.26所示)记录图像,可以简单且可靠地确定单个细胞中DNA的相对含量。
与测量同一视场内的相对浓度相比,测量荧光标记目标的绝对浓度更具挑战性。在尝试进行此类测量时,显微镜使用者需要考虑前文所述的限制,以及以下影响估计精度的因素:
- 探测器响应的线性;
- 探测器的动态范围;
- 光晕现象,即图像边缘的荧光强度低于图像中心;
- 不同物镜的光收集效率和透光率;
- 焦平面位置相对于物体的影响;
- 不同细胞区域中荧光探针的非均匀漂白;
- 平衡染色时荧光探针的动态交换;
- 荧光猝灭(探针之间或探针与氧气之间)的影响;
- 自猝灭探针漂白后荧光强度可能增加;
- 荧光探针在激发光照射下的光谱特性变化;
- 内滤效应。
即使是如此长的列表,对于某些荧光探针和样本类型来说,也可能并不全面。它至少说明了一个事实:在显微镜中测量荧光标记分子的浓度是一项复杂且繁琐的任务。尽管如此,荧光显微镜中相对准确地测量细胞内绝对浓度的一个重要例子是活细胞中钙离子和其他离子的比率测量,这将在下一部分中简要介绍。
比率测量(Ca²⁺、pH)
某些荧光染料不仅能通过改变荧光强度来响应钙离子或氢离子浓度的变化,还能通过改变两个发射波段的光谱特性来响应这些变化(如图3.27所示)。在这种情况下,荧光强度的比率(而非绝对荧光强度)可以与钙离子浓度或pH值建立关联。这种方法具有一个重要的优势:理论上,两个发射波段的比率与荧光探针的局部浓度无关。因此,常见的染料浓度变化(如离子流入、通过多药耐药机制的泵出、光漂白等)不应影响测量结果。
对利用比率测量细胞内钙离子和pH值的优势和局限性进行详细讨论,超出了本节的范围。然而,建议读者在使用这些技术时,务必充分考虑其潜在的局限性。例如,钙染料对钙离子的螯合可能会干扰细胞内钙离子平衡,而将细胞内钙离子指示剂暴露在光照下可能会产生单线态氧,进而导致各种光毒性效应。因此,比率测量需要经过仔细的校准和优化。
在细胞内,λ₁处检测到的荧光强度反映了探针在不同局部的浓度差异。而在λ₂处,细胞内的荧光强度不仅取决于探针的局部浓度,还与目标分子X的局部浓度相关。通过计算发射强度I₁(在λ₁处)与I₂(在λ₂处)的比值,可以获得目标分子X浓度的测量指标(如图3.27c所示)。图3.27d和e示意性地展示了在两种不同目标分子X浓度(c₁和c₂)下,分别在λ₁和λ₂处收集的图像,而图3.27f展示了“比率图像”。在这些比率图像中,每个像素代表I₁与I₂的比值。该比值与探针的局部浓度无关,能够反映细胞内目标分子X的浓度。
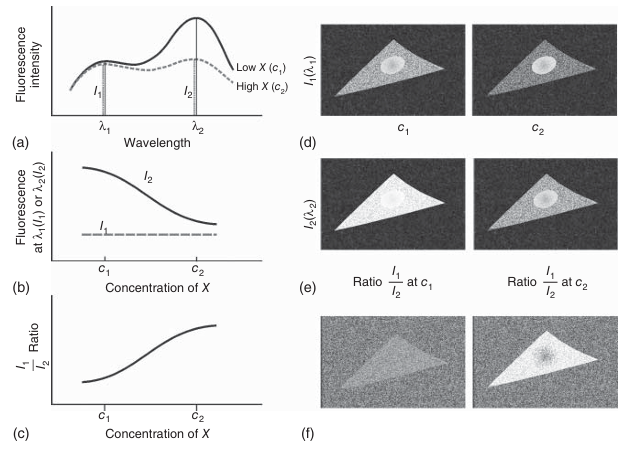
图 3.27 荧光比率测量的基本原理。 (a) 中示意性地展示了一种荧光团的发射光谱,其与分子 X(例如钙离子)的浓度相关。在波长λ₁处,发射强度 I₁与 X 的浓度无关;而在波长λ₂处,发射强度 I₂随 X 的浓度增加而降低,如 (b) 所示。
三维荧光显微镜中的尺寸测量
在样本平面上进行校准和尺寸测量是相对直接的,正如基础显微镜书籍中所详述的那样。然而,现代宽场荧光显微镜(包括图像去卷积显微镜)处理的是三维物体,而非仅限于二维图像。因此,沿光轴(即Z轴)的尺寸精确测量同样至关重要。这种测量相对复杂,因为物镜相对于样本的移动并不一定使图像平面在样本内以相同的距离移动。这种差异可能源于浸没介质和样本折射率的不匹配,从而导致球差。在使用油浸物镜对远离盖玻片表面的水性样本进行成像时,这种现象尤为显著(如图2.22所示)。相比之下,水浸物镜受到的影响较小。
值得注意的是,荧光显微镜中亚细胞结构的尺寸测量受到衍射的限制,且具有波长依赖性。在样本平面上,小于光波长一半的物体尺寸无法被准确分辨。沿光轴的物体长度测量精度大约低3倍。然而,亚分辨率物体之间的距离可以被更精确地测量。例如,在各类显微镜实验中,研究人员已成功测量了多种小型亚细胞结构质心之间的距离。
此外,荧光显微镜还提供了一种更为复杂的方法,用于检测相距仅几纳米的分子,即荧光共振能量转移(Förster Resonance Energy Transfer, FRET),该方法将在后续章节中进行详细介绍。
激发光强度的测量
在定量显微镜的系统校准或光学元件对准检查中,常常需要了解并比较从物镜射出的激发光强度。市场上提供了多种功率计,可用于测量不同波长的光强度。然而,需要特别注意的是,这些功率计通常配备平面入射窗口,并且要求与入射光束直接接触。对于高数值孔径(NA)的油浸或水浸物镜,其产生的光锥无法被平面窗口的功率计准确测量。这是因为光锥边缘的光线会以较大的角度入射到功率计的窗口上,从而导致显著的反射损失。因此,直接将简单的平面窗口功率计放置在高NA物镜前方,无法获得准确的射出光强度测量结果。
相比之下,对于低数值孔径(NA)的物镜(例如10×物镜),这种测量方法是可行的。
定量荧光显微镜的技术要点
定量荧光显微镜分析的成功与否,取决于能否识别并有效控制影响显微镜性能和测量能力的诸多因素。除了前文(第3.4节)提及的参数外,这些因素还包括显微镜主体、荧光探针的光谱和光物理特性,以及特定样本的性质。
关于显微镜的关键因素包括:
- 激发光源的稳定性;
- 色差和球差的存在;
- 通道配准问题,即由于显微镜光学元件的非理想对准,导致两个颜色通道的图像在焦平面上出现偏移;
- 检测通道之间的串扰,即一种荧光团发射的光子被多个检测通道错误检测;
- 荧光标记发射光波长对分辨率的影响(例如,红色发射标记的分辨率通常低于蓝色发射标记);
- 某些染料与细胞成分结合时发生的色移;
- 显微镜的机械稳定性;
- 激发与发射波段的最佳选择。
关于荧光探针,需要考虑以下因素:
- 光漂白的动力学特性;
- 染料之间或染料与氧气之间的碰撞猝灭以及自猝灭;
- 在使用多种颜色时,可能发生荧光共振能量转移(FRET),从而导致供体信号意外丢失;
- 光毒性效应,例如光毒性可能导致原本位于细胞外的染料进入受损细胞,溶酶体在光照下破裂,或者由于荧光探针的作用引发钙振荡。
对于每个特定样本,还需要注意以下问题:
- 某些光谱区域中存在的自发荧光;
- 内滤效应;
- 激发光的散射;
- 样本老化。
此外,特定标记物可能存在的不同结合位点也需要考虑,例如在讨论DNA染色染料时提到的问题,以及在使用抗体进行免疫标记时常见的交叉反应性。
需要注意的是,显微镜生成的是实际三维样本的二维图像。由于激发光不仅照亮了焦平面上的区域,还照亮了该平面以上和以下的区域,因此荧光总是在样本的较大体积中被激发。激发光和发射荧光都会在这个区域内散射,导致大量的离焦光被检测为背景。离散的荧光样本组分似乎被一圈“光晕”包围,甚至样本中荧光结构之间的区域也似乎在发光。这种模糊和背景在扫描激光共聚焦显微镜中被最小化。
荧光显微镜的局限性
荧光显微镜的应用范围及其在活细胞研究中的实用性受到三个主要问题的限制,即荧光探针的光漂白、毒性和光毒性。
光漂白
光漂白是一个渐进的过程,在此过程中,由于激发光与荧光化合物之间的相互作用,样本的荧光强度会逐渐减弱。这种现象是由于荧光染料分子发生了光化学破坏,导致其荧光性质丧失。由于这种功能性染料的丢失发生在观察过程中,光漂白会严重影响高质量图像数据的采集。然而,通过优化图像记录参数,特别是降低激发光的强度,可以显著减少光漂白的不利影响(如图3.28所示)。
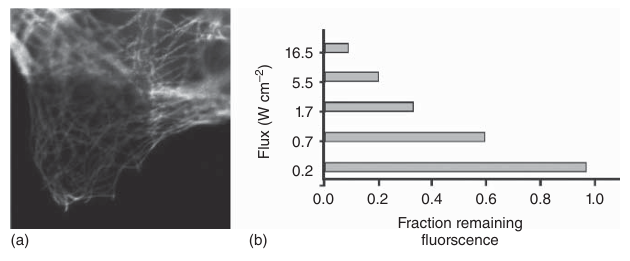
图 3.28 光漂白现象。 (a) 一个荧光样本的正方形区域被暴露在激发光下。图像显示了一个更大的视野,包含了最初被照亮的区域,从而展示了发生光漂白的区域。 (b) 激发光的强度对光漂白速率有显著影响。在此例中,一个带有 eGFP(增强型绿色荧光蛋白)的样本被暴露在相同光剂量下,但光束强度不同。在高强度光照射下,荧光几乎完全被漂白(仅约 10%的初始信号保留),而使用强度低两个数量级的光时,虽然需要更长的数据采集时间,但未检测到信号损失。
样本中染料荧光的衰减通常是由光氧化引起的,即在光照作用下,染料分子发生氧化反应。荧光探针的光漂白通常是一个不可逆的过程,但其他由光诱导的反应(不涉及氧化但会导致荧光分子结构改变)也可能发生。通过在样本中添加还原剂和/或活性氧清除剂,通常可以减缓信号衰减的速度。这些试剂包括N-丙基没食子酸和巯基乙醇。尽管自制或商业化的抗光漂白试剂在防止信号衰减方面可能非常有效,但它们的添加往往会降低初始信号的强度。这种现象很少被显微镜使用者注意到,因为他们通常在记录任何图像之前就将抗氧化溶液添加到样本中。
光漂白的当前应用是一个将“劣势”转化为“优势”的绝佳例证。曾经,光漂白是成功进行荧光成像的一大障碍,如今却已成为许多前沿显微镜技术的核心工具。例如,荧光恢复后光漂白(FRAP)及相关技术、通过受体光漂白检测荧光共振能量转移(FRET),以及包括光激活定位显微镜(PALM)和随机光学重建显微镜(STORM)在内的高分辨率技术,都依赖于光漂白现象。FRAP技术基于在选定视场中永久性光漂白一部分荧光分子,并记录这些分子在光漂白区域中由于动态交换而恢复(或未能恢复)荧光的速率。而PALM、STORM及相关技术则利用某些荧光分子能够暂时失去荧光的能力。
在氧化或还原条件下可逆的光漂白
传统上,光漂白被认为是荧光团在激发光照射下发生的不可逆荧光损失,这一直是荧光显微镜应用的主要限制。然而,近年来,研究人员发现某些荧光蛋白可以通过暴露于不同波长的光照,实现可逆的漂白和荧光恢复。这一特性具有极高的应用价值,目前已被广泛应用于现代超分辨率显微镜技术中。
更令人兴奋的是,最近的研究表明,在特定条件下,某些小分子染料也能够实现暂时性的漂白,这意味着荧光的丢失并非总是永久性的。通过特定波长的强光照射,荧光可以在一定时间内恢复。这表明,在特定的还原/氧化条件下,荧光的丢失是可以被逆转的。
光毒性
在活细胞成像实验中,被荧光标记并暴露于激发光的细胞会受到光动力效应的影响。这种效应是指在光敏剂(如荧光染料)和分子氧的存在下,光对细胞造成的损伤。与细胞成分相互作用的荧光染料充当光敏剂,从而引发多种类型的细胞损伤。例如,小分子染料通常通过与氧相互作用产生不良影响。相比之下,荧光蛋白(如增强型绿色荧光蛋白,eGFP)的发色团被蛋白质部分屏蔽,防止其与分子氧直接接触,这或许可以解释为什么荧光蛋白通常表现出较低的光毒性。

图 3.29 一个荧光探针对活细胞造成光毒性效应的示例。 HeLa 细胞在含有钌苯并菲复合物 Ru (phen)32+的培养基中孵育,该复合物作为一种细胞外光敏剂(见图 a)。已知该复合物在 458 nm 光照射下会产生单线态氧。将培养在共聚焦显微镜载物台上的细胞暴露于 458 nm 光下(0-600 帧,如图上方所示)。最初损伤的迹象包括细胞膜的起泡以及 Ru (phen)32+缓慢进入细胞内部——这在复合物与细胞核中的 DNA 结合时显现出来(见图 b,150 帧)。随后,细胞膜的完整性被破坏,复合物迅速进入细胞,与细胞内结构结合,并在细胞内积累到高浓度,导致细胞核和细胞质的荧光显著增强(见图 c-e,250-600 帧)。
光毒性效应可能表现为细胞功能的显著改变,例如细胞膜完整性丧失(如图3.29所示)、细胞从基底脱离、细胞膜起泡以及线粒体膜电位丧失。然而,有时即使是致命的损伤在初期也可能相当隐蔽。例如,DNA碱基的光氧化和DNA断裂等损伤可能导致细胞死亡,但在细胞成像实验期间或之后可能难以被轻易检测到。
因此,认识到光诱导的损伤可能会严重改变细胞的生理状态至关重要,但这种影响可能在相当长的时间内都无法被明显察觉。特别是在活细胞实验中,不可避免的光毒性可能对细胞生理产生显著影响,从而影响所收集图像数据的准确解读。因此,在实验设计和数据分析中,需要谨慎评估光毒性对细胞生理的潜在影响。
光学分辨率
阿贝公式(第2章)描述了影响样本平面光学分辨率的关键参数。然而,该公式仅适用于噪声可忽略不计的理想图像。在荧光显微镜中,图像通常具有较高的噪声水平和较低的信号强度,且信号会因光漂白而持续减弱。在这种条件下,噪声水平实际上成为决定空间分辨率的关键因素(如图3.30所示)。
显微镜在样本水平平面上的光学分辨率约为250纳米,这一数值取决于成像所用光的波长(第2章)和物镜的数值孔径(NA)(如图3.31所示)。沿光轴方向的分辨率与NA的平方成反比。对于高质量的物镜,NA通常大于1,因此沿光轴的分辨率通常远差于700纳米。
大多数亚细胞结构的尺寸远低于光学显微镜的分辨率极限。例如,生物膜的厚度为5-10纳米,肌动蛋白丝的直径约为7纳米,微管的直径约为25纳米,而早期内体的直径可达100纳米。这意味着,典型的光学显微镜无法分辨线粒体内膜的褶皱、紧密排列的肌动蛋白纤维、微管或内体。这些结构虽然可以通过电子显微镜轻松分辨,但由于完整细胞的厚度较大以及电子束引起的损伤,电子显微镜无法用于活细胞研究。
因此,对于生物学家而言,通过荧光显微镜实现显著更高的空间分辨率显得尤为重要。这一目标如今已通过几种新型显微镜技术得以实现,这些技术将在第8-10章中详细介绍。
小物体的错误表示
即使是像 eGFP 分子这样最小的发光物体,在荧光显微镜图像上也会以一个衍射受限的信号表示,这是一个直径不小于约 250 纳米的明亮圆形。这意味着,小于约 250 纳米的物体的大小会被荧光显微镜错误地表示(见图 3.32)。
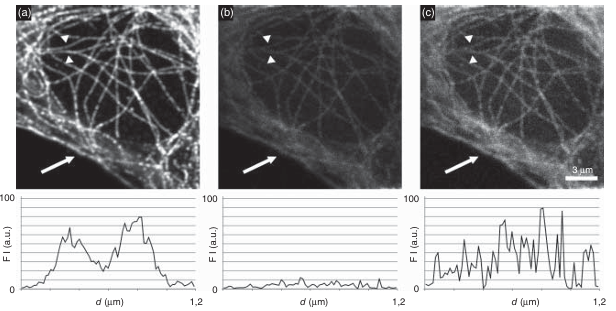
图 3.30 信噪比(S/N)对图像质量的影响。 (a) 通过免疫荧光染色的微管图像在高荧光信噪比下被记录。箭头所指的线条是穿过两条微管的荧光强度分布图(下方)的绘制路径。 (b) 当信噪比因光漂白而降低时,同一区域的图像。 (c) 将 (b) 中的图像亮度增加后的效果。在 (a)、(b) 和 (c) 的荧光强度分布图中可以看出,当信噪比降低时,图像分辨率显著下降。当荧光信号强度相对于噪声较低时,两条微管在视觉上无法分辨。在箭头标记的区域,图像分辨率的损失也清晰可见。
令人困惑的是,这意味着观察者在解释荧光图像时需要格外谨慎。细胞和细胞核的大小能够被准确呈现,但肌动蛋白纤维、微管、早期内体的直径,以及细胞膜的厚度——所有这些在同一图像中观察到的结构——都会被严重夸大,与细胞整体大小相比显得过大且不成比例。
 图 3.31 阿贝公式及数值孔径在图像分辨率中的作用。 (a) 阿贝公式被镌刻在德国耶拿市的一座纪念碑上。 (b) 耶拿光学博物馆中的恩斯特·阿贝雕像。 (c) 和 (d) 展示了来自摇蚊(Chironomus tentans)多线染色体片段的图像,染色用于显示凝聚和松弛的染色质。这些图像分别使用数值孔径(NA)为 0.7(图 c)和 1.4(图 d)的镜头拍摄,展示了高数值孔径下显著更高的分辨率。由于数值孔径更高,原始图像(图 d)比图像(图 c)更亮,因此为了清晰起见,提高了图像(图 c)的亮度。
图 3.31 阿贝公式及数值孔径在图像分辨率中的作用。 (a) 阿贝公式被镌刻在德国耶拿市的一座纪念碑上。 (b) 耶拿光学博物馆中的恩斯特·阿贝雕像。 (c) 和 (d) 展示了来自摇蚊(Chironomus tentans)多线染色体片段的图像,染色用于显示凝聚和松弛的染色质。这些图像分别使用数值孔径(NA)为 0.7(图 c)和 1.4(图 d)的镜头拍摄,展示了高数值孔径下显著更高的分辨率。由于数值孔径更高,原始图像(图 d)比图像(图 c)更亮,因此为了清晰起见,提高了图像(图 c)的亮度。
总结与展望
在过去的二十年里,荧光显微镜技术经历了前所未有的迅猛发展。推动这一技术领域发展的关键努力主要集中在多个研究方向。这些方向包括利用荧光恢复后光漂白(FRAP)、荧光共振能量转移(FRET)、斑点显微镜、荧光相关光谱(FCS)和荧光寿命成像显微镜(FLIM)等技术,深入研究细胞内的动态事件。此外,新型高分辨率显微镜技术,如受激发射损耗(STED)显微镜、结构化照明(SI)显微镜、光激活定位显微镜(PALM)和随机光学重建显微镜(STORM),以及高灵敏度和大视场的光片荧光显微镜,也获得了显著进展。同时,配备中等倍率物镜(mesolens)的显微镜也在不断开发中。现代光学显微镜技术还扩展到用于研究大量细胞的仪器开发,例如激光扫描细胞术(LSC)、高通量筛选以及“成像流式细胞术”(即流式细胞术的扩展)等技术。
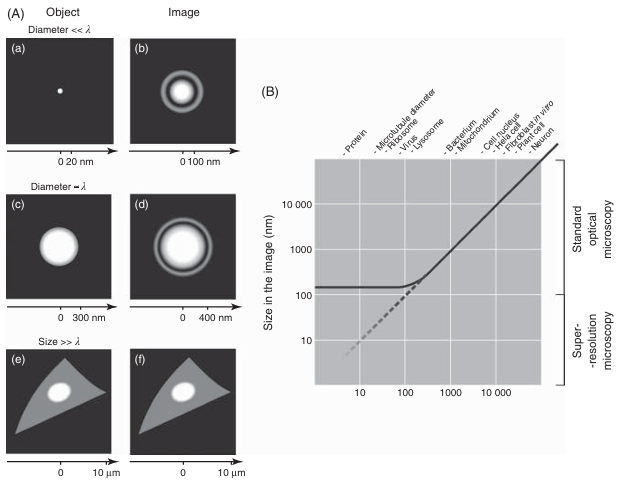 图 3.32 荧光显微镜中小物体的误表示。 (A) 小物体(左侧)及其由标准荧光显微镜生成的图像(右侧)的示意图。一个直径为 3 纳米的明亮小球(如图 a 所示)的图像是一个直径约 250 纳米的大圆,周围环绕着干涉条纹(如图 b 所示)。当对直径与光波长相当(几百纳米)的小球(如图 c 所示)进行成像时,图像的直径能够较为合理地反映真实大小(如图 d 所示),即与视野的比例大致正确,但边缘会出现干涉效应。当对体外动物细胞(大小为 10-30 微米,如图 e 所示)进行成像时,其大小和形状能够被正确反映,且干涉效应不太明显(如图 f 所示)。需要注意的是,图 a 中的物体和对应的图像 b 并未按比例绘制。如果要保持 3 纳米小球与其对应图像的比例,图像 b 的尺寸将大于打印它的页面。图 b 和图 d 中的干涉条纹强度被夸大了。 (B) 物体的真实大小与荧光显微镜图像中物体大小的关系。物体越小,相对变形越大。小物体图像中干涉条纹的相对贡献也越大。例如,细胞成分(如蛋白质分子,如果能够被检测到)或细胞膜的厚度,在与细胞核或整个细胞等较大物体的同一图像中,会显得过大。新的超分辨率显微镜方法旨在提高空间分辨率,减少小物体的误表示。
图 3.32 荧光显微镜中小物体的误表示。 (A) 小物体(左侧)及其由标准荧光显微镜生成的图像(右侧)的示意图。一个直径为 3 纳米的明亮小球(如图 a 所示)的图像是一个直径约 250 纳米的大圆,周围环绕着干涉条纹(如图 b 所示)。当对直径与光波长相当(几百纳米)的小球(如图 c 所示)进行成像时,图像的直径能够较为合理地反映真实大小(如图 d 所示),即与视野的比例大致正确,但边缘会出现干涉效应。当对体外动物细胞(大小为 10-30 微米,如图 e 所示)进行成像时,其大小和形状能够被正确反映,且干涉效应不太明显(如图 f 所示)。需要注意的是,图 a 中的物体和对应的图像 b 并未按比例绘制。如果要保持 3 纳米小球与其对应图像的比例,图像 b 的尺寸将大于打印它的页面。图 b 和图 d 中的干涉条纹强度被夸大了。 (B) 物体的真实大小与荧光显微镜图像中物体大小的关系。物体越小,相对变形越大。小物体图像中干涉条纹的相对贡献也越大。例如,细胞成分(如蛋白质分子,如果能够被检测到)或细胞膜的厚度,在与细胞核或整个细胞等较大物体的同一图像中,会显得过大。新的超分辨率显微镜方法旨在提高空间分辨率,减少小物体的误表示。
这些技术的扩展得益于新型小分子荧光探针和荧光蛋白标记物的开发(见第 4 章),以及新的图像分析工具的出现。因此,荧光显微镜已经发展成为一种能够在完整活细胞中进行生化研究的分析工具。