荧光显微成像系列——荧光标记
引言
光学成像技术是现代生命科学研究中不可或缺的关键工具,其中荧光显微镜技术尤为重要。它能够在细胞和分子水平上,实时、动态地观察和研究复杂的生物学过程。然而,生物分子的固有荧光通常较弱且缺乏特异性,这限制了其直接应用范围。经过多年的发展,科学家们已经开发出一系列性能优异的荧光标记物和可激活探针。这些工具能够用于活细胞和固定细胞中的分子水平生化过程研究,极大地拓展了荧光显微镜的应用领域。借助这些外源性探针,细胞、组织乃至整个生物体都可以被高度选择性地标记,从而以高对比度清晰地可视化特定的结构和生物分子。尽管如此,选择合适的荧光探针和标记策略仍然是一项极具挑战性的任务。本章将对荧光成像剂进行概述,并深入探讨在探针选择过程中需要考虑的关键因素。
荧光标记物的关键特性
荧光成像的潜力在很大程度上取决于所使用的荧光团的物理化学特性。这些特性包括其化学结构、分子大小、光学性质(详见第3章)、生物相容性,以及染料与生物分子之间的相互作用。
一般来说,可供选择的荧光团种类繁多。这些荧光团主要包括:小分子有机染料、纳米颗粒(例如半导体量子点和金属纳米团簇),以及基因编码的荧光蛋白(FPs)(如图4.1所示)。 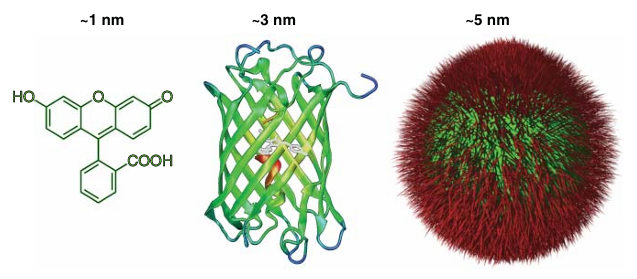 图 4.1 荧光标记物及其相对尺寸。从左到右依次为:有机染料、类似 GFP(绿色荧光蛋白)的荧光蛋白和纳米晶体。
图 4.1 荧光标记物及其相对尺寸。从左到右依次为:有机染料、类似 GFP(绿色荧光蛋白)的荧光蛋白和纳米晶体。
表 4.1 荧光标记物——关键特性对比
| Class | Examples | Brightness | Photostability | Biocompatibility | Environmental sensitivity | Two-photon excitation |
|---|---|---|---|---|---|---|
| AlexaFluor | AlexaFluor488 | ×××× | ×××× | ×××× | ×× | ××× |
| Atto | Atto488 | ×××× | ××××× | ×××× | ×× | ××× |
| BODIPY | BODIPYTMR | ××× | ×× | ×××× | ××× | ×× |
| Coumarin | Coumarin6 | × | × | ××× | ×××× | × |
| Cyanines | Cy5, Cy7 | ××× | ×××× | ××× | ×× | × |
| Fluorescein | FITC | ××× | × | ××× | ×××× | ×× |
| Rhodamines | Rhodamine6G | ××× | ×××× | ×× | ××× | ××× |
| Quantumdots | — | ××××× | ××××× | × | × | ××××× |
| GFP-likeproteins | EGFP, EosFP | ×× | ×× | ××××× | ×× | ×× |
| Phycobiliproteins | R-phycoerythrin | ×××× | ×× | ×× | ×× | ×××× |
表 4.1 对各种荧光标记物进行了总体比较,但仅凭这些信息仍不足以选择特定的荧光团。为此,必须进一步考虑一些关键特性,而这些特性往往因具体应用而异。例如,这些特性可能会影响检测的灵敏度和方法的动态范围,决定对特定目标或事件的检测可靠性,以及是否能够同时检测多个目标(即多重检测)。
表 4.2 荧光标记的关键性能
| Property | Definition/impact |
|---|---|
| Optical properties | |
| Excitation spectrum | Wavelength dependence of the ability of light to induce f luorescence emission of a chromophore |
| Extinction coefficient 𝜀𝜆 (M−1 cm−1) | Quantity characterizing a fluorophore's ability to absorb photons at a particular wavelength λ |
| Emission spectrum | Wavelength dependence of the emitted fluorescence |
| Stokes shift | Wavelength shift between excitation and emission bands |
| Fluorescence quantum yield (QY) | Ratio between the number of photons emitted and the number of photons absorbed |
| Molecular brightness | Product QY×𝜀quantifies the relative rate of photon emission from different fluorophores under identical excitation conditions |
| Photostability | Resistance to photobleaching, quantified by the quantum yield of photobleaching, that is, ratio of the number of photobleached molecules to the total number of photons absorbed in a sample during the same time interval |
| Physicochemical properties | |
| Size | Most often, the smaller the better |
| Material | May affect chemical stability, toxicity, options to functionalize the probe |
| Solubility | Most biological applications require aqueous solvents |
| Cytotoxicity | Effect on sample viability |
| Phototoxicity | Effect on sample viability |
| Conjugation chemistry | Determines labeling target |
| Localization of target | Affects the choice of conjugation |
| Metabolism of target | Determines temporal stability of labeled construct in live cells |
一般来说,理想的荧光标记物应具备以下特性:足够的光稳定性,能够被现有光源便捷地激发;在生物基质的固有荧光背景下产生尽可能低的背景荧光;具有足够的亮度,以便通过常规仪器进行检测。显然,对于生物应用,标记物还需要在缓冲溶液、细胞培养基或体液中具有良好的溶解性。根据具体的应用需求,其他重要的考虑因素可能还包括标记物的空间位阻和尺寸效应、发射光谱的pH依赖性、标记物进入细胞的能力、潜在的毒性,以及是否适用于多重检测。表4.2总结了荧光标记物的关键特性及其对潜在实验的重要性。
光学特性方面,主要包括激发和发射光谱、消光系数和量子产率(QY)。从显微镜硬件的角度来看,光学特性应与现有的激发和检测设备相匹配。由于有机染料和荧光蛋白(FPs)的激发光谱由单一窄带组成,现有光源可能会限制选择范围。相比之下,量子点的激发光谱较宽,从紫外光延伸到发射最大值以下的波长区域。从样品的角度来看,激发波长应与样品最佳的光学透过率和最小自发荧光波长区域相一致。由于光毒性和光散射在长波长下降低,因此在活细胞成像中,优先选择激发/发射最大值在近红外(NIR)区域的荧光团。
需要注意的是,最丰富的内源性荧光团(如芳香族氨基酸、脂褐素、吡啶核苷酸(NADPH)和黄素辅酶)主要在蓝绿光区域发射荧光。激发波长处的消光系数反映了荧光团吸收光子的能力,应尽可能高。有机染料和FPs的消光系数通常为10⁴-10⁵ M⁻¹cm⁻¹,而量子点的消光系数可能高达其100倍。
对于有机染料和FPs,激发和发射波长紧密相关,主要发射带通常比主要激发带红移(斯托克斯位移)20-40 nm。较大的斯托克斯位移有助于有效过滤散射的激发光和发射荧光。量子点的发射波长则取决于其尺寸,其发射带对称且较窄(量子点的半高全宽FWHM约为30-90 nm,而有机染料和FPs的FWHM约为70-100 nm)。结合其宽带吸收和尖锐的发射带,量子点特别适合多色应用。
荧光发射效率通过量子产率来量化,即荧光团发射的光子数与吸收的光子数之比。然而,要使荧光团明亮,它还需要具有高光子吸收能力。因此,引入了一个称为“分子亮度”的参数,定义为量子产率与激发波长处消光系数( )的乘积。
除了这些光物理特性外,荧光标记物的基本物理和化学特性也决定了其适用性。通常,我们假设这些标记物在实验期间至少是化学稳定的。有机染料和量子点本质上是疏水的,需要通过引入羧酸或磺酸等功能基团来提高其在水溶液中的溶解性。FPs是蛋白质,因此本质上是水溶性的,但某些FPs在高浓度下可能表现出聚集倾向,可通过适当的分子工程来提高其溶解性。芳香族染料的溶解性通常会随着分子尺寸的增加而降低,因此需要引入附加的带电基团来改善溶解性。
物理尺寸是荧光标记物的一个关键特性,不同荧光标记物之间的尺寸差异显著(如图4.1所示)。在传统的衍射受限荧光显微镜中,荧光标记物的尺寸及其与目标结构的连接方式对定位精度的影响可以忽略不计。然而,在超分辨率成像中,这种影响变得不可忽视。一般来说,较小的标记物通常具有更好的组织穿透能力,并且对生物靶标的生理活性影响较小。然而,这一特性需要针对每个具体应用进行深入研究。
化学毒性是另一个重要参数,尤其是在活细胞和生物体的长期实验中。生物分子衍生的标记物,例如荧光蛋白(FPs),在这方面似乎是最佳选择。尽管有报道称FPs的表达可能与某些病理异常相关,但这种情况较为罕见。重要的是,FPs在活细胞中的表达水平应保持适度,以避免潜在的负面影响。
荧光染料的系统毒性通常较低,尽管它们可能会在细胞内的特定部位积累,从而产生局部毒性。半导体量子点(如CdSe)由于其化学组成,对活体样本具有一定的毒性。然而,如果将有毒的纳米晶体核心紧密封装在化学稳定的外壳中(例如二氧化硅或聚合物),其毒性可以被有效抑制。尽管如此,关于量子点长期影响的可靠评估仍然缺乏。
除了化学毒性外,光毒性也是需要考虑的重要因素。光毒性源于光激发荧光团的电子特性,特别是荧光团在激发时可能与分子氧反应生成多种活性氧(ROS)。这些ROS会对样品中的蛋白质、核酸和其他生物分子造成损伤,从而导致光毒性。光漂白通常也是由同一过程引起的:激发态染料与分子氧反应生成ROS,导致单线态氧的产生。单线态氧具有高度反应性,可能会攻击染料并不可逆地破坏其共轭π电子体系,从而抑制荧光。
量子点因其刚性纳米晶体结构和强键合原子而表现出最高的光稳定性,这并不令人意外。然而,未钝化的量子点会促进ROS的生成,最终可能导致细胞死亡。为了最小化光毒性和光漂白,可以采用降低激发功率或应用氧清除系统的方法。氧清除系统通常包括具有还原活性的物质,用于去除氧气和高效的三重态猝灭剂。这些试剂主要用于体外实验。例如,常用的氧清除系统由葡萄糖氧化酶和过氧化氢酶组成,缓冲液中含有毫摩尔浓度的β-D-葡萄糖。另一种系统使用原儿茶酸(PCA)和原儿茶酸-3,4-双加氧酶(PCD)。此外,还可以使用还原剂,如抗坏血酸(AA)、丙基没食子酸、β-巯基乙醇和特罗洛克斯。最近,研究者引入了一种还原(如抗坏血酸)和氧化(如甲基紫)剂的组合(ROXS,还原和氧化系统),以有效耗尽三重态,并快速恢复氧化和还原态,从而同时抑制多种光漂白反应。
最后,在选择荧光标记物时,必须考虑如何将荧光团靶向目标生物分子。标记物必须配备适当的官能团,使其能够与目标结合。目标分子的特性(例如可用于连接标记物的化学官能团、浓度和定位)决定了标记的特异性。需要考虑的关键问题包括目标上的潜在连接位点数量及其位置,既要保留目标的功能特性,又要确保标记物的可及性和连接化学的特异性。目标分子的可及性和浓度也是选择标记策略的重要因素。
合成荧光团
有机染料
有机染料通常是具有共轭π电子体系的平面分子,其典型尺寸约为1-2纳米,分子量在500-1500 g/mol之间。在有机染料中,荧光素是最受欢迎的代表之一,它于1871年首次被合成。自那以后,合成染料的种类急剧增加。如今,市场上已有大量小分子荧光团可供选择,它们被广泛应用于生物大分子的共价标记。这些染料可以根据其核心骨架结构被划分为不同的家族。 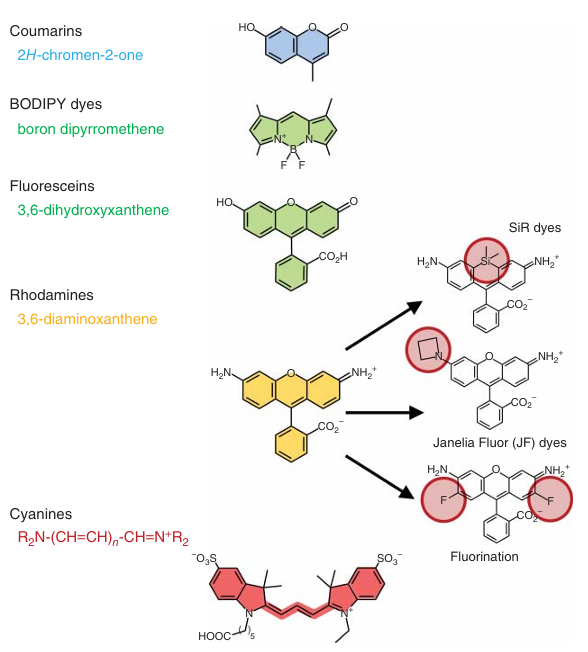 图 4.2 合成荧光染料的示例。其核心结构框架根据其最大发射波长的不同而被着色。
图 4.2 合成荧光染料的示例。其核心结构框架根据其最大发射波长的不同而被着色。
图4.2展示了最常见的有机染料家族,包括香豆素、BODIPY染料、荧光素、罗丹明和菁染料。图中根据染料骨架的激发/发射波长进行了颜色编码。在寻找合适的染料时,我们可能会遇到“ATTO染料”或“AlexaFluor染料”等术语。这些是品牌名称(ATTO染料:ATTO-TEC GmbH,德国锡根;AlexaFluor染料:Thermo Fisher Scientific,美国马萨诸塞州沃尔瑟姆),它们本身并不提供关于染料结构的任何信息。从图4.2的结构可以看出,随着荧光团离域π电子体系的扩展及其尺寸的增加,激发和发射波长也随之增加。例如,香豆素由两个环组成,吸收和发射在蓝色光谱区域,而具有三个环的荧光素则在绿色光谱区域发射。
这些合成荧光团的一个关键优势在于其性质可以通过化学方法进行调控。通过扩展双键共轭、增加额外的环以增强刚性,以及引入电子吸引基团或带电取代基(如氟或磺酸盐),可以优化其波长范围、亮度、光稳定性和自猝灭特性。罗丹明骨架是染料开发中最受欢迎的模板之一。例如,SiR染料是罗丹明的衍生物,其10位上的氧原子被硅原子取代(见图4.2),与原始染料相比,其激发和发射最大值显著红移。所谓的Janelia Fluor(JF)染料则是通过将四甲基罗丹明中的N,N-二甲氨基取代基替换为四元氮杂环丁烷环而获得的,它们在亮度和光稳定性方面表现出显著提升。此外,罗丹明染料的氟化可以使发射红移,并赋予染料穿透活细胞的能力。未来,随着对特定应用需求的深入理解,还将进一步开发和优化这些染料。
每一类染料都有其独特的优势和劣势(见表4.1)。一般来说,有机染料具有较高的消光系数(10⁴-10⁵ M⁻¹cm⁻¹)、典型的20-40 nm的斯托克斯位移,以及中等到较高的量子产率。通常,吸收和发射光谱是彼此的镜像。由于光谱线的宽度较大,少量的染料分子即可覆盖整个可见光和近红外区域。然而,这也意味着在同一个样本中使用多种染料进行标记(“多重检测”)时会受到限制,因为光谱重叠可能导致不同染料分子之间的串扰。如果两种染料的激发光谱部分重叠,仍可以选择一个仅激发其中一种染料的波长。实际上,只要两种染料的发射带能够很好地分离,交叉激发就不是问题。然而,部分重叠的激发光谱通常伴随着重叠的发射带,这会导致发射串扰(“发射渗漏”),使得发射信号无法被明确归因于其中一种染料,除非它们没有交叉激发。
为了将这些标记物特异性地靶向生物分子(无论是在体外还是体内),它们需要通过适当的官能团进行功能化(详见第4.3.3节)。幸运的是,近年来,大量功能化的染料已经商业化,并且不断通过新的和先进的变体进行扩展,这些变体针对特定应用进行了优化。然而,更复杂的染料通常价格昂贵(>200美元/g)。
荧光纳米颗粒
半导体量子点是一种纳米晶体,通常由CdSe核组成,或者在其外部包裹一层ZnS外壳(如图4.3a和b所示)。这些量子点的核心半径一般在2-5纳米之间。量子点的发射波长不仅取决于其尺寸(如图4.3a所示),还与核心材料的性质密切相关。它们能够从紫外光的短波长区域吸收能量,直至略低于其发射波长(如图4.3c所示),这意味着单波长的激发光源可以轻松激发不同尺寸、对应不同发射波长的量子点。量子点的消光系数非常高,尤其是在紫外光区域(ε > 10⁶ M⁻¹cm⁻¹),并且具有较高的量子产率。其发射带相对较窄(半高全宽FWHM为30-90纳米),并且呈对称分布(如图4.3d所示)。 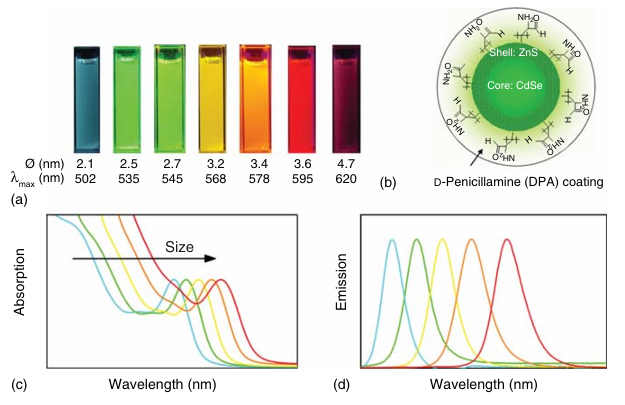
图 4.3 (a) 量子点的荧光发射特性。尺寸标注于下方。 (b) 水溶性半导体量子点(QD)的组装示意图:CdSe(硒化镉)核心、ZnS(硫化锌)外壳以及用于溶解的涂层。 (c) 不同尺寸量子点的吸收光谱。 (d) 不同尺寸量子点的发射光谱。
量子点还具有显著的光稳定性,这使得它们特别适合需要长时间高强度光照的实验。对于单个量子点(以及有机染料和荧光蛋白,FPs),一个有趣的现象是荧光间歇性,也称为闪烁或闪耀。这种特性可能对单颗粒跟踪(SPT)等应用产生不利影响。半导体核壳量子点通常在有机溶剂中合成,最初在水溶液中不溶。生物应用需要额外的(亲水性)涂层,以使量子点在水中溶解。这些涂层还可以提供用于与生物分子结合的官能团(如图4.3b所示)。虽然已有多种方法被报道用于水溶化量子点,但每种方法都有其优势和劣势,并且在一定程度上影响了量子点作为理想生物标记物所需的特性,包括小尺寸、化学稳定性和荧光量子产率。通常,水溶性量子点在生命科学中的应用受到其在生理介质中胶体稳定性差和与生物材料(尤其是细胞膜)的非特异性相互作用的限制。由于其较大的尺寸,附着在量子点上的生物分子数量和特定空间排列难以控制。例如,一些商业量子点由于额外的聚合物外壳,总半径可达10-20纳米,这与有机染料相比是一个明显的劣势。这种较大的尺寸可能会阻碍受体结合位点的访问或蛋白质的运输。然而,最近也设计出了具有单价结合的小型量子点。
金属纳米颗粒也表现出尺寸和形状依赖的光学和电子特性,使其可用作生物标记物。直径为几十纳米的金纳米颗粒(AuNPs)由于块体电子的等离子体激发而强烈散射光。非常小的荧光金纳米团簇(直径小于2纳米)仅由几个到几十个原子组成,表现出离散的、尺寸可调的电子跃迁和相当高的荧光量子产率(约10%)。AuNP表面可以很容易地用含有巯基、膦和胺等功能基团的配体修饰,以赋予它们在水中的胶体稳定性。此外,还可以将寡核苷酸、蛋白质和抗体等附加基团附着在AuNPs上,以赋予它们特定的功能。然而,化学和荧光稳定性问题仍然限制了荧光纳米团簇在细胞或组织成像中的应用。
碳点构成了另一类最近发现的纳米颗粒,尺寸小于10纳米,具有尺寸和激发波长依赖的光致发光特性。它们最终可能取代目前使用的有毒半导体量子点。其他由硅、碳化硅和锗制成的纳米颗粒也最近被提议作为生物标记物,显示出卓越的生物相容性。从光物理特性来看,荧光纳米颗粒似乎优于有机染料,具有更高的亮度和更好的光稳定性。此外,通过改变纳米颗粒的尺寸,可以轻松调节其发射波长。然而,它们的常规使用受到商业可用标记系统的数量有限和可重复性不足的限制。目前,建议在一组实验中使用同一批次的纳米颗粒,并在使用前对每一批纳米颗粒的特性进行表征。限制其应用的一个关键问题是缺乏简单易用的工具,用于将纳米颗粒靶向细胞内或组织和生物体内的特定生物分子(详见第4.3.5节)。
合成荧光团的结合策略
理想情况下,荧光标记物修饰生物分子后,应得到一个在功能上与未修饰形式完全相同的结合物。然而,在实际操作中,这往往难以实现。因此,必须进行严谨的对照实验,以确保标记过程不会干扰正在研究的生物学功能。
每个结合过程都涉及生物分子上的一个官能团与荧光团上的另一个官能团发生反应,从而形成共价键。根据具体的应用需求,可能需要实现荧光团与生物分子之间的1:1化学计量比。在某些情况下,目标可能是从构建体中获得最大的荧光发射。然而,这并不意味着需要尽可能多地将荧光团连接到生物分子上,因为染料在高密度下容易发生自猝灭。此外,荧光团也可能通过光诱导的电子转移而被猝灭。例如,可氧化的供体(如鸟嘌呤碱基和色氨酸残基)可能会将电子转移至激发态的荧光团,从而导致荧光量子产率降低。尽管电子转移是一个短程过程,但将荧光团连接到这些基团附近仍可能显著影响荧光效率。
商业有机染料通常配备有适合与生物分子反应的官能团。例如,N-羟基琥珀酰亚胺(NHS)酯可用于与胺基反应,异硫氰酸酯也可用于此类结合。此外,马来酰亚胺和碘乙酰基团则可用于与硫醇基团反应。这些官能团的设计使得荧光团能够特异性地结合到生物分子上,从而实现高效的标记。
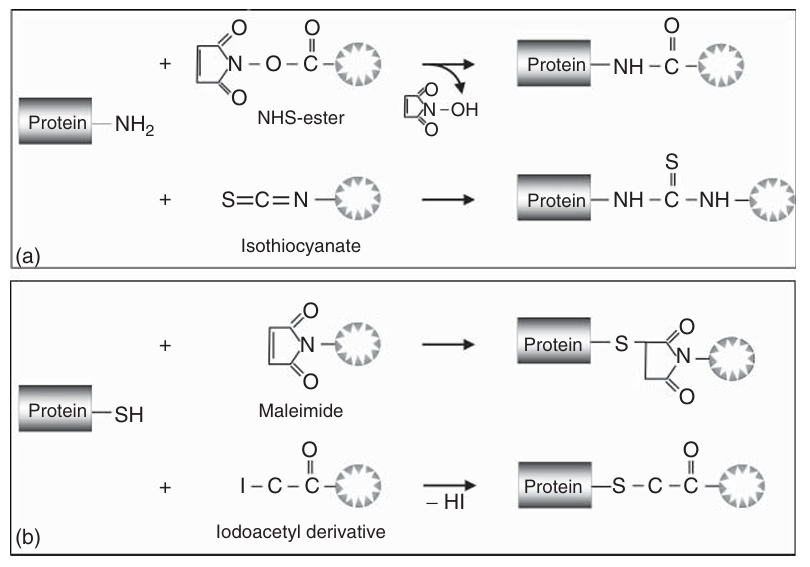 图 4.4 荧光标记物连接化学:(a) 胺基反应性官能团和 (b) 巯基反应性官能团。
图 4.4 荧光标记物连接化学:(a) 胺基反应性官能团和 (b) 巯基反应性官能团。
N-羟基琥珀酰亚胺(NHS)酯衍生物(如图4.4所示)能够与伯胺和仲胺发生交联反应,分别形成稳定的酰胺键和酰亚胺键。在蛋白质中,NHS酯试剂可以与N端α-胺以及赖氨酸侧链的ε-胺结合。这种方法虽然能够有效标记蛋白质,但其标记程度和特异性通常难以精确控制。这是因为蛋白质分子中通常存在多个赖氨酸残基,且这些残基的可及性各不相同,因此每个分子上的确切连接位点和标记数量在整个样本中会有所差异。一般来说,已发表的标记方案需要根据具体蛋白质,对染料与蛋白质的比例以及反应条件(如时间、温度和pH)进行优化。
马来酰亚胺(如图4.4所示)则通过与硫醇(-SH)基团发生烷基化反应,形成稳定的硫醚键。在pH 7时,马来酰亚胺与硫醇的反应速度比与胺的反应速度快约1000倍。然而,在较高pH下可能会发生一些交叉反应。由于携带硫醇基团的氨基酸——半胱氨酸在典型蛋白质中的含量远低于赖氨酸,因此硫醇衍生化可能允许在单一位点进行标记。事实上,定点突变常用于将多肽链中已有的少量半胱氨酸替换为其他氨基酸,并引入一个额外的半胱氨酸残基,从而实现蛋白质的特异性标记。
由于赖氨酸和半胱氨酸残基在所有蛋白质中普遍存在,这些技术通常仅限于体外标记纯化的生物分子(见框4.1)。
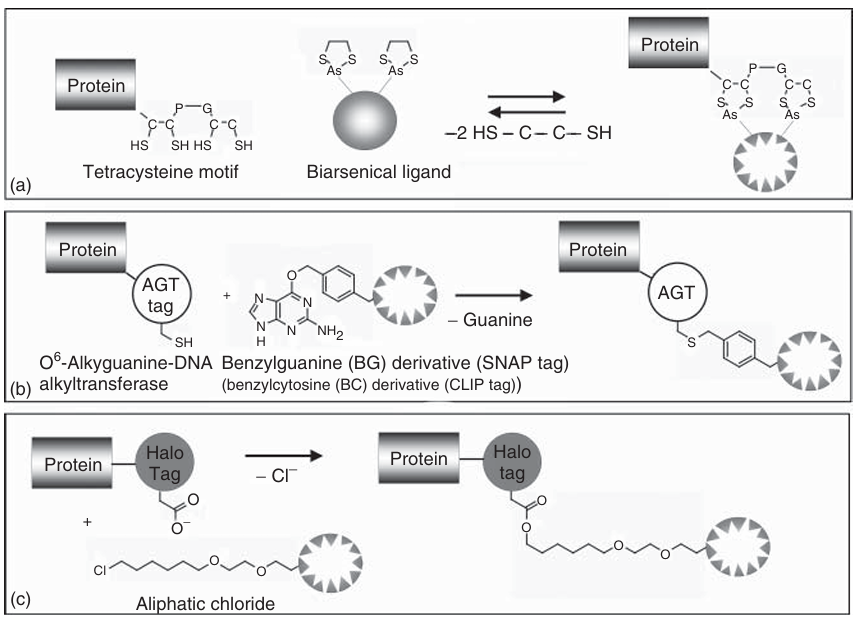
图 4.5 (a-c)荧光标记物的连接化学:蛋白质标签及融合方法。
为了在体外和体内实现高结合特异性,重组蛋白通常以融合蛋白的形式表达,其中包含一个额外的多肽片段——即所谓的“标签”。这些标签用于后续与荧光团的结合。最初,这些标签主要用于纯化目标蛋白,其中最典型的例子是六组氨酸(His6)标签。将组氨酸序列添加到蛋白质的N端或C端后,蛋白质能够与含有镍或钴离子(通过亚硝基三乙酸NTA络合)的亲和层析树脂结合,从而实现高效纯化。
另一种常用的标签是FLAG标签,它由八个氨基酸组成(AspTyrLysAspAspAspAspLys)。FLAG标签中的天冬氨酸残基可以与预先用荧光团标记的Zn²⁺-咪唑复合物配位。Strep标签也是一种合成的八肽(TrpSerHisProGlnPheGluLys),它对特异性设计的链霉亲和素具有高亲和力。
四半胱氨酸(TC)标签(Cys-Cys-Pro-Gly-Cys-Cys)能够特异性结合双砷化合物,如FlAsH或ReAsH(如图4.5所示)。这些化合物也可作为Lumio Green和Lumio Red(Life Technologies)的商业产品购买。此外,还有蓝色荧光化合物,如CHoXAsH。这些化合物中,两个砷原子保持一定的距离,能够与四半胱氨酸标签结合。最初的研究表明,双砷化合物能够识别由四个半胱氨酸侧链跨越单个α螺旋的基序。后来发现,只要两个Cys-Cys对之间的间距和相对取向与砷原子之间的距离匹配,TC标签可以添加到目标蛋白的N端或C端。这种要求通常由Pro-Gly序列满足。如果四半胱氨酸基序与双砷化合物“互补”,则两者可以形成荧光复合物,每个砷原子与一对半胱氨酸硫原子结合。这种标签的主要优点是其尺寸较小,最小可至六个氨基酸,CCPGCC(单字母氨基酸代码)是首选基序。然而,这种方法的一个限制是,染料只能在目标半胱氨酸处于还原态时与其结合。
其他标签来源于酶,因此尺寸较大。例如,SNAP标签是小酶O6-烷基鸟嘌呤-DNA烷基转移酶(AGT)的一个变体,能够特异性结合苯甲基鸟嘌呤(BG)衍生物。在正常功能中,AGT通过将烷基基团转移到其反应性半胱氨酸上,修复由鸟嘌呤O6-烷基化引起的DNA损伤。另一个AGT衍生的标签是CLIP标签,它与O2-苯甲基胞嘧啶(BC)衍生物特异性反应。这两种标签均有商业供应(New England Biolabs),并且可以在DNA水平上融合到目标蛋白的N端或C端,从而在融合蛋白中引入一个额外的AGT结构域用于染料连接。目前,市场上有多种不同发射波长的荧光BG和BC衍生物可供选择,可用于体外和体内的多色成像应用。最近,还引入了NIR硅-罗丹明染料衍生物(SiR-SNAP,SiR-CLIP)。SNAP和CLIP标签的特异性和底物的广泛可用性是其吸引人的特点,部分底物甚至可以穿过细胞膜,因此可用于活细胞成像。然而,基于AGT的标签尺寸较大(约200个氨基酸),在某些应用中可能是一个劣势。
HaloTag是从红球菌中修饰的卤代烷脱卤酶,是目前广泛使用的最大标签(约290个氨基酸)。它被设计为与合成配体(Halo-Tag配体)共价结合,这些配体通过氯代烷连接基团与各种荧光染料相连。蛋白质标签与氯代烷连接基团之间的共价键形成具有高度特异性,并且这种不可逆反应在生理条件下迅速完成(如图4.5所示)。
另一种标记融合蛋白的方法是通过适当的酶进行翻译后修饰。其基本原理十分直观:将一个识别肽融合到目标蛋白质上,随后利用天然或经过工程化的酶将小分子探针(探针本身可以是荧光的,也可以是经过特异性标记的)连接到该识别肽上。图4.6展示了磷酸泛酰巯基乙胺转移酶(PPTase)催化的蛋白质标记过程。PPTase的基本功能是将磷酸泛酰巯基乙胺基团从辅酶A(CoA)转移到载体蛋白(CP)结构域中的保守丝氨酸残基上。在实验中,CP结构域被用作识别肽,而荧光标记的CoA则作为底物加入。PPTase识别该底物,并将荧光标记的磷酸泛酰巯基乙胺基团转移到融合蛋白上。
另一种用于通过翻译后修饰标记融合蛋白的方法基于大肠杆菌生物素连接酶BirA对赖氨酸残基的生物素化。接受肽(AP)由15个氨基酸残基组成,可被生物素连接酶BirA识别。值得注意的是,BirA不仅可以识别生物素,还可以将生物素的酮类似物——酮生物素作为底物(如图4.6所示)。引入的酮生物素功能可以通过与荧光探针连接的水杨醛化合物进行共价标记。
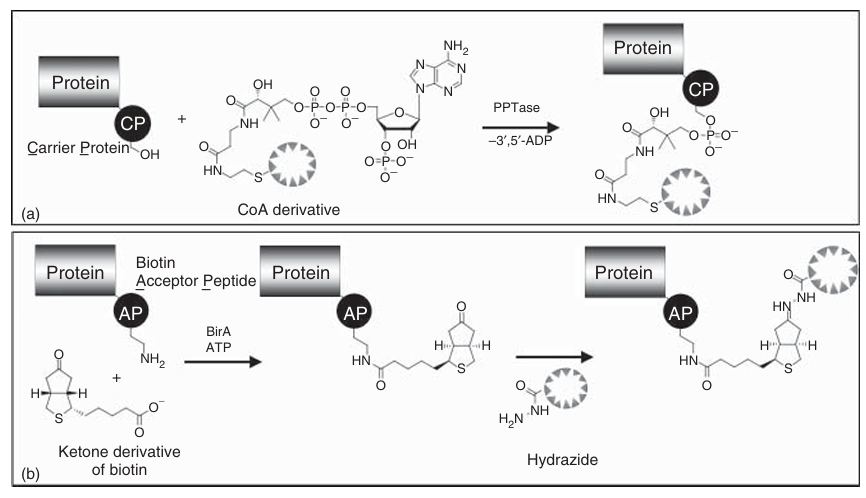 图 4.6 (a,b)荧光标记物的连接化学:通过翻译后修饰对融合构建物进行标记。
图 4.6 (a,b)荧光标记物的连接化学:通过翻译后修饰对融合构建物进行标记。
非天然氨基酸
将带有N-羟基琥珀酰亚胺(NHS)酯或马来酰亚胺基团的有机染料与蛋白质结合存在一定的局限性。关键问题在于,这种标记方式的程度和特异性往往难以预测。因此,研究人员致力于将其他化学正交官能团引入蛋白质,以实现对结合位点和化学计量比的精确控制。Schultz及其团队提出了一种非常巧妙的方法来解决这一问题。他们开发了一种重组技术,用于将非天然氨基酸(UAAs)引入蛋白质。这些UAAs带有修饰过的侧链,可以在任何期望的位置嵌入蛋白质中。通常情况下,蛋白质的结构仅受到最小程度的干扰,且经过位点特异性修饰的蛋白质可以在细菌、酵母或哺乳动物细胞中高效表达。与此同时,研究人员已经成功遗传编码了多种UAAs,包括带有酮基、叠氮基、炔基、烯基和四唑基侧链的UAAs(如图4.7所示)。
例如,引入叠氮基团后,可以通过Staudinger连接或铜(I)催化的[3+2]环加成反应(即所谓的“点击反应”)与三苯基膦试剂进行化学选择性修饰。对于体内应用,环辛炔与叠氮基团的应变促进环加成反应无需铜(I)作为催化剂,从而避免了铜离子对活细胞的毒性。然而,含有叠氮基的非天然氨基酸在表达和纯化过程中可能会发生叠氮基团的还原。因此,带有炔基功能的氨基酸(如丙炔赖氨酸和丙炔苯丙氨酸)可能是更理想的选择。目前,市场上有多种叠氮基功能化的有机染料可供选择。
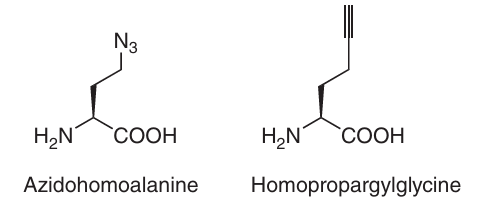 图 4.7 具有叠氮基和炔基功能的非天然氨基酸。
图 4.7 具有叠氮基和炔基功能的非天然氨基酸。
将荧光团送至靶标
结合化学在很大程度上决定了标记的特异性。由于赖氨酸和半胱氨酸在蛋白质中的普遍存在,NHS酯或马来酰亚胺偶联技术并不适用于特定生物分子的特异性标记,因此不推荐用于细胞应用。更具特异性的活细胞标记方法依赖于特定的“锁钥”原理,例如标签与其互补功能之间的相互作用。
在选择荧光团和目标分子后,需要将两个反应伙伴带到足够接近的距离,以便结合反应发生。对于体外标记纯化的生物分子,将染料和目标分子溶解在水溶液(pH 7-9)中,并以适当的浓度混合。反应完成所需的时间取决于反应伙伴、pH值和温度等参数。随后,可以通过凝胶过滤色谱法将蛋白质-染料结合物与未反应的染料分离。离子交换柱可以根据附着的标记数量分离蛋白质分子。
然而,标记细胞内或某些组织样本中的特定目标更具挑战性。对于具有通透细胞膜的固定样本,程序相对简单。在这种情况下,免疫染色是最流行的特异性标记技术。免疫荧光利用免疫球蛋白对其抗原的特异性,将荧光团靶向细胞内的特定生物分子目标。直接免疫荧光使用单个免疫球蛋白G(IgG)抗体,通过NHS酯偶联化学将其与荧光团化学连接。间接免疫荧光使用两个IgGs;初级抗体识别目标分子并与之结合。携带荧光团的次级抗体识别初级抗体并与之结合。荧光团可以是染料、量子点或荧光蛋白。然而,抗体无法穿过细胞膜,因此免疫荧光仅限于固定和通透的细胞(用于细胞内目标)或细胞膜的细胞外侧(用于活细胞)。IgGs是比较大的蛋白质,分子量为150 kDa,因此荧光标记物与标记位点之间的距离显著增加,这在某些应用中可能是不利的,例如超分辨率成像。在这种情况下,使用纳米抗体更为理想。纳米抗体是骆驼科重链抗体的可变结构域(VHH,12-15 kDa)。这种最小的功能性抗原结合片段可以重组生产,并通过NHS酯化学轻松与荧光染料结合,然后用于固定细胞染色。
活细胞和组织为标记物递送带来了额外的挑战。分子量小于1000 g/mol的中性、单阴离子和单阳离子染料分子,如LysoTracker Red、JC-1、MitoTracker Red CMXRos或BODIPY FL ceramide,可以相对容易地穿过细胞膜。如果特定细胞类型存在ATP门控阳离子通道,它们也可以通过这些通道内化。聚阴离子染料的醋酸酯衍生物也可能扩散穿过质膜。一旦进入细胞,染料通过内源性酯酶活性释放。有机染料和量子点也可以与肽结合,用于其细胞内递送。特别是聚阳离子肽已知可以穿透细胞膜并转移到细胞质中。肽介导摄取的效率和确切机制取决于肽的细节,包括肽的电荷和氨基酸序列、标记构建体的大小以及正在研究的特定细胞类型。
化合物SiR-tubulin和SiR-actin具有细胞通透性,并在远红光谱区域发射。在这两种化合物中,SiR被连接到多西他赛和去溴去甲基雅斯帕霉素,这些小的细胞毒性化合物已知分别特异性靶向微管和肌动蛋白。因此,它们可以实现活细胞中肌动蛋白和微管的特异性标记。这些探针结合了最小的细胞毒性、优异的亮度和光稳定性。对于体内研究,可以通过添加维拉帕米(一种广谱外排泵抑制剂)来增强标记效率。
FlAsH和ReAsH标记试剂具有膜通透性,可以轻松穿过细胞膜,允许在活细胞中对融合到TC标签的重组蛋白进行标记和检测。SNAP和CLIP标签系统以及HaloTag也具有这一关键优势;它们的大多数荧光衍生物也可以相对容易地穿过膜。值得注意的是,纳米抗体也被证明可以穿透活酵母细胞的细胞壁。或者,可以使用低剂量的细菌毒素、通过渗透压通透化或电穿孔暂时使细胞膜通透。最后,可以采用(微)注射程序。它们具有很高的侵入性,但可以实现极其精确的控制。例如,这种强制递送荧光团可以用于将定量的量子点注入细胞质中。
遗传编码标签
藻胆蛋白
在细胞生物学中,最早被使用的荧光蛋白标签之一是藻胆蛋白,这是一种从蓝藻中提取的光合作用天线色素。其中,最常用于生物分子标记的藻胆蛋白是R-藻红蛋白,它是一种具有红色荧光的多亚基蛋白。R-藻红蛋白包含34个藻胆素发色团(如图4.8所示),这些发色团赋予了该蛋白较高的摩尔消光系数,使其成为一种高效的荧光标记试剂。
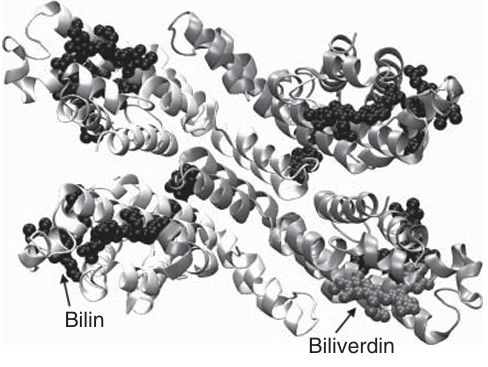 图 4.8 R-藻红蛋白多聚体的卡通结构示意图(PDB 代码:1EYX)。其中,胆绿素和胆色素辅基分别以灰色和黑色显示。
图 4.8 R-藻红蛋白多聚体的卡通结构示意图(PDB 代码:1EYX)。其中,胆绿素和胆色素辅基分别以灰色和黑色显示。
在细胞生物学中,最早被使用的荧光蛋白标签之一是藻胆蛋白,这是一种从蓝藻中提取的光合作用天线色素。其中,最常用于生物分子标记的藻胆蛋白是R-藻红蛋白,它是一种具有红色荧光的多亚基蛋白。R-藻红蛋白具有一个强烈的吸收带,其可见光区域从绿色延伸到远红光波长,最大吸收峰位于565 nm。该蛋白可以用488 nm的光高效激发,其摩尔消光系数(ε488)约为1.1 × 10⁶ M⁻¹cm⁻¹,量子产率为0.82。然而,由于其较大的尺寸(分子量达240 kDa),R-藻红蛋白在细胞内荧光标记中的应用受到限制,因此主要用于免疫分析。目前,多家公司提供用于抗体标记的R-藻红蛋白试剂盒,这些试剂盒还配备了合适的双功能交联剂,用于制备藻胆蛋白结合物。例如,一种带有NHS酯和吡啶二硫醇反应基团的交联剂可以与藻胆蛋白表面的伯胺反应,并引入吡啶二硫醇基团。这些基团随后可以与另一个含有自由巯基的蛋白质(通常是抗体)反应。此外,R-藻红蛋白还可以通过链霉亲和素/生物素偶联系统连接到目标蛋白上。
链霉亲和素/生物素系统是一种在免疫分析中用于连接蛋白质的高效系统。它利用生物素(维生素H)分子对链霉亲和素及其衍生物(如NeutrAvidin和CaptAvidin)的极高亲和力(解离常数Kd约为10⁻¹⁵ M)。链霉亲和素是一种从链霉菌中分离的非糖基化蛋白,其等电点接近中性。相比之下,Avidin是一种糖蛋白,等电点为10.5,容易非特异性吸附到带负电的表面,如细胞膜或硅基底上。为了将两个蛋白质连接起来,它们首先被生物素化,然后通过链霉亲和素进行连接。
2009年,研究人员从耐辐射球菌中成功工程改造出两种单体红外荧光蛋白(IFPs)。这些蛋白仅由约320个氨基酸组成,以胆绿素作为发色团。胆绿素是所有需氧生物中血红素降解的初始中间产物。在溶液中,胆绿素本身是非荧光的,即使在高浓度下(正常成年人每天内源性产生并代谢300-500 mg胆绿素),也不会对荧光背景产生贡献。然而,当胆绿素不可逆地结合到IFP中时,其构象灵活性被蛋白质基质限制,从而变得荧光。
目前,已有多种基于不同细菌光敏色素受体的近红外(NIR)荧光探针问世。IFPs的激发和发射峰远在红光区域,超过680 nm,因此它们可以在低散射和最小细胞自发荧光的条件下用于细胞和组织成像。IFPs可以通过廉价的激光二极管激发,为多色标记提供新的波长,并可作为Förster共振能量转移(FRET)对中的受体染料。大多数基于细菌光敏色素受体的NIR荧光探针是多聚体复合物,主要是二聚体。然而,在融合蛋白应用中,荧光蛋白应为单体。最近,研究人员成功将一种细菌光敏色素的截短形式工程改造为单体红外荧光蛋白(mIFP)。
绿色荧光蛋白(GFP)类似蛋白
来自维多利亚多管发光水母(Aequorea victoria)的绿色荧光蛋白(GFP)及其相关的GFP家族荧光蛋白已被广泛应用于生命科学领域,作为荧光标记工具。GFP的多肽链由238个氨基酸组成,形成一个刚性的11股β-桶状结构,其中心有一条α-螺旋贯穿其轴(如图4.9所示)。
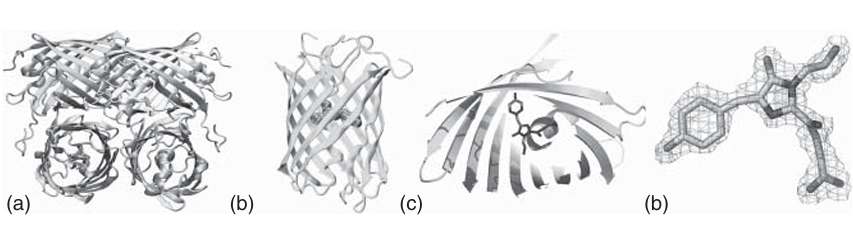 图 4.9 类 GFP(绿色荧光蛋白)蛋白的分子结构: (a) 四聚体排列; (b) 单体结构;(c) 单体的内部结构视图; (d) 色团本身。
图 4.9 类 GFP(绿色荧光蛋白)蛋白的分子结构: (a) 四聚体排列; (b) 单体结构;(c) 单体的内部结构视图; (d) 色团本身。
β-桶状结构的两端被短螺旋片段和环状结构覆盖。荧光发色团贯穿中心螺旋,并位于蛋白质的几何中心附近。GFP的发色团——4-(对羟基苯亚甲基)-5-咪唑啉酮(p-HBI)——由一个三肽序列(在GFP中为Ser65-Tyr66-Gly67)通过自催化反应形成,仅需分子氧即可完成(如图4.9所示)。通过对维多利亚多管发光水母GFP的突变,研究人员开发出了多种GFP变体,其发射光谱覆盖从蓝色(蓝色荧光蛋白,BFP)到黄色(黄色荧光蛋白,YFP)的范围(如图4.10所示)。
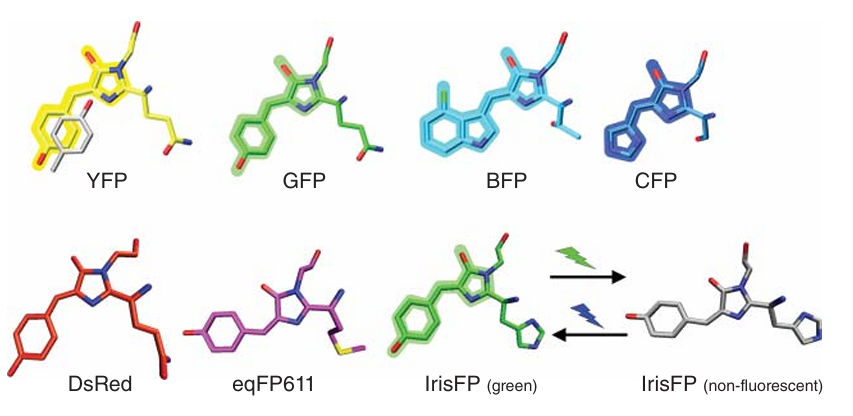 图 4.10 类 GFP(绿色荧光蛋白)蛋白色团结构的变化。关于缩写的解释,请参见附框 4.2。
图 4.10 类 GFP(绿色荧光蛋白)蛋白色团结构的变化。关于缩写的解释,请参见附框 4.2。
在珊瑚类生物中也发现了GFP的同源物,其中最具代表性的是橙色和红色荧光蛋白。近年来,光激活(PA)或光学高亮荧光蛋白作为一种强大的新型工具,被广泛应用于细胞成像领域。这些荧光蛋白(FPs)在特定波长的光照下,要么可以在荧光和非荧光状态之间可逆切换(光开关),要么不可逆地改变其荧光特性(光转换)。
原则上,荧光蛋白可以被功能化,带有上述任何官能团或标签,并与目标生物分子上的互补官能团结合(详见第4.4.3节和第4.4.5节),兼具所有已讨论的优点和局限性。例如,将纳米抗体与荧光蛋白构建融合蛋白,可以产生所谓的染色质抗体,用于追踪活细胞中表达该染色质抗体的各种细胞器中的抗原。然而,在实际应用中,功能化更多地被用于将荧光蛋白固定在表面上。
相比之下,荧光蛋白的融合蛋白应用更为普遍且独特。在这种方法中,FP基因在DNA水平上与目标蛋白的基因融合,二者之间通过编码短氨基酸连接肽的序列隔开。当细胞表达这种融合构建体时,额外的FP结构域确保了目标蛋白的完美标记(如图4.11所示),无需进一步的化学结合步骤。
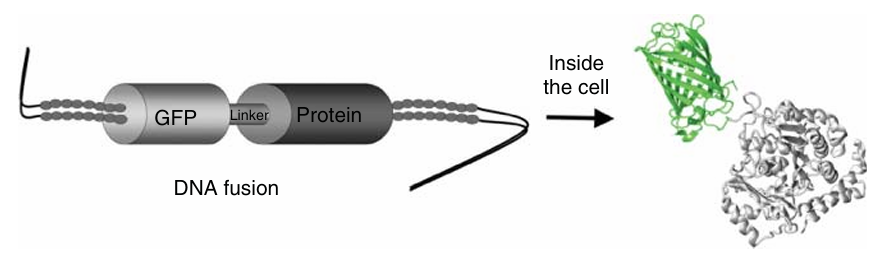 图 4.11 GFP(绿色荧光蛋白)的基因被融合到目标蛋白的基因上,这种融合在 DNA 水平上完成。随后,细胞表达这种融合构建物,从而无需进行任何额外的化学偶联步骤。
图 4.11 GFP(绿色荧光蛋白)的基因被融合到目标蛋白的基因上,这种融合在 DNA 水平上完成。随后,细胞表达这种融合构建物,从而无需进行任何额外的化学偶联步骤。
然而,尽管这种方法看似简便,成功实现仍需考虑诸多因素。从天然来源获得的荧光蛋白(FPs)往往具有聚集或寡聚化的倾向。对于某些应用,FP的寡聚化性质可能无关紧要,例如在组织成像、基因活性监测以及细胞和细胞器的标记中。然而,在涉及FP与其他蛋白质融合的研究中,寡聚化可能会干扰融合伴侣的功能。例如,FP部分诱导的二聚体和高阶寡聚体的形成可能导致错误靶向、非典型定位、破坏正常功能、改变标记蛋白的亚细胞动态,甚至导致聚集和细胞毒性。
克服寡聚化的基本策略是修改FP的氨基酸序列,引入破坏原聚体结合界面的残基。对于涉及哺乳动物细胞培养的活细胞应用,FP需要在37°C下高效表达并保持功能。大多数天然FP在室温或更低温度下折叠效率较高,但随着温度升高,其折叠效率会急剧下降。例如,GFP的密码子优化使其在37°C下的蛋白表达水平提高了四倍。对于其他FPs,仅需替换几个氨基酸即可获得热稳定的FP,从而增强高温下的蛋白表达和成熟。在研究动态基因表达模式或监测短寿命蛋白时,快速成熟的热稳定FP更为理想,尤其是当目标蛋白表达量较低时,高亮度的FP可以提高信噪比,便于定量分析。
红色发射FP通常更为理想,原因包括:(i)细胞对红光的耐受性优于绿光或蓝光;(ii)细胞的自发荧光主要集中在绿光区域;(iii)红光散射较少,能够更深入地穿透组织。然而,任何波长的高强度光本质上都会对活细胞造成损伤,因为它可能导致活性氧(ROS)的积累。在长期实验中,研究细胞内蛋白质的迁移和转位需要光稳定的FP,以最小化成像过程中不希望的光漂白。靶向细胞内非中性pH细胞器的蛋白质应使用pH不敏感的FP(pKa < 5.0)。
另一个重要问题是融合蛋白本身的构建。需要通过实验确定哪种融合位点(N端、C端或环状结构中)最能被容忍,以保留功能和荧光。光激活FPs常用于活细胞、组织和生物体中的光学脉冲-追踪实验。在这种实验中,FPs在特定位置被激活,其迁移可以在不受新表达蛋白干扰的情况下被跟踪。它们可以通过光进行标记,而不会受到新蛋白合成的干扰。基于定位的超分辨率成像技术依赖于光激活荧光团的存在,光激活FPs也最适合用于这些方法的活细胞成像应用。另一种基于受激发射损耗(STED)的超分辨率显微镜技术,由于需要非常光稳定的标记物,通常使用有机染料标记;然而,也有使用FPs的应用报道。表4.3列出了所选FPs的光学特性。
特定应用的标记选择
在前面的章节中,我们探讨了小分子有机染料、纳米晶体以及基因编码荧光蛋白(FPs)的化学和物理特性(详见表4.4)。显然,不存在一种“万能”的荧光标记物。如果尺寸是关键的考虑因素,小分子有机染料无疑是最佳选择;而对于高光稳定性的需求,量子点的表现则无与伦比。此外,只有荧光蛋白标签可以通过基因工程的方式直接引入其靶标,无需额外的化学结合步骤。因此,在选择最适合特定应用的标记物时,必须综合权衡各种优缺点,具体将在下节中详细讨论。
用 FRET 监测分子内构象动力学
蛋白质和其他生物分子是高度复杂的系统,在其折叠状态下表现出显著的结构变异性。在变性剂存在时,这种异质性会进一步增强,生物分子会在大量不同的折叠和展开构象之间,通过多种路径发生动态变化。
利用单分子荧光显微镜,可以通过Förster共振能量转移(FRET)来测量单个蛋白质或核酸的结构和动力学。FRET基于在生物分子的特定位点(通常相距约30-70 Å)连接两个荧光团——供体和受体。FRET是一种非辐射能量转移机制,通过激发供体来实现受体的激发。
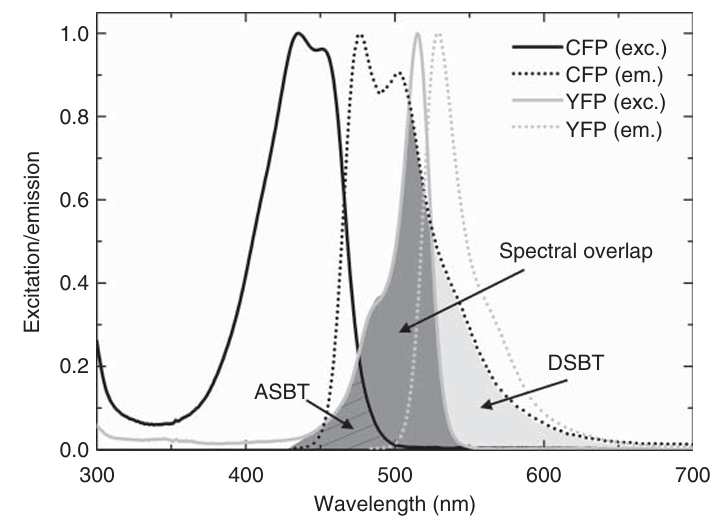 图 4.12 供体(CFP,青色荧光蛋白)和受体(YFP,黄色荧光蛋白)的激发光谱(实线;exc)和发射光谱(虚线;em)。FRET(荧光共振能量转移)对 CFP/YFP 具有足够的光谱重叠,尽管存在显著的光谱串扰(ASBT,受体光谱串扰;DSBT,供体光谱串扰)。
图 4.12 供体(CFP,青色荧光蛋白)和受体(YFP,黄色荧光蛋白)的激发光谱(实线;exc)和发射光谱(虚线;em)。FRET(荧光共振能量转移)对 CFP/YFP 具有足够的光谱重叠,尽管存在显著的光谱串扰(ASBT,受体光谱串扰;DSBT,供体光谱串扰)。
对于FRET标记,两个不同的荧光团附着在生物分子的特定位点,通常相距约30-70 Å。所选的染料对需确保供体的发射光谱与受体的激发光谱具有适当的光谱重叠(如图4.12所示)。这一参数(以及其他参数)决定了Förster半径,即两个染料之间的距离,此时FRET效率为0.5。
蛋白质的动力学也可以在活细胞内进行测量。为了确保完全且特异性的标记,建议使用融合构建体,将目标蛋白质基因夹在两个荧光蛋白(FP)基因之间。
FRET技术还可用于检测蛋白质-蛋白质相互作用,无论是在体外还是活细胞中。这一应用要求每个相互作用的伙伴都用FRET对中的一个荧光团进行标记(如图4.13a所示)。一种相当巧妙的方法用于观察两个生物分子之间的相互作用,依赖于双分子荧光互补。在这里,荧光蛋白(FP)在合适的位置被拆分成两个半部分,这两个半部分通过柔性连接子分别与假定的相互作用伙伴融合。一旦两个伙伴相互作用,并且两个FP半部分结合以重新构成完整的FP,荧光信号也会恢复。
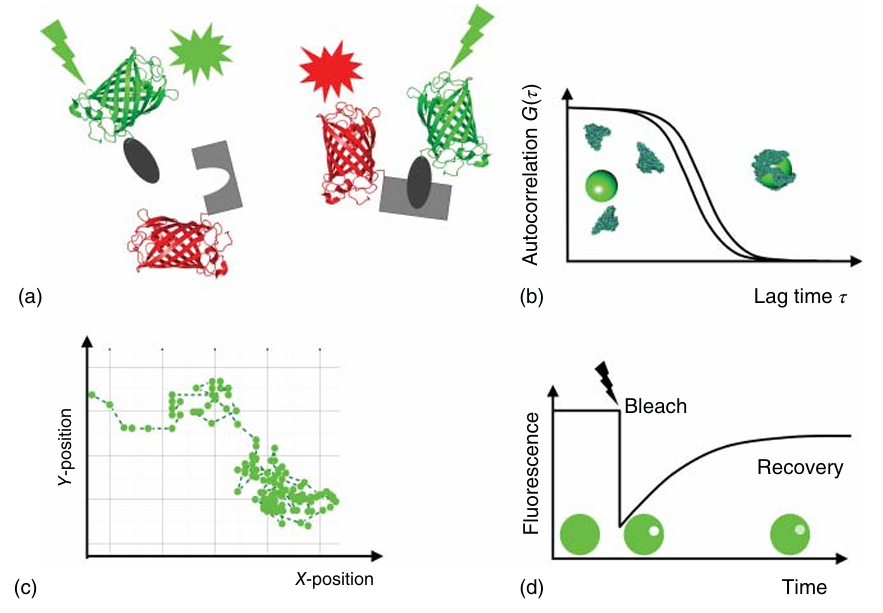 图 4.13 用于监测活细胞中蛋白质动态的荧光技术: (a) FRET(Förster 共振能量转移); (b) FCS(荧光相关光谱); (c) SPT(单颗粒跟踪); (d) FRAP(光漂白后荧光恢复)。
图 4.13 用于监测活细胞中蛋白质动态的荧光技术: (a) FRET(Förster 共振能量转移); (b) FCS(荧光相关光谱); (c) SPT(单颗粒跟踪); (d) FRAP(光漂白后荧光恢复)。
| Name | Excitation (nm) | Emission (nm) | Brightness | Photostability | Oligomerization state |
|---|---|---|---|---|---|
| Fluorescent proteins | |||||
| GFP | 395/475 | 508/503 | × | × | D |
| EBFP | 383 | 447 | ×× | × | D |
| mECFP | 433/452 | 475/505 | ×× | ××× | M |
| mTFP1 | 462 | 492 | ×××× | ×××× | M |
| EGFP | 488 | 507 | ××× | ×××× | D |
| EYFP | 514 | 527 | ×××× | ×× | D |
| Venus | 515 | 528 | ×××× | × | D |
| DsRed | 558 | 583 | ×××× | ×××× | T |
| mRFP1 | 584 | 607 | ×× | × | M |
| tdTomato | 554 | 581 | ×××× | ××× | tD |
| mOrange | 548 | 562 | ×××× | × | M |
| mKO | 548 | 559 | ××× | ××× | M |
| mRuby | 558 | 605 | ××× | ××× | M |
| eqFP611 | 559 | 611 | ×××× | ××× | T |
| mStrawberry | 574 | 596 | ××× | × | M |
| mCherry | 587 | 610 | ×× | ××× | M |
| mKate | 588 | 635 | ××× | ×××× | M |
| mPlum | 590 | 649 | × | ×× | M |
| mGarnet | 598 | 670 | × | ×× | M |
| mCardinal | 604 | 659 | × | ×× | M |
| eqFP670 | 605 | 670 | × | ×× | D |
| Photoactivatable proteins | Conversion states | ||||
| Irreversibly photoactivatable proteins | |||||
| PA-GFP | 504 | 517 | Dark/green | D | |
| Kaede | 508/572 | 518/580 | Green/red | T | |
| mEosFP | 505/569 | 516/581 | Green/red | M | |
| Dendra | 486/558 | 505/575 | Green/red | M | |
| mIrisFP | 486/546 | 516/578 | Green/red | M | |
| Reversibly photoactivatable proteins | |||||
| asFP595 | 572 | 595 | Dark/red | T | |
| KFP | 580 | 600 | Dark/red | T | |
| Dronpa | 503 | 518 | Dark/green | M | |
| mIrisFP | 486/546 | 516/578 | Dark/green, dark/red | M | |
| NijiFP | 469/507 | 526/569 | Dark/green, dark/red | M |
Table 4.4 Comparison of fluorescence markers.
| Property | Organic dye | Quantum dot | FP |
|---|---|---|---|
| Optical properties | |||
| Absorption spectra | Discrete band (s) | Continuous absorption from UV almost to emission | Discrete band (s) |
| Extinction coefficient,𝜀 (M−1 cm−1) | 2.5 × 104 − 2.5 × 105 | 105 − 106 | 104 − 2 × 105 |
| Emission spectra | Asymmetric band with tail to the red | Symmetric band, narrow | Asymmetric band with tail to the red |
| Emission maximum | UV–NIR | Vis–NIR | Vis |
| Stokes shift (nm) | Typically <50 | Up to >100 | 10–50 |
| Quantum yield (QY) | 0.5–1.0 (vis) 0.05–0.25 (NIR) | 0.1–0.8 (vis) 0.2–0.7 (NIR) | 0.05–0.8 |
| Photostabilityb) | ×× | ××××× | ×× |
| Fluorescence lifetime (ns) | 1–10 | 10–100 | 1–10 |
| Possible environmental effects on emission properties | pH, polarity | — | pH, solvent |
| Biocompatibility | |||
| Solubility in aqueous solution | Achieved by functional groups | Requires surface modification | Yes |
| Largest diameter (nm) | ∼0.5–1 | ∼5–60 | ∼3 |
| Conjugation to biomolecules | Conjugation chemistry | Conjugation chemistry | Fusion on DNA level (conjugation chemistry) |
| Toxicity | ×× | ××××× | × |
| In vitro conjugation | Yes | Yes | Yes |
| In vivo conjugation | Yes | Yes | Yes |
细胞内的蛋白质表达
如果将特定蛋白质与合适的荧光蛋白(FP)融合,并将基因构建体导入细胞,就可以在活细胞中实时观察该蛋白质的表达和动态变化。将外源DNA导入细胞的过程称为转染。在瞬时转染中,外源基因不会整合到细胞基因组中,仅在有限时间内表达;而在稳定转染中,外源基因被整合到宿主基因组中,使得这些细胞的后代也能持续表达新基因。
转染技术有多种方法。传统方法包括:病毒介导的DNA运输、将DNA与阳离子聚合物或阳离子脂质复合以促进其跨细胞膜运输、直接显微注射DNA、细胞膜电穿孔以及基于激光的转染技术。然而,需要注意的是,转染细胞中表达的融合蛋白,按定义,相对于内源性蛋白都是过表达的。虽然瞬时转染为分析蛋白质功能提供了最大的灵活性,但这种方法可能会导致目标细胞中融合蛋白的高水平表达,从而引起不适当的亚细胞分布和蛋白质功能障碍,最终可能导致对蛋白质定位和活性的错误解释。
近年来,基因组工程技术的进步使得研究人员能够在几乎所有生物的内源性背景下直接编辑或调节基因组。例如,外源基因可以直接插入基因组,实现内源性水平的表达。这种所谓的靶向基因组编辑技术利用位点特异性核酸酶,如巨核酸酶、锌指核酸酶(ZFNs)、转录激活因子样效应物核酸酶(TALENs),以及最重要的来自微生物适应性免疫系统的CRISPR(成簇规律间隔短回文重复序列)/Cas9系统。简单来说,Cas9有两个活性位点,每个位点都可以切割双链DNA的一条链。该酶通过一个RNA分子被引导至目标DNA,该RNA分子包含与待切割序列匹配的序列。这些位点特异性的双链DNA断裂随后通过细胞的修复机制进行修复。在同源重组过程中,外源基因可以在断裂位点插入,从而以内源性水平表达。
为了实现荧光团的最佳检测效率并最小化由于激发光引起的光毒性,优先选择发射红光的荧光蛋白(FP)。对于低表达量或表达位点广泛分布的目标蛋白,FP应尽可能明亮。定量测定表达量需要能够区分新表达的蛋白质和旧拷贝。目标蛋白与FP的融合构建体可以通过光漂白或光激活来选择在光照之前或之后表达的蛋白质。通过光激活,还可以将特定时间存在的所有蛋白质标记为一种颜色,而之后合成的蛋白质标记为另一种颜色。
细胞内的荧光探针作为传感器
目前,存在大量对金属离子(如Ca²⁺)敏感的荧光探针。这些钙敏感染料会根据Ca²⁺浓度的变化而改变其发射强度或波长。然而,几乎所有金属离子探针都存在一个问题,即它们可能会与目标离子以外的其他金属离子发生交叉反应。
研究最多的离子传感器是H⁺选择性探针。许多荧光团(如荧光素)本身具有固有的pH敏感性。某些荧光蛋白(FPs)能够通过发射强度的变化或光谱区域的改变来反映pH的变化。此外,还有一些FPs可以检测卤素离子,也有报道称某些荧光团可以用于检测活性氧(ROS)和活性氮物种。开发传感器的关键挑战在于实现对单一化合物的高度特异性。
活细胞动态
荧光标记蛋白在活细胞内的转位可以通过多种成像方法直接观察。例如,荧光相关光谱(FCS)是一种用于监测来自极小(约1飞升)光学定义体积内荧光信号的技术(详见第5章)。随着标记分子扩散进出该体积,荧光强度会发生波动,而分子在检测体积内的停留时间可用于计算荧光蛋白(FP)的扩散系数(如图4.13b所示)。
在单分子跟踪(SPT)实验中,单个分子需要被足够明亮的标记物标记,并且稀疏分布,以便能够单独跟踪(如图4.13c所示)。对于长期观察,标记物需要具备卓越的光稳定性。在这方面,量子点的独特光学特性尤为有利。由于量子点具有较大的消光系数、窄发射光谱和抗光漂白能力,它们可以在连续照射下被单独检测数分钟,这是传统有机染料难以实现的。
在细胞内,荧光标记物也可以通过光选择性操作,例如通过短而强烈的聚焦激光脉冲进行光漂白或光激活。荧光恢复后的光漂白是一种光学技术,其中样品的某个区域被光漂白(如图4.13d所示)。随后,由于该区域内的扩散,荧光会逐渐恢复,这一过程随时间跟踪,从而提供有关荧光团动态的信息。
超分辨率成像
在受激发射损耗(STED)显微镜中,样品通过一个由紧密聚焦的激光产生的激发光斑进行光栅扫描。一个具有甜甜圈形强度分布的第二高功率激光束被叠加,并通过受激发射有效地使激发光斑外围的所有荧光团去激发。随着两个激光束在样品上以小步移动,特定的荧光团将被多次激发和去激发。因此,与荧光蛋白(FPs)相比,更推荐使用有机染料作为标记物。
除了使用高功率激光进行去激发外,还可以利用荧光团在明亮和暗淡状态之间的光开关特性来实现去激发。这一技术被称为可逆饱和光学荧光跃迁(RESOLFT)显微镜。由于“开启”状态的寿命通常比荧光寿命长几个数量级,因此耗尽光束所需的激光功率非常低。然而,与STED一样,标记物在图像采集过程中仍需要在荧光和非荧光状态之间进行多次转换。
结构化照明显微镜(SIM)使用模式化的照明来激发样品并产生相应的发射模式(详见第9章)。通过使用高激发强度使荧光发射饱和,从而实现超分辨率,发射不再与激发功率成正比。饱和结构化照明显微镜(SSIM)的空间分辨率随着饱和度的增加而提高。因此,这种技术需要非常光稳定的荧光团以避免光漂白。与RESOLFT显微镜一样,当采用荧光团的光诱导开/关切换时,激光强度可以显著降低。
超分辨率定位显微镜利用光激活荧光团,使得单个荧光团可以被随机光激活,即切换到荧光状态(“开启”),而周围分子保持在暗(“关闭”)状态。随机光学重建显微镜(STORM)和直接随机光学重建显微镜(dSTORM)使用可光开关的有机染料。它们应具有非常高的亮度和对比度,以在光漂白或返回暗、非荧光状态之前,为每个分子提供最多的光子。许多染料已有商业供应,并已针对此应用进行了表征[34]。
对于活细胞定位显微镜,光激活荧光蛋白(FPs)变得非常流行。目前,绿色到红色光转换的FPs,如Kaede或EosFP,是最佳选择。它们以非激活状态表达,呈现绿色发射。因此,它们可以在光激活之前在细胞中定位。用于光转换的光(约400 nm)与激发绿色(约480 nm)和红色(532 nm)荧光团的光在波长上很好地分离,因此意外光转换的风险大大降低。关键优势是,只有在光转换后才形成红色发射荧光团,因此动态范围(激活和未激活形式之间的强度比)非常高。光开关FPs具有较小的动态范围,但也可以使用。
此外,商业上也有初始非荧光且可以转换为荧光状态的笼染料和光开关染料(Abberior;Microscopes & Dyes - @abberior.rocks)。
总结
基于荧光的显微镜技术已经发展成为一种高分辨率的成像手段,为活细胞和生物体内部机制的研究提供了前所未有的洞察力。然而,如果没有荧光标记物的同步发展,这一成功是无法实现的。这些标记物具备广泛的关键物理和化学特性,是实现高分辨率成像的基础。同样,生物分子与荧光团特异性结合技术的进步也至关重要。
荧光标记物的多样性以及众多可能影响其在特定应用中适用性的参数,给实验者带来了严峻的挑战。事实上,不存在一种“万能”的荧光团。在选择标记物时,必须综合考虑关键参数,例如尺寸、结合化学、选择性、光稳定性,以及其他可能使特定荧光团更具优势的特性。
在本章中,我们总结了各种荧光标记物的特性,包括小分子有机染料、纳米颗粒(如半导体量子点和金属纳米团簇),以及基因编码荧光蛋白(FPs),以帮助读者选择最适合的标记物。量子点可以说是亮度最高且最光稳定的标记物,但它们相对较大,生物相容性不总是理想,且往往难以附着在特定的目标位点。有机染料也很明亮且光稳定,其光学特性可以通过化学方法轻松调整。如果尺寸是最重要的考虑因素,小分子有机染料无疑是最佳选择,尽管它们与目标生物分子的结合可能会进一步增加标记的整体尺寸。如果尺寸不是关键问题,表达与基因编码化学标签(如SNAP等)融合的蛋白质可以提供非常明亮且特异性的标记。然而,许多染料无法穿透细胞膜,因此活体样本的标记可能存在问题。
相比之下,荧光蛋白(FPs)在亮度和光稳定性方面相对较弱。然而,在活细胞,特别是活生物体的应用中,这些缺点完全被它们可以基因编码的事实所弥补。因此,它们确保了目标蛋白在活体样本中的完美标记,无需进一步的结合化学步骤。
对于荧光成像实验的成功,明智地选择合适的标记物至关重要。本章提供的简洁概述可以作为读者寻找最佳标记策略的起点。