小分子NIR-II光热剂在图像引导肿瘤治疗中的发展
- [[#摘要|摘要]]
- [[#引言|引言]]
- [[#PTT的机理及影响因素|PTT的机理及影响因素]]
- [[#PTT的机理及影响因素#提升PTA的功率转换效率以改善PTT|提升PTA的功率转换效率以改善PTT]]
- [[#提升PTA的功率转换效率以改善PTT#形成聚集体以改善 PCE|形成聚集体以改善 PCE]]
- [[#提升PTA的功率转换效率以改善PTT#引入分子内旋转以改善 PCE|引入分子内旋转以改善 PCE]]
- [[#提升PTA的功率转换效率以改善PTT#其他改善 PCE 的策略|其他改善 PCE 的策略]]
- [[#PTT的机理及影响因素#增强 PTA 的特异性以改善 PTT|增强 PTA 的特异性以改善 PTT]]
- [[#增强 PTA 的特异性以改善 PTT#优化靶标配体/基团以提高特异性|优化靶标配体/基团以提高特异性]]
- [[#增强 PTA 的特异性以改善 PTT#构建激活型PTA以提高特异性|构建激活型PTA以提高特异性]]
- [[#PTT的机理及影响因素#增强 PTA 的生物相容性以改善 PTT|增强 PTA 的生物相容性以改善 PTT]]
- [[#增强 PTA 的生物相容性以改善 PTT#引入亲水装置以提高生物相容性|引入亲水装置以提高生物相容性]]
- [[#增强 PTA 的生物相容性以改善 PTT#提高生物相容性的两亲性基质包埋策略|提高生物相容性的两亲性基质包埋策略]]
- [[#增强 PTA 的生物相容性以改善 PTT#提高生物相容性的其他策略|提高生物相容性的其他策略]]
- [[#PTT的机理及影响因素#提升 PTA 光稳定性的方法以改善光热疗效|提升 PTA 光稳定性的方法以改善光热疗效]]
- [[#PTT的机理及影响因素#构筑协同PTA以增强PTT疗效|构筑协同PTA以增强PTT疗效]]
- [[#构筑协同PTA以增强PTT疗效#PTT-PDT 协同治疗|PTT-PDT 协同治疗]]
- [[#构筑协同PTA以增强PTT疗效#PTT 化疗协同治疗|PTT 化疗协同治疗]]
- [[#构筑协同PTA以增强PTT疗效#PTT 免疫疗法协同疗法|PTT 免疫疗法协同疗法]]
- [[#PTT的机理及影响因素#提升PTA的功率转换效率以改善PTT|提升PTA的功率转换效率以改善PTT]]
- [[#总结与展望|总结与展望]]
摘要
在近红外二区(NIR-II)区域工作的有机小分子光热剂(PTAs)因其具有副作用小、组织穿透能力强以及结构易于调节等优势,在癌症治疗和诊断中展现出巨大潜力。多种有机小分子PTA整合了NIR-II荧光/光声(PA)成像和热效应,能够实时可视化肿瘤位置并对肿瘤进行热辐射,对癌症的早期诊断和精准治疗具有重要意义。
在本综述中,我们总结了多种用于改善有机小分子PTA光热治疗(PTT)效果的策略,这些策略用于NIR-II成像引导的癌症治疗,包括提高光热转换效率(PCE)和光稳定性、改善生物相容性和靶向性,以及通过协同治疗增强PTT效果。同时,我们还讨论了NIR-II小分子PTA在应用中的前景和面临的挑战。
在本综述中,我们总结了用于成像引导的肿瘤治疗的近红外二区(NIR-II)小分子光热剂的最新进展,重点关注了影响和提升光热治疗(PTT)效果的多种策略,以及潜在的挑战和未来展望。
引言
光热治疗(PTT)作为癌症治疗领域中一种极具潜力的方法,近年来取得了显著的进展。该技术主要通过利用光能转化为局部高温来消除肿瘤细胞,具有微创性、精确的空间和时间控制以及对正常组织几乎无毒等优点。因此,众多类型的光热剂(PTAs),例如碳纳米材料、金和铂等金属纳米颗粒、硫化物或氧化物纳米结构以及有机小分子,已被开发并应用于PTT。这些光热剂不仅能够在肿瘤部位实现定位,还能通过荧光或光声(PA)成像提供早期诊断和治疗引导。
在上述光热剂中,无机光热剂由于其潜在的长期代谢毒性及生物降解问题,在实际应用中面临一定挑战。相较之下,有机小分子光热剂因其优异的生物可降解性、明确的化学结构和良好的加工性能,成为研究热点。特别是那些能够整合光热效应与光学成像功能的小分子光热剂,更是被视为非侵入性癌症治疗与精准诊断的重要工具。
然而,传统的小分子光热剂大多工作在可见光或近红外一区(NIR-I,700–900 nm)范围内,这限制了它们在深层肿瘤成像与治疗中的效果,因为短波长光容易被组织吸收和散射。相比之下,近红外二区(NIR-II,900–1700 nm)区域显示出更低的组织干扰和光毒性,使得基于NIR-II窗口的光热剂在深部肿瘤高效治疗和高分辨率成像方面展现出巨大优势。
目前,研究人员正积极探索如何将花青、呫吨、苯并双噻二唑和BODIPY等小分子染料的吸收波长扩展到NIR-II区域,以提升其光热性能。这通常通过杂原子取代、共轭体系扩展和端基修饰等策略实现。此外,优化分子刚性、引入靶向基团以及添加亲水单元等方法也被用于提高光热剂的性能,如增强摩尔消光系数、改善生物相容性和实现癌症精准成像与治疗。
本文综述旨在全面探讨影响光热效应的各种因素,并总结一系列改进NIR-II小分子光热剂PTT效果的策略,包括但不限于提高光热转换效率(PCE)、光稳定性、生物相容性、特异性和协同治疗等方面。最后,我们还将分析当前NIR-II小分子光热剂在临床应用中的局限性,为未来的研究和发展方向提供见解和建议。
PTT的机理及影响因素
通常情况下,光热剂(PTAs)通过吸收特定波长的光子能量来诱导电子从基态跃迁至激发单重态,或者进一步经由系间穿越(ISC)到达激发三重态。在随后的内转换(IC)过程中,这些处于激发态的电子经历能量耗散,并通过非辐射衰变过程将能量以热的形式释放出来,从而为光热治疗(PTT)提供了必要的热量来源(参见图1)。
对于理想的NIR-II光热剂而言,应满足以下四个关键要求:
- 高效的光热转换效率(PCE):这是指光能转化为热能的能力,高效的能量转换是确保治疗效果的基础。
- 卓越的光稳定性:意味着光热剂能够抵抗光漂白现象,在持续光照下保持稳定性能,这对于长期或重复性治疗尤为重要。
- 良好的生物相容性:确保材料对人体无害,减少对正常组织的损伤风险,提高治疗的安全性。
- 精准的靶向能力:能够特异性地聚集于肿瘤部位,减少对周围健康组织的影响,从而降低副作用的发生率。
通过满足上述条件,NIR-II光热剂不仅能够在癌症治疗中实现更深层次的穿透和更有效的热疗效果,同时还能借助其光学特性提供高分辨率的成像支持,为早期诊断、精确治疗以及疗效评估提供全面解决方案。这种综合性的应用前景使得NIR-II光热剂成为当前研究的一大热点领域。
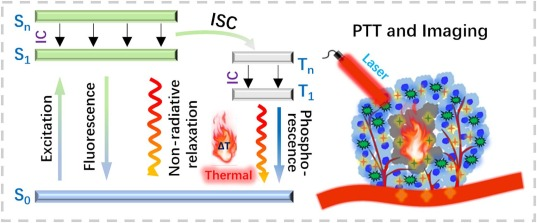
图1. 使用Jablonski能级图说明光热机制
光热治疗(PTT)在临床应用中的表现已证实,光热转换效率(PCE)、生物相容性、光稳定性和特异性是光热剂(PTAs)能否在PTT过程中充分发挥其潜力的关键因素。为了进一步提升PTT的疗效并克服单一治疗模式的局限性,研究人员正在开发多种协同治疗试剂。这些组合不仅能够增强治疗效果,还能通过减少所需剂量和副作用来提高治疗的安全性和精准度。
近年来,随着对NIR-II窗口(900–1700 nm)的研究深入,多种多功能NIR-II光热剂已被开发并应用于肿瘤成像引导的PTT。这些新型光热剂不仅具备高效的光热转换效率和优异的光稳定性,还展示了良好的生物相容性和靶向能力。通过整合光学成像功能,它们能够在提供高分辨率肿瘤成像的同时实现精确的光热治疗,为癌症的早期诊断和治疗提供了强有力的支持。
此外,通过分子设计和修饰,如杂原子取代、共轭体系扩展、端基改性以及引入亲水单元等策略,可以有效优化这些光热剂的性能,满足上述四个基本要求。这使得NIR-II光热剂在实际应用中展现出巨大的潜力,并为未来的研究奠定了坚实的基础。
所有关于NIR-II光热剂的具体信息及其特性总结于[表1]中,这为研究者们提供了一个全面而系统的参考框架,有助于推动该领域的进一步发展和技术革新。这种综合性的方法不仅促进了光热剂在肿瘤治疗中的应用,也为其他相关领域的发展提供了宝贵的经验和启示。
Table 1. NIR-II PTAs for tumor PTT.
| Agents | PCE% | Absorption wavelength (nm) | Laser irradiation wavelength (nm) | Emission wavelength (nm) | Therapeutic mode | Power (W cm−2) | Tumor type | NIR-II Imaging mode |
|---|---|---|---|---|---|---|---|---|
| IR1061@HSA | 51.89 | 1061 | 808 | N/A | PTT | 1 | 143B osteosarcoma tumor | fluorescence |
| P@FN9 | 55.40 | 1116 | 1064 | 1285 | PTT | 1 | 4T1 tumor | fluorescence |
| P-ipr@Gal | 42.60 | 820 | 808 | 1028 | PTT | 1 | 4T1 tumor | fluorescence |
| Gal-OHBDP | 55.00 | 815 | 808 | 1060 | PTT | 0.8 | HepG2 tumor | fluorescence |
| BisBDP2 | 63.00 | 1273 | 1208 | 1314 | PTT | 0.8 | HepG2 tumor | PA |
| BDP3 | 60.30 | 936 | 915 | 1003 | PTT | 1 | 4T1 tumor | N/A |
| Dye 2 | 35.60 | 939 | 915 | 1039 | PTT | 1 | 4T1 tumor | fluorescence |
| BDP-F | 50.90 | 800 | 808 | 910 | PTT-PDT | 1 | HeLa tumor | fluorescence |
| BSFX-BBT (Alpha NPs) | 36.70 | 901/1062 | 808 | 1124 | PTT | N/A | 4T1 tumor | Fluorescence/PA |
| RRIALP-C | 42.00 | 808/1061 | 808 | 1100 | PTT-Chemotherapy | 0.3 | A549 tumor | Fluorescence/PA |
| CY-1234 | 76.01 | 1234 | 1064 | 1334 | PTT | 1 | 4T1 tumor | PA |
| IC-1224 | 83.20 | 1224 | 1064 | N/A | PTT | 0.5 | 4T1 tumor | Fluorescence |
| BDTR9-OC8 | 78.00 | 726 | 808 | 1072 | PTT | 0.6 | 4T1 tumor | Fluorescence/PA |
| SQ 905 | 68.61 | 858 | 808 | N/A | PTT | 1 | 4T1 tumor | N/A |
| NSQ2 | 86.30 | 932 | 1064 | 1054 | PTT | 1 | N/A | PA |
| BITT | 35.76 | 731 | 660 | N/A | PTT-PDT | 0.3 | 4T1 tumor | Fluorescence |
| CyQN-BTT | 37.80 | N/A | 671 | N/A | PTT-PDT | 0.4 | 4T1 tumor | Fluorescence/PA |
| BITX-OH | 55.30 | 830 | 808 | 962 | PTT | 1 | HeLa tumor | Fluorescence |
| Tf-IRLy | 59.33 | 900–1300 | 1064 | 1354 | PTT | 0.8 | Glioma tumor | Fluorescence/PA |
| dimeric oBHCy | 49.20 | 878 | 808 | 1057 | PTT | 1 | 4T1 tumor | Fluorescence |
| CCNU-1060 | 26.50 | 690/846 | 808 | 1060 | PTT-PDT | 1 | 4T1 tumor | Fluorescence |
| CSMN2 | 31.60 | 700–1200 | 808/1064 | 1030 | PTT | N/A | HuH-7 tumor | PA |
| TCT | 40.10 | 695 | 808 | 980 | PTT | 0.6 | 4T1 tumor | Fluorescence |
| DFTQ–DTPA | 51.60 | 899 | 808 | 1098 | PTT | N/A | 4T1 tumor | Fluorescence/PA |
| FE-IDMN | 82.60 | 855 | 808 | 1080 | PTT | 0.83 | 4T1 tumor | Fluorescence/PA |
| 2PhNVDPP | 53.00 | 720 | 808 | 1013 | PTT | 0.5 | 4T1 tumor | Fluorescence |
| HCY-995 | 54.90 | 763 | 721 | 995 | PTT | 1 | 4T1 tumor | Fluorescence |
| ICR-Qu | 81.10 | 770 | 808 | 1020 | PTT-PDT-Immune therapy | 0.5 | 4T1 tumor | Fluorescence/PA |
| DPBTA-DPTQ | 40.60 | 806 | 808 | 1120 | PTT | N/A | HepG2 tumor | Fluorescence/PA |
| TPTQ | 73.32 | 800 | 808 | 1110 | PTT | 1 | 4T1 tumor | Fluorescence |
| BAF4 | 80.00 | 1000 | 1064 | N/A | PTT | 0.75 | 4T1 tumor | PA |
| BBTD-TP | 37.80 | 700–1200 | 1064 | 1200 | PTT | 1 | B16F10 tumor | Fluorescence/PA |
| MBPN-T-BTD | 71.96 | 750 | 808 | 1045 | PTT | 1 | Oral tumor | Fluorescence |
| CL4/FBS | 36.00 | 1182 | 1064 | 1235 | PTT | 1 | 4T1 tumor | Fluorescence |
| NF2 | 61.30 | 875 | 1064 | N/A | PTT | 1 | 4T1 tumor | Fluorescence |
| NT-4 | 43.00 | 805 | 808 | 1110 | PTT | 0.6 | 4T1 tumor | N/A |
| SW8 | 75.00 | 1000 | 1064 | 1230 | PTT | N/A | 143B tumor | Fluorescence |
| O–T | 73.00 | 857 | 1064 | 1100 | PTT | 1 | HeLa tumor | Fluorescence |
| o-ITNP | 76.00 | 760 | 808 | 942 | PTT | 0.3 | 4T1 tumor | Fluorescence |
| FY6 | 80.00 | 822 | 808 | 947/1052 | PTT | 0.3 | 4T1 tumor | Fluorescence |
| BTIC-4Br | 81.70 | 806 | 808 | 957 | PTT | 0.5 | 4T1 tumor | Fluorescence |
| SCy1 | 74.00 | 790–910 | 915 | 1030 | PTT | 1.2 | 4T1 tumor | N/A |
| BC1010 | 38.50 | 1010 | 1064 | N/A | PTT | 0.8 | 4T1 tumor | PA |
| Crizotinib-IR808@BSA | 36.90 | 778 | 808 | N/A | PTT-PDT | 0.8 | CT26 tumor | Fluorescence |
| QT-RGD | 36.50 | 841 | 808 | N/A | PTT | 1 | 4T1 tumor | Fluorescence/PA |
| HSA-ICG-iRGD | N/A | 803 | 808 | 806 | PTT | 1 | U251 glioma tumor | Fluorescence |
| FEPT | 56.80 | 808 | 808 | 1013 | PTT-PDT-Immune therapy | 1 | 4T1 tumor | Fluorescence |
| IR-FE-TPP | 43.90 | N/A | 808 | N/A | PTT-PDT-Immune therapy | 1 | 4T1 tumor | Fluorescence |
| TDTN+ | 66.70 | 685 | 808 | 1052 | PTT-PDT | 0.6 | 4T1 tumor | Fluorescence |
| H4-PEG-Glu | 11.60 | 810 | 808 | 1085 | PTT-Chemotherapy | N/A | AML cancer | Fluorescence |
| MTF | 39.00 | 741 | 808 | 918/1015 | PTT-PDT | 0.09 | 4T1 tumor | Fluorescence |
| DUT850 | 60.00 | 853 | 808 | 960 | PTT-PDT | 0.33 | 4T1 tumor | Fluorescence |
| Ph | 34.00 | 730 | 808 | 1010 | PTT | 0.5 | GBM tumor | Fluorescence |
| BPBBT | 30.50 | 700 | 808 | 1000 | PTT-Immune therapy | N/A | 4T1 tumor | Fluorescence |
| LTPA | 43.50 | 825 | 808 | 933 | PTT-PDT | 1 | U87-Luc tumor | Fluorescence |
| 5 | 49.70 | N/A | 880 | 1000 | PTT | 0.9 | 4T1/GBM tumor | Fluorescence |
| IR1048-MZ | 20.20 | 980 | 980 | 1046 | PTT | 0.1 | A549 tumor | Fluorescence/PA |
| MPSS-NPs | 50.53 | 900 | 915 | 1093 | PTT | 0.5 | 4T1 tumor | Fluorescence |
| DC@PEG | 48.10 | N/A | 808 | 1200 | PTT | 1 | 4T1 tumor | Fluorescence |
| BX-OH | N/A | 725/798 | 808 | 945 | PTT-PDT | 1 | HeLa tumor | Fluorescence |
| NSCy-1050 | 17.40 | 810/917 | 808 | 975 | PTT-Chemotherapy | 0.75 | 4T1 tumor | Fluorescence |
| LET-1052 | 57.20 | 1052 | 1064 | 1112 | PTT | 0.6 | 4T1 tumor | Fluorescence |
| 2e | N/A | 1090 | 1064 | N/A | PTT | N/A | N/A | N/A |
| IR820 | 32.74 | 820 | 793 | 858 | PTT | 2 | Bladder tumor | Fluorescence |
| QR-2PEG321 | 43.80 | 1045 | 808 | 1150 | PTT | 1 | MGC-803 tumor | Fluorescence |
| PF | 42.30 | 1026 | 808 | 1064 | PTT | 0.65 | 4T1 tumor | Fluorescence |
| BBTD-BTE-PEG | 39.42 | 780 | 808 | 1094 | PTT | 0.3 | H22 tumor | Fluorescence/PA |
| IR780 liposomes | N/A | 800 | 808 | >900 | PTT | 1 | A431 tumor | Fluorescence/PA |
| ZM1068 | 59.50 | 725/770 | 808 | 1050 | PTT | 1 | 4T1 tumor | Fluorescence |
| F4-Br@P17 | 43.50 | 1078 | 1064 | >1100 | PTT | 1 | 4T1 tumor | Fluorescence |
| PFD | 40.69 | 810/1050 | 808 | 1056 | PTT | 0.75 | 4T1 tumor | Fluorescence |
| RC | 28.70 | 868 | 915 | 1023 | PTT | 1 | 4T1 tumor | N/A |
| EA5_c3 | 60.86 | 905 | 880 | 966 | PTT | 1 | 4T1 tumor | Fluorescence/PA |
| SY1080 | 22.30 | 820 | 808 | 1080 | PTT | 1 | 4T1 tumor | Fluorescence/PA |
| SeC | 62.00 | 790 | 808 | 945 | PTT | 1 | 4T1 tumor | Fluorescence |
| IT-TQF | 47.00 | 806 | 808 | 1020 | PTT | 1 | 143B tumor | Fluorescence |
| DTP-DPTQ | 51.55 | 852 | 808 | 1120 | PTT | 0.33 | 4T1 tumor | Fluorescence/PA |
| BDF1005 | 39.90 | 775 | 808 | 1034 | PTT | 1 | 4T1 tumor | Fluorescence |
| NDI | N/A | 575 | 633 | 1060 | PTT | 0.8 | PC-3 tumor | Fluorescence |
| HQS-Cy | 35.50 | 986 | 915 | 985 | PTT | 1 | 4T1 tumor | Fluorescence |
| TP-BP | 53.80 | 856/910 | 808 | 1060 | PTT | 1.2 | 4T1 tumor | Fluorescence |
| GBox-44+ | 47.40 | N/A | 1064 | N/A | PTT | 1 | HeLa cells | N/A |
| NIR-OX | N/A | 822 | 808 | 993 | PTT | 0.9 | 4T1 tumor | N/A |
| Nano-dICG | 42.10 | 894 | 825 | N/A | PTT | 0.65 | 4T1 tumor | Fluorescence/PA |
| 55-TPB | 69.40 | N/A | 808 | N/A | PTT | 2.5 | 4T1 tumor | N/A |
| mCy890 | 51.00 | 890 | 808 | 1034 | PTT | N/A | 4T1 tumor | Fluorescence |
| FS-GdND | 43.99 | 800–900 | 808 | 1091 | PTT | 0.96 | 4T1 tumor | Fluorescence |
| TPA-Et | 52.50 | 764 | 808 | >900 | PTT | 1 | 4T1 tumor | Fluorescence |
| CB1 | 36.00 | 837 | 808 | 1045 | PTT | N/A | 4T1 tumor | Fluorescence |
| BPN-BBTD | 39.80 | 700 | 785 | 950 | PTT | 0.6 | bladder tumor | Fluorescence |
| FTQ | 49.00 | 1140 | 1064 | N/A | PTT | 1 | Hepa 1–6 liver tumor | N/A |
| BHcy | 42.20 | 770 | 808 | 915 | PTT-PDT | 0.25 | 4T1 tumor | Fluorescence |
| BH 1024 | 41.30 | 1024 | 1064 | 1070 | PTT-PDT | 1 | 4T1 tumor | Fluorescence |
| ML880 | N/A | 880 | 880 | 912 | PTT-PDT | 1 | HepG2 tumor | N/A |
| Se-IR1100 | 55.37 | 845 | 808 | 1100 | PTT-PDT | 1 | 4T1 tumor | Fluorescence |
| ZSY-TPE | 28.40 | 730 | 808 | 1020 | PTT-PDT | 1 | 4T1 tumor | Fluorescence |
| ETTC | 52.80 | N/A | 808 | >900 | PTT-PDT | 1 | A549 tumor | Fluorescence/PA |
| Y16-Pr | 82.40 | 600–900 | 808 | 920 | PTT-PDT | 1 | 4T1 tumor | Fluorescence/PA |
| IDCIC | 78.90 | 760 | 808 | 1000 | PTT-PDT | 1 | 4T1 tumor | Fluorescence/PA |
| P-TAB-2I | 42.30 | 669 | 808 | 965 | PTT-PDT | 0.8 | 4T1 tumor | Fluorescence |
| RNPs-SBA/PtIV | 65.17 | 1040 | 1064 | >1000 | PTT-Chemotherapy | 0.5 | Pan02 tumor | Fluorescence |
| TTQ-TC-PFru | 28.00 | N/A | 808 | 1050 | PTT-Chemotherapy | 1 | MCF-7 tumor | Fluorescence |
| IR-FEFc | 40.29 | 808 | 808 | 1030 | PTT-Chemotherapy | 1 | 4T1 tumor | Fluorescence |
| Ru1085 | 30.90 | 874 | 808 | 1085 | PTT-Chemotherapy | 0.8 | A549 tumor | Fluorescence |
| Ru1000 | 17.60 | 700 | 808 | 1000 | PTT-Chemotherapy | 1 | A549 tumor | Fluorescence |
| ABFe | 55.00 | 670/810 | 808 | N/A | PTT-Chemotherapy | 1 | 4T1 tumor | PA |
| HBP/PTX | N/A | 878 | 1064 | >1000 | PTT-Chemotherapy | 0.5 | 4T1 tumor | PA |
| BDP-T-N | 37.87 | 772 | 785 | >950 | PTT-Chemotherapy | 0.65 | 4T1 tumor | Fluorescence |
| Cy-PA | 61.00 | 910 | 915 | 1115 | PTT-Chemotherapy | 0.4 | B16-tumor | Fluorescence |
| BT-DPTQ | N/A | 850 | 808 | 1100 | PTT-Immune therapy | 0.8 | 4T1 tumor | Fluorescence/PA |
| PPor | 70.00 | 860 | 808 | 1000 | PTT-Immune therapy | 0.8 | 4T1 tumor | Fluorescence |
| CBT-3 | N/A | N/A | 1064 | >1000 | PTT-Immune therapy | 0.6 | 4T1 tumor | PA |
| CX | 57.00 | 770/820 | 808 | 970 | PTT-PDT-Immune therapy | N/A | melanoma tumor | Fluorescence |
| Hcy1100 | 58.70 | 730–800 | 980 | 1100 | PTT-Immune therapy | 0.5 | U87/GL261 tumor | Fluorescence |
提升PTA的功率转换效率以改善PTT
光热转换效率(PCE)是决定光热剂(PTAs)能否有效实现治疗效果的关键因素。高PCE意味着在较低的光照强度下就能产生足够的热量,从而避免因过度辐射对健康组织造成的潜在损伤,并有效地抑制肿瘤细胞的增殖。理论上,为了提高PCE,应当加速激发态的内转换(IC)过程,促进非辐射衰变过程,最大化热量的产生。
基于这一指导原则,研究人员已经探索并应用了多种策略以提升NIR-II小分子光热剂的PCE。这些策略包括但不限于:
形成J-聚集体和H-聚集体:通过特定的分子设计和聚集态调控,形成有序的分子聚集体结构,如J-聚集体和H-聚集体,可以显著增强光吸收能力,并优化能量转移路径,进而提高PCE。
引入分子内旋转:增加分子内旋转或振动等动态过程,有助于促进激发态的能量耗散,加快非辐射跃迁速率,从而更有效地将吸收的光能转化为热能。
遵循能量间隙定律的策略:通过调整分子结构参数,例如共轭长度、杂原子取代等,来缩小激发态与基态之间的能量差,这有助于加速电子从激发态回到基态的过程,从而提高非辐射跃迁的概率和效率。
通过上述方法优化分子结构及其聚集态特性,不仅可以增强光热剂的光吸收能力和能量转换效率,还能进一步提升其在光热治疗中的实际应用潜力。这些策略为开发高效、安全且具有优异生物相容性的新型NIR-II光热剂提供了重要的理论基础和技术支持,推动了光热治疗领域的发展。
形成聚集体以改善 PCE
聚集是荧光团中常见的现象,根据分子的空间排列模式,通常可以将聚集态分为H-聚集态和J-聚集态。这两种聚集态对光热转换效率(PCE)有着不同的影响:
J-聚集态:在这种状态下,分子以头尾相接的方式堆积,这导致吸收带变窄,有利于增强吸收系数,从而提高PCE。此外,J-聚集态缩小了S1-S0能级间隙,并在S1和S0态之间产生了强烈的振动耦合,这种耦合增强了非辐射跃迁过程,进一步提升了PCE。
H-聚集态:与此相反,H-聚集态的分子面对面堆积,这种方式倾向于加速内转换过程,促进热量的产生。
基于上述原理,Chen教授团队设计了一种基于白蛋白的NIR-II纳米颗粒(NPs),即IR1061@HSA,用于成像与光热治疗(PTT)(https://doi.org/10.1016/j.mtbio.2022.100366)。此纳米颗粒通过人血清白蛋白(HSA)组装形成,具有51.89%的高光热转换效率,发射波长超过1000 nm,并且表现出优异的生物相容性。由于纳米颗粒中的IR1061处于J-聚集态,因此IR1061@HSA纳米颗粒能够实现高效的光热转换。
实验表明,将IR1061@HSA纳米颗粒注入携带143B骨肉瘤的小鼠体内后,通过NIR-II成像技术可以清晰观察到肿瘤的主要血管结构。在使用808 nm激光照射5分钟后,肿瘤部位的温度上升至53°C,展示了其在癌症治疗中的潜力。这种多功能的NIR-II纳米颗粒平台不仅扩展了现有的抗癌手段,还在精准诊断和高效治疗方面展现了巨大潜力,为未来的研究和临床应用提供了新的方向和技术支持。
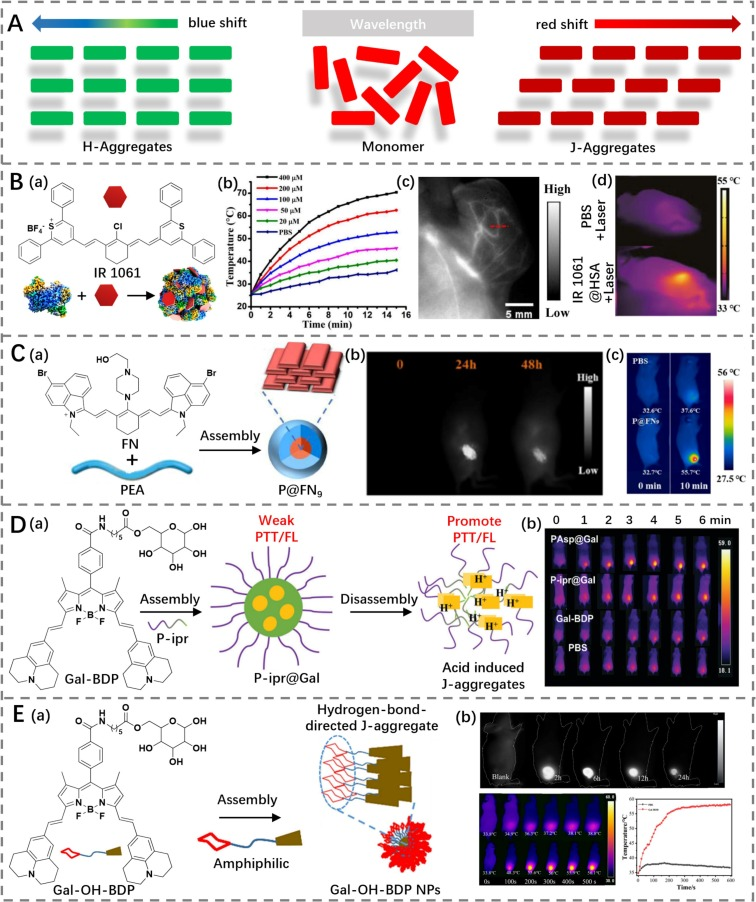
图2. (A)H-聚集和J-聚集的示意图。(B)a) IR1061的结构及IR1061@HSA制备过程示意图;b) 不同浓度IR1061@HSA的温度变化;c) 肿瘤血管的NIR-II成像;d) 经PBS或IR1061@HSA处理的143B骨肉瘤荷瘤小鼠的热成像。(C)a) FN的结构及P@FN9形成过程示意图;b) 使用P@FN9在不同时间点对肿瘤进行NIR-II成像;c) 经PBS或P@FN9处理的荷瘤小鼠在0/10分钟时的热成像。(D)a) Gal-BDP的结构及其组装/解组装过程;b) 经PBS、Gal-BDP、P-ipr@Gal和对照组(PAsp@Gal)处理的荷瘤小鼠的热成像。(E)a) Gal-OH-BDP纳米颗粒的结构及氢键导向的J-聚集过程;b) 经Gal-OH-BDP纳米颗粒处理的荷瘤小鼠的NIR-II荧光和热成像,以及随时间的温度变化。
Yan等人报道了一种NIR-II菁染料FN,通过哌嗪和溴原子修饰后能够形成J-聚集体P@FN9(https://doi.org/10.1016/j.actbio.2022.10.025)。这种染料是通过将多基团修饰的菁染料FN与两性嵌段共聚物PEA封装实现的,得益于溴取代的FN染料与π-轨道之间的Br-π相互作用。在1064 nm激光照射下,P@FN9展现出55.4%的高光热转换效率(PCE),显著高于P@FN2.5和P@FN5,这归因于其更高的吸收能力。实验显示,在相同条件下,P@FN9溶液温度上升更快且更显著。由于增强的渗透与滞留(EPR)效应,P@FN9纳米颗粒在肿瘤部位大量积累,并通过NIR-II成像展示出来。体内实验表明,在1064 nm激光照射10分钟后,肿瘤温度迅速升至最高55.9°C,经过15天治疗后肿瘤被完全消融。这一结果证明了J-聚集体策略可以有效提升FN染料的吸收能力和PCE,从而实现卓越的治疗效果。
硼二吡咯甲川(BODIPY)染料作为经典荧光染料之一,近年来也被认为是构建J-聚集态的理想骨架。Yan等人设计了一种半乳糖修饰的BODIPY染料Gal-BDP,具有NIR-II发射特性(https://doi.org/10.1039/D2TB00705C)。半乳糖不仅增强了BODIPY染料的亲水性,还促进了J-聚集体的形成。Gal-BDP与酸响应型两性嵌段共聚物结合形成P-ipr@Gal纳米颗粒,在胶束腔内呈现H-聚集态。在酸性环境中,P-ipr@Gal纳米颗粒的吸收强度显著增加,伴随着最大发射波长红移和强度增加。此外,Yan等人还开发了一种具有J-聚集特性的纳米颗粒(Gal-OH-BDP NPs),其PCE为55%,用于NIR-II荧光成像引导的PTT(https://doi.org/10.1016/j.jcis.2021.12.177)。
为了进一步扩展BODIPY J-聚集体的应用范围,Liu等人引入了双四氢喹啉(THQ)单元来修饰乙烯桥联的BODIPY骨架,创建了BisBDP2(https://doi.org/10.1126/sciadv.add5660)。该结构展示了1200 nm的红移吸收,并通过分子间J-耦合形成了J-聚集体。BisBDP2 J-聚集体被封装在Pluronic F-127基质中,形成了具有高光热转换能力的BisBDP2纳米颗粒(PCE为63%)。结合光声成像技术,BisBDP2纳米颗粒能够有效地追踪并消融体内的肿瘤。
Hao等人则设计了一种乙烯桥联的aza-BODIPY二聚体BDP3,在封装到F-127聚合物中形成J型聚集体纳米颗粒后,表现出明显的分子间激子耦合(https://doi.org/10.1002/anie.202211081)。这种J型聚集体展现了红移吸收和显著的PCE(60.3%),能够在NIR-II成像引导的PTT过程中有效地消融肿瘤。这些研究不仅拓展了NIR-II窗口下光热剂的设计思路,也为癌症治疗提供了新的高效、安全的方法。
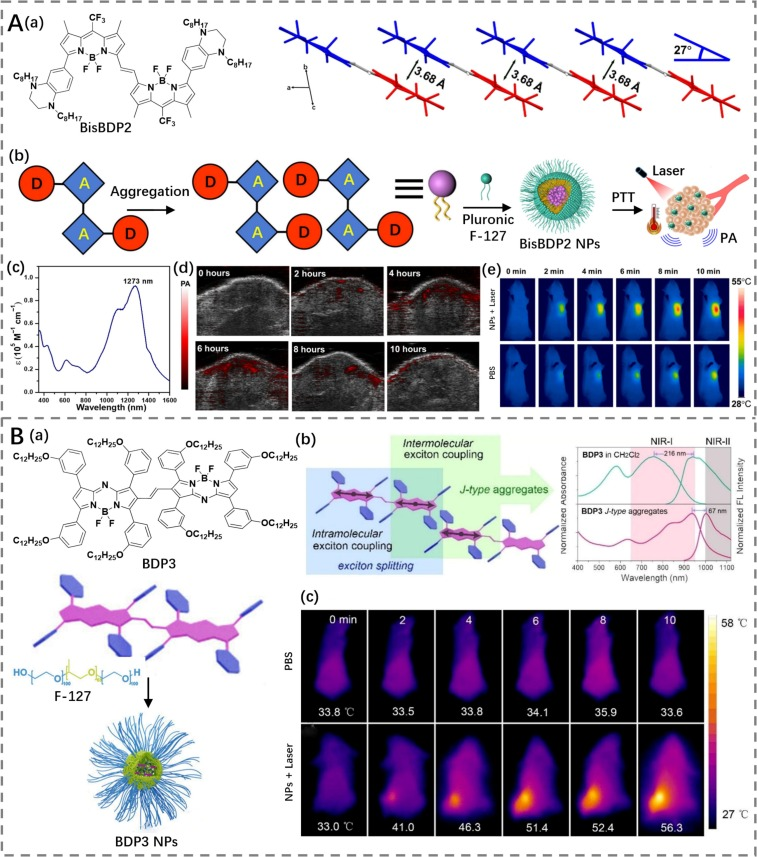
图3. (A)a) BisBDP2的结构及其在晶体状态下J-聚集体的示意图;b) BisBDP2 J-聚集体用于成像和光热治疗(PTT)的制备示意图;c) BisBDP2纳米颗粒在PBS溶液中的归一化吸收光谱;d) 使用BisBDP2纳米颗粒对肿瘤进行实时光声(PA)成像;e) 经PBS或BisBDP2纳米颗粒处理的荷瘤小鼠的热成像。 (B)a) BDP3的结构及其纳米颗粒(NPs)的制备示意图;b) 其J-聚集行为及其光谱变化示意图;c) 经PBS或BDP3纳米颗粒处理的荷瘤小鼠的热成像。
BODIPY染料单体通过自组装形成J-聚集体已被证明能够导致吸收波长的红移,这极大地增强了成像引导光热治疗(PTT)的应用潜力。然而,在实际应用中,J-聚集体与单体之间在荧光、光热或光动力活性方面往往存在不平衡的问题。为了克服这一挑战,研究人员采用了多种策略来优化这些性能。
Yan等人通过引入三苯胺和噻吩基团到aza-BODIPY分子(Dye2)结构中,减少了分子间的立体位阻和π-π相互作用,从而促进了J-聚集体的形成(https://doi.org/10.1039/D1TB02820K)。这种设计不仅显著提升了光热效应和荧光亮度,还实现了35.6%的光热转换效率(PCE)。随后,形成的J-聚集体被装载到两性嵌段共聚物中,制备成J-NPs,并成功应用于肿瘤NIR-II荧光成像和PTT,取得了高效的治疗结果(图4A)。
与此同时,Xiong等人通过在meso位置引入螺吡啶基团,在3,5-芳基位置引入氟代吲哚基单元,设计了一种具有给体-受体-给体结构的BODIPY荧光团(BDP-F),其PCE达到了50.9%(图4B)(https://doi.org/10.1021/acs.nanolett.4c01339)。此外,他们还在5-吲哚基位置修饰了各种电子取代基以调节分子间相互作用。特别是,引入电子吸引取代基可以减少π-电子密度,促进更紧密的分子排列,有助于形成具有强荧光特性的J-聚集体。这些J-聚集体表现出增强的系间穿越,导致显著的光动力和光热效应。因此,这些多功能的J-聚集体整合了荧光、光动力和光热特性,实现了全身血管和肿瘤的NIR-II成像,以及成像引导下的光动力治疗(PDT)和PTT。
这些研究展示了通过精确设计和修饰BODIPY分子结构,可以有效促进J-聚集体的形成,进而提升其在癌症治疗中的综合性能。这种方法不仅拓宽了光热剂的设计思路,也为开发高效、安全的多功能纳米材料提供了新的方向和技术支持。通过结合不同的光学特性,这些新型材料有望在未来的临床应用中展现出巨大的潜力。
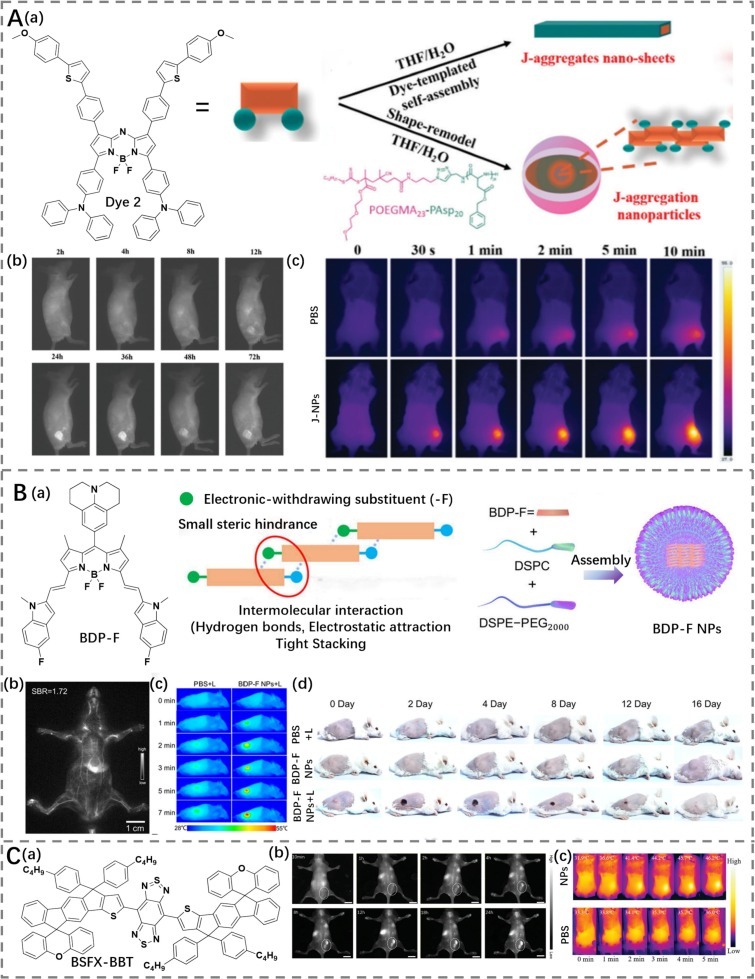
图 4. (A) a) 染料 2 的结构以及 J-聚集体 (J-NPs) 制备的示意图;b) 使用 J-NPs 进行肿瘤实时荧光成像;c) 用 PBS 或 J-NPs 处理的荷瘤小鼠的热成像。(B) a) BDP-F 的结构以及 J-聚集体 (BDP-F NPs) 形成和制备的示意图;b) 使用 BDP-F NPs 进行全身血管的近红外二区荧光成像;c) 用 PBS 或 BDP-F NPs 处理的荷瘤小鼠的热成像;d) 不同组小鼠治疗 16 天期间的图像。(C) a) BSFX-BBT 的结构;b) 在不同时间点使用 J-聚集的 NPs (alpha NPs) 进行肿瘤的近红外二区荧光成像;c) 用 PBS 或 alpha NPs 处理的荷瘤小鼠的热成像。
Dong等人利用螺芴基团引入策略,设计了两种新型苯并双噻二唑基染料BSFX-BBT和OSFX-BBT,这两种染料在粉末状态下展现出不同的荧光强度(https://doi.org/10.1002/adhm.202400846)。特别是BSFX-BBT能够通过头尾滑动堆积形成J-聚集体(Alpha NPs),这种堆积方式在晶体状态下由烷基链之间的范德华力稳定,从而赋予其增强的荧光强度和适宜的光热特性,并且表现出良好的光热稳定性(PCE为36.7%)。相比之下,由于长烷基链的阻碍,OSFX-BBT无法形成有效的J-聚集体。Alpha NPs因其优异的光热性能被应用于体内抗肿瘤实验。静脉注射后,这些纳米颗粒能够在肿瘤部位有效富集,这一过程可以通过NIR-II成像系统清晰地观察到。激光照射后,肿瘤区域温度显著升高,有效地抑制了肿瘤生长。
J-聚集态的荧光团倾向于导致吸收波长红移,这有助于实现更深的组织穿透能力,而H-聚集态则通过增强激发态的非辐射衰变来提高染料的光热性能。Ji团队构建了一种名为IALP的荧光脂质纳米系统,其中负载的NIR-II荧光团IR 1061由于磷脂双层与IR 1061之间的静电相互作用,在脂质体的狭窄空间内呈面对面堆积排列,形成了H-聚集体(图5A)(https://doi.org/10.1186/s40580-022-00352-4)。这种结构不仅增强了光热性能,还实现了NIR-II荧光成像、化疗和PTT功能的整合,进一步发展成为RRIALP-C(PCE为42%),并成功用于肿瘤消融。
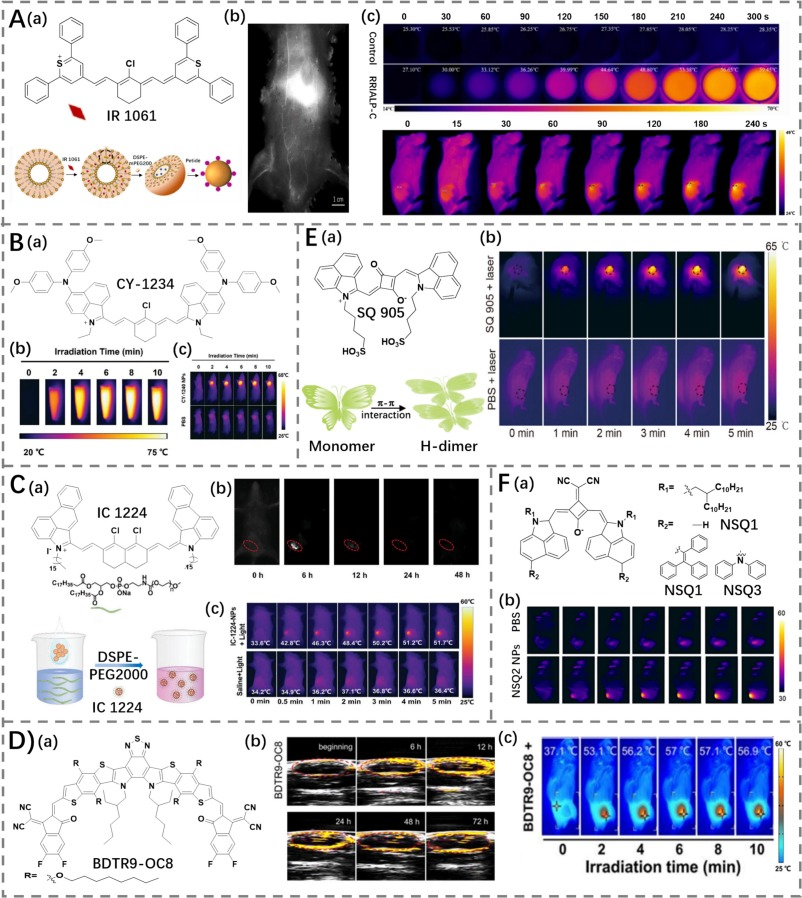
图5. (A) a) IR 1061 的结构以及 H-聚集体制备的示意图,b) 使用 J-NPs 进行小鼠身体荧光成像,以及 c) RRIALP-C 在体外/体内的热成像性能。(B) a) CY-1234 的结构,b) CY-1234 NPs 分散液在体外的热成像性能,c) 使用 PBS 或 CY-1234 NPs 处理的荷瘤小鼠的热成像。(C) a) IC 1224 的结构以及 IC 1224-NPs 制备的示意图,b) 使用 IC-1224-NPs 进行小鼠身体荧光成像,以及 c) 使用 PBS 或 IC-1224-NPs 处理的荷瘤小鼠的热成像。(D) a) BDTR9-OC8 的结构,b) 使用 BDTR9-OC8 NPs 对荷瘤小鼠进行光声成像,以及 c) 使用 BDTR9-OC8 NPs 处理的荷瘤小鼠的热成像。(E) a) SQ 905 的结构以及 SQ 905 的 H-聚集体排列示意图,b) 在不同时间点用 PBS 或 SQ 905 处理的荷瘤小鼠的热成像。(F) a) NSQ 1–3 的结构,b) 在不同时间点用 PBS 或 NSQ2 NPs 处理的荷瘤小鼠的热成像。
通过扩展π-共轭体系和端基取代,聚甲炔分子的发射波长可以达到1000 nm以上。Fan等人采用这种方法制备了一种NIR-II菁染料CY-1234(PCE为76.01%),该染料通过引入4,4'-二甲氧基-4'-联苯胺供体增强分子内电荷转移(ICT),并将苯环环化至3-吲哚基锚定基团以扩展π-共轭(https://doi.org/10.1002/smll.202307829)。CY-1234进一步与两性嵌段共聚物F-127纳米沉淀形成CY-1234纳米颗粒(NPs),在水溶液中展现出蓝移吸收、极低的荧光强度和超高的PCE。这种现象主要归因于CY-1234的良好平面性促进了H-聚集体的形成,而共轭长度的增加减小了能级间隙,从而提高了非辐射衰减速率,增强了光热效应。实验表明,在尾静脉注射CY-1234 NPs并暴露于1064 nm激光照射后,肿瘤抑制率达到85.9%,为NIR-II光引导PTT提供了新的思路。
Liu等人通过分子工程探索,合成了六种具有扩展末端吲哚盐π-共轭体系的聚甲炔菁染料IC-1224(PCE为83.2%)(https://doi.org/10.1002/adhm.202304421)。研究发现,通过烷基侧链修饰吲哚盐能够显著增强荧光并防止分子完全聚集。扩大共轭骨架不仅红移了吸收光谱,减小了能级间隙,还增加了非辐射衰减速率。IC-1224与DSPE-PEG-2000水合后形成的纳米颗粒由于其平面结构导致H-聚集,增强了热量产生,并在肿瘤部位有效积累,实现了肿瘤消融效果和显著的肿瘤抑制。
Tian等人设计了NIR-II分子BDTR9-OC8,通过侧链调控分子堆积策略,在载入PS5000-b-PEG500后形成H-聚集体(https://doi.org/10.1002/anie.202117433)。这些纳米颗粒(NPs)表现出高达78%的PCE和强光声(PA)信号强度,这得益于分子间的π-π堆积。BDTR9-OC8 NPs成功应用于光声成像引导下的肿瘤治疗。
Chen等人通过扩展共轭和增强ICT效应制备了方酸菁染料SQ 905,使其吸收/发射显著红移,这是由于最高占据分子轨道(HOMO)与最低未占据分子轨道(LUMO)间隙的减小所致(https://doi.org/10.1021/acs.jmedchem.4c00601)。SQ 905倾向于在水溶液中形成H-聚集体,因其疏水结构诱导的分子间π-π相互作用,展现出高PCE(68.61%),促进了其在体内肿瘤PTT中的应用。
Wang等人整合了H-聚集和分子内运动策略,合成了基于方酸的染料(NSQ1–3),实现了高达86.3%的PCE,用于体内光声成像引导的PTT(https://doi.org/10.1007/s11426-023-1830-0)。这一系列研究表明,通过精确设计分子结构和优化聚集态特性,可以显著提高NIR-II光热剂的性能,为癌症治疗提供了高效、安全的新方法。这些进展不仅拓宽了光热剂的设计理念,也为未来临床应用奠定了坚实基础。
引入分子内旋转以改善 PCE
分子的旋转、振动和扭转能够促进非辐射衰变,将激发态能量以热能形式释放,因此引入分子自由运动是提高光热转换效率(PCE)的有效策略之一。基于这一理念,研究人员设计了许多用于成像引导光热治疗(PTT)的光热剂(PTAs),通过在不同骨架中引入自由旋转/振动来提升其性能。
2020年,Wang团队开发了一种具有聚集诱导发光(AIE)特性的两性离子荧光团BITT,专门用于NIR-II荧光成像引导的协同光疗(https://doi.org/10.1002/adfm.202007026)。BITT通过π-桥连接二甲基苯胺/三苯胺基团与季铵盐单元,其固体状态下的尾部发射位于NIR-II区域。由于具备自由分子旋转器,BITT展现出卓越的光热转换效率(35.76%),并成功应用于NIR-II荧光成像引导的肿瘤消除,尤其是在制备成AIE点后,其效果尤为显著(图6B)。
随后,Peng等人报道了基于BITT类似骨架的结构固有靶向光敏剂CyQN-BTT、CyE-TT和CyQN-TT,这些化合物通过引入苯并噻二唑来延长π-桥进行合成(图6C)(https://doi.org/10.1039/D2SC02879D)。特别是CyQN-BTT,在NIR-II范围内展现了强烈的尾部发射,并能生成单线态氧。这是由于苯并噻二唑的引入缩小了HOMO-LUMO能隙和ΔES-T值。此外,CyQN-BTT扭曲的共轭骨架导致更高的PCE(37.8%),这归因于扭曲的分子内电荷转移(TICT)效应。因此,CyQN-BTT依靠NIR-II荧光和光声成像引导的光动力治疗(PDT)和PTT,实现了肿瘤的有效消除。
Shuang团队则设计了一种自监测NIR-II染料BITX-OH(图6D),通过引入可旋转的双键π-桥、p-羟基二苯黄素旋转器和具有多个可旋转单键的苯并[c,d]吲哚骨架(https://doi.org/10.1002/adhm.202402614)。BITX-OH展现出55.3%的高PCE,具备卓越的光热转换能力,可以有效地用于肿瘤消融。此外,它还展示了NIR-II荧光,作为PTT治疗的实时反馈机制,从而提高了治疗的精准度和效果。
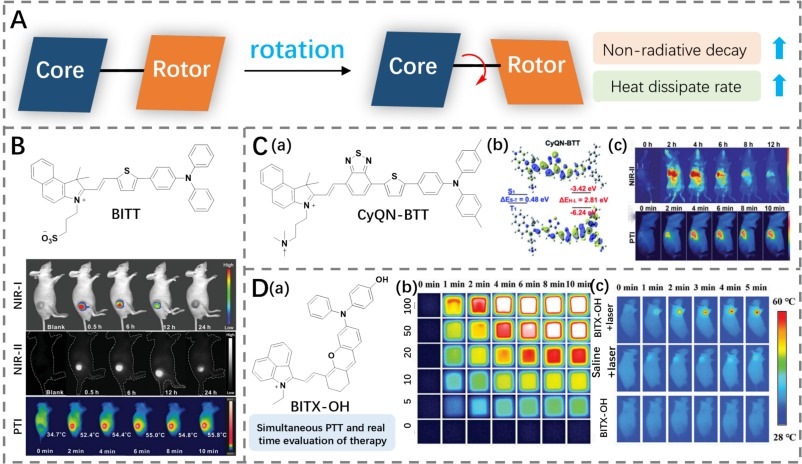
图 6. (A) 通过分子内旋转提高光热效应的示意图。(B) BITT 的结构以及荷瘤小鼠注射 BITT 纳米点后的近红外 I 区/近红外 II 区/光热成像。(C) a) CyQN-BTT 的结构,b) CyQN-BTT 的 HOMO-LUMO 分布和能隙,c) 注射 CyQN-BTT 的荷瘤小鼠的近红外 II 区和热成像。(D) a) BITX-OH 的结构,b) BITX-OH 浓度依赖的热成像实验,c) 激光照射或不照射下,注射 BITX-OH 或生理盐水的荷瘤小鼠的热成像。
Liu等人设计了一种新型染料IRLy,通过在长共轭菁染料骨架上引入分子转子(图7A)(https://doi.org/10.1016/j.jconrel.2024.03.020)。这种策略旨在通过促进分子内运动来有效调节激发态的辐射和非辐射衰变,从而提高光热治疗(PTT)效率,并实现与NIR-II荧光强度之间的更优平衡。进一步地,通过使用靶向配体Tf-F127和两性嵌段共聚物(mPEG-PBGE)负载IRLy形成纳米颗粒(Tf-IRLy NPs),其PCE达到了59.33%。这些纳米颗粒展现出强大的NIR-II发射和卓越的光热性能。实验表明,在给予Tf-IRLy NPs后,观察到其在原位胶质瘤中显著富集,这一过程由靶向配体介导,并伴随着激光照射下肿瘤区域温度的显著升高。通过NIR-II荧光/光声成像和光热成像技术确认了这一结果,显示出对肿瘤的显著抑制效果。
Li等人则使用二苯酚单元作为桥连基团,连接两个聚甲炔分子,构建了一种自由旋转的二聚体oBHCy(PCE为49.2%,图7B)(https://doi.org/10.1021/acssensors.4c00561)。这种化合物不仅展现出显著的NIR-II荧光,还具备优越的光热特性。在PTT治疗下,oBHCy实现了有效的肿瘤消融,展示了其在癌症治疗中的潜力。
Sun等人通过使用刚性共平面核心桥连一个灵活的四苯乙烯转子,构建了一种名为CCNU-1060的光热治疗剂(PCE为26.5%,图7C)(https://doi.org/10.1002/adhm.202101003)。这种设计使得CCNU-1060能够实现高空间分辨率的血管成像,并在体内实现了有效的NIR-II荧光引导PTT。这表明通过结合刚性和灵活性分子结构,可以有效地增强光热剂的性能,使其在复杂的生物环境中也能表现出优异的治疗效果。
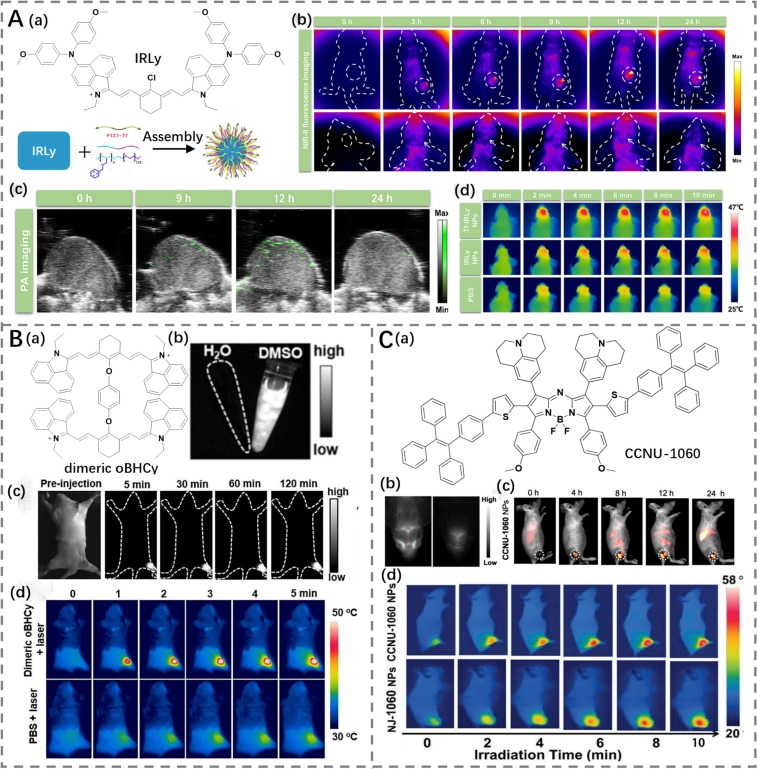
图7.(A)a) IRLy 的结构及 Tf-IRLy 纳米颗粒的制备示意图;b) 注射 Tf-IRLy 纳米颗粒后,皮下或原位荷瘤小鼠的近红外二区成像;c) 利用 Tf-IRLy 纳米颗粒进行皮下神经胶质瘤的光声成像;d) 分别注射 PBS、IRLy 纳米颗粒和 Tf-IRLy 纳米颗粒的荷瘤小鼠的热成像。(B) a) oBHCy 的结构;b) oBHCy 在水或 DMSO 溶液中的荧光图像;c) 注射 oBHCy 后,荷瘤小鼠的近红外二区荧光成像;d) 分别注射 PBS 和 oBHCy 的荷瘤小鼠的热成像。(C) a) CCNU-1060 的结构;b) 使用 CCNU-1060 纳米颗粒进行脑血管成像;c) 注射 CCNU-1060 纳米颗粒后,携带 4T1 肿瘤的小鼠的近红外二区成像;d) 分别注射 PBS 和 CCNU-1060 纳米颗粒的荷瘤小鼠的热成像。
苯并双噻二唑(BBTD)或6,7-二苯基-1,2,5]噻二唑[3,4-g]喹喔啉(DPTQ)基染料因其卓越的光学特性而被广泛应用于高分辨率NIR-II成像。为了在光热治疗(PTT)中实现最佳效果,必须平衡辐射和非辐射衰变过程。研究表明,通过引入分子转子来修饰BBTD/DPTQ染料是一种有效增强非辐射衰变、提高PTT效率的策略。通常,为了开发高效的NIR-II荧光团,研究人员会将富含电子的三苯胺基团引入BBTD/DPTQ骨架,以利用其强大的电子吸引特性作为荧光团的受体。
2020年,Ling等人通过引入噻吩桥和三苯胺来修饰BBTD受体,设计了一种新型染料CSM2(图8A)(https://doi.org/10.1039/C9MH00660E)。这种设计不仅扩展了共轭体系,还增强了分子内运动,从而提高了非辐射衰变速率。具体而言,噻吩桥的插入扩展了共轭体系,而三苯胺转子的引入则促进了非辐射衰变,使得CSM2展现出显著的NIR-II发射和较高的光热转换效率(PCE为31.6%)。随后,CSM2通过纳米沉淀法被负载到Pluronic F127中,形成CSMN2,用于MTT实验和体内抗肿瘤实验。
实验结果表明,CSMN2在NIR-II光声成像引导下,能够有效地通过光热消融方法杀死肿瘤细胞或抑制肿瘤生长。这不仅验证了通过引入分子转子来增强非辐射衰变的有效性,也展示了CSM2在实际应用中的潜力。此外,CSMN2的成功制备和应用进一步证明了通过精确设计分子结构、优化共轭体系以及增强分子内运动,可以显著提升光热剂的性能,使其在癌症治疗中发挥重要作用。
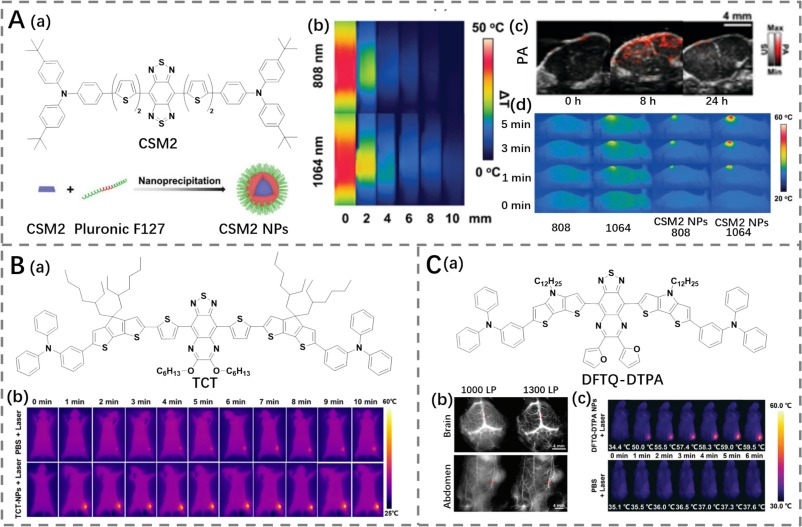
图8. (A) a) CSM2结构及CSM2纳米颗粒制备示意图;b) CSM2纳米颗粒在808纳米或1064纳米激光照射下的光热性能;c) CSM2纳米颗粒对肿瘤的PA成像;d) 荷瘤小鼠分别接受PBS或CSM2纳米颗粒治疗,在有或无808/1064纳米激光照射下的热成像。(B) a) TCT结构;b) 荷瘤小鼠接受PBS和TCT纳米颗粒治疗后的热成像。(C) a) DFTQ-DTPA结构;b) 使用DFTQ-DTPA纳米颗粒进行脑部和腹部成像;c) 荷瘤小鼠接受PBS和DFTQ-DTPA纳米颗粒治疗后的热成像。
在进一步发展这一策略的过程中,研究人员通过多种创新设计和合成路线,开发出了多种高效的NIR-II荧光团用于成像引导的光热治疗(PTT)。
Shen等人采用三苯胺和环戊二噻吩基团修饰DPTQ衍生的受体,合成了具有扭曲结构的NIR-II荧光团TCT(PCE为40.1%),用于NIR-II成像引导的PTT(图8B)(https://doi.org/10.1039/D3BM01604H)。这种设计不仅扩展了共轭体系,还增强了分子内运动,从而提高了非辐射衰变速率,使得TCT表现出显著的NIR-II发射和较高的光热转换效率。
Wu等人则通过整合三苯胺和环戊二噻吩基团修饰呋喃取代的噻二唑喹喔啉受体,调节了辐射和非辐射衰变过程,最终合成了新型NIR-II荧光团DFTQ-DTPA(图8C)(https://doi.org/10.1002/agt2.458)。这种荧光团已成功应用于脑部、腹部以及肿瘤PTT的NIR-II荧光成像。结果表明,引入三苯胺转子是促进非辐射衰变过程、实现高PCE(51.6%)的有效方法。
与复杂的合成路线不同,Li等人采用两种简单的合成方法开发了一种基于二苯并芴的D-π-A型光热剂FE-IDMN,展现出NIR-II发射和适宜的光热转换能力(图9A)(https://doi.org/10.1002/adfm.202311365)。研究表明,N,N-二乙氨基的引入增强了分子的给体-受体强度,从而促进了波长的延伸。转子单元(如N,N-二乙氨基)和振动单元(如氰基)的引入促进了非辐射衰变过程。此外,分子的非离子、共轭平面结构有利于π-π堆积,有助于非辐射衰变过程以产生热量。体外性能研究表明,FE-IDMN在855 nm和1080 nm处分别展现出最大吸收峰和发射峰,并且该光热剂展现出高光热稳定性和高达82.6%的PCE。为了验证治疗效果,FE-IDMN纳米颗粒被用于评估抗肿瘤效果,在激光照射下温度迅速升高,有效抑制了肿瘤生长,同时未对小鼠健康造成额外损害。
Wang等人通过使用二酮吡咯并吡咯受体和4-(N,N-二甲氨基)苯基给体,构建了一种稳定的NIR-II发光二自由基态光热剂2PhNVDPP(PCE为53%,图9B)(https://doi.org/10.1021/jacs.4c11549)。强分子内给体-受体相互作用有效扩展了波长,而分子间π-π相互作用抑制了分子的扭曲构象,优化了PCE。因此,稳定的NIR-II发光二自由基态光热剂的实现促进了高效的NIR-II荧光成像引导PTT在癌症诊疗中的应用。
这些研究展示了通过精确设计分子结构、优化共轭体系以及增强分子内运动,可以显著提升光热剂的性能,使其在癌症治疗中发挥重要作用。这些创新不仅提高了光热转换效率(PCE),还增强了成像引导下的治疗效果,为未来的临床应用提供了新的可能性和技术支持。通过不断探索和优化这些策略,有望开发出更加高效、安全的癌症治疗方法。
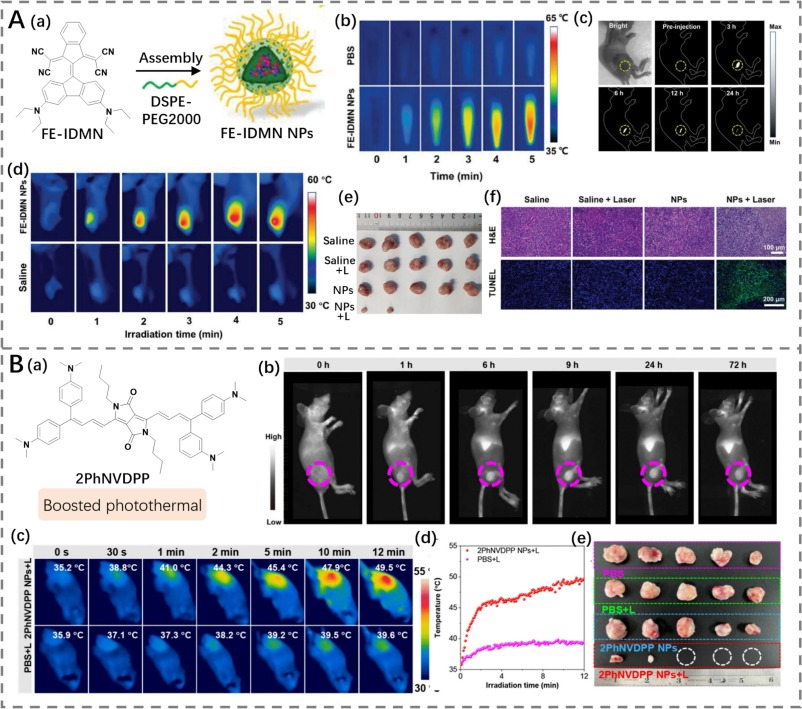
图9. (A) a) FE-IDMN的结构以及FE-IDMN纳米颗粒制备的示意图;b) CSM2纳米颗粒的光热性能;c) 使用FE-IDMN纳米颗粒对肿瘤进行近红外二区荧光成像;d) 使用生理盐水或FE-IDMN纳米颗粒治疗的荷瘤小鼠的热成像;e) 治疗14天后的肿瘤照片;f) 治疗14天后肿瘤组织的H&E染色和TUNEL染色。(B) a) 2PhNVDPP的结构;b) 使用2PhNVDPP纳米颗粒治疗的荷瘤小鼠的近红外二区荧光成像;c) 使用PBS和2PhNVDPP纳米颗粒治疗的荷瘤小鼠的热成像;d) 肿瘤部位随时间变化的温度变化;e) 治疗14天后的肿瘤照片。
TICT(扭曲的分子内电荷转移)现象在给体-受体(D-A)结构染料中尤为显著,特别是在由单键连接的给体和受体之间。这种过程通过增强染料的非辐射跃迁来产生热量,从而有效提高光热转换效率(PCE)。Liu等人利用吡啶盐作为电子受体、三苯胺作为电子给体,设计了一种具有TICT特性的NIR-II半菁染料HCY-995(图10A)(https://doi.org/10.1002/adhm.202301584)。该染料展示了较大的斯托克斯位移,并实现了高达54.9%的光热转换效率。PCE的提升主要归因于呋喃环数量增加所带来的强TICT效应。
进一步地,HCY-995被负载到聚合物中形成纳米颗粒(HCY-995 NPs),这些纳米颗粒不仅展现出高荧光亮度,能够清晰地对小鼠的大脑、后肢和腹部进行成像,还表现出卓越的光热性能。具体来说,在NIR-II成像引导下,HCY-995 NPs能够在肿瘤部位实现有效的光热消融,显示出其在肿瘤治疗中的巨大潜力。
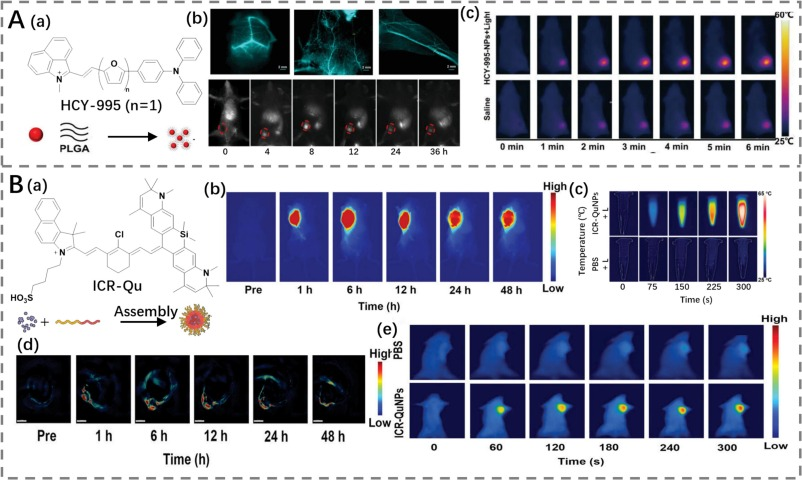
图10.(A)a)HCY-995的结构以及HCY-995纳米粒子制备的示意图;b)HCY-995纳米粒子对大脑、后肢、腹部血管和肿瘤进行的近红外二区荧光成像;c)用生理盐水或HCY-995纳米粒子治疗的荷瘤小鼠的热成像。(B)a)ICR-Qu的结构以及ICR-Qu纳米粒子制备的示意图;b)ICR-Qu纳米粒子对荷瘤小鼠进行的近红外二区荧光成像;c)ICR-Qu纳米粒子和PBS溶液的体外光热性能;d)用ICR-Qu纳米粒子治疗的荷瘤小鼠的PA成像;e)PBS或ICR-Qu纳米粒子治疗期间肿瘤部位的温度变化。
Yu等人通过合理设计,利用Si-黄酮取代吲哚菁绿(ICG)中的电子供体杂环,开发了一系列NIR-II染料ICRs(图10B)(https://doi.org/10.1002/adma.202210179)。这种设计不仅优化了供体-受体(D-A)体系,实现了波长扩展,还通过引入强电子供体修饰刚性的Si-黄酮骨架,增强了分子内运动的旋转和振动。这些改进促进了非辐射衰变路径,从而显著提高了光热转换效率(PCE),使其高于传统的ICG。为了体内应用,ICRs被封装到两性嵌段共聚物DSPE-PEG2000中,通过纳米沉淀法制备成纳米颗粒(NPs)。特别是ICR-Qu NPs(PCE为81.1%),展现出优异的光热性能和活性氧(ROS)生成能力,表明其作为一种潜在的双模态光疗剂的潜力。在NIR-II/光声成像引导的光动力治疗(PDT)/PTT治疗下,4T1荷瘤BALB/c小鼠接受ICR-Qu纳米颗粒治疗时,观察到了显著的肿瘤抑制效果。
Tang等人则通过精确的D/π桥工程,将苯并[c]噻吩单元引入DPTQ,合成了具有聚集诱导发光(AIE)特性的发光体DPBTA-DPTQ(PCE为40.6%,图11A)(https://doi.org/10.1002/anie.202111767)。该化合物具备扭曲的D-π构型和典型的AIE特性,使其在聚集态中由于旋转受限而发出特别明亮的荧光。此外,其扭曲主链和灵活转子的分子结构有助于部分能量转换过程转移到非辐射路径中,从而产生热量。为了提高水溶性,DPBTA-DPTQ被负载到两性肿瘤特异性共聚物DSPE-PEG2000-FA中,制备出具有NIR-II发射和显著光热行为的纳米颗粒(DPBTA-DPTQ NPs)。随后,DPBTA-DPTQ NPs被用于体内多模态成像引导治疗的评估。通过NIR-II荧光或光声成像证据表明,纳米颗粒在肿瘤中的有效积累,并且通过热成像观察到肿瘤区域温度的显著升高。这种纳米颗粒的显著特性有助于通过NIR-II成像引导的PTT抑制肿瘤生长。
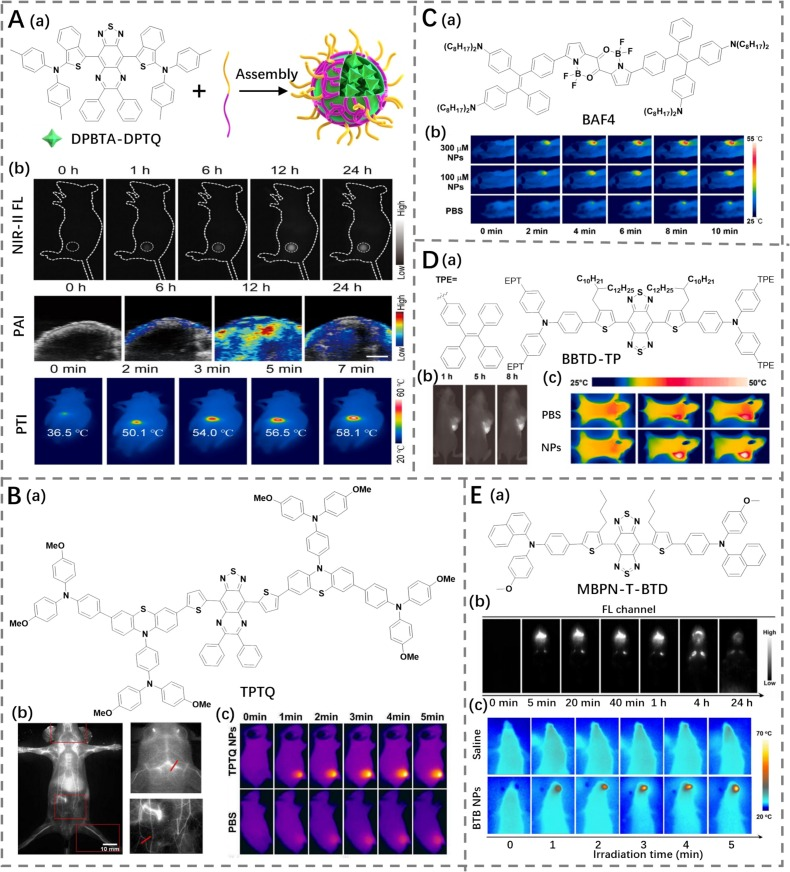
图 11. (A) a) DPBTA-DPTQ的结构以及DPBTA-DPTQ纳米颗粒的制备示意图;b) 带有DPBTA-DPTQ纳米颗粒的肿瘤的近红外二区荧光、光声和热成像。(B) a) TPTQ的结构;b) TPTQ纳米颗粒对血管的近红外二区荧光成像;c) 用PBS或TPTQ纳米颗粒处理的荷瘤小鼠的热成像。(C) a) BAF4的结构;b) 用PBS或BAF4纳米颗粒处理的荷瘤小鼠的热成像。(D) a) BBTD-TP的结构;b) BBTD-TP纳米颗粒对肿瘤的近红外二区荧光成像;c) 用PBS或BBTD-TP纳米颗粒处理的荷瘤小鼠的热成像。(E) a) MBPN-T-BTD的结构;b) BTB纳米颗粒对肿瘤的近红外二区荧光成像;c) 用PBS或BTB纳米颗粒处理的舌癌小鼠的热成像。
四苯乙烯(TPE)与三苯胺(TPA)已被广泛应用于构建聚集诱导发光(AIE)发光体。通过调节这些AIE发光体中的“分子内运动”,可以有效地平衡分子的辐射和非辐射衰变过程。Huang等人的研究中,通过将多个三苯胺转子引入到DPTQ受体上,成功创建了一种具有D-D-π-A-π-D-D结构的AIE发光体TPTQ(其光电转换效率PCE达到了73.32%,如图11B所示)(https://doi.org/10.1016/j.cej.2023.143726)。这种设计不仅显著地红移了发射波长,而且通过保持供体部分的自由旋转产生热量。TPTQ随后被制成水溶性纳米颗粒(TPTQ NPs),能够在NIR-II成像系统的辅助下清晰地标记血管和肿瘤。在激光照射下,观察到TPTQ NPs在肿瘤区域的积累导致局部温度从36.5°C上升至64.8°C,从而实现了有效的肿瘤消融。
Liu等人则通过向硼二氟化物桥联的氮杂芴二聚体骨架中添加双四苯乙烯单元,开发了一种D-A-D型染料BAF4(图11C)(https://doi.org/10.1002/anie.202107836)。这使得该化合物的吸收光谱延伸至NIR-II窗口,并且由于强烈的分子内电荷转移作用,其光电转换效率高达80%。BAF4的水合纳米粒子(BAF4 NPs)因此表现出优异的光热转换能力,并成功应用于影像引导下的肿瘤治疗。
Yin等人利用BBTD骨架上的多个分子转子修饰,构建了一种蝴蝶形NIR-II AIE发光体BBTD-TP(图11D)(https://doi.org/10.1002/anie.202107836)。该发光体显示出NIR-II荧光发射,PCE达到37.8%,并最终用于光声/荧光引导的光热疗法(PTT),展现出出色的肿瘤消融效果。
最后,Gao等人通过在BBTD骨架上引入甲氧基和萘基功能化的三苯胺作为电子供体,开发了一种整合了AIE和TICT特性的诊疗一体化剂MBPN-T-BTD(PCE为71.96%,见图11E)(https://doi.org/10.1021/acsami.3c14905)。此化合物能够实现NIR-II成像以及高效的光热治疗。特别是,MBPN-T-BTD的纳米颗粒形式(BTB NPs)在体内实验中显示出了1045 nm的NIR-II发射峰,并维持了较高的量子产率。此外,BTB NPs展现了卓越的光热性能,在成像指导手术切除及口腔癌的光热治疗方面取得了显著成效。
其他改善 PCE 的策略
根据Jablonski能级图的描述,激发态电子可以通过辐射跃迁和非辐射跃迁两种路径从最低单重激发态返回到基态,这两种衰变路径之间存在着竞争关系。研究表明,合理平衡这两种能量耗散过程是构建用于成像与光疗的多功能NIR-II染料的关键策略。通常,通过延长π共轭体系以及对端基进行修饰,可以实现NIR-II小分子染料吸收波长的红移,从而增强分子内的电荷转移(ICT)效应。依据能量间隙定律,这种结构上的调整会减小最高占据分子轨道(HOMO)与最低未占据分子轨道(LUMO)之间的能量差(Egap),促使激发态能量更多地通过非辐射路径耗散,进而加速热量的产生。
Wang团队的研究中,他们通过将两个黄酮核心通过聚甲炔链相连,合成了一种新型的NIR-II菁染料CL1(见图12A)(https://doi.org/10.1002/smll.202202078)。进一步地,用不同的亲核硫醇基团取代CL1中的氯原子,生成了最大吸收及发射波长约在1200 nm的CL2-4系列化合物(简称CLs)。这种设计极大地促进了ICT效应,缩小了HOMO-LUMO能隙值。此外,CL4/FBS复合物展示出了高达36%的光热转换效率,并在1064 nm激光照射下对癌细胞表现出显著的杀伤效果。CL4/FBS复合物巧妙地实现了辐射与非辐射衰变路径之间的平衡,成为成像与光疗应用的理想选择。
同样,Yu团队通过在IR 1048的杂环两端引入N,N-二乙氨基团,并使用邻巯基苯甲酸替代NF1中的氯原子,开发出一种新的NIR-II菁染料NF2(见图12B)(https://doi.org/10.1016/j.saa.2023.123668)。这增强了ICT效应,有助于实现更长波长的吸收与发射,同时加速了非辐射跃迁过程中能量作为光热热量的耗散。最终,通过薄膜法制备的负载NF2的两性嵌段共聚物F127纳米颗粒(NF2 NPs)展示了出色的光热转换效率(61.3%),并成功应用于肿瘤的光热治疗。这些研究不仅扩展了我们对NIR-II染料的理解,也为未来开发高效、多用途的生物医学材料提供了新思路。
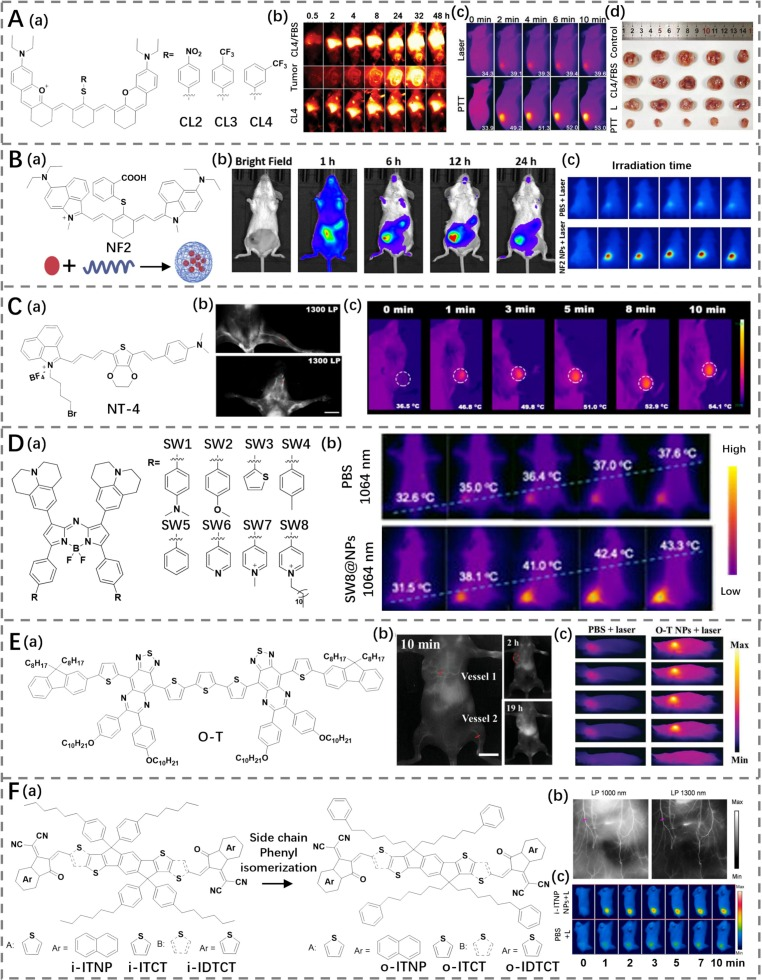
图12. (A) a) CL2–4的结构,b) 用CL4或CL4/FBS处理荷瘤小鼠的肿瘤的近红外二区荧光成像,以及用CL4/FBS处理后肿瘤的图像,c) 用PBS或PTT (CL4/FBS) 处理荷瘤小鼠的热成像,d) 治疗14天后肿瘤的图像。(B) a) NF2的结构以及NF2 NPs制备的示意图,b) 荷瘤小鼠注射NF2 NPs后的荧光成像,c) 用PBS或NF2 NPs处理荷瘤小鼠的热成像。(C) a) NT-4的结构,b) 用NT-4 NPs进行腿部血管和脑血管的近红外二区荧光成像,c) 用TPGS-NT-4处理荷瘤小鼠的热成像。(D) a) SW1–8的结构,b) 用PBS或SW8 NPs处理荷瘤小鼠的热成像。(E) a) O-T的结构,b) 使用O-T NPs进行全身血管和荷瘤小鼠的近红外二区荧光成像,c) 用PBS或O-T NPs处理荷瘤小鼠的热成像。(F) a) i/o-ITNP/ITCT/IDTCT的结构,b) 使用o-ITNP NPs进行全身血管和荷瘤小鼠的近红外二区荧光成像,c) 用PBS或o-ITNP NPs处理荷瘤小鼠的热成像。
Wang等人通过扩展π共轭体系并引入交替屏蔽单元,设计了一种NIR-II染料NT-4(图12C)(https://doi.org/10.1021/acsabm.3c00080)。这种设计不仅实现了适宜的量子产率和光热转换效率(PCE为43%),还表明屏蔽单元能够有效防止水分子干扰,从而增强亮度。此外,扩展的共轭体系缩小了能级间隙,促进了系间穿越,并增强了热量产生。利用D-α-生育酚聚乙二醇琥珀酸酯(TPGS)负载NT-4,成功实现了肿瘤血管造影及局部光热疗法(PTT)。
Huang等人的研究中,采用受体工程策略,通过改变aza-BODIPY框架的3位和5位上的不同基团作为受体,开发了一系列aza-BODIPY试剂(SW1–8,图12D)(https://doi.org/10.34133/research.0169)。这种方法显著将吸收波长红移至NIR-II区域,这得益于HOMO-LUMO能隙的减小。其中,具有更长波长的SW8被封装入纳米颗粒(SW8@NPs),显示出极高的PCE(75%),实现了成像引导的PTT,并在连续1064 nm激光照射下完全消融肿瘤。
Wang等人进一步采用了分子寡聚化和给体工程策略,通过调节能级设计出一种分子寡聚体O-T(图12E)(https://doi.org/10.1002/smll.202205640)。由Pluronic F127组装的O-T纳米颗粒展示了NIR-II发射和高PCE(73%),实现了高性能的NIR-II成像与PTT。此外,通过侧链苯基异构化诱导的空间共轭策略,设计了A-D-A型试剂(如o-ITNP,PCE为76%;ITCT/IDTCT),同时提升了光热效应和NIR-II荧光性能(图12F)。这些o-ITNP纳米颗粒在NIR-II成像引导的肿瘤PTT中展现了卓越性能。
Tang等人采用氟化策略构建了一种A-D-A型染料FY6,具有NIR-II发射特性(图13A)(https://doi.org/10.1002/adma.202208229)。氟化策略显著提高了摩尔消光系数(ε)和PCE(80%),这是由于增加了分子内和分子间的相互作用,导致紧密的分子堆积。FY6分子自组装形成FY6-NPs,其量子产率和ε值的提高使得FY6-NPs展现出明亮的荧光。相较于商业染料ICG,FY6-NPs展示了更优越的光热稳定性和性能,能够在肿瘤部位富集后通过激光照射实现有效的肿瘤消融。
Tian等人则采用溴代策略对A-D-A型染料进行卤化,设计了NIR-II试剂BTIC-4Br(图13B)(https://doi.org/10.1002/chem.202303502)。卤化策略通过调节能级和增强分子堆积,有效地提高了分子的ε值并改善了PCE(81.7%),显示出了显著的NIR-II荧光引导的PTT潜力。
Yang等人通过调节分子间氢键来控制分子组装,开发了一种基于NIR-II方酸菁骨架的染料SCy1(图13C),实现了PCE的提升(74%)(https://doi.org/10.1016/j.cclet.2023.108599)。该化合物在NIR-II成像引导的癌症PTT中表现出显著疗效,进一步展示了这类材料在生物医学应用中的巨大潜力。
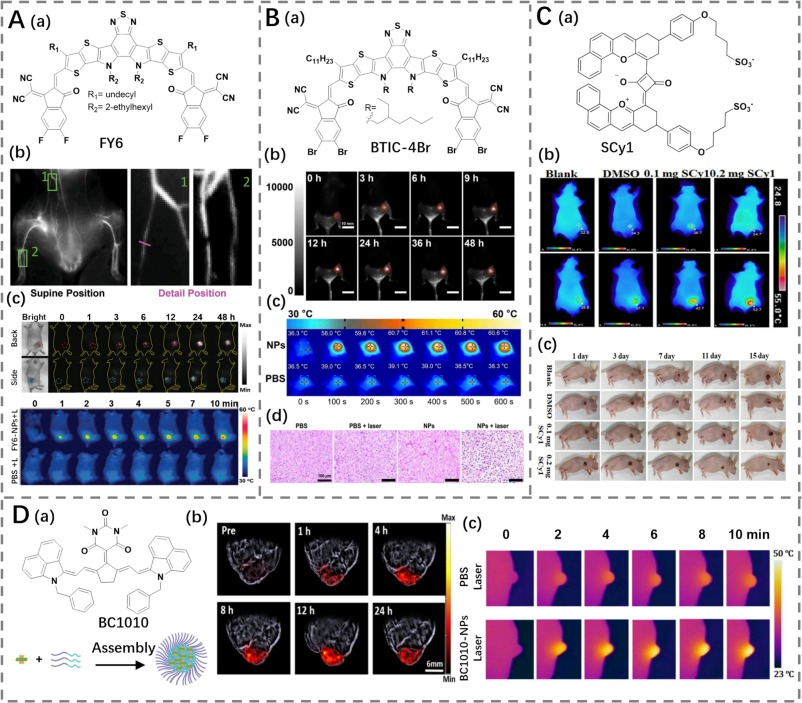
图 13. (A) a) FY6 的结构;b) FY6-NPs 小鼠血管的近红外二区荧光成像;c) 注射 PBS 或 FY6-NPs 的荷瘤小鼠的近红外二区荧光和热成像。(B) a) BTIC-4Br 的结构;b) 注射 BTIC-4Br NPs 的荷瘤小鼠的荧光成像;c-d) 注射 PBS/BTIC-4Br NPs 的荷瘤小鼠的光热成像 (PTI) 和 HE 染色图像。(C) a) SCy1 的结构;b) 注射 DMSO 或 SCy1 的荷瘤小鼠的热成像;c) 治疗过程中荷瘤小鼠的图像。(D) a) BC1010 的结构以及 BC1010-NPs 的制备示意图;b) 静脉注射 BC1010-NPs 后荷瘤小鼠的光声成像 (PA);c) 注射 PBS 或 BC1010-NPs 的荷瘤小鼠的热成像。
研究表明,促进非辐射衰变过程有助于热量的产生,这对于光热治疗(PTT)至关重要。然而,非辐射衰变过程中产生的活性氧(ROS),如单线态氧(^1O2),不仅与产热过程竞争能量,还可能引发氧化反应,影响染料的稳定性,并最终降低PTT的疗效。因此,采用措施来猝灭三重态,从而减少ROS的生成,有望增强热量的产生并提高PTT的效果。
Ntziachristos等人的研究中,在菁染料结构的_meso_-位引入强电子吸引基团——巴比妥酸,成功合成了巴比妥酸菁染料BC1010(PCE为38.5%,见图13D)(https://doi.org/10.1016/j.jconrel.2024.06.037)。这种设计促进了电子转移,尽管导致荧光减弱,但却显著提升了光稳定性。BC1010通过与PEG114-b-PCL60结合形成纳米颗粒(BC1010-NPs),显示出卓越的光稳定性和高效的产热能力,同时几乎不产生单线态氧。在体内抗肿瘤应用中,使用BC1010-NPs并在1064 nm激光照射下,能够在肿瘤部位产生显著的热量,实现有效的肿瘤消融。
这种策略巧妙地平衡了光热转换效率与避免ROS生成之间的关系,确保了治疗的有效性与安全性。BC1010-NPs的应用不仅证明了通过化学修饰控制染料的电子性质能够优化其光物理性能,也为开发高效、低副作用的PTT剂提供了新的思路。这种方法对于未来设计和合成具有高光热转换效率且生物相容性良好的材料具有重要意义。
增强 PTA 的特异性以改善 PTT
已报道的近红外二区(NIR-II)有机分子光热剂(PTAs)在癌症成像引导的光热治疗(PTT)中展现出显著优势。然而,在PTT过程中,由于光热剂在高强度照射下在肿瘤部位的富集不足,容易导致周围正常组织受到严重损伤。因此,迫切需要采取措施以减轻这些不良影响,并通过提高光热剂在癌症治疗中的特异性来增强其对肿瘤的抑制效果。迄今为止,大多数光热剂通过纳米组装后的增强渗透与滞留(EPR)效应,已在肿瘤部位显示出被动富集的能力,从而提升了其特异性。然而,纳米剂的有限富集导致PTT效率较低。为此,研究者们已设计出多种额外策略,以进一步提高光热剂对肿瘤的特异性,其中包括开发靶向配体/基团修饰的光热剂和可激活的光热剂。
优化靶标配体/基团以提高特异性
特异性靶向光热剂(PTAs)通常通过修饰靶向配体或基团来实现其靶向性。这些配体或基团能够特异性结合癌细胞表面过表达的受体(图14A),从而有效区分肿瘤组织与正常组织。例如,Chen等人利用牛血清白蛋白(BSA)包裹不溶于水的克唑替尼-IR808,开发了一种Crizotinib-IR808@BSA纳米颗粒(光热转换效率为36.9%,图14B)(https://doi.org/10.1021/acsami.3c05926)。与ICG相比,这种纳米颗粒展现出更优异的光热性能。当注射到CT26荷瘤小鼠体内时,Crizotinib-IR808@BSA能够通过克唑替尼与c-Met之间的相互作用在肿瘤部位富集,并且随着时间的推移,荧光亮度逐渐增强。在持续暴露于808 nm激光照射下,结合近红外二区(NIR-II)成像和光热治疗,肿瘤得到了有效消除。
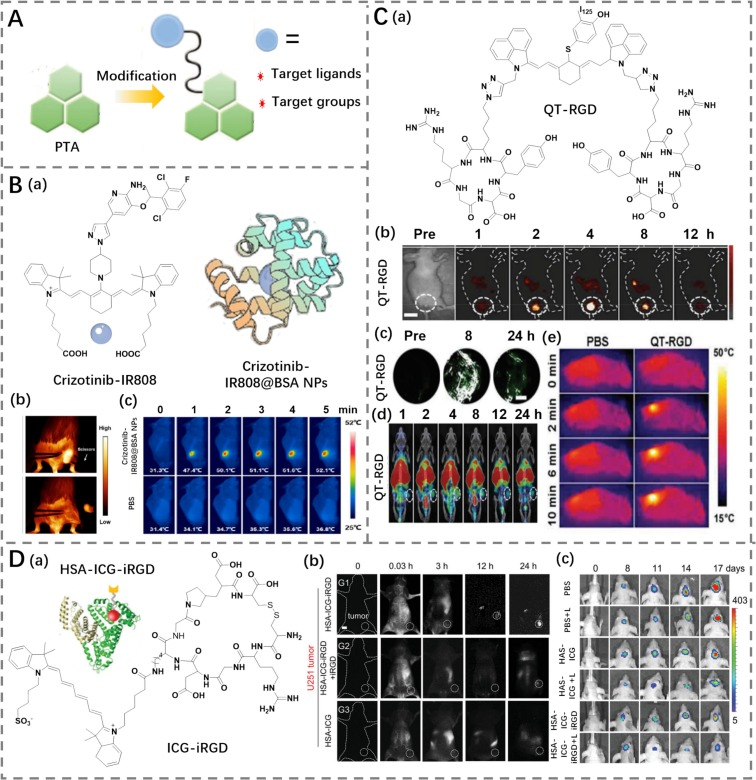
图14. (A) 修饰靶向配体和基团的示意图。(B) a) 克唑替尼-IR808的结构以及克唑替尼-IR808@BSA的示意图; b) 采用克唑替尼-IR808@BSA进行肿瘤手术的荧光成像; c) 用PBS或克唑替尼-IR808@BSA处理的荷瘤小鼠的热成像。(C) a) QT-RGD的结构; b) 不同时间点携带QT-RGD的荷瘤小鼠的荧光成像; c) 不同时间点携带QT-RGD的荷瘤小鼠的PA成像; d) 不同时间点携带QT-RGD的荷瘤小鼠的SPECT成像; e) 用PBS或QT-RGD处理的荷瘤小鼠的热成像。(D) a) ICG-iRGD的结构以及HSA-ICG-iRGD的示意图; b) 静脉注射HSA-ICG-iRGD后,U251荷瘤小鼠的荧光成像; c) 使用或不使用激光处理的PBS、HAS-ICG或HSA-ICG-iRGD处理的U251荷瘤小鼠的热成像。
整合素αvβ3作为纤维粘连蛋白的受体,在肿瘤的进展和转移过程中扮演着关键角色。环状精氨酸-甘氨酸-天冬氨酸(cRGD)肽因其能够特异性结合整合素αvβ3,被广泛用作靶向配体。基于此,Shi等人通过用两个cRGD肽修饰标记的近红外二区(NIR-II)菁染料,成功合成了具有强NIR-II发射和高光热转换效率(PCE为36.5%)的QT-RGD试剂(图14C)(https://doi.org/10.1039/C9NR10720G)。QT-RGD能够通过αvβ3整合素介导的内吞作用高效富集在肿瘤部位,并在808 nm激光照射10分钟后迅速升温。通过解决特异性靶向问题,QT-RGD显著提升了NIR-II/光声(PA)/单光子发射计算机断层扫描(SPECT)成像引导下的光热治疗(PTT)的抗肿瘤效果。
类似地,Sheng等人通过分子对接方法构建了由iRGD肽修饰的吲哚菁绿(ICG)(ICG-iRGD)和人血清白蛋白(HSA)组成的HSA-ICG-iRGD复合物(图14D)(https://doi.org/10.1002/adhm.202202379)。该复合物能够通过iRGD肽特异性靶向表达αvβ3受体的肿瘤细胞,为肿瘤的成像和治疗提供了一种有前景的策略。相比之下,未经过iRGD肽修饰的HAS-ICG的治疗效果相对较弱。进入肿瘤组织后,HSA-ICG-iRGD在808 nm激光照射下显示出快速升温的特性,并能有效诱导肿瘤细胞凋亡。
线粒体作为细胞能量产生的核心细胞器,对细胞的生存(包括癌细胞)至关重要。因此,研究人员开发了多种靶向线粒体的NIR-II光热剂,用于癌症的检测和治疗,这些光热剂通常通过线粒体膜电位驱动靶向。Yang团队通过修饰三苯基膦聚乙二醇化(PEG2000-TPP),设计了一种基于苯并双噻二唑(BBTD)的染料FEPT(图15A)(https://doi.org/10.1186/s12951-022-01679-0)。FEPT展现出明亮的NIR-II荧光(超过1000 nm)和卓越的光热转换效率(PCE为56.8%),满足了体内成像追踪和光热治疗的需求。最终,FEPT成功实现了线粒体驱动的肿瘤靶向NIR-II荧光成像、光热、光动力和免疫协同治疗。
与三苯基膦聚乙二醇化修饰策略不同,Yang等人采用谷胱甘肽响应型两性嵌段共聚物DSPE-SS-PEG-COOH封装了三苯基膦修饰的NIR-II染料IR-FE-TPP(PCE为43.9%),构建了FE-T纳米颗粒(图15B)(https://doi.org/10.1002/smll.202207995)。由于所得纳米颗粒具有卓越的光学性能、光动力治疗(PDT)和光热治疗性能,该策略在癌症治疗中展现出巨大的潜力。
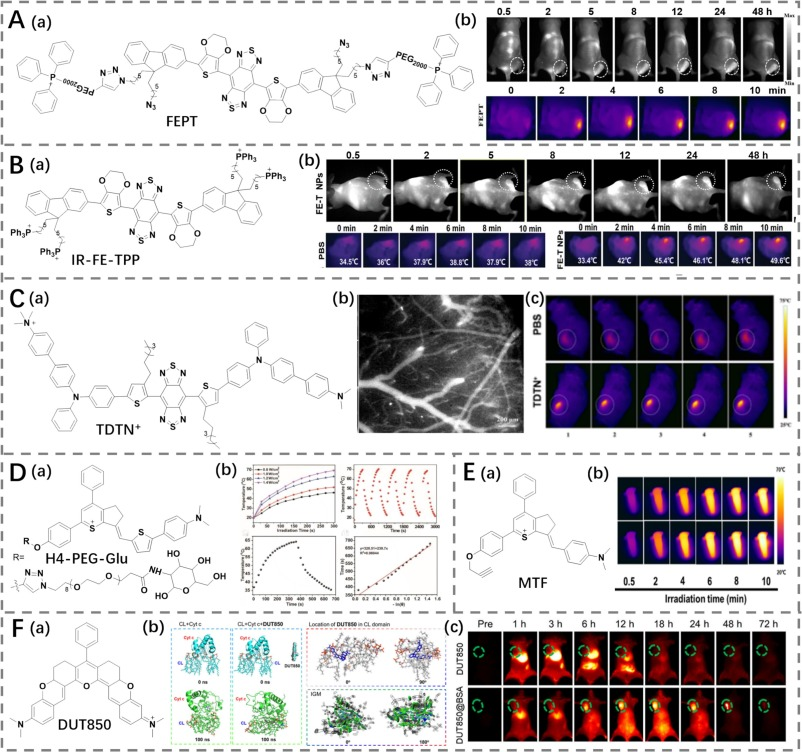
图 15. (A) a) FEPT 的结构,b) 注射 FEPT 后荷瘤小鼠的荧光和热成像。(B) a) IR-FE-TPP 的结构,b) 注射 FE-T NPs 后不同时间点荷瘤小鼠的荧光和热成像。(C) a) TDTN+ 的结构,b) 注射 TDTN+ NPs 后小鼠血管的荧光成像,c) 注射 PBS、TDTN+ NPs 后 4T1 荷瘤小鼠的热成像。(D) a) H4-PEG-Glu 的结构,b) H4-PEG-Glu 的体外光热性能。(E) a) MTF 的结构,b) MTF 在 DMF 溶液中的光热性能。(F) a) DUT850 的结构,b) DUT850-CL 相互作用的分子动力学模拟,c) 注射 DUT850@BSA NPs 和 DUT850 后荷瘤小鼠的荧光成像。
Tang团队设计了一种带有阳离子三甲基铵单元的聚集诱导发光(AIE)型染料,并开发了近红外二区(NIR-II)光热治疗剂TDTN+(图15C)(https://doi.org/10.1039/D2TB02295H)。由于引入的烷基链破坏了苯并双噻二唑(BBTD)和三苯胺单元之间的π-π相互作用,该物质在NIR-II区域表现出明亮的发光特性。此外,自组装成纳米颗粒后,TDTN+展现出高达66.7%的光热转换效率(PCE)。其阳离子化特性通过线粒体负电位与TDTN+正电荷之间的静电吸引,赋予了其靶向线粒体的能力。给予TDTN+后,在808 nm激光照射下,肿瘤区域温度显著升高,并伴随肿瘤增殖的明显抑制。Hong等人也报道了利用静电吸引驱动线粒体靶向作用,进行肿瘤成像和光热治疗的NIR-II硫吡喃类荧光团H4-PEG2K和H4-PEG-Glu(PCE为11.6%)(图15D)(https://doi.org/10.1039/D0SC04727A)。Kim等人合成了基于硫吡喃的线粒体靶向染料MTF(PCE为39%)(图15E)(https://doi.org/10.1039/D3CC02380J),展示了卓越的光动力和光热效应。
心磷脂作为线粒体内膜的标志性磷脂,是开发高特异性光疗剂用于癌症成像和治疗的理想靶标。Xiao及其同事构建了一个刚性和带正电荷的V形共轭骨架DUT850(图15F),该骨架表现出优异的NIR-II荧光、高单线态氧量子产率和光热转换效率(PCE为60%)(https://doi.org/10.1021/jacs.2c08602)。DUT850能够特异性结合心磷脂结构域以靶向线粒体,并随后激活凋亡途径,从而增强肿瘤抑制效果。得益于这一特性,利用牛血清白蛋白(BSA)封装的纳米粒子DUT850@BSA,实现了在NIR-II成像引导下的协同光热-化疗-光动力疗法,有效实现了肿瘤消融而无转移。
多形性胶质母细胞瘤(GBM)是一种特别侵袭性的脑肿瘤,大多数光疗剂在GBM肿瘤成像和治疗方面仍面临挑战,因为它们难以靶向大脑。2021年,Tang等人报告了一种新型聚集诱导发光(AIE)荧光素pH(PCE为34%)(图16A)(https://doi.org/10.1002/adma.202106082)。他们采用分子工程策略,使单体自组装形成Ph NPs,该纳米颗粒在1575 nm处显示出NIR-II发射和强烈的光热治疗(PTT)效应。然后,通过纳米粒子表面功能化方法,使用脑靶向载脂蛋白E肽(ApoE)修饰NPs,旨在促进其穿越血脑屏障以靶向GBM肿瘤。后续体内成像结果显示,ApoE-Ph NPs被肿瘤细胞高度选择性地摄取,并在6小时后达到肿瘤部位的最大积累量。在NIR-II成像引导下进一步实施体内PTT,激光照射后肿瘤区域温度显著上升,肿瘤通过PTT得到有效抑制。Gong等人报道了成功利用智能树突状细胞包覆纳米粒子(DC@BPBBT点)(PCE为30.5%),进行NIR-II成像引导的光热免疫治疗(图16B)。Miao等人设计了一种基于NIR-II LT骨架的I型光敏剂LTPA(PCE为43.5%)(图16C),连接亲水性聚乙二醇(PEG)并与脑肿瘤靶向肽angiopin-2偶联,实现了GBM的成像及联合PTT和光动力治疗(PDT)(https://doi.org/10.1002/adfm.202206346)。Zhang等人基于BODIPY骨架,通过战略性的吸电子基团取代,设计了一系列化合物(https://doi.org/10.1002/agt2.680)。其中,优化后的化合物5,具有NIR-II荧光发射和高光热转换效率(PCE为49.7%),自组装形成负载叶酸的纳米颗粒(图16D)。这些纳米颗粒能够通过内源性受体介导的胞吞过程,特异性地针对胶质母细胞瘤进行治疗。在激光照射后,5@FAP-NP能够在NIR-II荧光成像(FI)/光声成像(PAI)引导的光疗中,成功抑制胶质母细胞瘤的增长。
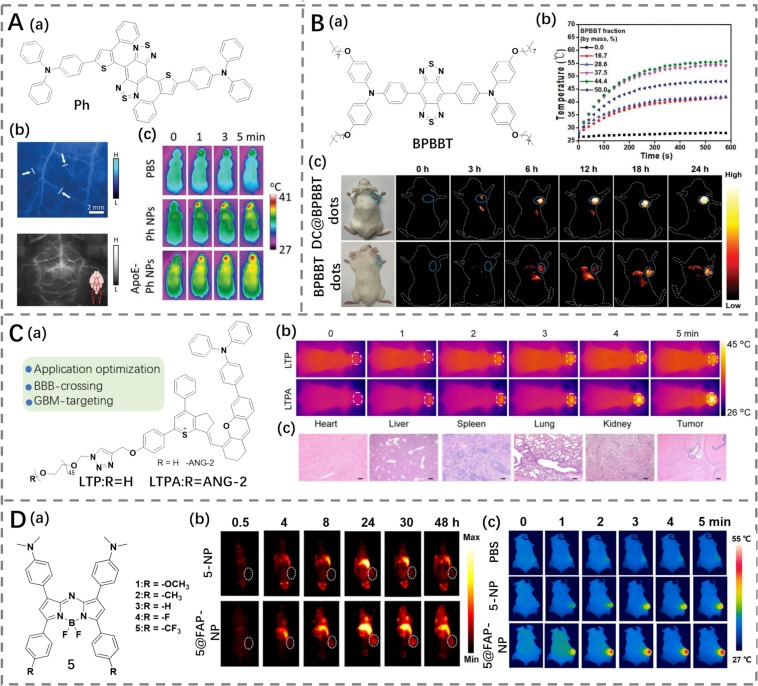
图 16. (A) a) Ph 的结构,b) 小鼠血管经 Ph 纳米颗粒处理后的荧光成像,c) 荷瘤小鼠经 PBS、Ph 纳米颗粒处理后的热成像。(B) a) BPBBT 的结构,b) BPBBT 纳米点在不同照射时间下的光热性质,c) 荷瘤小鼠经 BPBBT 纳米点或 DC@BPBBT 纳米点处理后的荧光成像。(C) a) LTP 和 LTPA 的结构,b) 4T1 荷瘤小鼠经 LTP、LTPA 处理后的热成像,c) 小鼠经 LTPA 处理后主要器官和肿瘤的 HE 染色图像。(D) a) 1–5 的结构,b) 荷瘤小鼠经 5@FAP 纳米颗粒和 5-FAP 处理后的荧光成像,c) 荷瘤小鼠经 PBS、5@FAP 纳米颗粒和 5-FAP 处理后的热成像。
构建激活型PTA以提高特异性
与靶向配体/基团修饰策略不同,“开启”型光热剂(PTAs)通过内源性生物标志物或肿瘤微环境的刺激被激活,从而启动光热治疗(PTT)并随后破坏肿瘤细胞(图17A)。这些PTA能够通过区分正常组织和癌组织之间的显著差异,减少PTT的副作用。通常,癌细胞快速消耗氧气,为其快速增殖和代谢提供能量,这加剧了缺氧状况。因此,缺氧是实体瘤的一个常见特征。
Cai团队开发了一种硝基还原酶(NTR)酶响应探针IR1048-MZ(PCE为20.2%),通过将IR-1048染料中的氯原子替换为硝基咪唑基团(图17B)(https://doi.org/10.7150/thno.26607)。与之前报道的近红外二区(NIR-II)PTA相比,在静脉注射IR1048-MZ 10小时后,仅在肿瘤部位可检测到明亮的NIR-II荧光/光声(PA)信号。使用980 nm激光照射期间,肿瘤部位的温度在2分钟内从约30°C迅速升高至约57°C。结果表明,IR1048-MZ可能是用于NIR-II/PA成像和缺氧激活PTT的一种有前途的工具。
Yan等人利用聚乙二醇连接了一个二硫键修饰的花菁类荧光素MPSS(图17C),该物质可以通过亲水-疏水自组装进一步形成MPSS-NPs胶束(https://doi.org/10.1016/j.jcis.2022.06.134)。MPSS-NPs(PCE为50.53%)可以在进入肿瘤后,对肿瘤微环境中的谷胱甘肽(GSH)作出反应,通过破坏二硫键降解,然后唤醒由于聚集淬灭(ACQ)效应导致的“休眠”状态的MPSS,产生NIR-II发射和PTT,用于NIR-II成像引导的PTT。这种机制不仅提高了治疗的选择性和效果,还减少了可能的副作用,展示了其在癌症治疗中的潜在应用价值。
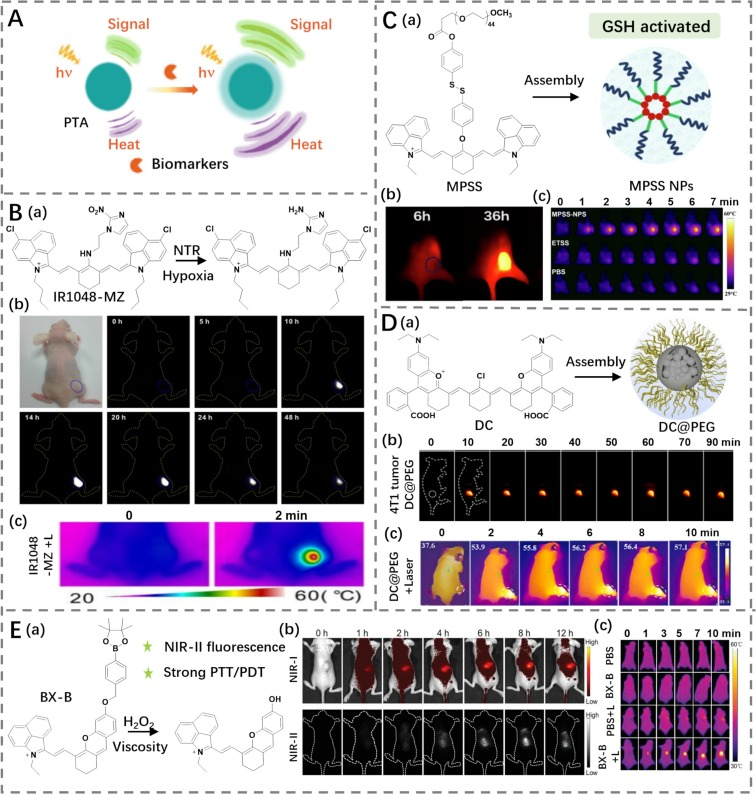
图17.(A)激活PTA用于成像和光热疗的示意图。(B)a)IR1048-MZ的结构及其响应机制;b)IR1048-MZ肿瘤部位实时荧光成像;c)IR1048-MZ处理的荷瘤小鼠热成像。(C)a)MPSS的结构和MPSS NPs的示意图;b)不同时间点MPSS NPs荷瘤小鼠荧光成像;c)PBS、ETSS或MPSS NPs处理的荷瘤小鼠热成像。(D)a)DC的结构和DC@PEG的示意图;b)不同时间静脉注射DC@PEG后4T1荷瘤小鼠荧光成像;c)激光照射下DC@PEG处理的荷瘤小鼠热成像。(E)a)BX-B的结构及其响应机制;b)不同时间点BX-B荷瘤小鼠的近红外I/近红外II荧光成像;c)有或没有激光照射的PBS或BX-B处理的荷瘤小鼠热成像。
除了缺氧和谷胱甘肽(GSH),其他肿瘤微环境因素(包括极性、氧化应激、粘度和pH值等)也与癌症的发展密切相关。Lin团队构建了一种对极性敏感的近红外二区(NIR-II)光疗纳米剂DC@PEG(光热转换效率为48.1%),其能够在极性逐渐增加的情况下激活NIR-II发射(https://doi.org/10.1016/j.snb.2023.135089)。当暴露于808 nm激光下时,DC@PEG表现出显著的光热特性(图17D)。给予DC@PEG后,肿瘤部位显示出明显的NIR-II荧光发射和光热效率激活。在连续使用DC@PEG和808 nm激光治疗后,肿瘤大小逐渐缩小,最终几乎完全消失。
为了进一步提高特异性,研究人员基于BX-OH荧光素合成了一种过氧化氢(H2O2)响应型双键激活探针BX-B(图17E)(https://doi.org/10.1002/adhm.202301230)。由于肿瘤组织相较于正常组织具有更高浓度的H2O2和更高的粘度,BX-B的NIR-II荧光和光热/光动力(PTT/PDT)协同治疗可以精确地在肿瘤部位激活。将BX-B瘤内注射到荷瘤小鼠体内后,在肿瘤部位观察到了明亮的NIR-II荧光。随后,将肿瘤部位暴露于808 nm激光下,导致温度从35.6°C显著上升至56.7°C。最终,延长治疗时间大大抑制了肿瘤生长并几乎完全消融了肿瘤。
2023年,一种基于NSCy-1050(光热转换效率为17.4%)荧光素的pH/粘度响应型双键激活光热剂被合成(图18A)(https://doi.org/10.1002/anie.202309768)。由于肿瘤的微环境差异(相比正常组织具有更高的粘度和更低的pH值),该物质在肿瘤部位的NIR-II荧光和高光热效应能够逐渐被激活。NSCy-1050凭借其对pH和粘度的敏感性,能够在肿瘤中有效激活,并通过NIR-II荧光成像引导的光热治疗(PTT)实现抗癌治疗。同样,基于LET-1052(光热转换效率为57.2%)框架报道了一种自我检查可激活剂(图18B),该试剂也被成功应用于NIR-II成像介导的疗法,比单激活PTAs具有更高的特异性。
Stȩpień及其同事开发了一系列萘酰亚胺融合的双吡咯类化合物(2e),这些化合物能够通过酸响应开关调节电子构象,从而产生NIR-II发射和光热效应,用于实现成像和PTT(图18C)(https://doi.org/10.1002/advs.202105886)。这一系列创新不仅提高了癌症治疗的选择性和效果,还展示了利用肿瘤微环境特征进行精准治疗的巨大潜力。
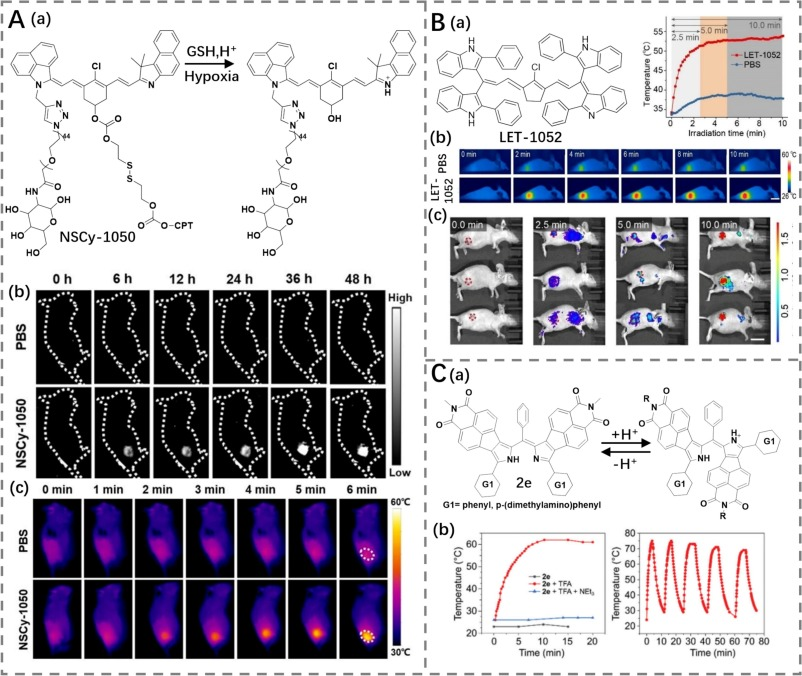
图 18.(A)a) NSCy-1050 的结构及响应机制,b) NSCy-1050 肿瘤部位实时荧光成像,c) NSCy-1050 治疗荷瘤小鼠的热成像。(B) a) LET-1052 的结构,b) PBS、LET-1052 治疗荷瘤小鼠的热成像,c) 不同时间点 LET-1052 荷瘤小鼠的荧光成像。(C) a) 2e 的结构及响应机制,b) 2e 的体外光热性能。
增强 PTA 的生物相容性以改善 PTT
NIR-II有机小分子光热剂(PTAs)因其卓越的光学性能和高光热效应,在NIR-II成像引导的PTT领域受到了研究人员的广泛关注。然而,当前大多数设计NIR-II有机小荧光素或PTAs的方法主要是通过延长共轭链或引入刚性平面端基来实现有效的NIR-II波长。不幸的是,由于这些化合物通常具有庞大的疏水基团或大的共轭骨架,导致它们在水中不溶解或者其生理代谢途径未知,从而引发潜在的长期毒性问题,生物相容性较差。
为了增强这类化合物的水溶性或调节其分子结构以提高生物相容性,减少暗毒性和改善药代动力学是非常有利的。因此,理想的NIR-II有机小分子PTA应当具备足够的亮度、高的光转化效率(PCE)、优异的光稳定性以及在生物系统中的良好生物相容性。
目前,有几种常见的策略可以用来改善NIR-II PTAs的水溶性或调整其生理代谢:
亲水单元修饰:通过引入亲水基团如聚乙二醇(PEG)或其他亲水性侧链,可以显著增加分子的水溶性,同时减少聚集引起的淬灭效应(ACQ),提高生物利用度。
使用两亲性/亲水性基质包封:将PTAs封装于两亲性或亲水性的纳米载体中,例如聚合物胶束、脂质体或蛋白质纳米颗粒等,不仅可以提高其水溶性,还能保护药物免受体内环境的影响,并实现靶向递送。
调节分子大小:适当调整分子大小有助于平衡药物的循环时间和肿瘤穿透能力。较小的分子可能更容易穿透组织,但较大的分子则可能提供更高的载药量和更长的血液循环时间。
探索主客体化学策略:利用环糊精、杯芳烃等主体分子与PTAs形成包合物,可以有效提高后者的水溶性及稳定性,同时可能调控其释放行为。
这些策略不仅有助于克服NIR-II有机小分子PTAs在实际应用中的主要障碍,也为开发更加安全有效的癌症治疗方案提供了新的思路。通过结合上述方法,研究人员能够设计出既保持高效光热转换性能又具有良好生物相容性的新型NIR-II PTA材料。
引入亲水装置以提高生物相容性
吲哚菁绿(ICG)是一种被美国食品药品监督管理局(FDA)批准用于临床的荧光素,因其出色的生物相容性而被广泛应用于成像领域。ICG具有一个带有多个磺酸盐基团的七甲川骨架,这确保了其水溶性,从而能够快速从体内清除,并具有高度的生物相容性。
基于ICG的结构特点,研究人员开发了一种新型光热剂(PTA)——IR820(光热转换效率为32.74%),通过在ICG框架基础上进一步延长共轭链构建而成(图19B)(https://doi.org/10.7150/thno.31332)。这种荧光素在水中显示出明亮的近红外二区(NIR-II)荧光。利用实时NIR-II成像技术揭示IR820在体内的动力学行为,结果显示,在注射IR820后48小时,小鼠肾脏、肝脏和肠道中的荧光信号存在明显差异。这些结果表明,IR820可以通过肝肾代谢途径排出体外,显示了其改进的生物相容性。
在进一步的实验中,将IR820注射到肿瘤部位后,在48小时内观察到了最大荧光信号。使用激光照射600秒后,肿瘤温度迅速升高至55.4°C。经过15天的体内光热治疗,肿瘤完全被抑制且没有复发迹象,并且在荷瘤小鼠中未观察到明显的副作用。由于其改进的水溶性,这种具有良好生物相容性的IR820在成像引导的癌症诊断和治疗方面展现出巨大的潜力。
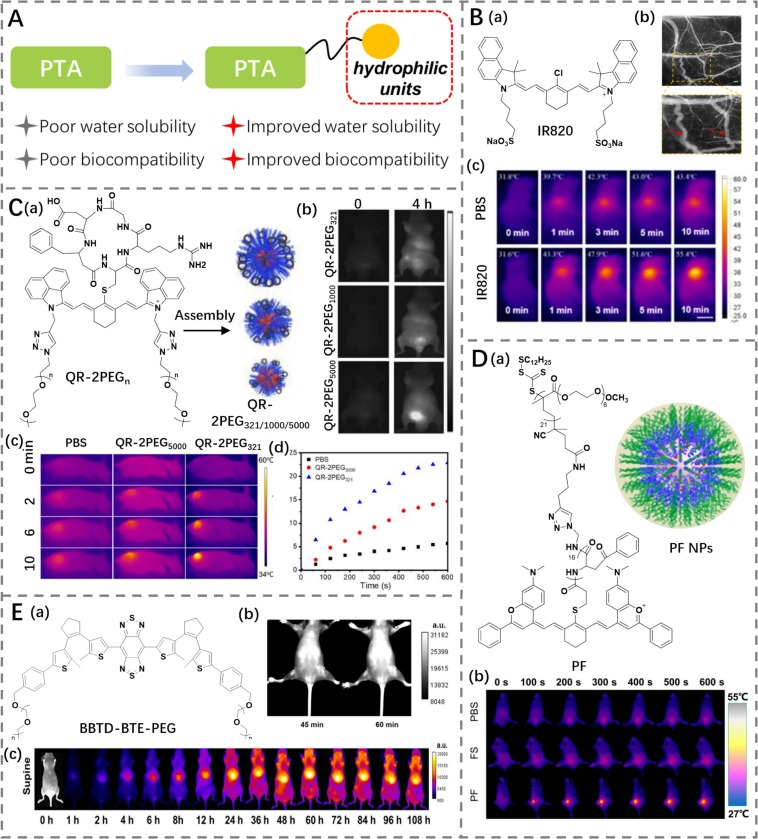
图 19. (A) 亲水性单元修饰示意图。(B) a) IR820 的结构式;b) IR820 小鼠脑血管荧光成像;c) PBS 和 IR820 治疗荷瘤小鼠的热成像。(C) a) QR-2PEGn 的结构式以及 QR-2PEG321/1000/5000 纳米颗粒示意图;b) QR-2PEG321/1000/5000 纳米颗粒治疗荷瘤小鼠不同时间点的荧光成像;c-d) PBS、QR-2PEG321 或 QR-2PEG5000 治疗荷瘤小鼠的热成像及相应温度变化。(D) a) PF 的结构式以及 PF 纳米颗粒示意图;b) 激光照射下,PBS/FS/PF 治疗荷瘤小鼠的热成像。(E) a) BBTD-BTE-PEG 的结构式;b) BBTD-BTE-PEG 治疗 H22 荷瘤小鼠不同时间点的荧光成像;c) 激光照射下,BBTD-BTE-PEG 治疗 H22 荷瘤小鼠的热成像。
Shi的研究小组报道了一系列基于近红外二区(NIR-II)七甲川菁荧光染料(Q3)的光热剂(PTA),这些光热剂通过用环状cRGD肽替代氯原子,并使用不同长度的聚乙二醇(PEG)链进行修饰(QR-2PEG321、QR-2PEG1000、QR-2PEG5000)(https://doi.org/10.1016/j.cclet.2022.03.023)。首先,MTT实验验证了QR-2PEGs具有优异的生物相容性,随后通过血液生化分析和红细胞溶血试验证实了这一点。研究结果支持了不同的PEG链可以通过调节水溶性来增强生物相容性的假设。在水溶液中,与QR-2PEG321(光热转换效率为43.8%)和QR-2PEG1000相比,QR-2PEG5000在1045 nm处显示出最强的吸收强度,在1065 nm处显示NIR-II发射强度最高。这表明较长的PEG链有助于提高水溶性和减少聚集。此外,光热实验确定QR-2PEGs在808 nm激光照射下的光热转换效率约为40%。将QR-2PEG321和QR-2PEG5000静脉注射到MGC-803肿瘤小鼠体内后,它们能够在注射后6小时有效积累于肿瘤部位。最后,当暴露于激光下时成功消融了肿瘤,并对胃腺癌的光热治疗表现出巨大潜力。
另一方面,多肽/PEG聚合物作为一种生物相容且可生物降解的聚合物,因其作为有前途的生物材料而受到科学家的关注。Yan的研究小组通过将NIR-II花菁染料Flav7与两亲性多肽结合形成纳米粒子(PF NPs),合成了一种聚合荧光剂(PF)(https://doi.org/10.1021/acsnano.9b00452)。PF依靠多肽获得了良好的生物相容性和靶向能力,使得Flav7在生物应用方面展现出越来越大的前景。此外,PF NPs被证明具有高达42.3%的光热转换效率以及出色的光热稳定性。这些NPs能够有效地吸收光能并将其转化为热能,同时有一部分能量以NIR-II辐射的形式释放出来。受体外观察到的优异光热效应的鼓舞,FP NPs在静脉给药16小时后可以在肿瘤部位积聚,并表现出优异的肿瘤消融效率。
Jiang等人采用电子供体改性策略,引入了一个独特的双噻吩基乙烯光致变色单元,构建了一个NIR-II荧光染料BBTD-BET,它展示了有利的光热和光学特性(https://doi.org/10.1021/acsami.1c17813)。为了便于其在生物医学中的应用,该荧光染料进一步通过添加PEG链进行了修饰,使其成为两亲性的,从而诱导BBTD-BET-PEG(光热转换效率为39.42%)自组装形成胶束。BBTD-BET-PEG胶束能够在水溶液中分散,并在1094 nm处显示出明显的发射峰。基于其优越的性能,BBTD-BET-PEG用于成像血管和追踪肿瘤位置,产生了高分辨率图像。此外,它能够迅速被循环系统清除。在光声(PA)/NIR-II荧光成像系统的引导下,BBTD-BET-PEG在其累积于肿瘤区域后应用于肿瘤的光热治疗(PTT)。研究表明,激光照射导致肿瘤部位温度升高,进而显著抑制了肿瘤生长,持续时间为14天。
提高生物相容性的两亲性基质包埋策略
两亲性/亲水性基质封装策略是另一种调节水溶性的方法,这种方法有可能改善生物相容性和降解性(图20A)。Zhang等人采用薄膜水合法制备了由DPPC/Chol/DSPE-PEG2000组成的IR780脂质体(图20B)(https://doi.org/10.1016/j.jmst.2022.05.027)。与游离的IR780相比,在水溶液中制备的IR780脂质体显示出强烈的吸收峰。在808 nm激光照射下,IR780脂质体表现出优异的光热效应,表明它们具有通过光热治疗(PTT)抑制肿瘤的潜力。由于生物相容性是光热剂(PTAs)的重要关注点,研究人员进行了血液生物标志物分析和苏木精-伊红(H&E)染色实验,以验证IR780脂质体未显示明显的全身毒性,并可用于图像引导的手术导航/PTT联合治疗。
Shi和他的同事使用两亲性的mPEG5000-PCL3000聚合物构建了一个智能纳米探针ZM1068-NPs,用于封装一种疏水性的近红外二区(NIR-II)花菁荧光染料ZM1068(光热转换效率为59.9%)(图20C)(https://doi.org/10.1021/acsami.0c22555)。ZM1068-NPs展示了良好的水分散性、稳定性和高荧光亮度。此外,它们对细胞表现出可忽略的细胞毒性,并且比临床上使用的吲哚菁绿(ICG)具有更高的光热转换效率。而且,ZM1068-NPs能够在静脉注射后通过共价交联与细胞内的大分子进行取代反应,从而有效地积聚于肿瘤内部。体内光热实验展示了ZM1068-NPs的卓越效果,这些纳米粒被应用于成像介导的肿瘤手术和PTT。这一系列研究不仅为提升治疗剂的生物相容性和疗效提供了新的思路,也为开发新型多功能纳米材料在癌症诊疗中的应用开辟了新路径。
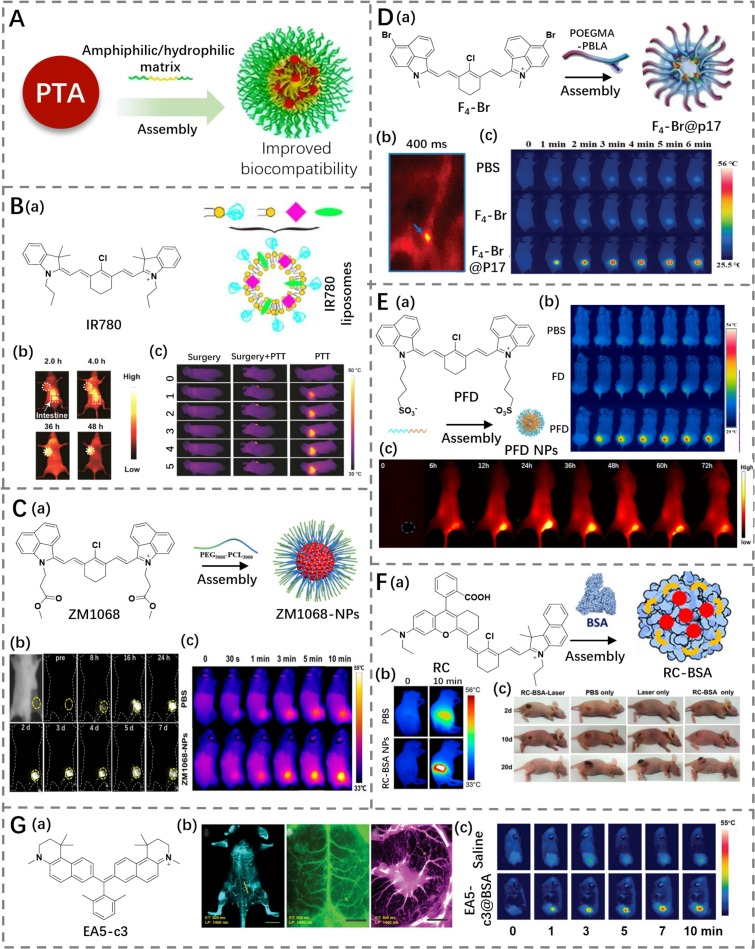
图 20. (A) 两亲性基质包封策略示意图。(B) a) IR780 的结构及用 DSPE-PEG 和 DPPC 包封 IR780 的示意图;b) 负载 IR780 脂质体肿瘤小鼠的代表性荧光成像;c) 不同处理组肿瘤小鼠的热成像。(C) a) ZM1068 的结构及用 PEG5000-PCL3000 包封 ZM1068 的示意图;b) 不同时间点 ZM1068-NPs 肿瘤小鼠的荧光成像;c) PBS、ZM1068-NPs 处理组肿瘤小鼠的热成像。(D) a) F4!单键Br 的结构及用 POEGMA-PBLA 包封 F4!单键Br 的示意图;b) F4-Br@P17 处理组颅骨血管的代表性荧光成像;c) 激光照射下,PBS、F4!单键Br 和 F4-Br@P17 处理组肿瘤小鼠的热成像。(E) a) PFD 的结构及用 P(OEGMA)23-P(Lys)15 包封 PFD 的示意图;b) 激光照射下,PBS、FD 和 PFD 处理组肿瘤小鼠的热成像;c) 不同时间点 PFD 处理组肿瘤小鼠的荧光成像。(F) a) RC 的结构及用 BSA 包封 RC 的示意图;b) 激光照射下,PBS 和 RC-BSA 处理组肿瘤小鼠的热成像;c) PTT 后不同时间点,不同组别肿瘤小鼠的照片。(G) a) EA5-c3 的结构;b) EA5-c3@BSA 处理组全身、脑部区域和肠道的荧光成像;c) PBS、EA5-c3@BSA 处理组肿瘤小鼠的热成像。
采用类似的方法,花菁F4-Br单体被一种两亲性多肽POEGMA-PBLA负载,形成了近红外二区(NIR-II)光治疗剂F4-Br@P17 NPs(光热转换效率为43.5%)(图20D)(https://doi.org/10.1002/adhm.202300541),该纳米粒子表现出高生物相容性和令人满意的光热性能。同时,由于F4-Br@P17 NPs具有良好的光热稳定性和NIR-II荧光,它们在肿瘤光热治疗(PTT)/血管成像中的应用得到了促进,并在暴露于1064 nm激光后展示了卓越的抗肿瘤效率。Yan等人利用两亲性多肽封装NIR-II荧光染料FD制备了PFD NPs。所制备的PFD NPs展示了出色的光热转换效率(40.69%)、良好的NIR-II光学性能和优异的生物相容性。这些NPs能够有效靶向肿瘤部位产生热量用于肿瘤消融,并通过荧光成像追踪PTT过程(图20E)(https://doi.org/10.1021/acsabm.0c01218)。
Liang的研究小组制备了一种不对称花菁染料(RC)(光热转换效率为28.7%),并将其封装入牛血清白蛋白(BSA)形成RC-BSA纳米颗粒(RC-BSA NPs)(图20F)(https://doi.org/10.1021/acsami.6b07838)。这些纳米颗粒在抗肿瘤过程中展示了优异的生物相容性和PTT性能,因此成功实现了肿瘤消融,而对治疗的小鼠没有造成显著损害。Yang和他的同事设计并筛选了一种NIR-II染料EA5-c3(光热转换效率为60.86%)(https://doi.org/10.1002/adma.202411515),它具有高的白蛋白结合率,并形成了EA5-c3@BSA复合物(图20G)。这种复合物在荧光亮度方面有了显著增强,实现了成像血管和肿瘤的高信噪比。EA5-c3@BSA在肿瘤中积累后,在延长照射期间,治疗区域观察到温度显著升高,有效地抑制了肿瘤生长。
多功能供体-受体-供体(D-A-D)荧光剂在癌症PTT中也显示出相当大的潜力。2019年,Sun的研究团队设计了一种新的染料SY1080(光热转换效率为22.3%),通过引入一个3,4-乙二氧基噻吩桥单元并在D-A-D骨架中将硫原子替换为硒,导致发射波长红移到1080 nm并产生了高的光热效应(图21A)(https://doi.org/10.1021/acs.analchem.9b03152)。为了增加水溶性从而改善生物相容性,SY1080用DSPE-PEG5000封装形成SY1080 NPs。形成的SY1080 NPs在水溶液中表现出明显的吸收,能够促进高分辨率的肿瘤位点跟踪成像。在给予SY1080 NPs 12小时后,在808 nm激光照射下,肿瘤部位的温度从31°C快速上升到50°C,同时有效抑制了肿瘤生长且没有相关的生理毒性。同样,Qu等人报道了一种NIR-II染料SeC(光热转换效率为62%),它不仅具有适当的摩尔吸光系数,还能发出NIR-II荧光(图21B)(https://doi.org/10.1002/adtp.202300159)。为了提高SeC在生物医学应用中的水溶性,通过纳米沉淀法合成了SeC NPs。随后,基于这些NPs的强NIR-II发射和高光热转换效率,它们被用于体内血管成像和肿瘤的PTT。
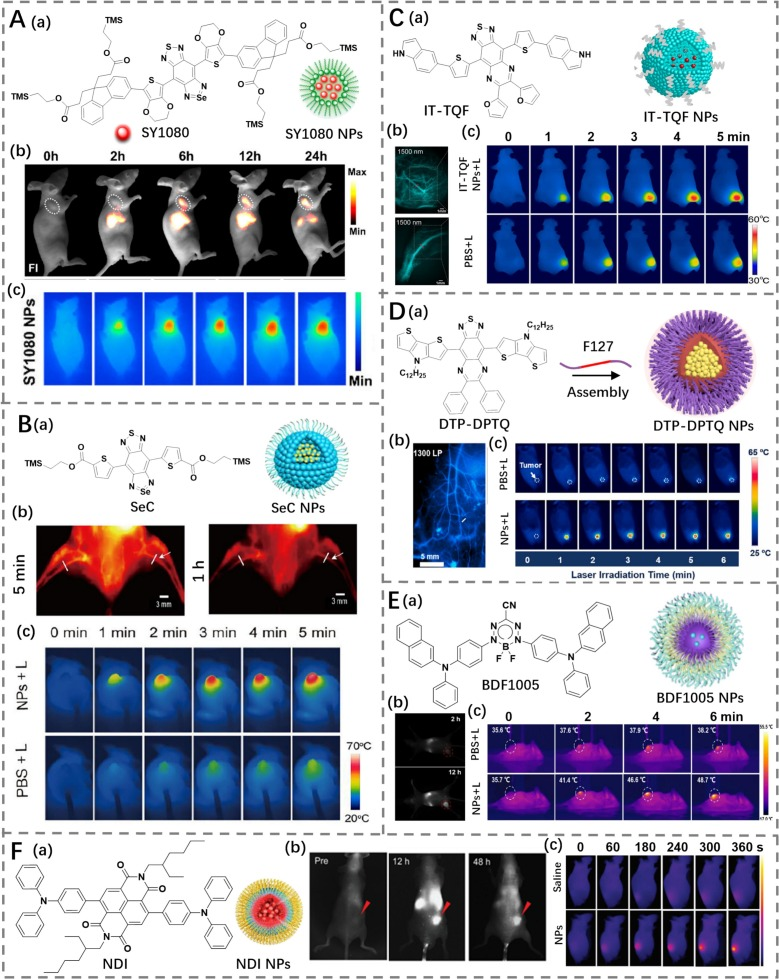
图 21. (A) a) SY1080 的结构及 SY1080 纳米颗粒示意图;b) SY1080 纳米颗粒在荷瘤小鼠体内的实时荧光成像;c) SY1080 纳米颗粒治疗荷瘤小鼠的热成像。(B) a) SeC 的结构及 SeC 纳米颗粒示意图;b) SeC 纳米颗粒在小鼠后肢血管中的代表性荧光成像;c) PBS 和 SeC 纳米颗粒治疗荷瘤小鼠的热成像。(C) a) IT-TQF 的结构及 IT-TQF 纳米颗粒示意图;b) IT-TQF 纳米颗粒对肿瘤血管和腿部脉管系统的荧光成像;c) 激光照射下,PBS 和 IT-TQF 纳米颗粒治疗荷瘤小鼠的热成像。(D) a) DTP-DPTQ 的结构及 DTP-DPTQ 纳米颗粒示意图;b) DTP-DPTQ 纳米颗粒对血管的代表性荧光成像;c) 激光照射下,PBS 和 DTP-DPTQ 纳米颗粒治疗荷瘤小鼠的热成像。(E) a) BDF1005 的结构及 BDF1005 纳米颗粒示意图;b) 不同时间点荷瘤小鼠图像;c) 激光照射下,PBS 和 BDF1005 纳米颗粒治疗荷瘤小鼠的热成像。(F) a) NDI 的结构及 NDI 纳米颗粒示意图;b) NDI 纳米颗粒治疗荷瘤小鼠的荧光成像;c) 生理盐水和 NDI 纳米颗粒治疗荷瘤小鼠的热成像。
基于D-A-D框架,Chen的研究小组在设计IT-TQF(光热转换效率为47%)时引入了苯并吲哚作为供体,并用DSPE-PEG2000封装以获得纳米颗粒IT-TQF NPs(图21C)(https://doi.org/10.1021/acsami.2c11706)。IT-TQF NPs不仅保留了IT-TQF优异的近红外二区(NIR-II)光学特性,还显著提高了其水溶性和稳定性。此外,IT-TQF NPs通过明亮的荧光信号实现了高分辨率的血管成像。随后,IT-TQF NPs被用于执行荧光成像引导的光热治疗(PTT),有效地抑制了肿瘤的生长趋势。
Wu等人报道了一种NIR-II荧光染料DTP-DPTQ,它是通过Suzuki偶联反应将二噻吩吡咯供体与6,7-二苯基-[1,2,5]噻二唑并[3,4-g]喹喔啉受体连接合成的(图21D)(https://doi.org/10.1016/j.mtnano.2023.100404)。为了增强水溶性,DTP-DPTQ被F127封装形成DTP-DPTQ NPs,这些NPs表现出出色的NIR-II荧光(超过1120 nm)和光热性质(光热转换效率为51.55%)。DTP-DPTQ NPs良好的荧光和光热特性在癌症诊断和治疗中具有巨大潜力,结果证明了这一点。
除了花菁和D-A-D染料之外,许多其他NIR-II荧光染料也通过扩展π共轭和相应的结构修饰被开发用于图像引导的PTT。然而,它们进一步发展的主要障碍仍然是生物相容性不足的问题。Zhong等人利用两亲聚合物聚(苯乙烯-co-氯甲基苯乙烯)-接枝-聚(乙二醇)封装NIR-II染料BDF1005(光热转换效率为39.9%)(图21E)(https://doi.org/10.1016/j.cclet.2021.11.079),以克服生物相容性差和潜在长期生物毒性的障碍。研究表明,BDF1005 NPs可以在肿瘤区域积聚并发出NIR-II荧光,从而照亮肿瘤。此外,BDF1005 NPs已被用于4T1肿瘤的体内荧光引导PTT,有效抑制了肿瘤生长的趋势。
Cui等人报道了一种基于萘二酰亚胺的NIR-II染料(NDI),并通过DSPE-PEG封装获得了具有出色水溶性的超均匀纳米探针,用于实现成像引导的肿瘤PTT(图21F)(https://doi.org/10.1039/D1NR04227K)。这一系列研究展示了通过不同策略提高NIR-II荧光染料的水溶性和生物相容性,从而推动了它们在癌症诊疗中的应用。
提高生物相容性的其他策略
尽管通过使用水溶性基团修饰或两亲性组装来提高有机小分子剂的生物相容性已经取得了一定进展,但大多数已报道的工作仅采用单一策略以实现这一目标。Yan等人制备了一种新型纳米粒子HQS-Cy@P(图22A),该粒子从两个方面调整了荧光染料的溶解度(https://doi.org/10.1039/D1TB00018G)。首先,在七甲川花菁骨架中引入了两个磺酸基团以增强其水溶性。其次,通过两亲性多肽封装锁定染料,形成纳米胶束(HQS-Cy@P),进一步提高了水溶性。在水溶液中,HQS-Cy@P在985 nm处显示出明显的吸收峰,在1050 nm处有发射峰。这些光谱特征的存在归因于引入了二甲基铵功能基团。这种功能基团抑制了电荷-电荷相互作用并增加了分子间的距离,从而防止了纳米胶束中的分子聚集。光热性能实验表明,HQS-Cy@P表现出显著的光热转换能力,在915 nm激光照射下有效杀死了细胞。此外,在静脉注射HQS-Cy@P 8小时后,HQS-Cy@P可以通过增强渗透和滞留(EPR)效应在肿瘤部位积聚,这是由于其体内循环时间延长所致。在HQS-Cy@P的最大积累量时,将肿瘤部位暴露于915 nm激光下10分钟,导致肿瘤区域温度显著升高,与对照组相比,从31.3°C升至48°C。此外,通过利用近红外二区(NIR-II)荧光,HQS-Cy@P能够实时监控这一过程,从而指导光热治疗。经过15天的时间,肿瘤生长被抑制,并且没有造成任何可观察到的器官损伤,这证实了通过调节水溶性改善生物相容性的组合策略的潜力。
Wu等人采用了结合亲水性聚乙二醇(PEG)修饰和纳米封装的双重策略开发了TP-BP NPs(光热转换效率为53.8%),用于NIR-II成像和局部光热治疗肿瘤(图22B)(https://doi.org/10.1021/acsanm.4c04398)。这种方法不仅增强了材料的水溶性和生物相容性,还提高了其光热转换效率,展示了在癌症诊疗中的巨大应用前景。通过综合运用多种策略,研究人员能够更有效地提升材料的性能,为临床应用提供了更多可能性。这些研究不仅推进了光热治疗技术的发展,也为开发新型多功能纳米材料奠定了基础。
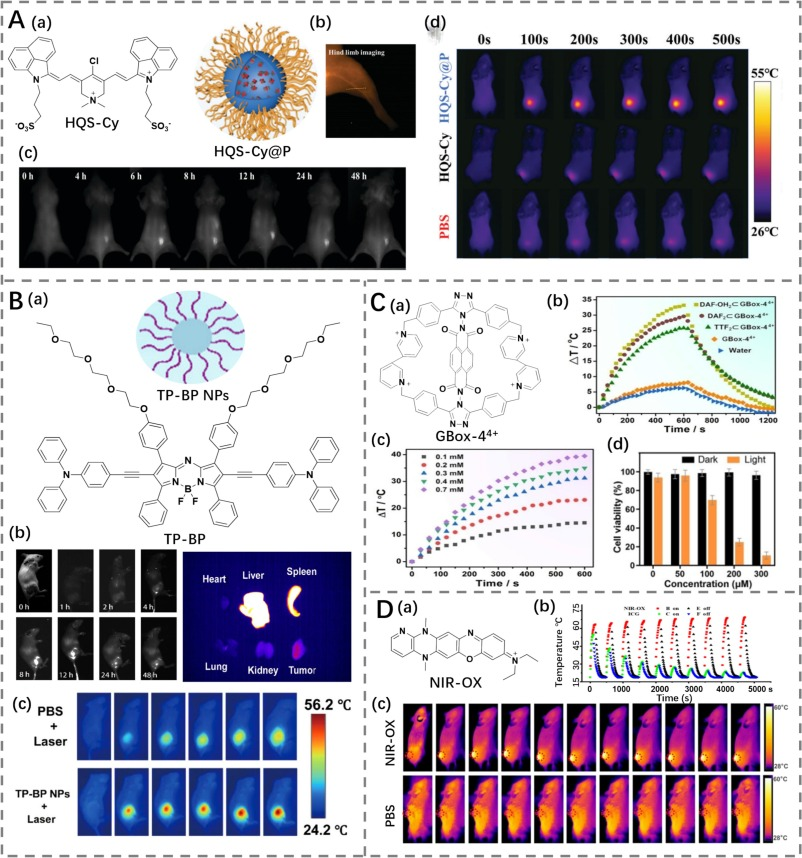
图22. (A) a) HQS-Cy的结构以及HQS-Cy@P的示意图;b) 使用HQS-Cy@P进行后肢血管荧光成像;c) 使用HQS-Cy@P进行荷瘤小鼠的实时荧光成像;d) 分别使用PBS、HQS-Cy和HQS-Cy@P处理荷瘤小鼠后的热成像。 (B) a) TP-BP的结构以及TP-BP NPs的示意图;b) 使用TP-BP NPs进行荷瘤小鼠以及分离器官/肿瘤的荧光成像;c) 分别使用PBS和TP-BP NPs处理荷瘤小鼠后的热成像。 (C) a) GBox-44+的结构;b-c) GBox-44+的体外热效应;d) 使用Box-44+进行癌细胞的光热消融。 (D) a) NIR-OX的结构;b) NIR-OX与ICG的光热性能对比;c) 激光照射下,分别使用PBS和NIR-OX处理荷瘤小鼠后的热成像。
超分子主客体化学通过电子互补的主体和客体分子之间的非共价结合形成主客体复合物,代表了一种提高水溶性的有效方法。这些主客体复合物展示了高水溶性和出色的生物相容性,使其适用于生物系统而无需额外的表面修饰。Wei等人制备了一种水溶性双腔环糊精,命名为GBox-44+(光热转换效率为47.4%)(图22C)(https://doi.org/10.1002/anie.202301267)。该化合物展示了通过电荷转移相互作用结合两个等量富电子平面分子的强大能力,从而促进了罕见的三元主客体超分子组装体的形成。主客体复合物在持续激光照射下表现出优异的生物相容性和增强的光热效应,并随后被用作高效的近红外二区(NIR-II)光热剂用于癌细胞消融。
尽管取得了显著进展,但在生物应用中染料未知的生理代谢途径及其在代谢器官中的长时间滞留带来的潜在风险仍然是一个关注点。为了解决这一问题,Yuan的研究小组开发了一种具有小分子量的NIR-II染料NIR-OX(图22D),通过在罗丹明结合骨架上附加二氢吡啶并吡嗪单元来实现(https://doi.org/10.1002/anie.202410666)。在成像性能方面,NIR-OX能够迅速通过肝脏排出并在小鼠肠道中代谢。这种快速代谢过程归因于其较小的分子量。此外,NIR-OX展示了卓越的光热能力和光稳定性,这可以归功于其刚性的骨架结构。鉴于其在成像、光热性能以及快速代谢过程方面的优越表现,NIR-OX成为一种有前景的平台,适用于NIR-II荧光引导的光热治疗(PTT)。
提升 PTA 光稳定性的方法以改善光热疗效
影像引导的光热治疗(PTT)的效果取决于入射光和光热剂(PTAs),这些PTA通过将吸收的光转化为成像信号和热能,从而实现肿瘤的追踪和消融。由于高光热转换效率(PCE)和优异的近红外二区(NIR-II)光学特性,大量NIR-II有机小分子光热剂已被广泛应用于癌症PTT中。然而,NIR-II小分子光热剂可能存在光降解的风险,这会导致其在有效PTT温度范围内的持续时间较短。为克服这一缺点,自组装纳米技术、离子抗衡离子和电荷调节策略被认为是提高光稳定性的非常有前景的方法(图23A)。
Buzzá等人利用吲哚菁绿(ICG)稳定纳米乳液,从而形成了二聚体ICG(Nano-dICG)的纳米结构(图23B)(https://doi.org/10.1002/anie.202305564)。随后,在ICG完全二聚化后生成了ICG二聚体的J-聚集体。与ICG相比,Nano-dICG表现出更高的光热转换效率(42.1%),显著减少了光漂白(−9.6% vs −46.3%),并在循环照射下保持温度升高。静脉注射后,Nano-dICG通过光声成像实现了实时肿瘤追踪,以指导有效的PTT。
Chen及其同事探索了抗衡离子配对策略来调节NIR-II七甲川花菁光热剂的光稳定性(图23C)。为此,55-ClO4的抗衡阴离子ClO4⁻被与其他十一种抗衡阴离子交换,以获得具有不同抗衡阴离子的不同七甲川花菁盐(https://doi.org/10.1016/j.bioorg.2024.107206)。由于各种样品的不同聚集行为,这些抗衡七甲川花菁盐表现出不同的光学性质和光稳定性。其中,55-TFSI和55-TPB(光热转换效率为69.4%)在808 nm激光照射下对癌细胞表现出优于55-ClO4的光热效应。这些试剂通过PTT展示了显著的抗肿瘤效果,证实了合适的配位阴离子有助于改善光热抗癌效果。
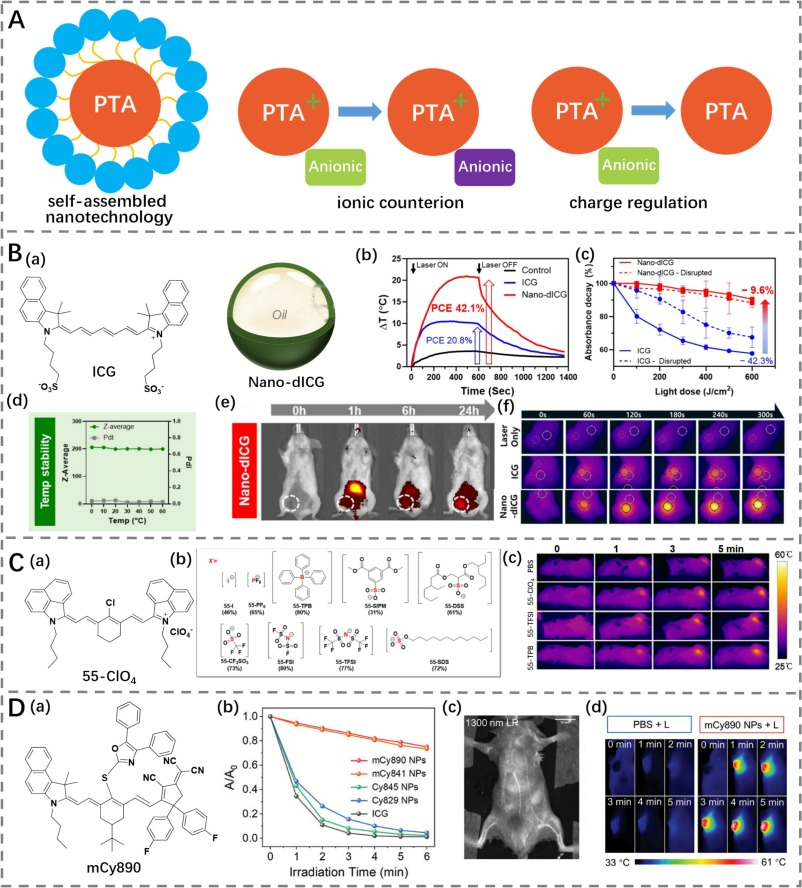
图 23. (A) 改善光热疗法(PTA)稳定性的不同策略示意图。(B) a) 吲哚菁绿(ICG)的结构及纳米-ICG的示意图;b) 纳米-dICG和ICG的光电转换效率(PCE)评估;c) ICG和纳米-ICG的光稳定性研究;d) 纳米-ICG的温度稳定性研究;e) 纳米-dICG对4T1原位肿瘤的荧光成像;f) PBS、ICG和纳米-dICG处理的荷瘤小鼠的热成像。(C) a-b) 55-ClO4及其替代阴离子的结构;c) PBS、55-TPB、55-ClO4和55-TFSI处理的荷瘤小鼠的热成像。(D) a) mCy890的结构;b) ICG、mCy890 NPs、mCy841 NPs、mCy845 NPs和mCy890 NPs的体外光稳定性研究;c) mCy890 NPs处理的血管的荧光成像;d) 激光照射下,PBS和mCy890 NPs处理的荷瘤小鼠的热成像。
在这些基于氰基的光热成像剂中,离子型氰基试剂由于其卓越的光物理和光热特性,在成像及光热治疗(PTT)方面得到了广泛应用。然而,大多数离子型氰基染料,包括那些已经获得FDA临床批准的如吲哚菁绿(ICG),在近红外二区(NIR-II)成像介导的PTT中仍表现出较差的光稳定性和有限的效果。2024年,Li等人提出了一种将离子型氰基染料转化为中性分子的策略,通过用一个中性的2-二氰亚甲基-3-氰基-4,5,5-三甲基-2,5-二氢呋喃(TCF)单元替换带电荷的吲哚单元来构建多甲炔类花青素mCy890(https://doi.org/10.1002/adma.202405966)。正如预期的那样,mCy890展示了提高的光热转换效率(51%),红移发射以及显著增强的光稳定性。随后,稳定的中性花青素mCy890与Pluronic F127共组装形成水性纳米颗粒分散液(mCy890 NPs)。最终,mCy890 NPs被静脉注射入小鼠体内用于血管的NIR-II成像,并观察到了高信噪比的血管图像。此外,mCy890 NPs还成功应用于实时NIR-II成像引导下的PTT以消除肿瘤。
两亲聚合物和生物大分子共组装策略在NIR-II有机小分子PTT-成像剂的包装中得到广泛使用。该策略已被证明可以提升生物相容性、改善肿瘤靶向能力并减少发光猝灭。而且,它似乎还能通过有效抵抗光漂白来促进光稳定性。因此,不同的NIR-II有机小分子PTT-成像剂与两亲聚合物和生物大分子共组装以制备稳定的NP分散体用于NIR-II成像介导的PTT。2020年,Qiu的研究小组通过功能化的牛血清白蛋白(BSA)修饰NIR-II花青荧光团(FS)开发了多功能纳米点(FS-GdND)(https://doi.org/10.1016/j.biomaterials.2020.120219)。FS-GdND展现了出色的双模态磁共振(MR)/NIR-II成像性能和在808 nm激光激发下的高光热转换效率(43.99%)。重要的是,光热稳定性实验表明,在循环激光照射期间PTT效果没有明显衰减,表明BSA组装体的耐久性。利用其高的光热稳定性和优越的光热效应,FS-GdND被静脉注射到携带4T1肿瘤的小鼠中,评估其对癌症治疗的光热细胞毒性。当肿瘤在治疗窗口内接受808 nm激光处理300秒时,肿瘤部位达到了足以摧毁肿瘤的温度。在高温条件下,与其他对照组相比,肿瘤生长得到了明显的抑制。
Yan等人设计了一个小分子花青荧光团(TPA-Et),并使用两亲共聚物P(OEGMA)20-P(Asp)14将其进一步制备为纳米胶束(P@TP)(https://doi.org/10.1016/j.nano.2022.102574)。纳米胶束在808 nm激光照射下显示出了高光热转换效率(52.5%)、良好的光稳定性和NIR-II荧光。药物给药后,P@TP能够在肿瘤部位有效积累,并提供高分辨率的NIR-II成像信号以指导PTT。在感染15天后的治疗中,肿瘤完全消除而没有对主要器官造成任何明显损伤。
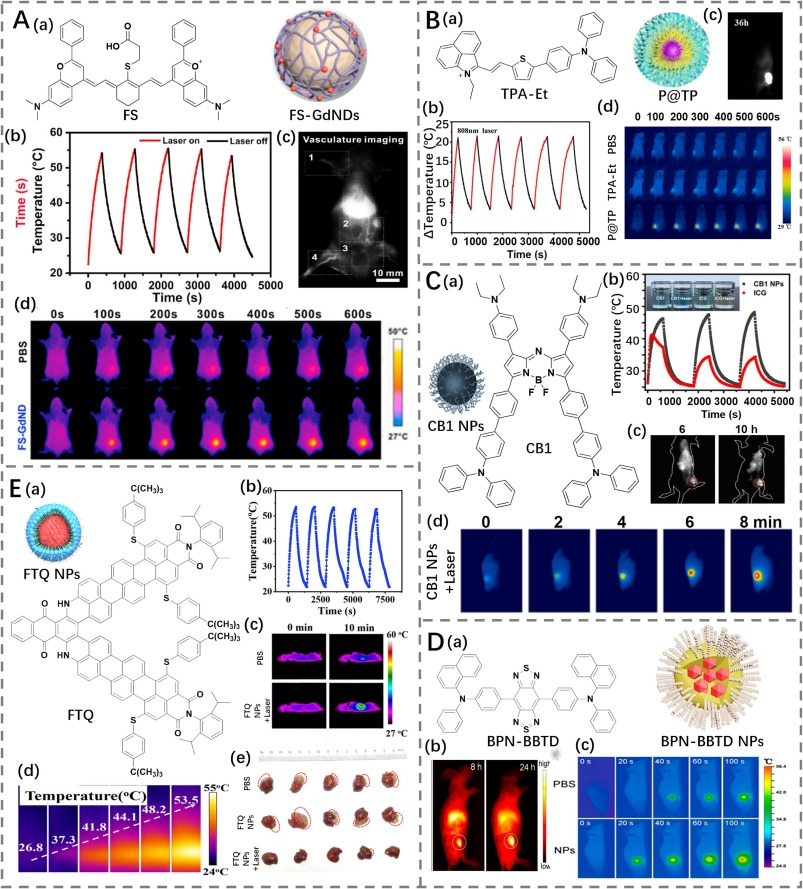
图 24. (A) a) FS 的结构及 FS-GdNDs 的示意图;b) FS-GdNDs 的循环加热/冷却性能;c) FS-GdNDs 的全身血管荧光成像;d) PBS 和 FS-GdNDs 处理的荷瘤小鼠热成像。(B) a) TPA-Et 的结构及 P@TP 的示意图;b) P@TP 的循环加热/冷却性能;c) P@TP 处理的荷瘤小鼠代表性荧光图像;d) PBS、TPA-Et 和 P@TP 处理的荷瘤小鼠热成像。(C) a) CB1 的结构及 CB1 NPs 的示意图;b) CB1 NPs 的循环加热/冷却性能;c) CB1 NPs 处理的荷瘤小鼠代表性荧光图像;d) CB1 NPs 处理的荷瘤小鼠热成像。(D) a) BPN-BBTD 的结构及 BPN-BBTD NPs 的示意图;b) BPN-BBTD NPs 处理的皮下荷瘤小鼠代表性荧光图像;c) 激光照射下 PBS 和 BPN-BBTD NPs 处理的荷瘤小鼠热成像。(E) a) FTQ 的结构及 FTQ NPs 的示意图;b) FTQ NPs 的循环加热/冷却性能;c) 0 分钟和 10 分钟时 PBS 和 FTQ NPs 处理的荷瘤小鼠热成像;d) 激光照射后 FTQ NP 溶液的热图像;e) 分离的原位荷瘤肝脏图像。
2022年,Yu的研究小组设计了一种新型的基于BODIPY衍生物的染料CB1(https://doi.org/10.1039/D2BM00670G)。由于结构上的修改,该染料表现出明亮的近红外二区(NIR-II)荧光。在制备成纳米颗粒后,这种染料显示出了高稳定性和超过1000 nm的峰值发射波长(图24C),并且展示了有利的光热转换效率(36%)。因此,CB1 NPs被用于由NIR-II成像引导的体内光热治疗(PTT)。激光照射后,在肿瘤区域通过荧光和光热成像清晰地展示了光学和热信号。结果表明,经过成像引导的治疗程序后,肿瘤的生长趋势得到了有效抑制。
2018年,Tang等人利用两亲聚合物Pluronic F-127(F-127)封装一种聚集诱导发光(AIE)型NIR-II染料BPN-BBTD,以制备具有优秀光热转换效率(39.8%)和高稳定性的BPN-BBTD NPs(图24D)(https://doi.org/10.1021/acsnano.8b05937)。在NIR-II成像的指导下,超稳定的BPN-BBTD NPs成功地应用于膀胱肿瘤的体内PTT。
2023年,Müllen及其同事通过引入二元体芘-3,4-二甲酰亚胺到蒽醌的bay位置取代来构建大型共轭分子FTQ(光热转换效率为49%)(图24E)(https://doi.org/10.1021/jacs.3c11314)。FTQ的延长共轭导致吸收带红移到1140 nm,并伴有延伸至1500 nm的延长尾部。与1,2-二硬脂酰-sn-甘油-3-磷乙醇胺-N-(甲氧基-(聚乙二醇)-2000(DSPE-PEG2000)包装后,FTQ表现出良好的光稳定性和光热转换效率。这促进了原位肝癌的NIR-II成像介导的体内PTT。
构筑协同PTA以增强PTT疗效
尽管一些具有高光热转换效率(PCE)、特异性等优点的小分子光热剂(PTAs)在肿瘤治疗中已显示出令人鼓舞的结果,但研究人员发现,单一的光热疗法(PTT)模式由于热休克蛋白(HSP)的耐热性以及肿瘤区域温度分布不均等原因,往往面临瓶颈问题。因此,科学家们探索了将PTT与其他治疗模式相结合的策略,这代表了一种提升PTT疗效并实现超越各单独成分总和治疗效果的有希望的方法。这种联合治疗策略包括与光动力疗法(PDT)、化疗及免疫疗法的结合,这些方法可以协同作用以增强PTT的有效性。因此,研究人员认为,开发协同增效剂有可能显著提高单次PTT治疗的效果。
PTT-PDT 协同治疗
研究人员发现,热量和活性氧(ROS)的产生作为染料激发态中非辐射衰减的两种主要表现形式,可以相互协同补充,以最大化单一光动力疗法/光热疗法(PDT/PTT)的有效性(图25A)。因此,一系列小分子PTT-PDT协同剂在体内癌症治疗中引起了广泛关注。
Xiong及其同事通过受体工程策略构建了一种D-A共轭结构的小分子花青染料(BHcy)(图25B)(https://doi.org/10.1002/smll.202204851)。该染料的最大发射峰位于915 nm,并且尾部发射可达1200 nm。此外,BHcy(光热转换效率为42.2%)表现出良好的ROS生成能力、优异的光热性能以及较大的斯托克斯位移。科学家们认为,这是由于受体工程策略增加了π共轭体系,从而缩小了能隙。理论计算表明,BHcy具有较小的ΔES1-T2,有利于生成单线态氧(¹O₂)。
在体内应用方面,研究人员通过将BHcy与DSPE-PEG2000共组装制备了BHcy-NPs纳米粒子。在808 nm激光照射下,相比于BHcy,水溶液中的BHcy-NPs实现了明亮的荧光、高产率的¹O₂以及卓越的光热能力。BHcy-NPs的PTT/PDT协同治疗效果在癌细胞和携带4T1肿瘤的小鼠模型中得到了验证,研究结果显示,癌细胞和4T1肿瘤的生长趋势被显著抑制,表明BHcy-NPs具有出色的抗癌效果。
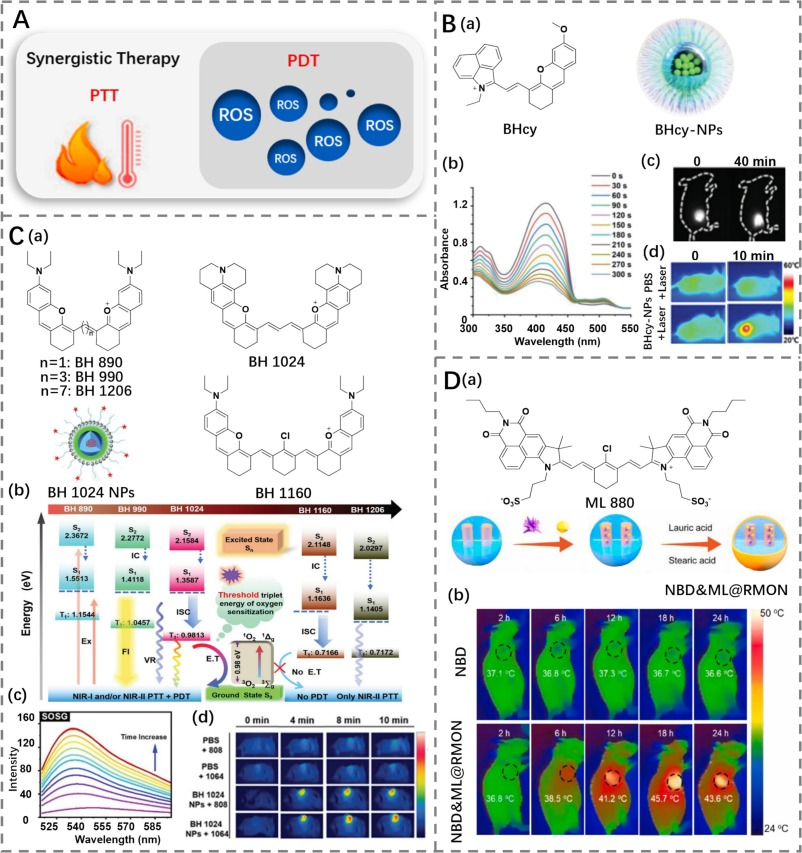
图 25. (A) PTT-PDT 协同治疗示意图。(B) a) BHcy 的结构和 BHcy-NPs 的示意图,b) BHcy-NPs 产生 ROS 的能力评估,c) BHcy-NPs 在 0 和 40 分钟时对 4T1 原位肿瘤的荧光成像,d) 经 PBS 和 BHcy-NPs 处理的荷瘤小鼠的热成像。(C) a) BHs 的结构和 BH 1024 NPs 的示意图,b) BH 染料和 O2 的单线态和三线态能级示意图,c) BH 1024 NPs 产生 ROS 的能力评估,d) 在 808/1064 nm 激光照射下,经 PBS 和 BH 1024 NPs 处理的荷瘤小鼠的热成像。(D) a) ML 880 的结构和 NBD&ML@RMON 制备的示意图,b) 在激光照射下,经 NBD 和 NBD&ML@RMON 处理的荷瘤小鼠的热成像。
Xiao的研究小组设计并合成了一系列基于荧光成像引导的PTT-PDT协同治疗剂(BHs),通过将黄酮与不同长度的聚甲炔桥相连(图25C)(https://doi.org/10.1002/smll.202100398)。研究发现,随着聚甲炔链长度的增加,BHs的吸收逐渐从890 nm扩展到1206 nm。得益于显著的电子离域和大的共轭体系,BH染料在聚甲炔链延长过程中表现出LUMO逐渐下降、HOMO逐渐上升的趋势,并且HOMO-LUMO能隙减小。正如预期的那样,BH 1024同时显示出高光热转换效率(41.3%)和高的单线态氧(¹O₂)产率。随后,研究人员将BH 1024封装进DSPE-PEG形成纳米粒子BH 1024 NPs,以进一步探索其抗肿瘤效果。结果表明,在1064 nm激光照射下,BH 1024 NPs在水溶液中仍然保持良好的光敏化能力。基于PDT和PTT特性,体内光疗实验显示BH 1024 NPs能够通过PTT-PDT协同疗法完全消除肿瘤,相较于单药治疗组BH 1160,未见明显的复发。
Chen及其同事利用端基调控策略设计合成了花青染料ML880(图25D)(https://doi.org/10.1016/j.bioactmat.2021.12.009)。他们用萘酰亚胺替换了七甲炔中的吲哚,以增加电子离域并将最大发射峰移至912 nm。此外,ML880不仅表现出显著的光热效应,还具有生成单线态氧的能力。接着,研究人员通过将ML880和化疗药物封装在RMON中构建了一种纳米药物NBD&ML@RMON,该药物对光热和ROS双重响应。给予NBD&ML@RMON后,在880 nm激光照射下成功抑制了肿瘤的生长。
苯并双噻二唑染料及其衍生物作为一类经典的NIR-II荧光团,广泛应用于成像领域,也在光疗中展现了巨大潜力。Liu的研究小组开发了一种基于BBTD的染料Se-IR1100(光热转换效率为55.37%),通过在BBTD骨架上整合重原子和3,4-乙烯二氧噻吩(EDOT)桥,从而导致明亮的NIR II发射及光动力-光热效应,这是由于增加了系间窜越(图26A)(https://doi.org/10.1039/D3AN01599H)。然后,Se-IR1100进行了DSPE-PEG化处理,在水溶液中表现出强的最大NIR-II发射波长为1100 nm,并拥有光动力-光热性质。为了评估体内肿瘤治疗的有效性,研究人员使用SeIR1100纳米粒子(NPs)进行给药并通过荧光信号可视化肿瘤部位。同时,在808 nm激光照射下温度升高至64.5°C。IR1100 NPs通过NIR-II成像引导的光动力-光热协同疗法成功抑制了肿瘤。
Sun和他的同事们开发了一种基于聚集诱导发光(AIE)的NIR-II试剂,命名为ZSY-TPE(光热转换效率为28.4%)(https://doi.org/10.1016/j.biomaterials.2020.120315),旨在解决传统基于BBTD的染料中观察到的聚集诱导猝灭问题(图26B)。这通过引入一个四苯基乙烯扭曲单元实现,从而达到了高效发光和显著的光热/光动力效应。因此,ZSY-TPE的应用推进了体内成像引导的光热/光动力癌症治疗的发展。
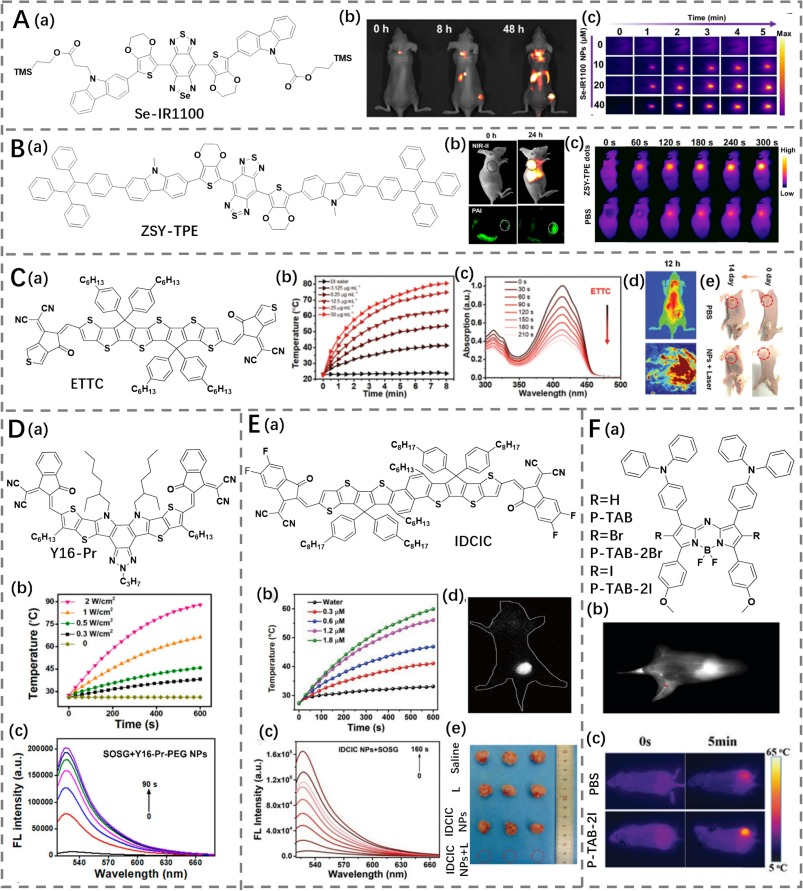
图 26. (A) a) Se-IR1100 的结构;b) Se-IR1100 纳米颗粒在不同时间点的肿瘤荧光成像;c) Se-IR1100 纳米颗粒治疗荷瘤小鼠在不同时间点的热成像。(B) a) ZSY-TPE 的结构;b) ZSY-TPE 纳米点在不同时间点的肿瘤荧光/光声成像;c) PBS 和 ZSY-TPE 纳米点治疗荷瘤小鼠在不同时间点的热成像。(C) a) ETTC 的结构;b) ETTC 纳米颗粒的热效应评估;c) 使用 DPBF 对 ETTC 纳米颗粒的活性氧 (ROS) 产生能力评估;d) ETTC 纳米颗粒在肿瘤部位的代表性荧光/光声图像;e) 治疗 14 天后荷瘤小鼠的图像。(D) a) Y16!single bondPr 的结构;b-c) Y16!single bondPr 的热/ROS 产生能力评估。(E) a) IDCIC 的结构;b-c) IDCIC 纳米颗粒的热/ROS 产生能力评估;d) IDCIC 纳米颗粒的肿瘤荧光成像;e) 用生理盐水和经/未经过激光照射的 IDCIC 纳米颗粒治疗荷瘤小鼠的热成像。(F) a) P-TABs 的结构;b) P-TAB-2I 腹部血管的荧光成像;c) PBS 和 P-TAB-2I 治疗荷瘤小鼠的热成像。
研究人员发现,近红外二区(NIR-II)成像介导的PTT/PDT多功能试剂通过将多个成分整合到单一实体中,使每个成分都能发挥其特定功能,从而更高效地治疗癌症。Li及其同事设计了一种基于受体-供体-受体(A-D-A)结构的染料(ETTC),通过结合刚性和柔性(图26C),展示了出色的活性氧(ROS)生成能力、明亮的NIR-II发射和良好的光热效应(https://doi.org/10.1039/D0NH00672F)。随后,ETTC(光热转换效率为52.8%)被组装成纳米粒子,旨在优化其功能,并在双模式NIR-II/光声(PA)成像指导下,通过光热治疗(PTT)和光动力疗法(PDT)的协同组合实现肿瘤消融。
利用分子工程策略,Lan和他的同事们相继开发了两种不同的A-D-A染料,分别是Y16-Pr(光热转换效率为82.4%)(图26D)和IDCIC(光热转换效率为78.9%)(图26E)(https://doi.org/10.1021/acsami.1c22444,https://doi.org/10.1007/s40843-022-2143-2)。这两种染料均表现出良好的体内抗肿瘤效率,通过多功能协同效应涵盖了NIR-II荧光/光声成像、光动力疗法和光热效应。
2022年,Yan的研究小组开发了一种名为TAB的NIR-II光敏剂,通过结合三苯胺、甲氧基和卤素原子(图26F),使得最大发射波长显著红移(https://doi.org/10.1039/D1TB02066H)。同时,重原子也增强了系间窜越能力,从而提高了单线态氧的生成。随后,TBAs被封装在纳米粒子内,制备出P-TAB、P-TAB-2Br和P-TAB-2I(光热转换效率为42.3%)。这些纳米粒子表现出显著的光热效应,并显示出对热和光漂白的强抵抗力。给予P-TAB-2I纳米粒子后,在肿瘤区域观察到了明显的荧光信号积累。随后,由光热治疗(PTT)和光动力疗法(PDT)介导的体内协同光疗对肿瘤表现出显著的抑制效果。
PTT 化疗协同治疗
已有研究表明,升高温度可以通过加速化疗药物在血液中的循环来增强其疗效。因此,研究人员认为,将化疗作为临床癌症治疗方法与光热疗法(PTT)相结合,是一种潜在有效的癌症治疗方法(图27A)。目前,研究人员提出了三种常见的策略用于开发化疗和PTT协同治疗试剂:
- 共价修饰策略:将化疗药物共价修饰到PTT试剂的主链上。
- 金属-配体自组装策略:利用金属-配体配位作用自组装PTT试剂和金属原子药物。
- 纳米封装策略:将PTT试剂和药物分子封装在一起形成纳米试剂。
叶及其同事设计了一种靶向碳酸酐酶的联合治疗纳米颗粒试剂(IRNPs-SBA/PtIV),通过整合顺铂前药和NIR-II光热剂IR 1040(图27B)(https://doi.org/10.1016/j.biomaterials.2023.122454)。IRNPs-SBA/PtIV(光热转换效率为65.17%)能够精确靶向肿瘤,这是由于IRNPs-SBA/PtIV对肿瘤细胞中过表达的碳酸酐酶具有高结合亲和力。然后,在肿瘤区域响应谷胱甘肽时,可以释放表面修饰的顺铂。此外,当IRNPs-SBA/PtIV暴露于1064 nm激光照射下时,观察到了高温。化疗和PTT的结合增强了IRNPs-SBA/PtIV的治疗效果,并成功抑制了胰腺肿瘤的生长。在整个治疗过程中,未观察到任何显著的不良反应。
研究人员认为,这种组合疗法不仅提高了单一疗法的效果,还减少了可能的副作用,为癌症患者提供了一种更安全、更有效的治疗选择。通过靶向特定的生物标志物如碳酸酐酶,该纳米颗粒能够更精准地定位并攻击癌细胞,从而提高治疗的选择性和效率。此外,纳米载体的设计也考虑到了对肿瘤微环境的响应性释放机制,确保了药物能够在最需要的地方发挥作用,进一步提升了治疗效果。
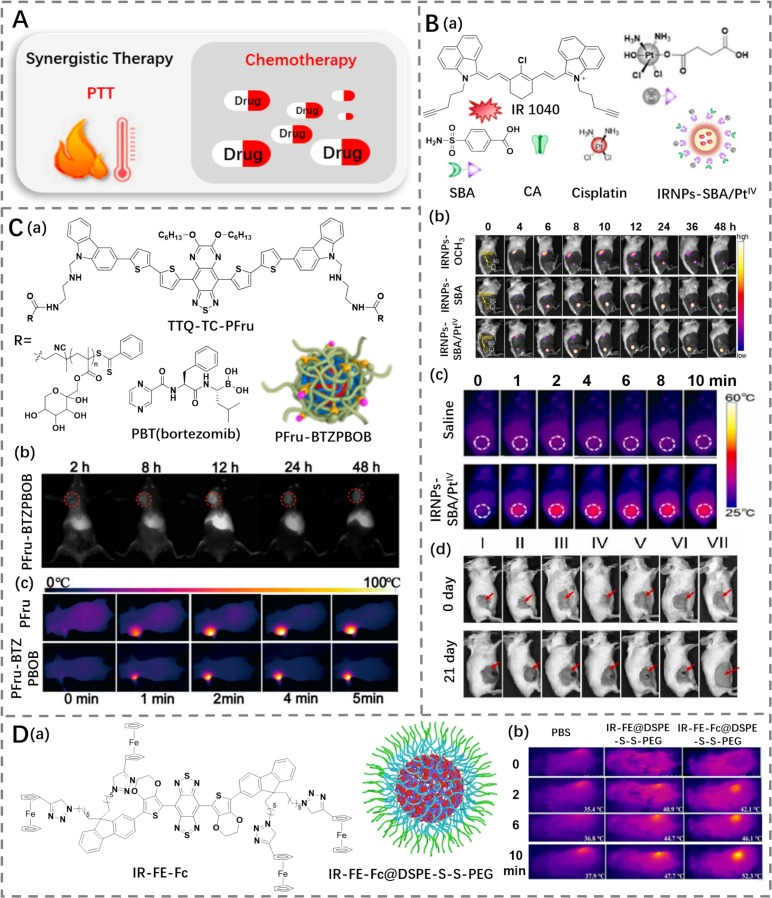
图27.(A)PTT(光热疗法)与化疗协同治疗示意图。(B)a) IR1040的结构和IRNPs-SBA/PtIV的示意图;b) IRNPs-OCH3、IRNPs-SBA和IRNPs-SBA/PtIV处理Pan02肿瘤后不同时间的荧光成像;c) 注射生理盐水和IRNPs-SBA/PtIV的荷瘤小鼠在不同时间点的热成像;d) 治疗前后荷瘤组织的图像。(C)a) TTQ-TC-PFru的结构和PFru-BTZPBOB的示意图;b) PFru-BTZPBOB处理MCF-7肿瘤后不同时间的荧光成像;c) PFru和PFru-BTZPBOB处理荷瘤小鼠在不同时间点的热成像。(D)a) IR-FE-Fc的结构和IR-FE-Fc@DSPE-S-S-PEG的示意图;b) 激光照射下PBS、IR-FE @DSPE-S-S-PEG和IR-FE-Fc@DSPE-S-S-PEG处理荷瘤小鼠的热成像。
Fan和他的同事们设计了一种基于NIR-II苯并双噻二唑染料TTQ-TC的多功能遥爪糖聚合物,命名为TTQ-TC-PFru(光热转换效率为28%)(https://doi.org/10.1021/acsmaterialslett.9b00480)。该聚合物通过硼酸-儿茶酚共轭作用构建,并作为药物载体用于开发刺激响应性纳米粒子(NPs),PFru-BTZPBOB(图27C)。在体内癌症治疗中,苯并双噻二唑单元TTQ-TC不仅作为信号成分用于追踪肿瘤部位以实现成像,还能产生热量以实现肿瘤热消融。此外,硼酸-儿茶酚共轭物被设计为控制抗癌药物的释放,以增强刺激响应条件下的光热治疗(PTT)效果,最终对肿瘤产生了显著的抑制效果。
Yang的研究小组合成了一种名为IR-FE-Fc(光热转换效率为42.29%)的试剂(图27D)(https://doi.org/10.1016/j.cej.2023.142372),利用NIR-II染料的四盾臂通过点击化学连接功能性二茂铁。然后,该化合物被包裹在谷胱甘肽(GSH)响应的两亲嵌段共聚物中,形成水溶性的IR-FE-Fc@DSPE-S-S-PEG,可以在肿瘤微环境中由高水平的GSH降解以释放IR-FE-Fc。游离的IR-FE-Fc可以通过肿瘤内的H₂O₂引发芬顿反应进一步增加•OH含量。此外,IR-FE-Fc@DSPE-S-S-PEG能够产生高热效应以消除癌细胞。生成的热量还可以通过加速血流来增强化疗效果,从而实现肿瘤消融。
传统的基于BODIPY的光敏剂由于激发态猝灭而导致治疗和成像效果不佳。为解决这一问题,Sun等人提出了使用金属环自组装NIR-II发射BODIPY配体的方法,通过双核芳烃钌制备了锁定NIR-II氮杂-BODIPY配体的Ru(II)金属环Ru1085(光热转换效率为30.9%)(图28A)(https://doi.org/10.1038/s41467-022-29572-2)。金属配位的大环结构不仅延长了短波长金属基化学剂的激发和发射波长,还减轻了基于BODIPY的光敏剂的激发态猝灭,从而增强了治疗和成像效果。此外,Ru(II)原子的引入通过促进系间窜越(ISC)增强了BODIPY的光疗效果。与铂类化疗相比,小分子钌(Ru)复合物因其较低的毒性和对铂耐药癌细胞的增强活性而被认为是更优的选择(https://doi.org/10.1016/j.ccr.2014.04.012)。最终,Ru1085的明亮NIR-II发射和高光热转换效率使其成功应用于NIR-II荧光成像,指导有效的肿瘤化疗-光疗。
采用金属配位驱动的自组装策略,他们报道了一种通过双核芳烃钌阻断D-A-D骨架NIR-II发射配体的NIR-II发射Ru(II)金属环Ru1000(光热转换效率为17.6%)(图28B)。金属配位的大环结构Ru1000整合了NIR-II光学特性和化疗-光疗性能,提供了精确实现成像引导的化疗-光疗的有效工具,具有良好的肿瘤抑制效果(https://doi.org/10.1002/smll.202201625)。
Yin等人通过金属-配体配位将铁(III)和儿茶酚修饰的NIR-II氮杂-BODIPY(ABFe)(光热转换效率为55%)组装在一起,实现了PTT/CDT联合抗癌活性(图28C)(https://doi.org/10.1021/acsbiomaterials.2c01539)。研究人员认为,这种组合不仅提高了单一疗法的效果,还通过协同作用增强了对肿瘤的抑制能力,展示了在癌症治疗中的巨大潜力。
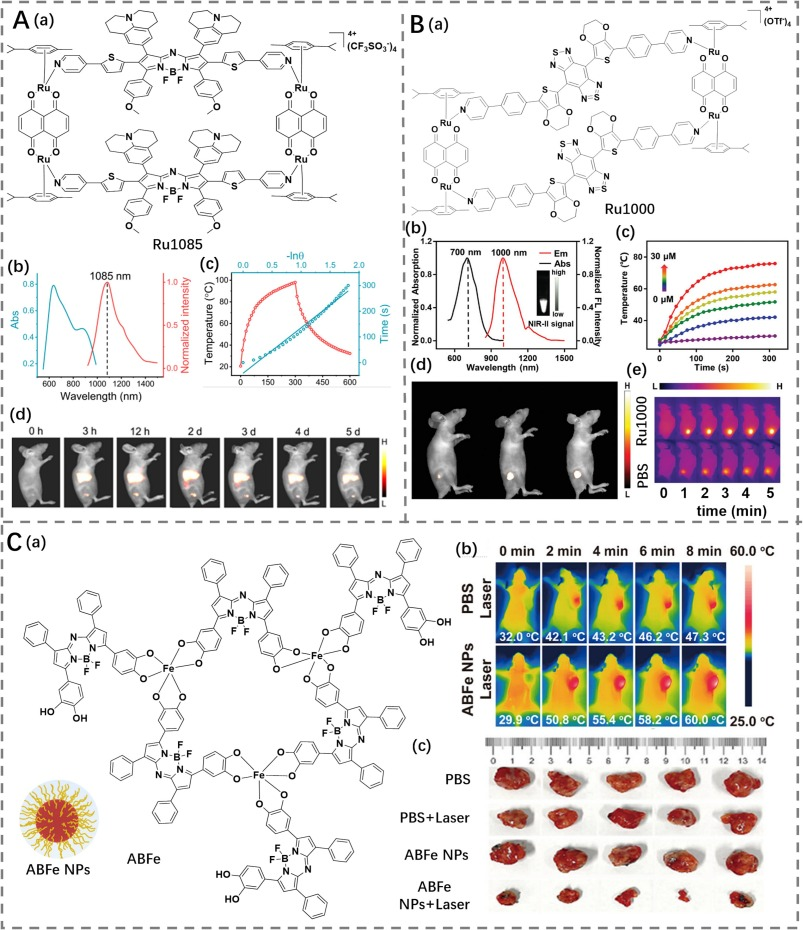
图28.(A)a)Ru1085的结构;b)Ru1085的吸收和发射光谱;c)Ru1085的体外生热能力评估;d)不同时间点,生理盐水和Ru1080 NPs处理的A549荷瘤小鼠的荧光成像。(B) a)Ru1000的结构;b)Ru1000的吸收和发射光谱;c)Ru1000的体外生热能力评估;d)Ru1000处理的A549肿瘤的荧光成像;e)不同时间点,PBS和Ru1000处理的荷瘤小鼠的热成像。(C)a)ABFe的结构及ABFe NPs示意图;b)激光照射下,PBS和ABFe NPs处理的荷瘤小鼠的热成像;c)各组治疗15天后肿瘤的照片。
研究人员发现,纳米封装是一种开发用于光疗、化疗和疾病成像的多功能试剂的高度有效策略,其中NIR-II染料与药物分子的整合是一个特别突出的特点。
Feng和他的同事们通过铃木偶联反应成功设计了一种名为HBP的NIR-II发射染料(图29A),使用溴代氮杂二吡咯甲烯作为导向前体,随后进行区域选择性氧化环融合反应(https://doi.org/10.1016/j.jconrel.2020.07.017)。在1064 nm激光照射下,HBP表现出高光热转换能力。然后,研究人员将HBP加载到普朗尼克F127作为表面活性剂,并以疏水性紫杉醇(PTX)作为间隔物,形成HBP/PTX胶束用于肿瘤成像和治疗。当暴露于1064 nm激光时,在NIR-II荧光/光声(PA)双模成像引导下,通过静脉注射HBP/PTX胶束后生长在小鼠体内的肿瘤显著减少,这得益于联合光热和化疗治疗的效果。
Jiang的研究小组通过在BODIPY框架中插入噻吩单元并修饰碘原子,合成了具有高亮度NIR-II发射和高光热转换效率(37.87%)的硼二吡咯甲烯(BDP-T-N)(图29B)(https://doi.org/10.1016/j.actbio.2021.03.064)。随后,他们使用一种合成的两亲性聚(苯乙烯-co-氯甲基苯乙烯)-接枝-聚(乙二醇),并用叶酸功能化,来封装BDP-T-N染料和化疗药物多西他赛,从而形成多功能纳米粒子(BDP-T-N-DTX-FA),用于癌症成像和治疗。
Yin的研究小组通过将光热剂Cy-PA(光热转换效率为61%)与十二烷基硫酸钠和DSPE-PEG5000结合,开发了Cy-PA NPs用于光热治疗(PTT)(https://doi.org/10.31635/ccschem.021.202101630)。随后,他们还成功地使用辅助维生素C(Vc)促进光热疗法以进行肿瘤治疗(图29C)(https://doi.org/10.1002/adtp.202300017)。
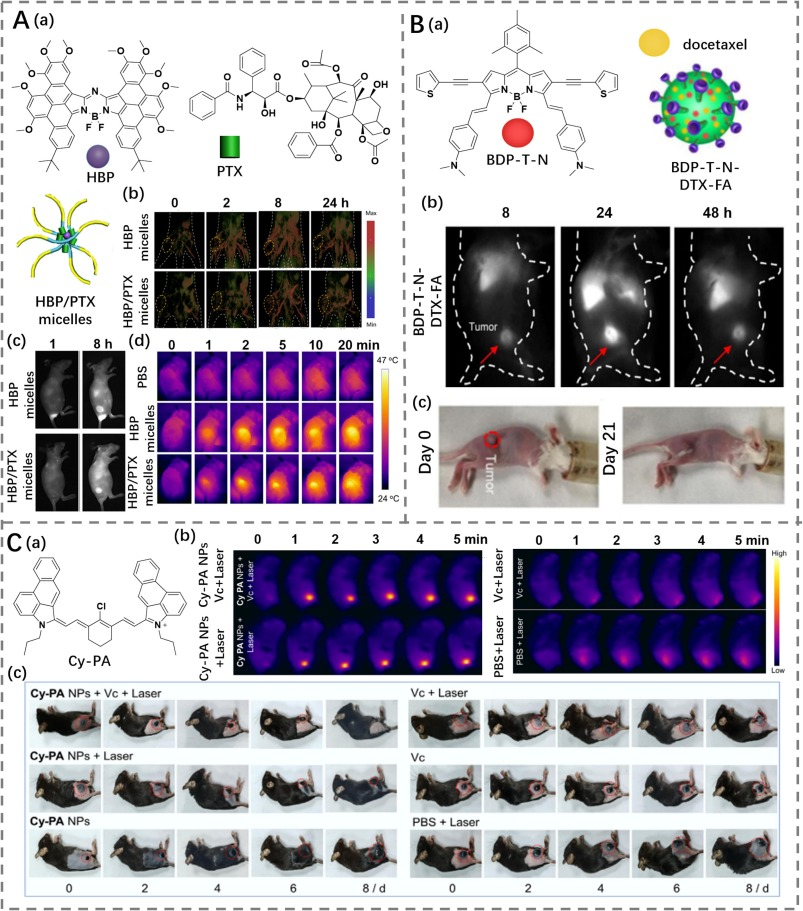
图 29. (A) a) HPB、PTX 的结构以及 HPB/PTX 胶束示意图;b) 荷瘤小鼠分别经 HPB 胶束和 HPB/PTX 胶束处理后,不同时间点的光声成像图;c) 荷瘤小鼠分别经 HPB 胶束和 HPB/PTX 胶束处理后,1 小时和 8 小时的荧光成像图;d) 激光照射下,分别经 PBS、HPB 胶束和 HPB/PTX 胶束处理的荷瘤小鼠的热成像图。(B) a) BDP-T-N 的结构以及 BDP-T-N-DTX-FA 示意图;b) 荷瘤小鼠经 BDP-T-N-DTX-FA 处理后的荧光成像图;c) 治疗前后荷瘤小鼠的图像。(C) a) Cy-PA 的结构;b) 在有/无激光照射下,分别经 PBS、维生素 C (Vc)、Cy-PA NPs 和 Cy-PA/Vc NPs 处理的荷瘤小鼠的热成像图;c) 各组治疗 8 天后荷瘤小鼠的图像。
PTT 免疫疗法协同疗法
研究人员发现,免疫疗法作为一种新兴的癌症治疗方法,利用患者自身免疫系统的内在能力来攻击癌细胞。研究表明,通过光热剂(PTAs)产生的高温可以诱导免疫原性细胞死亡(ICD),进而通过肿瘤相关抗原和损伤相关分子模式的产生刺激抗肿瘤免疫反应。因此,科学家们认为,将光热治疗(PTT)与免疫疗法相结合提供了一种提高治疗效率的优选方法(图30A)。
在2022年,Tang等人通过对D-A-D NIR-II骨架进行修饰,利用马达单元和屏蔽单元构建了多功能聚集诱导发光材料(AIEgens)BT-DPTQ,该材料表现出优异的光学和光热性能(图30B)(https://doi.org/10.1002/anie.202202614)。
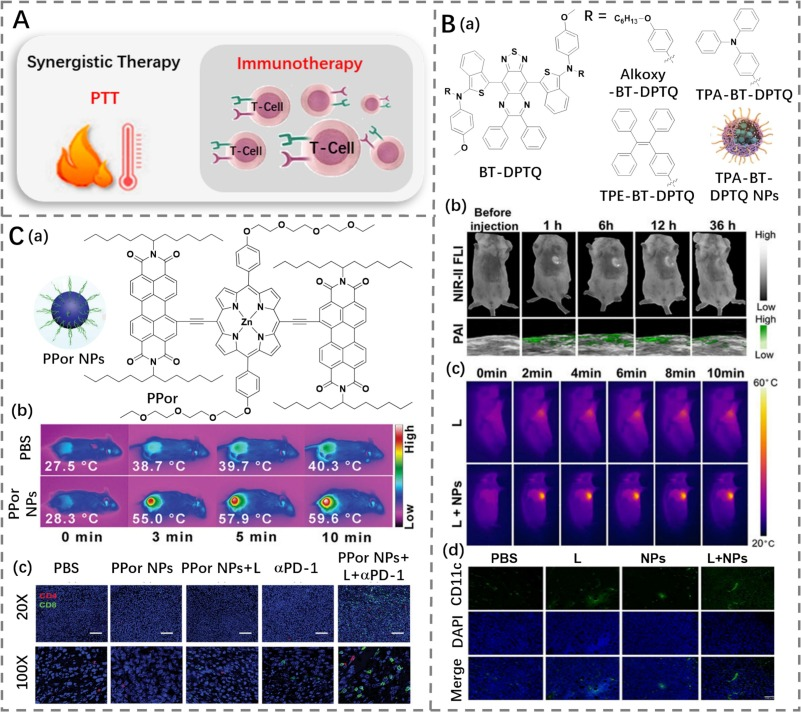
图 30. (A) 光热疗法联合免疫疗法的协同治疗示意图。(B) a) BT-DPTQ 的结构以及 TPA-BT-DPTQ 纳米颗粒的示意图;b) 在不同时间点用 TPA-BT-DPTQ 纳米颗粒治疗的肿瘤的荧光/光声成像;c) 在激光照射下,用 PBS 和 TPA-BT-DPTQ 纳米颗粒治疗的荷瘤小鼠的热成像;d) 不同治疗后 1 天,肿瘤切片中 CD11c+ 细胞和 DAPI 染色的代表性图像。(C) a) PPor 的结构以及 PPor 纳米颗粒的示意图;b) 用 PBS 和 PPor 纳米颗粒治疗的荷瘤小鼠的热成像;c) 不同治疗后肿瘤切片中 CD4+ T 细胞和 CD8+ T 细胞染色的代表性图像。
研究表明,光热剂(PTAs)产生的高温可以诱导免疫原性细胞死亡(ICD),进而刺激抗肿瘤免疫反应。因此,研究人员认为,将光热治疗(PTT)与免疫疗法相结合是一种提高治疗效率的有效方法(图30A)。
在这些研究中,Zeng等人使用PEG化的两亲性卟啉(PPor)(光热转换效率为70%)衍生物,即PPor NPs,用于NIR-II荧光成像引导的癌症PTT-免疫协同治疗(https://doi.org/10.1002/adhm.202102526)。TPA-BT-DPTQ被DSPE-PEG2000-MAL封装后形成的纳米粒子(NPs),显示出优异的水分散性和光电转换效率(PCE)。尾静脉注射后,TPA-BT-DPTQ NPs能够在肿瘤区域聚集并发光,随后在激光照射下迅速升温。这种光热治疗(PTT)激活了免疫原性细胞死亡,促使抗原和损伤相关分子模式的释放,从而启动适应性免疫反应,促进肿瘤治疗。
Fan等人设计了一种膜锚定BBTD衍生剂(CBTs),通过结合四悬挂季铵盐脂质锚来调节其亲水性(https://doi.org/10.1002/anie.202418081)。加热时,该工程分子能锚定到细胞膜上,导致细胞膜破裂,进而触发强烈的持续炎症反应,促进免疫激活和增强癌症治疗效果。
Tian等人的研究则采用了一种GSH激活的聚氨酯材料,内含多二硫键的NIR-II光敏剂CX(光热转换效率为57%),称为CX@PSS(https://doi.org/10.1021/acsmacrolett.4c00251)。这种材料在肿瘤部位响应升高的GSH水平而分解。激光照射后,这一分解过程伴随着温度升高和免疫反应的启动,共同促进了光热免疫疗法的发展,有助于破坏肿瘤结构。
然而,研究人员发现,胶质母细胞瘤内的酸性和免疫抑制微环境显著阻碍了光热免疫疗法诱导免疫原性细胞死亡的能力。为解决这一问题,Zhou等人设计了一种NIR-II染料Hcy1100(光热转换效率为58.7%),并与乳酸氧化酶共载于靶向肿瘤的DSPE-PEG2000-Angiopep-2上,形成了多功能纳米颗粒PLH1100(https://doi.org/10.1002/adfm.202413847)。PLH1100能够在肿瘤部位积聚,便于成像。激光照射后,PLH1100引起快速的温度上升,导致癌细胞的消除和免疫原性细胞死亡的诱导。更重要的是,乳酸氧化酶催化乳酸的消耗,显著降低了酸度并缓解了免疫抑制,促进了效应细胞的浸润和有效的免疫反应,最终贡献于更有效的肿瘤治疗。
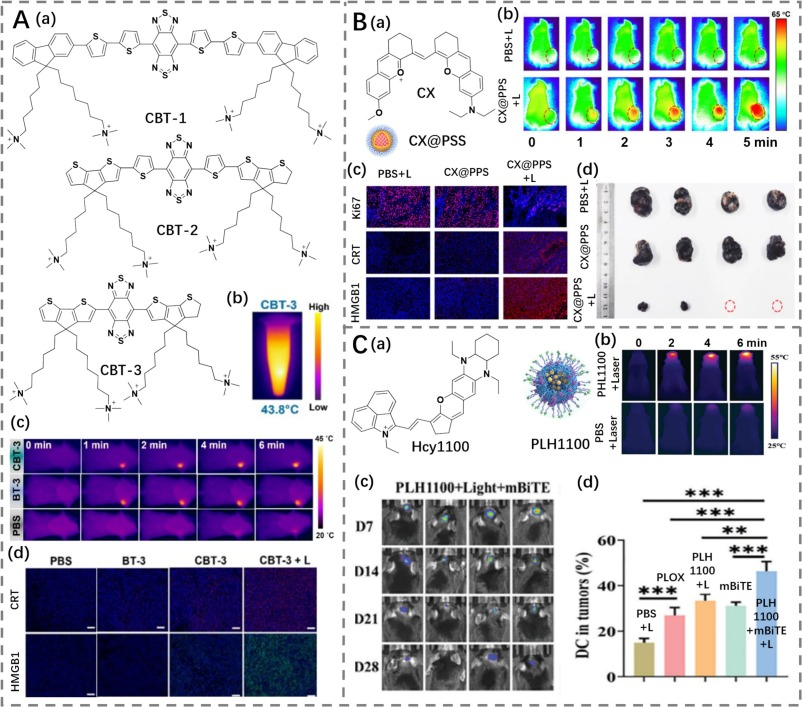
图 31. (A) a) CBT-1-3 的结构式;b) 激光照射后 CBT-3 的热像图;c) 荷瘤小鼠分别经 PBS、BT-3 和 CBT-3 处理后在激光照射下的热成像;d) 不同处理后肿瘤切片中钙网蛋白 (CRT) 和高迁移率族蛋白 B1 (HMGB1) 染色的代表性免疫荧光图像。(B) a) CX 的结构式及 CX@PSS 的示意图;b) 荷瘤小鼠分别经 PBS 和 CX@PSS 处理后在激光照射下的热成像;c) 不同处理后肿瘤切片中 CRT、Ki67 和 HMGB1 染色的免疫荧光图像;d) 治疗 14 天后肿瘤的图像。(C) a) Hcy1100 的结构式及 PLH1100 的示意图;b) 荷瘤小鼠分别经 PBS 和 PLH1100 处理后在激光照射下的热成像;c) 经 PLH1100 + mBiTE 处理后的同种异体移植生物发光代表性图像;d) 不同处理后 DC 细胞的统计分析。
总结与展望
光热治疗(PTT)作为一种具有低药物抗性和时空可控性的非侵入性癌症治疗方法,展现出巨大潜力。近红外二区(NIR-II)生物窗口因其低自吸收和散射特性,为精准成像引导的PTT治疗提供了机会。近年来,NIR-II光热剂(PTAs)在癌症治疗和成像领域的开发取得了显著进展。它们不仅为肿瘤的可视化和追踪提供了高分辨率成像信号,还在深层组织中实现了有效的癌症治疗效果。本综述总结了NIR-II小分子光热剂,并详细探讨了提升PTT治疗效果的各种策略,包括提高光热转换效率(PCE)、优化生物相容性、增强光稳定性、调节特异性和开发协同治疗剂等。尽管已有多项研究致力于提升NIR-II小分子光热剂的PTT疗效,但在肿瘤治疗领域仍面临一些关键挑战。
第一,NIR-II光热剂的水溶性与其药代动力学行为密切相关,而其肿瘤靶向能力则直接影响治疗效果。 许多NIR-II小分子光热剂通过纳米载体策略增强了水溶性或提高了靶向能力。然而,纳米颗粒也可能被网状内皮系统(RES)捕获,从而延长其在体内的清除时间,导致潜在的器官毒性。因此,采用合理方法提高小分子光热剂纳米颗粒的清除率至关重要,例如调节其尺寸、电荷和表面结构。此外,开发具有优良生物可降解性和低代谢毒性的水溶性、低分子量NIR-II小分子光热剂也显得尤为迫切。
第二,大多数NIR-II小分子光热剂具有较大的共轭骨架,这种骨架会缩小能级间隙,从而扩展波长。 然而,这些光热剂的窄能级间隙特性使其在PTT过程中容易通过光氧化裂解反应发生光降解或光漂白。与聚合物或大分子组装被认为是提高光热剂稳定性的有效方法,但可能会带来代谢问题。因此,通过结构修饰(如调节分子刚性和引入活性氧猝灭基团)来提高有机小分子的稳定性至关重要。
第三,光热剂能够将吸收的光能转化为热量,从而在肿瘤区域产生局部高温以消融肿瘤。 然而,如何在PTT过程中精确调控光照区域以最小化对正常组织的光损伤仍然是一个挑战。因此,研究者们采用了多种靶向策略,以提高NIR-II小分子光热剂在肿瘤部位的特异性,并通过可视化光学信号引导精准PTT,从而避免对正常组织的副作用。然而,目前仅实现了有限的肿瘤富集效果。因此,需要更多地考虑开发合适的靶向增强策略和特异性可激活的光热剂,以减轻副作用。此外,调节光热效率与光学信号之间的平衡,通过成像精准引导PTT以减轻副作用也至关重要。
最后,单模态PTT的应用会导致局部高温的产生,这些高温被用于肿瘤治疗。 然而,这种方法在控制辐射剂量方面面临挑战,因为过高的温度可能会超出有效杀死肿瘤所需的阈值。此外,在癌症PTT过程中,由于温度急剧升高导致热休克蛋白(HSPs)的上调,癌细胞会变得耐热。因此,癌细胞的热敏感性降低,削弱了PTT的治疗效果。这些情况不利于单模态PTT在癌症治疗中的应用。PTT与其他治疗模式(包括PTT-PDT、PTT-化疗和PTT-免疫治疗)的联合应用有望缓解单模态PTT的一些局限性。需要进一步研究以识别和评估新的解决方案。例如,开发PTT-基因治疗可用于探索新的治疗模式,而设计智能协同试剂以实现治疗模式的可控切换和调整,从而实现高效治疗并减少副作用的发生。
综上所述,当前的NIR-II小分子光热剂仍存在一些问题,需要进一步探索以确定其在药代动力学、靶向性和临床前疗效方面的应用。 总之,我们相信NIR-II光热剂的快速发展将为光疗研究和应用提供新的机遇。