阿尔兹海默症荧光探针
摘要
AD是最主要的神经退行性疾病,全球约有60%-80%的痴呆症患者受到该病的影响。由于阿尔茨海默症的发病机制错综复杂,许多生物活性物质受到关注,其中包括淀粉样β斑块(Aβ)、Tau蛋白、金属离子和活性氧/氮/硫物种。针对这些分子的小分子荧光探针的开发已成为诊断和治疗阿尔兹海默症的一条很有前景的途径。尽管取得了重大进展,但AD相关荧光探针领域仍面临挑战。其中一个挑战就是在复杂的生物环境中实现对目标生物分子的高选择性和高灵敏度。此外,还需要进一步研究探针的稳定性、生物利用度和生物相容性等问题,以保证其在临床应用中的有效性。当务之急是进一步创新设计和合成专门针对AD的荧光探针。先进成像技术(如荧光成像)的整合可提高这些探针的灵敏度和空间分辨率,从而促进疾病的早期诊断和进展监测。本综述系统研究了过去五年中开发的多功能荧光探针,重点介绍了它们的结构、特性以及在AD靶向诊断和成像中的应用。通过阐明探针的设计原理和作用机制,我们希望深入了解它们在艾滋病临床研究中的潜在应用。
1.引言
AD是神经退行性疾病中最常见的一种,全球范围内约有60%至80%的确诊痴呆症患者深受其影响。据统计,目前全球有超过5500万人患有痴呆症,而预计到2050年,这一数字将激增至1.39亿。阿尔茨海默症是一种极为复杂的疾病,通常表现为复发-缓解型病程。其最主要的风险因素是年龄增长,随着年龄的增长,罹患阿尔茨海默症的概率也随之上升。尽管神经科学研究已取得显著进步,但关于阿尔茨海默症的精确分子机制,我们仍知之甚少。
在阿尔茨海默症的初期阶段,患者可能会遇到学习新信息困难、情感淡漠及抑郁等问题。随着病情的逐渐恶化,患者的时间感和空间感将发生显著变化,进而无法胜任工作,最终丧失全部生活技能。该病的成因复杂多样,涉及遗传、环境及生活方式等多种因素的相互作用。其中,遗传易感性(如APOE基因的存在)是晚发性阿尔茨海默症的重要风险因素,而晚发性病例占据了大多数。此外,环境因素和生活方式,包括饮食习惯、睡眠模式以及肠道微生物群的状况,也被视为潜在的致病因素。与年龄相关的蛋白质代谢变化、淀粉样蛋白级联反应、Tau蛋白异常及氧化应激等分子事件均与阿尔茨海默症的发病机制紧密相关。
Aβ蛋白和Tau蛋白本是健康脑组织的正常组成部分。然而,当Aβ蛋白过度累积且Tau蛋白发生异常磷酸化时,神经元细胞将发炎、受损并最终死亡,从而引发阿尔茨海默症。当前用于诊断阿尔茨海默症的方法,如认知测试和正电子发射断层扫描(PET),均存在一定的局限性,难以实现准确且早期的检测。认知测试依赖于主观评估,可能遗漏疾病早期的细微认知功能下降。而PET虽能提供大脑异常的宝贵信息,但因其昂贵且具侵入性,许多患者难以承受。此外,这些方法还无法实现实时监测或高分辨率成像,这对于深入分析阿尔茨海默症的进展至关重要。
相比之下,用于阿尔茨海默症成像的小分子荧光探针的开发展现出诸多优势。它们能够无创地成像与阿尔茨海默症相关的生物标志物,如淀粉样蛋白-β斑块和Tau缠结,从而实现更早且更准确的疾病检测。此外,荧光探针还能实时展现大脑中的分子变化,为疾病进展和治疗效果的评估提供宝贵信息。其高分辨率成像能力使得对受阿尔茨海默症病理影响的特定脑区进行详细分析成为可能,有助于精确诊断和长期疾病监测。
在过去的二十年里,多种成像技术已被应用于Aβ和Tau聚集的诊断,包括PET、单光子发射断层扫描(SPECT)、磁共振成像(MRI)和荧光成像等。特别是荧光成像技术,作为一种新兴的早期诊断方法,在艾滋病等领域已展现出巨大潜力。与其他诊断技术相比,荧光成像具有高灵敏度、高选择性、优异的信噪比、时空分辨率高、操作简便且能实现实时检测等优势。此外,荧光成像无需依赖昂贵的大型设备,且荧光光谱仪和共聚焦显微镜等设备价格相对低廉,操作简便,因此已成为检测领域的普遍方法,并获得了科学界的广泛认可。与无机纳米材料相比,基于小分子的有机荧光探针无需使用重金属,生物毒性较低,且具有良好的生物兼容性,因此在生物组织的荧光成像方面具有显著优势,广泛应用于蛋白质检测、手术导航及治疗等领域。由于小分子有机荧光探针的合成过程快速且简单,因此在阿尔茨海默症的检测中得到了广泛应用。
阿尔茨海默症的发病机制极为复杂,除上述因素外,金属离子平衡的破坏、活性氧/氮/硫物种(ROS/RNS/RSS)、氧化应激、线粒体损伤及神经炎症等也在其发病机制中发挥着关键作用。通过使用对这些因素敏感的荧光探针,可以进一步验证它们对阿尔茨海默症早期诊断的潜在价值。人体内的金属离子在维持各种生理机制的正常调节功能中起着至关重要的作用,从而确保生长和新陈代谢过程的顺利进行。然而,金属离子浓度的失衡将对人体健康产生严重影响。在阿尔茨海默症患者的大脑中,锌、铁和铜等金属离子的浓度失衡与氧化应激和神经炎症密切相关,对神经元组织和脑细胞造成有害影响。
铁离子参与氧化还原反应,将过氧化氢转化为剧毒的羟自由基,后者通过形成活性氧对大脑造成损害。铜离子以氧化态和还原态存在,能与体内的有机物和蛋白质结合。铜离子平衡的破坏将导致神经元损伤,进而损害大脑功能,其机制涉及儿茶酚胺合成受阻、神经肽激活受阻、结缔组织形成受阻、免疫功能受损以及突触传递受阻等多个方面。锌离子在大脑中积聚在突触处,阻止神经末梢释放突触小泡,从而损害神经元活动。过量的锌离子已被证实会加剧细胞外液的神经毒性并影响蛋白质的聚集。在阿尔茨海默症患者中,锌离子浓度超过300nM会促进Aβ在斑块中的沉积。
氧化应激被认为是神经退行性疾病的重要病因之一,在阿尔茨海默症的发病机制中发挥着重要作用。羟自由基、过氧化氢、过氧自由基、一氧化氮等活性氧自由基(ROS)、活性氮自由基(RNS)和活性硫自由基(RSS)的浓度紊乱会导致细胞抗氧化机制失衡,从而引发氧化应激、分子氧化和组织损伤。在阿尔茨海默症患者的大脑中,不同程度的蛋白质、脂质、DNA和RNA氧化以及线粒体功能障碍最终导致氧化应激,这表明氧化损伤可作为阿尔茨海默症早期检测和诊断的潜在标志物。
本综述旨在全面概述与阿尔茨海默症相关的多功能荧光探针的研究进展,并为从事该领域荧光探针开发和应用的研究人员和临床医生提供全面的资源。通过阐述这些探针的结构特点、成像能力和临床潜力,我们旨在强调开发下一代阿尔茨海默症的诊断和治疗干预措施的紧迫性和重要性。
2.针对阿尔兹海默症相关活性物种的高选择性荧光探针
多功能荧光探针阿尔茨海默症相关活性蛋白的检测中扮演着日益重要的角色,特别是针对淀粉样β斑块和神经纤维缠结这两种被视为AD主要病理特征的物质。这些探针通过提供一种非侵入性的实时手段,使我们能够可视化和量化这些关键蛋白,进而为疾病的早期诊断和进展监测提供了可能。目前,这些探针的应用已不仅限于淀粉样蛋白-β和Tau蛋白,而是扩展到了更广泛的阿尔茨海默症相关生物标记物,包括金属离子、活性氧/氮/硫物种以及胆碱酯酶等,这些物质同样与AD的发病机制紧密相关(表1)。
在设计和开发这些荧光探针时,科研人员需要对结构-性质关系进行深入的研究,以确保探针能够特异性地识别并灵敏地响应目标蛋白质。这些与Aβ和Tau蛋白相关的荧光探针具有显著的优势:它们不仅非侵入性,确保了患者的安全性,而且能够提供更高的分辨率,使我们能够更清晰地观察到目标蛋白在体内的分布和变化。
3.Aβ和Tau靶向荧光探针
开发针对Aβ(β淀粉样蛋白)和Tau蛋白聚集体的荧光探针,已成为AD诊断领域的一个核心研究方向。这些探针的设计初衷在于能够特异性地与AD病理标志物,如Aβ斑块和Tau缠结,实现紧密结合,并在结合后释放出荧光信号,这种信号可以通过多种先进的成像技术进行捕捉和分析。
迄今为止,已有众多针对Aβ聚集体的荧光探针被成功研发出来。然而,相比之下,针对Tau蛋白聚集体的特异性探针则显得较为稀缺,大多数研究资源仍然聚焦于Aβ聚集体的检测上。不过,也有研究取得了突破性的进展,例如探针4PmNO-2,该探针展现出了对Aβ和Tau聚集体均具备的高亲和力以及增强的荧光特性,在体内成像方面表现出了出色的能力。
除此之外,还有其他一些针对Aβ聚集体的高选择性探针也相继问世。这些探针包括基于喹啉-丙二腈结构的近红外荧光探针,以及具有独特供体-π-受体结构的茚满衍生物等。这些探针在Aβ聚集体的检测中表现出了优异的性能。
值得一提的是,PTAD-3****探针所引入的“光触发”策略,更是为Aβ的检测提供了一种全新的思路。这种策略使得探针在光照射的条件下能够迅速响应Aβ纤维,从而实现了对Aβ更加灵敏和准确的检测。这一创新不仅拓宽了荧光探针在AD诊断中的应用范围,也为未来的研究提供了新的启示和方向。
3.1.针对Aβ蛋白的荧光探针
荧光探针在检测与研究Aβ蛋白——这一AD的关键生物标志物——中发挥着不可或缺的作用。开发此类探针,尤其是那些适用于光学成像的探针,对于实现AD的早期诊断以及深入阐明其发病机制具有至关重要的意义。
在已开发的多种荧光探针中,近红外(NIR)探针因其独特的优势而备受瞩目。它们不仅能够实现实时检测,还能提供高分辨率的成像效果,同时避免了放射性照射的风险。特别是苯并噻唑衍生物,因其能与Aβ聚集体发生特异性相互作用,从而改变其发光特性,成为检测Aβ的有效工具。这一点已在体外实验和体内研究中得到了充分的验证。
此外,基于肽的荧光探针也被广泛应用于蛋白质的检测中,其结构与检测原理已得到了广泛的综述。在Aβ蛋白的检测领域,研究人员设计并合成了多种基于BODIPY的荧光探针,其中Sozmen等人开发的EUA系列探针以及Ren等人设计的QAD-1尤为突出。这些探针不仅具有更高的亲和力,还展现出了优异的发光效果。
值得注意的是,QAD-1探针在与可溶性和不可溶性Aβ蛋白结合时,会呈现出不同的荧光特性。这一特性为研究人员提供了进一步区分Aβ蛋白种类的参考依据,有助于更深入地理解Aβ蛋白在AD发病机制中的作用。
3.1.1.以Aβ检测为目标的姜黄素基荧光探针。
姜黄素,作为一种低分子量的橘黄色色素,在体外和体内环境中均展现出了与Aβ原纤维及低聚物的特异性结合能力。其存在两种主要的异构体形态:烯醇形式,它更倾向于与Aβ原纤维结合;以及酮形式,它则更偏好与Aβ低聚物结合。鉴于这些特性,姜黄素及其衍生物已被开发为针对Aβ蛋白的荧光探针。
其中,CRAN3AD是一种广为人知的化合物,它能与Aβ原纤维结合并在体内作为有效的示踪剂。Ni等人的研究表明,姜黄素衍生物CRANAD-2在传统近红外荧光光学成像、Aβ蛋白共定位以及新型成像技术vMSOT(容积多谱段光声层析成像)中,均展现出了预测AD的潜力()。该探针不仅定位精度更高、实时分辨率更强,而且对Aβ的特异性也更为显著。与PIB和氟苯并[b]芘相比,CRANAD-2与其他蛋白质(如白蛋白)的结合倾向性更低,尽管后两者在Aβ蛋白成像方面也有一定效果。此外,当这种化合物与放射性物质结合时,还能在PET(正电子发射断层扫描)中精确追踪Aβ,提供精准的靶向结果。
另一方面,Dai及其团队合成了一种稳定的酮型姜黄素衍生物——Shiga-Y51()。他们发现,这种化合物在穿越血脑屏障(BBB)后,更容易与可溶性Aβ寡聚体结合。这一发现强调了可溶性Aβ寡聚体在AD发病机制和治疗中的关键作用,预示着这种新型化合物在未来有望得到广泛应用。
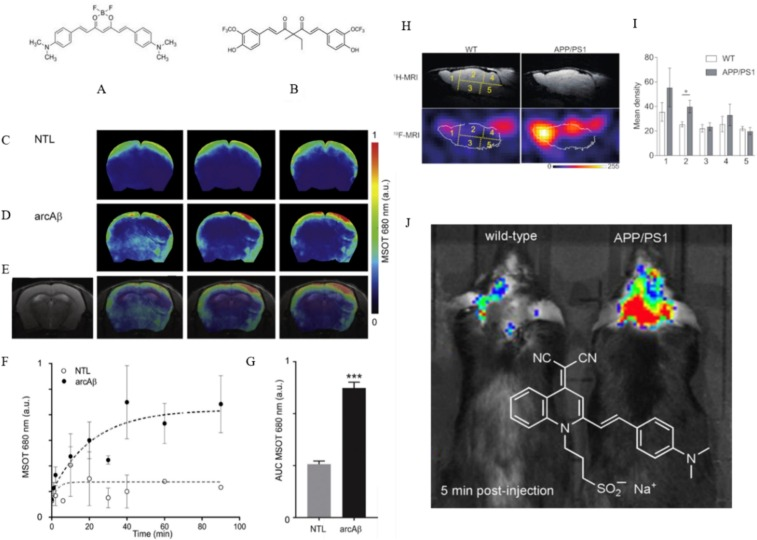
图1. CRANAD-2和Shiga-Y51的化学结构及其成像
3.1.2.以Aβ检测为目标的喹啉-丙二腈基荧光探针
喹啉-丙二腈(QM)被用作设计针对Aβ蛋白检测的荧光探针的基础。Xu等人成功合成了两种QM衍生物——TM-1和TM-2,这两种衍生物均具备分子内电荷转移(ICT)效应,能够发出高强度的红外荧光,从而实现对Aβ蛋白的检测。然而,值得注意的是,这两种衍生物都具有一定的细胞毒性。尽管TM-1和TM-2在结构上仅有细微差异,但这却导致了它们在水溶液和有机溶剂中光学性质的显著差异。具体而言,与TM-2相比,TM-1展现出了更高的局部荧光强度和更低的背景荧光,因此,TM-1被证明是比TM-2更为灵敏的Aβ蛋白荧光探针。
此外,Dou等人则对QM衍生物进行了聚集诱导发光(AIE)改造,使其能够用于Aβ蛋白的检测。在这个过程中,EDS和MoS2在水溶液中自组装形成了平面复合结构。当这种复合结构与Aβ蛋白结合后,荧光强度显著增强了19倍。同时,该复合结构还展现出了更强的穿越血脑屏障(BBB)的能力。基于EDS的“芯片状”结构不仅有效地穿越了BBB,促进了中枢神经系统的进入,还进一步提高了荧光强度和检测的灵敏度。
到了2023年,Fang等人又设计并合成了一种新型荧光探针PTPA-QM。该探针以QM为底物,能够迅速地在小鼠脑细胞中观察到Aβ蛋白,并且具有较低的细胞毒性。PTPA-QM作为一种AIE探针,其荧光强度得到了明显的增强()。与此同时,Yan等人也合成了一种名为QM-FN-SO3的荧光探针,这是另一种QM衍生物。该探针同样具有AIE特性,具有高灵敏度和强荧光强度的特点。然而,它也存在着激发光引起的自淬灭的问题。尽管如此,QM-FN-SO3在体外和体内应用中均表现出了优越性,对Aβ蛋白具有高亲和力,并且能够有效地穿过BBB()。

图2.A)使用PTPA-QM荧光探针对Aβ进行靶向成像;B)使用QM-FN-SO3荧光探针对Aβ进行靶向成像。
3.1.3.以Aβ检测为目标的苯并噻唑基荧光探针。
Watanabe等人基于苯并噻唑结构,成功合成了三种针对Aβ蛋白的荧光探针。相较于其他近红外荧光探针,这些探针不仅能够特异性地与Aβ蛋白结合并产生荧光,实现Aβ蛋白的定位,还能用于研究AD的病理改变,特别是α-突触核蛋白(α-syn)的沉积情况。在两种PP-BTA衍生物探针——PP-BTA-4和PP-BTA-5中,它们展现出了在近红外区域的卓越荧光性能,且脑内背景荧光极低。此外,这两种探针对于Aβ蛋白和α-syn蛋白沉积的亲和力也得到了显著提升()。
另外,Mallesh等人也合成了一种名为RM-28的苯并噻唑衍生物荧光探针,用于Aβ蛋白的检测(图3B)。该探针在体外和体内实验中均表现出了对Aβ蛋白沉积的高度亲和力。与Aβ低聚物相比,RM-28具有更显著的Aβ蛋白沉积和共定位效应,并且具备穿越血脑屏障(BBB)的能力()。此外,作者还提出了一种创新的思路,即可以利用RM-28作为药物骨架,根据其靶向Aβ蛋白的特性,进一步开发出用于治疗阿尔茨海默症的药物。 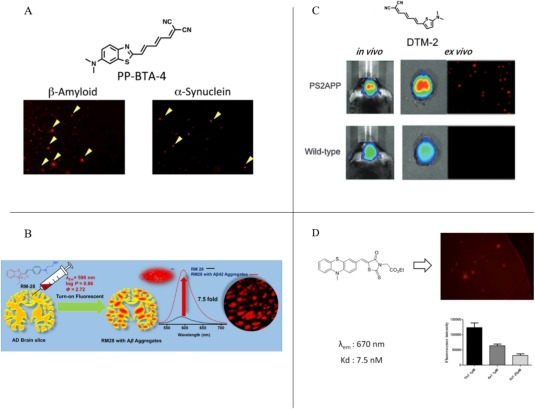 图.3.A)使用PP-BTA-4荧光探针对AD中的Aβ和α-syn进行成像;B)RM-28探针用于检测AD中的Aβ蛋白;C)DTM-2用于AD中Aβ的靶向成像;D)使用PBS4a1荧光探针对AD中的Aβ和α-syn进行靶向成像.
图.3.A)使用PP-BTA-4荧光探针对AD中的Aβ和α-syn进行成像;B)RM-28探针用于检测AD中的Aβ蛋白;C)DTM-2用于AD中Aβ的靶向成像;D)使用PBS4a1荧光探针对AD中的Aβ和α-syn进行靶向成像.
3.1.4.基于二甲氨基噻吩的靶向Aβ检测荧光探针
2015年,Watanabe等人成功合成了一种名为DTM-2的新型荧光探针,该探针以二甲基氨基噻吩为基础,专门用于靶向Aβ蛋白。DTM-2展现出对Aβ蛋白的高亲和力,能够高效地穿过血脑屏障(BBB),并且具备与Aβ蛋白结合及精准定位的特性()。
3.1.5.以Aβ检测为目标的吩噻嗪基荧光探针。
Dao等人研发了一种吩噻嗪衍生物荧光探针,该探针具备多重功能:它能有效抑制Aβ的聚集过程,阻止Aβ的沉积,并具备降解Aβ复合物的能力。报告中详尽阐述了数种新型近红外荧光探针的设计思路、合成方法及性能评估结果。这些探针在磷酸盐缓冲溶液(PBS)中的最大发射波长普遍超过650nm,这一特性对于近红外荧光探针而言极为有利。在孪生转基因小鼠的大脑和视网膜组织切片实验中,该探针展现出了对Aβ聚集体的极高亲和力(Kd=7.5nM),同时表现出卓越的靶向Aβ斑块的能力()。实验数据进一步证实,这些化合物不仅能有效抑制Aβ纤维的形成,还能分解已经形成的Aβ纤维。因此,这些吩噻嗪衍生物荧光探针有望成为诊断和治疗阿尔茨海默症的新型药物,为医学界带来新的希望。
3.1.6.与D-π-A电子结构相关的Aβ蛋白靶向探针
Mallesh及其团队成功合成了具备D-π-A电子结构的AR探针系列。其中,AR-14展现出了对可溶性和不可溶性Aβ蛋白的双重亲和力,而AR-7和AR-11()则专门针对不可溶性Aβ蛋白,表现出选择性的亲和力。
此外,Yue等人也研发了一种D-π-A结构的荧光探针,该探针在Aβ蛋白沉积斑块上展现出了选择性的亲和力,同时具备高特异性的定位能力,并能从脑组织中迅速吸收和清除。另一项研究中,Lv等人合成了一种名为DCM-AN的荧光探针,它专门用于选择性靶向Aβ寡聚体。该探针结合了发光分子二氰亚甲基-4H-吡喃(DCM)和具有特定立体阻碍效应的结合分子氨基萘(AN)()。与此同时,Ji等人创新性地合成了一种名为的双乙酰基修饰的四苯基乙烯(TPE)分子,它同样是一种D-π-A结构的荧光探针,内含两个丙二腈分子。TMNL探针因具有聚集诱导发光(AIE)效应,而表现出高灵敏度和高选择性。
到了2020年,Wang等人又合成了两种基于喹啉的AIE荧光探针FA,专门用于Aβ斑块和脂滴的成像。这些探针采用二甲胺作为电子供体,氰基作为电子受体,以及喹啉酮乙烯基苯作为π-共轭化合物,共同构成了D-π-A结构。这两种荧光探针均能对Aβ聚集体产生荧光反应,尤其是FB探针,它对Aβ聚集体表现出了极高的选择性和亲和力,检测限低至26.9nM。此外,FB探针还能在AD转基因小鼠的细胞和大脑层面上清晰地成像β淀粉样蛋白斑块和脂滴,进一步的研究还表明,莫能菌素或霉菌病的刺激会导致细胞粘度的增加()。
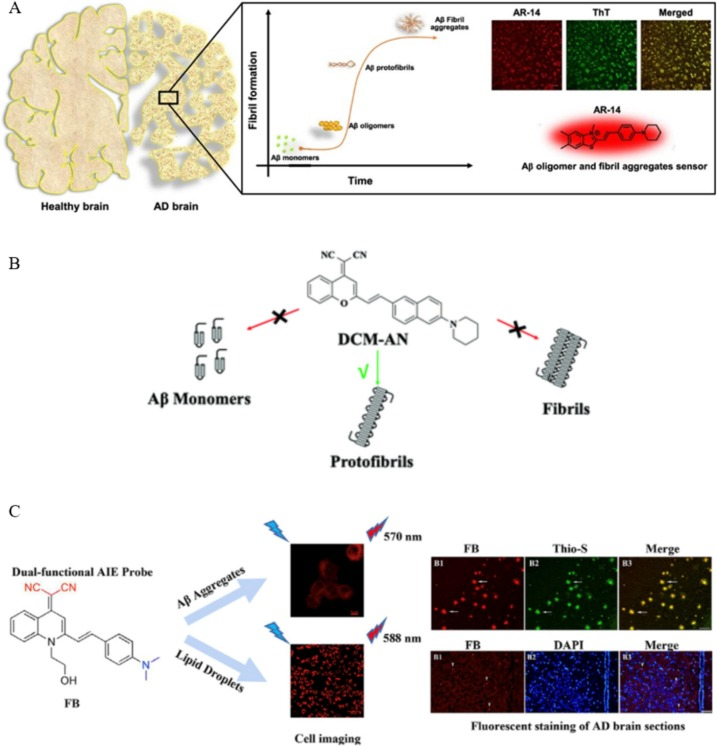
图4.A)使用AR荧光探针对Aβ进行靶向成像;B)使用DCM-AN荧光探针对Aβ进行靶向成像;C)使用FA荧光探针对AD中的Aβ进行靶向成像。
3.1.7.以Aβ检测为目标的螺吡喃基荧光探针
Lv等人成功合成了一种名为AN-SP的螺吡喃衍生物荧光探针,该探针专门设计用于定位可溶性原纤Aβ蛋白寡聚体。AN-SP探针利用了螺吡喃(SP)适当的立体阻碍效应,能够精准地锚定在Aβ蛋白寡聚体上,这对于检测这种与疾病发展预后密切相关的高神经毒性蛋白化合物尤为重要()。值得注意的是,该探针并不会与Aβ蛋白沉积斑形成荧光聚集体。此外,体内实验结果显示,AN-SP探针具有良好的血脑屏障(BBB)通透性和低细胞毒性,这为其在临床环境中用于早期阿尔茨海默症诊断提供了有力支持。
Yang等人提出了一个创新性的观点,即从Aβ寡聚体的X射线衍射图样中可以观察到其空间结构中的三角形空腔,并据此确定了Aβ蛋白寡聚体独有的结构特征——Phe19/Val36残基。基于这一理念,他们设计了一系列名为PTO的化合物,这些化合物具有针对Aβ蛋白寡聚体的“V形”结构。其中,PTO-29是一种化学性质稳定、发射波长长且发光特性稳定的化合物。初步的小鼠体外和体内实验表明,PTO-29不仅具有良好的发光稳定性和靶向特异性,还展现出了优异的BBB渗透性和较低的细胞毒性。这些特性使得PTO-29成为一种极具潜力的荧光探针,可用于靶向Aβ寡聚体,并在未来具有广泛的潜在临床应用价值。
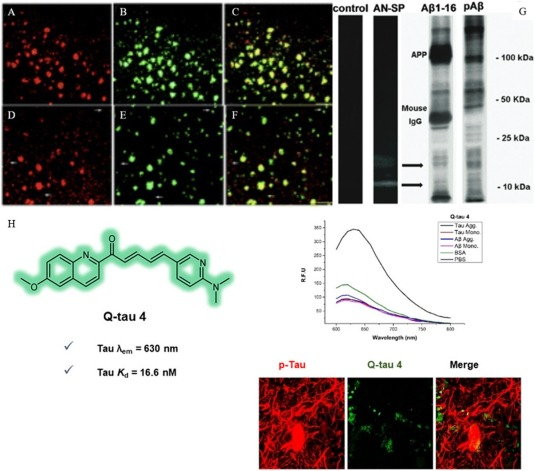
图5.A-G)在AD中使用AN-SP荧光探针对Aβ进行靶向成像;H)利用Q-Tau4荧光探针对AD中的Tau进行靶向成像.
3.2.针对Tau蛋白的荧光探针
阿尔茨海默症的发病机制中,Tau蛋白扮演着另一个至关重要的角色。当Aβ蛋白沉积并形成斑块时,原本在正常脑功能中发挥关键作用的Tau蛋白会发生构象变化。而这种异常的过度磷酸化正是导致Tau蛋白转变为致病形式的关键因素。
尽管Aβ蛋白荧光探针的研究领域正在不断拓展,但针对Tau蛋白特异性定位的研究却相对匮乏。这主要是因为Tau蛋白与Aβ蛋白在结构上存在诸多相似之处,这无疑为开发Tau蛋白特异性探针带来了极大的挑战。然而,在2021年,Ahmed等人取得了突破性进展,他们成功合成了一种名为Q-Tau4的新型化合物,这是一种基于喹啉的荧光探针(Q-Tau),专为Tau蛋白设计。实验结果显示,Q-Tau4对Tau蛋白的亲和力远超Aβ蛋白,这充分展示了其作为Tau蛋白特异性荧光探针的巨大潜力。进一步的体外实验还表明,Q-Tau4与异常磷酸化的Tau抗体()之间存在显著的正相关性,这进一步增强了其在阿尔茨海默症诊断中的应用价值。
此外,Nilsson等人合成的低聚噻吩PBB3杂化物——双噻吩-乙烯基苯并噻唑/苯并咪唑(bTVBTs/bTVBIs)也被证实具有类似的效果。这些化合物能够有效区分由Aβ蛋白沉积形成的神经原纤维缠结(NFT)与体外脑组织中的Tau蛋白,并能使荧光探针与Tau蛋白分子实现共定位。同时,一些姜黄素衍生物也被发现能够定位Tau蛋白,且其亲和力高于Aβ蛋白。这些化合物不仅对Tau蛋白具有适度的亲和力,还具备良好的血脑屏障(BBB)渗透性,因此非常适合用于Tau蛋白的定位和追踪。
另一方面,BODIPY衍生物也被广泛应用于Aβ蛋白和Tau蛋白的研究中。作为一种出色的近红外发光成像分子,BODIPY凭借其优良的光学特性,在研究这两种蛋白的过程中发挥了重要作用。
4.基于ROS/RNS/RSS的用于诊断阿尔兹海默症的荧光探针
ROS/RNS/RSS是一类在信号转导、免疫系统调节及细胞凋亡等生理过程中发挥着关键作用的小分子。近年来,随着对ROS/RNS/RSS作用机制的深入研究,人们发现这些小分子与多种疾病的发病机理紧密相关。尤为值得关注的是,作为一类复杂的神经系统疾病,AD的发病过程高度依赖于ROS/RNS/RSS水平的异常波动。针对ROS/RNS/RSS的荧光探针在AD治疗中的应用已逐渐成为研究热点,具体探针信息参见表3。
2021年,Shin及其研究团队成功开发出一种对超氧化物高度敏感的荧光分子探针——苯磺酰化间苯二酚衍生物(BSRs)。该探针能够实现对神经变性过程中氧化过程的光学生物成像,其检测机制基于亲核裂解反应以捕获超氧阴离子(O2-)。通过在7-羟基位置引入化学基团,研究团队巧妙地淬灭了间苯二酚的荧光,并探索了一系列可根据目标分析物选择性裂解的BSR激活荧光探针。其中,BSR6以其高灵敏度和特异性脱颖而出。实验结果显示,PMA能够在炎症刺激过程中有效检测内源性O2-。此外,研究小组还发现,与对照组相比,脂多糖(LPS)在小鼠腹膜组织中诱导的O2-水平显著升高。更值得一提的是,BSR6探针还被成功应用于经低聚Aβ和4-羟基壬烯醛(HNE)处理的Bv2细胞,以鉴别氧化事件相关神经变性中的O2-,并实现了对神经变性引起的氧化事件的可视化生物成像。
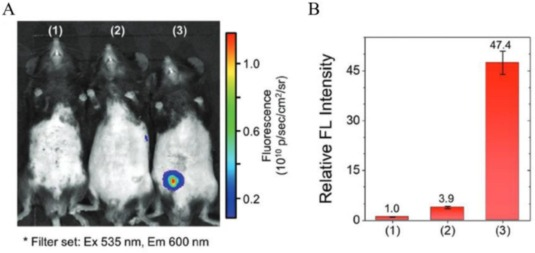
图6.利用BSR6荧光探针对AD中的ROS进行靶向成像。
与此同时,Dang等人则开发了一种用于近红外检测甲基乙二醛(MGO)的荧光探针DBTPP。该探针采用噻二唑缩合的苯二胺化合物作为高灵敏度的MGO识别分子,能够准确追踪SH-SY5Y细胞中外源性和内源性MGO的动态变化。此外,DBTPP探针还成功应用于转基因小鼠AD模型的内源性MGO检测,这一发现揭示了MGO作为早期诊断生物标记物的巨大潜力。DBTPP探针在375纳米处展现出单一的吸光度峰,加入MGO后,峰值波长红移至500纳米,并伴随明显的颜色变化。在500纳米波长激发下,由于电子推拉强度减弱,DBTPP的荧光发射几乎可以忽略不计。然而,加入MGO后,波长在550纳米至850纳米之间的荧光强度显著增强,同时在紫外线照射下,颜色从淡绿色明显转变为红色。
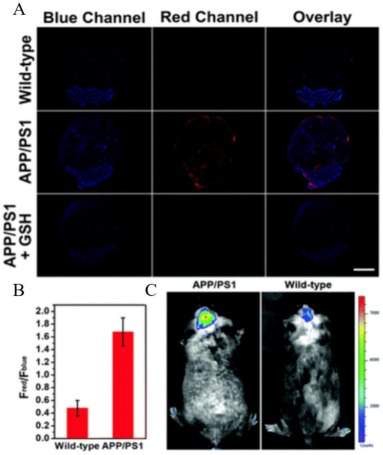 图.7.利用BSR6荧光探针对AD中RSS的靶向成像。
图.7.利用BSR6荧光探针对AD中RSS的靶向成像。
2022年,Xie等人通过巧妙合成含有羟基吲哚基团的萘胺荧光团簇,成功设计出一种针对过亚硝酸盐(ONOO-)的双光子荧光探针。这款基于萘酰亚胺的双光子荧光探针展现了对ONOO-的高度特异性和快速荧光响应能力。它不仅能够有效穿透双光子成像系统,还具备穿越血脑屏障(BBB)的特性。活细胞成像实验有力证明了,在3-盐酸吗啉胍(SIN-1)和Aβ肽的刺激下,该探针能够清晰捕捉到PC12细胞内ONOO-的峰值变化。此外,研究还发现,抗坏血酸、咖啡酸和尿酸这三种天然产物能有效抑制ONOO-的过量表达,同时GPX4的表达量也有所增加,进而减弱了Aβ诱导的神经元铁凋亡。尤为重要的是,NATP探针成功穿越了BBB,通过原位和活体脑成像技术,直观展示了活体动物及活体大脑中ONOO-的实际水平。研究结果显示,阿尔茨海默症模型小鼠在年仅4个月大时,其大脑内就已出现了ONOO-应激反应。
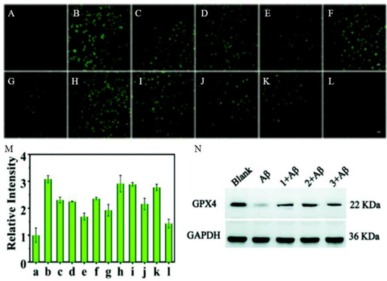 图.8.使用NATP荧光探针对AD中ONOO-的靶向成像。
图.8.使用NATP荧光探针对AD中ONOO-的靶向成像。
Wang等人则研发出一种活性荧光探针Rd-DPA3,该探针通过结构调控策略得以激活。在0.3mM的其他活性氧(ROS)物质和多种蛋白质共存的环境中,Rd-DPA3仍能与ONOO-发生排他性反应,实现显著的荧光增强(F/F0=50)。Rd-DPA3结构的特点在于其分子小巧且亲油性可调,这使得它能够轻松穿越生物屏障,包括血脑屏障。因此,Rd-DPA3成为监测AD患者大脑中ONOO-波动的一种极具价值的体内工具。通过在不同干扰蛋白和不同pH值的实验介质中进行测试,研究验证了Rd-DPA3荧光的特异性、稳定性和选择性均表现优异。荧光成像结果显示,Rd-DPA3在线粒体中积累,并能有效检测到在SIN-1或LPS/PMA/干扰素-γ刺激下的活PC12细胞中外源性和内源性ONOO-。此外,随着APP/PS1小鼠年龄的增长,AD症状逐渐加重,这表明ONOO-的自然水平与AD的脑衰老进程呈正相关。值得一提的是,两种用于治疗阿尔茨海默症的药物——喹啉和姜黄素,已被证实能有效抑制ONOO-的产生。
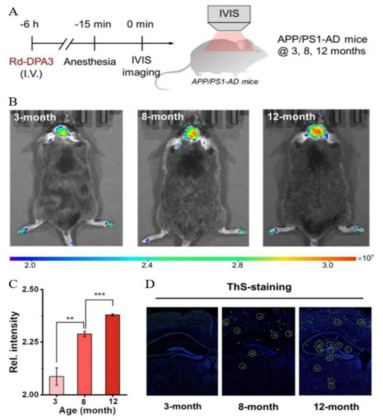 图9.使用Rd-DPA3荧光探针对ONOO-进行靶向成像。
图9.使用Rd-DPA3荧光探针对ONOO-进行靶向成像。
在另一项最新研究中,Chem及其团队开发了一种名为DCO-POT的近红外荧光探针,用于可视化监测线粒体中的ONOO-活性。当ONOO-活化时,近红外荧光团DCO-CHO会从探针中释放,并在670纳米波长处发出强烈的近红外荧光。特别是在炎症过程及AD小鼠模型中,该探针在细胞和机体水平上对ONOO-的产生进行了深入分析。凭借其出色的体内可视监测特性,DCO-POT成为研究ONOO-病理生理作用的理想工具。
在最近发表的一篇研究论文中,Lu及其研究团队详细介绍了一种新型NO触发药物,该药物专为治疗AD而设计。实验过程中,当将200μM的NO水溶液加入到DPAC溶液(浓度为10μM,溶剂比例为水/MeCN=99:1)中时,原本无色的溶液迅速转变为淡黄色。紧接着,荧光强度在480纳米波长下显著下降,五分钟内降低了26.1%。这一观察结果暗示,与NO发生反应后,该探针会经历NO介导的分解代谢过程,从而释放出抗AD药物美金刚,并相应地减少DPAC的荧光强度()。这一特性使得该探针不仅具备出色的NO成像能力,还兼具抗AD治疗效果。这主要归功于AD组织中NO的精确定位能力,以及药物治疗与NO对抗之间的协同作用。
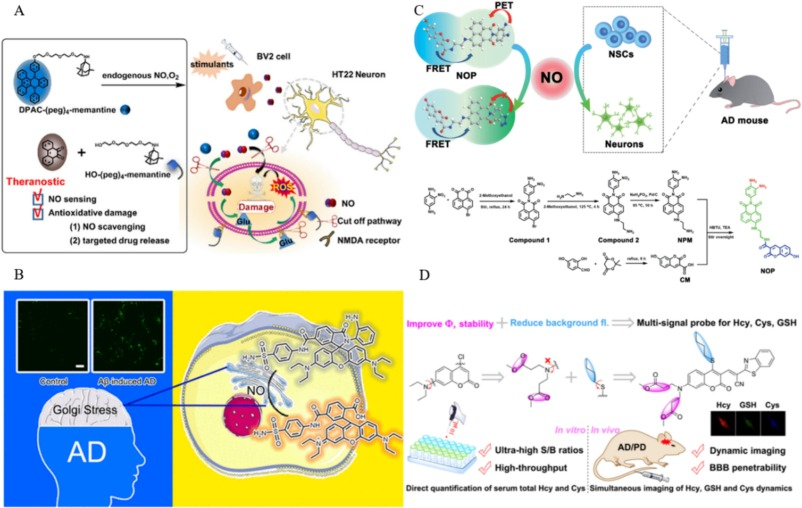 图.10.A)DPAC荧光探针;B)Golgi-NO荧光探针及其靶向成像;C)NOP荧光探针对NO的靶向成像;D)MPTP荧光探针对AD中Hcy、GSH和Cys的靶向成像。
图.10.A)DPAC荧光探针;B)Golgi-NO荧光探针及其靶向成像;C)NOP荧光探针对NO的靶向成像;D)MPTP荧光探针对AD中Hcy、GSH和Cys的靶向成像。
2022年,He及其团队设计了一种名为Golgi-NO的新型荧光探针,旨在观测AD模型中的一氧化氮(NO)。该探针通过NO的环化和水解反应,形成高荧光性的罗丹明衍生物来实现识别。体外检测结果显示,Golgi-NO探针对NO具有高灵敏度和卓越的选择性。实验证明,该探针主要在高尔基体内聚集,能够有效检测SH-SY5Y和HepG2细胞中外源性和内源性高尔基体应激诱导产生的NO()。此外,在Aβ刺激的AD细胞模型中,该探针也成功观测到了NO的过量生成。
Liang等人则开发出一种基于荧光共振能量转移-光诱导电子转移(FRET-PET)原理的双光子比例荧光探针NOP,用于实时观测和量化NO。该荧光受体能够选择性识别NO和香豆素(CM,一种荧光供体)。当NOP与NO反应后,455纳米波长处的双光子荧光(TPF)强度显著降低,而535纳米波长处的TPF强度则显著增强。在表皮生长因子(EGF)和碱性成纤维细胞生长因子(bFGF)诱导的神经干细胞(qNSCs)活化过程中,NOP探针展现出了与NO浓度成比例的反应特性。研究还发现,AD小鼠大脑中的齿状回(DG)区域NO浓度明显低于海马下托(S1BF)、海马CA1区、尾状核壳(CPu)和外侧背盖区(LD)等区域(C)。激活qNSCs以增加AD小鼠体内的NO水平,可显著改善其症状。这一发现为通过调节大脑DG区域的NO水平来治疗AD提供了新的可能。
2021年,Yin等人研发出一种具有多个结合位点的荧光探针,能够同时对半胱氨酸(Cys)、同型半胱氨酸(Hcy)和谷胱甘肽(GSH)的动态变化进行荧光成像。该探针由苯并噻唑单元和经过N,N-二甲基丙酸酯及正丁硫基修饰的香豆素荧光团构成。其识别机制在于,这些硫醇的-NH2和-SH基团能够引发取代和加成反应。由于蛋白质结构差异,探针在与Cys(453纳米)、Hcy(542纳米)和GSH(513纳米)反应时,会发出明显不同的荧光,从而实现对这些硫醇的区分和检测。研究结果表明,在AD小鼠脑组织中,Hcy和Cys的浓度有所升高,而GSH的浓度则略有下降()。这些发现为探索Hcy/Cys/GSH与AD之间的关联性提供了有力证据。
5.用于诊断阿尔兹海默症的金属离子敏感荧光探针
体内金属离子平衡的紊乱是驱动Aβ肽聚集以及AD中观察到的相关淀粉样蛋白级联反应的关键因素。此外,金属离子代谢的异常还会促进活性氧(ROS)的生成,加速Aβ蛋白的聚集与沉积。鉴于此,研究人员设计了一系列金属离子荧光探针(如表4所示),旨在作为金属复合物来调节Aβ蛋白的聚集过程,从而缓解阿尔茨海默症 的症状。
2021年,Peng及其团队成功开发了一系列以8-羟基喹啉、吡啶或咪唑为螯合剂,苯并咪唑为识别单元的多吡啶基-Ru(II)复合物,用于治疗阿尔茨海默症。这些复合物能够有效捕获Aβ中的Cu2+,并在与Cu2+配位后形成二聚体,展现出高效的Cu2+外流能力和Aβ组装抑制作用。此外,这些合成复合物还被证实能够抑制Aβ产生ROS,保护线粒体免受损害,并提升神经元的存活率。该研究为通过Cu2+螯合作用开发新型淀粉样蛋白抑制剂提供了有力支持。
Yu等人则研发了一种基于钌复合物的发光探针Ru-fipc,该探针能够在单个纤维水平上精确成像整个聚集过程,包括成核、低聚和纤维化阶段。Ru-fipc的光物理特性在可见光区域具有吸收能力,最大吸收波长约为454纳米(摩尔吸光系数为40,300M-1cm-1),并在600纳米处呈现强烈的荧光发射(激发波长为454纳米,荧光量子产率为0.088)。此外,Aβ(单体、低聚体、纤维)和牛血清白蛋白(BSA)的存在对Ru-fipc的荧光发射无明显影响。值得注意的是,铜离子对Aβ的聚集过程具有显著影响。研究表明,Cu2+离子能够加速现有聚集体的聚集,但聚集体的具体形态取决于Aβ和Cu2+的浓度。在Aβ浓度较高时,Cu2+会促进无定形低聚物的生成(如图11所示)。相反,在Aβ浓度较低时,低于化学计量的Cu2+离子则会刺激纤维的形成。  图.11.在AD中使用Cu2+荧光探针对Aβ进行靶向成像.
图.11.在AD中使用Cu2+荧光探针对Aβ进行靶向成像.
Shao及其团队精心设计了一种三叉钌配合物2,该配合物由三个独特的双叉配体和一个1,10-菲罗啉配体(phen)巧妙构成。值得注意的是,phen配体凭借其刚性的平面结构,不仅显著增强了探针的发光性能,还极大地促进了其与Aβ原纤维之间的相互作用。该探针的激发态因电子丰富、配体诱导以及能量分离的特性,而展现出了独特的双重发射模式:在415纳米波长处呈现出高能发射带,同时在650纳米波长处则显示出低能的三态金属配体电荷转移(3MLCT)发射带。当探针与Aβ40混合后,随着培养时间的推移,这两个发射带均会出现明显的波动和增强现象。这一现象主要归因于dppz配体与Aβ原丝疏水微环境之间的相互作用,这种相互作用有力地促进了3MLCT发光的增强。
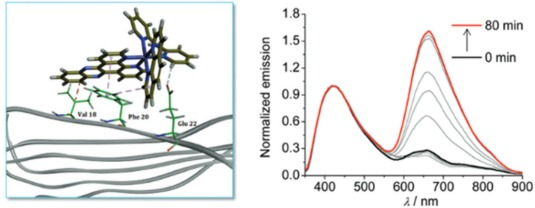 图.12.在AD中使用三叉钌复合物荧光探针对Aβ进行靶向成像。
图.12.在AD中使用三叉钌复合物荧光探针对Aβ进行靶向成像。
Pradhan等人成功合成了一种基于罗丹明B(Rh-BT)的螯合物探针,该探针将罗丹明与苯并噻唑巧妙结合,形成对淀粉样蛋白-β(Aβ)聚集体具有高度识别能力的基团。实验观察发现,这种分子能够有效剥离Aβ-Cu2+复合物中的氧化还原活性金属离子,进而抑制Aβ的自组装过程,包括阻止毒性低聚物和纤维状聚集体的形成。通过精确计算检测限(LOD),研究团队确定Rh-BT对Cu2+的检测灵敏度高达11nM。
此外,Rh-BT探针能够与Aβ肽发生特异性相互作用,有效抑制由金属离子诱导的活性氧(ROS)生成以及Aβ-Cu2+()复合物触发的细胞毒性。这些发现充分展示了Rh-BT探针的多功能性,其关键在于其具备的β特异性识别基团。
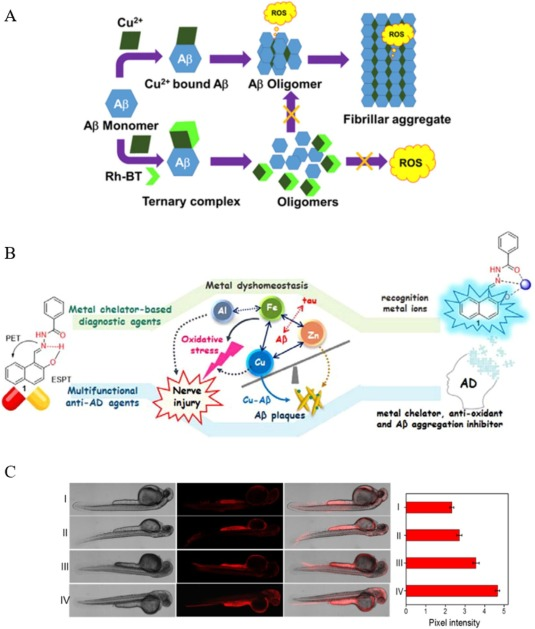 图.13. A)使用Rh-BT荧光探针对Aβ-Cu2+复合物进行靶向成像;B)使用N-(蒽-9-亚甲基)苯甲酰肼荧光探针对AD中的Cu2+进行靶向成像;C)在AD中使用DDP荧光探针对Cu2+进行靶向成像.
图.13. A)使用Rh-BT荧光探针对Aβ-Cu2+复合物进行靶向成像;B)使用N-(蒽-9-亚甲基)苯甲酰肼荧光探针对AD中的Cu2+进行靶向成像;C)在AD中使用DDP荧光探针对Cu2+进行靶向成像.
Kou等人基于光诱导电子转移(PET)和激发态质子转移(ESPT)原理,精心合成了一种针对Al3+测量的高选择性、高灵敏度萘酚基团荧光传感器探针。这种多功能探针是一种萘酚衍生物,其结构中的羟基、亚胺基和羰基作为金属离子的螯合剂,能够显著增强对Al3+的荧光响应(检测限低至0.01ppm)。与姜黄素相比,该探针的金属离子螯合作用更为显著,对Cu2+诱导的Aβ1-42积累表现出更强的调节作用。此外,它还展现出增强的活性氧清除能力,使活细胞荧光图像更加清晰,同时降低了细胞毒性,并提高了血脑屏障(BBB)的通透性。
另外,研究人员还以蒽衍生物为基础,利用亚胺和羰基作为螯合位点,成功合成了一种蒽-9-亚甲基N-(蒽-9-亚甲基)苯甲酰肼探针。该探针不仅能够检测Cu2+,还能有效抑制Aβ聚集并消除活性氧(ROS),显示出在AD诊断和治疗方面的巨大潜力。
Zhou等人则合成了一种高灵敏度、高选择性的荧光探针DDP-Cu,该探针采用二氰异佛尔酮衍生物作为荧光团,2-吡啶羰基作为铜离子的近红外荧光识别和闪烁单元。DDP-OH化合物具有典型的供体-π-受体(D-π-A)结构和大π共轭体系,其最大近红外(NIR)发射峰位于665纳米处。当在DDP-OH中引入2-吡啶羰基后,D-π-A结构转变为受体-π-受体(A-π-A)结构,导致DDP-Cu的荧光发生减弱。研究人员利用这一特性,对患有阿尔茨海默症的小鼠、果蝇和斑马鱼的脑组织中的Cu2+进行了精确的量化和可视化研究。结果显示,AD小鼠和果蝇大脑中的Cu2+水平分别是正常对照组的3.5倍和4倍。这一发现揭示了Cu2+水平升高与ROS产生、Aβ聚集以及神经元细胞毒性增强之间的密切关联,从而进一步阐明了Cu2+与阿尔茨海默症之间的相关性。
6.用于诊断阿尔兹海默症的胆碱酯酶敏感荧光探针
在人脑中,胆碱酯酶扮演着调节神经递质乙酰胆碱代谢的关键角色,主要分为乙酰胆碱酯酶(AChE)和丁酰胆碱酯酶(BChE)两种。其中,BChE主要在大脑白质和神经胶质中表达,并且与AD中观察到的认知和行为障碍存在关联。表5详细列出了针对胆碱酯酶的多种荧光探针。
Yang及其研究团队成功开发了针对BChE的Bhy-1和Chy-1两种探针。这两种探针巧妙地采用了铬苯吲哚/铬吲哚作为荧光团,环丙烷甲酰氯作为识别元件。它们不仅灵敏度高,而且具有良好的生物相容性,检测限(LOD)低至0.12ng/ml,因此非常适合用于BChE的生物成像研究(图14A)。此外,Chy-1探针还被应用于监测AD小鼠模型中的BChE活性。
为了验证Chy-1探针作为组织中BChE检测工具的灵敏度,研究人员在共聚焦成像前,将APP/PS1转基因小鼠(AD模型)和健康小鼠的脑切片与Chy-1一起孵育了10分钟。结果显示,在AD小鼠的脑组织中观察到了显著的荧光信号,而对照组的荧光强度则相对较弱。 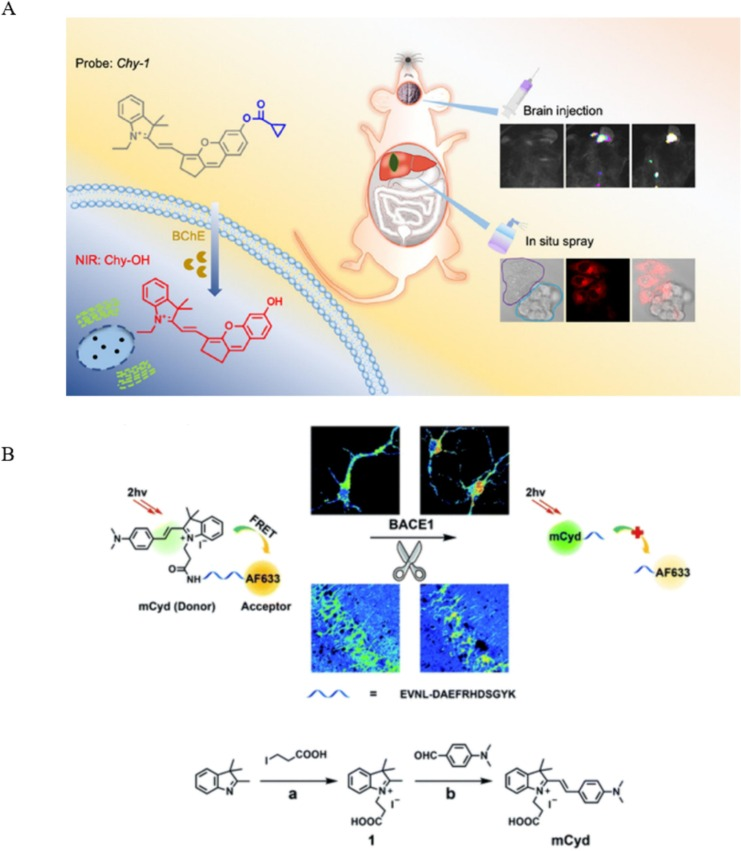 图.14.A)使用Bhy-1和Chy-1荧光探针对AD中BChE的靶向成像;B)使用AF633mCyd荧光探针对AD中的BACE1进行靶向成像.
图.14.A)使用Bhy-1和Chy-1荧光探针对AD中BChE的靶向成像;B)使用AF633mCyd荧光探针对AD中的BACE1进行靶向成像.
Ge及其团队成功研发了一种创新的双光子比例荧光探针——AF633mCyd,该探针专为活细胞及深部组织中β-分泌酶1(BACE1)的可视化检测而设计。此探针巧妙地将AlexaFluor633受体(AF633)与荧光共振能量转移(FRET)系统相结合,其中FRET系统通过一种长度在10纳米以下的多肽底物将新型双光子供体美罗菁华衍生物(mCyd)与AlexaFluor633受体相连。由于mCyd的发射光谱与AF633的吸收光谱完美重叠,AF633-mCyd探针展现出了极高的灵敏度。通过在供体与受体之间巧妙地插入BACE1特异性裂解的多肽底物,该探针实现了对BACE1的高选择性检测。实验显示,AF633-mCyd在578纳米和651纳米处呈现出明显的荧光发射峰,且在0.1至40.0纳摩尔范围内,其发射比与BACE1浓度之间呈现出良好的线性关系,检测限更是低至65.3±0.1皮摩尔。研究结果显示,BACE1在AD小鼠大脑的不同区域(包括初级体感皮层桶状区S1BF、尾状核CPu、外侧下丘脑LD以及海马CA1区)的含量存在显著差异。特别地,BACE1在S1BF和CA1区域的表达显著增强(图14B)。
另一方面,Anyabe等人则开发了一种名为HBAE的探针,作为监测小鼠AD模型中内源性BACE1活性的创新工具。这是首个基于激发态分子内质子转移(ESIPT)机制的近红外荧光探针,为观察AD大脑活体退化过程提供了一种多功能化学仪器。令人惊喜的是,通过高分辨率成像技术,研究人员能够清晰地观察到红色荧光染色在AD模型小鼠海马区的精确位置。这一研究成果为从体内BACE1蛋白中获得功能性见解提供了一种可行的方法,并可用于活动病理过程的成像研究。体外实验结果显示,AD患者海马区BACE1的活性存在显著差异。在海马及其周围区域,通过Fgreen/Fred通道的伪色成像,可以观察到从绿色向红色的转变,这进一步证实了AD小鼠大脑这些区域的BACE1水平明显升高。 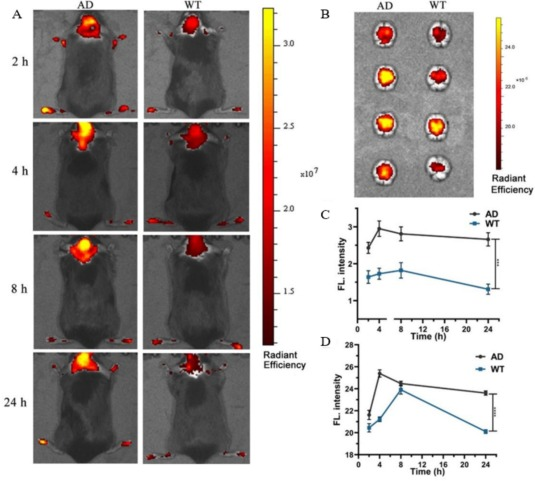 图.15.使用HBAE荧光探针对AD中的BACE1进行靶向成像。
图.15.使用HBAE荧光探针对AD中的BACE1进行靶向成像。
7.用于诊断阿尔兹海默症的纳米颗粒荧光探针
纳米颗粒因其独特的性质,如穿越血脑屏障(BBB)的能力、直接功能化以实现多模态成像的潜力、以及较大的有效载荷和显著的增强效果,已被广泛用作β-淀粉样蛋白(Aβ)斑块的荧光探针,特别是在AD的体内诊断中。表6列出了基于纳米粒子的用于诊断AD的荧光探针的相关信息。
Xia等人巧妙地设计了一种双功能纳米探针,该探针通过将金纳米粒子(AuNPs)与孟加拉红(BR)染料相结合,形成了RB-AuNPs探针。这种结合使得BR的拉曼信号在表面增强拉曼散射(SERS)效应的作用下得到了显著的增强。当RB-AuNPs探针与Aβ42肽共轭后,研究人员观察到了光谱的变化,这种变化与目标肽的浓度呈现出一定的相关性。这种光谱变化源于肽与探针之间的相互作用,它导致了探针荧光发射的增强。
为了观察转基因小鼠脑切片中的淀粉样蛋白斑块,研究人员利用该纳米探针同时采用了SERS和荧光成像技术来检测Aβ42肽。这种多功能淀粉样蛋白探针不仅有助于深入研究淀粉样蛋白的聚集过程,还为艾滋海默症的早期诊断提供了新的工具。在对3xTg小鼠脑切片进行荧光成像时,研究人员发现年龄增长与荧光强度的升高之间存在着明显的相关性,这一发现为理解阿尔茨海默症的发病机理提供了重要的线索。
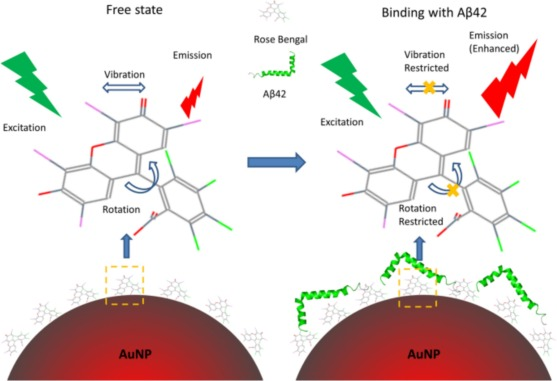
图16.在AD中使用RB-AuNPs荧光探针对Aβ42进行靶向成像。
8.用于诊断阿尔兹海默症的双靶向荧光探针
阿尔茨海默症是一种错综复杂的神经退行性疾病,其发病过程中涉及多种生物分子的协同变化。准确并同时检测AD中的多个靶点,无疑将为我们更全面地揭示该疾病的病理过程提供有力支持。
Wang等人在其研究中,创造性地提出了一种对过氧化氢(H2O2)高度敏感的荧光探针——R-MA-SLM。该探针的设计独具匠心,以甲基氨基取代的喹啉基精氨酸作为荧光基团,而苯基硼酸盐则作为检测H2O2的关键位点。当加入H2O2后,探针在574纳米波长处的荧光强度会逐渐减弱,而在490纳米波长激发下,661纳米波长处的荧光发射强度则会显著增强。这一特性使得R-MA-SLM能够实现双通道发射和比率追踪,从而提高了检测的准确性和灵敏度。
尤为值得一提的是,在β-淀粉样蛋白(Aβ)聚集体存在的情况下,R-MA-SLM对H2O2的反应速度竟快了四倍之多,同时荧光强度也得到了显著提升。这种增强的反应特性使得R-MA-SLM在生物系统中检测和监测Aβ诱导产生的H2O2方面具有独特的优势。作者不仅通过实验证明了内源性β能够诱导产生H2O2,还进一步利用该探针对神经元和注意力缺失模型小鼠中内源性β诱导的H2O2进行了量化和可视化研究。
鉴于R-MA-SLM出色的血脑屏障渗透性,该探针在活细胞和动物模型中实时检测和监测Aβ诱导的H2O2方面具有巨大的应用潜力。这一研究成果不仅为我们更深入地理解阿尔茨海默症的发病机理提供了新的视角,也为该疾病的诊断和治疗提供了新的思路和工具。 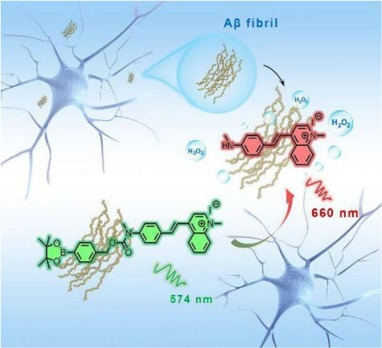 图.17.使用R-MA-SLM荧光探针对AD中的H2O2进行靶向成像。
图.17.使用R-MA-SLM荧光探针对AD中的H2O2进行靶向成像。
在近期的一项研究中,Li等人成功研制出一种名为Mito-NIRHV的近红外荧光探针,该探针专为活体AD大鼠脑中线粒体的粘度及过氧化氢(H2O2)测量而设计。Mito-NIRHV探针的结构独特,融合了频哪醇苄基分子、季铵化喹啉单元以及π-共轭噻吩桥。该探针在粘度与H2O2测量方面展现出卓越的灵敏度,且能在近红外区域产生两个发射峰,这两个峰的斯托克斯位移均超过200纳米。当与过氧化氢发生反应时,频哪醇苄基部分会裂解,生成醌噻吩衍生物。利用小鼠脑组织进行的体内实验揭示,相较于野生型(WT)小鼠,AD小鼠大脑中的H2O2浓度与粘度均有所提升。此外,研究表明,含有季铵盐的某些分子探针不仅能有效观测淀粉样蛋白,而且在穿越血脑屏障(BBB)时表现出良好的渗透性。
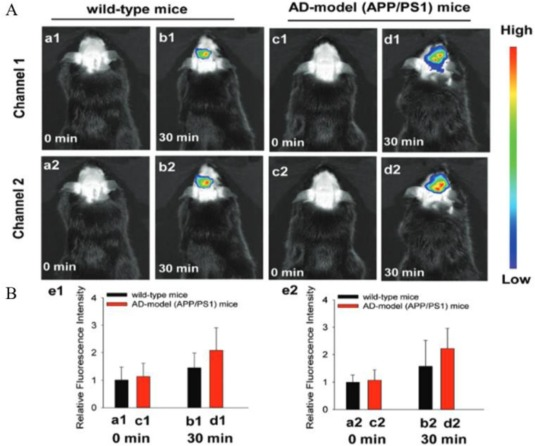 图.18.使用Mito-NIRHV荧光探针对AD中的H2O2进行靶向成像。
图.18.使用Mito-NIRHV荧光探针对AD中的H2O2进行靶向成像。
另一方面,Xie及其团队开发了名为BTNPO的双光子荧光探针。他们基于与Aβ斑块结合的荧光团簇,创新性地构建了一种新型ONOO-(过氧亚硝基阴离子)响应触发器,即环氧吲哚官能化苯并噻唑基萘衍生物。该探针对Aβ斑块和ONOO-展现出高选择性与高灵敏度。凭借其独立的光谱响应能力,该探针能够分别在蓝色(418纳米)和绿色(506纳米)通道中监测Aβ斑块和ONOO-的分布与变化。研究发现,ONOO-压力与Aβ斑块聚集这两个关键因素通过正反馈机制相互促进,共同推动了AD的发生与发展。此外,通过绘制Aβ斑块形成与ONOO-水平的动态图,他们发现,在转基因小鼠模型中,大脑中的ONOO-比Aβ斑块更早出现,提示其可能作为AD的一种潜在生物标志物。
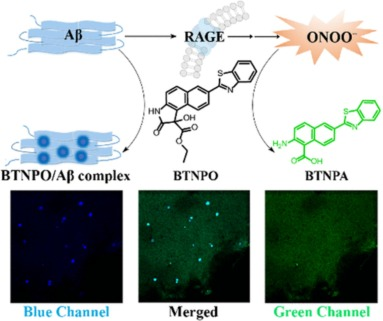 图.19.使用BTNPO荧光探针对AD中ONOO-的靶向成像。
图.19.使用BTNPO荧光探针对AD中ONOO-的靶向成像。
Zhang及其同事则开发了一种名为P2的逻辑探针,用于连续检测丁酰胆碱酯酶(BChE)和活性氧(ROS)。P2探针由亚甲基蓝(作为近红外荧光团)、环丙基格式(作为BChE反应位点)以及羟苯基脲(作为ROS反应单元)组成。当BChE和ROS分别受到酶水解和氧化还原反应的刺激时,探针会发出690纳米的近红外发射光,并易于被激活。该探针被用于监测活细胞中ROS和BChE的变化。实验结果显示,在使用脂多糖(LPS)加佛波酯(PMA)处理后,荧光强度增加;而使用他克林刺激后,荧光强度减弱。与正常小鼠相比,AD小鼠的近红外探针荧光信号更强,表明该探针对BChE和ROS具有更高的敏感性。
此外,Sun等人开发了一种名为AD-3的双光子荧光探针,该探针能够同时观察活体AD大鼠大脑中的内源性硫化氢(H2S)和腺苷三磷酸(ATP)。AD-3探针由1,8-萘亚胺衍生物与罗丹明通过胺化反应耦合而成。其中,1,8-萘亚胺衍生物与叠氮基团反应,用于识别H2S;而罗丹明衍生物则通过二乙烯三胺连接与ATP形成键合。该探针具有出色的选择性和灵敏度,对H2S的检测限为0.19微摩尔/升,对ATP的检测限为0.01毫摩尔/升。此外,通过实时定量聚合酶链反应和Western印迹技术,他们证实了线粒体呼吸链中存在H2S,这是H2S对细胞色素C和线粒体呼吸链细胞质产生影响的结果。探针的体内成像结果显示,AD小鼠大脑中H2S和ATP的浓度低于WT小鼠。
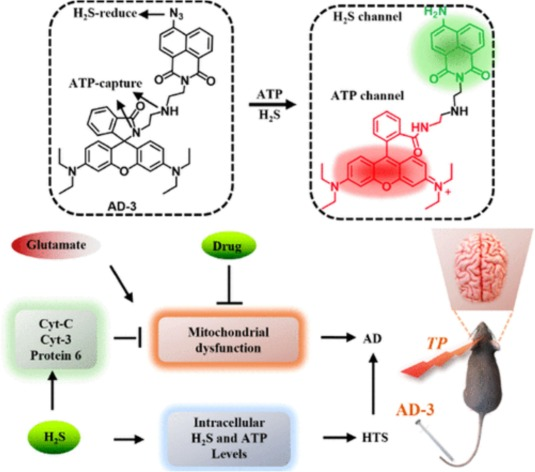 图.20.使用AD-3荧光探针对AD中的H2S进行靶向成像。
图.20.使用AD-3荧光探针对AD中的H2S进行靶向成像。
8.1.挑战
尽管小分子探针在AD的诊断中展现出巨大潜力,但脑脊液(CSF)分析和正电子发射计算机断层显像(PET)仍是当前主要的辅助检测手段。然而,这些方法存在固有的局限性,如放射性或侵入性,这主要归因于一系列重大挑战。
首要挑战在于血脑屏障(BBB)的穿透性。BBB是一个由内皮细胞、周细胞和星形胶质细胞构成的复杂结构,它严格把控着进入大脑的细胞、分子和病原体,包括用于检测AD的探针。开发一种既能有效穿越BBB,又对β-淀粉样蛋白(Aβ)保持高度特异性的探针,是一项极为艰巨的任务。目前,研究人员主要通过化学方法合成针对目标分子的探针,但往往忽视了生物可及性的重要性。为了促进药物和治疗性抗体通过BBB,载体介导转运(CMT)或受体介导转运(RMT)等策略已被采用。然而,我们仍需探索新方法,其中,纳米颗粒(如钟刚等人所报道的)因其潜在的治疗应用前景而备受瞩目。我们相信,这些策略将有助于克服BBB穿透性的难题。
另一个关键问题是体内稳定性和细胞毒性。探针在体内必须保持稳定,以抵御酶和其他生物过程的降解。同时,探针应无明显的细胞毒性,以确保其临床使用的安全性。这是确保探针能够到达预定目标并提供可靠信号的基础。然而,目前大量正在研究的探针尚未在这一领域进行充分测试,且有证据表明,部分探针已在体内表现出毒性或不稳定性。为了提升体内稳定性,化学修饰或使用生物相容性材料可能是有效的途径。
此外,区分健康状态的Tau蛋白与病理状态的Tau蛋白也是一大挑战。Tau蛋白缠结是AD的重要生物标志物,但在人体中,Tau蛋白对神经系统的正常功能至关重要,主要功能是调节轴突微管的稳定性。只有当Tau蛋白发生异常高磷酸化时,才会导致疾病。因此,未来的研究可能会将高磷酸化本身以及下调后的相关磷酸酶作为潜在靶点。然而,目前的探针往往难以准确区分Tau蛋白的健康形态与病理形态,这种不准确性可能导致误诊。为了更准确地鉴别病理Tau,研究人员正在致力于开发针对病理Tau特有结构特征的探针。
8.2.未来发展方向
研究人员正积极致力于探索创新途径,旨在克服现有挑战,充分挖掘小分子探针在AD诊疗中的巨大潜力。具体而言,他们的工作聚焦于以下几个关键方向:
针对多因素疾病特性:鉴于AD的复杂性,其发病机制不仅涉及Aβ斑块,还包括多种其他致病因素。因此,拓宽探针的应用范围,以涵盖更广泛的AD病理特征,对于深化我们对这一疾病的理解至关重要。例如,类似于BOODIPY的双功能分子探针,既能与Tau蛋白结合,也能与Aβ斑块结合,为疾病的全面分析提供了可能。此外,多目标荧光探针的开发,能够同时检测包括Aβ、粘度、ROS以及多种蛋白质(如NFT、Aβ聚合体或Aβ寡聚体)在内的多种生物分子,进一步丰富了诊断手段。
靶向其他生物标记物:除了Aβ和Tau蛋白外,研究人员还在积极探索与AD发病密切相关的其他关键病理特征。特别是Tau病理方面,尽管目前针对Tau的靶向探针数量相对较少,但这些探针有望为揭示Tau聚集及其在AD进展中的作用提供宝贵信息。同时,神经炎症作为AD的另一个重要方面,其与Aβ、Tau蛋白及神经元间的相互作用在疾病发病机制中占据核心地位。因此,开发针对神经炎症标记物的荧光探针,将有助于评估神经炎症对疾病进程的影响,并为制定治疗策略提供重要线索。
脑血流屏障(BBB)的研究:斯威尼及其同事的研究揭示了BBB在神经退行性疾病中的受损情况及其在疾病发病机制中的关键作用。通过PET成像等手段,可以识别大脑特定区域的BBB损伤。在此基础上,金属有机框架(MOFs)等前瞻性解决方案被提出,以克服BBB带来的挑战。然而,要阐明BBB与疾病之间的复杂关系,并开发出有效的修复方法,仍需进一步的深入研究。
酶的研究与应用:酶与多种人类疾病的发生发展密切相关,其早期准确诊断对于提高治愈率和患者存活率至关重要。荧光标记探针和可活化探针在酶的高分辨率成像中发挥着重要作用。为了优化探针设计,研究人员正在探索具有优异光物理特性的新型荧光色素作为通用平台。一系列荧光染料,如香豆素、Cl-HPQ、NBD、荧光素、罗丹明、罗丹醇、BODIPY、半氰胺和氰胺等,被总结并用于此目的。
多模态成像技术的发展:结合不同成像模态的探针,能够更详细、更准确地反映AD的病理学特征。例如,在荧光显微镜下能够照亮Aβ斑块的探针,在AIE方法中同样表现出色。AIE发光剂(AIEgens)因其独特的优势,如发射波长可调、高量子产率、优异的空间分辨率、光敏性、光稳定性、高信噪比和良好的生物相容性等,在多模式成像中展现出巨大潜力。
治疗探针的研发:虽然目前可用的传统药理学方法有限,但治疗探针的开发为AD的治疗提供了新的希望。这种“二合一”探针不仅有助于疾病的诊断,还能将治疗药物直接输送到大脑中的目标部位,实现有针对性的治疗,并可能减缓疾病的进展。纳米粒子等新型载体的疗效已得到初步验证,如Bahareh Farasati及其同事研究的封装姜黄素的脂基纳米颗粒(LNPs-CUR)就展现出了良好的应用前景。此外,关于使用含有干细胞的水凝胶和纳米纤维支架作为治疗干预手段的研究也在进行中,但尚需进一步的体内测试和安全性验证。
综上所述,通过应对这些挑战并寻求这些未来的发展方向,研究人员有望创造出新一代小分子探针,作为诊断和治疗阿尔茨海默症的有力工具。这将有助于更早地进行干预、加强治疗策略,并为患者带来更乐观的预后。
9.结论
近年来,荧光成像技术在化学生物学和医学领域内大放异彩,成为一项功能多样的技术,为揭示AD的病理生理学机制提供了宝贵的洞察。小分子荧光探针的研发在这一进程中发挥了举足轻重的作用,使得我们能够检测和鉴定与AD病理紧密相关的多种生物活性化合物。然而,尽管已取得显著进展,该领域仍面临一系列挑战。
首要挑战在于,尽管当前的探针主要聚焦于Aβ和Tau蛋白质,但迫切需要发现与AD进展紧密相关的新型生物标记物,且这些标记物最好能在血液等易于获取的体液中被检测到。在这方面,探索血浆蛋白等生物标志物具有广阔的希望,有望成为研究的新途径。
其次,现有探针的最大发射波长限制了其应用,因此,开发近红外二区(NIR-II,波长>900纳米)的探针显得尤为重要。这类探针能够显著提高成像深度和分辨率,使组织穿透更深,活体AD病理学的时空特征得以更清晰地展现。
最后,尽管现有探针在检测分子异常方面表现出色,但缺乏兼具成像与治疗功能的探针。将成像探针与光动力或光热疗法相结合,为同时观察和治疗AD病理提供了一种创新思路。
综上所述,小分子AD荧光探针的快速发展为揭示该疾病的复杂性以及推动诊断和治疗策略的进步提供了巨大潜力。然而,要将这些科学发现转化为切实的临床成果,为抗击阿尔茨海默症带来希望,就必须通过精细的分子设计和跨学科合作来应对上述挑战。