【疾病诊断荧光探针】心血管疾病的荧光探针
Fluorescent Probes for Disease Diagnosis
疾病诊断荧光探针
心血管疾病(CVD)被公认为是全球范围内导致死亡和残疾的主要元凶。据权威统计,2019年全球因心血管疾病而丧生的人数高达1790万,占据全球死亡总人数的32%。其中,高达85%的死亡病例归因于心脏病发作或中风这两种严重并发症。鉴于这一严峻形势,提升对心血管疾病异常生物分子趋势的检测能力,以深入探索其分子机制,显得尤为重要。这不仅有助于我们更好地理解疾病的本质,还能为开发更为精准有效的诊断、预防和治疗策略提供强有力的支撑。
在本节中,我们将聚焦于几种主要的心血管疾病,如心肌缺血/再灌注损伤、动脉粥样硬化、药物诱导的心脏毒性和高血压等,并举例说明为这些疾病成像和诊断而开发的代表性荧光探针(如表4所示)。这些荧光探针以其独特的光学特性,为心血管疾病的早期诊断和精准治疗提供了重要支持。
| cardiovascular diseases | probe | λex/λem (nm) | LOD | bioactive molecule | biological model |
|---|---|---|---|---|---|
| MI/RI | 126, 127 | 323/470, 385/510 | 800 nM, 10 nM | O2•– | A549 cells, H9C2 cells, HepG2 cells, C57BL/6 mice |
| OGD/R | 128 | 390/525 | 90 nM | ONOO– | H9C2 cells |
| I/RI | 129 | 530/560, 670/725 | 0.085 μM | ONOO– | H9C2 cells, HUVECs cells, SD rats |
| MI/RI | 130 | 420/600 | 256, 200 nM | HOBr | H9C2 cells |
| myocardial hypoxia injury | 131 | 560/ | NO | H9C2 cells, HCASMC, Kunming male mice | |
| atherosclerosis | 132 | 365/580 | ONOO– | RAW 264.7 cells, C57BL/6 mice, Ldlr–/– mice | |
| atherosclerosis | 133 | 72.6 ng/mL | ONOO– | A549 cells, RAW 264.7 cells, C57BL/6 mice | |
| atherosclerosis | 134 | 651/725, 488/575 | 0.014 U/mL | β-Gal | VSMCs, male C57BL/6 mice |
| atherosclerosis | 135 | 458/520 | LDs | A549 cells, 4T1 cells, RAW 264.7 cells, Balb/c nude mice, C57BL/6 mice | |
| atherosclerosis | 136 | 475/662 | CD47 | SMCs cells, RAW 264.7 cells, HUVECs cells, C57BL/6 mice | |
| atherosclerosis | 137 | 561/615 | 87 nM | LD, HClO | RAW 264.7 cells, HepG2 cells, C57BL/6J mice |
| atherosclerosis | 138, 139 | 0.5 μM, 0.9 μM | GSH, H2O2 | RAW 264.7 cells, mice | |
| atherosclerosis | 140 | 380/530, 415/645 | 3.8 μM | pH, phosphate | Km mice, Wistar mice, Balb/c mice |
| atherosclerosis | 141 | 417/650, 550/580 | 0.28 μM, 0.15 mM | phosphorylation, glucose | HL-7702 cells, mice |
| atherosclerosis | 142 | 640/663–738 | 0.437 μM | O2•– | RAW 264.7 cells, C57BL/6 mice |
| cardiovascular disease | 143 | 532/565,595 | 3.4 × 10–8 M | NO, GSH | HUVECs cells, zebrafish |
| hypertension | 144 | 405/470, 405/560 | 0.20 mM | H2O2 | SMCC-7721 cells, HL-7702 cells, HeLa cells, Kunming mice |
| hyperlipidemia | 145 | TC, TG | RAW 264.7 cells, C57BL/6N mice | ||
| cardiotoxicity | 146 | 570/630 | 34 nM | ONOO– | H9C2 cells, Kunming mice |
| myocardial fibrosis | 147 | 405/515–565 | NO | SH-SY5Y cells, RAW 264.7 cells, C57BL/6 mice |
【心血管疾病的荧光探针】缺血再灌注损伤的荧光探针
Fluorescent Probes for Disease Diagnosis
疾病诊断荧光探针
缺血性心脏病是一系列心脏问题的总称,这些问题源于心脏动脉的狭窄或堵塞,导致心脏缺氧(缺血),进而引发急性心肌梗塞(MI,俗称心脏病发作),对心脏造成广泛且难以逆转的损害。尽管及时的再灌注治疗可以通过恢复缺血组织的冠状动脉血流来减缓疾病进程,但这一过程也伴随着心肌缺血再灌注损伤(MI/RI)的风险。MI/RI是一个复杂的过程,涉及氧化损伤、线粒体功能障碍、细胞凋亡、炎症、能量代谢紊乱和钙超载等多种因素和机制。
其中,氧化应激是MI/RI的重要诱因之一,它在再灌注后持续造成损伤。超氧阴离子是这一过程中的关键分子,作为氧化应激的典型生物标志物,因其是多种活性氧(ROS)的最终来源而备受关注。超氧阴离子(O2-)由线粒体电子传递链和烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶等多种酶产生,并通过与超氧化物歧化酶作用生成H2O2,进而引发一系列ROS的生成。
2023年,Li小组成功设计与合成了基于活性的传感探针126和127,用于在活细胞中对O2-进行高特异性成像( 图 56)。研究发现,1,2,4,5-四嗪(Tz)作为超特异性的O2-反应触发器,与其他ROS无交叉反应。Tz本身具有荧光淬灭特性,其降解会导致荧光”点亮”,当暴露于O2-时,荧光强度显著增强。通过微调探针结构,可以实现探针反应性和发射波长的变化,从而在不同颜色/波长下以出色的空间分辨率对细胞内的O2-进行成像。基于探针设计的通用性,Li小组进一步开发了一个高通量药物筛选模型,从223种天然产品中筛选出coprostanone,该物质能有效减轻氧化应激引起的损伤。这一研究不仅揭示了一种新的超氧化物特异性反应单元,还展示了其在ROS选择性荧光探针中的有效应用,为ROS探针设计提供了新的功能模式。 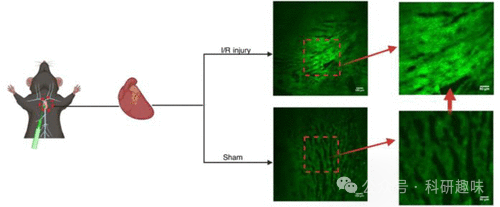 图 56.心肌损伤时超氧化物生成的体内外成像。
图 56.心肌损伤时超氧化物生成的体内外成像。
超氧阴离子(O2-)作为所有活性氧(ROS)的源头,是过氧亚硝酸根(ONOO-)生物生成的关键前驱体,ONOO-则是NO与O2-反应的产物。在再灌注损伤中,ONOO-含量异常丰富,其ROS/RNS双重反应性赋予其相较于其他ROS或自由基更强的细胞毒性,从而可能导致心肌细胞的丧失。为了深入探究这一过程,Tang小组于2019年设计并合成了荧光探针128,专门用于实时监测ONOO-的动态变化。该探针对ONOO-展现出高灵敏度和特异性,因此能够精准捕捉并确认缺血期间细胞内ONOO-的累积情况。
进一步地,通过将探针128(图57)与硫化氢(H2S)特异性探针结合使用,Tang小组实现了对H2S和ONOO-浓度的同步成像。当用能够上调H2S的雌二醇E2处理细胞时,实验结果显示探针128的荧光信号显著下降,而H2S探针的信号则明显增强,这有力证明了H2S浓度的增加确实伴随着ONOO-浓度的降低。这一发现不仅证实了H2S在降低ONOO-浓度方面的作用,进而减少氧化应激,还暗示了雌二醇E2在缺血事件中可能具有保护心肌细胞的潜力。 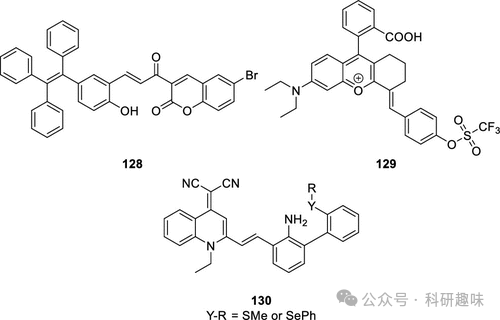 图 57.用于 MI/RI 的荧光探针。
图 57.用于 MI/RI 的荧光探针。 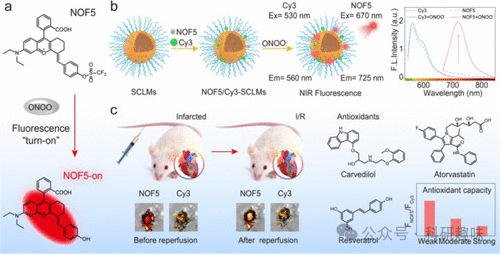 图 58.(a) 129(NOF5)的荧光开启机制。(b) 以 Cy3 为内参构建比率传感器。(c) 心脏中的荧光比率 FNOF5/FCy3 可用于实时监测心脏中 ONOO- 的水平,并就地评估药物的抗氧化能力。
图 58.(a) 129(NOF5)的荧光开启机制。(b) 以 Cy3 为内参构建比率传感器。(c) 心脏中的荧光比率 FNOF5/FCy3 可用于实时监测心脏中 ONOO- 的水平,并就地评估药物的抗氧化能力。
Tang等人在2023年成功研发了两种具备聚集诱导发光(AIE)特性的荧光探针130,旨在监测心肌缺血再灌注损伤(MI/RI)过程中的次溴酸(HOBr)动态(如图59所示)。与多数现有探针的设计不同,这两种探针采用了“关闭”机制,即当HOBr与探针发生氧化反应时,探针的荧光发射被有效抑制。
这些探针的测试结果显示,在H9C2心脏细胞中,HOBr的浓度在MI/RI过程中显著上升,这一发现进一步证实了HOBr与先前已确认的活性氧(ROS)共同参与了MI/RI中的氧化应激过程。鉴于MI/RI同时涉及炎症和铁离子迁移等复杂生物过程,Tang团队利用抗氧化剂(如N-乙酰半胱氨酸NAC、雌二醇E2)、环氧化酶-2(COX-2)抑制剂(如吲哚美辛、舒利迭酸)以及铁离子迁移抑制剂(如Fer-1)来降低氧糖剥夺/再灌注(OGD/R)期间H9C2细胞中HOBr的水平,并通过监测荧光强度的变化来评估其效果。
在这项研究中,探针130作为一种高效的成像工具,被用于揭示OGD/R与H9C2细胞中HOBr水平之间的潜在关联,为深入理解MI/RI的分子机制提供了有力的实验支持。 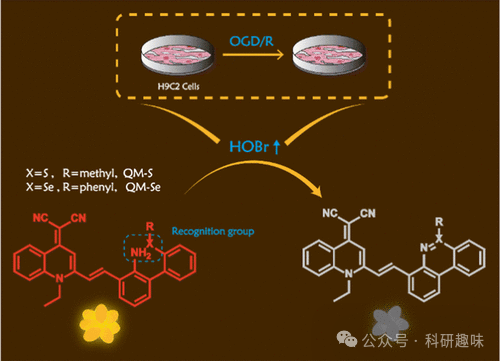 图 59.在 MI/RI 期间使用 130 号探针对 HOBr 进行细胞内观察。
图 59.在 MI/RI 期间使用 130 号探针对 HOBr 进行细胞内观察。
【心血管疾病的荧光探针】动脉粥样硬化荧光探针
Fluorescent Probes for Disease Diagnosis
疾病诊断荧光探针
动脉粥样硬化是一种复杂的病理过程,涉及脂肪、胆固醇以及其他物质在动脉内壁的逐渐累积。这些累积物被医学界统称为“斑块”,它们随时间的推移会逐步增大,导致动脉管腔的狭窄,进而阻碍血液的正常流动。更为严重的是,这些斑块可能因内部压力过大而发生破裂,进而损伤血管壁,为血栓形成提供了条件。
动脉粥样硬化斑块的形成是众多心血管疾病的始作俑者。为了实现对这一病理过程的精准监测和有效干预,近年来,科学家们致力于研发基于活性分子变化的荧光探针技术。这些荧光探针能够特异性地响应动脉粥样硬化过程中的关键分子变化,并通过荧光信号的强弱和变化来反映斑块的生成和发展情况(如图60所示),为动脉粥样硬化的早期诊断和干预提供了新的策略。 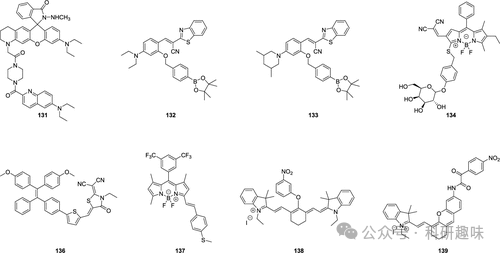 图 60.部分动脉粥样硬化荧光探针。 在2021年,Canary小组展示了一种新颖的荧光探针131的开发及其在生物学领域的应用,该探针旨在准确测量体外和体内过氧亚硝酸根(ONOO-)的浓度(如图61所示)。 探针131作为一种基于反应的比率测量工具,具备100纳米的显著红移发射光谱,这使得它能够灵敏地响应ONOO-浓度的微小变化。
图 60.部分动脉粥样硬化荧光探针。 在2021年,Canary小组展示了一种新颖的荧光探针131的开发及其在生物学领域的应用,该探针旨在准确测量体外和体内过氧亚硝酸根(ONOO-)的浓度(如图61所示)。 探针131作为一种基于反应的比率测量工具,具备100纳米的显著红移发射光谱,这使得它能够灵敏地响应ONOO-浓度的微小变化。
在细胞和小鼠模型的研究中,发现巨噬细胞内的ONOO-水平与精氨酸酶-1的活性呈负相关。进一步地,在动脉粥样硬化小鼠体内,探针131能够实时追踪进展斑块和退化斑块中ONOO-的动态变化,揭示了动脉粥样硬化过程中活性氧(ROS)水平的上升。
这些实验结果支持了一个重要假说:在动脉粥样硬化的消退阶段,高表达精氨酸酶-1的M2样巨噬细胞逐渐富集,通过降低ONOO-水平,进而发挥抗动脉粥样硬化的作用。鉴于ONOO-在动脉粥样硬化过程中的有害影响,利用探针131来揭示精氨酸酶-1潜在的抗动脉粥样硬化机制,对于未来开发针对动脉粥样硬化的新型疗法具有极其重要的指导意义。  图 61.精氨酸酶 1 下调 ONOO-
图 61.精氨酸酶 1 下调 ONOO-
2023年,Zheng等人报道了一种先进的双分析荧光报告系统132,该系统基于逻辑顺序激活机制,能够精准地以过氧亚硝酸根(ONOO-)和脂滴为靶标,实现对体内动脉粥样硬化斑块的准确识别(如图62所示)。此探针设计为双锁荧光系统,首先通过与ONOO-发生特异性反应,去除对苄基宾ROS识别基团,进而释放出一个酚官能团。这一官能团随后与邻近的丙烯腈发生闭环反应,生成一种具有显著荧光特性的香豆素衍生物。
值得注意的是,探针132的荧光特性强烈依赖于其所处的溶剂环境,使其能够区分水滴和脂滴,并仅在脂滴的环境中展现出强烈的荧光信号。这一特性使得探针132无需额外的二级靶向或反应单元,即能凭借对脂质(高度非极性)环境的固有选择性实现精准检测。尤为值得一提的是,当探针132进入脂滴时,其荧光增强率高达365倍,相较于典型的商用探针,展现了更优异的选择性和信噪比,为动脉粥样硬化的早期诊断和监测提供了强有力的工具。  图 62.ONOO-/LD 序列激活的荧光探针 132 的设计。(A、B)先前工作(A)和探针 132(B)所采用的设计策略。(C) 探针 132 的机制。(D) 探针 132 的术中成像。
图 62.ONOO-/LD 序列激活的荧光探针 132 的设计。(A、B)先前工作(A)和探针 132(B)所采用的设计策略。(C) 探针 132 的机制。(D) 探针 132 的术中成像。
"AND"分子逻辑门正日益受到研究人员的青睐,为通过优化荧光增强(F/F0)以最大化信噪比提供了一种高效策略。以探针132为例,其中脂滴作为可控背景输入,目标分析物作为可变输入。这种双重锁定机制实现了荧光的完全淬灭,从而为目标分析物提供了极高的F/F0比值。同一研究团队进一步利用此原理,对探针进行了重新设计,得到了新型探针133(如图63所示)。遵循相同的反应机理、检测方法和荧光歧管技术,这款改进型探针在受到ONOO-激活并进入液滴后,展现出了惊人的2600倍荧光增强。这一框架为新型高信噪比、显著荧光增强技术的开发提供了一个高效且创新的平台。 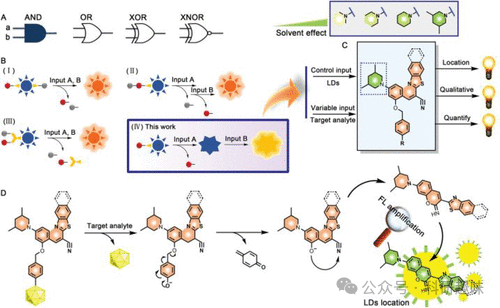 图 63."AND" 分子逻辑门探针 133。(A) 分子逻辑门。(B,C) "AND" 分子逻辑门的设计原理。(D) 探针 133 的荧光激活机制。
图 63."AND" 分子逻辑门探针 133。(A) 分子逻辑门。(B,C) "AND" 分子逻辑门的设计原理。(D) 探针 133 的荧光激活机制。
最新的研究成果揭示了衰老细胞,包括血管内皮细胞、平滑肌细胞和巨噬细胞,在动脉粥样硬化形成和发展过程中的关键作用。为了对衰老进行成像,科学家们开发了一种针对衰老相关β-半乳糖苷酶(SA-β-Gal)的成像技术。具体而言,通过将134封装在聚乳酸-羟基乙酸共聚物(PLGA)纳米颗粒的内核中,成功制备了SA-β-Gal传感纳米颗粒(如图64所示)。研究表明,这些纳米探针在动脉中表现出良好的聚集性,进而实现对动脉粥样硬化小鼠体内衰老细胞的高效成像。 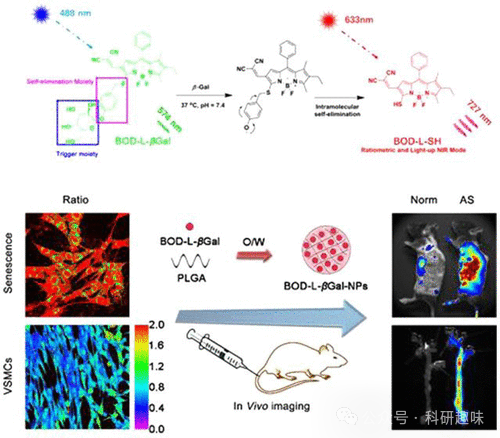 图 64.探针 134 的 β-Gal 传感机制。
图 64.探针 134 的 β-Gal 传感机制。
在动脉粥样硬化等进展性疾病的治疗中,手术切除病变和斑块通常是一种有效且有时是唯一的治疗手段。在此过程中,对动脉粥样硬化斑块进行可视化对于实现积极疗效至关重要。正如之前所讨论的案例,荧光成像技术为达成此目标展现了巨大的潜力,目前荧光引导下的动脉粥样硬化手术新方法正处于研发阶段。
例如,一种可能的方法是,在动脉外侧应用含有类似于上述135号探针类型的荧光探针的脂质激活贴片。这种贴片能够促进探针在组织中的扩散,从而在动脉粥样硬化小鼠的手术过程中迅速且准确地定位斑块(如图65所示)。通过快速识别泡沫细胞中脂滴的异常积聚,斑块成像可在5分钟内完成。斑块与正常组织的荧光比值高达4.3,使得斑块与非斑块组织之间的区分变得轻而易举,从而实现对颈动脉粥样硬化的精准诊断。
利用脂质激活探针的可见荧光生物成像技术,能够精确识别直径小至0.5毫米的斑块。这种在手术过程中对斑块进行原位术中荧光成像的开发,为未来的临床评估和图像引导下的手术干预提供了新的视角,同时也为荧光探针在斑块识别中的应用开辟了新的前景。 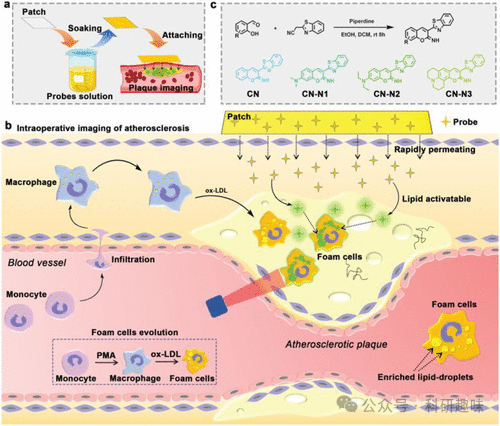 图 65.利用原位斑块对动脉粥样硬化斑块进行术中成像的脂质可激活荧光探针 135。
图 65.利用原位斑块对动脉粥样硬化斑块进行术中成像的脂质可激活荧光探针 135。
2022年,丁氏研究团队成功研发了一种基于聚集诱导发光(AIE)原理的纳米探针136,其核心成分源于罗丹宁衍生物。该探针以其高精度、高灵敏度和快速响应的特性,在动脉粥样硬化斑块的早期检测以及药物筛选中展现出了显著优势。相较于典型的参考探针,探针136在摩尔消光系数、光致发光量子产率方面表现出色,同时拥有理想的吸收/发射光谱红移。这款纳米探针采用两亲性共聚物作为封装基质,并通过表面功能化处理结合抗CD47抗体,实现对动脉粥样硬化斑块中过度表达CD47的特异性识别。实验证实,探针136能够有效区分缺乏载脂蛋白E的小鼠(动脉粥样硬化模型)中不同阶段的斑块。尤为值得一提的是,探针136能在动脉粥样硬化早期阶段识别斑块,这一能力远超传统的CT或MRI成像技术。因此,探针136在评估阿托伐他汀和GW3965等抗斑块药物的潜力时发挥了关键作用,其研究结果与这些药物已知的临床效果相吻合。
同年,刘氏研究团队也报道了一种名为探针137的双靶向序列荧光系统。该系统采用了一种名为序列内高特异性双报告器解锁(iSHERLOCK)的技术,实现了对动脉粥样硬化斑块在体内和体外的精确识别(图66)。iSHERLOCK能够同时检测HClO和脂滴,这两种物质均为动脉粥样硬化的典型标志物。与前文提到的探针类似,探针137在水介质中不显示荧光,但进入非极性脂滴时即被“激活”,随后HClO触发的氧化作用进一步引发荧光信号的转变,实现双重输出的功能。 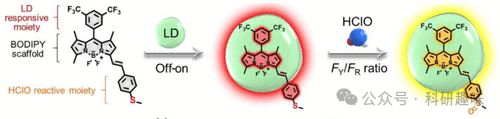 图 66.iSHERLOCK 探针 137 的示意图,用于 LD 和 HClO 的 "关-开 "和比率检测。FY 和 FR 分别代表黄色和红色通道中的荧光强度 (FI)。
图 66.iSHERLOCK 探针 137 的示意图,用于 LD 和 HClO 的 "关-开 "和比率检测。FY 和 FR 分别代表黄色和红色通道中的荧光强度 (FI)。
22019年,Tang研究团队发表了关于两种近红外荧光探针138和139的研究,这些探针被设计为用于动脉粥样硬化斑块脆弱性的光声成像,特别关注于斑块的氧化应激/炎症活动。这些探针能够检测与氧化应激密切相关的GSH/H2O2氧化还原偶联物,并通过与牛血清白蛋白(BSA)的结合,形成BSA-Cy-Mito纳米探针(如图67所示)。这种基于BSA的自组装结构展现出了优异的生物相容性和延长的血液循环时间,有效增强了其在生物体内的渗透性和保留性。在765纳米和680纳米波长下,该纳米探针能够产生强烈且特异的GSH和H2O2响应信号。
BSA-Cy-Mito纳米探针在氧化低密度脂蛋白激活的巨噬细胞以及高脂饮食导致的载脂蛋白E缺乏小鼠模型中,成功用于GSH/H2O2的检测,从而能够准确诊断与氧化还原相关的炎症过程。通过全身给药,BSA-Cy-Mito纳米探针能够基于不同的氧化还原状态,有效区分易损斑块和稳定斑块。这种高灵敏度的氧化还原反应型光声纳米探针,有望成为早期识别易损斑块的有力工具,为实施成功的预防性治疗策略提供有力支持。 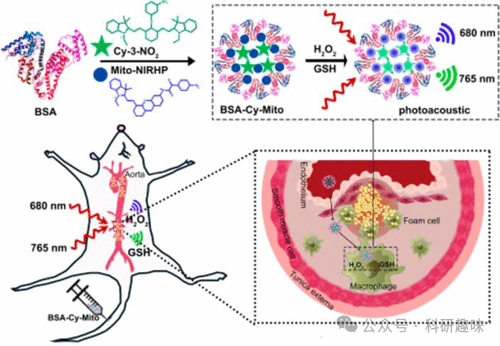 图 67.基于荧光探针 138 和 139 的 GSH/H2O2- 响应型 BSA-Cy-Mito 纳米探针的结构,用于体内 PA 氧化还原状态成像,以评估动脉粥样硬化斑块的脆弱性。
图 67.基于荧光探针 138 和 139 的 GSH/H2O2- 响应型 BSA-Cy-Mito 纳米探针的结构,用于体内 PA 氧化还原状态成像,以评估动脉粥样硬化斑块的脆弱性。
在炎症和胁迫环境中,pH值的变化通常是一个重要的生物标志物,动脉粥样硬化疾病中也不例外。针对这一现象,Tang及其合作者于2023年研发了一种基于MOF(金属有机框架)的双检测荧光纳米传感器PCN-NP-HPZ(如图68所示,探针140),并成功应用于动脉粥样硬化斑块的成像研究。该传感器通过结合pH敏感基团哌嗪和磷酸盐与ZrIV,实现了对pH值和磷酸化的同时高灵敏检测与成像。
Tang等人利用探针140监测了动脉粥样硬化小鼠在斑块形成不同阶段血液pH值和磷酸化水平的变化。实验结果显示,动脉粥样硬化小鼠主动脉内壁的酸度明显增加,这一变化与血管内皮炎症紧密相关。同时,与正常小鼠相比,磷酸化水平也显著升高。这些发现为深入理解动脉粥样硬化斑块的形成机制以及动脉粥样硬化早期阶段的病理环境提供了重要的实验数据和理论支持。 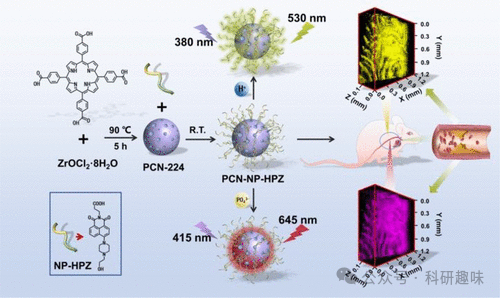 图 68.探针 140 的合成及其在动脉粥样硬化小鼠荧光检测和双光子荧光成像中的应用。
图 68.探针 140 的合成及其在动脉粥样硬化小鼠荧光检测和双光子荧光成像中的应用。
2023年,唐氏研究小组在动脉粥样硬化研究领域取得了新的突破,他们开发了一种基于MOF(金属有机框架)的动脉粥样硬化传感器,该传感器旨在监测斑块形成前的关键生物标志物。这款名为I3--RhB@PCN-224(探针141)的探针,被设计用于同时监测磷酸化和葡萄糖水平(如图69所示)。
探针141的制备过程采用了对MOF进行后修饰的方法,通过引入碘(I3-)-罗丹明B复合物来实现。该探针能够利用ZrIV与磷酸盐的特异性相互作用来监测磷酸化水平,同时,其I-RhB成分则对葡萄糖展现出高度选择性识别能力。
唐氏研究小组利用探针141对早期非斑块阶段的动脉粥样硬化进行了深入研究,以评估这两种目标分析物在病变过程中的变化。通过TP成像技术,他们发现早期动脉粥样硬化小鼠的蛋白质磷酸化和葡萄糖水平均显著高于正常小鼠。这一发现为未来的动脉粥样硬化治疗策略和研究提供了新的视角,可能对疾病的早期诊断和干预产生重要影响。 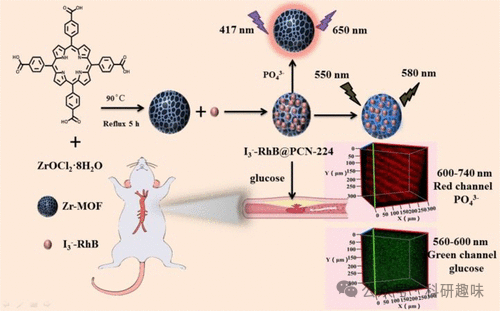 图 69.纳米探针 141 的合成及其在早期动脉粥样硬化模型中磷酸化和葡萄糖水平的检测和成像应用。
图 69.纳米探针 141 的合成及其在早期动脉粥样硬化模型中磷酸化和葡萄糖水平的检测和成像应用。
2021年,张研究小组成功研制出一种新型比率计量半导体聚合物纳米粒子(RSPN,探针142),旨在针对缺乏载脂蛋白E的肺炎小鼠模型中的易损斑块进行精准的光声成像。这一创新方法针对肺炎这一显著加剧斑块破裂风险的因素,提供了有效的成像策略(如图70所示)。
探针142具有独特的化学性质,能够与氧气发生反应,并在690纳米附近产生显著增强的光声信号。同时,其在800纳米的发射作为内部不变的参照,确保了测量的准确性和可靠性。通过比率测量法,探针142能够精确量化主动脉粥样硬化内的O2--水平,从而帮助研究人员评估易损斑块的氧化应激程度。
值得特别注意的是,探针142在实验中展现出卓越的性能,能够明确区分有斑块的小鼠、有斑块且患有肺炎的小鼠以及健康小鼠。这一发现充分证明了探针142在预测斑块易损性方面的巨大潜力和实用价值,为未来的动脉粥样硬化研究提供了新的工具和方法。 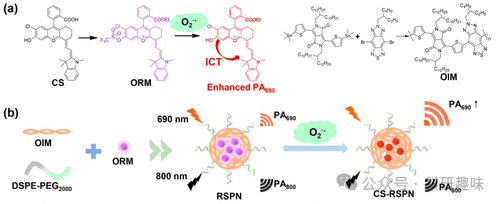 图 70.(a) 荧光探针 142 的结构和开启机制。(b) RSPN 的一步式自组装。
图 70.(a) 荧光探针 142 的结构和开启机制。(b) RSPN 的一步式自组装。
【心血管疾病的荧光探针】其他心血管疾病的荧光探针
Fluorescent Probes for Disease Diagnosis
疾病诊断荧光探针
内皮细胞在心血管系统中扮演着守门人的角色,它们构成了一道选择性的屏障,调控血液与血管壁之间大分子的交互。研究表明,氧化应激可导致内皮功能障碍,这是心血管疾病发病的重要因素之一。因此,明确与NO(一种重要的血管扩张剂)和GSH(NO的还原剂)相关的信号通路,对于预防心血管疾病及深入理解ROS(活性氧物种)介导的内皮损伤下游效应至关重要。
在这一背景下,2021年Yang等人开发了一种基于BODIPY的荧光探针143,用于特异性检测NO和GSH(如图71和图72所示)。该探针在NO存在时表现出荧光开启的特性,随后在GSH的作用下发生红移发射。这种独特的顺序激活机制在药物处理的内皮细胞和斑马鱼模型中首次被观察到,揭示了NO诱导的GSH上调现象,进而揭示了一种新的NO/γ-谷氨酰半胱氨酸合成酶/GSH信号通路。这一发现对于心血管疗法的开发具有重要的潜在价值。 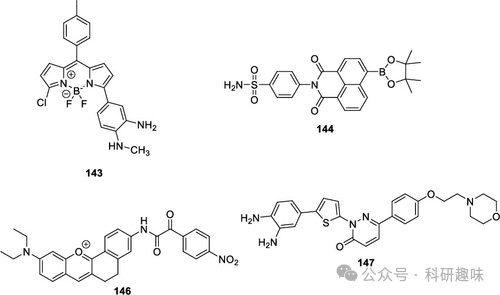 图 71.部分心血管疾病探针。
图 71.部分心血管疾病探针。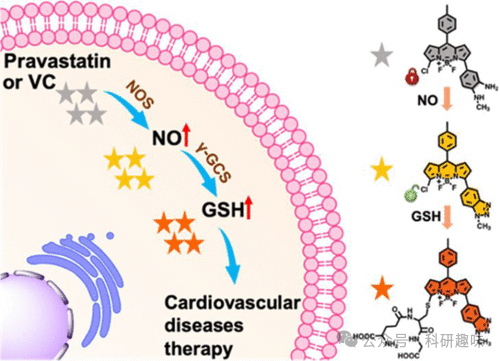 图 72.用 143 号探针监测人脐静脉内皮细胞中 NO 和 GSH 的连续生成,治疗心血管疾病。
图 72.用 143 号探针监测人脐静脉内皮细胞中 NO 和 GSH 的连续生成,治疗心血管疾病。
高尔基体相关的氧化应激,特别是H2O2的水平,与高血压的进展紧密相关,直接反映了高尔基体的氧化应激程度。2019年,Tang研究团队成功设计了一种新型的高尔基体靶向探针144,用于在生物体内原位检测H2O2水平。这款探针的结构设计精巧,由萘二甲酰亚胺荧光团、过氧化氢响应官能团以及高尔基体靶向苯磺酰胺分子三部分组成。其合成和修饰过程简便,预示着该基础结构框架在传感领域具有广泛的应用前景。Tang团队利用探针144深入研究了高血压小鼠肾脏中高尔基体H2O2的产生情况,发现其水平显著升高。
到了2022年,Tang团队再次取得突破,报道了一系列用于高脂血症诊断的智能近红外荧光探针(图73,探针145),进一步丰富了该领域的研究成果。这些探针基于分子转子供体-齐聚物单元受体模板,展现出独特的扭曲ICT特性,使其在水环境中荧光微弱,但在高粘度介质中聚集时发出强烈荧光。由于这些探针能够根据环境可逆地切换聚集状态和荧光状态,无需发生化学反应或结构变化,因此被称为“智能聚集体”。令人兴奋的是,这些发光物质同时具备近红外-II和近红外-III发光特性,并展现出较大的斯托克斯偏移(950纳米),预示着它们在开发“超组织透明”成像剂方面具有巨大的潜力。在小鼠模型中,这些探针成功实现了低血脂症(HLP)的体外检测和体内成像,并且其发射强度与HLP患者血液样本中的多个关键病理参数呈良好的线性关系。 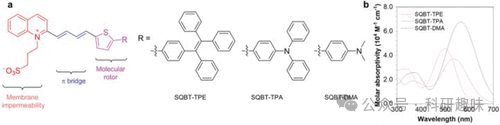 图 73.(a) 探针 145 的分子设计和制备。(b) 探针 145 在二甲基亚砜中的吸收光谱。
图 73.(a) 探针 145 的分子设计和制备。(b) 探针 145 在二甲基亚砜中的吸收光谱。
心脏毒性在新药研发及临床应用过程中常构成严峻挑战,以蒽环类抗癌药为例,其高效治疗能力伴随显著的心脏毒性,为临床应用带来极大困扰。为精准评估这一风险,Tang研究团队于2018年成功研发了一种新型TP近红外荧光探针——146号探针,专门用于线粒体中ONOO-(过氧亚硝酸根离子)过度表达的成像检测(如图74所示)。
通过该探针的应用,研究团队在心肌细胞及小鼠模型中观察到,蒽环类药物心脏毒性早期阶段线粒体ONOO-水平显著上调。这一发现表明,146号探针可作为药物诱发心脏毒性的早期生物标志物,为新药研发过程中的药物筛选提供重要参考,并有助于在治疗过程中预防心脏不良事件的发生。 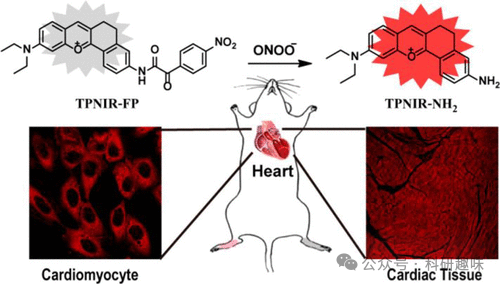 图 74.用于 ONOO- 成像的 146 号探针示意图。
图 74.用于 ONOO- 成像的 146 号探针示意图。
在2020年,Xu小组研发了一种新型探针147,专门用于心肌纤维化的成像研究(图 75所示)。这款探针在接触到内源性和外源性NO时,其特有的三嗪基团会迅速发生裂解反应,从而有效抑制了PeT(光诱导电子转移)引起的荧光淬灭现象。此外,由于探针147具备高效的吗啉溶酶体靶向能力,它成功应用于追踪和研究动物组织中NO的产生,特别是溶酶体内一氧化氮的生成情况。
在小鼠心肌纤维化模型中,探针147展现出了优异的体内成像性能。通过这一研究,我们得以深入阐明心肌一氧化氮产生与心肌纤维化之间的动态关联和渐进过程,为心血管疾病的研究提供了新的视角和工具。 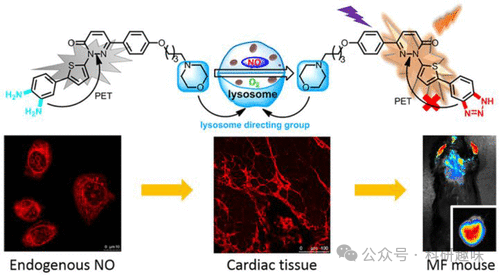 图 75.147 NO 成像示意图。
图 75.147 NO 成像示意图。
参考文献
Wang, X.; Ding, Q.; Groleau, R. R.; Wu, L.; Mao, Y.; Che, F.; Kotova, O.; Scanlan, E. M.; Lewis, S. E.; Li, P.; Tang, B.; James, T. D.; Gunnlaugsson, T. Fluorescent Probes for Disease Diagnosis. Chem. Rev. 2024, 124 (11), 7106–7164. https://doi.org/10.1021/acs.chemrev.3c00776.