【Chem. Rev.】细胞氧化还原调控与荧光成像
- 摘要
- 1. 引言
- 2. 活性氧 (Reactive Oxygen Species)
- 3. 活性氮 (Reactive Nitrogen Species)
- 4. 活性硫 (Reactive Sulfur Species)
- 5. 氧化还原金属 (Redox Metals)
- 6. 结论与展望
摘要
细胞氧化还原稳态主导着众多关键的生物过程,并对人类健康与疾病产生广泛影响。细胞通过表达某些类型的氧化剂、还原剂和具有氧化还原活性的金属来维持氧化还原稳态,同时运用精密的机制来调控其内部的氧化还原状态。这些生物分子可作为生物标志物,用于识别氧化还原状态的改变。细胞氧化还原失调是炎症性疾病、癌症和神经退行性疾病等病症的关键致病机制。因此,探索细胞氧化还原稳态的自调控机制以及对氧化还原变化进行原位成像已成为研究的核心焦点。在本综述中,我们聚焦于参与维持氧化还原的生物分子,并重点阐述其详细的调控机制。此外,我们系统地回顾了主要在过去五年中,响应氧化还原变化生物标志物的荧光探针的最新进展,包括其设计原理、反应机理以及在氧化还原相关疾病中的生物成像应用。本综述最后讨论了氧化还原调控与成像在人类疾病治疗和诊断中所面临的挑战与前景。我们希望它能为对这一迅速扩展的研究领域感兴趣的研究者提供宝贵的资源。
1. 引言
细胞氧化还原稳态调控着一种对人类健康与疾病至关重要的复杂平衡。细胞内的氧化还原平衡是氧化剂(包括活性氧ROS和活性氮RNS)与还原剂(如硫醇和其他还原剂)以及氧化还原活性金属参与下的动态平衡。ROS是功能多样的分子,具有双重细胞生理作用。其双相性,即低水平时有益,高水平时有害,使其成为维持健康和引发疾病的关键因素。常见的生物学相关ROS主要包括:超氧阴离子 (O₂•⁻),一种由分子氧部分还原产生的主要ROS,通常由NADPH氧化酶或线粒体呼吸等酶催化产生;过氧化氢 (H₂O₂) ,一种由O₂•⁻歧化或通过超氧化物歧化酶(SOD)等其他酶促反应形成的膜渗透性分子;单线态氧 (¹O₂) ,一种通过线粒体呼吸和酶活性产生的高能态分子氧;羟自由基 (•OH),是ROS中反应性最强的,通常通过芬顿反应或在金属离子(如铁)存在下由H₂O₂还原产生;脂质过氧自由基 (ROO•),在脂质过氧化过程中形成,ROS攻击不饱和脂肪酸产生;臭氧 (O₃),虽然O₃更常与环境污染相关,但它也可以在生物系统中形成,通常在免疫应答或特定化学反应中;次氯酸/次氯酸盐 (HClO/ClO⁻),由H₂O₂与氯离子反应形成,通常在髓过氧化物酶存在下;次溴酸/次溴酸盐 (HBrO/BrO⁻),当溴离子与H₂O₂反应时产生 (图1)。
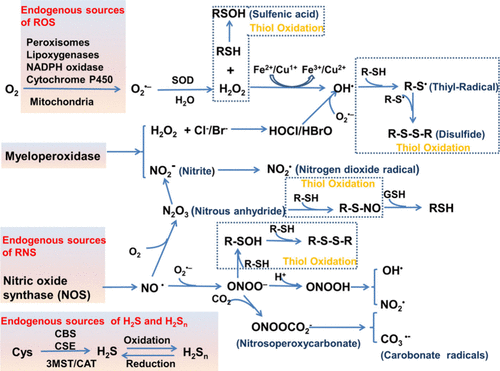 图 1. 产生ROS、RNS和RSS的各种酶促和非酶促过程,以及它们之间的相互作用(消耗和产生)。缩写:胱硫醚b-合酶 (CBS),胱硫醚c-裂解酶 (CSE),3-巯基丙酮酸硫转移酶 (3MST),半胱氨酸-天冬氨酸转氨酶 (CAT)。
图 1. 产生ROS、RNS和RSS的各种酶促和非酶促过程,以及它们之间的相互作用(消耗和产生)。缩写:胱硫醚b-合酶 (CBS),胱硫醚c-裂解酶 (CSE),3-巯基丙酮酸硫转移酶 (3MST),半胱氨酸-天冬氨酸转氨酶 (CAT)。
RNS 主要包括一氧化氮 (NO),由NO合酶从精氨酸合成,及其衍生的氮氧化态从1+到4+的分子,如过氧亚硝酸盐 (ONOO⁻)(NO与O₂•⁻反应形成的高活性中间体),二氧化氮 (NO₂) (NO与空气中的氧气反应或在其他活性物种如H₂O₂或过渡金属离子存在下氧化NO产生),S-亚硝基硫醇 (RSNO)(NO与硫醇反应形成),以及硝酰 (HNO)(NO的还原产物,硝酰阴离子的质子化形式)。RNS对于维持细胞氧化还原稳态、细胞信号传导、免疫应答和血管调节至关重要。然而,RNS的过量或失调产生会导致硝化应激,引起蛋白质硝化、脂质过氧化和DNA损伤。
活性硫物种 (RSS) 是一组含硫的高活性分子和中间体,在细胞信号传导、氧化还原调节和解毒中起着至关重要的作用。虽然对维持细胞稳态和防止氧化应激至关重要,但RSS的过量产生也可能导致细胞损伤。常见的生物学相关RSS包括生物硫醇(最常研究的生物硫醇是谷胱甘肽 (GSH)、半胱氨酸 (Cys) 和同型半胱氨酸 (Hcy)),硫化氢 (H₂S),硫自由基 (RS•),二硫化物 (RSSR),次磺酸 (RSOH),二氧化硫/亚硫酸盐/亚硫酸氢盐 (SO₂/SO₃²⁻/HSO₃⁻),过硫化物 (H₂S₂) 和多硫化物 ((R₂Sn/H₂Sn, n > 2))。此外,具有氧化还原活性的金属,如铁 (Fe) 和铜 (Cu),参与重要的酶促反应,同时在失调条件下有产生自由基的风险,也参与氧化还原稳态的调节。综上所述,上述具有氧化还原活性的组分构成了一个高度调控的网络,这些组分之间的动态相互作用确保了细胞过程的最佳功能,同时最大限度地减少了过度氧化或还原应激造成的损害。这种平衡的破坏,即氧化还原失调,可导致多种疾病的发生,包括炎症性疾病、癌症和神经退行性疾病。在这些疾病中,由于活性物种的过量产生或抗氧化防御的耗尽导致的氧化还原失衡,会引起蛋白质翻译后修饰、细胞功能障碍和组织损伤,最终导致疾病进展。因此,实时动态监测与氧化还原相关的生物活性组分,对于更深入地理解氧化还原调控机制,以及全面揭示与氧化还原平衡相关的生理和病理事件的分子基础至关重要。
研究与氧化还原相关的生物活性物质是一项相当大的挑战,因为这些分子中的大多数寿命极短,通常在毫秒或更短的数量级。这些物质的快速衰变给在生物系统中观察和追踪其行为带来了重大挑战。此外,许多这类物质以低稳态浓度存在,通常在皮摩尔到低微摩尔范围内,这进一步使其检测复杂化。而且,由于细胞环境中生成和扩散速率的动态变化,它们的水平持续波动。这种波动给在任何给定时间点准确量化分子浓度带来了挑战。此外,这些生物活性物质可以迅速与蛋白质、脂质和DNA相互作用,导致其结构和功能改变,从而在正常生理过程和病理条件中发挥关键作用。因此,开发能够原位监测生物系统中物质生成、分布、积累和动态波动的有效分析工具,将为我们提供关于其时空行为的关键见解,从而增进我们对与氧化还原相关物质在各种生物过程中的作用的理解,并推动与氧化还原相关的疾病机制和治疗策略的研究。
荧光探针成像正成为一种检测与氧化还原相关物质的强有力工具,它提供卓越的灵敏度和时空分辨率,能够在动态、复杂的环境中对与氧化还原相关的物质进行实时和无创的监测,显著增强了我们研究活体系统中氧化还原生物学的能力,为我们提供了对其分子机制的宝贵见解。在这篇综述中,作者重点介绍参与维持氧化还原的关键生物分子,并深入探讨它们的调控机制,重点关注这些具有氧化还原活性的物质如何促进细胞稳态和氧化应激反应(图2)。此外,作者系统地讨论了主要在过去五年中,用于检测与氧化还原相关物质的荧光探针的最新进展。这包括对其设计策略、反应机理以及与其开发相关的挑战的概述。此外,还回顾了它们在研究与氧化还原相关的疾病(如癌症、神经退行性疾病和心血管疾病)中的生物成像应用,强调了它们在临床诊断和治疗干预中的潜力。 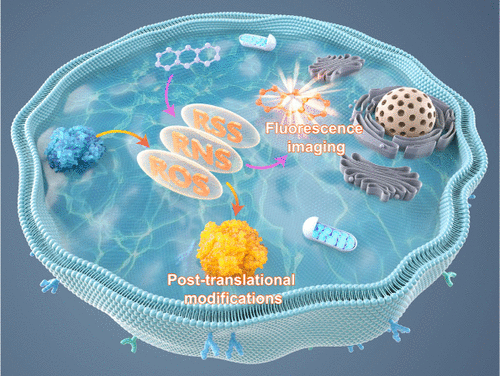 图 2. 氧化还原诱导的蛋白质翻译后修饰及其荧光成像。
图 2. 氧化还原诱导的蛋白质翻译后修饰及其荧光成像。
2. 活性氧 (Reactive Oxygen Species)
2.1. 过氧化氢 (Hydrogen Peroxide)
2.1.1. 过氧化氢简介
过氧化氢 (H₂O₂) 是一种非自由基ROS,可在多种生理和病理条件下产生。作为一种细胞内信号分子,H₂O₂ 可以激活多种细胞表面受体,增加细胞内ROS水平,从而导致下游信号通路的激活。 H₂O₂ 在细胞增殖和分化中也起着重要作用,通过激活特定的转录因子促进细胞生长和增殖。此外,为应对氧化应激和外部刺激,H₂O₂ 的产生和积累可促使细胞启动适应性反应,包括上调抗氧化酶的表达和抗氧化剂的合成。虽然H₂O₂在生理过程中起着关键的调节功能,但其过量积累可能导致细胞的氧化损伤。过量的H₂O₂可导致细胞膜、蛋白质和DNA的氧化,从而促进心血管疾病和癌症等病理状况的发展。
在生物环境中,H₂O₂ 可以通过氧化关键氨基酸残基来调节蛋白质功能和细胞生理过程。例如,H₂O₂ 可以将蛋白质中的半胱氨酸残基氧化成次磺酸 (-SOH),后者可进一步氧化成亚磺酸 (-SO₂H) 甚至磺酸 (-SO₃H)。这种翻译后修饰通常是可逆的,在细胞信号传导中起着至关重要的作用。同样,H₂O₂ 可导致半胱氨酸残基的硫氧化,这可能影响蛋白质的活性和稳定性。此外,H₂O₂ 可以通过将蛋氨酸残基氧化成蛋氨酸亚磺酸来不可逆地修饰蛋白质,导致蛋白质结构和功能的持久性变化。细胞膜中的脂质也可以与H₂O₂反应形成脂质过氧化物,影响细胞间的信号转导。在某些特定情况下,H₂O₂ 可以促进蛋白质的磷酸化修饰,影响信号通路的激活。
为了高通量地识别蛋白质氨基酸的氧化修饰位点,研究人员开发了一系列间接标记的化学蛋白质组学方法。化学选择性质谱探针因其独特优势已被用于标记蛋白质的氧化翻译后修饰。自从Benitez和Allison在1974年首次提出半胱氨酸次磺酸的关键反应以来,二甲双酮已被广泛用作半胱氨酸次磺酸 (Cys–SOH) 的标记探针。2008年,Carroll及其同事合成了一种叠氮标记的二酮衍生物,并测试了该探针在细胞裂解液和活细胞中可以标记的次磺酸位点(图3)。此后,多个研究小组评估了各种二酮类似物对次磺酸反应的影响,并开发了蛋白质次磺酸标记探针,以获取关于-SOH修饰的蛋白质和位点的信息。
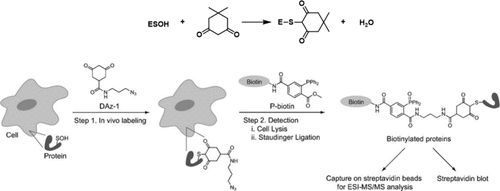 图 3. 上图:1974年Benitez和Allison提出的二甲双酮与次磺酸反应的机理(E代表酰基磷酸酶)。下图:直接在活细胞中检测次磺酸修饰蛋白质的策略。
图 3. 上图:1974年Benitez和Allison提出的二甲双酮与次磺酸反应的机理(E代表酰基磷酸酶)。下图:直接在活细胞中检测次磺酸修饰蛋白质的策略。
Carroll及其同事与Yang及其同事合作,利用Wittig试剂的反应性和磺酸的独特化学性质(可在亲核的α-C和亲电的γ-S之间产生共价键),构建了一个-SOH位点传感器。合成的质谱探针具有高选择性、快速性,并能对次级磺化位点进行特异的蛋白质组学化学计量分析,并可视化线粒体半胱氨酸氧化的变化,从而促进小分子向线粒体的转移(图4)。
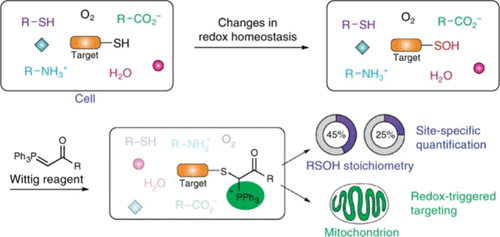 图 4. 复杂生物环境中质谱探针与次磺酸的反应性。
图 4. 复杂生物环境中质谱探针与次磺酸的反应性。
Tang及其同事设计并开发了一种功能性探针,生物素-苯并硼氧杂环戊烯 (Bioben),用于检测Cys–SOH,该探针基于硼酸/苯并氧杂硼杂环戊烯能与次磺酸形成可逆复合物的反应(图5)。在这项工作中,他们引入了一个小分子的次磺酸模型,以验证探针在体外与次磺酸反应的能力。通过使用各种蛋白质次磺酸模型和蛋白质组学测试进行进一步验证,结果表明该探针能有效结合Cys–SOH,即使在低浓度下也表现出良好的捕获效率和灵敏度。该探针的标记时间明显短于其他常用探针。所提出的方法为研究蛋白质氧化修饰中的S-次磺酸化提供了一种策略,并有助于相关的生物学和临床应用。
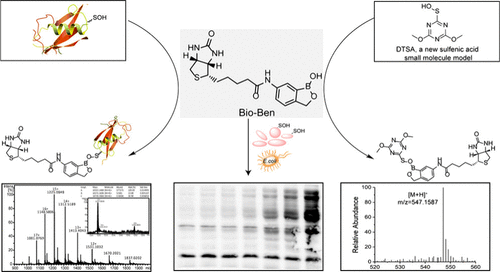 图 5. 左图:使用bioben标记大肠杆菌蛋白质上Cys–SOH的工作流程。右图:大肠杆菌蛋白质上S-次磺酸化的分析。
图 5. 左图:使用bioben标记大肠杆菌蛋白质上Cys–SOH的工作流程。右图:大肠杆菌蛋白质上S-次磺酸化的分析。
2.1.2. H₂O₂ 的荧光成像
作为一种重要的信号分子,H₂O₂ 可以通过多种翻译后氧化修饰来调节蛋白质功能。这些修饰不仅对细胞生理过程至关重要,而且与多种疾病的发生密切相关。因此,实时检测H₂O₂对于深入研究H₂O₂及其翻译后氧化修饰的机制和生物学效应具有重要意义,从而阐明疾病的分子机制。与质谱法相比,基于荧光探针的方法具有多种优势,包括高时空分辨率,以及与活细胞或体内成像的兼容性。这些特点使荧光探针特别适用于动态和无创的生物学研究。
2.1.2.1. 基于 Payne/Dakin 反应机理的 H₂O₂ 荧光成像策略
Yang及其同事基于Payne/Dakin反应开发了一种H₂O₂识别基团。由H₂O₂激活的反应将缺电子的腈转化为过氧亚胺酸。随后,邻羟基苯甲醛在-中性pH下经历Dakin氧化转化为苯酚,随后释放荧光产物。基于这种独特化学策略的探针 1(图6,表1)可以通过常规偶联反应合成。利用共聚焦成像和流式细胞术,该探针成功检测到小鼠巨噬细胞中饥饿诱导的H₂O₂产生。
表1. 部分 H₂O₂ 荧光探针
| 探针 | λex/λem (nm) | 检测限 | 响应时间 | 响应类型 | 响应机理 | 参考文献 |
|---|---|---|---|---|---|---|
| 1 | 520/543 | 0.53 nM | 30 分钟 | 关-开 | ICT | 10.1002/anie.201805162 |
| 2 | 405/510 | n.d. | 15 分钟 | 关-开 | ICT | 10.1002/anie.202007104 |
| 3 | n.d. | n.d. | 5 分钟 | 关-开 | n.d. | 10.1016/j.biomaterials.2018.07.003 |
| 4 | 350/550 | 110 nM | n.d. | 关-开 | ICT | 10.1039/C9SC03781K |
| 5 | n.d. | n.d. | n.d. | 关-开 | ICT | 10.1021/jacs.8b02279 |
| 6 | 446/560 | 0.20 μM | 60 分钟 | 比率 | ICT | 10.1039/C9SC04384E |
| 7 | 350/483 | 1.72 μM | n.d. | 关-开 | ICT | 10.1021/jacs.9b09813 |
| 8 | n.d. | 7.1 nM | 3 分钟 | 关-开 | n.d. | 10.1002/anie.202005429 |
| 9 | 405/580 | n.d. | n.d. | 关-开 | ICT | 10.1002/anie.202005959 |
| 10 | 401/470 | 68 ± 5 nM | 8 分钟 | 关-开 | ICT | 10.1021/jacs.0c00771 |
| 11 | 488/520 | n.d. | n.d. | 关-开 | ICT | 10.1073/pnas.2018513118 |
| 12 | 808/1060 | 1.2 μM | 100 分钟 | 关-开 | ICT | 10.1002/ange.202419191 |
| 13 | 695/723 | 2.7 μM | 30 分钟 | 关-开 | ICT | 10.1016/j.cej.2023.142496 |
| 14 | 480/710 | 23.08 nM | 30 分钟 | 比率 | ICT | 10.1016/j.cej.2023.144900 |
| 15 | 703/730 | n.d. | 7 分钟 | 关-开 | ICT | 10.1016/j.biomaterials.2024.122506 |
| 16 | n.d. | 0.1 μM | n.d. | 关-开 | n.d. | 10.7150/thno.22481 |
| 17 | 365/642 | 5.0 nM | n.d. | 关-开 | n.d. | 10.1002/advs.201903525 |
| 18 | 808/938 | 0.74 μM | n.d. | 关-开 | AIE | 10.1038/s41467-021-27233-4 |
| 19 | 670/925 | 44.4 nM | n.d. | 关-开 | FRET | 10.1002/advs.202207651 |
| 20 | 610/700 | n.d. | n.d. | 关-开 | PET | 10.1016/j.cej.2022.139330 |
| 21 | PA 1064 | n.d. | n.d. | 关-开 | n.d. | 10.1016/j.biomaterials.2024.122506 |
| 22 | 808/1003 | n.d. | n.d. | 关-开 | n.d. | 10.7150/thno.22481 |
缩写:无数据 (n.d.), 分子内电荷转移 (ICT), 聚集诱导发光 (AIE), 光诱导电子转移 (PET), Förster共振能量转移 (FRET), 光声 (PA)。
 图 6. 基于烯丙基硒醚氧化的部分H₂O₂荧光探针。
图 6. 基于烯丙基硒醚氧化的部分H₂O₂荧光探针。
2.1.2.2. 基于烯丙基硒醚氧化的H₂O₂荧光成像策略
Koide及其同事设计了探针 2 用于快速检测H₂O₂。该探针引入了烯丙基硒醚氧化产物的Mislow-Evans重排反应,该反应选择性地与H₂O₂反应并发射荧光信号。这种烯丙基硒醚化合物可被H₂O₂氧化形成氧化硒中间体。随后,该中间体经历Mislow-Evans重排和水解,最终释放荧光素,从而实现H₂O₂的监测。作者测量了速率常数并验证了探针 2(图6)可以定量检测H₂O₂的浓度。该探针成功用于检测细胞和斑马鱼中的外源性和内源性H₂O₂。
2.1.2.3. 基于过氧酯氧化的H₂O₂荧光成像策略
Lee及其同事开发了负载姜黄素的香草醇共聚草酸酯 (PVAX) 纳米粒子(图7,探针 3),作为缺血性损伤的对比增强超声成像剂和按需治疗剂。这是基于PVAX纳米粒子通过H₂O₂触发的过氧酯氧化产生回声CO₂气泡的假设,姜黄素和PVAX的组合发挥了可由H₂O₂激活的协同治疗效果。与空的PVAX纳米粒子和等量姜黄素相比,探针 3 在血管内皮细胞中表现出显著更高的抗氧化和抗炎活性。采用缺血性损伤的小鼠模型评估探针 3 作为超声成像剂和按需治疗剂的潜力,结果显示探针 3 可以抑制促炎细胞因子如肿瘤坏死因子-α (TNF-α) 和白细胞介素-1β (IL-1b) 的表达。此外,探针 3 增加了血管内皮生长因子 (VEGF) 和血小板内皮细胞粘附分子-1 (PECAM-1, 也称为CD31) 的水平,导致血液灌注到缺血组织中。
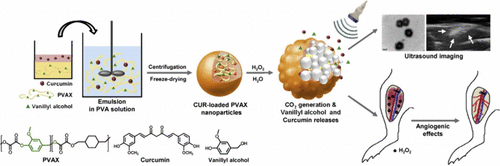
图 7. Ur PVAX 纳米粒子(探针 3)作为PAD纳米治疗剂的示意图。
2.1.2.4. 基于硼酸酯氧化反应的H₂O₂荧光成像策略
Zhang及其同事开发了一种基于乙二醇壳聚糖 (GC) pH依赖性表面电荷转换的含硼酸酯双光子荧光纳米探针(图8,探针 4),用于肿瘤靶向的H₂O₂成像。GC上的氨基使得GC–NABP(探针 4)能够在酸性肿瘤微环境中将负电荷转换为正电荷。探针 4 的正电荷促进了与细胞膜的静电相互作用,从而增强了在酸性环境中的细胞摄取。细胞摄取后,肿瘤细胞中高水平的H₂O₂触发了纳米探针的硼酸脱保护,导致强烈的荧光发射。探针 4 对H₂O₂表现出良好的灵敏度和选择性,体外检测限为110 nM。在酸性条件下,活细胞和组织的流式细胞术和双光子荧光成像结果证实了探针 4 的H₂O₂检测能力。
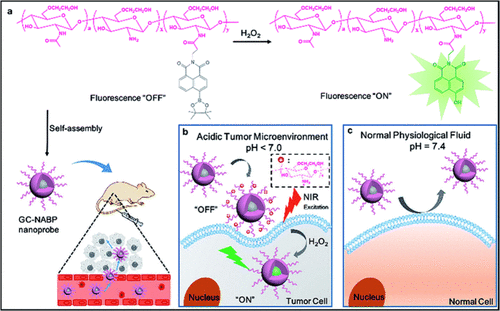 图 8. (a) GC–NABP(探针 4)在H₂O₂存在下的“开启”荧光以及自组装GC–NABP纳米探针用于体内靶向成像的示意图。(b) 在酸性肿瘤微环境中使用GC–NABP纳米探针靶向成像肿瘤细胞中的H₂O₂。(c) 在正常生理液体中GC–NABP纳米探针的示意图。
图 8. (a) GC–NABP(探针 4)在H₂O₂存在下的“开启”荧光以及自组装GC–NABP纳米探针用于体内靶向成像的示意图。(b) 在酸性肿瘤微环境中使用GC–NABP纳米探针靶向成像肿瘤细胞中的H₂O₂。(c) 在正常生理液体中GC–NABP纳米探针的示意图。
Chang及其同事设计了一种基于硼酸酯的探针 5(图9),该探针通过H₂O₂介导的硼酸氧化反应产生嘌呤霉素。嘌呤霉素是一种带有α-氨基的核苷,可以与核糖体内的初级肽段结合,有效地附加一个永久且浓度依赖性的标签。通过利用嘌呤霉素特异性抗体和免疫荧光成像技术,对细胞中的H₂O₂进行了检测。该方法不仅证明了其在正常生理条件和氧化应激下分析H₂O₂水平的能力,而且还揭示了不同细胞系中H₂O₂水平的差异。
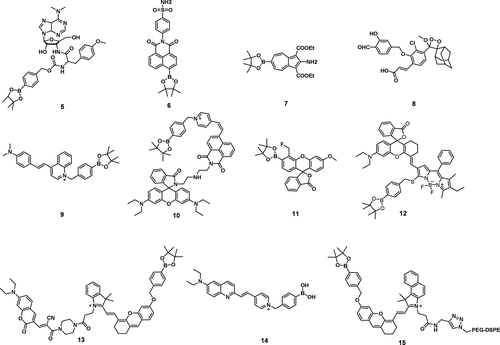 图 9. 基于硼酸酯氧化反应的部分H₂O₂荧光探针。
图 9. 基于硼酸酯氧化反应的部分H₂O₂荧光探针。
Tang及其同事通过引入苯磺酰胺单元作为高尔基体靶向基团,设计了一种比率型双光子荧光探针 6,用于检测H₂O₂。在与H₂O₂反应后,硼酸酯单元转化为羟基,这促进了萘酰亚胺共轭体系中的推拉电子效应,从而增强了荧光发射。使用探针 6,在小鼠肾细胞的高尔基体中进行了双光子成像。与对照组相比,高血压小鼠的荧光强度比率显著增加,证实了高尔基体中的氧化应激与高血压之间存在强烈的相关性。
Lewis及其同事报道了一种与硼酸酯受体基序共轭的荧光团——薁,并探索了探针 7 通过双光子成像在体内可视化ONOO⁻和H₂O₂的能力。作者切片了大鼠的海马体并用探针 7 进行染色。与细胞实验结果一致,双光子图像在海马CA1区显示出微弱的荧光信号。然而,用佛波醇12-肉豆蔻酸酯13-乙酸酯 (PMA) 和3-吗啉基悉尼酮盐酸盐 (SIN-1) 处理后荧光信号增强,而用依布硒处理后信号减弱,证实探针 7 可用于检测组织中的ROS。
Yang及其同事通过将Payne/Dakin反应与化学发光支架相结合,并将H₂O₂特异性响应基团嫁接到发光二氧戊环基团上,开发了一种化学发光探针 8,用于体外和体内检测H₂O₂。探针 8 的化学发光可由H₂O₂直接触发,亮度在3分钟内增加430倍。探针 8 成功检测了三氧化二砷对白血病造成的氧化损伤,并可视化了大鼠脑缺血再灌注期间的H₂O₂。先前的研究表明,中风的脑再灌注治疗可能加剧继发性神经血管损伤,表现为白细胞浸润和血脑屏障功能障碍。值得注意的是,H₂O₂的爆发被认为是这些病理的起因,通过放大氧化应激和激活焦亡/凋亡。为了阐明这一机制,作者采用了一种空间分辨探针 8 来绘制大鼠脑缺血再灌注期间的实时H₂O₂通量动态,并检测三氧化二砷对白血病造成的氧化损伤。
Zhang及其同事设计了一种基于喹啉乙烯基N,N-二甲基苯基硼酸酯衍生物的阳离子探针 9。 苯基硼酸酯部分通过单个碳原子间隔基与喹啉乙烯基-N,N-二甲苯胺连接,从而形成带正电荷的N-烷基喹啉化合物。由于分子内单键旋转导致激发态能量耗尽,探针 9 本身不发荧光。阳离子盐结构赋予探针 9 特异性靶向线粒体的能力。探针 9 可以通过三种不同方式与H₂O₂、蛋白质和核酸相互作用:1) 与H₂O₂发生化学反应,消除硼酸基团,将喹啉鎓转化为喹啉衍生物;2) 探针 9 的疏水性 (logP = 2.995) 使其能与暴露有疏水囊的蛋白质结合;3) 探针 9 的正电荷和π-共轭使其能与带负电荷的核酸(DNA和RNA)相互作用,导致探针的凝固和聚集。因此,该探针展示了利用三种不同的荧光切换模式同时区分和成像线粒体H₂O₂、表面疏水囊内的蛋白质和核酸的能力。这项研究证实,H₂O₂作为上游信号分子,调节线粒体内核蛋白的解离。
Tian及其同事开发了一种基于双光子荧光寿命的探针 10,它可以通过不同的荧光寿命信号同时测定线粒体中的H₂O₂和ATP。 由于线粒体膜的负电位,探针 10 的吡啶阳离子有助于其在线粒体内积累。H₂O₂响应位点源自一个萘酰亚胺荧光团,该位点的苯基硼酸酯抑制了荧光团的荧光。当H₂O₂选择性地与苯基硼酸酯反应时,它会去除淬灭基团,从而恢复萘酰亚胺荧光团的荧光。该探针被应用于不同条件下线粒体中H₂O₂和ATP水平变化的荧光寿命成像。此外,由于探针 10 的双光子吸收能力,它适用于分析正常氧和缺氧条件下斑马鱼幼体中H₂O₂和ATP的水平。
Chang及其同事引入了一种新颖的级联激活传感和标记方法,不仅可以检测H₂O₂,还有助于永久记录其空间分布。 在与H₂O₂反应后,探针 11 上的硼酸酯形成酚羟基,随后发生1,4-消除反应,去除了亚甲基氟。这个过程产生了一个高活性的亚甲基醌中间体,可以共价标记周围蛋白质的亲核性,从而触发探针的荧光并能够永久保存H₂O₂的空间信息。该探针可以在胶质细胞-神经元共培养模型中可视化细胞间的H₂O₂信号。这种级联传感和标记策略为设计具有高空间保真度的化学探针提供了一种方法。
Kim及其同事开发了一种代谢酸性/H₂O₂双级联激活的荧光探针 12。 该探针需要同时存在酸性肿瘤微环境和高水平H₂O₂才能激活荧光信号。这种双重需求最大限度地减少了非特异性信号和假阳性,从而提高了肿瘤成像的准确性和信噪比。结果表明,H₂O₂促进了BODIPY供体的加速释放。结合酸性条件下罗丹明的开环结构,这恢复了分子内电荷转移过程,导致近红外-II区荧光显著增强。借助探针 12,成功切除了直径约为0.7毫米的微小肺转移瘤。在临床癌症标本中,该探针在清晰描绘肿瘤病变和边界方面表现出卓越的功效。
Yin及其同事设计了探针 13,用于同时检测H₂O₂和GSH。 选择了具有非干扰荧光特性的半花青和香豆素作为荧光报告基团。α,β-不饱和双键和苯基硼酸分别作为GSH和H₂O₂的特异性响应位点。在与H₂O₂和GSH反应后,探针 13 分别发射近红外和青色荧光,从而能够通过差异光谱波长同步检测H₂O₂和GSH。作者使用该探针证明,铁死亡抑制剂Fer-1可以下调H₂O₂和GSH的水平,以减轻肾脏缺血-再灌注损伤。
Long及其同事提出了一种比率型近红外荧光探针 14,用于定量检测各种食品样品中的H₂O₂。 该探针的检测限为23.08 nM (S/N = 3),并成功应用于检测活细胞中的外源性和内源性H₂O₂。此外,还监测了感染马铃薯晚疫病菌的马铃薯组织中H₂O₂水平的变化。该探针与便携式检测设备和智能手机协同工作,通过比色和荧光检测的双信号输出,实现了对鸡翅和牛奶中H₂O₂的实时定量测量。
Liu及其同事设计了一种血小板 (PLT) 标记策略,用于特异性非酒精性脂肪性肝炎 (NASH) 诊断。 在该方法中,H₂O₂响应部分与DSPE-PEG共轭,开发出一种水分散性探针 15,随后通过脂质融合将其插入PLT膜中,形成工程化PLT (PLT-DP)。PLT-DP首先可以与浸润的库普弗细胞和丰富的细胞外基质透明质酸结合,然后在炎症部位选择性积聚,形成一个相互作用网络。捕获在PLT-DP表面的探针 15 随后与炎症部位的H₂O₂反应,导致荧光增强,从而实现NASH诊断。
2.1.2.5. 基于其他氧化相关机理的H₂O₂荧光成像策略
Kim及其同事制备了一种过氧草酸酯化学发光探针 16(图10),该探针是通过聚合表面活性剂Pluronic F-127、双草酸酯 (CPPO) 和苯乙烯蒽衍生物疏水性染料 (BDSA) 组装而成。 该探针成功用于实时、无创地成像双氧化酶2 (Duox2) 介导的呼吸道免疫应答。结果显示,探针 16 在体外人黏膜上皮细胞和体内小鼠黏膜上皮细胞的炎症状态下提供了有效的H₂O₂成像。通过利用探针 16 的化学发光特性,该研究实现了对H₂O₂的高灵敏度和特异性检测,证实了其作为活体生物中内源性H₂O₂实时、无创纵向检测有效工具的潜力。这种方法为理解呼吸道免疫应答的机制提供了宝贵的见解。
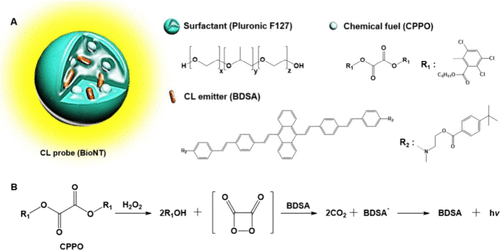
图 10. 探针 16 (BioNT) 的响应机理和体内成像。(A) BioNT的示意图和组成部分。(B) 在BioNT中发生的POCL反应示意图。
Shan及其同事报道了近红外 (NIR) 化学发光 (CL) 碳纳米点 (CDs)(图11,探针 17)的开发及其在H₂O₂生物成像中的应用。 这些CDs表现出极高的CL量子产率,达到9.98 × 10⁻³ 爱因斯坦/摩尔。通过两亲性三嵌段共聚物的桥接作用,将CDs与过草酸酯部分 (P-CDs) 整合,使其能够作为开启型探针,用于H₂O₂的灵敏检测和成像。P-CDs表现出卓越的效率和NIR光子显著的穿透深度,促进了其在体外和体内H₂O₂生物成像中的应用。检测限低至5 × 10⁻⁹ M,P-CDs还被用于腹膜炎小鼠模型中成像炎症性H₂O₂,展示了其在诊断和治疗炎症相关疾病和癌症方面的潜力。
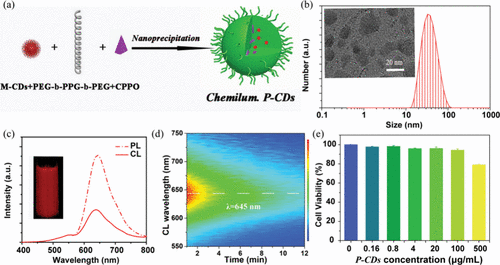 图 11. (a) P-CDs(探针 17)的制备示意图。(b) P-CDs的动态光散射 (DLS) 分布。(c) P-CDs的光致发光 (PL) 和化学发光 (CL) 发射光谱,PL光谱是在540 nm激发下检测P-CDs水溶液,CL是通过将1 mL, 10 mg/mL P-CDs溶液加入到20 × 10⁻³ M H₂O₂中检测。(d) P-CDs的动态CL光谱。(e) 在不同浓度的P-CDs中孵育24小时后Hela细胞的活力。
图 11. (a) P-CDs(探针 17)的制备示意图。(b) P-CDs的动态光散射 (DLS) 分布。(c) P-CDs的光致发光 (PL) 和化学发光 (CL) 发射光谱,PL光谱是在540 nm激发下检测P-CDs水溶液,CL是通过将1 mL, 10 mg/mL P-CDs溶液加入到20 × 10⁻³ M H₂O₂中检测。(d) P-CDs的动态CL光谱。(e) 在不同浓度的P-CDs中孵育24小时后Hela细胞的活力。
Zhao及其同事设计了一种基于AIE的可激活苯并噻二唑核纳米探针,BTPE-NO₂@F127(图12,探针 18)。 该探针具有一个与两个四苯基基团共轭的苯并噻二唑核心,作为疏水性分子转子。随后,在核心的两端引入了硝基苯氧乙酰胺单元,起到识别元件和荧光猝灭剂的双重作用。然后,使用两亲性聚合物Pluronic F127封装BTPE-NO₂分子,生成纳米探针BTPE-NO₂@F127。该探针能够原位检测并响应曲唑酮诱导的肝损伤、肝缺血-再灌注损伤 (I/R) 以及间质性膀胱炎小鼠模型中的H₂O₂。此外,生成的三维图像为疾病部位的空间分布提供了宝贵的见解,通过详细的三维信息增强了可视化效果。
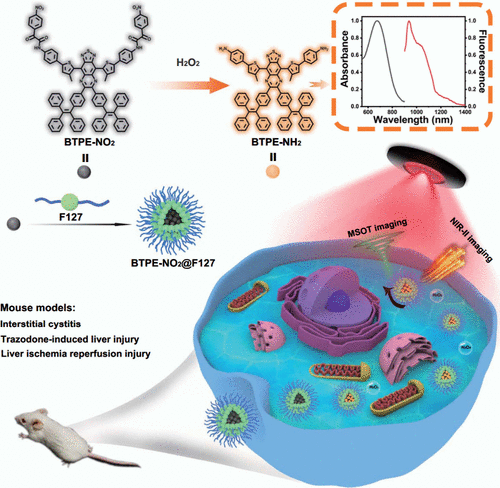
图 12. 纳米探针 18 (BTPE-NO₂@F127) 的制备和应用示意图。
Wang及其同事设计了一种近红外-II化学发光纳米探针(图13,探针 19),用于追踪体内H₂O₂的波动。 该探针是通过将CPPO、半导体聚合物 (PFODBT) 和AIEgens BPN-BBTD纳米沉淀到Plannik F127中制备的。封装的传感部分通过两个级联能量转移过程(CRET和FRET)产生近红外-II化学发光。CRET指的是在H₂O₂存在下,能量从CPPO转移到PFODBT的过程。掺杂的CPPO被用作化学发光底物,它与H₂O₂特异性反应产生高能中间体。随后,通过分子间电子转移,中间体首先从PFODBT获得电子,生成二氧化碳自由基阴离子和PFODBT自由基阳离子。阳离子和阴离子发生逆电子转移,生成激发态的PFODBT,其在近红外-I区发光。当激发态的PFODBT将接收到的能量转移到能量受体BPN-BBTD时发生FRET,从而在近红外-II区发光。
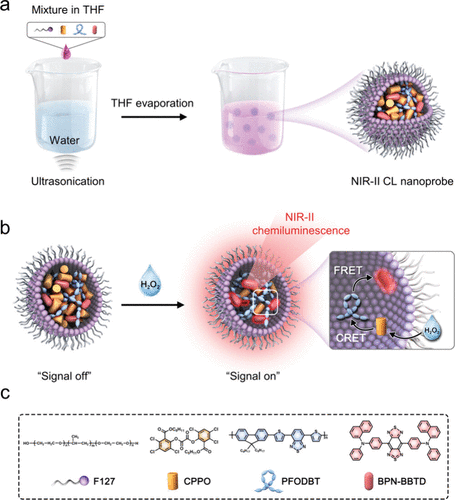
图 13. (a) 合成近红外-II CL纳米探针 19 的示意图。(b) 近红外-II CL纳米探针的近红外-II化学发光机理。(c) 用于合成近红外-II CL纳米探针的F127、CPPO、PFODBT和BPN-BBTD的结构。
Liu及其同事设计了一种基于酞菁铁的探针,FeS₂@PcD(图14,探针 20), 作为一种多功能纳米反应器用于诊断和治疗。该探针被设计为受肿瘤微环境中H⁺和H₂O₂水平的调节。在高浓度的H⁺和H₂O₂存在下,探针与H⁺反应释放PcD并生成Fe²⁺。随后,Fe²⁺被H₂O₂氧化为Fe³⁺,导致PcD荧光的恢复。对H⁺和H₂O₂水平的可编程调节导致 20 的磁共振信号和声敏性从“关”态切换到“开”态。20 的这些特性在肿瘤细胞和HepG2荷瘤小鼠中得到进一步探索,突显了其作为癌症治疗中靶向诊断和治疗的多功能纳米反应器的潜力。
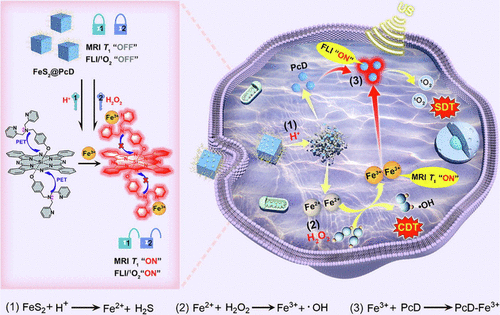 图 14. FeS₂@PcD的制备和可编程机理。在H⁺和H₂O₂的可编程调节下,FeS₂@PcD的MRI、荧光和声敏活性从“关”态变为“开”态。
图 14. FeS₂@PcD的制备和可编程机理。在H⁺和H₂O₂的可编程调节下,FeS₂@PcD的MRI、荧光和声敏活性从“关”态变为“开”态。
Zhao及其同事构建了一种纳米隔室限制策略,以促进生物系统内广泛的聚合反应。 通过将辣根过氧化物酶 (HRP) 和苯胺类似物封装在囊泡中,实现了响应H₂O₂的内源性聚合。在这些底物中,ADPAH@AOT(图15,探针 21)在响应H₂O₂后在近红外-II区显示出明显的吸收。通过与肿瘤细胞孵育,发现该处理可以诱导免疫原性细胞死亡 (ICD),促进树突状细胞的成熟,并激活免疫应答。由于肿瘤中H₂O₂的过表达,该系统显示出作为可激活的近红外-II光热免疫治疗的潜力。借助菠萝蛋白酶降解肿瘤细胞外基质,ADPAH@AOT促进了小鼠体内的ICD效应,增强了树突状细胞的成熟,增加了T细胞浸润,并增强了免疫应答。
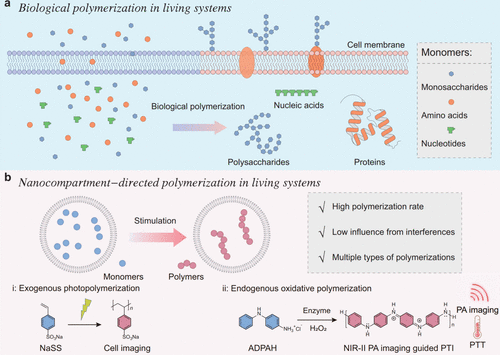 图 15. ADPAH@AOT(探针 21)反应示意图。(a) 单糖、氨基酸和核苷酸的生物聚合,用于合成多糖、蛋白质和核酸,以构成基本组分,赋予基本功能,并调节生物过程。(b) 纳米隔室限制策略,使广泛的聚合反应在活体系统中成为可能:4-苯乙烯磺酸钠 (NaSS) 的外源性光聚合和对氨基二苯胺盐酸盐 (ADPAH) 的内源性氧化聚合。NIR-II PA成像:第二近红外光声成像,PTI:光热免疫治疗,PTT:光热治疗。
图 15. ADPAH@AOT(探针 21)反应示意图。(a) 单糖、氨基酸和核苷酸的生物聚合,用于合成多糖、蛋白质和核酸,以构成基本组分,赋予基本功能,并调节生物过程。(b) 纳米隔室限制策略,使广泛的聚合反应在活体系统中成为可能:4-苯乙烯磺酸钠 (NaSS) 的外源性光聚合和对氨基二苯胺盐酸盐 (ADPAH) 的内源性氧化聚合。NIR-II PA成像:第二近红外光声成像,PTI:光热免疫治疗,PTT:光热治疗。
Yang及其同事提出了一种微环境定制的催化纳米探针 (MTCN,探针 22),用于肿瘤和淋巴转移中H₂O₂的比率型近红外-II荧光和光声成像(图16)。 MTCN由Fe²⁺、柠檬酸、过氧化物酶底物 (ABTS)、下转换纳米粒子和封装在脂质体腔内的参考染料组成。脂质体膜为Fe²⁺催化剂提供了有利的酸性pH环境,并阻止了谷胱甘肽的进入,否则谷胱甘肽会抑制信号。在暴露于H₂O₂后,ABTS催化转化为其氧化形式ABTS•⁺,增加了808 nm处的光声信号,并降低了近红外II荧光,从而实现了比率成像。探针 22 成功用于可视化皮下和前哨淋巴结转移瘤中的H₂O₂,具有良好的灵敏度和高穿透深度。
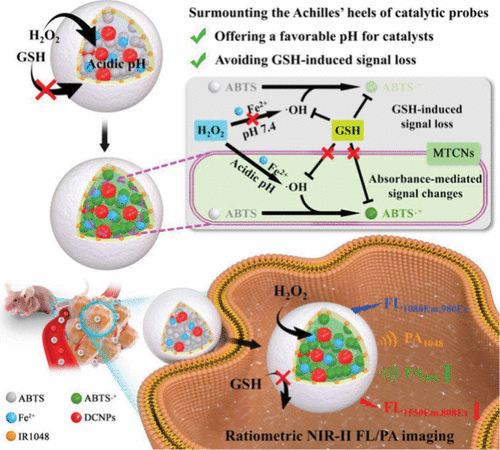 图 16. MTCNs(探针 22)用于肿瘤和淋巴转移中H₂O₂比率型近红外-II FL/PA成像的示意图。
图 16. MTCNs(探针 22)用于肿瘤和淋巴转移中H₂O₂比率型近红外-II FL/PA成像的示意图。
2.2. 脂质过氧自由基 (Lipid Peroxide Radicals)
2.2.1. 脂质过氧自由基简介
脂质过氧自由基 (ROO•) 是脂质过氧化过程中产生的关键ROS。 脂质过氧化是一个复杂的生化过程,主要分为三个阶段: 在氧化应激条件下,自由基(如•OH)与脂质分子反应,导致脂质分子中的氢原子被夺走,形成脂质过氧自由基; ROO•可以与其他脂质分子反应生成新的过氧化物,促进进一步的氧化反应。这个过程可以诱导更多的脂质过氧化,形成连锁反应; 通过抗氧化剂(如维生素E和谷胱甘肽)的作用或酶促反应,脂质过氧化最终被终止,从而减少对细胞的损害。 在正常生理条件下,细胞中ROO•的存在与细胞信号转导密切相关。ROO•可以作为信号分子调节细胞增殖、分化和凋亡。它们还可以激活特定的信号通路(如MAPK通路),影响细胞功能。 在免疫系统中,脂质过氧化产物可以调节免疫细胞的活性,促进炎症反应的发生,在人体对抗感染和修复受损组织中起着至关重要的作用。虽然ROO•在生理过程中起着重要作用,但其过量产生或不平衡的调节可能导致各种病理状态。在细胞中,过度的脂质过氧化导致氧化应激,损害细胞膜、蛋白质和DNA。氧化应激是许多疾病(包括心血管疾病、癌症和神经退行性疾病)的重要诱因。 此外,研究表明,ROS诱导的脂质过氧化在细胞死亡(如凋亡和自噬)中起着关键作用。过度的脂质过氧化可能激活促凋亡信号通路,导致程序性细胞死亡。 相反,脂质过氧化产物(如羟基壬烯醛)可以引发慢性炎症反应,导致多种疾病的发生。
细胞系统内ROO•的调节是一个复杂且多方面的过程。它们在生理过程中的信号传导中起着关键作用,但过量产生可能导致一系列病理状态。未来的研究应进一步阐明脂质过氧化的具体机制,为预防和治疗相关疾病提供新的思路和策略。通过调节脂质过氧化,可能有助于改善细胞健康,降低疾病风险,从而增强整体健康。目前,研究人员已经设计并开发了特异性识别ROO•的探针,用于可视化监测。
2.2.2. 脂质过氧自由基的荧光成像
2.2.2.1. 基于自由基氧化偶联机理的ROO•荧光成像策略
Xiao及其同事设计了一种对氨基苯硫酚 (PATP) 和血红素修饰的金纳米探针 (Au/PATP/Hemin)(图17,探针 23),实现了用一种探针同时检测所有五种ROS。 PATP可以通过自由基氧化偶联机理与•OH、O₂•⁻、ROO•和¹O₂反应,形成4,4'-二巯基偶氮苯 (DMAB)。DMAB在1142、1386和1432 cm⁻¹处激发强烈的特征性表面增强拉曼散射 (SERS) 峰,因此可以直接检测•OH、O₂•⁻、ROO•和¹O₂,而H₂O₂则可以通过血红素催化的芬顿反应将其转化为•OH来间接检测。在肿瘤和过敏性皮炎两种代表性小鼠模型中,Au/PATP/Hemin纳米探针以高灵敏度和定量的方式显示了其在监测肿瘤发生和炎症进展方面的强大性能。
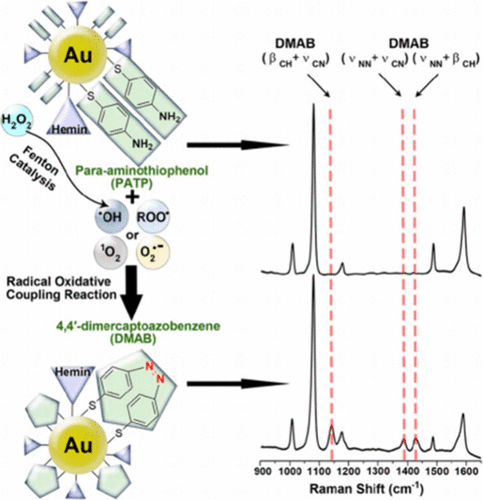
图 17. 探针 23 (PATP) 的反应机理。
2.2.2.2. 基于C=C双键氧化的ROO•荧光成像策略
高通量筛选已确定Ferrostatin-1 (Fer-1) 和Lipoxstatin-1 (Lip-1) 是铁死亡的有效抑制剂。它们的功效归因于抑制脂质氢过氧化物的积累,这很可能是由它们的自由基清除和抗氧化特性介导的。基于这一发现,Pratt及其同事假设,作为自由基捕获抗氧化剂 (RTA) 的二芳基胺化合物也可能对铁死亡诱导的铁沉积表现出抑制作用。 STY-BODIPY(图18,探针 24)是一种高吸收/荧光的可氧化底物,作为脂质过氧化反应进展的报告分子,因为它在脂质体中与多不饱和磷脂竞争过氧自由基的传播。体外实验结果证实,只有在原位有效转化为胺的氮氧化物才表现出显著的抑制活性,并且它们的功效与初始胺基的稳定性相关。作者使用该探针监测活细胞的脂质过氧化过程。监测了氧化和未氧化 24 的荧光,这表明正在经历铁死亡的细胞中脂质过氧化迅速增加。在小鼠胚胎成纤维细胞中进行的实验表明,与单独使用吩恶嗪(或其氮氧化物)处理的细胞相比,用吩恶嗪(或其氮氧化物)和超氧化物源组合处理的细胞对铁死亡诱导的铁沉积表现出更强的保护作用。
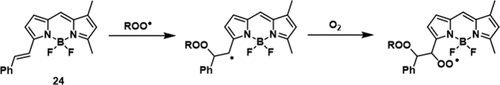 图 18. 基于C=C双键氧化的部分ROO•荧光探针 24。
图 18. 基于C=C双键氧化的部分ROO•荧光探针 24。
2.3. 次氯酸 (Hypochlorous Acid)
2.3.1. 次氯酸简介
次氯酸 (HClO) 是一种强氧化剂,能消除细菌和其他病原体,在人体的免疫防御中起着关键作用。 当被病原体(如细菌或病毒)感染时,中性粒细胞被激活并迁移到感染部位。中性粒细胞在NADPH氧化酶的存在下将氧气转化为O₂•⁻,后者迅速被超氧化物歧化酶 (SOD) 转化为H₂O₂。然后,H₂O₂在髓过氧化物酶 (MPO) 的催化作用下与氯离子 (Cl⁻) 反应生成HClO,然后释放到细胞内的吞噬体中,破坏病原体的结构完整性。
蛋白质组质谱法在检测由HClO引发的生化事件中起着至关重要的作用,主要是通过分析它在蛋白质上诱导的氧化修饰。 这项技术有助于研究由HClO引起的氧化应激反应、炎症和细胞损伤。 作为氧化应激的生物标志物,HClO在体内主要通过与生物分子相互作用发挥其作用,导致氧化修饰。 在蛋白质中,HClO靶向特定的氨基酸,包括酪氨酸、 半胱氨酸、 精氨酸、 和赖氨酸。 它氧化酪氨酸的酚羟基,形成醌衍生物如酪氨酸醌,这改变了其化学性质并影响其在蛋白质中的功能作用。HClO还氧化半胱氨酸的硫醇基,导致含硫氧化物,破坏蛋白质的结构和功能。精氨酸的氨基 (-NH₂) 与HClO反应被氯化和氧化。赖氨酸经历氯化,通过修饰赖氨酸残基影响蛋白质的结构和功能。除了蛋白质修饰,HClO还诱导脂质过氧化,特别是在膜脂质中。 HClO与磷脂双层中的不饱和脂肪酸链反应,引发自由基链式反应,导致脂质过氧化物的形成。此外,脂质过氧化的副产物,如丙二醛和4-羟基壬烯醛,可以与蛋白质和DNA相互作用,形成交联或突变,从而引发氧化应激和炎症。 HClO在免疫应答中也起着关键作用,帮助中性粒细胞摧毁病原体。 然而,免疫激活期间HClO的过量产生会损害宿主细胞膜,导致自身组织损伤。这突显了HClO在免疫防御和过度氧化应激下组织损伤潜力方面的双重作用。
2.3.2. 次氯酸的荧光成像
2.3.2.1. 基于硫醚或硒醚氧化的HClO荧光成像策略
氧族元素如硫 (S) 和硒 (Se) 显示出显著的单电子氧化潜力,使得含S和Se的化合物容易被HClO氧化。Liu及其同事设计了一种基于二吡咯硼氟化物 (BODIPY) 染料的双靶点序列激活荧光探针 25(图19,表2)。 高亲脂性的双(三氟甲基)苯基基团与BODIPY核心共轭,以增强探针的脂滴 (LDs) 靶向能力。探针 25 的硫醚可被HClO氧化成亚砜,削弱其给电子能力,从而降低ICT效应。通过同时成像LDs和HClO的相对浓度,探针 25 准确地描绘了主动脉中斑块的形状和分布。在ApoE⁻/⁻模型小鼠中,肝脏和主动脉都发现了丰富的脂质积累,但显著的氧化应激仅发生在主动脉,进一步证实了探针 25 准确识别动脉粥样硬化斑块的能力。
 图 19. 基于硫醚或硒醚氧化的部分HClO荧光探针。
图 19. 基于硫醚或硒醚氧化的部分HClO荧光探针。
表2. 部分HClO荧光探针
| 探针 | λex/λem (nm) | 检测限 | 响应时间 | 响应类型 | 响应机理 | 参考文献 |
|---|---|---|---|---|---|---|
| 25 | 561/600, 670 | 87 nM | 2 分钟 | 比率 | ICT | 10.1002/anie.202204518 |
| 26 | 480/565, 680 | 15.4 nM | 2 秒 | 比率 | PET | 10.1021/acs.analchem.4c00328 |
| 27 | 374/450, 560 | 1.8 nM | 30 分钟 | 比率 | ESIPT | 10.1016/j.saa.2022.121881 |
| 28 | 488/513 | 86 nM | n.d. | 关-开 | ICT | 10.1002/adma.202307008 |
| 29 | 585/700 | 0.84 μM | 2 秒 | 关-开 | ICT | 10.1021/acs.analchem.4c02130 |
| 30 | 520/682 | 0.90 μM | 30 分钟 | 关-开 | ICT | 10.1021/acs.analchem.4c02423 |
| 31 | 640/710 | 89.7 nM | 5 秒 | 关-开 | ICT | 10.1021/acs.analchem.2c03887 |
| 32 | 470/578, 641 | 68 nM | 6 秒 | 比率 | ICT | 10.1021/acs.analchem.4c02435 |
| 33 | 360/492, 562 | 89 nM | 60 秒 | 比率 | ICT | 10.1039/C8SC01697F |
| 34 | 684/768 | 102 nM | n.d. | 比率 | ICT | 10.1021/jacs.4c01173 |
| 35 | 405/535 | 0.108 μM | 30 秒 | 关-开 | AIE | 10.1021/acs.analchem.9b05347 |
| 36 | 480/545 | 21.9 nM | n.d. | 关-开 | ICT | 10.1021/acs.analchem.2c00903 |
| 37 | 988/1058 | 0.056 μM | n.d. | 关-开 | ICT | 10.1002/anie.202211409 |
| 38 | 390/581 | 104 nM | 5 秒 | 关-开 | ICT | 10.1073/pnas.1917946117 |
| 39 | 450/610 | 0.64 μM | 30 分钟 | 关-开 | PET | 10.1021/acs.analchem.0c01198 |
| 40 | 936/1237 | 55 nM | 30 秒 | 关-开 | ICT | 10.1021/acs.analchem.1c02831 |
| 41 | 475/495, 618 | 4.6 nM | n.d. | 比率 | ICT | 10.1039/C8CC07312K |
缩写:无数据 (n.d.), 分子内电荷转移 (ICT), 光诱导电子转移 (PET), 激发态分子内质子转移 (ESIPT)。
Lu及其同事设计了一种比率型近红外荧光探针 26,用于检测线粒体HClO。 探针结构中的2-甲氧基吩噻嗪部分是一个具有低氧化电位的富电子基团。当S原子被HClO氧化成亚砜时,光诱导电子转移过程从“开”态切换到“关”态,从而激活红色荧光并实现对HClO的比率检测。探针 26 成功应用于HepG2细胞中内源性和外源性HClO的成像。结果表明,探针 26 可以准确检测铁死亡过程中线粒体HClO水平的波动。
Tang及其同事设计了一种可逆的基于HClO/H₂S比率的荧光探针 27,利用苯基硒醚作为响应基团。 探针 27 中的硒 (Se) 原子可被HClO氧化,导致反应产物的荧光发射峰发生110 nm的显著蓝移。此外,H₂S可以通过还原氧化硒有效地将检测系统的荧光恢复到原始状态。细胞成像研究表明,探针 27 可以监测细胞中HClO/H₂S的变化,并在研究HClO/H₂S的生物学功能方面显示出巨大潜力。
2.3.2.2. 基于N,N-二甲基硫代氨基甲酰基氧化的HClO荧光成像策略
Tang及其同事构建了一种基于金属-有机框架 (MOF) 材料的纳米探针PCN@FL(图20,探针 28),用于同时检测和成像早期动脉粥样硬化小鼠中的磷酸化和HClO。 PCN@FL通过N,N-二甲基硫代氨基甲酰基部分与HClO之间的特异性相互作用,对HClO表现出选择性识别。此外,它可以通过MOF内Zr(IV)金属节点与磷酸基团之间的特异性配位来量化磷酸化程度。利用双光子荧光的特性,PCN@FL可以显著减少生物背景干扰,并提高动脉粥样硬化成像的灵敏度。通过对不同阶段血液样本的PCN@FL测试,作者成功地使用动物模型评估了动脉粥样硬化早期阶段HClO水平和磷酸化状态的变化。此外,作者还发现早期动脉粥样硬化小鼠的血清pH值低于正常小鼠,而HClO和磷酸盐水平则更高。
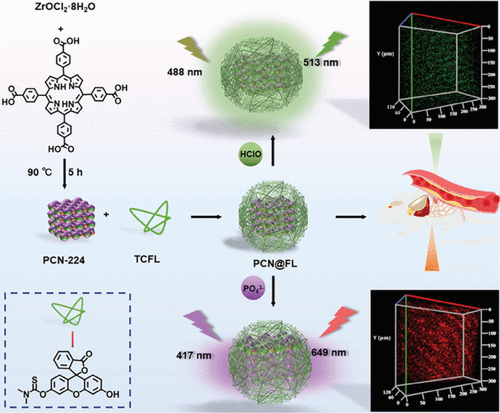
图 20. 探针 28 (PCN@FL) 的合成方法及其在早期动脉粥样硬化模型中检测和成像磷酸化及HClO水平的应用示意图。
Wang及其同事设计了一种近红外荧光探针 29(图21),它对HClO表现出选择性响应,用于监测炎症性肠病 (IBD)。 探针 29 由三部分组成:(i) 识别基团,N,N-二甲基硫代氨基甲酰基,可被HClO特异性激活;(ii) 信号片段 (QCy7),响应后可产生近红外荧光信号;以及 (iii) D-甘露糖靶向配体,可促进肠道炎症细胞的摄取。在肠道上皮损伤的情况下,大量炎症细胞,包括巨噬细胞和中性粒细胞,会涌入肠道组织。甘露糖受体在细胞膜表面大量表达,促进了甘露糖修饰探针的加速摄取。为了研究甘露糖受体介导的探针 29 的细胞摄取,用不同浓度的d-甘露糖胺(甘露糖受体的结合底物)或不同浓度的根皮苷(GLUT1抑制剂)预处理RAW 264.7细胞。结果表明,预处理细胞的近红外荧光显著降低,证实探针 29 的摄取主要由MRC1和GLUT1介导。此外,在脂多糖诱导的IBD小鼠模型中实现了内源性HClO的无创可视化。
 图 21. 基于N,N-二甲基硫代氨基甲酰基氧化的部分HClO荧光探针。
图 21. 基于N,N-二甲基硫代氨基甲酰基氧化的部分HClO荧光探针。
Lin及其同事设计了荧光探针 30,用于监测细胞和体内HClO的变化,基于分子内电荷转移 (ICT) 机理。 在与HClO反应后,探针的N,N-二甲基硫代氨基甲酰基被水解,ICT效应得以恢复并发射荧光,从而实现对HClO的检测。探针 30 在HeLa细胞中表现出低细胞毒性,并能够成功检测LPS诱导的HClO。该探针在斑马鱼和老年小鼠模型中直观地捕捉到了HClO水平的变化,实验结果表明衰老过程中HClO水平增加。
Guo及其同事构建了一种基于N,N-二甲基硫代氨基甲酰基的荧光探针 31,用于追踪线粒体HClO。 通过在荧光团中引入Br原子来调节pKa,扩大了成像的pH范围,并提高了信噪比。N⁺基团赋予探针 31 靶向线粒体的能力。通过超分辨率成像技术,使用探针 31 实现了对线粒体HClO水平波动和线粒体形态变化的实时监测。此外,借助该探针,作者成功监测了细胞铁死亡过程中的线粒体HClO变化,并区分了肿瘤与健康组织。
2.3.2.3. 基于硫缩酮氧化的HClO荧光成像策略
硫缩醛和硫缩酮的形成在合成化学中作为甲酰基和羰基的保护策略。在过去十年中,这种方法已被用于开发HClO响应性荧光探针。Yang及其同事设计了一种比率型荧光探针 32(图22),用于在铁死亡期间对溶酶体位置的HClO进行超分辨率成像。 在与HClO反应后,硫缩酮结构中的硫原子首先被氧化形成砜中间体。随后是环状电子转移和水解,导致羰基的生成。该羰基的形成增强了分子内电荷转移 (ICT) 效应,导致荧光从绿色转变为红色,从而实现对HClO的比率检测。结构光照明显微镜 (SIM) 提高了溶酶体靶向的准确性,并使探针 32 成功应用于在纳米尺度上快速监测炎症和铁死亡期间上调的溶酶体HClO。
图 22. 基于硫缩酮氧化的部分HClO荧光探针。
Liu及其同事设计并合成了一种基于喹诺酮的比率型双光子荧光探针 33,用于检测HClO。 在与HClO反应后,探针 33 的蓝色发射减少,绿色发射增加。荧光强度比(绿色/蓝色)被引入作为HClO检测的比例信号。探针 33 能够监测小鼠受损组织中的HClO,显示了伤口愈合过程中HClO的产生。这项研究为HClO的检测和成像提供了一个简单可靠的工具,并有望在与HClO相关的生物学和病理学研究中找到更多应用。
2.3.2.4. 基于双键氧化裂解的HClO荧光成像策略
Liu及其同事开发了一种荧光纳米探针,BI-PEG-PSBPNP(图23,探针 34),能够特异性标记来自泡沫细胞的外泌体。 该探针可被细胞内HClO特异性降解,产生一种亲脂性的含三氟甲基的BODIPY衍生物B-CF₃,后者可被脂滴 (LDs) 有效富集。BI-PEG-PSBP纳米探针被应用于检测活体小鼠中的动脉粥样硬化斑块。在具有稳定和易损斑块的小鼠中,荧光比率(代表HClO/LDs的相对水平)增加。这表明该探针可以区分动脉粥样硬化斑块的不同阶段。随后解剖小鼠,取主动脉和主要器官进行荧光成像,进一步证实了BI-PEG-PSBP识别不同阶段动脉粥样硬化斑块的能力。
 图 23. 探针 34 (BI-PEG-PSBP NPs) 检测HClO及其在动脉粥样硬化模型小鼠泡沫细胞中代谢过程的示意图。
图 23. 探针 34 (BI-PEG-PSBP NPs) 检测HClO及其在动脉粥样硬化模型小鼠泡沫细胞中代谢过程的示意图。
Wang及其同事设计并合成了一种基于四唑的AIE探针 35(图24),用于检测HClO。 在与HClO反应后,35 的双键被氧化,导致双电荷部分(4-甲基-1-(3-(三甲基铵基)丙基)吡啶-1-鎓溴化物)的裂解,从而导致聚集诱导的荧光发射增强。35 对HClO的开启响应在加入HClO(0至50 μM)后提供了1000倍的荧光增强。实验和理论结果表明,疏水性氢键在提高探针对HClO检测的灵敏度方面起着至关重要的作用。最后,35 被成功用于炎症小鼠模型(腹膜炎和类风湿性关节炎)和原位肝癌小鼠模型中内源性HClO的成像。
 图 24. 基于双键氧化裂解(探针 35)和其他氧化相关机理(探针 36–41)的部分HClO荧光探针。
图 24. 基于双键氧化裂解(探针 35)和其他氧化相关机理(探针 36–41)的部分HClO荧光探针。
2.3.2.5. 基于其他氧化相关机理的HClO荧光成像策略
Tang及其同事报道了双响应荧光探针 36,用于成像活细胞中同一反应位点Cl⁻/HClO的波动。 探针与Cl⁻静电结合后,探针的蓝色荧光减弱。酰肼被HClO氧化为酰亚胺,这破坏了键并在亲核溶剂中水解。然后罗丹明开环,545 nm处的荧光恢复,产生强烈的绿色荧光信号。在Fe²⁺刺激的HL-7702细胞中,蓝/绿双荧光信号显示细胞中Cl⁻和HClO水平都增加了。相反,在Fe²⁺耗尽的SMMC-7721细胞中,Cl⁻和HClO水平都降低了。进一步的实验结果表明,铁过载可以通过上调氯离子细胞内通道蛋白1和MPO来增加Cl⁻和HClO水平。
Yuan及其同事报道了一系列基于三甲川菁骨架的近红外-II染料 (NIR-II Cy3s),在不同溶液中其近红外-II吸收/发射超过930/1000 nm。 与报道的七甲川染料IR 26/IR 1048/IR 1061/Flav 7/CX-3相比,NIR-II Cy3s对ROS/RSS的化学稳定性显著提高。此外,将富电子的1,4-二乙基十氢喹喔啉部分引入NIR-II Cy3s对于增加其波长至关重要,并提供了氧化还原响应位点,以构建一系列用于检测HClO/RSS的可逆近红外-II探针。NIR-II Cy3-988(探针 37)表现出可逆检测氧化应激标志物,特别是HClO和RSS的能力。该探针进一步用于评估几种非甾体抗炎药,包括阿司匹林、双氯芬酸和布洛芬,在角叉菜胶诱导的急性炎症模型中的抗炎效果。观察到双氯芬酸表现出优越的抗炎效果,并能够逆转角叉菜胶诱导的小鼠减少。这可能是因为双氯芬酸可以迅速抑制中性粒细胞的招募以减少MPO并抑制巨噬细胞的积累。
Qian及其同事报道了一种基于ICT原理的双光子荧光探针 38,能够在红藻氨酸诱导的癫痫小鼠模型的大脑中检测由MPO产生的HClO的变化。 在探针的结构中,共轭的电子受体二氨基马来腈基团削弱了喹诺酮荧光团的推拉电子效应,从而导致微弱的黄色荧光。在HClO存在下,38 的结构修饰改变了分子间的电子效应,导致发射增强并蓝移。使用探针 38,通过评估HClO水平,发现在癫痫行为小鼠的大脑中MPO过表达。探针 38 还被用于构建一种高通量筛选策略,可以快速筛选潜在的抗癫痫药物,以控制MPO介导的氧化应激。基于这种筛选技术,作者发现黄酮类化合物芹菜素可以有效调节MPO介导的氧化应激。进一步研究发现,芹菜素可以通过调节SIRT1/p53/GPX4的表达来抑制神经细胞的铁死亡。
Yuan及其同事将磁共振造影剂 (Gd-DOTA) 添加到联吡啶-Ru (II) 复合衍生物中,构建了探针 39。 探针对HClO的特异性反应导致醚键断裂,从而开启探针的磷光信号并关闭磁共振 (MR) 响应。MR和磷光的这种结合使得探针能够在相当大的浓度范围(0.6–2000 μM)内检测HClO,并且其检测分辨率可以从亚细胞水平扩展到生物体水平。活细胞中HClO的磷光成像、小鼠关节炎模型中HClO生成的可视化,以及药物诱导的小鼠急性肝肾损伤中HClO的双模态磷光-MR成像,共同展示了该探针在HClO相关疾病的诊断和治疗监测中的潜在应用。
Xiong及其同事报道了一种基于分子内电荷转移 (ICT) 机理的近红外荧光探针 40,用于在体内检测HClO。 在HClO存在下,探针 40 的富电子供体吩噻嗪被部分氧化成强电子受体,形成供体-受体-供体 (D–A–D) 结构,导致近红外吸收和发射波长增强。水溶液中的HClO可以在30秒内被探针 40 灵敏和特异性地检测到。此外,该探针能够在可见光和近红外-II光谱窗口中监测活细胞溶酶体中外源性和内源性HClO浓度的变化。借助该探针,实时近红外-II荧光成像允许在至少30分钟的时间内连续监测炎症性类风湿性关节炎 (RA) 中的HClO水平。
Tang及其同事报道了一种基于硒氧化-消除级联反应的双光子比率型HClO荧光探针 41。 硒醚容易被HClO氧化生成硒氧化物,这使得含硒醚的探针能够显示开启型荧光变化。探针本身发射绿色荧光,在共轭结构扩展后,观察到红色荧光,从而实现对HClO的比率检测。结果表明,该探针在细胞和组织中对HClO表现出高选择性、灵敏度和响应性,实现了对HClO浓度变化的双光子比率成像。此外,借助探针 41,发现服用环孢素的小鼠肝脏和肾脏中的HClO水平显著上调,表明环孢素具有强烈的肝肾毒性。
2.4. 次溴酸 (Hypobromous Acid)
2.4.1. 次溴酸简介
次溴酸 (HBrO) 是一种不稳定的单质子酸,也是一种重要的ROS,其物理和化学性质与HClO相似。在生物系统中,HBrO是由溴离子与H₂O₂在嗜酸性粒细胞中的嗜酸性粒细胞过氧化物酶 (EPO) 催化下反应产生的。 与HClO相比,HBrO在内源性产生的量要少得多。这种产生水平的差异主要是由于生物系统中Cl⁻的浓度高于Br⁻,以及溴与髓过氧化物酶 (MPO) 等活性物质的反应性相对较低,这些物质会产生这些化合物。因此,在体内检测HBrO可能更具挑战性,因为其水平要低得多且不稳定。此外,HBrO往往不太稳定,会迅速分解或与其他生物分子发生反应,进一步使其检测复杂化。HBrO具有强大的氧化和卤化能力,有助于免疫防御和抗菌活性,其过表达与多种疾病的发病机制有关,包括类风湿性关节炎、炎症性组织损伤、心血管疾病、神经退行性疾病、肾脏疾病和癌症。 因此,实时监测体内HBrO的波动对于理解其生理和病理意义至关重要。
HBrO可以诱导多种生物分子的氧化修饰,特别是靶向蛋白质、脂质和DNA。HBrO诱导的氧化修饰的主要生化反应如下:半胱氨酸的硫醇基 (-SH) 可以与HBrO反应,形成N-溴-半胱氨酸或半胱氨酸溴化物,从而改变蛋白质的结构和性质。它还氧化蛋氨酸残基,产生蛋氨酸亚砜,并可能进一步将其转化为蛋氨酸砜,对蛋白质造成不可逆的结构和功能损伤。 此外,HBrO可以溴化酪氨酸残基,形成3-溴酪氨酸 (3-Br-Y),这种修饰被认为是氧化应激和炎症的标志。 在脂质中,HBrO氧化不饱和脂肪酸中的双键, 生成溴化的脂质过氧化产物。这些产物改变膜的流动性和结构,影响膜蛋白的功能。在DNA中,HBrO氧化DNA碱基,特别是鸟嘌呤 (G) 和腺嘌呤 (A),形成如8-溴鸟嘌呤等修饰,这可能导致DNA突变,可能驱动癌变或凋亡。 HBrO还可以与DNA的脱氧核糖骨架反应,导致链断裂,损害DNA的稳定性并影响细胞增殖。虽然HBrO在正常免疫防御中起着至关重要的作用,但过量的HBrO产生可能导致氧化损伤和炎症反应加剧,在多种慢性和炎症相关疾病中充当病理因素。
2.4.2. 次溴酸的荧光成像
2.4.2.1. 基于硫族元素 (S和Se) 氧化的HBrO荧光成像策略
Tang及其同事报道了一种荧光探针 42(图25,表3),由于其能够超灵敏地检测HBrO,显示出巨大的商业化潜力。 该探针通过HBrO催化产生共轭扩增产物,极大地提高了信噪比,并首次成功地区分了正常细胞和肿瘤细胞之间HBrO水平的差异,以及在不同发育阶段的斑马鱼中HBrO分布的差异。因此,该探针将成为研究HBrO调节胶原蛋白活性以及胶原蛋白过表达与肝病之间相关性的有前途的实用探针材料。
 图 25. 基于硫族元素氧化(S和Se,探针 42–45)、溴化(探针 46)和其他氧化相关机理(探针 47, 48)的部分HBrO荧光探针。
图 25. 基于硫族元素氧化(S和Se,探针 42–45)、溴化(探针 46)和其他氧化相关机理(探针 47, 48)的部分HBrO荧光探针。
表3. 部分HBrO荧光探针
| 探针 | λex/λem (nm) | 检测限 | 响应时间 | 响应类型 | 响应机理 | 参考文献 |
|---|---|---|---|---|---|---|
| 42 | 480/525 | 17 pM | n.d. | 关-开 | ICT | 10.1002/anie.201606285 |
| 43 | 380/500, 550 | n.d. | n.d. | 关-开 | ICT | 10.1002/anie.202315861 |
| 44 | 560/632, 864 | 32.9 nM | 20 秒 | 关-开 | ICT | 10.1021/acs.analchem.3c05073 |
| 45 | 440/560 | 296 nM | 4 分钟 | 关-开 | ICT | 10.1039/D1CC04832E |
| 46 | 480/581, 616 | 3.8 nM | 2 秒 | 比率 | J-聚集 | 10.1021/jacs.8b07073 |
| 47 | 400/505 | 15 nM | 5 秒 | 关-开 | ICT | 10.1021/acs.analchem.2c01884 |
| 48 | 350/493 | 5.47 nM | ❤️ 秒 | 关-开 | AIE | 10.1016/j.aca.2024.342642 |
缩写:无数据 (n.d.), 分子内电荷转移 (ICT), 聚集诱导发光 (AIE)。
Tang及其同事报道了一种基于香豆素的序列激活双锁双光子荧光探针 43。 探针与γ-谷氨酰转肽酶 (GGT) 反应后,荧光发射首先从430 nm红移到500 nm,然后与HBrO反应,发射光谱进一步红移到550 nm,从而实现了对GGT和HBrO的光谱可分辨检测。该探针被用于泡沫细胞的成像,发现泡沫细胞中GGT和HBrO的水平显著增加。在该研究中,作者发现Br⁻通过CLC-1蛋白转运到细胞内,并与细胞内H₂O₂反应生成HBrO。并解析了氯离子通道 (CLC-1)-HBrO-CAT-GGT信号通路。使用该探针,在ApoE⁻/⁻/HF小鼠的血管中检测到GGT活性增加和HBrO浓度升高。该探针被成功用于在肉眼或经典染色观察到斑块之前预测动脉粥样硬化斑块的形成。这项研究为动脉粥样硬化的识别提供了一种新方法,不仅可以指示成熟斑块的精确位置,还可以预测即将形成的动脉粥样硬化斑块。
Tang及其同事报道了一种基于罗丹明的近红外荧光探针 44,用于在活细胞和体内对GGT和HBrO进行原位成像。 该探针揭示了GGT和HBrO在斑块破裂中的调节机制。在氧化应激下,GGT参与促氧反应,导致细胞内H₂O₂和HBrO的过量产生,从而增加了runt相关转录因子2和IV型胶原蛋白的水平。Tang及其同事还报道了通过Suzuki偶联反应,以苯并噻唑衍生物为荧光基质的HBrO荧光探针 45。 与上述含S原子的探针类似,该探针与HBrO反应形成环状Se=N键。该探针可用于活细胞中内源性HBrO的双光子成像,为进一步探索HBrO的生理和病理效应提供了有力的工具。
2.4.2.2. 基于溴化的HBrO荧光成像策略
Kim及其同事报道了一种基于BODIPY的比率型HBrO荧光探针 46。 该探针可被EPO产生的HBrO高选择性地溴化,溴化的BODIPY分子自发形成J-聚集体,并在不同波长发射荧光信号。该探针在EPO活性测定、EPO活性荧光成像、癌细胞氧化应激测定和免疫应答检测中显示出良好的应用前景。
2.4.2.3. 基于其他氧化相关机理的HBrO荧光成像策略
Tang及其同事开发了一种基于HBrO引发的叔胺芳香取代的双光子荧光探针 47,并用它实时监测活体系统中痕量的HBrO。 探针中引入了N-(2-氨乙基)-吗啉,它既可作为HBrO的识别受体,又可作为溶酶体的靶向基团。实验通过对小鼠脑组织的原位双荧光成像揭示了HBrO的含量与抑郁表型呈正相关,从而为氧化应激与抑郁之间的关系提供了直接证据,并为进一步研究抑郁和HBrO的病理机制提供了参考。
Wang及其同事开发了一种基于AIE染料的荧光探针 48,用于检测HBrO。 在与HBrO反应后,探针的偕胺肟单元发生氧化反应,由此产生的结构差异触发AIE效应并开启荧光。该探针可以在接近纯水相(99%水)的环境中快速识别HBrO,并产生荧光响应,检测限为5.47 nM。此外,该探针显示出作为HBrO试纸的巨大潜力,并成功用于监测水样、活细胞和斑马鱼中的HBrO。
2.5. 超氧阴离子 (Superoxide Anion)
2.5.1. 超氧阴离子简介
超氧阴离子 (O₂•⁻) 的产生主要通过中性粒细胞和其他免疫细胞中NADPH氧化酶的催化,这一过程被称为呼吸爆发,在防御入侵病原体中至关重要。 此外,线粒体呼吸链和某些酶促反应中会产生痕量的O₂•⁻作为副产物。 作为氧分子单电子还原的产物,O₂•⁻是其他ROS的前体。O₂•⁻与H₂O₂反应产生•OH,或与NO反应生成ONOO⁻。 过量的O₂•⁻会导致生物膜和组织的损伤,导致多种疾病的发生。
O₂•⁻引发了一系列影响正常细胞生理的氧化修饰反应。由于其强大的氧化能力,O₂•⁻可以直接或间接地氧化蛋白质、脂质和DNA等生物大分子,导致细胞损伤甚至细胞死亡。 以下是涉及O₂•⁻的关键生化反应及其氧化修饰的机制:在蛋白质中,O₂•⁻可以氧化半胱氨酸残基,形成二硫键或磺酸衍生物,这会破坏蛋白质的结构和功能,特别是在酶和抗氧化蛋白中。 蛋氨酸,由于其硫基,也极易被氧化,导致形成蛋氨酸亚砜和蛋氨酸砜,这会损害蛋白质的活性,特别是在酶和信号蛋白中。 酪氨酸残基可以被ONOO⁻硝化,ONOO⁻是由O₂•⁻和NO形成的强氧化剂,导致形成3-硝基酪氨酸。 色氨酸被•OH氧化,导致形成羟基色氨酸或色氨酸醌,这会破坏蛋白质的结构稳定性。组氨酸被O₂•⁻氧化,改变咪唑环形成2-氧代组氨酸,这会影响酶的活性位点和蛋白质的稳定性。 精氨酸和赖氨酸残基被O₂•⁻及其衍生物氧化形成羧化衍生物,这会改变蛋白质的电荷和结构,影响蛋白质的功能。 在脂质中,O₂•⁻引发脂质过氧化,生成丙二醛和4-羟基壬烯醛等产物,这些产物会损害膜的完整性,并进一步修饰蛋白质和DNA,导致细胞功能障碍、凋亡或坏死。 虽然O₂•⁻本身不直接损害DNA,但其衍生物,包括•OH和ONOO⁻,会氧化鸟嘌呤形成8-氧代鸟嘌呤,这是氧化性DNA损伤的关键标志,可能导致突变、基因组不稳定和增加癌症风险。 这种氧化损伤与多种疾病的发病机制有关,包括神经退行性疾病、炎症、心血管疾病和癌症。
2.5.2. 超氧阴离子的荧光成像
2.5.2.1. 基于酚-醌互变的O₂•⁻荧光成像策略
Tang及其同事开发了一种基于咖啡酸的新型双光子荧光成像探针 49(图26,表4),用于特异性捕获活细胞和小鼠大脑中的过氧化物酶体O₂•⁻。 在探针的结构中,咖啡酸既是荧光基团,也是O₂•⁻的识别基团,而Ser-Lys-Leu (SKL) 肽则作为过氧化物酶体的靶向基团。为了避免识别基团和靶向基团之间的潜在干扰,引入了谷氨酰胺 (Q) 作为探针的连接体。在O₂•⁻存在下,探针中的给电子分子儿茶酚可被氧化成吸电子的蒽醌,从而释放荧光,实现对过氧化物酶体中产生的O₂•⁻的成像。通过双光子荧光成像和蛋白质组学分析,发现过量的过氧化物酶体O₂•⁻导致过氧化氢酶 (CAT) 失活。CAT的失活导致细胞内H₂O₂的过量产生,这进一步降低了色氨酸羟化酶-2 (TPH2) 的含量。TPH2的减少导致小鼠大脑中血清素功能异常,最终导致抑郁。同时,过氧化物酶体O₂•⁻和细胞内H₂O₂可以氧化和修饰CAT。
图 26. 基于酚-醌互变(探针 49–53)和亲核取代反应(探针 54, 55)的部分O₂•⁻荧光探针。
表4. 部分O₂•⁻荧光探针
缩写:无数据 (n.d.), 分子内电荷转移 (ICT), 聚集诱导发光 (AIE), Förster共振能量转移 (FRET), 化学发光 (CL), 光声 (PA)。
Tang及其同事开发了两种小型荧光探针 50 (PA-CA 和 HT-CA),通过将咖啡酸与5-羟色胺或帕罗西汀结合,后者作为血清素转运蛋白 (SERT) 的靶向基团,用于成像小鼠活动脑血清素能神经元中的O₂•⁻。 在与O₂•⁻反应后,探针中咖啡酸的儿茶酚部分可被氧化形成吸电子的苯醌。这种反应改变了电子分布并产生明亮的荧光,从而对O₂•⁻产生特异性的荧光响应。PA-CA和HT-CA都表现出优异的SERT靶向性和对O₂•⁻的良好选择性。这两种探针可以监测在氧化应激下特异性表达SERT的活HEK293细胞中O₂•⁻的增加。通过对抑郁和对照小鼠脑组织的转录组分析,以及使用蛋白质质谱法的蛋白质组学分析,发现小鼠大脑中O₂•⁻的过量产生可能会氧化SERT,导致抑郁。这一结果为理解氧化应激在抑郁中的作用提供了直接证据。
Tang及其同事报道了一种双色可逆荧光探针 51,用于实时、动态、同步地可视化肝缺血再灌注损伤 (HIRI) 过程中的O₂•⁻和ATP,并揭示了它们在HIRI中的相互关系和协同效应。 咖啡酸和罗丹明分别被选为O₂•⁻和ATP的特异性识别部分和相应的荧光部分,它们通过二乙烯三胺连接。咖啡酸是一种常见的O₂•⁻清除剂,可作为O₂•⁻的高度特异性识别部分,其中O₂•⁻特异性地将儿茶酚氧化成苯醌,从而促进蓝色荧光的产生。咖啡酸基团与O₂•⁻的反应以及罗丹明螺内酰胺与ATP的结合反应都是可逆的,这应该能够动态追踪O₂•⁻和ATP的波动。该探针在体外对O₂•⁻和ATP的出色响应性使其能够同时成像和动态监测肝细胞中内源性的O₂•⁻和ATP。此外,该探针能够在小鼠肝脏HIRI期间可视化O₂•⁻和ATP,并揭示了HIRI中细胞内O₂•⁻-SDH-线粒体NADH-线粒体ATP-细胞内ATP级联介导的信号通路。过量的O₂•⁻导致琥珀酸脱氢酶 (SDH) 失活,SDH是氧化磷酸化和三羧酸 (TCA) 循环中的关键酶。SDH的失活导致肝细胞中线粒体NADH水平降低,从而损害线粒体ATP的合成,最终降低细胞内ATP水平。相关的信号通路进一步强调了O₂•⁻和ATP在HIRI中的关键作用,为未来研究该过程中涉及的相互关联的信号分子奠定了基础。这项研究提出了一种荧光探针,旨在研究HIRI中O₂•⁻和ATP之间的相关性和协同作用,为HIRI进展过程中相互关联的活性分子的相互作用提供了宝贵的见解。
Tang及其同事利用探针 52 实现了内质网应激和糖尿病心肌期间O₂•⁻的荧光成像。 该探针结构由以下三部分组成: 内质网靶向基团——对甲基苯磺酰胺; O₂•⁻的动态荧光响应基团——咖啡酸; 荧光基团——萘酰亚胺。借助探针 52 和研究组之前开发的极性探针, 发现糖尿病心肌组织中O₂•⁻的含量显著增加,心肌组织的极性变大。这种双色成像策略为研究内质网应激诱导的疾病过程中多个参数的协同变化提供了一种可靠的方法。
Xing及其同事报道了一种可逆光声 (PA) 信号探针 53,用于动态监测O₂•⁻和GSH的氧化还原循环。 其检测原理是基于探针在与O₂•⁻/GSH反应期间在680和750 nm之间的可逆吸收位移,导致PA信号比 (PA750/PA680) 的变化。通过构建纳米胶束,该探针成功应用于肿瘤微环境中O₂•⁻/GSH的光声可视化。这种类型的PA探针显示出优异的特异性和可逆的氧化还原响应,为探索与氧化还原相关的病理事件提供了新工具。
2.5.2.2. 基于亲核取代反应的O₂•⁻荧光成像策略
Tang及其同事开发了一种双位点荧光探针 54,用于以高灵敏度和特异性顺序检测O₂•⁻和ONOO⁻。 在探针的结构中,三氟甲磺酸基团用于O₂•⁻的检测,苯基硼酸基团用于与ONOO⁻的选择性反应。在被O₂•⁻激活后,探针发射出显著的红色荧光信号,随后被ONOO⁻级联激活,导致荧光响应增强。该探针成功用于评估氧化应激和erastin诱导的铁死亡下PC12细胞中O₂•⁻和ONOO⁻的水平。这项研究为研究O₂•⁻和ONOO⁻之间的相关性提供了可靠的工具,可能推动神经退行性疾病的研究。
Jiang及其同事报道了一种近红外荧光探针 55,用于精确追踪铁死亡介导的癫痫中O₂•⁻的波动。 该探针是基于分子内电荷转移 (ICT) 机理设计的。由于其典型的供体-π-受体 (D-π-A) 结构,探针反应产物表现出强烈的ICT过程。三氟甲磺酸酯单元作为一个强吸电子基团,可以有效地中断FP-OH的ICT过程,导致荧光猝灭。在与O₂•⁻发生亲核反应后,三氟甲磺酸酯单元被迅速移除,有效地恢复了荧光。该探针对生理环境中的O₂•⁻具有高选择性和灵敏度。在体外和体内有效地研究了三种铁死亡介导的癫痫模型中O₂•⁻的动态变化,并为研究癫痫的发生、发展和治疗提供了有力的分子工具。
Pu及其同事合成了一种双通道探针ADR(图27,探针 56),它分别在O₂•⁻和NAG (N-乙酰-β-d-葡糖苷酶) 存在下选择性地激活化学发光和近红外荧光 (NIRF) 成像。 该探针已用于实时体内成像和造影剂诱导的急性肾损伤 (CIAKI) 的早期检测。该探针被证明对两种生物标志物都具有高灵敏度和特异性,同时具有高肾清除效率(注射后24小时内80%的注射剂量),最小的体内代谢和优异的生物相容性。将探针全身给药到活体小鼠中,能够实时成像与肾损伤相关的两个相关分子事件(氧化应激和溶酶体损伤)。这种主动传感能够在肾小球滤过率下降和肾组织损伤之前检测到CIAKI,比标准临床血浆测定和临床前测定至少提前8小时。
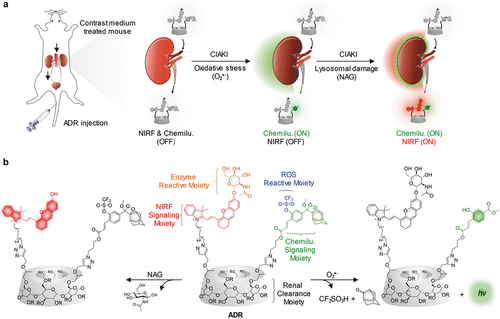
图 27. ADR(探针 56)的设计与合成。a) 使用ADR进行实时双重成像和CIAKI早期检测的示意图。b) ADR及其分别响应氧化应激O₂•⁻和溶酶体损伤 (NAG) 的活化形式的化学结构(R = H, CH₂CHOHCH₃, 或 CH₂CCH)。
Pu及其同事报道了荧光探针 57(图28),用于药物诱导的肝毒性 (DIH) 的双通道成像。 该探针配备了两个独立的光学通道,能够分别通过化学发光 (CHL) 和近红外荧光 (NIRF) 信号对O₂•⁻和caspase-3进行灵敏和特异性的检测。探针的无串扰双重成像能力使得能够纵向监测两个顺序相关的生物分子事件,证实了在药物挑战的细胞和小鼠中,O₂•⁻的上调先于caspase-3的激活。此外,探针的CHL通道比常规组织学分析检测DIH提前17.5小时。这些发现突显了该探针在临床前药物筛选和DIH临床诊断中的巨大潜力。探针的分子设计可以通过改变CHL和NIRF信号部分的笼蔽基团,轻松地适应其他生物标志物的双重成像。
图 28. 基于亲核取代反应的部分O₂•⁻荧光探针。
Li及其同事设计了一种聚集诱导发光探针 58,它对O₂•⁻表现出高选择性和灵敏度,并能够实现长期、免洗的细胞成像。 基于该探针,他们开发了一种模拟微重力导向的集成芯片平台,该平台包含一个用于充足培养基存储的高深宽比室,一个用于仿生3D细胞培养的基于细胞外基质的水凝胶室,以及一个用于在微重力条件下维持水凝胶稳定性的多孔膜。该平台成功实现了人胶质母细胞瘤 (U87-MG) 细胞的3D培养,并在72小时的微重力暴露下原位可视化了内源性O₂•⁻,为氧化应激研究提供了工具,并推动了空间生命科学的地面研究。
Huang及其同事开发了一种尺寸可变的纳米探针(图29,探针 59),它可以被O₂•⁻特异性激活,以触发化学发光和随后的纳米结构分解为可通过肾脏清除的荧光片段。 这使得能够进行双重体内成像和体外尿液分析,用于检测炎症相关疾病。该纳米探针对O₂•⁻表现出卓越的灵敏度,使得腹膜炎的诊断比金标准组织学测试至少提前19小时。该纳米探针成功应用于活体小鼠药物诱导的肝毒性成像的概念验证。该纳米探针优于临床可用的血浆(血清丙氨酸转氨酶/天冬氨酸转氨酶)和组织学测定,检测肝毒性至少提前5小时,并在检测深层组织中的氧化应激方面表现出优越的功效。这项研究突显了一种具有结构适应性和功能多样性的模块化设计,促进了创建可用于腹膜炎和肝毒性以外多种疾病早期诊断的多功能纳米探针库,并具有广阔的临床应用前景。
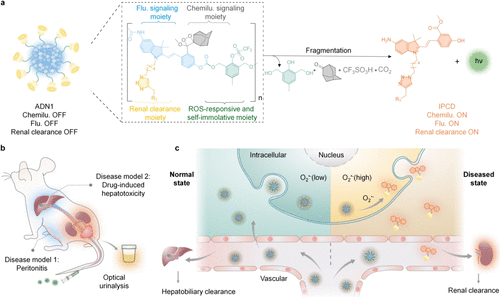
图 29. 尺寸可变的化学-荧光-发光纳米报告子的设计与机理,用于无串扰的双重成像和尿液分析。a) ADN1(探针 59)及其响应O₂•⁻的片段的化学结构 (R₁ = (2-羟丙基)-β-环糊精)。b) 活体小鼠多器官化学-荧光-发光双重成像和体外尿液分析的示意图。c) 用于成像和尿液分析O₂•⁻的可激活纳米报告子的示意图。在正常组织中,可激活的纳米报告子不发化学光和荧光,主要通过肝胆清除途径排泄。在疾病部位,上调的O₂•⁻诱导可激活纳米报告子的降解,释放化学发光信号并释放荧光的可肾清除片段,用于成像和尿液分析。
Pu及其同事报道了使用由O₂•⁻激活的化学发光半导体聚合物纳米载体SPNRs(图30,探针 60),用于癌症免疫治疗期间的体内免疫激活。 该纳米探针由半导体聚合物 (SP) 和一种定制设计的O₂•⁻响应性化学发光底物组成,分别作为化学发光受体和供体,从而实现颗粒内化学发光共振能量转移。该纳米探针能够灵敏地区分免疫细胞中较高的氧水平与其他细胞,包括癌细胞和正常细胞。全身给药后,纳米探针在活体小鼠肿瘤中被动聚集,并响应肿瘤微环境中O₂•⁻的浓度激活化学发光信号。此外,肿瘤免疫治疗后体内化学发光信号的增强与肿瘤内T细胞数量的增加有关,证明了其在追踪T细胞激活方面的可行性。
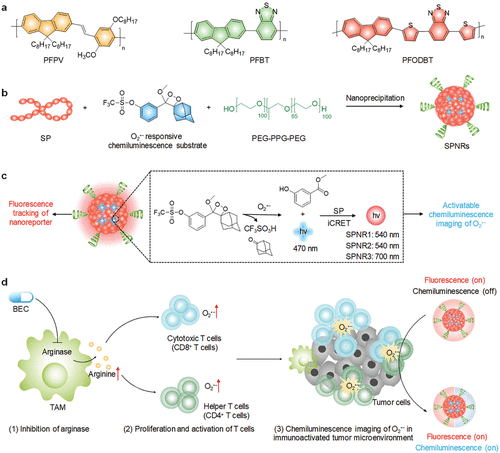
图 30. SPNRs用于免疫激活化学发光成像的设计与合成。a) 半导体聚合物的化学结构。b) 通过纳米沉淀法合成SPNRs(探针 60)的示意图。c) SPNRs O₂•⁻激活的化学发光机理示意图。d) 药物诱导免疫激活后肿瘤中O₂•⁻的体内化学发光成像示意图。
Song及其同事,基于Schaap的二氧杂环丁烷,开发了一系列近红外II (NIR-II) 化学发光探针,最大发射波长达到1060 nm。 通过共轭聚乙炔链,这些可激活的NIR-II化学发光染料成功地与Schaap二氧杂环丁烷化学发光供体和三种类型的受体(二氰基亚甲基-4H-苯并吡喃及其衍生物,二氰基亚甲基-4H-苯并噻喃,以及二氰基亚甲基-4H-苯并硒喃)耦合。通过引入二苯基次膦酸酯作为识别基团,作者构建了一种双激活的NIR-II化学发光/荧光探针 61(图31),用于检测对乙酰氨基酚诱导的肝损伤期间的O₂•⁻,并证明了NIR-II化学发光成像比NIR-II荧光成像具有更高的灵敏度和分辨率。
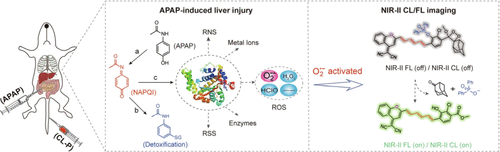
图 31. 探针对O₂•⁻响应机理的示意图以及探针 61 的生物应用。
2.5.2.3. 基于其他机理的O₂•⁻荧光成像策略
Li及其同事报道了一系列基于活性的传感探针 62(图32),用于在活细胞中成像O₂•⁻。 这些探针的设计利用了O₂•⁻到1,2,4,5-四嗪 (Tz) 的单电子转移作为响应机理。由于Tz固有的荧光猝灭特性,这些探针对O₂•⁻表现出超荧光响应。通过调节探针的反应性和发射颜色,实现了对细胞O₂•⁻水平的多重成像,具有卓越的空间分辨率。鉴于探针的稳健性,建立了一个高内涵药物筛选模型,从而鉴定出一种能够减轻缺血性心脏病病理中氧化应激诱导的损伤的天然产物。这些基于Tz的探针的特异性和超荧光响应有望使其成为在各种病理生理背景下追踪超氧化物的宝贵工具。
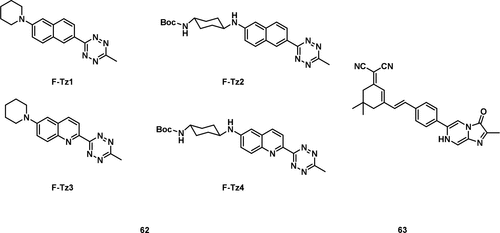
图 32. 部分O₂•⁻荧光探针。
Qian及其同事报道了一种双光学模式探针 63,用于观察癫痫小鼠中的O₂•⁻。 腔肠素 (CLA) 基团作为化学发光分子骨架,而二氰基异佛尔酮框架被选为荧光平台。使用碳-碳双键连接这两个部分,形成双光学分子探针。当响应O₂•⁻时,CLA单元首先被氧化形成二氧戊环中间体,随后分解产生单线态激发酰胺。这个激发态然后衰变到其基态,伴随着化学发光 (CL) 的发射。同时,荧光 (FL) 也被触发。探针的氧取代咪唑部分表现出更强的吸电子效应,这削弱了ICT效应并猝灭了探针的荧光。当探针与O₂•⁻反应时,咪唑环打开形成酰胺,降低了吸电子能力并恢复了ICT效应,导致荧光增强。通过荧光和化学发光成像,该探针有效地监测了体外和活HT-22细胞中的O₂•⁻,表现出高选择性、快速响应和优异的灵敏度。
2.6. 羟自由基 (Hydroxyl Radicals)
2.6.1. 羟自由基简介
羟自由基 (•OH) 是最重要的ROS之一,由氢氧根失去一个电子生成,具有高活性、短半衰期和最强氧化性的特点。 •OH是一种极具反应性的自由基,能非特异性地与多种生物分子反应,导致蛋白质、脂质等关键分子的氧化损伤。•OH被认为是细胞损伤和DNA氧化的引发剂。 如果•OH的稳态失衡,通常与其他ROS和下游调节物质的异常表达相关,导致细胞死亡和疾病的发生,如细胞铁死亡、 神经退行性疾病、 缺血-再灌注损伤、 急性肝肾损伤等。
•OH还可以通过氧化蛋白质来影响细胞信号转导。半胱氨酸残基可被•OH氧化, 将硫醇基 (-SH) 氧化成硫自由基,这可能导致二硫键 (-S–S⁻) 或-SO₃H 等氧化产物的形成,破坏蛋白质的折叠和稳定性。蛋氨酸被•OH氧化产生蛋氨酸亚砜, 后者可进一步转化为蛋氨酸砜,可能改变蛋白质的活性。酪氨酸被•OH氧化形成二酪氨酸或羟基化衍生物, 如3-羟基酪氨酸,也可能转化为醌类化合物,导致蛋白质聚集或交联。色氨酸被•OH氧化产生羟基色氨酸(如5-羟基色氨酸)和色氨酸醌, 影响蛋白质的性质和结构稳定性。组氨酸的咪唑环被•OH氧化,产生如2-氧代组氨酸等产物,这会改变其pKa并破坏其在酶活性位点中的作用。脯氨酸被氧化形成羟脯氨酸或开环产物,影响蛋白质的折叠和结构完整性。 精氨酸和赖氨酸被•OH氧化, 改变蛋白质的电荷和构象。在脂质中,•OH通过与不饱和脂肪酸的双键反应引发连锁反应,形成脂质自由基,产生脂质过氧化物, 包括丙二醛 和4-羟基壬烯醛。 在DNA中,•OH主要导致鸟嘌呤的氧化, 这是氧化性DNA损伤的标志,增加碱基错配,可能导致突变和癌变。•OH还通过与脱氧核糖反应诱导DNA链断裂, 导致单链或双链断裂,这可以停止细胞周期,激活DNA修复系统,或诱导凋亡。为了抵消这些有害影响,内源性抗氧化系统,如谷胱甘肽、超氧化物歧化酶和过氧化氢酶,在清除过量•OH和维持细胞稳态中起着关键作用。因此,使用高灵敏度和选择性的荧光探针来分析和研究不同生理和疾病过程中•OH的波动,对于探索疾病的分子机制和评估可能的治疗方法具有重要意义。
2.6.2. 羟自由基的荧光成像
2.6.2.1. 基于芳香族羟基化的•OH荧光成像策略
基于花青分子骨架与•OH之间独特的芳香环羟基化反应,Ma及其同事报道了一种探针 64(图33,表5),通过对花青分子的合理修饰来检测•OH。 探针的羟基化主要发生在甲氧基的中间位置,形成酚中间体,该中间体经历去质子化和电子重排,最终形成一个更大的π-共轭体系,导致光谱发生大的红移和高灵敏度的近红外荧光。与传统的电子自旋共振 (ESR) 方法相比,探针 64 不仅可以检测芬顿反应产生的•OH,还可以检测铁自氧化产生的•OH。该探针成功用于检测不同条件下活细胞中•OH的变化。
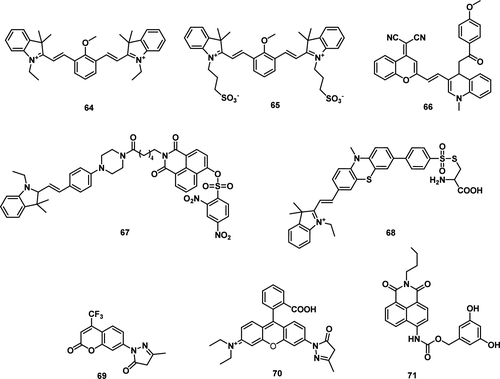
图 33. 基于芳香族羟基化(探针 64, 65)、夺氢(探针 66, 67)、富电子杂原子氧化(探针 68)和其他氧化相关机理(探针 69–71)的部分•OH荧光探针。
表5. 部分•OH荧光探针
| 探针 | λex/λem (nm) | 检测限 | 响应时间 | 响应类型 | 响应机理 | 参考文献 |
|---|---|---|---|---|---|---|
| 64 | 570/653 | 38 nM | 30 分钟 | 关-开 | ICT | 10.1002/anie.201808400 |
| 65 | 400/520 (粘度) 590/652 (•OH) | 8.6 nM | 30 分钟 | 关-开 | ICT | 10.1021/jacs.9b09722 |
| 66 | 400/525, 635 | 5.77 nM | 3 分钟 | 比率 | ICT | 10.1016/j.bios.2023.115868 |
| 67 | 535/626 (•OH); 360/530 (GSH) | 41.6 nM (•OH); 324.74 nM (GSH) | 30 分钟 (•OH); 5 分钟 (GSH) | 关-开 | ICT | 10.1021/acs.analchem.4c01688 |
| 68 | 485/608 (•OH); 426/538 (Cys) | 69.65 nM (•OH); 30.01 nM (Cys) | 3 分钟 (•OH); 4 分钟 (Cys) | 关-开 | ICT | 10.1021/jacs.2c10855 |
| 69 | 380/500; 800/500 | 2.4 nM | 数秒 | 关-开 | ICT | 10.1002/anie.201901318 |
| 70 | 550/579 | 33 nM | 6 分钟 | 关-开 | TICT | 10.1021/acs.analchem.1c03877 |
| 71 | 440/550 | 70 nM | 30 分钟 | 关-开 | ICT | 10.1021/acs.analchem.3c00822 |
| 72 | 740/780, 808/1113; PA755; PA905 | 3.69 nM; 240 nM (PA) | 3 分钟 | 比率 | ICT | 10.1038/s41467-021-26380-y |
缩写:无数据 (n.d.), 分子内电荷转移 (ICT), 扭曲分子内电荷转移 (TICT), 光声 (PA)。
Ma及其同事报道了一种双功能荧光探针 65,用于检测铁死亡过程中细胞质粘度和•OH的变化。 基于D-π-A结构和扭曲分子内电荷转移机制 (TICT),该探针能够检测粘度的变化。引入了两个磺酸基团以中和正电荷,使探针能在细胞质中更有效地工作。为了检测•OH,利用了•OH对芳香族化合物的独特羟基化作用来实现高选择性。此外,设计引入了强给电子的甲氧基,以增强所得探针的捕获能力,从而提高•OH检测的灵敏度。借助该探针,在铁死亡过程中观察到显著的•OH生成、细胞质粘度增加和脂滴形成加速。生成的•OH被认为是铁死亡过程中总ROS的较大部分,并被认为是脂质过氧化的主要驱动力。这种脂质过氧化随后与细胞质粘度增加和脂滴形成加速有关。由于其良好的生物相容性和简便的合成,该探针有望用于检测各种生物系统中的•OH和粘度。
2.6.2.2. 基于夺氢的•OH荧光成像策略
•OH可以特异性地夺取氨基的α-H形成亚胺。基于此机理,Ren及其同事报道了一种比率型•OH荧光探针 66,通过将二氢喹啉作为识别位点引入近红外染料二氰基亚甲基-4h-吡喃 (DCM) 中。 在与•OH反应后,二氢喹啉部分被特异性氧化为喹啉,导致探针本身的荧光强度在635 nm处降低,在525 nm处逐渐增加。该探针与DSPE-PEG2000自组装形成纳米颗粒,用于成像被脂多糖刺激的活细胞和斑马鱼。最后,该探针可视化了糖尿病小鼠模型中•OH的检测。
Yuan及其同事报道了一种用于•OH和GSH的双检测探针 67,使用哌嗪环桥连接两个反应位点。 探针一侧的氢氰部分作为•OH识别位点,通过FRET效应显示红色荧光。分子的另一侧连接有二硝基苯磺酸酯,作为GSH的识别位点。GSH与磺酸酯的硫解反应触发了萘酰亚胺平台的ICT效应,导致绿色荧光的激活。该探针可以实现•OH和GSH的独立实时可视化,监测外源性和内源性•OH和GSH在细胞水平和体内的变化。作者使用该探针评估了铁死亡抑制剂的功能和功效,并初步探讨了其抑制机制。
2.6.2.3. 基于富电子杂原子氧化的•OH荧光成像策略
Yuan及其同事开发了一种用于•OH和Cys的双位点探针 68,基于吩噻嗪-花青结构,用于监测细胞和体内氧化还原动态反应和关系。 吩噻嗪中的硫原子被特异性氧化成亚砜结构,作为•OH的反应位点。磺酰胺基团可以与Cys特异性反应,通过形成苯磺酰硫酯衍生物而呈现绿色荧光。在•OH和Cys反应后,探针的光谱可以被区分而不会交叉。使用探针的荧光响应和可视化能力,进一步研究了HepG2和RAW264.7细胞中各种生理过程中•OH和Cys之间的氧化还原动态和相互作用。该探针还被用于监测活体小鼠和斑马鱼中的•OH和Cys。这项研究为分析和可视化两种对立的生物活性物质提供了一个平台,为开发其他旨在促进我们对生理和代谢过程理解的探针提供了宝贵的设计框架。
2.6.2.4. 基于其他氧化相关机理的•OH荧光成像策略
Tang及其同事报道了一种用于•OH成像的双光子荧光探针 69。 该探针通过3-甲基-吡唑酮的单电子氧化作为特异性识别位点,实现了对•OH的卓越选择性。当探针与•OH反应时,3-甲基-吡唑酮开环,香豆素环的推拉电子效应得以恢复,从而导致荧光增强。引入强吸电子基团三氟甲基,可以增强香豆素共轭体系的推拉电子效应,并由于其优异的亲脂性而促进探针穿过血脑屏障。通过使用该探针结合双光子成像,实现了对小鼠抑郁模型中•OH的成像分析。结果显示,小鼠脑组织中•OH的含量与小鼠抑郁程度呈正相关。蛋白质组学分析发现,Sirtuin 1 (SIRT1) 活性位点的三个苯丙氨酸残基被•OH氧化,表明•OH的过量产生会降低SIRT1的活性,导致抑郁样行为。
Yang及其同事报道了基于罗丹明和依达拉奉结合TICT机理的荧光探针 70,用于检测•OH。 与•OH反应后,3-甲基吡唑酮部分开环,TICT被抑制,罗丹明荧光开启。该探针对•OH表现出高灵敏度和选择性,不受其他刺激的干扰,并已成功用于成像不同刺激条件下细胞和斑马鱼中的内源性•OH。该探针能够根据β-Lap刺激后其不同的•OH水平来区分正常细胞和癌细胞,表现出高的荧光对比度。因此,该探针促进了•OH的有效体内监测,从而有助于更深入地理解与•OH相关的生物过程。
Tang及其同事报道了一种独特的荧光探针 71,用于活细胞和活体小鼠大脑中的原位•OH成像。 该探针引入萘酰亚胺作为荧光团,3,5-二羟基苄氧基作为•OH的特异性响应基团。与•OH反应后,引发了一系列重排和消除反应,导致ICT效应的激活和绿色荧光的发射。细胞成像结果表明,过量的同型半胱氨酸通过N-甲基-d-天冬氨酸受体和NADPH氧化酶介导,诱导了压倒性的•OH产生。值得注意的是,使用该探针,在活体小鼠中原位可视化了脑部•OH的波动,显示出与高同型半胱氨酸血症诱导的阿尔茨海默样痴呆的严重程度呈正相关。这项研究为原位可视化脑部•OH波动提供了一种稳健的荧光探针,为•OH在脑部疾病中的作用提供了关键见解。
Ye及其同事报道了一种•OH响应性近红外纳米探针 72,用于体内的荧光和光声 (FL/PA) 双模态成像(图34)。 随后通过DSPE-PEG2000辅助封装1-Br-Et、NIR775和IR1048制备了比率型近红外FL/PA双模态成像纳米探针。该纳米探针在780和1113 nm之间表现出显著的FL比率 (FL780/FL1113),在755和905 nm之间表现出相对较低的PA比率 (PA755/PA905)。•OH对纳米探针的氧化导致FL780/FL1113比率降低,同时PA755/PA905比率增加,从而有助于可靠地监测经历erastin诱导的铁死亡或放射治疗的肿瘤中•OH的产生。利用比率型近红外FL和PA成像的互补优势,该纳米探针能够以高灵敏度、优异的空间分辨率和增强的穿透深度对肿瘤•OH进行体内成像。这种方法为早期评估肿瘤对放射治疗和其他与•OH相关的治疗策略的反应提供了一个有价值的平台,有助于预测治疗效果和优化治疗干预。
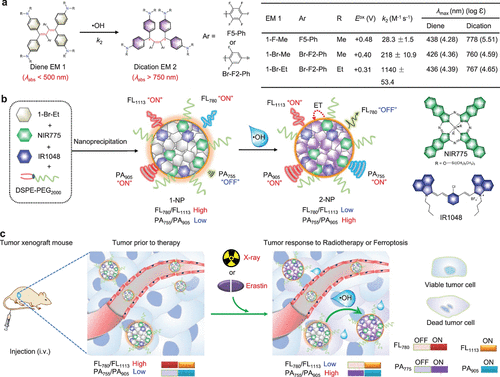
图 34. 探针对•OH响应机理的示意图以及探针 72 的生物应用。(a) 二烯EM 1-F-Me、1-Br-Me和1-Br-Et的化学结构,以及在•OH氧化后提议转化为二阳离子EMs 2-F-Me、2-Br-Me和2-Br-Et。(b) 通过DSPE-PEG2000辅助封装1-BrEt、NIR775和IR1048制备1-NP的示意图,以及提议在响应•OH时1-NP转化为2-NP,伴随着荧光 (FL780/FL1113) 比率降低但光声 (PA755/PA905) 比率同时增加。(c) 1-NP用于比率型近红外FL/PA双模态成像•OH在经历X射线放疗或erastin诱导的铁死亡的肿瘤中产生的机理示意图。
2.7. 单线态氧 (Singlet Oxygen)
2.7.1. 单线态氧简介
单线态氧 (¹O₂),一种高活性的氧物种,具有在细胞环境中引发氧化应激的能力。 它主要通过光合作用、光敏作用或各种生物代谢途径产生。 该物种表现出强大的氧化特性,能够与多种生物分子相互作用,最终导致蛋白质、脂质和DNA的氧化损伤。 这些氧化修饰可以深刻影响蛋白质的功能、稳定性和分子间相互作用,并与一系列疾病密切相关,包括癌症、神经退行性疾病和衰老过程。
由于其强大的氧化能力,¹O₂主要通过与生物分子双键的特定加成反应在细胞水平上氧化功能性和结构性蛋白质。因此,¹O₂的氧化作用超越了仅仅改变蛋白质的理化性质,对细胞功能产生了深远的影响。氧化的蛋白质可能会破坏细胞信号级联,引发异常的细胞反应。值得注意的是,¹O₂使CCK-1受体 (CCK-1R) 持续激活,并差异性地调节其他G蛋白偶联受体。 此外,¹O₂在信号转导过程中特异性地调节一系列信号蛋白,例如通过钙离子激活钙调蛋白依赖性激酶II, 从而调节细胞内信号转导通路。除了与蛋白质中的不饱和键直接相互作用,导致结构改变外,¹O₂还可以产生其他活性氧物种,这些物种通过氧化相邻分子间接影响蛋白质,从而调节蛋白质功能。此外,蛋白质的氧化修饰与凋亡密切相关,氧化损伤可能诱导程序性细胞死亡。
相反,在某些情况下,¹O₂对蛋白质的氧化修饰可能促进细胞对环境扰动的适应。例如,在抗氧化应激反应中,一些氧化修饰的蛋白质可能会增强细胞的抗氧化能力。 此外,某些氧化修饰的蛋白质可能作为参与细胞调节的信号分子。值得注意的是,¹O₂在光动力疗法中起着关键作用,利用光敏剂和光反应产生过量的¹O₂,从而摧毁或消除肿瘤细胞。因此,¹O₂在体内的氧化作用对蛋白质的翻译后修饰产生重大影响。这些氧化修饰不仅改变了蛋白质的结构和功能,还影响了细胞的生理和病理过程。因此,深入理解¹O₂及其氧化机理对于阐明衰老和疾病等生物学现象至关重要。
2.7.2. 单线态氧的荧光成像
Tomita及其同事发现,组氨酸 (His) 通过其咪唑环的1,4-环加成反应有效清除¹O₂,产生羟基化合物。 利用这一发现,Tang及其同事通过将组氨酸作为¹O₂捕获部分与具有高消光系数的近红外染料三碳菁共轭,合成了探针 73(图35)。 最初,由于His与荧光团之间的光诱导电子转移过程,探针 73 表现出微弱的荧光。然而,在His的咪唑环与¹O₂发生1,4-环加成反应后,光诱导电子转移效应减弱,导致系统荧光恢复。该探针对¹O₂具有快速的响应动力学、高灵敏度和优异的选择性。此外,它具有线粒体靶向能力,能够对细胞线粒体内的¹O₂进行可视化成像。
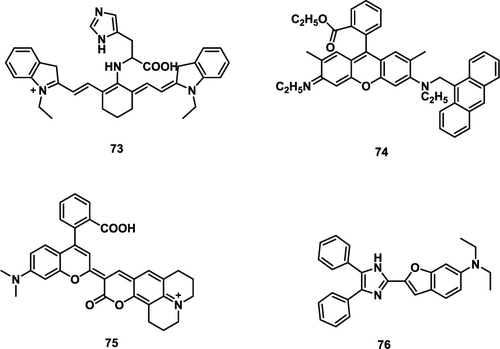
图 35. 部分¹O₂荧光探针。
蒽及其衍生物已知与¹O₂发生特异性反应,使其成为构建荧光探针的宝贵材料。Huang及其同事选择了两种不同的荧光团,并将其共价连接到蒽甲基上,从而设计并合成了一系列¹O₂响应性荧光探针。 这些探针与¹O₂特异性反应,导致C-C键断裂,随后蒽单元与荧光团分离,从而中断光诱导电子转移过程。值得注意的是,探针 74 表现出高灵敏度和选择性,能够有效检测和成像细胞内的¹O₂。这为进一步研究细胞氧化应激提供了有力的工具,为我们提供了对其潜在机制和潜在影响的见解。
Jiménez-Sánchez及其同事引入了一种双发射荧光探针 75,它能够动态监测响应线粒体膜电位变化和使用光敏剂的光动力治疗期间线粒体¹O₂的产生。 在与¹O₂反应后,探针 75 表现出失去线粒体定位能力,随后形成的香豆素单元靶向核仁,在线粒体、细胞质和核仁之间产生明显的荧光强度差异。值得注意的是,75 的荧光响应可以通过其亚细胞分布来监测,并且不受局部pH变化、膜电位波动和其他ROS的影响。
Long及其同事报道了一种比率型荧光探针 76,用于现场定量检测作物中的¹O₂。 ¹O₂在作物的各种生物和非生物胁迫中起着至关重要的作用,监测其水平对于理解作物的生长和发育至关重要。探针 76 在与¹O₂反应后,荧光波长从450 nm到565 nm发生大的位移,实现了比率荧光检测。反应机理涉及探针 76 中的2,3-二苯基咪唑基团作为¹O₂的选择性识别基团。该探针成功用于检测细胞和斑马鱼中光照射诱导的¹O₂,以及研究不同光源下作物叶片中¹O₂的产生。此外,借助该探针,开发了一种移动荧光分析设备,以实现对作物中¹O₂的现场定量检测。
2.8. 臭氧 (Ozone)
2.8.1. 臭氧简介
臭氧 (O₃) 是一种具有强氧化特性的无色气体。在医学领域,O₃被用于治疗多种疾病,主要是通过在细胞内诱导氧化还原反应。O₃在生物液体中迅速溶解后,形成具有生物活性的氧化物,对细胞功能产生显著影响。 研究表明,O₃可以通过引发氧化应激来调节细胞生理过程。暴露于低剂量的O₃会破坏氧化还原系统,在细胞内引发氧化应激。 这种氧化应激激活了细胞的抗氧化防御机制,促使抗氧化剂合成增加,从而保护细胞免受潜在损害。 除了在氧化应激中的作用外,O₃还在细胞信号通路的调节中起着至关重要的作用,作为一种外源性调节剂,影响线粒体的更新和生物合成。 这种调节可能会影响细胞生长、分化和凋亡等生理过程。
长期暴露于低剂量的O₃可能会使细胞进入持续的氧化应激状态,这与多种疾病的发生密切相关。 慢性氧化应激会损害细胞功能,导致功能障碍,并最终引发一系列病理状况,包括炎症、衰老和肿瘤发生。研究表明,O₃暴露会激活炎症信号通路,导致炎症因子的释放,从而加剧局部和全身性炎症反应。 虽然这种炎症反应在某些情况下可能具有保护作用,但不受控制的炎症可能导致慢性炎症和相关疾病。此外,O₃已被证明可以调节凋亡过程,通常被认为是通过提高细胞内ROS水平来诱导凋亡的关键因素。 这种效应在肿瘤细胞和病变组织的背景下具有潜在的治疗意义。
此外,O₃可以通过氧化反应氧化蛋白质氨基酸残基。在氧化过程中,胱氨酸和赖氨酸等氨基酸可能会形成二硫键或其他氧化产物,影响蛋白质的折叠和功能。氨基酸侧链的羟基化可以改变蛋白质的构象,损害其功能。 O₃还可以促进某些氨基酸(如赖氨酸)与醛的反应,导致羰基化修饰,影响蛋白质的结合和催化活性。 此外,臭氧诱导的氧化会产生ROS,如H₂O₂,这会进一步加剧对蛋白质的氧化损伤。 值得注意的是,O₃诱导的翻译后修饰与多种疾病的发展有关,特别是影响呼吸系统的疾病。 例如,O₃可以通过氧化应激诱导肺细胞损伤,导致慢性阻塞性肺病 (COPD) 和哮喘等疾病。这与SRB1的氧化修饰及其在肺组织中的保护作用密切相关。因此,O₃在调节细胞内生理和病理事件中的作用构成了一个复杂而重要的研究领域。通过诱导氧化应激、调节线粒体功能和影响细胞信号转导,O₃参与了众多的生理过程和病理状态。
2.8.2. 臭氧的荧光成像
由于活细胞中O₃的半衰期短且浓度低,因此迫切需要一种快速且特异的检测方法。Tang及其同事基于分子内电荷转移机理,利用花青 (Cy) 作为荧光核心,L-色氨酸 (Trp) 作为O₃的识别部分,合成了一种近红外荧光探针 77(图36)。 探针 77 具有斯托克斯位移大、对O₃响应快、灵敏度高、细胞毒性低等优点。值得注意的是,它成功用于细胞内O₃的荧光可视化,代表了生物系统中臭氧检测领域的重大进展。
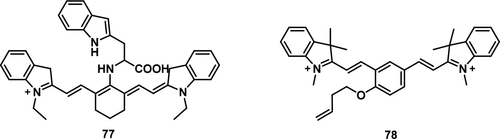 图 36. 部分O₃荧光探针。
图 36. 部分O₃荧光探针。
研究人员现在已经建立了O₃与包括抑郁在内的多种疾病之间的紧密联系。然而,由于大脑复杂的生理环境和检测工具的稀缺,抑郁与O₃之间的关系仍不清楚。为了解决这个问题,Tang及其同事设计并构建了近红外荧光探针 78,用于直接可视化抑郁模型小鼠大脑中的O₃。 O₃与探针的3-丁烯基的末端烯烃反应,将 78 转化为醌类衍生物。该反应扩展了探针 78 的共轭体系,导致荧光增加。探针对O₃的高灵敏度和选择性使得能够成功可视化PC12细胞氧化应激过程中O₃的产生。更重要的是,实现了对表现出抑郁表型的小鼠脑组织中O₃的原位成像观察,揭示了抑郁小鼠大脑中O₃的异常上调。实验证明,小鼠大脑中的O₃通过介导IL-8的过表达诱导抑郁。这一发现为O₃与抑郁之间的正相关关系提供了令人信服的证据。
2.9. 简要总结
用于ROS的荧光探针在结构设计、反应机理和生物成像应用方面取得了显著进展。对于H₂O₂,基于硼酸酯氧化、Payne/Dakin重排、过氧酯裂解和硒氧化的探针实现了生理条件下的灵敏检测。ROO•已通过自由基氧化偶联或C=C键氧化进行可视化,为脂质过氧化过程提供了见解。对于HClO,探针通常基于硫醚或硒醚、N,N-二甲基硫代氨基甲酰基和硫缩酮的氧化,以及C=C键的氧化裂解和其他氧化相关机理进行设计。同样,HBrO探针利用基于硫/硒的硫族元素的氧化和溴化反应,以及其他氧化特异性转化,尽管与HClO的化学相似性,但仍能实现选择性识别。O₂•⁻通过酚-醌互变和亲核取代等机理进行检测,而•OH则通过芳香族羟基化、夺氢和富电子杂原子的氧化来识别。同时,识别¹O₂和O₃的探针仍然相对有限,但在氧化应激监测方面显示出前景。结合亚细胞靶向单元(例如,用于线粒体或溶酶体),这些探针能够实时成像细胞和动物模型中的H₂O₂、•OH、¹O₂和O₂•⁻等ROS物种。尽管取得了这些进展,但关键挑战仍然存在,包括区分具有重叠反应性的ROS,确保探针在氧化环境中的稳定性,以及在活体组织中实现定量成像。未来的方向应优先发展比率型或可逆探针、深层组织兼容的荧光团、用于同时ROS映射的多分析物平台,并加强体内药代动力学和毒性评估,以加速临床转化。
3. 活性氮 (Reactive Nitrogen Species)
3.1. 过氧亚硝酸盐 (Peroxynitrite)
3.1.1. 过氧亚硝酸盐简介
过氧亚硝酸盐 (ONOO⁻) 是由一氧化氮 (NO) 和超氧阴离子 (O₂•⁻) 反应形成的强氧化剂。它能以不同方式与蛋白质、脂质和DNA反应,进而参与或影响细胞内的许多生物事件。 ONOO⁻及其质子化形式ONOOH可通过单电子或双电子氧化过程直接与氨基酸反应,其中3-硝基酪氨酸是公认的ONOO⁻硝化蛋白质的产物。酪氨酸硝化主要涉及一个两步自由基反应。首先,单电子氧化导致酪氨酸自由基的形成,随后NO₂与酪氨酸自由基快速反应形成3-硝基酪氨酸。这种修饰通常会导致蛋白质构象的改变,影响其活性及与其他分子的相互作用,从而影响相应的生理生化过程,并最终导致心血管疾病和神经退行性疾病等。 此外,ONOO⁻与半胱氨酸中的巯基反应,导致半胱氨酸的氧化或硝化。具体来说,ONOO⁻与硫醇反应形成活性中间体次磺酸,后者可再与其他含硫醇的物质反应形成二硫键。 硫醇也可被ONOO⁻产生的次级自由基氧化生成RS•,后者再与NO反应形成亚硝基硫醇。S-硝化被认为是一种可逆的修饰,可调节蛋白质的活性、稳定性以及与其他分子的相互作用。这种修饰在细胞信号传导和应激反应中起着关键作用,帮助细胞适应环境变化。ONOO⁻介导的半胱氨酸氧化通常导致酶或蛋白质失活,但研究也表明这种氧化可能会激活一些基质金属蛋白酶。 因此,ONOO⁻通过修饰多种关键酶和蛋白质来调节多种生物信号通路。例如,S-硝化和酪氨酸硝化可以影响信号转导通路,并调节细胞增殖、凋亡和炎症反应。
在细胞层面,线粒体被认为是负责ONOO⁻产生、反应和发挥功能的主要细胞器。研究表明,与NO和线粒体之间的可逆相互作用相比,ONOO⁻与线粒体的相互作用更为剧烈,常伴有细胞毒性。 由于ONOO⁻具有强大的氧化和硝化能力,ONOO⁻与线粒体组分之间的不可逆反应严重影响电子传递链复合物I、II和ATP酶的活性,改变线粒体的生物学功能和钙离子稳态,并进一步促进O₂•⁻的形成,从而加剧细胞毒性。 事实上,有大量证据表明,由NO引起的对线粒体功能的持久性损伤主要是由ONOO⁻造成的。例如,乌头酸酶是线粒体三羧酸循环中的一种重要酶,ONOO⁻可通过氧化分解使其失活,从而影响线粒体的生理功能。Mn-SOD是线粒体中一种关键的抗氧化酶,它很容易被ONOO⁻进行酪氨酸硝化,导致失活并进一步加剧线粒体氧化应激。细胞色素C是一种丰富的线粒体蛋白,在电子传递链中起着关键作用。 研究表明,细胞色素C与心磷脂结合可引起构象变化,在线粒体中形成血红素过氧化物酶,这与凋亡信号转导有关。然而,ONOO⁻裂解产生的次级自由基可以硝化细胞色素C并引起构象变化,阻止其与心磷脂结合,从而影响凋亡信号。
在正常生理条件下,细胞可以产生一定量的ONOO⁻作为参与调节抗氧化机制的内源性信号分子。ONOO⁻激活细胞内的抗氧化酶,从而增强细胞的抗氧化能力并保护其免受氧化损伤。 ONOO⁻还影响细胞内信号转导通路,参与血管舒张、神经传导和炎症等生理过程,这些对于维持正常的细胞功能至关重要。 此外,ONOO⁻在细胞增殖和分化中起着调节作用。适度的ONOO⁻可以促进细胞增殖和分化,而过量的ONOO⁻可能导致细胞凋亡。 因此,细胞中ONOO⁻浓度的稳态波动是维持正常细胞功能和生长的关键因素。
因此,ONOO⁻在细胞内生理和病理过程中扮演着复杂而重要的角色。它不仅可以作为细胞信号分子参与正常生理功能,还可以在病理状态下引起细胞损伤并促进疾病进展。因此,研究ONOO⁻在不同疾病中的作用机制、作用方式和具体作用,将有助于深入了解其在生物体中的调节作用,并为相关疾病的治疗提供新的思路和方法。迄今为止,研究人员已经开发了多种方法来检测ONOO⁻及其相关生物事件,其中荧光成像技术因其高灵敏度、高时空分辨率和无创特性而受到越来越多的关注。
直接检测S-亚硝基化蛋白依赖于S-NO键的不稳定性,这导致NO部分在肽骨架断裂前从蛋白质上丢失,从而产生29 Da的质量差异(-NO和+H)。 因此,基于中性丢失的质谱 (MS) 方法可用于鉴定含有S-亚硝基硫醇 (SNO) 基团的蛋白质。Wang等人开发了一种使用ESI-Q-TOF MS直接检测S-亚硝基化蛋白的策略。 在该方法中,用过量的S-亚硝基谷胱甘肽(一种NO供体)处理硫氧还蛋白1 (Trx1),并通过中性丢失29 Da的MS分析来研究蛋白质S-亚硝基化的水平(图37)。结果显示,66%的Trx1含有一个SNO修饰,17%含有两个SNO单元。Trx1-Cys73处的S-亚硝基化位点也被确定。重要的是,该策略的有效性要求研究人员仔细调整样品缓冲液成分和MS硬件参数,以确保能够以最佳信噪比分析S-亚硝基化肽离子。
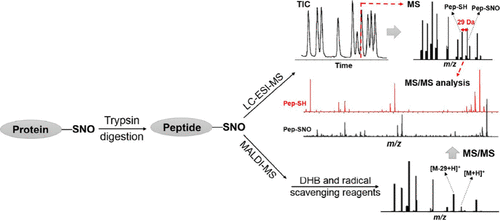 图 37. 直接检测蛋白质S-亚硝基化的质谱方法。
图 37. 直接检测蛋白质S-亚硝基化的质谱方法。
然而,由于内源性S-亚硝基化蛋白的丰度低以及S-NO键的不稳定性,蛋白质中S-亚硝基化的检测仍然具有挑战性。目前,研究人员已经开发了多种用于间接检测S-亚硝基化蛋白的分析策略。 Faccenda及其同事首次证明了一种用于鉴定蛋白质中S-亚硝基化位点的AuNPs富集方法。该纳米探针基于AuNPs与SNO基团反应,从S-亚硝基化蛋白中释放NO的事实(图38)。 蛋白质上的自由硫醇被烷基化剂IAM封闭,并在AuNPs富集前进行蛋白酶解。然后将AuNPs引入消化液中,S-亚硝基化肽与AuNPs反应形成AuNP硫肽。这些与AuNP结合的肽通过离心富集,并通过与二硫苏糖醇孵育来释放。最后,使用MALDI-TOF MS鉴定释放的肽。与有机汞树脂类似,AuNPs也直接与SNO反应形成相对稳定的S-Au键,从而无需进行SNO还原步骤即可进行分析。然而,该方法仅在纯蛋白质系统中得到验证,尚未在复杂的蛋白质混合物中验证。
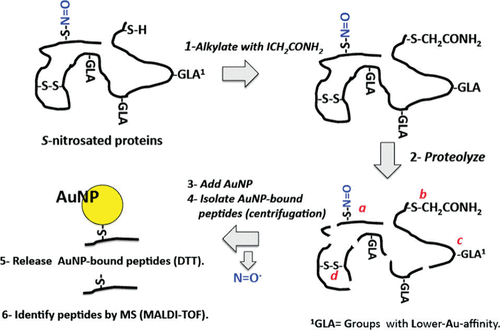
图 38. 用于鉴定蛋白质中S-亚硝基化位点的AuNP富集方法。
Held及其同事设计并合成了一种可点击的探针PBZyn,用于S-亚硝基化的多功能表征。 该探针含有邻-膦基-苯甲酰基,可与SNO基团反应形成二硫键;此外,在探针末端引入了一个末端炔基,可与各种功能基团(如生物素或荧光团)进行点击偶联,用于蛋白质S-亚硝基化分析。他们成功地使用该探针标记了S-亚硝基-谷胱甘肽和S-亚硝基-N-乙酰青霉胺,并通过LC-MS分析证实了PBZyn与SNO基团的相互作用(图39)。用PBZyn标记S-亚硝基化血红蛋白,随后与叠氮生物素偶联,使用链霉亲和素富集,并通过SDS-PAGE检测,从而评估了该探针对蛋白质富集的效果。通过与PBZyn孵育并与两种不同的荧光团TAMRA和Alexa Fluor 488进行点击结合,还在活细胞中完成了S-亚硝基化的原位成像。这些结果表明PBZyn能够量化和定位细胞中S-亚硝基化的水平。
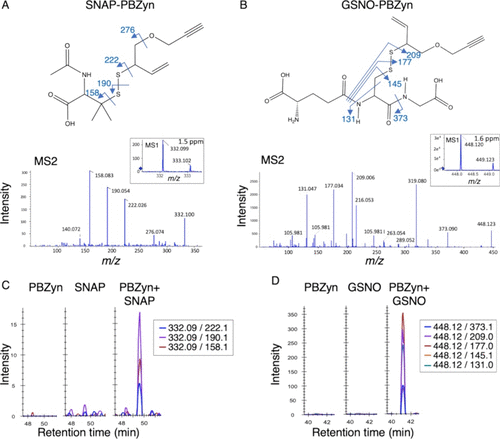 图 39. 通过质谱法确认PBZyn与SNOs的反应。
图 39. 通过质谱法确认PBZyn与SNOs的反应。
3.1.2. 过氧亚硝酸盐的荧光成像
3.1.2.1. 基于硼酸酯氧化水解的ONOO⁻荧光成像策略
硼酸酯已证明与ONOO⁻具有反应性,并被广泛用于设计和开发ONOO⁻荧光探针。 反应机理如图40所示。强亲核体ONOO⁻攻击苯基硼酸酯的硼原子,形成过硼酸酯中间体。随后,芳基迁移至氧原子,产生芳氧基硼烷,最终水解生成酚类物质(荧光团)。由于其快速的反应速率和高转化效率,硼酸酯在新型ONOO⁻荧光探针开发领域引起了广泛关注。
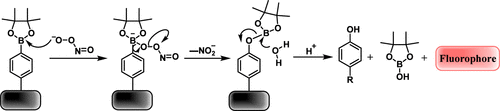
图 40. 苯基硼酸酯与ONOO⁻之间的反应机理。
James及其同事设计了一系列基于3-羟基黄酮 (3-HF) 激发态分子内质子转移 (ESIPT) 的硼酸酯荧光探针,用于在与Aβ聚集体结合时对ONOO⁻进行比率检测。 在这些探针中,探针 79(图41,表6)表现出最显著的荧光强度变化。探针 79 的ESIPT过程可以被苄基硼酸酯基团的引入所阻断,后者可被ONOO⁻选择性去除,导致荧光开启响应。具体而言,当探针 79 与Aβ聚集体形成的疏水腔结合时,会导致ESIPT探针 79 的正常 (N) 态荧光增强。随后与ONOO⁻反应并与Aβ结合,激活了ESIPT探针 79 在互变异构体 (T*) 态的荧光。探针 79 被应用于AD转基因小鼠脑切片中Aβ和ONOO⁻的同时荧光成像。
图 41. 基于硼酸酯氧化水解的部分ONOO⁻荧光探针。
表6. 部分ONOO⁻荧光探针
| 探针 | λex/λem (nm) | 检测限 | 响应时间 | 响应类型 | 响应机理 | 参考文献 |
|---|---|---|---|---|---|---|
| 79 | 365/530 | 21.7 ± 1.2 nM 至 106.9 ± 4.6 nM | n.d. | 比率 | ESIPT | 10.1021/jacs.8b08457 |
| 80 | 640/692 | 94 nM | 15 分钟 | 关-开 | ICT | 10.1002/advs.201900341 |
| 81 | n.d. | 68.27 nM | n.d. | 关-开 | ICT | 10.1002/anie.202209793 |
| 82 | 450/562 | n.d. | n.d. | 关-开 | FRET | 10.1021/jacs.1c07954 |
| 83 | 515/630 | 34 nM | n.d. | 关-开 | AIE | 10.1021/jacs.1c11455 |
| 84 | 430/517 | n.d. | n.d. | 关-开 | ICT | 10.1002/advs.202207066 |
| 85 | 500/664 | 10 nM | 0.3 分钟 | 关-开 | ICT | 10.1016/j.bios.2023.115415 |
| 86 | 425/530 | 10.4 nM | n.d. | 关-开 | ICT | 10.1002/anie.202409295 |
| 87 | 360/461 | 38.2 nM | n.d. | 关-开 | ICT | 10.1021/jacs.6b06398 |
| 88 | 640/660 | 6.09 nM | n.d. | 关-开 | ICT | 10.1016/j.biomaterials.2019.119499 |
| 89 | 660/760 | 64.2 nM | 15 分钟 | 关-开 | ICT | 10.1002/anie.202116174 |
| 90 | 627/678 | 90 nM | n.d. | 关-开 | ICT | 10.1021/jacs.9b01374 |
| 91 | 564/698 | 3.4 nM | 30 分钟 | 关-开 | ICT | 10.1002/anie.202206894 |
| 92 | 498/545 | 0.5 nM | 10 秒 | 关-开 | PET | 10.1039/C9SC03798E |
| 93 | 350/550 | 9.8 nM | 10 分钟 | 关-开 | ICT | 10.1016/j.jhazmat.2024.134094 |
| 94 | 808/1050 | 0.06 μM | n.d. | 关-开 | FRET | 10.1002/anie.201911803 |
| 95 | 520/700 | 17 nM | n.d. | 关-开 | ICT | 10.1002/adfm.202003628 |
缩写:无数据 (n.d.), 分子内电荷转移 (ICT), 光诱导电子转移 (PET), 激发态分子内质子转移 (ESIPT), Förster共振能量转移 (FRET)。
Qian及其同事描述了一种基于硼酸化的亚甲蓝 (MB) 的近红外荧光探针 80,用于监测癫痫脑中内源性ONOO⁻通量的动态变化。 由于MB被还原为无色亚甲蓝 (LMB),破坏了MB荧光团的共轭结构,探针 80 本身不发荧光。在ONOO⁻的攻击下,探针 80 的硼酸酯部分发生氧化水解,形成LMB,后者进一步被氧化为MB,导致强荧光的恢复。值得注意的是,80 的检测限 (LOD) 为94 nM,信噪比 (S/N) = 3。该探针成功应用于成像各种抗癌剂在SH-SY5Y细胞中诱导的外源性ONOO⁻。最后,探针 80 被用于可视化红藻氨酸 (KA) 诱导的癫痫大鼠海马中的内源性ONOO⁻通量。
诊疗一体化结合了诊断和治疗的功能,可以实现疾病的早期检测、药物递送追踪、治疗反应的实时监测等,在精准医疗中具有巨大潜力。 理想的癌症治疗剂应仅在病变部位激活其诊断信号并发挥其治疗效果。基于诊疗一体化的概念,Ding及其同事报道了一种可激活的近红外 (NIR) 余辉诊疗前药 81,可以避免由外部光激发引起的高背景噪声的干扰。 81 可以响应与免疫原性细胞死亡 (ICD) 相关的肿瘤中升高的ONOO⁻水平,从而促进羟基喜树碱 (HCPT) 的释放,并同时激活余辉信号。这使得能够实时监测药物释放过程以及肿瘤从冷状态到热状态的转变。81 本身是一种通过光动力疗法 (PDT) 实现的ICD诱导剂。PDT引发ICD并招募第一批中性粒细胞分泌ONOO⁻以触发HCPT的释放。作者证明HCPT可以显著放大PDT介导的ICD过程。因此,81 通过建立“ICD-HCPT释放-放大ICD”的循环回路,显示出自我维持的ICD放大效应。体内研究显示,前药可以通过抗肿瘤免疫反应根除现有肿瘤并预防肿瘤复发。
三磷酸腺苷 (ATP) 稳态的破坏与许多疾病有关,而这种破坏的原因通常归因于氧化应激,其中涉及高水平的活性氧 (ROS) 和活性氮 (RNS) 的产生。 特别是,ONOO⁻是一种已知的RNS,通过氧化性失活线粒体ATP合酶来抑制ATP的产生。然而,ATP-LW已在COVID-19大流行期间由默克公司上市,但关于其范围、效用甚至使用模式的详细信息尚未出现在同行评审的论坛中。为了解决这一不足并强调目前市售的荧光ONOO⁻和ATP探针 82 的实用性,使用罗丹明内酰胺/1,8-萘酰亚胺混合结构作为支架,创建了一种双分析物荧光探针。 它可以同时检测ONOO⁻和ATP。ONOO⁻选择性地氧化探针 82 的硼酸酯部分,得到荧光化合物。相反,ATP与探针 82 结合诱导罗丹明的螺内酰胺环打开,产生高荧光强度的发射产物。由于ONOO⁻和ATP产物之间的发射差异,探针 82 允许在绿色通道中检测ONOO⁻,在红色通道中检测ATP浓度。在细胞成像实验中,使用肝细胞 (HL-7702细胞) 证明了 82 同时监测ONOO⁻和ATP的可能性。在用寡霉素A(ATP合酶抑制剂)处理HL-7702细胞后,红色通道的信号强度降低,而绿色通道的信号强度增加。在存在SIN-1(一种外源性ONOO⁻供体)的情况下,观察到类似的荧光变化。最后,通过使用探针 82 和两个不同的通道,可以同时监测APAP诱导的肝毒性期间ONOO⁻的增强和ATP的耗尽。这种监测为APAP诱导的毒性的信号通路提供了支持,其中增加的ONOO⁻和ATP耗尽被认为是导致肝坏死的原因。
Ding及其同事合成了一种包含甲基硫代苯基硼酸片段的Schaap的1,2-二氧杂环丁烷前体 (AGL)。他们采用两亲性DSPE-PEG2000共聚物作为基质,通过纳米沉淀法将AGL和具有3D扭曲分子结构的近红外发射分子 (TPE-TV CyP) 共封装,制备了ONOO⁻可激活的余辉发光 (PA-AGL) 纳米探针 83(图42)。 研究发现,纳米探针中可以发生向TPE-TV CyP的有效能量转移,导致纳米探针 83 具有近红外余辉发光行为。扭曲的AIE分子还可以减少非辐射热失活,从而增强纳米探针中的近红外余辉发光性能。纳米探针 83 的水溶液在白光照射下可以在TPE-TV CyP中产生¹O₂,然后氧化AGL的烯醇醚结构产生1,2-二氧杂环丁烷。鉴于甲基硫代苯基硼酸显著抑制二氧杂环丁烷的降解,该过程无法产生余辉发光。光照后,将纳米探针注射到炎症小鼠模型中。在炎症部位,中性粒细胞可以进入并产生丰富的ONOO⁻,后者可以快速解离甲基硫代苯基硼酸片段,导致二氧杂环丁烷变得不稳定并进一步分解产生绿色发光化合物。该化合物与AIE分子之间的能量转移最终导致纳米探针 83 的近红外余辉发光和炎症部位的成像。此外,ONOO⁻激活探针可以通过捕捉免疫原性细胞死亡期间浸润中性粒细胞的动态变化来有效评估ICD药物的疗效,并预测其在肿瘤冷却和加热过程中的有效性。
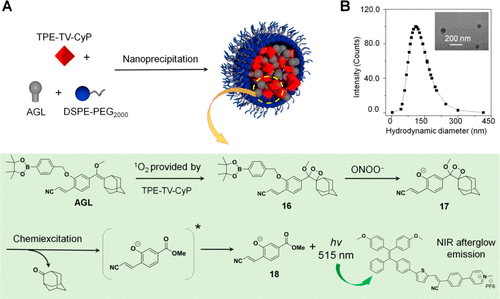
图 42. 探针 83 (PA-AGL) 的响应机理示意图。(A) 纳米颗粒制备及纳米颗粒内近红外余辉发光机理示意图。(B) PAAGL纳米颗粒的尺寸分布和TEM图像(插图)。
Zheng及其同事为设计具有高F/F₀和S/N比的可激活探针,开发了一种“与”逻辑门。 它利用脂滴 (LDs) 作为可控的背景输入,并将目标分析物设置为可变输入。由于双重锁定,荧光被极大地猝灭,导致目标分析物的F/F₀比率极高。目标分析物可以通过空间位置直接可视化,无需对照组。因此,作者设计了一种ONOO⁻可激活探针 84。探针 84 与ONOO⁻反应后,F/F₀达到2600。84 在激活后可以从线粒体转移到LDs。该探针在体外和体内环境中均表现出优于市售探针的选择性和信噪比。因此,在原位给予 84 后,小鼠模型中的动脉粥样硬化斑块被清晰地描绘出来。这种输入可控的“与”逻辑门有望用于执行更多的成像策略。
为了实现各种胶质瘤相关样品中ONOO⁻的多尺度成像,Li及其同事提出了一种物理化学性质指导的探针设计策略。 该小组首先对一系列近红外荧光基团进行CNS多参数优化 (CNS MOP) 评分,以预测其血脑屏障通透性,最终筛选出Si罗丹明荧光基团。源自该荧光基团和芳基硼酸酯的探针 85 可以有效且选择性地检测各种胶质瘤相关样品中的ONOO⁻。探针 85 成功完成了对来自患者的外源性原代细胞、体外临床胶质瘤切片和体内胶质瘤小鼠模型中ONOO⁻的成像。此外,该小组通过尿酸 (UA) 调节细胞ONOO⁻,下调ONOO⁻表达水平可以抑制胶质瘤细胞的增殖。这些结果表明ONOO⁻是胶质瘤诊断的潜在生物标志物和治疗靶点。
Kim及其同事开发了一种二氨基萘保护的硼酸作为识别部分,用于创建ONOO⁻特异性荧光探针。 合成了三种不同的荧光探针,发射范围在可见光和近红外区域。与相应的基于芳基硼酸的探针相比,这些探针对ONOO⁻的响应优于对H₂O₂和其他ROS的响应,从而克服了基于芳基硼酸酯的ONOO⁻探针选择性低的问题。它们的高选择性可以导致在帕金森病等复杂疾病过程中准确检测ONOO⁻。此外,探针 86(图43)表现出优异的血脑屏障通透性,并被优化用于动态可视化帕金森病小鼠大脑中ONOO⁻的变化。体外和体内结果表明,86 是对ONOO⁻具有高选择性和灵敏度的反应基团。该策略可以扩展到其他常见的含羟基染料,并大大提高在复杂生物系统和过程中对ONOO⁻的准确检测。尽管其选择性令人印象深刻,但该探针目前仅能对ONOO⁻进行静态监测。
图 43. 基于二氨基萘保护的硼酸的探针 86 的化学结构。
3.1.2.2. 基于C=C双键氧化裂解的ONOO⁻荧光成像策略
含有C=C双键的物质已知会与ROS反应。具体而言,ONOO⁻可以氧化裂解含有C=C双键的化合物,导致形成相应的醛或羧酸。 利用这一特性,Tang及其同事开发了一种荧光探针 87(图44),用于检测和成像与药物性肝损伤 (DILI) 相关的两个关键生物标志物:O₂•⁻和ONOO⁻。 该探针采用双重响应机制。在O₂•⁻存在下,三氟甲基磺酰基脱保护,从而选择性地激活近红外荧光 (NIRF) 输出。此后,与ONOO⁻的反应诱导探针烯烃链的氧化裂解,从而触发双光子激发荧光 (TPEF) 信号。该机制能够对两种分析物进行差异化和同时检测,为与DILI相关的氧化和硝化应激通路提供了宝贵的见解。探针 87 成功用于监测叔丁基羟基茴香醚 (BHA) 对对乙酰氨基酚 (APAP) 细胞毒性的化学保护作用。体内成像实验表明,NIRF和TPEF荧光信号均随APAP浓度的升高而增加,表明在APAP处理后O₂•⁻和ONOO⁻被诱导产生。 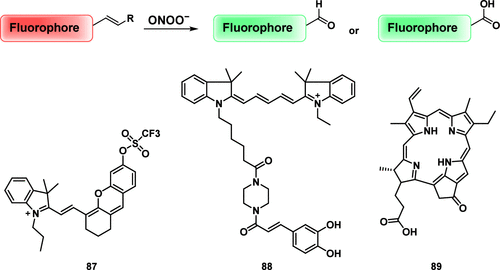
图 44. ONOO⁻触发的C=C键裂解示意图以及部分ONOO⁻荧光探针。
双光子成像技术因其成像深度深、光损伤低、信噪比高、三维成像能力强和实时观察等优点,已成为现代生物医学研究中不可或缺的工具。 其在细胞行为、组织结构和生物过程研究中的应用不仅推动了基础生物学的进步,也为疾病的诊断和治疗提供了新的思路和方法。Tang及其同事介绍了一种双光子荧光探针 88 的开发,该探针可以可视化肝缺血再灌注 (IR) 损伤中的O₂•⁻和ONOO⁻。 另一方面,荧光成像和蛋白质组学分析支持的详细数据揭示了由O₂•⁻–ONOO⁻–精氨酸酶1介导的IR损伤信号通路。作者还发现精氨酸酶1的硝化加剧了IR损伤,为治疗IR损伤提供了一种新方法。该探针通过哌啶基连接咖啡酸基团和Cy5基团,并显示出高特异性、灵敏度和线粒体靶向性。Cy5染料的特点是近红外发射和ONOO⁻诱导的荧光猝灭。ONOO⁻触发了Cy5部分的单电子氧化,形成1,3,3-三甲基氧吲哚,这裂解了探针 88 的聚乙炔链。在O₂•⁻暴露下,咖啡酸残基中的邻苯二酚转化为苯醌。使用探针 88,研究人员首次观察到IR小鼠线粒体中O₂•⁻和ONOO⁻的协同增加。此外,该研究确定了精氨酸酶1中ONOO⁻的三个酪氨酸硝化位点,这进一步促进了ONOO⁻的形成,并加剧了细胞内氧化还原失衡和IR损伤。这些发现阐明了O₂•⁻、ONOO⁻和精氨酸酶1之间的直接分子联系,为预防和治疗IR损伤提供了见解。
持续发光成像可以避免自发荧光噪声的干扰;因此,它具有更高的信噪比,在活体生物中具有广阔的应用前景。然而,持续发光材料的临床应用仍然受到生物安全性、可修饰性、稳定性和发射波长的挑战。为了筛选和探索持续发光能力,Ding及其同事选择了六种具有不同但相似分子结构的卟啉衍生物作为研究对象。 发现当激发照射(660 nm, 1.4 W/cm², 2 分钟)停止时,所有卟啉都表现出显著的余辉发光;其中,探针 89 表现出最高的信号。当加入高氧化含量的ONOO⁻时,这些卟啉也表现出化学发光行为,其中 89 表现出最强的持续发光信号。作者强调了对探针 89 的研究,并认为ONOO⁻首先氧化了探针 89 中的α-碳双键,形成了不稳定的中间体 89-二氧杂环丁烷。在β/γ C-C双键持续氧化的过程中,89-二氧杂环丁烷中间体逐渐降解为 89-醛,最终释放光子形成持续发光。具有同时双模态成像能力的光学试剂,能够提供术前具有深层肿瘤信息的光声成像和术中具有高信噪比 (SBR) 和灵敏度的成像,尤其具有价值。基于探针 89 构建了一种具有β-折叠结构的超分子多肽纳米组装体 89-FFGYSAYPDSVPMMS (Ppa-FFGYSA),其功能特性从光声成像过渡到持续发光成像,并显示出对高表达EphA2蛋白的肿瘤细胞的高度靶向能力。在乳腺癌和腹膜癌小鼠模型中实现了持续发光成像引导的肿瘤切除。
3.1.2.3. 基于α-酮酰胺氧化的ONOO⁻荧光成像策略
多项研究已确定α-酮酰胺基团是与ONOO⁻反应的重要触发器。据推测,4-硝基苯取代的α-酮酰胺首先受到ONOO⁻的亲核攻击,形成一个中间体,该中间体经历Baeyer-Villiger重排和水解,产生胺、4-硝基苯甲酸和二氧化碳。这种独特的反应性凸显了α-酮酰胺基团作为开发用于实时监测的特异性ONOO⁻荧光探针的关键功能基团的潜力(图45)。其有前途的反应特性使其成为推进生化研究和诊断中ONOO⁻荧光传感器设计与合成的有价值的目标。
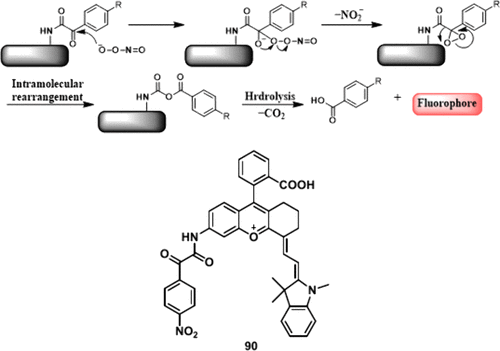
图 45. α-酮酰胺与ONOO⁻的反应原理及探针 90 的化学结构。
由于近红外染料本身在病理过程中容易被过度产生的高活性物质破坏,因此大多数近红外探针都存在假信号的问题。 Zhang及其同事设计并构建了一种高保真近红外荧光探针 90,用于准确监测ONOO⁻。 最初,作者通过将α-酮酰胺与两种近红外荧光团结合,设计了探针DCM-ONOO⁻和HD-ONOO⁻,但这两种探针在与ONOO⁻反应后都不能产生阳性信号。基于上述实验结果,监测了23种近红外染料的稳定性,以筛选并构建稳定的目标探针 90。4-硝基苯基乙醛酸能够作为荧光团氨基的保护基,在与ONOO⁻反应后可被去除,进而释放出含氨基的荧光团,并伴随荧光的变化。此外,共定位实验表明,探针 90 主要位于线粒体中,非常适合特异性检测活细胞中的内源性ONOO⁻。重要的是,通过探针 90 和氨肽酶(一种肝毒性标志物)探针的协同检测效果,作者评估了多种保肝药物在药物性肝损伤 (Dili) 后的治疗效果,并筛选出了对乙酰氨基酚诱导的肝毒性的有效修复药物。这项工作为近红外荧光探针的设计提供了一种可靠的新方法,可以有效提高探针的稳定性并避免假信号,实现对活体系统的高保真成像。
3.1.2.4. 基于氧化脱芳构化的ONOO⁻荧光成像策略
构建ONOO⁻探针的另一种策略是将富电子的酚单元引入荧光团中。在ONOO⁻存在下,酚被氧化并随后水解,导致苯醌的释放,同时释放荧光团,从而导致荧光信号的变化。
Kim及其同事基于先前对二氨基取代的若丹明染料的研究,发现增强π-结构体系、增加二氨基结构的刚性以及在核心引入氯可以产生更长的近红外发射波长。 因此,该小组开发了一种新的二氨基取代的若丹明染料,NIR-RD-3,通过将哌嗪样二氨基结构锁定在刚性的五元环中并嫁接一个氯原子,从而实现了更长的近红外发射。此外,据报道,4-氨基酚基团可被ROS(•OH, ONOO⁻, ClO⁻)氧化,但对ONOO⁻的选择性较低。因此,将化学触发剂4-(4-羟基苯胺)通过三碳链(-CH₂CH₂CH₂-)连接到优化的近红外荧光团NIR-RD-3上,得到用于检测ONOO⁻的探针 91(图46)。探针 91 满足了作为活体脑ONOO⁻成像的几个要求,包括优异的ONOO⁻灵敏度和选择性、近红外发射,特别是良好的血脑屏障穿透性。ONOO⁻的过表达是阿尔茨海默病 (AD) 的病理标志。用氯碘羟喹或姜黄素处理的APP/PS1小鼠大脑的实时荧光成像表明,ONOO⁻的表达在0到12小时之间降低到低水平。体内结果表明,施用抗AD化学物质,如氯碘羟喹和姜黄素,可能参与调节大脑中的氧化还原状态,以促进AD的治疗效率。
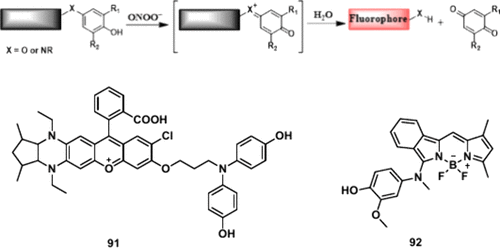
图 46. 由ONOO⁻促进的提议的氧化脱芳构化反应以及部分ONOO⁻荧光探针。
Li及其同事设计了两种探针,用于实时体内成像,以研究中风病理学中的亚硝酸盐应激。 选择了苯并BODIPY作为荧光团,通过摇瓶正辛醇/水分配实验,选择了对-羟基苯胺作为ONOO⁻的识别单元。这些探针由于对-羟基苯胺和苯并-BODIPY支架之间的自由旋转而表现出微弱的荧光,而在加入ONOO⁻后,对-羟基苯胺被迅速氧化并移除,释放出具有强荧光的荧光团支架类似物。由于在羟基旁引入了给电子的甲氧基,探针 92 对ONOO⁻的灵敏度比另一探针高741倍。有趣的是,即使是痕量的ONOO⁻ (0.5 nM) 也能诱导探针 92 荧光强度的统计学显著变化。该探针表现出最小的背景荧光信号,但对ONOO⁻的响应荧光增强高达1000倍,使得能够可视化中风病理学中亚硝酸盐应激的进展。此外,探针 92 成功可视化了氧-葡萄糖剥夺刺激 (OGD) 诱导的EA.hy926细胞中的内源性ONOO⁻。它有效地以时空分辨的方式检测了光血栓形成诱导的局灶性缺血模型中ONOO⁻的动态变化。最后,探针 92 成功用于追踪中脑动脉闭塞 (MCAO) 模型中凝块微血管中的ONOO⁻通量。
3.1.2.5. 基于其他氧化相关机理的ONOO⁻荧光成像策略
Xu及其同事开发了一种化学发光探针(图47,探针 93),利用二苯基次膦酸酯作为识别基团。 值得注意的是,探针 93 表现出高灵敏度 (9.8 nM)、高信噪比 (S/N) 和优异的生物成像能力。在生理条件下,ONOO⁻通过高选择性的水解裂解途径与二苯基次膦酸盐反应,导致形成中间体1 (Int 1)。(247-249) Int 1 随后经历化学诱导的电子交换发光和逆电子转移,导致产生激发态中间体2 (Int 2)。此外,受激的Int 2 产生基态荧光产物苯甲酸酯1 (Ben 1) 并伴随化学发光(发射波长530 nm)。因此,探针 93 可被ONOO⁻选择性激活,在激活时发射化学发光。这使得能够在体内检测和成像ONOO⁻。作者成功使用探针 93 检测百草枯刺激的细胞产生的ONOO⁻,以及肿瘤细胞、小鼠和人类肝癌组织中的内源性ONOO⁻。
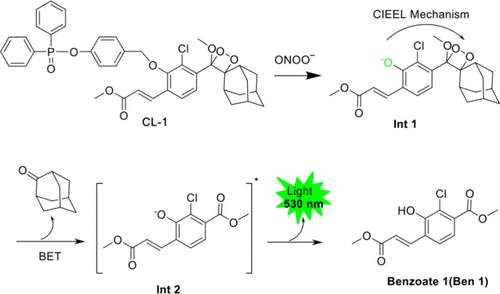
图 47. 探针 93 的反应机理和化学结构。
第二近红外窗口(NIR-II, 1000–1700 nm)的荧光成像技术因其无与伦比的组织穿透性(几厘米)和空间分辨率(约10毫米)而受到越来越多的关注,使其成为新一代体内成像技术的首选。 利用该成像技术的优势,Wang及其同事报道了一种新型靶向可激活NIR-II纳米探针 94(图48)的设计与合成,用于实时体内成像创伤性脑损伤 (TBI) 的早期生物标志物 (ONOO⁻)。 生色团A1094的吸收光谱与Ag₂S量子点的发射光谱显著重叠。因此,在没有ONOO⁻的情况下,当有效能量从Ag₂S量子点转移到A1094时,纳米探针 94 保持在关闭状态。在ONOO⁻存在下,A1094被氧化,1094 nm处的吸收峰消失,Ag₂S量子点开启,诱导1050 nm处荧光信号的显著增加。此外,与血管细胞粘附分子1 (VCAM1) 结合的肽使得纳米探针对TBI区域表达VCAM1的炎症内皮具有高靶向能力。使用创伤性脑损伤小鼠模型评估了体内ONOO⁻检测的可行性。由于没有背景噪声,优越的信噪比 (SNR > 10.2) 使得在注射后10分钟内即可在体内进行快速诊断。实验结果表明,基于这种靶向激活的NIR-II成像策略,在活体小鼠中很容易检测到ONOO⁻的动态过程。
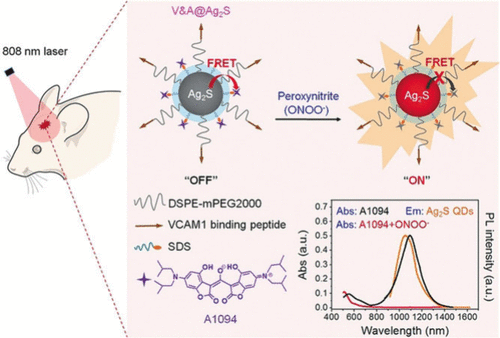
图 48. 探针 94 (V&A@Ag₂S) 的制备及体内ONOO⁻检测示意图。
化学发光比荧光更灵敏,但大多数化学发光探针往往只发射可见光且水溶性低,这也使得它们在体内成像中的效果较差。 Pu及其同事合成了两种近红外 (NIR) 化学发光探针 (NCRs),它们具有高肾脏清除效率,可用于肾脏中活性氧和活性氮物种 (RONS) 的实时成像。 NCRs由β-环糊精单元和修饰的二氰基亚甲基-4H-吡喃(含有Schaap的二恶烷)组成,分别作为肾脏清除增强剂和化学发光基团。NCR1和NCR2(图49,探针 95)的近红外化学发光可分别被O₂•⁻和ONOO⁻特异性激活。NCRs还具有高灵敏度和高效的肾脏清除率,不仅用于检测细胞内内源性RONS的细微上调,还用于无创监测肾脏中的RONS。NCR1被证明比NCR2更早被激活,表明在药物诱导的急性肾损伤 (AKI) 中O₂•⁻和ONOO⁻的序列上调。此外,通过荧光检测代谢后的NCRs进行了AKI的尿液分析,该方法比组织学分析更早(24小时)检测到RONS的上调。
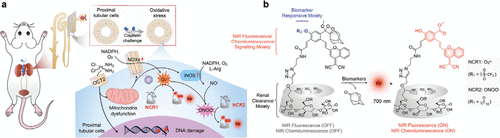
图 49. (a) NCR1和NCR2(探针 95)在AKI进展过程中检测O₂•⁻和ONOO⁻上调的示意图。(b) NCR1和NCR2响应其各自生物标志物(O₂•⁻和ONOO⁻)的化学结构。
3.2. 一氧化氮 (Nitric Oxide)
3.2.1. 一氧化氮简介
自20世纪80年代发现一氧化氮 (NO) 是心血管系统中一种重要的信号分子以来,NO在生理活动中的调节作用引起了广泛关注。大量研究表明,NO在许多生理过程中起着关键作用,如血管生成、凋亡、免疫反应、神经传递和心血管调节。(254-257)
NO是一种关键的信号分子,通过氧化和亚硝基化与各种生物分子相互作用,在免疫反应和细胞信号通路中发挥重要作用。与NO相关的氧化修饰的主要生化反应如下:主要的修饰之一是蛋白质S-亚硝基化,即NO与蛋白质中的半胱氨酸残基反应形成S-亚硝基硫醇 (SNOs), 如S-亚硝基半胱氨酸。这种可逆修饰可以影响蛋白质的活性、结构和相互作用,影响酶活性,并在细胞信号传导、基因表达和免疫反应中发挥关键作用。S-亚硝基化过程可以被抗氧化系统(包括硫氧还蛋白和谷胱甘肽)逆转。 另一个重要的修饰是酪氨酸硝化, 当NO和O₂•⁻的产物ONOO⁻将酪氨酸残基硝化形成3-硝基酪氨酸时发生。这种修饰通常是不可逆的,会改变蛋白质的电荷、构象和功能,可能导致酶失活或蛋白质聚集。 酪氨酸硝化是氧化应激和炎症的常见标志,与神经退行性疾病和动脉粥样硬化等疾病有关。 NO还可以通过N-亚硝基化修饰蛋白质,即与N-末端胺或赖氨酸氨基相互作用, 尽管这种修饰不如S-亚硝基化常见。 此外,NO与金属蛋白相互作用,特别是那些含有血红素 或铁硫簇 的蛋白。例如,NO与血红素蛋白结合会抑制酶活性,而与铁硫簇结合会影响电子传递链复合物,这对于血压调节 和免疫防御 至关重要。在DNA中,NO及其衍生物,包括ONOO⁻,可以引起脱氨反应,特别是腺嘌呤 和胞嘧啶, 导致杂环氧化产物。ONOO⁻还可以将鸟嘌呤氧化为8-氧代鸟嘌呤, 导致DNA突变和不稳定,可能驱动癌变。此外,NO可以与不饱和脂肪酸相互作用,导致亚硝基化和氧化,形成亚硝基化脂质如硝基脂质。 虽然这些NO诱导的修饰对于正常的细胞功能至关重要,但过量的NO产生(常见于慢性炎症或氧化应激)可能导致蛋白质、脂质和DNA损伤,导致神经退行性疾病、 心血管疾病 和癌症 等病理状况。
3.2.2. 一氧化氮的荧光成像
3.2.2.1. 基于三唑形成的NO荧光成像策略
NO在氧气存在下可与邻苯二胺及其衍生物反应形成三唑,该过程可抑制氨基产生的PET效应或增强ICT效应或导致开环。Yang及其同事报道了一种基于BODIPY荧光母核和PET机理的荧光探针 96(图50,表7),用于顺序检测NO和GSH。 BODIPY上的邻苯二胺基团作为NO识别位点,由于PET的存在,探针本身不发荧光。与NO反应形成三唑后,PET效应被抑制,荧光开启。氯原子是GSH的识别位点,与GSH反应后光谱发生红移。因此,可以从两个传输信号中顺序监测NO和GSH的相互作用。作者使用该探针监测了普伐他汀(或VC)处理的HUVEC细胞和斑马鱼中NO诱导的GSH上调。 
图 50. 基于三唑形成(探针 96–101)、芳香族仲胺(探针 102, 103)和其他机理(探针 104, 105)的部分NO荧光探针。
表7. 部分NO荧光探针
| 探针 | λex/λem (nm) | 检测限 | 响应时间 | 响应类型 | 响应机理 | 参考文献 |
|---|---|---|---|---|---|---|
| 96 | 532/565, 595 | 34 nM (NO), 29 nM (GSH) | 20 分钟 | 关-开 | PET | 10.1021/acs.analchem.0c04754 |
| 97 | 760/804 | 242 nM | 30 分钟 | 关-开 | PET | 10.1021/acs.analchem.1c00281 |
| 98 | 808/1046 | 0.05 μM | 10 分钟 | 关-开 | ICT | 10.1021/acsnano.3c05410 |
| 99 | 470/512, 592 | 31 nM | 30 秒 | 比率 | FRET | 10.1021/jacs.3c12181 |
| 100 | 540/558 (GSH), 660/685 (NO) | 230 nM (GSH), 750 nM (NO) | 1 小时 (GSH), 30 分钟 (NO) | 比率 | ICT | 10.1016/j.bios.2022.114510 |
| 101 | 555/585 | 55 nM | 35 秒 | 关-开 | ICT | 10.1021/acs.analchem.2c02768 |
| 102 | 570/655 (NO), 806/936 (H₂S) | 0.031 μM (NO), 0.02 μM (H₂S) | 5 分钟 (NO), 10 分钟 (H₂S) | 关-开 | PET | 10.1002/anie.202015650 |
| 103 | 550/610, 815 | 0.49 μM | 10 分钟 | 比率 | ICT | 10.1021/cbmi.3c00016 |
| 104 | 463/661 | 17 nM | 60 秒 | 关-开 | ICT | 10.1021/acs.analchem.1c05643 |
| 105 | 450/550 | 0.17 μM | 20 分钟 | 关-开 | ICT | 10.1021/acs.analchem.0c04019 |
缩写:无数据 (n.d.), 分子内电荷转移 (ICT), 光诱导电子转移 (PET), Förster共振能量转移 (FRET)。
Xiong及其同事报道了一种基于ICT机理的近红外荧光探针 97,用于检测NO,利用NO与邻苯二胺的特异性反应。 寡聚乙二醇吗啉功能化的噻吩作为强电子供体,而二氨基苯并[1,2,5]噻二唑部分作为相对较弱的电子受体。在与NO特异性反应后,弱电子受体的二氨基苯并[1,2,5]噻二唑基团转化为强电子受体的三唑并-苯并[1,2,5]噻二唑部分。这种转化增强了分子内电荷转移 (ICT) 效应并激活了近红外荧光。该探针可以高灵敏度和特异性地检测活细胞溶酶体中的外源性和内源性NO。该探针还能够实时检测脂多糖诱导的炎症性肠病 (IBD) 小鼠模型中的NO。结果显示,IBD小鼠的肠道和粪便中的近红外荧光强度是正常小鼠的2-3倍。
Liu及其同事开发了一种激活的近红外双波段荧光探针 98,利用分子内电荷转移 (ICT) 机理和二氨基苯并[1,2,5]噻二唑的结构框架。 该探针开启了一个高分辨率和深层组织穿透的NIR-II荧光信号,特异性响应NO,用于在严重急性呼吸综合征冠状病毒2 (SARS-CoV-2) 感染小鼠模型的肺组织中原位和无创地可视化NO的波动。体内可视化显示NO水平与SARS-CoV-2感染过程呈正相关。
Zhang及其同事报道了一种基于Förster共振能量转移 (FRET) 的比率型NO荧光探针 99。 该探针由三部分组成:一个稳定的BODIPY供体,一个对NO敏感的罗丹明受体和一个四嗪连接体。在对NO敏感的罗丹明与NO反应后,发生开环,FRET效应开启,从而发射红色荧光。四嗪连接体可以有效地猝灭两个荧光团的荧光,而不影响FRET效率。通过温和的生物正交反应,在活的RAW264.7细胞上标记FRET对,构建了一个活体传感器,从而实现了对动脉粥样硬化斑块的智能靶向并检测斑块中的内源性NO。
Yang及其同事报道了一种用于NO和GSH双重检测的荧光探针 100,基于硅罗丹明和BODIPY。 该探针本身表现出绿色荧光。与GSH相互作用后,它发射红色荧光,而在NO存在下,它显示近红外 (NIR) 荧光。这使得探针能够通过三个不同的荧光通道检测NO和GSH的浓度。该探针被用于成像射血分数保留的心力衰竭 (HFpEF) 模型。成像结果表明,心肌细胞和HFpEF小鼠中NO和GSH的浓度同时升高。
Xiao及其同事利用生物正交反应结合基于罗丹明的螺内酰胺开环机理,开发了荧光探针 101,用于NO检测,同时采用四嗪部分作为猝灭剂。 三种用不同靶向基团修饰的应变炔衍生物被用作生物正交反应的对应物。探针与靶向应变炔衍生物之间高效且特异的细胞内逆电子需求Diels-Alder (IEDDA) 点击反应促进了对特定亚细胞区域(如溶酶体、线粒体和膜)的免洗染色,同时能够清晰地监测这些区域内的局部NO水平。结果显示,该探针在斑马鱼中代谢并分布在细胞的各个位置,从而可以检测到不同炎症部位产生的内源性NO。该策略是可扩展的,可以通过改变四嗪传感器或功能性应变炔衍生物来轻松扩展,从而能够方便高效地开发具有可靠靶向能力或其他所需功能的综合传感工具包。
3.2.2.2. 基于芳香族仲胺N-亚硝基化的NO荧光成像策略
芳香族仲胺中的氮原子显示出高电荷密度,容易发生光诱导电子转移 (PET) 效应。当它与NO反应形成稳定的N-亚硝基化合物时,由于亚硝基的吸电子作用,氮原子的电荷密度降低,从而抑制PET效应。Zhao及其同事报道了一种基于BODIPY荧光核心的双检测荧光探针 102(图50),通过以N-甲基-2-甲氧基苯胺作为NO的响应位点,BODIPY上的4-硝基苯硫醇作为H₂S的响应位点。 在初始阶段,探针表现出可忽略的荧光。然而,在用NO和H₂S顺序处理后,观察到655 nm处的红色荧光和936 nm处的NIR-II荧光。探针与NO和H₂S的反应产物可以进一步与NO反应,生成一个表现出相同红色荧光的新产物。这个新产物可以随后与H₂S反应,恢复到由NO和H₂S形成的原始探针反应产物。因此,可以实时监测NO和H₂S的动态变化。该探针被用于评估结肠平滑肌活细胞和HepG2细胞中NO和H₂S的动态循环。
Tang及其同事报道了一种用于检测NO的近红外荧光探针 103。 它可以特异性靶向肿瘤相关巨噬细胞 (TAMs),并对NO表现出优于其他生物活性分子的优异选择性。选择了具有大π-共轭结构的七甲川菁衍生物作为近红外成像的荧光团,亚氨基作为NO特异性识别基团。与NO的反应导致比例荧光信号的变化,从而实现了对TAM中NO的定量检测。基于TAM中NO浓度的变化和探针的优异性能,作者成功开发了一种评估抗肿瘤药物疗效的方法,并评估了几种抗肿瘤药物(伊布替尼、二甲双胍、索拉非尼和PLX-3397)在体外和体内的抗肿瘤效果。
3.2.2.3. 基于其他机理的NO荧光成像策略
作为一种NO介导的可裂解位点,4-(4-硝基苯基)硫代氨基脲通过亚硝酰基酰化形成1,3,4-恶二唑,随后水解释放氨基。 基于该反应机理,Song及其同事报道了一种基于二氰基亚甲基-4H-吡喃 (DCM) 的NO荧光探针 104。由于4-(4-硝基苯基)硫代氨基脲部分的分子转子旋转,该探针不发荧光,当它与NO反应时,释放出一个氨基,产生红色荧光产物。研究人员将该探针应用于特发性肺纤维化 (IPF) 模型,并在细胞、组织和体内水平检测到NO水平升高。
Lee及其同事报道了一种荧光探针 105,能够通过利用萘酰亚胺检测NO和粘度。 探针的荧光发射被分子转子猝灭。随着系统粘度的增加,N-N单键的旋转受限,导致蓝色荧光的发射。此外,与NO的反应导致绿色荧光发射。探针 105 表现出优异的选择性和灵敏度,并被用于检测脂多糖或制霉菌素处理的活细胞的氧化应激和粘度。
3.3. 简要总结
RNS的荧光成像通过开发针对ONOO⁻和NO独特性质的多种高效探针构建策略取得了进展。对于ONOO⁻,探针设计基于硼酸酯的氧化水解、C=C键裂解、α-酮酰胺氧化和氧化脱芳构化,由于ONOO⁻的高氧化电位,这些策略提供了快速和特异的响应。这些机制使得能够有效地实时可视化生物系统中与氧化和硝化应激相关的事件。NO成像主要依赖于通过[2+3]环加成反应形成荧光三唑和芳香族仲胺的N-亚硝基化,其他设计则利用了其他NO响应性转化。这些探针在理解活细胞和组织中的NO信号、炎症和氧化还原调节方面做出了重要贡献。然而,在区分RNS与ROS、提高体内稳定性以及实现比率和可逆响应方面仍存在挑战。此外,正如ROS探针的开发一样,构建新的反应性部分变得越来越少见,限制了进一步的创新。未来的努力应集中于发现新的RNS特异性反应支架,增强探针的选择性和体内性能,扩展到NIR/NIR-II和多模态成像方式,并探索诊疗一体化应用和动态多重成像,以实现对RNS相关氧化还原生物学的更全面和临床相关的见解。
好的,这是剩余部分的完整翻译。
4. 活性硫 (Reactive Sulfur Species)
4.1. 半胱氨酸和同型半胱氨酸 (Cysteine and Homocysteine)
4.1.1. 半胱氨酸和同型半胱氨酸简介
半胱氨酸 (Cys) 是一种含有巯基的极性α-氨基酸,而同型半胱氨酸 (Hcy) 在结构上与Cys相似,但其侧链多一个亚甲基 (-CH₂-)。Cys和Hcy都具有很强的氧化还原特性和显著的亲核性,使它们成为细胞防御机制中的关键角色,保护细胞和组织免受内源性ROS和自由基诱导的氧化损伤。Cys和Hcy参与生物系统中的信号转导、细胞生长与凋亡、蛋白质合成和免疫调节等过程。生物体中Cys的正常水平 (30–200 μM) 对确保蛋白质的三级和四级结构至关重要。Cys也是人体代谢中硫化物的重要来源。然而,Cys水平异常与多种疾病有关,如肝损伤、帕金森病、糖尿病和癌症。 健康成年人血清中正常的Hcy浓度为9–13 μM。然而,当浓度超过15 μM时,可导致高同型半胱氨酸血症。Hcy水平异常被认为是心血管疾病、妊娠相关并发症、神经系统疾病和各种心理健康状况发展的重要风险因素。
蛋白质Cys/Hcy上的翻译后修饰及其生物学效应包括以下几点(图51)。 S-亚硝基化修饰:NO可以与蛋白质Cys/Hcy的巯基共价结合,将其转化为亚硝基硫醇 (S-NO)。这是一种可逆的、依赖于氧化还原的翻译后修饰形式,参与调节几乎所有的生物过程,并与人类疾病密切相关。 半胱氨酸氧化:Cys/Hcy的巯基是细胞内ROS的主要靶标,pKa值较低的巯基通常更容易被氧化。它们可以被选择性氧化形成次磺酸 (-SOH)、亚磺酸 (-SO₂H)、磺酸 (-SO₃H) 以及分子内/分子间的二硫键 (-SS-)。其中,次磺酸因其易于进一步氧化成二硫键、亚磺酸或磺酸,成为影响信号转导的“氧化还原开关”。S-NO也可以水解产生硫化修饰。这种修饰增强了蛋白质的氧化还原敏感性,并可能参与调节蛋白质活性。一级或更高级结构中相邻Cys/Hcy残基之间的分子内/分子间二硫键 (-SS-) 对蛋白质的稳定性和生物活性至关重要。 S-谷胱甘肽化:GSH可以通过与Cys/Hcy上的巯基形成二硫键来修饰蛋白质。这是一种可逆的蛋白质翻译后修饰形式,可在基础状态和氧化应激状态下发生。它在信号转导、蛋白质稳态和细胞氧化还原状态的调节中起着重要作用,并与心血管和神经系统疾病有关。 4-羟基壬烯酸 (HNE) 可以与蛋白质上的组氨酸、赖氨酸,特别是Cys/Hcy发生迈克尔加成反应,从而改变蛋白质功能。 S-棕榈酰化:16碳饱和脂肪酸 (SFA) 在S-酰基转移酶的作用下,通过硫酯键共价修饰到蛋白质Cys/Hcy残基上。这是一种动态且可逆的脂质修饰,通过增加蛋白质的疏水性来调节其结构、组装、成熟和功能(如离子通道和激酶)。它在细胞信号转导、新陈代谢以及疾病的发生和发展中起着关键作用。 S-异戊烯化:一种重要的脂质修饰,涉及将异戊二烯基团共价连接到蛋白质的Cys/Hcy残基上。这种修饰增加了蛋白质的疏水性,有助于其锚定在细胞膜或内膜系统上,并调节其功能,在信号转导和细胞周期控制中起着重要作用。 S-羧乙基化:在胱硫醚-β-合酶的催化下,蛋白质Cys/Hcy残基与3-羟基丙酸 (3-HPA) 结合形成硫醚键。其中,整合素96-半胱氨酸 (ITGA2B-96-Cys) 的羧乙基化修饰激活了溶酶体降解途径。
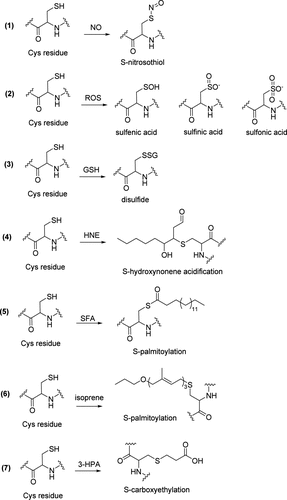
图 51. 蛋白质中Cys残基的翻译后修饰类型。
Qian及其同事设计了一种基于质谱的直接检测工作流程,该流程无需富集步骤,可在单次实验中同时定量分析全局蛋白质组和多种类型的硫醇翻译后修饰。 他们使用一种温和的亲电烷基化剂,β-(4-羟基苯基)乙基碘乙酰胺(探针 106,图52),来封闭各种类型的硫醇翻译后修饰(肽二硫键 (S–S)、-SSG、-SO₂H、-SO₃H、-SSH和-SSSH),生成相对稳定的加合物。利用这种蛋白质组学分析策略,他们研究了经受内质网应激的胰腺β细胞中各种类型硫醇翻译后修饰的分布。
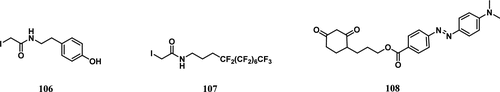
图 52. Cys修饰的部分探针。
Lu及其同事利用氟固相萃取 (FSPE) 的概念,开发了一种用于S-NO蛋白质组动态和位点特异性定量分析的分析策略。 他们建立了一种氟标记转化技术 (FST),以促进S-NO的位点特异性靶向,并通过FSPE增强S-NO肽的富集,从而提高S-NO蛋白质组学分析的特异性和灵敏度。该研究的工作流程包括以下步骤: 使用氟化标签(探针 107)对蛋白质进行衍生化; 对标记的蛋白质进行蛋白酶消化; 通过氟固相萃取 (FSPE) 分离含氟标记的肽,肽混合物被分为两部分:氟亲和部分(洗脱液)和氟排斥部分(上清液和洗涤液的组合); 对所得肽片段进行LC-MS/MS分析。该方法能够以高特异性对S-NO肽进行靶向富集和分析。
Girod及其同事报道了使用液相色谱与激光诱导解离质谱 (LID-MS) 联用,对来自阿尔茨海默病 (AD) 患者和健康对照组血浆蛋白中低浓度半胱氨酸亚磺酸 (Cys–SOH) 进行特异性检测和多重相对定量。 为了提高氧化蛋白质的检测特异性,他们用473 nm的LID取代了经典的碰撞诱导解离 (CID) 模式,增加了质量选择性的光学特异性。由于肽本身不能在可见光范围内自然吸收,这种新方法依赖于使用特定的Dabcyl环己二酮生色团(探针 108)对Cys–SOH蛋白进行适当的化学衍生化。因此,只有一部分衍生肽在LID中被特异性裂解,从而提高了生物样品中氧化蛋白定量的一致性。为了克服与样品制备相关的分析偏差和患者之间蛋白质表达水平的差异,使用Dabcyl马来酰亚胺生色团对未氧化的Cys–SH肽进行衍生化,并用作内参。
4.1.2. 半胱氨酸和同型半胱氨酸的荧光成像
4.1.2.1. 基于亲核加成的荧光成像策略
Song及其同事通过在香豆素染料中引入苯乙炔基作为传感基团,构建了荧光探针 109(图53,表8),用于选择性、快速地区分Cys和Hcy。 该探针可通过迈克尔加成与Cys和Hcy反应,发出微弱的红光。之后,亲核的巯基和氨基与Cys和Hcy加成产物中活化的烯基反应,通过反向氮杂醛醇反应生成五/六元环中间体。由Cys形成的五元环在动力学上比Hcy形成的六元环更有利,因此反应速率更快。Cys和Hcy加成产物中的醛基可分别与Cys和Hcy进一步反应,发出蓝光。因此,在380 nm激发下,Cys或Hcy的存在诱导探针产生明显的比率荧光变化:Cys从红色变为蓝色,Hcy从红色变为红/蓝混合色。对于GSH,仅形成荧光减弱的GSH加成产物。 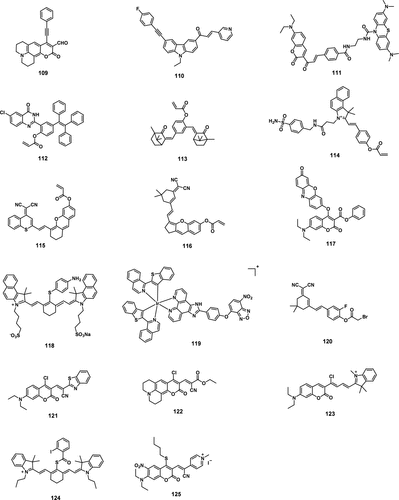
图 53. 基于亲核加成(探针 109–111)、酯/磺酰胺/硫醚的硫解(探针 112–116)、醚/硫醚键(探针 117–120)、双响应位点(探针 121–123)和其他响应机理(探针 124, 125)的部分Cys荧光探针。
表8. 部分Cys荧光探针
| 探针 | λex/λem (nm) | 检测限 | 响应时间 | 响应类型 | 响应机理 | 参考文献 |
|---|---|---|---|---|---|---|
| 109 | 380/485 (Cys), 380/608 (Hcy) | 0.17 nM (Cys), 0.19 nM (Hcy) | 3 分钟 | 比率 | PET | 10.1021/acs.analchem.1c01750 |
| 110 | 730/456 | 18 nM | 60 分钟 | 关-开 | ICT | 10.1021/acs.analchem.2c05441 |
| 111 | 660/685 (HClO), 450/495 (Cys) | 0.098 μΜ (HClO), 0.079 μM (Cys) | n.d. | 关-开 | ICT | 10.1016/j.cclet.2024.109778 |
| 112 | 410, 560 | 2.78 μM | 20 分钟 | 关-开 | PET/ESIPT | 10.1021/acs.analchem.3c02872 |
| 113 | 420/604 | 0.0728 μM | <1 分钟 | 关-开 | PET/ESIPT | 10.1021/acs.jafc.1c06294 |
| 114 | 520/590 | 0.23 μM | 7 分钟 | 关-开 | ICT | 10.1016/j.talanta.2023.125532 |
| 115 | 580/835 | 0.11 μM | 4 分钟 | 关-开 | ICT | 10.1021/acsnano.4c04211 |
| 116 | 660/851 | 10.6 nM | 3 分钟 | 关-开 | ICT | 10.1021/acs.analchem.2c01372 |
| 117 | H₂S: red; Cys: blue-red; Hcy: blue-green-red; GSH: green-red | 2.43 μM (Cys), 4.78 μM (Hcy), 2.43 μM (GSH), 1.14 μM (H₂S) | 30 分钟 | 关-开 | ICT | 10.1021/acs.analchem.8b03869 |
| 118 | 650/776 | 0.47 μM (Cys), 0.23 μM (Hcy) | 15 分钟 | 关-开 | ICT | 10.1007/s11426-019-9688-y |
| 119 | 450/680 (GSH), 450/560 (Hcy/Cys) | 1.32 μM (GSH), 0.42 μM (Hcy), 0.51 μM (Cys) | 15 分钟 | 关-开 | PET/ICT | 10.1016/j.bios.2023.115901 |
| 120 | 500/670 | 1.39 μM | 90 秒 | 关-开 | ICT | 10.1016/j.nantod.2024.102401 |
| 121 | 360/457 (Cys), 480/559 (Hcy), 400/529 (GSH) | 0.5 nM (Cys), 3.6 nM (Hcy), 6.9 nM (GSH) | 15 分钟 | 关-开 | ICT | 10.1002/anie.201800485 |
| 122 | 375/467 (Hcy), 400/503 (Cys), 500/568 (GSH) | 0.7 nM (Hcy), 0.2 nM (Cys), 1 nM (GSH) | 15 分钟 | 关-开 | ICT | 10.1002/anie.201813935 |
| 123 | 417/489 (Cys/Hcy), 514/564 (GSH) | 2.965 μM (Cys), 6.140 μM (Hcy), 6.847 μM (GSH) | 60分钟(Cys), 90分钟(Hcy), 80分钟(GSH) | 关-开 | ICT | 10.1021/acs.analchem.8b04485 |
| 124 | 550/625, 740 (Cys); 550/740 (Hcy) | 0.55 μM (Cys), 0.35 μM (Hcy) | 20分钟(Cys), 4分钟(Hcy) | 关-开 | ICT | 10.1021/acs.analchem.1c04895 |
| 125 | 561/654 | 3.7 nM | n.d. | 关-开 | ICT | 10.1021/acs.analchem.3c00799 |
缩写:无数据 (n.d.), 分子内电荷转移 (ICT), 聚集诱导发光 (AIE)。探针117的蓝色表示 λex/λem = 376/473 (nm),绿色表示 426/537 nm,红色表示 582/602 nm。
Meng及其同事开发了一种基于咔唑骨架的双光子荧光探针 110,通过氢键辅助策略特异性检测Hcy。 作为氢键受体,吡啶中的N原子与生物硫醇的氨基形成氢键,由于空间距离的限制,这抑制了Cys对探针的亲核加成活性。Hcy的加入触发了456 nm处的强烈荧光。此外,该探针成功应用于动脉粥样硬化模型小鼠中Hcy异常水平的双光子可视化。
Yin及其同事设计了双位点荧光探针 111,用于独立、连续地检测Cys和HClO。 该探针通过乙二胺连接香豆素衍生物和亚甲蓝衍生物合成,其中α,β-不饱和酮是Cys的反应位点,酰胺键是HClO的反应位点。探针与HClO反应后,亚甲蓝荧光团被释放,并发出强烈的近红外荧光,而Cys与探针的反应是由巯基对α,β-不饱和酮的亲核加成引起的,这导致荧光发射蓝移并产生绿色荧光。此外,探针与HClO的反应产物可以再次与Cys反应,探针与Cys的反应产物也可以再次与HClO反应,从而实现了对HClO和Cys的连续检测。该探针可用于观察HeLa细胞氧-葡萄糖剥夺/再灌注 (OGD/R) 模型中HClO和Cys的动态变化。
4.1.2.2. 基于酯/磺酰胺/硫醚的硫解的荧光成像策略
固态荧光是一种独特的现象。当荧光团在水中处于固态时,会发出强烈的荧光。当荧光团分散在溶剂中时,会显示微弱的荧光。Li及其同事制备了一种用于检测Cys的固态荧光探针 112。 探针本身不发荧光,因为光诱导电子从四苯基转移到丙烯酸酯基团,同时,由于羟基被丙烯酸酯单元取代,激发态下的分子内质子转移过程被阻断,因此探针的荧光被猝灭。在Cys存在下,荧光团被释放,通过恢复ESIPT过程中的分子内氢键和阻断PET过程,显示出固态荧光信号。双重猝灭机理赋予了探针 112 在生物成像中高灵敏度、良好选择性和高对比度的优点。该探针被用于检测活细胞和肿瘤小鼠中外源性和内源性Cys的水平。
Wang及其同事设计了一种比色荧光探针 113,用于高灵敏度和高特异性地监测Cys。 由于丙烯酸酯基团的强猝灭效应,探针 113 显示出极弱的荧光发射。与Cys反应后,113 的丙烯酸酯键通过加成环化反应选择性地裂解,释放荧光团,在604 nm处发出明亮的红色荧光,并用肉眼观察到从无色变为黄色。探针 113 对Cys表现出良好的传感性能,包括大的斯托克斯位移 (184 nm)、快速的响应时间 (<1 分钟)、宽的线性范围 (0–100 nM) 和低的检测限 (0.0728 μM)。该探针还可以对活细胞中的内源性和外源性Cys进行成像。
Tang及其同事开发了一种靶向高尔基体的Cys荧光探针 114,并通过原位成像实现了对类风湿性关节炎的治疗评估。 该探针采用苯磺酰胺作为高尔基体靶向基团,丙烯酸酯作为Cys响应基团。与Cys发生加成-环化反应后,在590 nm处发出黄色荧光。活细胞和小鼠成像结果表明,该探针可有效用于评估高尔基体应激的程度。该研究证明了高尔基体应激与类风湿性关节炎之间的相关性。
Yang及其同事设计了一种硫取代的二氰基亚甲基-4H-色烯 (DCM) 衍生物 115 作为基于ICT机理的近红外荧光探针。 丙烯酸酯与Cys之间的迈克尔加成生成相应的硫醚。随后,通过分子内环化和裂解产生内酰胺副产物和荧光分子。为了更好地在体内成像,作者构建了一种水溶性纳米探针,以监测缺血性中风条件下因Cys代谢破坏而导致的中风病灶中Cys浓度的变化。
Cheng及其同事以二氰基异佛尔酮-呫吨为基质,丙烯酸酯为识别基团,合成了探针 116,并实现了Cys在体外和体内的近红外荧光/光声双模态成像。 该探针引入黄酮作为电子供体,二氰基异佛尔酮作为电子受体。双键用于连接供体和受体,有效延长了共轭并增强了电子供体强度。其中,丙烯酸酯不仅作为Cys的识别位点,还阻止了ICT过程。在Cys存在下,丙烯酸酯发生环加成,释放近红外荧光团,导致光声信号和近红外荧光信号显著增加。该探针不仅可以检测过表达cys的癌细胞,还可以在肝癌异种移植小鼠模型中实时准确地检测过表达Cys的肿瘤部位。
4.1.2.3. 基于醚/硫醚键的荧光成像策略
Song及其同事通过醚键将7-二乙基香豆素和间苯二酚结合,开发了一种荧光探针 117,可以同时区分Cys、Hcy、GSH和H₂S。H₂S与探针反应断裂醚键,释放红色的试卤灵并形成无荧光的硫代香豆素。 GSH、Cys和Hcy与探针的反应可以产生试卤灵和相应的硫代香豆素。Cys和Hcy产生的硫代香豆素的氨基可以取代硫原子形成氨基香豆素。由于十元环过渡态的动能高,GSH产生的硫代香豆素是稳定的。由于五元环的动能较小,Cys产生的硫代香豆素可能完全转化为氨基香豆素,而Hcy产生的硫代香豆素可能部分转化为氨基香豆素。因此,该探针与GSH、Cys和Hcy反应分别产生红-绿、红-蓝和红-绿-蓝的荧光信号变化。该探针通过多色荧光成像实现了对活HeLa细胞中各种生物硫醇的同时检测。
Guo及其同事报道了一种被对氨基苯硫醚取代的IR-820近红外探针 118,在被Cys或Hcy激活后可以实现近红外荧光和光声双模态成像。 芳基硫醚取代的花青探针可以发生亲核取代和Smiles重排反应,并对Hcy/Cys产生特异的近红外荧光和比率型光声响应。该探针可应用于通过近红外荧光和光声双模态成像检测活细胞和小鼠中的Hcy/Cys。
Fu及其同事设计了一种以铱(III)配合物为主骨架,连接苯并噁二唑基团的发光探针 119。 由于PET效应的存在,探针本身的发光很弱,但与生物硫醇反应后,苯并噁二唑基团脱离,PET过程被抑制,从而恢复发光。探针与GSH反应得到的产物仅在680 nm处显示增强的发光。然而,由Hcy或Cys得到的产物发生分子内重排,与苯环的连接位点从硫醇变为氨基。分子发光增强,发射波长在560 nm左右。通过双通道发光实现了GSH和Hcy/Cys的同时检测。
Yin及其同事设计并合成了以异佛尔酮为母体化合物,溴乙酰酯为Cys响应位点的探针 120。 他们在溴乙酰酯的邻位引入氟,通过其强吸电子能力激活了亚甲基和羰基的亲电性。氟延长了探针的荧光发射波长并提高了其亲脂性。探针的原位成像显示,由核因子红细胞2相关因子2 (Nrf2) 激活的抗氧化机制可以上调帕金森病细胞和大脑中的Cys水平,并可视化了帕金森病小鼠脑区中Cys的差异分布。
4.1.2.4. 基于双响应位点的Cys荧光成像策略
Li及其同事报道了一种具有多个结合位点的探针 121,可以利用生物硫醇(Cys < Hcy < GSH)硫醇和氨基之间间距的差异同时区分和检测硫醇和氨基。 其中,GSH的硫醇基团可以与碳氯键发生亲核取代反应,氨基可以与苯并噻吩的双键发生加成反应,从而实现探针在529 nm处基于ICT效应的荧光增强。该探针可以通过三个不同的发射通道检测Cys、Hcy和GSH,具有高选择性和灵敏度。对不同活细胞的荧光成像研究显示,该探针可以通过多色成像同时监测内源性Cys和GSH以及外源性Cys、Hcy和GSH。
Yao及其同事报道了一种带有2-氰基丙烯酸乙酯基团的生物硫醇探针 122。 当探针与生物硫醇相互作用时,香豆素的4位氯可被生物硫醇取代,得到硫代香豆素衍生物。探针与Hcy反应产生的硫代香豆素衍生物发生硫和氨基取代,然后形成的硫醇基与活性双键发生加成反应,形成环状产物;探针与Cys反应形成的硫代香豆素衍生物的氨基可与活性双键反应生成C=N,然后继续与Cys加成。探针与GSH反应生成的硫代香豆素的氨基可攻击活性双键并发生C=C裂解,随后氨基和醛基反应形成铵盐。因此,探针与Cys、Hcy和GSH的反应可以产生具有不同信号输出的不同产物。这可以促进使用不同荧光通道同时识别Cys、Hcy和GSH。该探针成功应用于同时识别和可视化活细胞中内源性Hcy、Cys和GSH及其转化。
Yin及其同事设计了一种7-(二乙胺基)香豆素衍生物的荧光探针 123,用于识别生物硫醇。 该探针具有三个潜在的反应位点:活性氯原子(位点1)、β-不饱和键(位点2)和吲哚部分的不饱和键(位点3)。探针与生物硫醇之间不同的键合机制(Cys/Hcy的取代-重排-环化和GSH的取代-环化)导致相应的加合物,从而可以选择性地检测Cys/Hcy和GSH。此外,该探针可以同时监测HepG-2细胞和小鼠中的Cys/Hcy和GSH。
4.1.2.5. 基于其他响应机理的Cys荧光成像策略
Wang及其同事开发了一种基于花青和硫酯的荧光探针 124。 花青骨架(作为荧光团)与邻碘苯甲酸酯(作为猝灭基团和离去基团)通过硫酯连接体结合,该连接体用作Cys和Hcy的反应位点。Cys上的硫醇基对硫酯键的亲核能力远强于Hcy和GSH。因此,在Cys存在下发生两种反应。首先,半胱氨酸的硫醇基通过硫醇交换反应与硫酯反应,产生花青类似物的烯醇形式,后者发生质子化恢复显著的红色荧光。其次,Cys的硫醇基通过硫醇化反应与硫醚反应,生成无荧光的副产物和S-取代的中间态。通过五元环的分子内重排,生成具有近红外发射的最终氨基产物。然而,由于Hcy和GSH对硫酯键的亲核能力较弱,在Hcy和GSH存在下不发生硫交换反应。因此,GSH和Hcy不触发红色发射。在Hcy存在下,Hcy的硫醇基通过亲核取代反应与硫醚反应,生成具有近红外发射的氨基产物。对于GSH,由于其化学结构较大,难以在分子内重排形成10元环中间态。因此,在550 nm激发下,产生无荧光的化合物。该探针用于通过一次激发下的双发射通道可视化细胞中的外源性Cys和Hcy。此外,它可以有效靶向线粒体,并用于通过红色发射通道独立监测线粒体中内源性Cys的波动。
Yin及其同事开发了一种双识别位点探针 125,通过在香豆素荧光团的6位引入硝基,用于Hcy的特异性检测。 合成的具有6-硝基取代的探针表现出增强的长波吸收、比色响应以及用于检测Hcy的选择性红/近红外荧光信号。利用该探针,成功地在糖尿病和阿尔茨海默病 (AD) 的斑马鱼和小鼠模型中对Hcy水平进行了原位动态监测。
4.2. 谷胱甘肽 (Glutathione)
4.2.1. 谷胱甘肽简介
谷胱甘肽 (GSH) 是细胞内最丰富的硫醇,由谷氨酸、半胱氨酸和甘氨酸通过肽键偶联合成。它具有硫醇、氨基和γ-酰胺官能团,通常在细胞质中合成,然后转运到细胞区室。其对细胞内生理和病理事件的调节作用包括以下几点。 抗氧化防御:GSH是保护细胞免受自由基和氧化应激损伤的最重要的抗氧化剂之一。 解毒:GSH通过与生物体中的有毒物质(如重金属、药物代谢物等)结合形成无毒或低毒化合物,然后从体内排出,参与细胞的解毒过程。 细胞信号传导:GSH参与细胞信号传导过程,影响细胞生长、分化和凋亡。 免疫系统调节:GSH对免疫系统具有调节作用,因为它可以影响免疫细胞的增殖和功能,并维持免疫系统的稳态。 炎症调节:GSH可以抑制炎症反应并减少炎症因子的释放。 线粒体功能和能量产生:GSH参与维持线粒体功能和能量产生。GSH水平异常也是许多疾病的信号,包括癌症、糖尿病、动脉粥样硬化、肝硬化和阿尔茨海默病。(318-320)
蛋白质由GSH进行的翻译后修饰主要是通过S-谷胱甘肽化过程实现的,该过程涉及GSH与目标蛋白质的半胱氨酸残基之间形成二硫键(图54)。S-谷胱甘肽化修饰的反应机理主要如下。 含巯基的蛋白质与氧化型谷胱甘肽 (GSSG) 之间的硫醇-二硫键交换(图54a)。 细胞内ROS和/或RNS诱导产生蛋白质次磺酸 (P–SOH) 或谷胱甘肽次磺酸 (GSOH) 中间体,导致S-谷胱甘肽化修饰(图54b, c)。 由亚磺酰胺中间体介导的S-谷胱甘肽化修饰(图54d)。 ROS和/或RNS诱导产生硫自由基,然后通过自由基重组或与硫醇盐反应进行修饰(图54e, f)。 硫代亚磺酸酯与硫醇反应形成二硫键和水,导致修饰(图54g, h)。 与亚磺酸酯类似,ROS和/或RNS可以诱导产生亚硝基谷胱甘肽 (GSNO) 或亚硝基蛋白 (P–SNO) 中间体,导致修饰(图54i, j)。 当细胞受到氧化应激刺激时,谷胱甘肽还原酶 (Grx) 可以催化蛋白质谷胱甘肽化(图54k)。但当细胞内的氧化信号减弱时,Grx也可以催化蛋白质的去糖基化(图54k)。(321-323) 蛋白质S-谷胱甘肽化的生物学效应主要包括以下几点。 S-谷胱甘肽化修饰在调节某些酶的活性以及将氧化还原信号与蛋白质状态联系起来方面起着关键作用。 氧化应激诱导的蛋白质S-谷胱甘肽化是一种可逆的保护机制,有助于维持细胞氧化还原稳态。 S-谷胱甘肽化修饰也参与平衡的细胞信号传导。
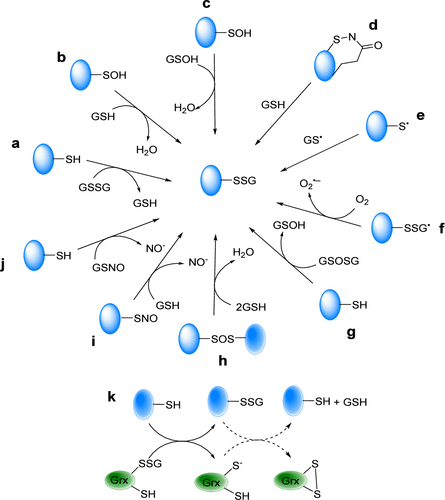
图 54. 蛋白质S-谷胱甘肽化修饰的机理。
4.2.2. 谷胱甘肽的荧光成像
4.2.2.1. 基于磺酰基的GSH荧光成像策略
铁死亡是一种新兴的非凋亡性细胞死亡形式,其特征是铁(II)依赖性脂质过氧化物的显著积累。在铁死亡过程中,GSH被持续消耗直至耗尽,细胞GSH水平可以为实时监测铁死亡提供一个指标。内质网 (ER) 作为真核细胞中最大的膜结构,在铁死亡过程中易受氧化损伤。Dong及其同事设计并合成了一种GSH响应性荧光探针 126(图55,表9)。 选择了环己基磺酰脲作为ER靶向基团,氧化吡啶磺酰基作为GSH响应位点。在与GSH发生硫醇亲核取代反应后,触发了高效的ICT,导致523 nm处的荧光强度显著增加3900倍。探针 126 可以检测erastin诱导的铁死亡过程中ER中的GSH水平。作者使用该探针发现,芦丁可以阻止erastin诱导的铁死亡过程中GSH的消耗,并可能作为一种新型的铁死亡抑制剂。
图 55. 基于磺酰基(探针 126, 127)、醚键(探针 128–130)、硫醚键(探针 131, 132)、亲核加成(探针 134–143)、硒酰基(探针 144)、二硫键(145, 146)、磺酸酯(探针 147)和双反应位点(148–150)的部分GSH荧光探针。
表9. 部分GSH荧光探针
| 探针 | λex/λem (nm) | 检测限 | 响应时间 | 响应类型 | 响应机理 | 参考文献 |
|---|---|---|---|---|---|---|
| 126 | 405/523 | 0.12 μM | 30 分钟 | 关-开 | ICT | 10.1021/acs.analchem.2c04209 |
| 127 | 410/496 (GSH), 410/638 (GSH), 410/638 (SO₂) | 17.43 μM (GSH), 412.45 nM (SO₂) | 1小时 (GSH), 2分钟 (SO₂) | 关-开 (GSH) 开-关 (SO₂) | ICT/FRET | 10.1021/acs.analchem.2c04333 |
| 128 | 505/528 (NO), 538/558 (GSH) | 31 nM (NO), 56 nM (GSH) | 30 分钟 | 关-开 | PET | 10.1021/acs.analchem.9b00169 |
| 129 | 808/1550 | 0.3 mM | 30 秒 | 比率 | NRET | 10.1002/adfm.202009942 |
| 130 | 450/545 (Cys/Hcy), 580/620 (GSH) | n.d. | 6 分钟 | 比率 | n.d. | 10.1039/C7SC05407F |
| 131 | 808/923 | 90 nM | 60 分钟 | 关-开 | PET | 10.1016/j.snb.2025.137371 |
| 132 | 808/928 | 85 nM | 60 分钟 | 关-开 | PET | 10.1021/acs.analchem.1c04504 |
| 133 | 396/495 (Cys/Hcy), 505/565 (GSH) | 106 nM (Cys), 82 nM (Hcy), 57 nM (GSH) | 25分钟 (Cys/Hcy), 20分钟 (GSH) | 关-开 | PET | 10.1021/acs.analchem.0c04100 |
| 134 | 488/544 | n.d. | 数分钟 | 比率 | ICT | 10.1039/D0SC02889D |
| 135 | 405/494 (SO₂), 488/638 (GSH) | 0.16 μM (SO₂), 75 μM (GSH) | 40秒 (SO₂), 240秒 (GSH) | 比率 | ICT/FRET | 10.1021/jacs.0c00992 |
| 136 | 570/593 | n.d. | 30 分钟 | 关-开 | ICT | 10.1021/jacs.0c06916 |
| 137 | 395/497, 455/562, 594/681 | n.d. | <60 秒 | 关-开 | ICT | 10.1021/jacs.0c10840 |
| 138 | 550/570 | n.d. | 0.46 ms | 关-开 | ICT | 10.1021/jacs.0c00451 |
| 139 | 640/736 | n.d. | 0.57 秒 | 比率 | FRET | 10.1002/anie.202217326 |
| 140 | 561/630 | n.d. | n.d. | 关-开 | ICT | 10.1038/s41557-023-01249-3 |
| 141 | 405/485, 514/570 | n.d. | 12 分钟 | 比率 | ICT | 10.1021/acs.analchem.3c05603 |
| 142 | 320/510 | 0.49 μM | 18 分钟 | 关-开/比率 | PET/ICT | 10.1021/acs.analchem.1c03836 |
| 143 | 480/516 | n.d. | 4.7 秒 | 关-开/比率 | PET/ICT | 10.1021/acs.analchem.3c05430 |
| 144 | 445/514 | 27 nM (ClO⁻), 36 nM (GSH) | 20秒 (ClO⁻), 6分钟 (GSH) | 比率 | ICT | 10.1021/acs.analchem.3c00825 |
| 145 | 420/547, 420/677 | n.d. | n.d. | 比率 | ICT | 10.1002/anie.202009141 |
| 146 | 808/1047 | n.d. | n.d. | 比率 | PET | 10.1002/advs.202304104 |
| 147 | 680/710, 680/620 | n.d. | n.d. | 比率 | PET | 10.1021/jacs.3c01666 |
| 148 | 490/556 (GSH), 588/716 (Cys), 670/529 (SO₂) | 1.37 μM (GSH), 2.29 μM (Cys), 40 nM (SO₂) | 60分钟 (GSH), 60分钟 (Cys) | 比率 | ICT | 10.1021/acs.analchem.0c02255 |
| 149 | 415/519 | n.d. | 7 秒 | 比率 | ESIPT/ICT | 10.1021/acs.analchem.1c03376 |
| 150 | 488/542 (Hcy), 360/453 (Cys), 415/513 (GSH) | 0.5 nM (Hcy), 2–30 μM (Cys), 8.0 nM (GSH) | 60分钟 (Hcy), 30分钟 (Cys), 30分钟 (GSH) | 比率 | TICT/ICT | 10.1021/acs.analchem.1c01945 |
缩写:无数据 (n.d.), 分子内电荷转移 (ICT), 光诱导电子转移 (PET), 激发态分子内质子转移 (ESIPT), Förster共振能量转移 (FRET), 扭曲分子内电荷转移 (TICT), 非辐射能量转移 (NRET)。
GSH和硫代硫酸盐 (S₂O₃²⁻) 可以通过线粒体中的硫代硫酸盐硫转移酶 (TST) 内源性地产生二氧化硫 (SO₂)。为了成像从GSH到SO₂的代谢过程以及SO₂对GSH水平的影响,Liu及其同事提出了一种具有线粒体靶向性的双光子荧光探针 127。 该探针通过双荧光团和双位点策略展示了ICT介导的FRET。探针通过亲核取代反应与GSH反应后,ICT效应触发了从萘酰亚胺到苯并吡喃鎓的FRET效应,产生红色荧光。与SO₂反应后,探针的FRET效应消失,产生萘酰亚胺的绿色荧光。在双光子激发下,在两个独立的发射通道中实现了对GSH-SO₂代谢过程的实时追踪,且没有光谱交叉干扰。作者观察到,高剂量二氧化硫处理后,细胞内GSH水平显著降低,表明当暴露于过量二氧化硫时,生物体的氧化还原稳态被破坏。
4.2.2.2. 基于醚键的GSH荧光成像策略
GSH可以与NO反应形成亚硝基谷胱甘肽 (GSNO),这可以防止细胞受到亚硝化应激的不利影响。Yang及其同事报道了一种用于同时检测和区分NO和GSH的荧光探针 128。 该探针使用BODIPY片段作为荧光报告基团,4-氨基-3-(甲基氨基)-苯酚单元作为荧光调节剂。由于从4-氨基-3-(甲基氨基)-苯酚单元到BODIPY的PET过程,探针本身显示出荧光猝灭。而与GSH的取代反应导致PET过程被抑制,从而激活红色发射。当与NO反应时,探针发出绿色荧光。该探针可以监测RAW 264.7细胞中的外源性和内源性NO和GSH,并可以可视化IFN-γ/LPS/l-Arg诱导的RAW 264.7细胞炎症过程中NO和GSH的增加。
Song及其同事开发了一种基于化合物 129 的近红外-II比率型荧光纳米探针,用于体内GSH的定量检测和可视化。 镧系下转换纳米探针 (DCNPs) 通过吸收高能光子发射波长更长的近红外-II光子。他们在DCNPs表面包覆了4-硝基苯酚-Cy7 (NPh) 和PEG,制备了纳米探针 (DCNP@NPh-PEG)。由于PET过程的存在,包裹在DCNPs表面的NPh分子不显示荧光。在GSH存在下,NPh分子与GSH发生取代反应生成Cy7-SG,导致分子内PET过程消失,荧光恢复。在808 nm激光照射下,Cy7-SG通过非辐射能量转移 (NRET) 过程将激发能转移到DCNPs,从而实现DCNPs的敏化,并最终在1550 nm处发射增强的近红外-II荧光信号。DCNP@NPh-PEG对GSH表现出比率响应,并被用于成像小鼠MCF-7细胞、皮下肿瘤和原位结肠肿瘤中的GSH。
Guo及其同事报道了一种基于帕罗尼的探针 130,用于区分Cys和GSH。 它可以通过有机阴离子转运肽OATP的主动转运快速进入癌细胞而非正常细胞,OATP在多种癌细胞中过表达。探针然后与GSH发生亲核取代,阻断PET过程并产生红色荧光发射,而与Cys反应则产生绿色发射。这使得能够在各种癌细胞中对Cys和GSH进行双通道荧光成像,并成功实现了癌组织和正常组织冰冻切片的荧光成像。
4.2.2.3. 基于硫醚键的GSH荧光成像策略
Yoon及其同事开发了一种近红外-II荧光探针 131,由一个阴离子聚甲川菁骨架与一个3,4-二甲氧基苯硫醇猝灭部分连接组成。 猝灭部分通过PET效应抑制聚甲川菁的荧光。GSH的强亲核性触发了二甲氧基苯硫醇基团的取代,导致荧光激活。该探针的检测限为90 nM,荧光强度增强约18倍,能够清晰地区分肿瘤(具有高GSH水平)和正常组织。Lin及其同事报道了一种GSH可激活的近红外-II荧光探针 132,它通过硫醚键连接了七甲川菁和三氟甲基苯基。 在GSH存在下,三氟甲基苯基可被GSH取代,从而恢复ICT效应,激活强烈的近红外-II荧光发射。该探针成功用于实时成像荷瘤活体小鼠中的GSH。Wu及其同事报道了一种探针 133,可以通过不同的荧光信号同时识别Cys/Hcy和GSH。 该探针使用香豆素作为荧光基团。由于结构中存在供体光诱导电子转移 (d-PET) 效应,荧光发生猝灭。该探针的两个特异性识别位点可以与Cys/Hcy和GSH反应,中断d-PET过程并产生不同的荧光物质。该探针可以使用双通道荧光信号在细胞和斑马鱼中区分和检测Cys/Hcy和GSH。
4.2.2.4. 基于亲核加成反应的GSH荧光成像策略
GSH在解毒过程中起着不可或缺的作用。在谷胱甘肽-S-转移酶的帮助下,GSH嵌入毒素中,从而协助清除细胞中的有害物质。Shen及其同事提出了一种可逆的比率型(从红到绿)荧光探针 134,用于活细胞中GSH水平的实时定量成像。 该探针可以与GSH发生亲核加成反应,导致荧光发射蓝移。其硫醇加成产物也可以在H₂O₂或N-乙基马来酰亚胺 (NEM) 存在下发生逆反应。其正向和逆向反应都很快,能够实时监测细胞内GSH水平的动态变化。它可以连续10小时定量成像顺铂处理后细胞内GSH水平的变化。作者使用该探针发现,耐药A549-DDP细胞中GSH的浓度呈拱形趋势,表明细胞经历了与GSH相关的解毒过程。
GSH和Na₂S₂O₃可以通过硫代硫酸盐硫转移酶在线粒体中内源性地产生SO₂。Yin及其同事提出了一种探针 135,可以通过ICT和FRET的集成机理同时快速感知GSH和SO₂。 该探针引入α,β-不饱和氰基香豆素作为能量供体,并可以通过GSH对活性烯烃的亲核加成,基于ICT效应可逆地响应GSH。苯并吡喃鎓部分作为能量受体,其吸收光谱与香豆素的发射光谱良好重叠。它还可以作为SO₂的反应位点,阻断FRET过程并恢复香豆素片段响应SO₂的荧光发射。在此基础上,该探针可以可视化不同细胞系和荷瘤裸鼠中GSH转化为SO₂的酶促过程,这可能有助于阐明SO₂产生的代谢途径。
Guo及其同事提出了一类新的阳离子荧光染料,包括化合物 136,即碳二吡咯 (Cardipys),其吸收和发射波长覆盖可见光和近红外区域。 通过对BODIPY骨架应用B→C原子取代策略,这些Cardipys不仅保留了传统BODIPYs的优异光物理性质,如明亮的荧光和窄的发射带宽,而且由于其阳离子性质,还表现出更好的水溶性和光稳定性。此外,它们的阳离子性质使其极易穿透细胞膜并在线粒体中积累。通过使用活性苯乙烯基作为GSH的响应基团,Cardipys与GSH发生亲核加成,导致荧光降低。在溶酶体中也可以发生逆反应,从而可以可视化由谷胱甘肽S-转移酶 (GST) 催化的谷胱甘肽偶联物的细胞转运。
Yin及其同事通过将二乙胺基香豆素与α,β-不饱和吡喃二酮共轭,并在吡喃二酮中引入强吸电子的氟化硼结构,开发了一种具有近红外发射的分子 137。 该探针在乙腈和水的混合相中表现出聚集行为,荧光发射从蓝色转变为黄色。探针与GSH部分反应,因此反应混合物同时表现出探针本身的红色发射、聚集产生的黄色发射以及与GSH反应产物的绿色发射。然而,它与Cys完全反应,仅发射绿色。实验结果表明,该探针可以有序地监测细胞中Cys和GSH的水平。
为了扩展用于单分子定位显微镜 (SMLM) 成像的自发闪烁荧光团的分子设计策略,Urano及其同事开发了一种用于SMLM成像的探针 138,它可以在活细胞中响应GSH而自发闪烁。 由于细胞内GSH对蒽环第九个碳原子的可逆基态亲核攻击,一些蒽荧光团可以在荧光和非荧光形式之间切换。为了在SMLM中利用这种分子间反应,需要确保只有一小部分荧光基团被开启,然后以适当的动力学随机恢复到非荧光状态。因此,他们设计并合成了探针 138,优化了其平衡常数、GSH响应性和发光动力学。作者证实,探针 138 的Halo-Tag配体可以特异性地标记目标蛋白,并在活细胞中由于细胞内GSH的可逆亲核攻击而表现出自发闪烁,从而获得SMLM图像。
Cui及其同事报道了一种基于罗丹明的FRET探针 139,它将三氟甲基磷酸酯取代的罗丹明 (PR) 与硅取代的罗丹明 (SiR) 连接起来。 由于SiR对PR的FRET效应,该探针显示出PR的荧光。与GSH发生加成反应后,FRET效应消失,从而显示出SiR的荧光。在NEM或H₂O₂存在下,它可以恢复到之前的状态。作为一种具有适当GSH解离常数的比率型近红外探针,该探针可以在宽动态范围和快速反应速率下与GSH发生可逆反应,并可用于定量荧光监测活细胞和组织各种病理过程中GSH的水平。
具有细胞器靶向能力的GSH荧光探针在靶向细胞器之前可能会与细胞质中的GSH反应,这使得难以评估探针是否感知到其目标细胞器中GSH的真实浓度。Rivera-Fuentes及其同事报道了一种GSH探针 140,它只能在靶向的亚细胞区室中被激活。 该探针基于SiR染料的螺环形式构建,对GSH不反应且荧光处于“关闭”状态。与自标记的Halo-Tag蛋白结合后,它可以异构化为两性离子形式,从而开启荧光并作为亲电试剂与GSH发生加成反应。生成的加成产物是荧光“关闭”的,从而能够在活细胞内的特定亚细胞区室中对比率定量测定GSH浓度。作者连续监测了超过24小时的细胞分裂周期中细胞核和总GSH的水平,并发现细胞核GSH的波动与细胞增殖相关。
Meng及其同事报道了一种线粒体靶向的GSH探针 141,它通过亲核加成反应对GSH表现出可逆的响应性。 它可以独立于线粒体膜电位在线粒体内定位。使用该探针,他们成功地量化了心肌纤维化细胞模型、小鼠心肌组织和心脏器官中GSH的减少。Zhu及其同事设计并合成了一种比率型荧光GSH探针 142,它还可以诱导肿瘤细胞凋亡。 该探针采用4-三氟甲基-7-氨基喹啉作为高尔基体靶向基团,2-羰氧基甲基环己酮 (COMC-6) 作为GSH的识别基团。探针本身显示蓝色荧光。COMC-6的活性双键可以与GSH发生迈克尔加成反应,然后探针自发去除CO₂,生成具有绿色荧光发射的喹啉荧光团和与谷胱甘肽连接的亚甲基环己酮。该探针成功应用于高尔基体中GSH浓度变化的比率荧光成像。该探针对癌细胞表现出更强的细胞毒性,这可能归因于癌细胞中GSH的浓度高于正常细胞。
Yang及其同事报道了一种基于BODIPY的双模态探针 143,用于共聚焦成像和荧光寿命成像。 该探针分别通过荧光波长和寿命对GSH和粘度表现出可逆的响应性。它还含有用于线粒体靶向的哌嗪阳离子。探针中的α,β-不饱和酰胺与GSH发生可逆的迈克尔加成反应,这阻断了π-共轭,导致吸收和发射蓝移。另一方面,苯环和氰胺都是分子转子。随着微环境粘度的增加,扭曲的分子内电荷转移 (TICT) 被抑制,导致荧光寿命增加。通过结合共聚焦激光扫描显微镜和荧光寿命成像显微镜双模态成像技术,该探针可以可逆地同时检测铁死亡过程中线粒体GSH水平和粘度。
4.2.2.5. 基于硒酰基的GSH荧光成像策略
Song及其同事报道了一种基于吩噻嗪-香豆素的可逆、比率型双检测探针 144,用于监测高尔基体中ClO⁻/GSH的氧化还原稳态。 硒醚部分显示出强大的给电子能力,ICT效应导致探针呈现红色荧光。在ClO⁻存在下,Se原子被氧化成氧化硒 (Se=O),由于吩噻嗪氧化物的弱电子供体性而呈现绿色荧光。在GSH存在下,Se=O被还原成Se以恢复红色荧光。重叠的吸收光谱使得可以在单一激发波长下进行检测。经过4个ClO⁻/GSH的可逆检测循环后,该探针仍保持其优异的性能。它成功用于监测高尔基体中ClO⁻/GSH介导的氧化还原稳态的动力学。观察到小鼠急性肺损伤的进展,表明该探针是监测ClO⁻/GSH氧化还原对的有效工具,并适用于长期研究ClO⁻/GSH氧化还原动态。
4.2.2.6. 基于二硫键的GSH荧光成像策略
Ye及其同事报道了一种基于分子 145 的含钆 (Gd) 纳米探针 (NP-RGD),用于由近红外荧光/磁共振 (MR) 双模态成像引导的肿瘤光动力学治疗 (PDT)。 NP-RGD由两亲性小分子探针 (1-RGD) 自组装而成,其中RGD肽用于靶向肿瘤,Gd用于肿瘤的MR成像。在肿瘤细胞中,大量内源性GSH对二硫键的还原触发了NP-RGD分解为荧光小分子产物 (2-RGD) 和疏水性有机光敏剂 (PPa-SH)。随后,PPa-SH与细胞内白蛋白的结合可以激活其近红外荧光并延长其在肿瘤细胞中的保留时间。该纳米探针成功实现了近红外荧光和MRI的协同双模态成像,以及在体内的有效肿瘤PDT。
Yang及其同事报道了一种基于分子 146 的三硫介导的分子光疗平台,用于由GSH激活的NIR-II成像引导的增强光热疗法。 RGD肽用于靶向肿瘤,二茂铁用于通过光诱导电子转移 (PET) 机理猝灭荧光,三硫化物用于在与GSH反应时释放二茂铁以恢复荧光,并伴随H₂S的释放。释放的近红外荧光基团可用于低温光热疗法 (HPTT),释放的二茂铁可在激光照射下将内源性H₂O₂转化为ROS,可用于化学动力学疗法 (CDT),释放的H₂S可用于气体疗法 (GT)。因此,该平台是一个具有肿瘤特异性NIR-II荧光成像和CDT/HPTT/GT联合增强治疗的多功能光疗平台。
4.2.2.7. 基于磺酸酯的GSH荧光成像策略
Zhang及其同事报道了一种光敏剂 147,它响应GSH以启动荧光信号并激活其光敏特性。 这种通过RGD肽靶向肿瘤的光敏剂,具有一个2-氰基-4-硝基苯-1-磺酰基部分,该部分被GSH裂解,从而激活荧光。近红外光照射导致双键的氧化裂解,导致探针的荧光发生红移,并产生ROS以杀死肿瘤细胞。这种多功能光敏剂的抗肿瘤效果在GSH水平升高的A549荷瘤小鼠中得到验证,证实了其在肺癌治疗和实时成像中的体内应用。
4.2.2.8. 基于双反应位点磺酸酯的GSH荧光成像策略
Yang及其同事报道了一种探针 148,可以同时检测和区分GSH、Cys和SO₂衍生物。 该探针采用醚键将半花青和BODIPY荧光团共轭。与GSH反应后,探针的醚键通过亲核芳香取代发生裂解。此外,氯原子可被GSH取代,形成一个具有黄色荧光的含氯BODIPY,一个表现出近红外荧光的二硫BODIPY,以及一个显示紫色荧光的半花青衍生物。该探针在与Cys和Hcy反应时也可以产生不同的荧光信号。作者将该探针封装在聚合物基质中,形成纳米探针,用于成像活细胞中的GSH、Cys和亚硫酸盐。
Yin及其同事报道了一种结合ESIPT和ICT荧光机理的GSH响应探针 149。 探针本身由于氢质子和氮原子之间的氢键引起的激发态分子内质子转移 (ESIPT) 而产生红色荧光。当GSH与探针发生亲核取代时,GSH的羧基氢与氮原子形成分子内氢键。这种相互作用消除了ESIPT效应并激活了ICT效应,从而增强了荧光强度。该探针可以对GSH表现出比率响应,并成功检测到细胞凋亡过程中GSH的实时浓度波动。
Yao及其同事报道了一种探针 150,可以使用不同的荧光通道区分和检测GSH、Cys和Hcy。 该探针的香豆素荧光团中的N,N-丙酸二甲酯取代基可以通过电子诱导效应和氢键相互作用抑制扭曲分子内电荷转移 (TICT) 的形成,并减少外部转换(EC,溶剂-溶质与激发分子之间的相互作用),从而提高探针的亮度和稳定性,并显著增强其穿透血脑屏障的亲脂性。香豆素的正丁基硫基的活性分子运动可以增加非辐射衰变,从而降低探针的背景荧光,并防止其与蛋白质中的氨基和羟基反应。GSH的硫醇基可以与探针的正丁基硫基发生取代反应,氨基可以与噻唑上的双键发生加成反应,从而激活绿色荧光。在三种不同的激发和发射通道下,实现了对Hcy、Cys和GSH动态的荧光成像和同时区分。作者利用该探针监测了活细胞、组织以及阿尔茨海默病 (AD) 和帕金森病 (PD) 小鼠模型中的同型半胱氨酸 (Hcy) 和半胱氨酸 (Cys) 水平。他们发现,升高的Hcy和Cys水平与氧化还原稳态失衡和淀粉样蛋白聚集增加显著相关。
4.3. 硫化氢和多硫化氢 (Hydrogen Sulfide and Hydrogen Polysulfide)
4.3.1. 硫化氢和多硫化氢简介
硫化氢 (H₂S) 是人体内发现的第三种内源性气体信号分子。它主要由L-半胱氨酸通过酶促水解反应合成,涉及的酶包括胱硫醚-β-合酶 (CBS)、胱硫醚-γ-裂解酶 (CSE)、3-巯基乙酸硫转移酶 (3-MST) 和半胱氨酸转氨酶 (CAT)。H₂S的生理浓度范围为1 nM至1 mM。H₂S参与广泛的生理调节活动,包括调节血管舒张、神经传导、心肌收缩、细胞凋亡、炎症反应、缺血-再灌注损伤和胰岛素分泌。由于其还原性,H₂S也是生物体中ROS和RNS的清除剂。细胞维持正常H₂S浓度能力的中断可能导致一系列疾病,包括阿尔茨海默病、唐氏综合征、胃黏膜损伤、高血压和肝硬化。 多硫化氢 (H₂Sn, n ≥ 2) 被认为是一种新的潜在信号分子,它主要由H₂S通过酶或ROS的作用生成,并发挥与H₂S相似的生理功能。由于H₂Sn中硫原子的氧化态为0,它比氧化态为-2的H₂S具有更强的还原性和亲核性,使其在调节某些生理功能方面效果更显著。与经典的信号分子H₂S相比,H₂Sn显示出更高的蛋白质硫醇化效率,这使其在调节蛋白质活性方面具有更大的优势。在生物系统中,H₂Sn和H₂S作为氧化还原对,共同调节生物体内的氧化还原水平。H₂Sn作为一种氧化产物,也可以降低细胞内ROS水平并保护细胞免受氧化应激。
H₂S可以介导蛋白质S-硫化修饰,产生参与调节生理功能的硫醇硫化物 (-SSH)(图56)。其修饰靶标包括具有巯基 (-SH)、亚硫酸基 (-SOH)、亚硝基 (-SNO) 和二硫键 (-SS-) 的蛋白质。H₂S不能直接修饰蛋白质的-SH,这需要在O₂•⁻存在下进行。S-硫化修饰可以调整蛋白质的结构、活性、稳定性及相互作用,从而调节细胞内信号通路和相关生物过程。H₂S可以通过硫化修饰钾通道,并作为内皮源性超极化因子参与血管舒张;H₂S通过S-硫化修饰某些代谢酶,影响代谢过程;H₂S可以修饰特定的信号分子,影响其活性和信号转导;H₂S通过S-硫化修饰增强抗氧化酶的活性,并加强细胞对氧化应激的抵抗力。S-硫化修饰与许多疾病的发生和发展有关,如心血管疾病、糖尿病、神经退行性疾病等。(351-356)
图 56. H₂S介导的蛋白质S-硫化反应。
4.3.2. 硫化氢的荧光成像
4.3.2.1. 基于醚键/酯基/磺酸酯基硫解的H₂S荧光成像策略
Wang及其同事报道了一种靶向线粒体的荧光探针(151,表10,图57),并利用它筛选H₂S供体。 选择了二硝基苯 (DNP) 作为荧光猝灭基团。与H₂S反应时,DNP醚分解并释放荧光团以恢复荧光。作者应用它筛选了十字花科蔬菜中的15种硫代葡萄糖苷和异硫氰酸酯,并确定了具有显著H₂S释放能力的H₂S供体萝卜硫素 (SFN)。Xu及其同事报道了一种双响应荧光探针 152,用于同时检测H₂S和N₂H₂,它由1-甲基喹啉鎓碘化物和4-(二乙胺基)水杨醛-2,4-二硝基苯基组成。 H₂S发生亲核取代反应,消除DNP并激活ICT过程,导致680 nm处发射增强。强吸电子的喹啉单元增强了C=C的亲核反应,并在与N₂H₄反应时形成新的产物肼基亚甲基苯酚。作者使用该探针检测土壤、食品和活细胞样品中的H₂S和N₂H₄。
图 57. 基于醚键/酯基/磺酸酯基硫解(探针 151–154)、叠氮/硝基/磺酰基还原(探针 155–159)、活性烯烃加成(探针 160)、亲核取代(探针 161)和其他响应机理(162, 163)的部分H₂S荧光探针。
表10. 部分H₂S荧光探针
| 探针 | λex/λem (nm) | 检测限 | 响应时间 | 响应类型 | 响应机理 | 参考文献 |
|---|---|---|---|---|---|---|
| 151 | 560/645 | 62.5 nM | 90 分钟 | 关-开 | ICT | 10.1016/j.bios.2023.115521 |
| 152 | 450/680 (H₂S), 420/488 (N₂H₄) | 51 nM (H₂S), 40 nM (N₂H₄) | 70秒 (H₂S), 30秒 (N₂H₄) | 关-开 | ICT | 10.1016/j.jhazmat.2023.133036 |
| 153 | 470/555 (Cys/Hcy), 550/719 (H₂S) | 79 nM (Cys), 24 nM (Hcy), 203 nM (H₂S) | 40分钟(Cys), 30分钟(Hcy), 20分钟(H₂S) | 关-开 | ICT | 10.1016/j.cclet.2023.109156 |
| 154 | 595/630, 805 | 0.5 μM | 10 分钟 | 比率 | ICT | 10.1021/jacs.9b09181 |
| 155 | 330/415 (HClO), 440/539 (H₂S) | 27.8 nM (HClO), 34.4 nM (H₂S) | 5秒 (HClO), 6分钟 (H₂S) | 比率 | ICT | 10.1016/j.jhazmat.2023.133253 |
| 156 | 450/543, 254 nM (HBrO) | 23.5 nM (H₂S) | 420秒 (H₂S), 5秒 (HOBr) | 比率 | ICT/PET | 10.1016/j.jhazmat.2021.126898 |
| 157 | 405/515 | 0.11 μM | n.d. | 关-开 | ICT | 10.1021/acs.analchem.9b04009 |
| 158 | 360/470 | n.d. | 4 分钟 | 关-开 | n.d. | 10.1021/acs.analchem.1c04468 |
| 159 | 730/800 | 9 μΜ (H₂O₂), 0.74 μM (H₂S) | n.d. | 关-开 | ICT | 10.1016/j.cej.2023.143102 |
| 160 | 410/500 (H₂S), 505/565(SO₂) | 6.2 nM (H₂S), 8.0 nM (SO₂) | 10分钟(H₂S), 30秒(SO₂) | 比率 | PET | 10.1021/acs.analchem.1c03963 |
| 161 | 410/718 | 60 nM | 60 分钟 | 关-开 | PET/AIE | 10.1021/jacs.0c06533 |
| 162 | 510/639 | 36 nM | 60 分钟 | 关-开 | PET/AIE | 10.1016/j.snb.2019.126773 |
| 163 | 650/830 | 0.7 μM | 10 分钟 | 关-开 | FRET | 10.1021/jacs.8b10176 |
缩写:无数据 (n.d.), 分子内电荷转移 (ICT), 聚集诱导发光 (AIE), 光诱导电子转移 (PET), 激发态分子内质子转移 (ESIPT), Förster共振能量转移 (FRET)。
Li及其同事构建了一种基于ICT过程的近红外探针 153。 探针 153 由7-硝基-1,2,3-苯并噁二唑 (NBD) 与二氰基异佛尔酮-香豆素连接而成。NBD是识别单元和荧光掩蔽基团。该探针对Cys/Hcy和H₂S显示出不同的荧光信号响应(Cys/Hcy为绿色和红色,H₂S为红色),具有大的斯托克斯位移和高信噪比。探针 153 能够可视化各种细胞和斑马鱼中的内源性/外源性生物硫醇,并且还可以监测活HepG2细胞中Cys/Hcy或GSH向H₂S的转化。
鉴于荧光和光声成像的互补优势,He及其同事开发了一种比率型探针 154,它利用光学/光声双模态成像进行体内/体外H₂S成像。 H₂S亲核攻击 154 并释放出烯醇型七甲川菁,后者经历酮-烯醇互变异构形成环状酮。这种互变异构反应显著改变了发射和吸收,对H₂S显示出比率型荧光和光声响应。该探针被用于在胱硫醚酶激活剂S-腺苷-L-蛋氨酸 (SAM) 刺激内源性H₂S上调的小鼠中实现体内/体外光学和光声成像。
4.3.2.2. 基于叠氮/硝基/磺酰基还原的H₂S荧光成像策略
Hou及其同事设计了一种由香豆素衍生物 (Cou-CN) 和萘酰亚胺 (NAP) 组成的双通道荧光探针 155,用于检测H₂S和HClO。 探针的叠氮基可被H₂S还原为氨基,激活ICT过程并发出明亮的绿色荧光。N,N-二甲基硫代氨基甲酸酯作为HClO的识别基团,经历亲核攻击和消除过程,形成在蓝色通道中具有强荧光信号的化合物Cou-CN。同时加入HClO和H₂S产生青色荧光信号。该探针被用于准确量化河水、牛奶和茶叶中的HClO水平,以及红酒和啤酒中的H₂S水平。此外,还建立了一种使用薄膜试纸检测HClO和H₂S的视觉评估方法。该探针也成功应用于Hela细胞、斑马鱼和拟南芥中HClO和H₂S的实时成像。
Zhang及其同事开发了一种萘酰亚胺-叠氮荧光探针 156,用于连续监测溶酶体H₂S和HBrO。 强吸电子的叠氮基团可被H₂S还原为氨基,产生ICT效应并发出绿色荧光。之后,HBrO与S-甲基基团环化,产生PET过程,猝灭荧光。该探针成功用于可视化RAW 264.7、Hela和HepG2细胞中的外源性/内源性H₂S和HBrO。发现HBrO的消除是由于细胞中N-乙酰-L-半胱氨酸 (NAC) 代谢物H₂S所致。
Zhu及其同事开发了一种具有高尔基体靶向性的喹啉衍生荧光探针 157。 三氟甲基的引入提高了化合物的稳定性和亲脂性,这有助于探针进入高尔基体。与H₂S反应时,探针的叠氮基被还原为氨基,形成一个强的推拉体系,增强了荧光强度。该探针可以监测活细胞和斑马鱼高尔基体中H₂S水平的变化。
硝基还原酶 (NTR) 和H₂S都可用于检测肿瘤的侵袭性。然而,硝基芳香探针对硝基还原酶 (NTR) 和H₂S的反应机理是相同的:硝基还原为胺。由于NTR是一种酶,硝基周围的空间位阻可以显著影响反应速率。Liang及其同事设计了一种具有2'-硝基-[1,1'-联苯]-2-甲醛骨架的动力学正交探针 158。 该探针的检测机理是由亲核攻击引起的硝基还原和环化的级联过程。探针的硝基首先被还原为氨基。然后,通过亲核攻击诱导环化,生成荧光团并发出荧光。该探针可以在动力学曲线上用断点同时区分和测量两种底物。探针 158 在结肠肿瘤模型中显示出良好的准确性,并能正确指示侵袭倾向。
Zhao及其同事开发了一种动态可逆荧光探针 159,用于可视化活细胞中H₂O₂和H₂S的动态变化。 探针的芳基硼酸酯作为H₂O₂的响应基团,在与H₂O₂反应时会自发脱离。发生由H₂S触发的芳香亲核反应,去除荧光猝灭基团2,4-二硝基苯磺酰基并发出荧光。巯基部分可被H₂O₂氧化为-SOH,导致近红外发射猝灭,而与H₂S进一步孵育导致还原反应,从而再生荧光团和明亮的近红外发射。重要的是,中间探针在连续处理H₂O₂和H₂S时可以重复循环的S-氧化和还原过程,从而在800 nm处提供关和开状态的荧光交替,以显示H₂O₂和H₂S的共存和交替存在。
4.3.2.3. 基于活性烯烃加成的H₂S荧光成像策略
Song及其同事开发了一种荧光探针 160,可以比率型地区分H₂S和SO₂。 该探针在7-氨基香豆素的3位有一个双键,4位有一个三键。与SO₂反应时,双键发生加成反应,产生发黄光的化合物。作者证实,H₂S首先与双键反应产生发黄光的化合物。然后,H₂S与三键之间发生亲核加成反应,产生发绿光的化合物。三键将探针的发射波长扩展到红色区域,并且只对H₂S响应。该探针被应用于活细胞和斑马鱼中,以区分H₂S和SO₂。
4.3.2.4. 基于亲核取代的H₂S荧光成像策略
Zhao及其同事开发了一种对H₂S具有聚集增强响应 (AER) 的活化小分子 161,可用于H₂S富集型癌症的体内成像。 该探针是两亲性的:N-甲基吡啶鎓是亲水的,作为吸电子基团,疏水的单氯化BODIPY核心作为H₂S响应单元。该探针可以自发自组装成具有纳米结构的纳米探针。在引入H₂S后,探针通过硫醇-卤素亲核芳香取代反应 (SNAr) 发生转化,聚集增强,在组装的探针中产生明亮的近红外辐射。此外,证实了探针的聚集增强响应性是由于组装探针表面正电荷的富集,这增加了H₂S的局部浓度,从而极大地促进了SNAr的发生。该探针可以区分富含H₂S的肿瘤细胞和正常细胞,并在活体水平上对富含H₂S的结肠癌进行成像。
4.3.2.5. 基于其他响应机理的H₂S荧光成像策略
Yin及其同事开发了一种基于双核反应的荧光探针 162,以实现H₂S的亚细胞检测。 带正电荷的花青 (Cy7),一种红色荧光团,与2-(吡啶-2-基-二硫基)苯甲酸共轭,引入了二硫键和碳酸酯基团。这种修饰为H₂S提供了一个特异的反应位点。在H₂S对硫中心的亲核攻击后,产生的中间体也是一种硫醇,可以发生第二次亲核加成。与H₂S反应时,探针 162 通过两次亲核反应释放荧光团,荧光在639 nm处增强。该探针可以靶向线粒体,用于检测Hela细胞中的外源性和内源性H₂S。由于其高信噪比,它也可以用于小鼠的体内成像。
Ye及其同事开发了一种基于化合物 163 的H₂S激活的近红外荧光探针。 探针的有机π电子体系在500–850 nm范围内表现出强吸收,可以有效猝灭各种荧光团的荧光。与H₂S反应时,该探针可通过H₂S介导的双电子还原被还原为二烯,显著降低吸收,消除FRET过程,从而恢复荧光。发现该探针可以无创地监测活体小鼠肝脏中的H₂S水平。通过引入肿瘤靶向片段,可以实现小鼠肿瘤的荧光成像,从而激活PDT,提高肿瘤治疗的特异性和疗效。
4.3.3. 多硫化氢的荧光成像
4.3.3.1. 基于取代反应的H₂Sn荧光成像策略
Gu及其同事开发了一种可激活的近红外-II探针 164(图58,表11),它通过芳基亲核取代反应选择性地响应H₂Sn,从而通过SNAr反应机理确保特异性并防止其他活性硫物种的干扰。 该探针能够可视化小鼠深层组织中急性炎症期间H₂Sn的波动,从而能够精确识别动物模型中的急性炎症,并促进对H₂Sn作为活性物质的生理作用的更深入理解。 
图 58. 基于取代反应(探针 164–170)和还原反应(探针 171)的部分H₂Sn荧光探针。
表11. 部分H₂Sn荧光探针
| 探针 | λex/λem (nm) | 检测限 | 响应时间 | 响应类型 | 响应机理 | 参考文献 |
|---|---|---|---|---|---|---|
| 164 | 808/920 | 105 nM | 3 分钟 | 关-开 | ICT | 10.1021/acs.analchem.4c04848 |
| 165 | 488/515 | 2 nM | 20 分钟 | 关-开 | ICT | 10.1039/C8SC01879K |
| 166 | 480/530 (GSH), 480/670 (H₂Sn) | 0.83 μM (GSH), 0.43 μM (H₂Sn) | 4.5分钟(GSH), 45分钟(H₂Sn) | 关-开 | PET | 10.1016/j.snb.2021.130224 |
| 167 | 511/576 | 20 nM | 6 分钟 | 关-开 | ICT | 10.1016/j.snb.2019.127382 |
| 168 | 480/620 | 1 nM | 30 分钟 | 关-开 | PET | 10.1016/j.snb.2018.12.106 |
| 169 | 372/506 | 0.1 μM | 5 分钟 | 关-开 | ICT | 10.1016/j.snb.2018.12.087 |
| 170 | 635/727 | 46 nM | 2 分钟 | 关-开 | ICT/PET | 10.1016/j.jhazmat.2020.122673 |
| 171 | 500/635 | 100 nM | n.d. | 关-开 | PET | 10.1021/acs.analchem.9b01189 |
缩写:无数据 (n.d.), 分子内电荷转移 (ICT), 光诱导电子转移 (PET)。
Chen及其同事报道了一种H₂Sn荧光寿命探针 165。 H₂Sn触发了分子芳构化重排和环状内酯的水解,最终导致荧光激活和荧光寿命的增加。该探针能够检测Hela细胞和斑马鱼中超痕量的内源性H₂Sn,显示HeLa细胞中内源性H₂Sn的浓度范围约为0至120 nM,平均约为60至70 nM。斑马鱼中内源性H₂Sn的浓度范围约为0至160 nM,但平均浓度约为70至80 nM。
Song及其同事开发了一种单波长激发荧光探针 166,可以从不同的荧光通道选择性地定量检测GSH和H₂Sn。 在多硫化物与探针的苯基硒化物片段发生亲核取代后,分子内环化过程将释放红色荧光基团。该探针已应用于同时检测细胞内GSH和H₂Sn,并能对活细胞中的内源性H₂Sn进行成像。Song及其同事还开发了一种H₂Sn荧光探针 167,通过在香豆素丙二腈衍生物的4位通过醚键整合4-甲氧基苯酚部分。 由于内键自由旋转引起的非辐射衰变过程,探针本身基本上不发荧光。该探针利用H₂Sn取代反应触发级联分子内环化反应并激活黄色荧光,可以可视化活MGC-803细胞中的H₂Sn。
Zhao及其同事使用吩噻嗪香豆素作为染料制备了一种用于检测H₂Sn的荧光探针 168。 该探针利用H₂Sn与-F之间的取代反应引发顺序的分子内环化反应,从而激活荧光。该探针证明了能够对活RAW 264.7细胞和斑马鱼中的外源性和内源性H₂Sn进行成像。Kim及其同事开发了一种线粒体靶向和双光子可激发的探针 169,它通过一系列取代反应对H₂Sn产生响应,最终触发级联环化和消除反应。 这导致荧光从蓝色转变为绿色。该探针能够在帕金森病模型的神经元和脑组织中对H₂Sn进行比例双光子成像。结果显示,帕金森病模型中的H₂Sn水平高于野生组,表明H₂Sn可能在帕金森病中起作用。
Chen及其同事设计了一种近红外荧光探针 170,通过取代-环化反应选择性地响应H₂Sn。 该探针能够在ZF4细胞缺氧再灌注模型和斑马鱼缺氧模型中原位成像H₂Sn的变化,包括缺氧应激下HSNO介导的H₂Sn产生。结果显示,在缺氧期间,ZF4细胞和斑马鱼中的H₂Sn上调。该探针还可以在小鼠腹腔中对H₂Sn进行原位成像。
4.3.3.2. 基于还原反应的H₂Sn荧光成像策略
H₂Sn是细胞内抗氧化剂,而O₂•⁻被认为是ROS的前体。因此,捕捉O₂•⁻和H₂Sn之间的相互作用有助于进一步理解生理和病理效应。Chen及其同事开发了一种荧光探针 171,它在不同的荧光通道中对H₂Sn和O₂•⁻表现出荧光响应。 该探针利用硝基还原后的H₂Sn的1,6-重排消除反应,使其能够在连续和间歇性缺氧条件下同时监测活细胞中O₂•⁻和H₂Sn水平的变化。该探针可以通过分析急性腹膜炎小鼠模型中H₂Sn和O₂•⁻之间的关系来区分炎症组织和正常组织,并应用于SH-SY5Y荷瘤小鼠模型中O₂•⁻和H₂Sn的成像。
4.4. 二氧化硫/亚硫酸盐/亚硫酸氢盐 (Sulfur Dioxide/Sulfite/Bisulfite)
4.4.1. 二氧化硫/亚硫酸盐/亚硫酸氢盐简介
二氧化硫 (SO₂) 是一种无色、有刺激性气味的气体,是主要的大气污染物之一。SO₂在生物体中主要以两种形式存在:亚硫酸氢根离子 (HSO₃⁻) 和亚硫酸根离子 (SO₃²⁻)。生物体中少量的内源性SO₂衍生物具有抗氧化和舒张血管平滑肌的功能。然而,异常水平的HSO₃⁻/SO₃²⁻可以诱导脂质过氧化损伤、蛋白质氧化损伤、DNA蛋白质交联和细胞DNA损伤,降低各种酶的活性,特别是超氧化物歧化酶和谷胱甘肽过氧化物酶等抗氧化酶的活性,并且也可能参与各种呼吸系统、神经系统和心血管疾病的发病机制。(378-380)
4.4.2. 二氧化硫/亚硫酸盐/亚硫酸氢盐的荧光成像
中暑可引起严重的身体损伤甚至死亡。早期了解热细胞毒性的机理可以预防或治疗与中暑相关的疾病。Yin及其同事开发了一种靶向溶酶体的比例荧光探针 172(图59,表12),可以在紫外线照射下检测SO₂。 在紫外线照射下,螺吡喃基团异构化为部花青形式,呈现出微弱的红移发射。此外,光控异构化产生了一个C=C–C=N⁺片段,能够通过迈克尔加成与SO₂反应,产生在绿色通道中有荧光的加合物。该探针被用于追踪热休克期间溶酶体SO₂的变化。细胞和肠道组织成像显示,升高的内源性SO₂可以保护小肠免受中暑引起的损伤。
图 59. 部分二氧化硫/亚硫酸盐/亚硫酸氢盐荧光探针。
表12. 部分二氧化硫/亚硫酸盐/亚硫酸氢盐荧光探针
| 探针 | λex/λem (nm) | 检测限 | 响应时间 | 响应类型 | 响应机理 | 参考文献 |
|---|---|---|---|---|---|---|
| 172 | 450/535, 630 | 4.7 μM | 5 分钟 | 关-开 | FRET | 10.1021/jacs.9b13936 |
| 173 | 400/482 (SO₂), 550/653 (dsDNA) | 1 μM (SO₂), 1 μM (dsDNA) | 1 分钟 | 关-开 | TICT | 10.1021/acs.analchem.1c03109 |
| 174 | 560/695 | 12.3 nM | 130 秒 | 关-开 | ICT | 10.1016/j.cej.2021.133468 |
| 175 | 488/568 (SO₂) | 3.5 μM | 110 秒 | 关-开 | FRET | 10.1016/j.snb.2024.136470 |
| 176 | 600/740 (HS⁻), 415/485, 740 (SO₃²⁻) | 0.60 nM (HS⁻), 1.28 μM (SO₃²⁻) | 1分钟 (HS⁻), 2分钟 (SO₃²⁻) | 开-关 (HS⁻), 比率 (SO₃²⁻) | ICT | 10.1016/j.snb.2024.136243 |
| 177 | 480/560 | 0.239 μM | 30 分钟 | 关-开 | ICT/PET | 10.1016/j.snb.2024.136113 |
| 178 | 390/475 | 0.28 μM | 5 秒 | 比率 | FRET | 10.1016/j.snb.2024.135795 |
| 179 | 365/545 | 12 nM | <5 秒 | 比率 | ICT | 10.1016/j.jhazmat.2024.135975 |
| 180 | 531/667, 531/735 | 80.3 nM | <15 秒 | 比率 | FRET | 10.1016/j.jhazmat.2024.133653 |
| 181 | 520/810 | 38 nM | 40 秒 | 比率 | ICT | 10.1016/j.jhazmat.2023.133165 |
| 182 | 810/493, 810/611 | 0.09 μM | 5 分钟 | 比率 | TBET | 10.1016/j.biomaterials.2020.119910 |
| 183 | 560/625 | 53 nM | <5 秒 | 关-开 | PET/ICT | 10.1016/j.jhazmat.2024.136291 |
缩写:无数据 (n.d.), 分子内电荷转移 (ICT), 光诱导电子转移 (PET), Förster共振能量转移 (FRET), 扭曲分子内电荷转移 (TICT), 贯穿键能量转移 (TBET)。
Zhang及其同事报道了一种探针 173,可以标记溶酶体和细胞核,并指示细胞内SO₂的水平。 该探针通过迈克尔加成反应响应SO₂,产生蓝色荧光信号。该探针随后被用于活细胞的三维超分辨率动态成像,揭示了SO₂作为关键的上游信号分子,在程序性细胞死亡期间激活核吞噬。作者还发现,在斑马鱼胚胎发育过程中,SO₂主要在卵黄中产生,诱导卵黄自噬以提供营养,并与听觉神经系统的发育高度相关。
作为一种还原剂,SO₂可能在保护细胞免受内质网应激方面起着重要作用。Lin及其同事开发了一种靶向内质网的SO₂荧光探针 174,具有近红外发射。 基于乙酸在响应SO₂时的脱保护反应,探针 174 可以显示细胞、组织、斑马鱼和小鼠中外源性/内源性SO₂的变化。并且探针 174 使用该探针直接可视化了由二硫苏糖醇诱导的内质网应激期间SO₂的产生和消耗,这有助于揭示SO₂在内质网相关疾病中的作用。
为了研究SO₂在铁死亡中的生理作用,Tian及其同事设计并合成了一种具有脂滴靶向能力的光控SO₂荧光探针 175。 探针 175 具有用于脂滴靶向的三苯胺片段,以及作为SO₂反应位点和光响应开关的螺吡喃。探针本身表现出黄色荧光,在紫外线激活下,探针的螺吡喃部分异构化为部花青形式,产生红色荧光发射。暴露的C=C–C=N⁺片段与SO₂发生特异的迈克尔加成反应,猝灭红色荧光并增强黄色荧光。该探针可以监测铁死亡期间脂滴内SO₂水平的变化。
H₂S和SO₃²⁻都显示出强大的亲核特性。Xu及其同事设计并制备了一种近红外荧光探针 176,可以区分和检测H₂S、SO₃²⁻和粘度,并靶向线粒体。 该探针对H₂S表现出猝灭型响应,而对SO₃²⁻的响应是比率型的,并对粘度表现出敏感性。探针 176 能够监测和成像Hela细胞和97H细胞中的H₂S、SO₃²⁻和粘度。
Li及其同事通过引入苯并吡喃荧光团作为吸电子基团和二乙胺衍生物作为给电子基团,构建了一种荧光探针 177,用于在三个通道中实时追踪极性和HSO₃⁻。 探针 177 具有优异的AIE和近红外特性,可以通过极性变化荧光成像准确区分正常细胞和癌细胞。探针 177 还可以追踪具有炎症和铁死亡的细胞以及小鼠中SO₂和极性的变化。
Yang及其同事开发了一种双靶向SO₂特异性荧光探针 178。 该探针通过电荷效应优先附着于线粒体并发出红色荧光。暴露于SO₂后,中性结构特异性靶向内质网并表现出蓝色荧光。这使得能够可视化由SO₂驱动的活细胞(具有线粒体功能障碍)和斑马鱼中线粒体和内质网之间的相互作用。此外,该探针可以准确检测食品中的SO₂。
为了快速准确地检测环境、食品和生物样品中的SO₂衍生物,Wang及其同事构建了一种诺蒎酮荧光探针 179,它在与SO₂衍生物相互作用时表现出黄色荧光。 该探针显示出大的斯托克斯位移、低的检测限和快速的响应时间,使其适用于环境水、土壤和食品样品中SO₂衍生物的定量分析。该探针还可以对Cd²⁺胁迫下的拟南芥中的内源性SO₂衍生物进行成像,并观察活细胞和斑马鱼中的外源性和内源性SO₂衍生物。
镉污染的水和食品对人类健康构成严重威胁,特别是肝损伤。为了解Cd²⁺诱导的肝损伤与SO₂之间的关系,Zhou及其同事设计并合成了一种基于FRET策略的SO₂激活的比率荧光探针 180,具有双近红外发射。 它由近红外二氰基磷酮和近红外苯并吡喃酯分别作为供体和受体组成。SO₂的比率响应由迈克尔加成反应调节。该探针被用于Cd²⁺诱导的细胞内SO₂的比例成像和肝损伤小鼠模型的诊断。
Zhang及其同事报道了一种基于ICT机理的近红外荧光探针 181,在响应HSO₃⁻时表现出蓝移的吸收和发射光谱。 该探针能够快速、现场检测工业废水、食品样品和生物系统中的SO₂衍生物。该探针实现了对活Hela细胞、斑马鱼和小鼠中HSO₃⁻的荧光成像,并通过光谱分析和基于智能手机的技术确定了实际食品样品中HSO₃⁻的浓度。该探针还允许试纸通过智能手机检测水样和焦化废水中的HSO₃⁻浓度。
SO₂通过线粒体呼吸与许多神经系统疾病密切相关。Liu及其同事开发了一种基于贯穿键能量转移 (TBET) 的双光子比率荧光探针 182。 该探针能够靶向线粒体并追踪活细胞和脑组织中SO₂的水平,并可视化由SO₂污染引起的神经炎症期间活细胞和小鼠脑组织中的SO₂。Zhong及其同事提出了一种喹啉融合的罗丹明荧光探针 183,通过在喹啉单元的4位进行1,4-亲核加成反应来响应HSO₃⁻,激活分子内电荷转移机理,表现出可见的颜色变化,并激活红色荧光。 该探针可以准确检测实际食品样品和活细胞中HSO₃⁻的水平。
4.5. 简要总结
RSS的荧光成像见证了重大的创新,导致了高灵敏度和选择性探针的开发。对于Cys和Hcy,诸如亲核加成、硫解和双响应设计等策略通过利用独特的结构或反应性特征实现了差异化检测。GSH成像通过各种识别基序取得了进展,包括磺酰基、醚、硫醚和硒酰基,以及二硫键交换和多位点激活,从而改善了与其他硫醇的区分。用于H₂S的探针利用了多种机制,如硫解、叠氮/硝基还原和亲核取代,提供了可调的响应动力学和发射特性。同时,新兴的H₂Sn成像领域利用了基于取代和还原的探针进行复杂氧化还原环境中的实时追踪。尽管取得了这些进展,但在实现结构相似的硫醇之间的精确选择性、在体内维持稳定性和响应性以及实现定量和可逆成像方面仍然存在挑战。此外,一些探针仍然存在响应动力学慢、光稳定性有限或在复杂氧化还原环境中缺乏特异性的问题。在多重成像或可激活探针方面的进展,以及在动态生物模型中的应用,对于阐明RSS在健康和疾病中的细微作用至关重要。
5. 氧化还原金属 (Redox Metals)
5.1. 铜和铁简介
在细胞生物学这幅错综复杂的织锦中,氧化还原稳态代表了一种以极高精度维持的关键平衡。处于这种平衡核心的是具有氧化还原活性的金属,铁 (Fe) 和铜 (Cu),它们在细胞环境中充当关键的调节节点。(393-395) 铜离子的氧化还原调节对细胞功能至关重要,因为铜在各种酶促过程中不可或缺,具有氧化还原特性,并参与电子转移反应。 在生物系统中,铜以两种氧化态存在:高活性的Cu(I),过量时可能因其通过类芬顿反应催化ROS形成的能力而变得有毒;以及更稳定的Cu(II),通常在催化过程中起作用,但在某些条件下也可能带来毒性风险。细胞对铜的调节涉及维持这两种形式之间的平衡,以避免缺乏和毒性,因为铜失调与神经退行性疾病和心血管疾病等有关。诸如Atox1、Cu/Zn-超氧化物歧化酶 (SOD1) 和用于超氧化物歧化酶的铜伴侣等蛋白质有助于在细胞内运输和螯合铜离子,确保铜在需要的地方可用但不过量。 Menkes和Wilson病蛋白是铜转运ATP酶,分别在铜的摄取和输出中起作用,从而维持其稳态。铜离子已被证明在其氧化还原调节状态下作为信号分子发挥作用,影响诸如脯氨酰羟化酶和免疫信号通路等酶的活性。由不当的氧化还原调节导致的铜稳态失调与多种疾病有关,ATP7B和ATP7A基因的突变分别导致铜的积累或缺乏,异常的铜积累被认为有助于阿尔茨海默病中淀粉样斑块的形成和氧化损伤。 氧化还原调节确保铜保持在细胞健康和功能的最佳范围内。通过调节铜的氧化还原状态和可用性,细胞可以有效地利用铜进行必要的代谢过程,同时防止其潜在的毒性作用。
铁离子的氧化还原调节对于维持铁稳态和细胞功能至关重要,因为铁在众多生化过程中起着核心作用。在生物系统中,铁以两种氧化态存在,Fe(III)和Fe(II)。还原形式的Fe²⁺具有高反应性,参与必要的氧化还原反应,如血红蛋白中的氧气运输和细胞色素及铁硫簇中的线粒体呼吸。 更稳定的氧化形式Fe³⁺通常储存在铁蛋白中或由转铁蛋白运输。过量的铁储存在铁蛋白或含铁血黄素中,而转铁蛋白在血流中运输铁,STEAP3将其还原为Fe²⁺以供细胞使用。Fe²⁺是参与电子传递链和DNA修复酶中氧化还原反应的铁硫簇的核心组分,在Fe²⁺和Fe³⁺状态之间交替。 氧结合蛋白拥有含有Fe²⁺的血红素基团。这些基团可以根据需要结合和释放O₂。然而,Fe²⁺已被证明可以通过芬顿反应从H₂O₂中催化产生活性羟基自由基,如果Fe²⁺积累,可能会引起氧化损伤。 细胞通过抗氧化系统如超氧化物歧化酶和过氧化氢酶,以及铁蛋白和脂质过氧化抑制剂来对抗这一过程。铁的氧化还原状态参与各种细胞信号通路,包括在低氧条件下稳定HIF转录因子和调节脯氨酰羟化酶,后者在常氧条件下靶向HIF进行降解,并依赖于Fe²⁺的活性。 铁还影响炎症通路,如NF-κB,以响应应激或感染。铁稳态失调,特别是由不当的氧化还原调节引起的,与多种疾病有关,从铁过载导致器官损伤到铁缺乏导致贫血。氧化还原敏感的荧光探针被用于研究细胞内铁水平及其氧化还原状态的动态变化。 铁调节蛋白 (IRPs) 在控制铁相关基因表达中至关重要,通过它们与mRNAs中的铁应答元件 (IREs) 结合,从而根据细胞铁的可用性来调节翻译。总之,铁的氧化还原调节对于维持细胞功能和避免毒性至关重要,通过对Fe²⁺和Fe³⁺状态之间的平衡以及参与铁摄取、储存、运输和氧化还原调节的各种蛋白质和酶的严格控制,以防止铁过载或缺乏,凸显了其在健康和疾病中的重要性。 通过检查Fe²⁺到Fe³⁺和Cu⁺到Cu²⁺的转化及其逆过程,本部分强调了这些反应在细胞代谢中的重要性及其在疾病背景下易于失调的特性。它还探讨了金属离子和螯合剂之间复杂的相互作用,突出了这些相互作用对于环境传感和生物分析应用至关重要的精细选择性、灵敏度和稳定性。此外,本节概括了荧光探针开发这一新兴领域,它为响应Fe和Cu离子的存在提供了新颖的发光特征,强调了它们在检测、成像和阐明生物学作用方面的效用。
5.2. 铜的荧光成像
5.2.1. 铜(II)的荧光成像
5.2.1.1. 基于配位相互作用的Cu²⁺荧光成像策略
Wanichacheva及其同事通过引入螺烯衍生物作为荧光团和二-2-吡啶鎓作为识别配体,合成了一种对Cu²⁺具有高灵敏度的荧光探针(图60,表13,探针 184)。 Cu²⁺与二-2-吡啶鎓的结合位点受结合环境的影响。因此,该探针可以在不同的介电环境中实现对Cu²⁺的选择性配位。在含有Triton-X100的HEPES缓冲液中,该探针可以评估Cu²⁺的浓度。并且,该传感器对Cu²⁺的检测限显著低于美国环境保护局 (U.S. EPA) 和世界卫生组织 (WHO) 规定的饮用水中Cu²⁺的允许浓度,显示出广泛的潜在应用。 
图 60. 探针 184 对Cu²⁺响应机理的示意图。
表13. 部分Cu²⁺荧光探针
| 探针 | λex/λem (nm) | 检测限 | 响应时间 | 响应类型 | 响应机理 | 参考文献 |
|---|---|---|---|---|---|---|
| 184 | 373/524 | 88.6 nM | n.d. | 关-开 | PET | 10.1021/acssensors.8b00158 |
| 185 | 310/390 | 0.83 nM | 30 分钟 | 开-关 | 配位 | 10.1016/j.bios.2021.113174 |
| 186 | 440/560 | 190 nM | 1 分钟 | 开-关 | AIE | 10.1039/D2CC06350F |
| 187 | 520/580 | 1 nM | 20 分钟 | 关-开 | 开环 | 10.1016/j.talanta.2018.01.073 |
| 188 | 425/520, 650/696 | 200 nM | 30 分钟 | 比率 | 开环 | 10.1039/D0CC01481H |
| 189 | 554/584 | 5.8 nM | 1 分钟 | 关-开 | 开环 | 10.1016/j.talanta.2023.125530 |
| 190 | 720/740 | 152 μM | 20 分钟 | 关-开 | 开环 | 10.1021/acs.analchem.4c00909 |
| 191 | 470/510 | 95 nM | 4 小时 | 关-开 | ICT | 10.1039/D3CC02201C |
| 192 | 475/580, 648 | 30 nM | 15 分钟 | 比率 | AIE/ESIPT | 10.1039/D1CC02233D |
| 193 | 523/600, 710/810 | 53 nM | 1 小时 | 比率 | ICT | 10.1021/acssensors.3c02549 |
| 194 | 290/360 | 200 nM | 15 分钟 | 开-关 | 配位 | 10.1016/j.snb.2022.131423 |
| 195 | 417/470, 565 | 7.44 × 10⁻¹¹ M | n.d. | 关-开 | ICT | 10.1073/pnas.2202736119 |
缩写:无数据 (n.d.), 分子内电荷转移 (ICT), 聚集诱导发光 (AIE), 光诱导电子转移 (PET), 激发态分子内质子转移 (ESIPT)。
Xiao及其同事报道了一种基于2,6-吡啶二甲醛的大环希夫碱荧光探针(图61,探针 185),用于检测环境水样和活细胞中的Cu²⁺。 该荧光探针本身在DMSO/H₂O溶液中表现出显著的荧光。探针的亚胺基团表现出强大的配位能力,导致氮原子与Cu²⁺配位,从而猝灭荧光。值得注意的是,该探针在GM12878细胞中表现出有效的荧光成像性能。Wei及其同事构建了一种基于三苯胺、香豆素和吡啶单元的具有AIE特性的双功能荧光探针 186。 与Cu²⁺配位后,由于分子内电荷转移效应,探针荧光被猝灭。此外,该探针在光照下能够产生各种ROS,使其成为用于癌症PDT的有前途的候选者。因此,该探针以及通过与Cu²⁺配位形成的纳米颗粒在光照下可产生ROS,为癌症的协同治疗提供了工具。
图 61. 基于配位相互作用(探针 185, 186)、螺内酰胺开环反应(探针 187–190)、C-O键裂解反应(探针 191)、水解反应(探针 192, 193)及其他机理的部分Cu²⁺荧光探针。
5.2.1.2. 基于螺内酰胺开环反应的Cu²⁺荧光成像策略
Jiao及其同事设计了一种基于罗丹明的荧光探针 187。 探针与Cu²⁺的相互作用导致罗丹明基团中螺内酯环的打开,导致结构从闭环形式转变为罗丹明的开环形式。该探针对Cu²⁺表现出优异的选择性和低检测限,能够监测痕量的金属离子。探针在乙腈水溶液中识别Cu²⁺离子的能力通过颜色从无色变为紫色得到证明。
Aydin及其同事利用香豆素-苯并吡喃平台作为骨架,并将其部分连接到Cu²⁺受体上,合成了一种近红外比率荧光探针 188。 在螺环闭环状态下,探针表现出较短的荧光发射波长。相反,当与Cu²⁺结合时,探针转变为开环状态,表现出近红外荧光的特性。该探针在生物环境中表现出显著的溶解性,并对Cu²⁺离子具有高选择性。它表现出快速的响应速率,并且在各种pH范围内不受干扰。值得注意的是,该探针被证明在检测细胞环境中Cu²⁺的动态变化方面是有效的。
Pitsanuwong及其同事合成了一种用于检测Cu²⁺的荧光探针 189,基于部分连接到芳酰胺-吡啶鎓的罗丹明。 获得的结果表明,该探针对Cu²⁺表现出高选择性和灵敏度。并且该探针显示出检测水样中Cu²⁺的潜力。此外,荧光生物成像实验的结果表明,该探针能够检测人肝癌细胞中的Cu²⁺。这项工作为检测水样和生物系统中的Cu²⁺提供了有力的工具。
Shen及其同事通过将近红外罗丹明荧光团与吲哚盐共轭,设计了一种能够靶向线粒体的荧光探针 190。 在探针与Cu²⁺结合后,观察到罗丹明从闭环到开环的转变,同时伴随着荧光特异性的激活。对该探针进行了荧光寿命成像,成功地实现了对线粒体膜电位的监测。作者发现,在Cu²⁺诱导的细胞死亡过程中,线粒体膜电位的降低通常伴随着异常的蛋白质聚集。这一发现为线粒体疾病的分子机制提供了见解。
5.2.1.3. 基于C-O键裂解反应的Cu²⁺荧光成像策略
Datta及其同事使用五个N原子供体作为响应基团,设计了一种基于活性的荧光探针 191。 探针本身不发荧光。然而,在氧气和GSH存在下,该探针选择性地检测Cu²⁺,导致荧光激活。实验结果表明,氧气和GSH是探针对Cu²⁺进行检测的必要条件。此外,该探针不仅促进了活细胞中Cu²⁺的成像,还在斑马鱼幼体中检测到Cu²⁺,表明该探针在复杂的生物系统中有潜在的应用。这项工作为开发基于反应性的荧光探针提供了思路,并有助于开发新的金属离子成像工具。
5.2.1.4. 基于水解反应的Cu²⁺荧光成像策略
Jiang及其同事开发了一种基于2'-羟基查尔酮衍生物的有效近红外发射Cu²⁺荧光探针 192,该探针带有一个可以选择性捕获Cu²⁺的三齿结合位点。 探针与Cu²⁺配位后,水溶液中分子内氢键的形成导致探针水解,从而释放出自由的羟基化合物。该过程最终导致分子聚集,由于AIE和ESIPT效应而产生强烈的近红外荧光。该探针在水溶液和HeLa细胞中均对Cu²⁺表现出比率荧光响应。该探针能够成像细胞内Cu²⁺的动态变化,且不受不稳定的Cu⁺池的影响。这项工作为监测细胞内Cu²⁺的变化提供了有力的工具。
New及其同事引入IR-780作为近红外荧光支架,并修饰2-吡啶甲酸酯作为Cu²⁺响应基团,构建了一种对Cu²⁺具有良好选择性的比率荧光探针 193。 Cu²⁺与吡啶N和羰基O的络合增强了羰基的亲电性,从而加速了酯的水解。水解产物随后显著改变了探针的吸收和荧光发射。探针的高稳定性和选择性使其成为检测不同生物系统中Cu²⁺的荧光探针。作者利用该探针研究了路易体痴呆 (DLB) 患者死后脑组织中Cu²⁺的水平和分布。获得的结果表明,与健康组织相比,DLB患者退化神经元和神经元外环境中Cu²⁺的水平显著降低。这些发现有助于更深入地了解神经退行性疾病中的Cu²⁺失调。
5.2.1.5. 基于其他机理的Cu²⁺荧光成像策略
Zhang及其同事设计了一种基于有机硒配合物的多光子Cu²⁺荧光探针 194。 探针的长烷氧基在苯环周围形成一个有效的空腔,促进了对Cu²⁺的识别。探针与Cu²⁺的结合导致探针荧光的显著猝灭。经过彻底的筛选过程,作者确定通过加入葡萄糖可以部分恢复探针的荧光。随后使用HeLa细胞和动物模型进行了研究,成功地在Cu²⁺环境中检测到葡萄糖。这项工作为开发新型多光子荧光探针提供了思路。
Chang及其同事报道了一种基于作用的传感策略,通过调节探针金属螯合部分的软硬酸碱配对,利用金属导向的酰基咪唑化学实现对Cu²⁺的氧化态特异性检测。 与Cu⁺相比,Cu²⁺被归类为更硬的路易斯酸,因此对更硬的路易斯碱表现出更强的偏好。鉴于此,作者选择用一个羧酸配体取代其中一个软的硫醚配体,从而确保探针对Cu²⁺的选择性优于Cu⁺。Cu²⁺与金属和氧化态特异性受体的结合激活了悬垂染料与近端生物亲核体之间的反应,导致金属离子的释放。该过程有效地避免了荧光的猝灭。Cu²⁺的铜导向酰基咪唑649.2(图62,探针 195)为不稳定Cu²⁺池的存在和调节提供了见解,包括将二价金属转运蛋白1鉴定为Cu²⁺输入蛋白,并显示了氧化应激如何通过耗尽总谷胱甘肽水平来增加不稳定的Cu²⁺。
图 62. (A) 调节CDAI中金属受体的软硬酸碱性质以增加对Cu(II)而非Cu(I)的氧化态选择性的设计策略。用较硬的羧酸酯配体模块化取代软的硫醚供体,可提供更高的Cu(II)选择性。(B) Cu(II)选择性探针CD649.2(探针 195)和CD517.2的合成。
5.2.2. 铜(I)的荧光成像
5.2.2.1. 基于配位相互作用的Cu⁺荧光成像策略
Guo及其同事开发了一种基于FRET机理的比率荧光探针 196(图63,表14),用于追踪内质网中的Cu⁺。该探针由香豆素和4-氨基-7-磺酰基苯并噁唑组成。 它通过一个具有内质网靶向功能的烷基磺酰胺片段连接在一起。该探针检测活细胞中Cu⁺的能力归因于由Cu⁺诱导的FRET效率的变化。在MCF-7细胞中,该探针对Cu⁺显示出高度特异性的比率荧光响应,并能够直观地检测内质网中的外源性和内源性Cu⁺。此外,该探针能够检测ER应激下Cu⁺的波动和分布,从而证实了Cu⁺增加与ER应激之间的直接关系。该探针在阐明ER应激相关疾病中依赖Cu⁺的信号传导方面具有广阔的应用前景。
图 63. 基于配位相互作用的部分Cu⁺荧光探针。
表14. 部分Cu⁺荧光探针
| 探针 | λex/λem (nm) | 检测限 | 响应时间 | 响应类型 | 响应机理 | 参考文献 |
|---|---|---|---|---|---|---|
| 196 | 415/470, 475/565 | n.d. | 15 分钟 | 比率 | 配位 | 10.1007/s11426-018-9424-8 |
| 197 | 750/792 | n.d. | 10 分钟 | 关-开 | 配位 | 10.1016/j.jconrel.2020.02.023 |
| 198 | 610/660 | n.d. | 20 分钟 | 关-开 | 配位 | 10.1002/anie.202109349 |
| 199 | 390/505 | n.d. | n.d. | 关-开 | AIE | 10.1021/acs.est.1c05408 |
缩写:无数据 (n.d.), 聚集诱导发光 (AIE)。
Sun及其同事通过将化合物 197 和多柔比星共载入胶束中,开发了一系列探针,以实现对活体Cu⁺离子的近红外 (NIR) 荧光和光声实时成像。 该探针使用cRGD肽靶向肿瘤新生血管的能力,使得能够同时递送化疗药物和铜螯合剂。利用NIR荧光和光声成像,该探针促进了对Cu⁺螯合事件的无创和实时观察。作者通过监测肿瘤中铜离子和氧饱和度的浓度来研究抗新生血管形成的机理。体内肿瘤模型表明,化合物 197 和多柔比星的共同递送显著抑制了肿瘤生长并减少了新生血管形成。Priessner及其同事报道了一种基于BODIPY的探针 198。 该探针与Cu⁺的结合导致荧光强度的显著增加和其荧光寿命的显著延长。该探针对Cu⁺的选择性使得能够直接检测活细胞中的Cu⁺。通过荧光寿命成像显微镜,在用Cu⁺释放剂Cu-GTSM处理细胞后,检测到Cu⁺浓度的增加,增加主要定位于溶酶体。
5.2.2.2. 基于其他反应机理的Cu⁺荧光成像策略
Wang及其同事开发了一种策略(探针 199,图64),用于检测淡水藻类莱茵衣藻生物体中产生的Cu⁺。 该探针被用于检测细胞中的内源性和外源性Cu⁺,结果显示缺铁细胞中Cu⁺的荧光信号增强,这与细胞死亡高度相关。此外,在铁充足的条件下,Cu²⁺可以在正常细胞和锌含量低的细胞中积累,但不会引起细胞死亡,表明Cu⁺是缺铁条件下藻类细胞中铜毒性的主要原因。该研究揭示了缺铁条件下铜毒性增加的潜在机理,并强调了藻类中铜代谢调节的关键作用。
图 64. 探针 199 与Cu⁺反应机理图。
5.3. 铁的荧光成像
5.3.1. 铁(III)的荧光成像
5.3.1.1. 基于氨基相互作用的Fe³⁺荧光成像策略
Tang及其同事通过限制分子内旋转,设计了一种多功能AIE荧光探针 200(图65,表15)。 探针 200 源自一种带有亚苯基乙烯基的寡聚苯胺衍生物。将具有显著空间位阻的亚苯基乙烯基引入寡聚苯胺骨架,有效地阻止了分子间堆积结构的形成,从而赋予了AIE特性。该策略克服了传统寡聚苯胺衍生物在高浓度或聚集状态下通常观察到的荧光猝灭问题。该探针在与Fe³⁺络合后表现出降低的荧光强度,表明对Fe³⁺具有高度选择性的荧光猝灭响应。它被用于大肠杆菌和金黄色葡萄球菌的荧光成像,证明了能够在无需洗涤步骤的情况下标记和可视化这些细菌,从而可以直接在培养基中实现高对比度的荧光成像。 
图 65. 基于氨基相互作用(探针 200)和配位相互作用(探针 201–205)的部分Fe³⁺荧光探针。
表15. 部分Fe³⁺荧光探针
| 探针 | λex/λem (nm) | 检测限 | 响应时间 | 响应类型 | 响应机理 | 参考文献 |
|---|---|---|---|---|---|---|
| 200 | 390/500 | n.d. | 0.5 小时 | 开-关 | AIE | 10.1007/s11426-018-9440-0 |
| 201 | 365/420 | n.d. | 10 分钟 | 关-开 | 配位 | 10.1016/j.snb.2019.04.021 |
| 202 | 340/507 | 17.7 nM | n.d. | 关-开 | PET | 10.1016/j.snb.2019.01.046 |
| 203 | 405/530 | 79.0 nM | 10 分钟 | 关-开 | PET | 10.1016/j.snb.2022.132840 |
| 204 | 405/530 | 50.6 nM | 10 分钟 | 关-开 | PET | 10.1016/j.snb.2022.132840 |
| 205 | 405/530 | 104 nM | 10 分钟 | 关-开 | PET | 10.1016/j.snb.2022.132840 |
| 206 | 350/510 | 0.039 μM | n.d. | 开-关 | 配位 | 10.1021/acsnano.0c01899 |
| 207 | 350/440 | 0.57 μM | n.d. | 关-开 | 配位 | 10.1021/acssuschemeng.9b03281 |
| 208 | 365/472, 573 | 20 nM | 0.5 小时 | 比率 | AIE | 10.1002/adfm.201802833 |
| 209 | 390/516 | Fe³⁺(0.124 nM)/Fe²⁺(0.138 nM) | 1 小时 | Fe³⁺(关-开) Fe²⁺(开-关) | PET | 10.1016/j.carbpol.2018.03.073 |
| 210 | 320/548, 618 | 3.8 μM | n.d. | 关-开 | 配位 | 10.1007/s42114-022-00547-7 |
| 211 | 405/525 | 129.3 nM | n.d. | 关-开 | PET | 10.1016/j.bios.2022.114083 |
| 212 | 405/525 | 77.35 nM | n.d. | 关-开 | PET | 10.1016/j.bios.2022.114083 |
| 213 | 405/525 | 132.5 nM | n.d. | 关-开 | PET | 10.1016/j.bios.2022.114083 |
| 214 | 375/546 | 950 nM | n.d. | 开-关 | 配位 | 10.31635/ccschem.021.202000737 |
| 215 | 365/478 | 1.63 mM | 264.6 ms | 开-关 | 配位 | 10.1039/D4TA00356J |
缩写:无数据 (n.d.), 聚集诱导发光 (AIE), 光诱导电子转移 (PET)。
5.3.1.2. 基于配位相互作用的Fe³⁺荧光成像策略
Lin及其同事利用简单的硫醇-烯“点击”反应构建了咪唑功能化的聚硅氧烷。他们设计并合成了一种荧光探针 201,用于连续检测Fe³⁺离子循环。 探针 201 在365 nm激发下发出荧光,并对Fe³⁺表现出顺序响应,促进了活细胞成像中细胞内Fe³⁺循环的监测。荧光的猝灭和恢复是由咪唑基团与Fe³⁺的配位以及随后与氨基酸的配体交换引起的。该探针在HeLa细胞中表现出良好的生物相容性和细胞通透性,并成功用于监测细胞内Fe³⁺和Cys的循环。
Gomes及其同事采用简便的一锅水热和溶剂热法,利用含氮前体酞菁,制备了用于Fe³⁺传感的激发无关碳点(探针 202)。 探针与Fe³⁺之间的相互作用导致荧光猝灭,这归因于探针表面官能团与金属离子之间的配位反应,这增加了激子非辐射复合的可能性。该探针成功用于MCF-7细胞中内源性Fe³⁺的检测和成像。
通过利用半乳糖作为肝细胞靶向配体,三苯基膦作为线粒体靶向部分,以及吡啶-哌嗪衍生物作为荧光团骨架,Wang及其同事设计了三种具有肝细胞和线粒体双重靶向性的荧光探针(203, 204, 205),用于Fe³⁺监测。 通过利用吡啶和糖簇的光诱导电子转移效应的抑制,实现了荧光的关-开行为。在HepG2细胞中,该探针有效检测了线粒体Fe³⁺。小鼠体内研究表明,该探针能够选择性地靶向肝脏而非其他主要器官。
5.3.1.3. 基于电子转移的Fe³⁺荧光成像策略
Wu及其同事利用机器学习技术和XGBoost回归模型来预测和优化基于碳点(图66)的荧光探针 206 的合成。 通过水热合成法制备的探针表现出强烈的绿色发射和高达39.3%的高量子产率。该探针在0-150 μM的宽浓度范围内对Fe³⁺表现出线性响应,检测限为0.039 μM。

图 66. 探针 206 与Fe³⁺反应的示意图。
5.3.1.4. 基于静电相互作用的Fe³⁺荧光成像策略
Liu及其同事采用原位绿色合成方法,以五味子多糖为唯一碳源和氮掺杂,制备了用于Fe³⁺可视化检测的室温磷光材料(探针 207,图67)。 该探针在0.1-2 mM的浓度范围内对Fe³⁺表现出反向结合,检测限为0.57 μM。探针表面的C=N/C=O基团通过氢键与基质中的羟基相互作用,抑制了非辐射跃迁并稳定了三重态,从而实现了室温磷光。这种磷光源于C=N/C=O基团,它们促进了n-π*跃迁并增强了系间窜越 (ISC) 速率,导致三重态激子的产生。凭借优异的光学和物理稳定性,该薄膜被用作检测Fe³⁺离子的可见室温磷光探针。
图 67. 探针 207 的示意图。
5.3.1.5. 基于水解反应的Fe³⁺荧光成像策略
Tang及其同事开发了一种四苯乙烯衍生的荧光探针 208(图68),通过分子内电荷转移效应表现出pH依赖性和比率荧光特性。 该探针具有邻位取代的吡啶功能,表现出独特的AIE特性。探针的荧光响应受其与Fe³⁺的特异性结合,随后由于Fe³⁺水解导致溶液pH降低而引起的探针质子化所控制。它在溶液中发出微弱的蓝光,但在Fe³⁺存在下表现出强烈的橙红色荧光。在HeLa和MCF-7细胞中的细胞成像研究显示,在Fe³⁺暴露下,既有蓝色荧光也有红色荧光,红色荧光的强度与Fe³⁺浓度成正比增加。 
图 68. 基于水解反应(探针 208)和其他反应机理(探针 209–214)的部分Fe³⁺荧光探针。
5.3.1.6. 基于其他反应机理的Fe³⁺荧光成像策略
Ganguly及其同事开发了一种基于壳聚糖结构的荧光水凝胶探针 209,它抑制了光诱导电子转移过程,用于选择性检测和区分水溶液中痕量的Fe³⁺/Fe²⁺。 探针在516 nm处的荧光强度在与Fe³⁺相互作用后显著增强,而在与Fe²⁺形成π-配合物后表现出强烈的猝灭。同样,在活细胞中,该探针对Fe³⁺表现出增强的响应,对Fe²⁺表现出猝灭的响应。细胞毒性测定显示,该探针在5 μg/mL的浓度下对HepG-2细胞的毒性小于20%,表明其细胞毒性较低。
Tang及其同事使用羧化聚(芳醚醚酮)作为载体,通过静电纺丝技术制备了一种用于检测Fe³⁺离子的纳米纤维膜。 探针 210 功能化的纳米纤维膜在紫外线照射下发出强烈的红色荧光,并表现出优异的荧光稳定性。Fe³⁺离子的加入显著猝灭了纳米纤维膜的红色荧光,检测限为3.8 μM。并且纳米纤维膜在超过10个循环中对Fe³⁺离子的检测表现出优异的可重复使用性能。该纳米纤维膜还可应用于实际湖水中Fe³⁺离子的检测,通过离子与羧化聚合物和1,10-菲咯啉形成的配位聚合物结构,实现了对Fe³⁺离子的高度选择性和灵敏检测。
Wang及其同事通过结合半乳糖和咪唑,设计了三种对Fe³⁺具有良好选择性和灵敏度的双靶向荧光探针(211, 212, 213)。 探针与Fe³⁺的结合模式为1:2。探针与Fe³⁺的结合导致萘酰亚胺的PET效应被抑制,从而恢复了1,8-萘酰亚胺的强荧光。该探针在细胞和组织水平上对Fe³⁺表现出良好的响应,并具有肝脏和溶酶体的双重靶向能力,这对于准确诊断和治疗肝脏溶酶体铁相关疾病具有重要意义。
Li及其同事合成了一种荧光/比色双模态探针 214,用于检测Fe³⁺。 该探针在各种溶剂中表现出高效率和最小的溶剂极性依赖性。该探针是通过将三个(2,4,6-三氯苯基)甲基自由基部分与两个α-吡啶酮咪唑烷和两个δ-吡啶酮咪唑烷单元共价连接合成的。这些自由基促进了纯红色发射,并在多种溶剂中表现出高光致发光量子产率,且受溶剂极性影响最小。探针对Fe³⁺的荧光猝灭和比色响应可归因于Fe³⁺与自由基形成螯合物。探针与Fe³⁺相互作用时的静态荧光猝灭表明与自由基形成了基态复合物。掺杂该探针的有机发光二极管表现出纯红色发射,最大外量子效率为10.6%。
Zhang及其同事开发了一种基于镉的金属-有机框架(探针 215,图69),用于Fe³⁺的持续检测。 该探针显示出蓝绿色的室温磷光,寿命为264.6 ms。利用Fe³⁺的余辉“关闭”特性,该探针通过框架分解机理选择性地检测Fe³⁺离子,检测限为1.63 mM。Fe³⁺的检测是通过框架分解机理实现的,其中探针的持续特性通过改变配体和金属离子之间的结合模式来调节。这项工作为开发基于MOF的余辉探针提供了机会,展示了在生物成像、信息加密、光学和传感等领域的潜在应用。
图 69. 探针 215 的结构。
5.3.2. 铁(II)的荧光成像
5.3.2.1. 基于N-O裂解反应的Fe²⁺荧光成像策略
Tang及其同事设计了一种水溶性氧探针 216(图70,表16),用于基于AIE效应的缺氧成像,使用带有N-氧化物基团的四苯乙烯。 AIE活性的TPE基团与中性离子N-氧化物官能团的结合导致这些N-氧化物在分子分散状态下具有非发射特性。在加入Fe²⁺后,N-氧化物表现出不同的荧光响应,这可归因于存在不同的取代基。这些观察结果表明,基于TPE的N-氧化物可以为基于AIEgen的治疗系统提供一种新颖的方法。
图 70. 基于N-O裂解反应的部分Fe²⁺荧光探针。
表16. 部分Fe²⁺荧光探针
| 探针 | λex/λem (nm) | 检测限 | 响应时间 | 响应类型 | 响应机理 | 参考文献 |
|---|---|---|---|---|---|---|
| 216 | 380/430, 560 | n.d. | 30 分钟 | 关-开 | AIE | 10.1002/adfm.201903278 |
| 217 | 505/700 | 51 nM | 10 分钟 | 关-开 | ICT | 10.1016/j.snb.2020.127796 |
| 218 | 430/675 | 75 nM | 0.5 小时 | 关-开 | FRET | 10.1016/j.snb.2022.132512 |
| 219 | 450/540 | 89 nM | 50 秒 | 关-开 | ICT | 10.1016/j.dyepig.2019.108065 |
缩写:无数据 (n.d.), 分子内电荷转移 (ICT), 聚集诱导发光 (AIE), Förster共振能量转移 (FRET)。
Feng及其同事报道了一种基于N-氧化物的近红外探针 217,用于在水溶液、活细胞和体内有效检测和可视化Fe²⁺。 该探针展示了卓越的近红外荧光生物成像能力,能够在活细胞脂滴和活体受试者中可视化Fe²⁺。这凸显了该探针在亚细胞器和体内Fe²⁺成像中的应用潜力,强调了该探针在推进活体系统中Fe²⁺动态研究方面的巨大潜力。
Feng及其同事利用N-氧化物化学原理,设计了一种基于FRET系统的近红外比例荧光探针 218。 与Fe²⁺反应后,探针发生还原,恢复二氰基异佛尔酮单元的荧光并激活FRET系统,从而导致荧光信号比率的后续变化。该探针能够成像药物诱导的肝损伤 (DILI) 模型中Fe²⁺的变化,从而有助于评估DILI治疗药物的治疗效果。Zhu及其同事合理构建了一种荧光探针 219,通过将氮氧化物还原为羟胺,实现了对生物系统中Fe²⁺的选择性检测。 该探针表现出在0-5 μM浓度范围内检测Fe²⁺的能力,检测限为89 nM。值得注意的是,它表现出快速的Fe²⁺结合动力学,在50秒内达到响应,使其成为迄今为止报道的响应速度最快的探针之一。此外,利用该探针的成像研究证实了其在监测活细胞和斑马鱼中动态Fe²⁺波动方面的有效性,从而证实了其在生物系统中实时追踪铁物种的潜力。
5.4. 简要总结
氧化还原活性金属荧光成像的最新进展产生了一系列具有更高灵敏度、选择性和时空分辨率的探针。对于Cu²⁺,基于配位相互作用、螺内酰胺开环、C-O键裂解、水解和其他反应机理的创新策略已经出现,实现了生理条件下的靶向检测。相比之下,Cu⁺成像主要依赖于软配体配位和氧化还原触发的反应,以应对其较低氧化态和高反应性的挑战。对于Fe³⁺,已开发出多种识别策略,包括氨基相互作用、配位、电子转移、静电相互作用和水解,以解决其强顺磁性和易于猝灭荧光的倾向。探索较少的Fe²⁺检测主要集中在基于N-O键裂解的探针上,突显了对更多氧化还原特异性设计的需求。尽管取得了这些进展,但在复杂生物环境中实现高选择性、最小化其他金属离子的干扰以及实现可逆和比率响应方面仍然存在局限性。未来的方向可能包括开发多模态和细胞器特异性探针、可逆的氧化还原可切换系统以及整合人工智能辅助设计和机器学习引导筛选的体内成像平台,以加速探针优化和生物学应用。
6. 结论与展望
近年来,主要在荧光成像技术的推动下,对细胞氧化还原调控及其在健康和疾病中作用的理解取得了显著进展。细胞内氧化剂和抗氧化剂之间的微妙平衡现在越来越被认为是维持细胞稳态、调节信号通路以及调节蛋白质翻译后修饰和新陈代谢等过程的关键因素。这种平衡的破坏现在被认为是多种疾病发病机制的关键因素,凸显了氧化还原平衡在维持细胞功能和机体健康中的重要性。
毫无疑问,荧光成像通过提供对活细胞和组织内氧化还原变化时空动态的实时、高分辨率洞察,在推进氧化还原研究方面发挥了变革性作用。氧化还原敏感荧光探针的最新进展,加上超分辨率显微镜和多重成像等成像技术的进步,使得对细胞氧化还原状态的理解更加精确和全面。这些创新使得研究人员能够实时追踪氧化剂和抗氧化剂,揭示了关于氧化还原相关疾病机制、信号网络和潜在治疗靶点的新见解。
在本综述中,我们重点关注参与维持氧化还原的生物分子及其潜在的调节机制,特别是那些与蛋白质翻译后修饰相关的机制,同时概述了用于检测氧化还原生物标志物的荧光探针的最新进展。它涵盖了探针的设计策略,以及能够在活细胞、组织和生物体中精确、实时监测氧化还原动态的传感机制。此外,还描述了探针在生物成像中日益增长的应用,特别强调了与氧化还原相关的疾病。尽管荧光探针的开发取得了显著进展,但该领域仍然存在一些挑战,我们认为其中最突出的是以下几点:
缺乏对细胞内活性分子和蛋白质翻译后修饰的精确时空检测。 细胞生物学最重要的挑战之一是缺乏能够以高时空分辨率准确检测和追踪细胞内氧化还原活性物质及其蛋白质翻译后修饰的探针。这些氧化还原物质及其相关的蛋白质修饰通常是动态的,并对外部信号迅速发生反应,这使得在其实际细胞环境中进行实时研究变得困难。此外,这些事件的瞬时性意味着即使是高度灵敏的检测方法也常常错过关键的时间窗口。
氧化还原物质可以与DNA、RNA和蛋白质相互作用以调节其功能并促进细胞信号通路。 然而,精确成像和理解这些氧化还原分子与生物大分子之间的相互作用,特别是在疾病背景下,仍然是一个存在显著差距的领域。目前仍然缺乏对氧化还原相互作用如何调节细胞功能并导致疾病机制的全面理解。缺乏能够以时空分辨率实时监测这些相互作用的工具,使得研究它们在健康和疾病中的作用变得困难。
类器官,即模仿器官结构和功能的三维细胞培养模型, 近年来因其能够比传统二维培养更真实地复制生理相关条件而受到广泛关注。虽然类器官可以模仿组织结构,但这些模型内细胞通讯、信号传导和行为的复杂性尚未完全理解。这些模型仍需进一步发展,特别是在研究细胞间相互作用方面。此外,将这些模型与更先进的评估细胞功能和对疾病响应的技术相结合,可以增强它们在药物发现和疾病建模中的效用。
设计不仅灵敏、特异,而且生物相容且对活体生物无毒的探针仍然是一个挑战。 开发具有深层组织穿透性的探针对于推进我们对体内生物学的理解至关重要。传统的荧光探针由于生物组织中的光散射和吸收而面临显著的局限性,这将其穿透深度限制在几毫米之内。为了解决这个问题,需要能够更有效地穿透组织同时保持高灵敏度和低背景噪声的长波长探针。在近红外 (NIR) 或第二近红外 (NIR-II) 区域工作的探针因其能够以最小的散射穿过组织而显示出潜力。此外,开发能够同时检测多个生物标志物的多组分探针将为活体生物中细胞和组织动态提供更全面的视角。此类探针对于追踪疾病进展、评估药物疗效和实时研究组织功能可能具有不可估量的价值。
除了荧光成像,将氧化还原响应探针与其他诊断模式相结合具有巨大潜力。 例如,将氧化还原激活系统与超声成像相结合将提供一种无创且深层组织的成像替代方案,可以补充光学方法有限的穿透深度。氧化还原敏感的超声造影剂的开发可能能够动态监测深层组织中的氧化应激,从而拓宽基于氧化还原的诊断方法的临床适用性。此外,在易于获取的生物液体(如血液和尿液)中检测与氧化还原相关的生物标志物,为早期诊断和疾病监测提供了一种微创策略。未来的研究应探索开发能够量化这些液体中氧化还原活性物质及其副产物的高灵敏度和选择性探针或传感器。此类进展可能为即时检测平台铺平道路,促进患者氧化还原状态的实时评估并支持个性化治疗策略。
虽然荧光探针在实验室研究中取得了显著进展,但其向临床应用的转化仍面临若干挑战。 首先,必须严格测试这些探针在活体生物中的生物相容性和安全性,以确保它们不会引起不良反应。此外,必须针对临床场景优化探针的灵敏度和特异性,因为在这些场景中,检测低丰度的生物标志物或细胞事件对于准确的诊断和治疗至关重要。另一个主要障碍是将实验室发现转化为实际应用的困难,因为临床条件可能与受控的实验室环境有很大不同。为了应对这些挑战,需要继续开发不仅有效而且易于适应临床工作流程的探针。克服这些障碍对于实现荧光探针在临床诊断、疾病监测和个性化医疗中的全部潜力至关重要。
总之,这些挑战凸显了在实时分子成像、氧化还原生物学、类器官建模和临床转化等多个领域创新的迫切需求,这些不仅是障碍,也为研究探索开辟了入口。我们相信,荧光探针的持续改进将提高氧化还原物质追踪的准确性,并提供对氧化还原物质生理调节作用的更深入理解,从而为疾病发病机制的研究、早期诊断和药物疗效评估做出重大贡献。