【疾病诊断荧光探针】用于神经系统疾病诊断的荧光探针
Fluorescent Probes for Disease Diagnosis
疾病诊断荧光探针
大脑和脊髓作为人体的中枢神经系统,与附属神经系统一同在人类生物学的各个方面发挥着核心指挥作用。 鉴于大脑和神经功能的微妙变化可能引发广泛的问题和损伤,精确且及时地监测关键生物标志物的动态变化显得尤为重要。 为此,科研人员致力于开发多种针对神经系统疾病的标志物荧光探针(见表1中的部分示例),以期改善这些疾病的诊断和治疗。
本节将详细阐述针对阿尔茨海默症(AD)、癫痫、威尔逊病(WD)、帕金森病(PD)、抑郁症以及中风等神经系统疾病的荧光探针。此外,我们还将探讨用于胶质瘤检测的纳米荧光探针,因为它们代表了该领域未来发展的重要新趋势,充满了无限的可能性.
表1. 神经系统疾病的荧光探针
| probe | λex/λem (nm) | LOD | bioactive molecule | biological model |
|---|---|---|---|---|
| Alzheimer’s Disease | ||||
| 1 | 565/635 | Aβ fibrils | arcAβ mice | |
| 2 | 453/580 | Aβ aggregates | HeLa cells, U87 cells, APP/PS1 transgenic mice | |
| 3 | 490/574 | 0.17 μM | H2O2 | N2aSW cells, 5XFAD mice |
| 4 | 560/589 | 45 nM | NO | HepG2 cells, SH-SY5Y cells |
| 5 | 602/702 | 3.4 nM | ONOO– | PC12 cells, AD mouse |
| 6 | 656/690 | 1.08 μg·mL–1 | BChE and ROS | HEK293 cells, APP/PS1(B6) mice |
| 7 | 600/710 | 16.8 nM | NFTs/Tau | SH-SY5Y cells, Tg-Tau mice |
| Epilepsy | ||||
| 8 | 440//700 | 20.8 nM | Cys | BALB/c nude mice |
| 9 | 540/750 | 43 nM | Cys in LDs and mitochondria | chronic epilepsy mice |
| 10 | 460/685 | 151 nM | ONOO– | HT22 cells, rat epilepsy models |
| 11 | 440/635 | 64.3 μM | norepinephrine | PC12 cells, epileptic mice |
| Wilson’s Disease | ||||
| 12 | 670/800 553/– 823/– | 80 nM | Cu2+ | urine of WD patients |
| 13 | 310/415 | 2.60 μM, 0.31 μM, 0.05 U/mL | Cu2+, pyrophosphate, alkaline phosphatase | HeLa cells |
| Depression | ||||
| 14 | 700/780 | polarity | PC12 cells, C57BL/6J mice | |
| 15 | 520/560 | 0.36 μM | AChE | PC12 cells, mice |
| 16 | 390/460 | 0.32 μM | Zn2+, H+ | PC12 cells, C57 mice |
| 17 | 340/443 | 0.16 μM | Cys | PC12 cells, C57BL/6J mice |
| 18 | 378/490 | 46 nM | Cys | HEK293 cells, depression mouse model |
| 19 | 370/500 | 2.4 μΜ | OH• | PC12 cells, C57BL/6J mice |
| 20, 21 | 370/445; 610/670 | 2.413 mM (MI), 0.453 mM (LY) | H2O2 | PC12 cells, C57BL/7J mice |
| 22 | 570/690 | 10 nM | O3 | RAW 264.7 cells, CUMS (chronic unpredictable mild stress) mouse model |
| 23 | 620/685 | 222 nM | HClO | RAW 264.7 cells, PC12 cells, C57BL/6J mice |
| 24 | 400/505 | 15 nM | HClO | PC12 cells, RAW 264.7 macrophages, zebrafish, mice |
| 25 | 365/440,510 | 0.13 μM (MDA), 0.11 μM (FA) | malondialdehyde (MDA); formaldehyde (FA) | PC12 cells, C57 mice |
| 26 | 720/750 | norepinephrine | PC12 cells, depression mouse model | |
| 27 | 580/724 | norepinephrine | PC12 cells | |
| Parkinson’s Disease | ||||
| 28 | 438/503 | 25.8 nM | HClO | SH-SY5Y cells, drosophila, PD mouse |
| 29 | 510/670 | 4.59 nM | ONOO– | PC12 cells, SH-SY5Y cells, Parkin null Drosophila, WLZ3 C. elegans |
| 30 | 395/500,650 | 0.27 μM | H2O2 | living cells, zebrafish and Drosophila |
| 31 | 630/770 | 0.48 μM | formaldehyde | PC12 cells, PD zebrafish, PD mice |
| 32 | 385/516 | viscosity, hydrogen sulfide | HeLa cells, PD mouse | |
| 33 | 343/464 | 0.4 μM | H2S | HeLa cells, DJ-1-KO mice |
| 34 | 335/438 | methionine sulfoxide reductase | PC 12 cells | |
| Stroke | ||||
| 35 | 500/557 | ONOO– | RAW 264.7 cells, LPS-induced kidney injury of zebrafish | |
| 36 | 475/545 | 0.5 nM | ONOO– | EA.hy926 endothelial cells, intra_x005fluminal middle cerebral artery occlusion (MCAO) model |
| 37 | 416/495 | 63.4 nM | viscosity/ONOO– | BV-2 cells, MCAO model |
| 38 | 410/675 | viscosity | BV-2 cells, MCAO model | |
| 39 | 440/544 | 0.017 μM | Fe2+ | astrocyte cells, rat’s ischemic brain tissue |
| 40 | 370/490 | thioredoxin reductase | HeLa cells, zebra_x005ffishes, brain of mice with cerebral ischemia reperfusion injury (CIRI) | |
| 41 | 430/646 | 1.3 nM | H2S | PC12 cells, MCAO in living mice model |
| 42 | 490/510 | 4.3 nM | glutathione | PC12 cells, MCAO in living mice model |
| 43 | 736/1036 | vascular | C57BL/6 mice, stroke mice model | |
| Glioma | ||||
| 44 | 980/448 | N/A | U87MG cells, BCECs cells, glioblastoma-bearing mice | |
| 45 | 680/710 | N/A | tiny brain glioma mice model | |
| 46 | 450/540 | N/A | GBM cells, heterotopic glioma model | |
| 47 | 745/800 | N/A | tumor-bearing mice | |
| 48 | 600/635 | N/A | C6 cells, L929 cells, glioma-bearing mice | |
| 49 | 395/459 | N/A | U87 cells, bEnd.3 cells, U87 cell xenograft-bearing mice | |
| 50 | 808/1055 | N/A | C6 cells, glioma-bearing mouse | |
| 51 | 330/605 | A32 DNA | U87 cells, HUVEC cells, human glioma tissues, orthotopic brain glioma model in mice | |
| 52 | 488/525 | N/A | C6 cells, glioma-bearing mouse | |
| 53 | 550/570 | N/A | C6 cells, bend.3 cells, glioblastoma bearing mice | |
| 54 | 808/1060,1340 | N/A | U87-Luc cells, the tumor-bearing mice | |
| 55 | 397/1064 | N/A | C6 cells, C57BL/6J mice |
【神经疾病诊断探针】用于阿尔茨海默症诊断的荧光探针
Fluorescent Probes for Disease Diagnosis
疾病诊断荧光探针
阿尔茨海默症(AD)是一种逐渐恶化的脑部疾病,严重影响个体的记忆、思维和行为能力,最终引发痴呆、严重的认知衰退及生活质量的显著降低。AD作为一种复杂的疾病,其确切的发病机制尚未明晰,但当前研究普遍认为,大脑中特定蛋白质(特别是淀粉样蛋白β,简称Aβ)的异常累积是疾病发展的关键。这些异常累积的蛋白质会形成淀粉样蛋白斑块,进而导致组织细胞的死亡和神经网络的严重损伤。因此,在AD的诊断和研究中,荧光探针(如图2所示)被广泛应用于检测典型的生物标志物,如Aβ以及氧化应激的一般生物标志物,如活性氧(ROS)和活性氮(RNS),这些标志物对于理解疾病进程和评估治疗效果具有重要意义。 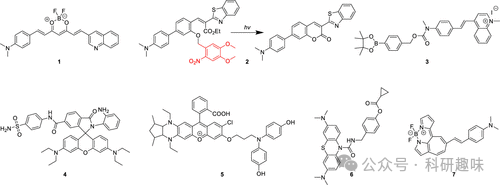 图 2.部分阿尔茨海默症荧光探针。
图 2.部分阿尔茨海默症荧光探针。
Aβ是一种由36至43个氨基酸组成的多肽,通过β和γ分泌酶对淀粉样前体蛋白(APP)的水解作用生成。其异常沉积形成淀粉样斑块,与阿尔茨海默症(AD)的发病和疾病进展密切相关。Aβ特异性荧光探针的最新进展之一是由Qian及其团队在2021年开发的姜黄素衍生物探针1。这款探针能够利用多光谱光声断层扫描和荧光成像技术,对脑淀粉样变性进行精准检测。研究表明,探针1不仅能特异性地定量检测Aβ纤维,还能有效区分这些纤维与Aβ的单体形式。免疫组化分析进一步证实,在arcAβ小鼠的脑切片中,探针1与Aβ沉积物共定位,凸显了其高度的特异性。探针1在AD病理动物模型中的成功应用,为纵向监测Aβ治疗效果和揭示疾病演变机制提供了有力工具。
同样值得关注的是,Wang等人在2022年开发的探针2。该探针采用“光触发”荧光机制,能够检测Aβ聚集。在光照条件下,探针2中的6-硝基藜芦酰保护基团发生光裂解,导致酚基环化至邻近的酯上,进而产生荧光香豆素核心。这一新形成的荧光团虽荧光较弱,但结合Aβ后能产生强烈的局部荧光反应。实验证实,探针2在APP/PS1转基因AD模型小鼠体内能有效检测Aβ聚集,且光照后血脑屏障(BBB)通透性良好。这种创新的“光触发”方法为设计高信噪比、靶向特定蛋白质的荧光探针提供了新的思路。
氧化应激作为导致注意力缺失症的重要因素之一,由ROS或RNS的产生和积累失衡所引发。2023年,Wong及其合作者开发了荧光探针3, 该探针不仅能靶向Aβ,还能实时响应活细胞和AD小鼠模型中过氧化氢(H2O2)浓度的变化。探针3采用甲基喹啉鎓荧光单元和苯硼酸频哪醇酯(BPin)作为H2O2识别单元,具有较长的荧光波长(λem = 574 nm),适用于直接定位Aβ。一旦与斑块结合,探针3便能迅速与H2O2反应,氧化BPin并释放出新物种,该物种在更长波长(λem = 660 nm)下发光,从而实现对Aβ位点H2O2浓度变化的比率可视化和测量。研究显示,探针3能成功地对神经元细胞和AD小鼠模型中Aβ物种诱导的过氧化氢含量变化进行实时成像。
2022年,Ma及其同事开发了高尔基体靶向荧光探针4, 该探针能够检测AD小鼠体内的一氧化氮(NO)。探针4由6-羧基罗丹明B荧光团、4-氨基苯磺酰胺高尔基体靶向基团和邻二氨基苯NO传感基团组成。这款探针在检测NO方面展现了出色的高尔基体靶向能力和高特异性。利用探针4,研究人员发现Aβ诱导的AD中高尔基体内的NO水平显著升高。因此,探针4为高尔基体内NO的原位成像提供了宝贵的新工具,有助于揭示NO在疾病相关信号通路中的关键作用。此外,该探针还展示了荧光探针的“模块化设计概念”,通过替换2-羧基反应基团为其他生物靶向单元,即可识别不同的生物分析物,实现对高尔基体中多种生物分子的可视化。
Kim及其合作者于2022年发明了探针5, 这是一款用于检测过氧化亚硝酸盐(ONOO-)的近红外荧光探针。探针5采用二氨基取代的罗多染料NIR-Rd-3作为荧光团,结合4-氨基苯酚基团作为ONOO-的识别单元。通过探针5,研究人员成功实现了对AD小鼠体内ONOO-的原位成像(图3),并证明了ONOO-可作为AD的生物标志物。 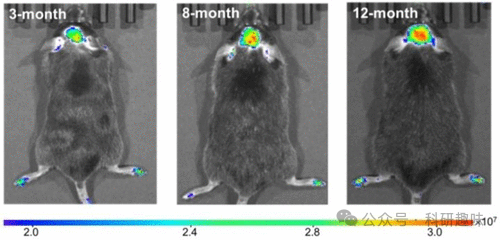 图 3.不同年龄(3、8 和 12 个月)的 AD 小鼠通过尾部注射探针 5 进行体内荧光成像,显示随着年龄的增长,大脑中 ONOO- 的浓度也在增加。
图 3.不同年龄(3、8 和 12 个月)的 AD 小鼠通过尾部注射探针 5 进行体内荧光成像,显示随着年龄的增长,大脑中 ONOO- 的浓度也在增加。
在AD的诊断和研究中,丁酰胆碱酯酶(BChE)作为一个显著的靶点,其水平在疾病进程中呈现上升趋势。2021年,Ding等人巧妙设计并合成了基于BChE和ROS双“逻辑门”的荧光探针6。该探针融合了BChE特异性环丙基甲酸酯基团以及酰胺/酯键作为ROS反应基团,仅在同时与ROS和BChE反应时才会触发荧光信号,从而实现了高选择性和高灵敏度的双分析检测(LOD = 1.08 μg·mL⁻¹)。值得一提的是,Ding等人还深入探讨了具有不同连接长度的类似荧光团,并最终发现脲基和酚基之间的单亚甲基单元为最佳选择。
神经纤维缠结(NFTs),由异常高磷酸化的tau蛋白构成,是AD及其他tau病的典型特征之一。为了实现对NFTs的高特异性成像,Cui及其合作者在2022年研发了融合环庚三烯-BODIPY衍生物的荧光探针7。研究表明,探针7不仅能有效穿越血脑屏障(BBB),还能与NFTs特异性结合,从而在tau小鼠的大脑中清晰地识别NFTs。这一创新性的荧光探针为NFTs的成像研究提供了有力的工具。
【神经疾病诊断探针】用于癫痫诊断的荧光探针
Fluorescent Probes for Disease Diagnosis
疾病诊断荧光探针
荧光探针在癫痫研究中已成为一种备受青睐的方法(如图4所示),癫痫作为一种神经系统疾病,其特征在于脑电活动的异常紊乱,进而引发不受控制的癫痫发作或抽搐。癫痫发作的临床表现多样,包括但不限于意识丧失、肌肉痉挛以及感觉障碍等。然而,遗憾的是,癫痫的治疗仍然面临诸多挑战,迫切需要开发新的、更有效的治疗方法。这种迫切的需求推动了荧光探针在癫痫成像及其病理机制理解方面的深入研究。通过荧光探针技术,我们能够更深入地了解癫痫在分子和细胞层面的变化,为开发新的治疗方法提供重要依据。 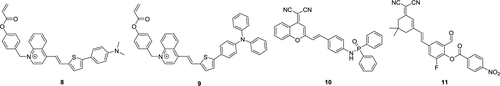 图 4.部分癫痫荧光探针。
图 4.部分癫痫荧光探针。
癫痫,与注意力缺失症相似,其显著特征之一是大脑内氧化应激的加剧。在研究氧化应激的过程中,硫醇半胱氨酸(Cys)作为一个关键生物还原剂,直接参与细胞内ROS(活性氧物种)的调节,因此备受关注。有研究表明,血浆中半胱氨酸水平的降低可作为颞叶癫痫的生物标志物,这暗示了持续存在的氧化应激状态。
2020年,Li及其合作者报道了一种名为探针8的近红外发射成像探针,该探针能够追踪戊四唑(PTZ)诱导癫痫发作期间大脑中的内源性Cys。探针8的设计基于Mito-Q荧光团,并融入了N,N-二甲基氨基电子供体、喹啉阳离子电子受体(形成推拉式分子内电荷转移(ICT)结构)以及丙烯酸酯结构(作为Cys识别位点)。探针8展现出优异的血脑屏障(BBB)穿透性,通过静脉注射后能迅速进入大脑,进而绘制Cys的分布图。
在多种生物模型中,包括培养细胞、斑马鱼和小鼠,探针8均能有效检测Cys浓度的变化,无论是外部添加的还是氧化应激引起的内源性变化(如图5所示)。这些发现为理解线粒体Cys水平与癫痫的发病、进展以及治疗策略之间的关系提供了新的视角。 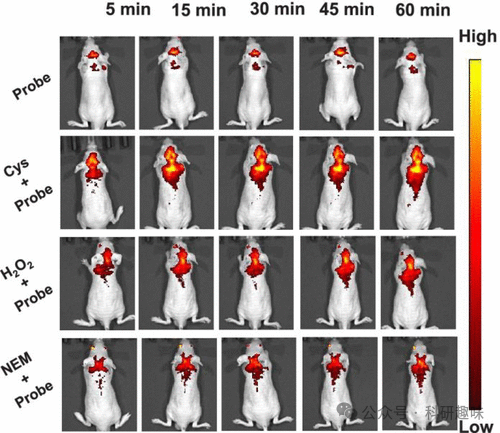 图 5.活体小鼠腹腔注射各种影响 Cys 的制剂后,用探针 8 绘制 5、15、30、45 和 60 分钟的 Cys 通量图。
图 5.活体小鼠腹腔注射各种影响 Cys 的制剂后,用探针 8 绘制 5、15、30、45 和 60 分钟的 Cys 通量图。
在Cys成像的荧光机制中,聚集诱导发光(AIE)技术备受关注,它特指分子在聚集或接近时发光的现象。基于此原理,He等人于2023年研发了探针9, 这是一种基于AIEgen的双通道Cys响应近红外荧光探针,旨在实现脂滴和线粒体的特异性成像。探针9的设计结构类似于探针8,包含三苯胺基团作为脂滴靶向分子、喹啉基团作为线粒体靶向分子,以及丙烯酸酯基团以实现Cys的特异性识别。利用探针9,He等人通过免洗荧光生物成像技术,成功监测了细胞凋亡过程中线粒体和脂滴中的Cys水平(双通道)。在癫痫患者的细胞凋亡事件研究中,探针9揭示了线粒体Cys在癫痫中的重要作用,为癫痫的治疗和诊断提供了新的潜在靶点。
作为氧化应激的关键标志物之一,ONOO-的过表达在癫痫早期诊断中展现出极高的信息价值。为此,Yu及其合作者于2021年设计了一种近红外荧光探针10,用于追踪细胞和体内ONOO-水平的变化。该探针由近红外二氰基亚甲基-4H-吡喃(DCM)荧光团单元和二苯基膦酰胺识别分子构成。当暴露于ONOO-时,膦酰胺的P-N键断裂,释放出的苯胺为荧光系统提供自由电子,导致在685纳米波长处的荧光发射显著增强。探针10在癫痫模型大鼠的海马中成功追踪了内源性ONOO-,尤其在凯因酸盐诱导的癫痫模型中表现出色。此外,该探针还用于评估抗氧化剂白藜芦醇的效果,随着药物浓度的增加,荧光强度显著降低,表明ONOO-的过表达得到有效抑制。因此,探针10为实时监测神经组织中ONOO-的波动提供了强大工具,进一步助力癫痫疾病的诊断。
最后,去甲肾上腺素(NE)作为多种神经系统疾病的关键生物标志物,包括癫痫,因其在神经递质调节中的核心作用而备受关注。Yin等人于2023年采用了一种创新的“狩猎-射击”设计策略,通过探针11克服了NE检测中特异性不足的难题。探针11的荧光团基于2-(环己-2-烯-1-亚基)丙二腈衍生物,并配备了一个悬挂的醛作为反应单元。醛与NE反应后,4-硝基苯甲酸酯荧光掩蔽基团脱落,释放出高荧光性物质。这种探针能够高效穿透BBB,用于观察癫痫前后小鼠大脑内NE释放的动态变化。通过对脑组织的解剖研究,可以绘制出癫痫前后NE在大脑不同区域的分布和水平变化图。
以上案例展示了荧光探针在穿越BBB并有效成像难以感应的生物标志物方面的成功应用,为神经系统疾病的发病机制研究和诊断提供了有力的工具。
【神经疾病诊断探针】用于威尔逊氏病诊断的荧光探针
Fluorescent Probes for Disease Diagnosis
疾病诊断荧光探针
肝细胞变性所引发的威尔逊氏病(WD)是一种典型的常染色体隐性遗传病,其主要特征是铜在体内的异常积累以及尿铜排泄的增加。鉴于尿铜检测在WD患者日常监测中的重要性,Li等人于2018年设计了一种针对Cu2+的比色/荧光双功能探针12(图6中初始形式标记为CY1)。此探针的核心组成部分包括多巴胺基团,它作为Cu2+的特异性配位/检测位点,以及氰基染料作为荧光信号团。
在微酸性环境(pH < 6.8)中,CY1形式的探针12(λex = 670 nm,λem = 800 nm)能够与Cu2+发生氧化反应,生成新的化合物CY2(λex = 553 nm)。而在碱性条件下,CY1则会被氧化为另一种形态CY3(λex = 823 nm)(如图6所示)。由于这三种物质在吸收光谱上表现出显著的差异,因此可以通过紫外-可见-红外光谱技术精确地监测Cu2+的浓度。当Cu2+存在时,不仅会引起溶液颜色的显著变化(表现为吸收光谱的改变),还会导致CY1的荧光信号减弱。
综上所述,探针12展现出了出色的检测性能,是一种高效、有潜力的双模式(比色/荧光)探针,对于监测尿液中的Cu2+水平具有重要的应用价值。 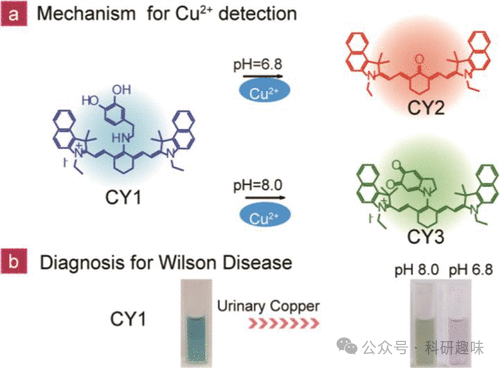 图 6. (a) CY1 在酸性和碱性溶液中被 Cu2+ 氧化成 CY2/CY3。(b) 在 WD 患者的尿液中使用 CY1 作为铜离子检测探针,在检测到 Cu2+ 时会显示由蓝色变为绿色(碱性)或粉红色(酸性)。
图 6. (a) CY1 在酸性和碱性溶液中被 Cu2+ 氧化成 CY2/CY3。(b) 在 WD 患者的尿液中使用 CY1 作为铜离子检测探针,在检测到 Cu2+ 时会显示由蓝色变为绿色(碱性)或粉红色(酸性)。
在威尔逊氏病(WD)的生物学研究中,除了铜离子(Cu²⁺)外,焦磷酸(PPi)和碱性磷酸酶(ALP)也作为重要的生物标志物受到关注。PPi作为三磷酸腺苷(ATP)代谢的副产物,而ALP则参与该转化过程的去磷酸化反应。在WD患者中,常见到PPi浓度升高和血清ALP水平降低的现象,这两种生物标志物在WD的诊断中均具有重要意义。
为了同时检测这三种生物标志物,Schirhagl等人于2019年设计了一种创新的探针13。该探针在体外、活细胞和滑液样本中能够按照“off-on-off”的荧光信号顺序,实现对Cu²⁺、PPi和ALP的选择性检测。探针13的结构设计精巧,采用双齿配体形式,通过亚胺和苯胺氮原子与Cu²⁺螯合,使荧光信号处于“关闭”状态。然而,由于PPi与Cu²⁺的结合亲和力高于探针13,因此当PPi加入时,会导致Cu²⁺与探针解离,引发“点亮”的荧光反应(如图7所示)。随后,ALP的加入会催化PPi的水解反应,破坏PPi-Cu²⁺复合物,释放出的Cu²⁺再次被探针13螯合,导致荧光信号再次“关闭”。
这种独特的荧光“关-开”方法有望为理解Cu²⁺、PPi和ALP在WD中的平衡关系提供有价值的信息,从而助力未来WD的诊断和研究工作。 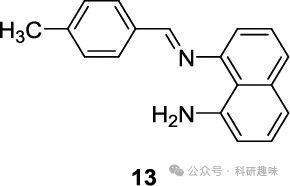 图 7.Schirhagl 等人的探针 13,用于连续检测 Cu2+、PPi 和 ALP。
图 7.Schirhagl 等人的探针 13,用于连续检测 Cu2+、PPi 和 ALP。
【神经疾病诊断探针】用于抑郁症诊断的荧光探针
Fluorescent Probes for Disease Diagnosis
疾病诊断荧光探针
抑郁症,作为一种以持续低落情绪为主要特征的神经系统疾病,给重度患者带来了生活质量的普遍下降以及严重的自残风险。然而,遗憾的是,抑郁症的发病机理尚未明确,这无疑为新疗法(如抗抑郁药物)的开发带来了极大挑战。因此,科研人员正积极投入于研究抑郁症的分子和生物机制,旨在通过开发一系列新型探针,以实现对与抑郁症相关的生物标记物的精准感知、可视化以及追踪(如图8所示)。这些努力将有助于我们更深入地理解抑郁症的病理过程,从而为未来的治疗策略提供科学依据。  图 8.部分抑郁荧光探针。
图 8.部分抑郁荧光探针。
脑源性神经营养因子(BDNF,又称abrineurin)在抑郁症的发病过程中扮演着至关重要的角色。鉴于高尔基体在proBDNF加工中的核心作用,其微环境(特别是极性)被认为与BDNF水平紧密相关,从而推测高尔基体极性的变化可能作为抑郁症发展的一个潜在标志。为了监测这一变化,Tang及其团队在2019年报道了一种半胱氨酸衍生探针14,该探针以高尔基体为靶点,通过美蓝和二氟硼酸苯甲酰分别作为电子供体和受体基团,利用激发态分子内电荷转移(ICT)来检测高尔基体的极性。在极性环境中,由于溶解探针与溶剂间的偶极-偶极相互作用,激发态能量被耗散,导致探针14发出较弱的荧光。相反,在非极性介质中,随着极性的降低,探针14的荧光显著增强。研究发现,抑郁表型小鼠大脑中的高尔基体极性显著高于非抑郁小鼠,这可能导致BDNF合成减少,为抑郁症的诊断提供了新的视角,并为探索其发病机制提供了有力的工具。
另一个与抑郁症紧密相关的因素是乙酰胆碱酯酶(AChE),其抑制剂在缓解某些抑郁症状中展现出潜在价值。为了监测抑郁小鼠大脑中AChE的活性,2019年研究者们开发了一种双光子(TP)荧光探针15。该探针采用新斯的明(neostigmine)作为AChE的识别基团,并结合梅洛青(merocyanine)作为荧光团。探针15在未被激活时显示微弱的荧光,这是因为其苯酚基团被二甲基氨基甲酸酯所掩蔽,削弱了其电子供能能力,从而抑制了基于ICT的推拉电子效应。然而,当探针15与AChE接触时,酯键被裂解/水解,释放出强供体苯酚,从而激活荧光团,产生强烈的荧光信号。探针15对AChE显示出高度的选择性。此外,研究还发现,乙酰胆碱酯酶的活性与抑郁表型呈正相关(图9)。因此,探针15不仅为探索AChE相关疾病提供了有力的工具,还为抑郁症的治疗策略提供了有价值的参考信息。 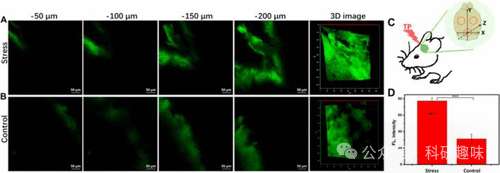 图 9.用探针 15 对应激小鼠(A,连续 14 天的慢性束缚应激)和对照组小鼠(B)大脑进行原位 TP 荧光成像。(C)三种不同的 TP 荧光成像区域示意图。(D)A 和 B 中小鼠的相对荧光强度:480-650 纳米。标尺 = 50 μm。
图 9.用探针 15 对应激小鼠(A,连续 14 天的慢性束缚应激)和对照组小鼠(B)大脑进行原位 TP 荧光成像。(C)三种不同的 TP 荧光成像区域示意图。(D)A 和 B 中小鼠的相对荧光强度:480-650 纳米。标尺 = 50 μm。
N-甲基-D-天冬氨酸(NMDA)受体,作为离子谷氨酸受体的一种关键亚型,不仅作为离子通道蛋白在神经元发育和突触可塑性中扮演核心角色,其活性还受到调节结合伙伴(如Zn²⁺和H⁺)的密切影响,从而影响神经抑制过程。为了深入探究这一关系,2020年成功开发出一种双色荧光探针16,该探针能够同步监测抑郁小鼠大脑中Zn²⁺和H⁺的浓度变化。该探针融合了荧光素作为荧光团,利用DPA(2,2′-二二甲胺)作为Zn²⁺的特异性识别基团,以及萘荧光素作为酸敏感的质子识别单元。研究揭示了DPA基团通过光诱导电子转移(PeT)机制抑制了香豆素核心的荧光。一旦与Zn²⁺结合,PeT被阻断,导致在460纳米波长处产生明亮的蓝色荧光。同时,在酸性条件下,萘荧光素基团会经历可逆的醌型至螺内酯型的转变,导致680纳米波长处的红色荧光强度降低。这一发现表明,在氧化应激条件下,PC12细胞中的Zn²⁺和H⁺水平均有所上升。而在具有抑郁症样行为的小鼠大脑中,Zn²⁺浓度和pH值均呈现下降趋势,这暗示了Zn²⁺、H⁺水平以及NMDA受体活性的变化可能与抑郁症的发病机制相关联。
如前文所述,ROS的过量生成会导致大脑氧化应激,进而损害蛋白质、核酸等生物大分子,这可能是抑郁症发病的潜在因素。因此,内源性还原剂Cys的成像技术成为评估氧化应激的重要工具。基于此,2020年开发了一种TP荧光探针17。当Cys与探针中的硫代羰基发生选择性亲核加成反应时,会形成一个稳定的五元硫唑啉环,与香豆素产生基于ICT的推拉电子效应,从而显著增强荧光信号。利用该探针,研究者们成功追踪了抑郁样行为小鼠大脑中的Cys水平,并发现Cys水平与抑郁样行为程度呈负相关,这与ROS/氧化应激的增加与抑郁状态的正相关关系相吻合。
为了进一步研究抑郁症中Cys的变化,Ma等人在2022年提出了一种新的荧光探针18,专门用于监测Cys水平。该探针以香豆素为荧光团,马来酰亚胺基团作为Cys的特异性识别基团。在未与Cys结合时,荧光团与马来酰亚胺基团之间的PeT效应抑制了荧光发射。而当Cys的硫醇基团与马来酰亚胺发生加成反应后,PeT效应减弱,探针的荧光特性得以恢复。Ma及其合作者观察到Cys水平与抑郁程度之间的负相关关系,这一发现与探针17的研究结果相呼应。这两项互补性研究不仅展示了设计此类探针的通用原则,还突出了其在研究神经疾病中生物巯基(尤其是Cys与抑郁症关系)方面的潜力。
在众多内源性ROS中,羟基自由基(-OH)因其强大的氧化能力而备受关注,它能严重破坏生物大分子,加速细胞衰老,并可能诱发神经系统疾病。为了探究-OH浓度变化与抑郁症之间的联系,2019年开发了一种特异性检测-OH的探针19。该探针采用带有β-三氟甲基取代基的香豆素作为荧光团,这一取代基不仅增强了香豆素的推拉效应,还提高了其亲脂性,有助于探针穿过血脑屏障(BBB)。在羟基自由基的作用下,探针中的3-甲基吡唑酮识别单元经历单电子氧化导致吡唑酮开环,形成一个高效的ICT荧光体系,从而显著增强荧光发射。通过探针19,研究者们成功地对抑郁样行为小鼠大脑中-OH含量的增加进行了成像(图10)。这一研究结果表明,-OH可能通过抑制SIRT1的活性参与抑郁症的发病过程,进一步证明了探针19是研究-OH相关疾病的有力工具,对于深入理解抑郁症的分子机制具有重要意义。 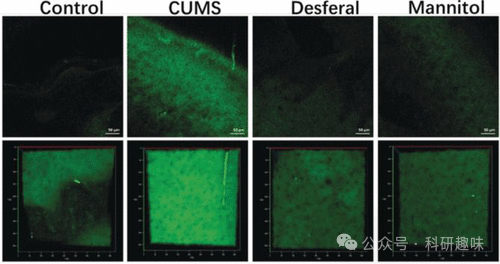 图 10.探针 19 对小鼠体内羟自由基的原位 TP 成像。对照组:无 CUMS 的小鼠。CUMS:易受 CUMS 影响的小鼠。去铁剂:注射去铁胺的易感小鼠。甘露醇注射甘露醇的易感小鼠。荧光图像使用 800 纳米光源获得。三维图像(第二行)由轴向(z)增量为 2 μm 的横截面(xy 截面,400 μm)堆叠生成。荧光发射窗口:400-650 纳米。比例尺 = 50 μm。 在深入探究抑郁症模型中的ROS成像技术的同时,研究者们还开发了一系列探针,旨在成像除羟基自由基(-OH)外的其他ROS,如过氧化氢(H2O2)、臭氧(O₃)、次氯酸(HClO)或次溴酸(HBrO)。例如,2022年研发的荧光探针20和21分别针对线粒体和溶酶体中的H2O2进行了检测。这两款探针均基于广泛应用的苄基频哪醇硼酸酯过氧化物识别单元。探针20以荧光素为荧光团,结合三苯基膦作为线粒体靶向分子;而探针21则结合香豆素荧光核心和吗啉基溶酶体靶向单元。荧光成像技术揭示了线粒体H2O2可影响小鼠大脑溶酶体中葡萄糖脑苷脂酶的活性。
图 10.探针 19 对小鼠体内羟自由基的原位 TP 成像。对照组:无 CUMS 的小鼠。CUMS:易受 CUMS 影响的小鼠。去铁剂:注射去铁胺的易感小鼠。甘露醇注射甘露醇的易感小鼠。荧光图像使用 800 纳米光源获得。三维图像(第二行)由轴向(z)增量为 2 μm 的横截面(xy 截面,400 μm)堆叠生成。荧光发射窗口:400-650 纳米。比例尺 = 50 μm。 在深入探究抑郁症模型中的ROS成像技术的同时,研究者们还开发了一系列探针,旨在成像除羟基自由基(-OH)外的其他ROS,如过氧化氢(H2O2)、臭氧(O₃)、次氯酸(HClO)或次溴酸(HBrO)。例如,2022年研发的荧光探针20和21分别针对线粒体和溶酶体中的H2O2进行了检测。这两款探针均基于广泛应用的苄基频哪醇硼酸酯过氧化物识别单元。探针20以荧光素为荧光团,结合三苯基膦作为线粒体靶向分子;而探针21则结合香豆素荧光核心和吗啉基溶酶体靶向单元。荧光成像技术揭示了线粒体H2O2可影响小鼠大脑溶酶体中葡萄糖脑苷脂酶的活性。
臭氧作为一种ROS,会通过臭氧分解与不饱和脂肪酸反应,生成更多具有强氧化性的活性ROS,从而对细胞关键成分造成进一步损害。2019年,研究者使用近红外荧光探针22直接在小鼠大脑中观察到了臭氧的存在。该探针基于氰基-7型荧光团前体,并通过3-丁烯基官能团与O₃发生环加成(臭氧分解)反应。此系统特定的环化反应导致氧化、碎裂和重排,最终产生相关醌,从而在与O₃反应时产生明亮的近红外荧光发射。与正常小鼠相比,抑郁症模型小鼠脑组织中O₃的原位成像显示有所增加,提示臭氧可能通过诱导过量IL-8的生成而诱发抑郁症。
为间接评估神经递质释放和抗抑郁药效果,研究者开发了多功能荧光平台23用于监测HClO。该平台基于亚甲基蓝(MB)构建,亚甲基蓝因其出色的抗炎特性和光学性质而广受认可。神经递质或抗抑郁药通过脲键与MB共价连接,这种脲键仅能被HClO特异性裂解。行为学测试和生化分析表明,探针23能有效降低ROS水平,缓解氧化应激/炎症,并减轻小鼠的抑郁症状。与常用抗抑郁药相比,探针23采用协同治疗策略,展现出更优的抗抑郁效果、更少的副作用和更短的治疗时间。此外,探针23还成功实现了对小鼠抑郁症的初步诊断,为抑郁症的诊断和治疗提供了一个新的、有前景的平台。
鉴于次溴酸(HOBr)的潜在危害,2022年研究者设计了TP荧光探针24,用于实时监测和可视化活体系统中的HOBr水平。该探针由1,8-萘二甲酰亚胺荧光团和N-(2-氨基乙基)-吗啉溶酶体靶向基团组成,其中1,2-氨基乙醇基团有助于提高溶解度。当吗啉被HOBr氧化时,通过SEAr反应生成多取代的荧光萘二甲酰亚胺。该探针表现出出色的选择性、快速响应时间(5秒)和高灵敏度(LOD = 15 nM)。探针24成功检测了炎症组织、乳腺癌模型以及抑郁症小鼠大脑中增加的HOBr水平。
丙二醛(MDA)和甲醛(FA)作为高活性、毒性和亲脂性的活性羰基物种(RCS),能够轻易穿透血脑屏障(BBB),对大脑内蛋白质功能造成损害,可能与抑郁症等脑部疾病相关。为解决这一问题,2022年研究者开发出一种TP荧光探针25,能够同时检测MDA和FA,并产生光谱分辨信号。探针25的肼基作为识别基团,与MDA反应生成吡唑,与FA反应生成肼基,从而实现MDA和FA的准确区分。类似探针19,三氟甲基的引入有望增强探针穿越BBB的能力,实现在活体组织中检测MDA和FA。探针25在活细胞和体内同时对MDA和FA进行成像,首次证明抑郁症小鼠大脑中MDA和FA的浓度高于正常健康小鼠。
去甲肾上腺素(NE)水平与抑郁症密切相关,赵等人于2023年合成了探针26,实现了近红外荧光光声(PA)成像。该探针以氰基为荧光团,添加磺酸基团以提高溶解性和生物相容性,同时利用酚羟基作为反应位点,并通过与NE-选择性甲苯硫醚基团进行官能化。因此,采用探针26的大脑可视化技术不仅可用于诊断模型小鼠的抑郁症,还能监测药物干预对NE水平的影响。
Yin等人于2022年开发了一种类似的探针27。虽然“正常”细胞和“抑郁”细胞之间的NE基线含量无显著差异,但在暴露于高钾水平时,抑郁细胞分泌的NE却少于正常细胞。这一发现揭示了NE在抑郁症病理过程中的潜在作用。该研究还评估了抗抑郁药和G蛋白偶联受体拮抗剂对抑郁细胞和正常细胞的影响,进一步证实了NE的外排与抑郁症之间的关联,并提示抑制NE受体可能会影响NE的释放。
探针27的设计基于先进的荧光成像技术,其独特的分子结构使其能够高选择性地与NE相互作用,并在近红外区域产生强烈的荧光信号。这种近红外荧光成像技术具有出色的组织穿透能力和低背景干扰,使得在活体动物模型中实时监测NE水平成为可能。
通过利用探针27进行的研究,研究者们不仅加深了对NE在抑郁症中作用机制的理解,还为开发新的抗抑郁药物提供了有力的工具。此外,该探针还可用于评估抗抑郁药物的治疗效果,为个体化治疗方案的制定提供重要依据。
总之,随着化学和材料科学领域的不断进步,越来越多的先进技术和方法被应用于生物医学研究中。通过开发新型荧光探针,研究者们能够更深入地了解抑郁症等复杂疾病的病理机制,并为开发更有效的治疗方法提供新的思路。
【神经疾病诊断探针】用于中风诊断的荧光探针
Fluorescent Probes for Disease Diagnosis
疾病诊断荧光探针
中风,亦称为脑血管意外(CVA),是一种紧急医疗状况,它涉及大脑某个区域的血液流动中断或显著减少,进而导致脑组织出现缺血性损伤。中风的典型症状涵盖面部、手臂或腿部的突然麻木或无力,言语表达和理解上的困难,视力异常,头晕以及剧烈的头痛。这些症状的长期影响可能极为严重,包括不可逆的脑损伤。鉴于中风的严重性,目前已有大量研究致力于其早期诊断和治疗方法的探索(如图15所示)。  图 15.部分中风荧光探针。
图 15.部分中风荧光探针。
在探讨中风的病理机制中,ROS(活性氧物种)和RNS(活性氮物种)再次扮演了至关重要的角色,它们在血液和血管组织中的浓度与中风的发病密切相关。Liu等人在2020年设计了一种双光子荧光探针35,专门用于ONOO-(过氧亚硝酸根)的检测。该探针以罗丹明衍生物为荧光团,结合1-甲基吲哚啉-2,3-二酮作为ONOO-的特异性反应位点。探针35不仅能够成功追踪活细胞和斑马鱼体内的内源性ONOO-,还能通过TP(双光子)显微镜实时观察缺血性和出血性中风大鼠脑微血管中的ONOO-。这一突破性的设计解决了长期以来使用光学探针区分ONOO-与其他ROS/RNS的难题,为评估与ONOO-相关的生理和病理事件,尤其是中风,提供了有力的工具。
据Li在2019年的报道,已成功开发了36号探针,用于在中风模型中成像ONOO-。在该探针中,对羟基苯胺被选为ONOO-感测的反应性触发器,而α-氯苯并-BODIPY作为荧光团。探针36能够轻松穿越BBB(血脑屏障),追踪微血管中的ONOO-,并对缺血引起的脑损伤进行成像。这一特性使其能够实时监测血栓形成过程和早期缺血时大脑中ONOO-的过度生成,为研究ONOO-在中风神经血管损伤进展过程中的分子作用提供了一种极具前景的工具。
2022年,James等人设计了一种独特的TP比率荧光探针37,用于实时监测氧-葡萄糖剥夺/再氧合(OGD/R)过程中的自噬和氧化应激。ONOO-能够轻易地将炔烃单元氧化为相应的醛,导致分子共轭结构和分子内电荷转移发生显著变化,进而影响其吸收和荧光发射特性。探针37能够对OGD/R过程中的自噬和氧化应激进行实时的比率分析和可视化。研究结果显示,在细胞OGD/R过程中会产生ONOO-,引发细胞氧化应激,并在大约15分钟后出现自噬信号。这一成果为开发新型的中风诊断、治疗和药物设计内聚系统提供了巨大的潜力。
同样在2022年,Li等人专注于自噬成像的研究,成功构建了溶酶体靶向荧光探针38。该探针以香豆素衍生物为TP荧光团,结合乙烯基偶联异佛尔酮衍生物作为粘度传感单元,并通过吗啉衍生物实现溶酶体的定位。这一设计使得探针能够准确检测溶酶体粘度,进而实现自噬水平的原位检测和评估。研究结果表明,中风期间自噬水平显著升高,而抑制氧化应激则能有效降低自噬程度(如图16所示)。这一发现证实了中风引发的氧化应激可导致自噬的发生。  图 16.在大脑中动脉闭塞(MCAO)过程中,使用探针 38 在不同时间段对不同处理方法下的大脑自噬进行活体成像:Sham 组(未进行 MCAO 的小鼠)、MCAO 组(进行 MCAO 的小鼠)、载体组(向小鼠尾静脉注射生理盐水)和 APO 组(向小鼠腹腔注射阿朴霉素)。
图 16.在大脑中动脉闭塞(MCAO)过程中,使用探针 38 在不同时间段对不同处理方法下的大脑自噬进行活体成像:Sham 组(未进行 MCAO 的小鼠)、MCAO 组(进行 MCAO 的小鼠)、载体组(向小鼠尾静脉注射生理盐水)和 APO 组(向小鼠腹腔注射阿朴霉素)。
2016年,Wang等人成功开发了一种对Fe²⁺具有高灵敏度和选择性的“关-开”型荧光探针39,鉴于Fe²⁺在缺血性脑卒中相关氧化应激中的关键角色。该探针融合了萘二甲酰亚胺荧光团和可还原的O-酰羟胺作为Fe²⁺的特异性识别单元。通过探针39,研究人员能够监测Zn²⁺诱导的脑细胞中Fe²⁺的释放,并观察到缺血脑组织中Fe²⁺水平的显著升高。
鉴于中风与脑部氧化应激的紧密联系,以及硫氧还蛋白还原酶(TrxR)在维持细胞氧化还原平衡中的核心作用,研究者们开发了专门用于监测中风模型中TrxR活性的探针。其中,TP荧光探针40是通过将1,2-二硫环戊烷分子与带有氨基甲酸酯连接体的2-乙酰基-6-氨基萘荧光团结合设计而成。这一系统不仅通过TP荧光成像技术追踪了TrxR在斑马鱼体内的分布,还揭示了脑缺血再灌注损伤后小鼠脑内TrxR功能的下降,从而证明了TrxR作为中风潜在治疗靶点的价值。
2022年,James等人开发了一种新型的近红外荧光探针41,该探针通过H₂S触发和H₂S释放机制,实现了对铁突变的高保真原位成像。探针41采用偶氮苯作为硫化氢的识别单元,并通过硫代氨基甲酸酯(H₂S前体)与喹啉乙腈荧光团相连。连接体的旋转能力使得探针分子具有可调节的荧光输出,受粘度影响。因此,探针41在高粘度环境中对铁突变进行特异性成像时,展现出高灵敏度(LOD = 1.3 nM)和高选择性。细胞实验表明,尽管有无探针41在麦拉宁诱导的铁突变过程中无明显差异,但硫化氢触发和释放机制的应用显著提高了成像的准确性,避免了探针本身对铁突变的干扰。
同年,Gu等人合成了一种用于检测谷胱甘肽(GSH)的荧光探针42。该探针基于BODIPY荧光支架,在3位上引入了2,4-硝基苯磺酸作为GSH的识别基团。为了验证探针的实用性,研究者构建了OGD/R和MCAO模型来模拟中风条件,并利用探针42在体内外对脑缺血再灌注(I/R)过程中的GSH进行了荧光成像。这一方法特别突出了再灌注过程中氧化还原平衡的紊乱,证明了探针42在时空上的高度特异性。这不仅为脑缺血再灌注的研究提供了新的视角,还作为高灵敏度成像平台,为术后器官诊断等临床应用提供了有力工具。此外,该方法还可扩展至其他涉及细胞脱氧和复氧的病理生理过程。
Hong等人于2022年开发了一种基于苯并双(1,2,5-噻二唑)(BBTD)结构的近红外-II(1000-1700纳米,第二个近红外窗口)荧光探针43。在此探针中,BBTD作为电子受体,而3,4-双(烷氧基)噻吩环和N,N-二苯基萘-2-胺(BPN)则作为电子供体。噻吩单元上的3,4-双(2-乙基己氧基)链不仅作为良好的电子供体,还增大了BBTD与噻吩之间的二面角(达52°),从而显著改善了探针的AIE(聚集诱导发光)特性(I/I₀ > 13)。探针43展现出了强烈的AIE特性,在近红外-II区的荧光量子产率高达14.45%。Hong的研究进一步证实,探针43是一种有效的成像剂,可用于缺血性中风的图像引导药物治疗。此外,他们还利用探针43证明了灯盏细辛注射液在促进血管生成、保护缺血性脑部方面的潜在作用。
【神经疾病诊断探针】用于胶质瘤诊断的荧光探针
Fluorescent Probes for Disease Diagnosis
疾病诊断荧光探针
胶质瘤,作为源自大脑或脊柱胶质细胞的一种原发性脑肿瘤,其常见临床表现涵盖头痛、癫痫发作、视力或听力异常,以及记忆力和注意力的减退。尽管当前临床实践中手术、放疗和化疗的综合治疗策略已取得一定成效,但仍有待进一步优化。鉴于此,荧光成像技术因其独特的优势,正被广大研究者应用于开发新型的手术导航、早期诊断以及优化治疗模式。
多功能材料,与先前探讨的小分子探针相比,因其在发挥多种功能方面的显著优势而备受瞩目。以2014年Shi等人研发的一种脑纳米探针(ANG/PEG-UCNPs,图17,探针44)为例,该探针不仅具备穿越血脑屏障(BBB)的能力,还能精准靶向胶质母细胞瘤(GBM),这是一种高级别且生长迅速的胶质瘤类型。该探针的核心结构由钆(III)修饰的上转换纳米粒子(UCNPs)构成,并锚定于聚乙二醇(PEG)基底之上,同时结合双靶向配体Angiopep-2(ANG, TFFYGGSRGKRNNFKTEEY)。这一配体能够特异性地与低密度脂蛋白受体相关蛋白结合,而后者在BBB和GBM细胞中均呈现过度表达的状态。
细胞和动物实验结果表明,探针44通过受体介导的内吞作用成功穿越BBB,并有效靶向GBM。这些双模纳米探针在无创荧光成像领域展现出巨大的应用潜力,尤其是在脑肿瘤的术前诊断和定位方面,其成像性能甚至超越了临床广泛使用的磁共振成像(MR)。这一研究成果不仅验证了利用荧光成像技术对胶质母细胞瘤进行诊断和定位的可行性,更为高效的肿瘤手术提供了有力的技术支撑。 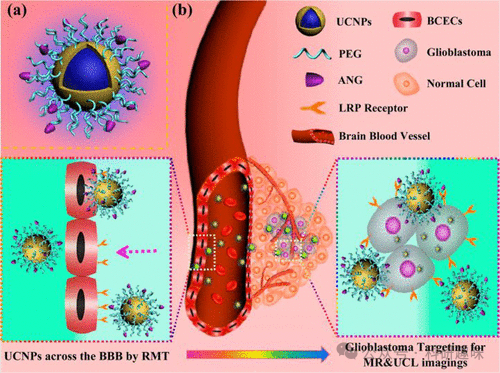 图 17.(a) 双靶向探针 44 的设计。(b) 双靶向系统探针 44 的示意图,通过 LRP 介导的内吞作用穿过 BBB 并靶向胶质母细胞瘤,实现颅内胶质母细胞瘤的 MR 和 UCL 成像。
图 17.(a) 双靶向探针 44 的设计。(b) 双靶向系统探针 44 的示意图,通过 LRP 介导的内吞作用穿过 BBB 并靶向胶质母细胞瘤,实现颅内胶质母细胞瘤的 MR 和 UCL 成像。
2015年,Ye等人成功报道了1 nm大小的掺钆MnCO₃纳米粒子,这些粒子通过锰油酸酯(探针45)的引导进行热分解处理,实现了对微小脑胶质瘤的精准靶向磁共振(MR)和荧光成像。(101) 在此研究中,研究者们巧妙地在MnCO₃纳米粒子中引入了钆(III)元素,并通过羧酸末端硅烷配体交换和PEG共轭技术,赋予了这些纳米粒子出色的水分散性和水稳定性。
为了进一步提升纳米粒子的功能性和应用潜力,探针45进一步融合了近红外染料5.5号氰基与靶向配体叶酸(FA),构建了一种多功能纳米探针。这种纳米探针巧妙地结合了核磁共振成像技术的高空间分辨率优势和荧光成像技术的高灵敏度特点(如图18所示),为早期胶质瘤的有效检测提供了强有力的工具。 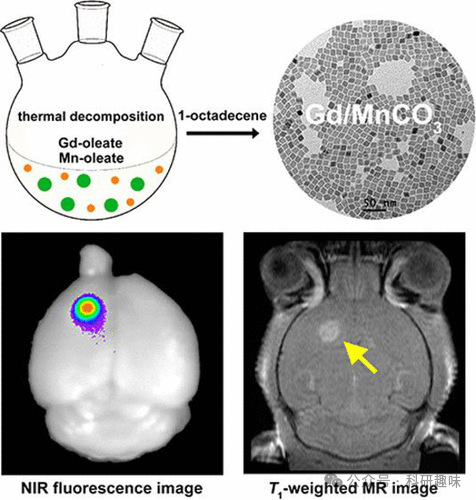 图 18.多功能探针 45 的合成示意图以及近红外荧光图像和磁共振图像。
图 18.多功能探针 45 的合成示意图以及近红外荧光图像和磁共振图像。
2021年,Pilar等人成功开发了磁共振成像(MRI)和荧光成像双重共轭的聚合物纳米粒子(CPNs),即探针46,用于检测胶质母细胞瘤(GBM)。 这些CPNs通过纳米沉淀法合成,其中金属氧化物磁核(Fe₃O₄/NiFe₂O₄纳米粒子)被巧妙地嵌入到油酸封端的基质中。所得的纳米粒子展现出优异的生物相容性和细胞渗透性。在静脉给药后,这些CPNs 46能够在异位GBM模型的肿瘤和排泄器官中被有效检测到,并成功应用于活体GBM的成像研究,为多模态成像探针的开发提供了新的方向。
同年,Gong等人报道了一种双模态成像纳米探针,该探针结合了磁共振成像(MRI)和近红外荧光(NIRF)技术,以实现体内恶性胶质瘤的精确定位。 这些纳米探针利用内源性触发配体Angiopep-2(ANG)来识别并结合在脑毛细血管内皮细胞和胶质瘤细胞上过度表达的低密度脂蛋白受体蛋白1(LRP1)。这种特异性识别使得ANG能够穿越血脑屏障(BBB)并直接靶向胶质瘤细胞。通过将超顺磁性氧化铁纳米粒子(SPIONs)与近红外荧光染料吲哚菁(Cy7)和ANG结合,Gong等人构建了一种双模式成像探针(图19,探针47)。探针47通过MRI和NIRF成像技术,能够精确地将纳米探针聚集在胶质瘤部位并进行检测。这一创新方法为术前诊断和术中定位提供了巨大的潜力,使探针47成为胶质瘤靶向造影剂领域的一个有前景的候选者。 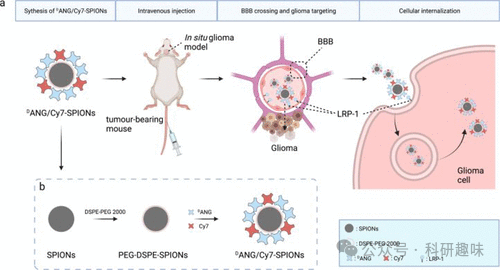 图 19(a) 47 号探针的构造和功能示意图,包括其穿过 BBB 和靶向胶质瘤细胞的机制;(b) 其合成过程。
图 19(a) 47 号探针的构造和功能示意图,包括其穿过 BBB 和靶向胶质瘤细胞的机制;(b) 其合成过程。
荧光碳点(CDs)以其低毒性、高稳定性、多功能性和生物可降解性等卓越特性,在荧光传感和成像领域展现出巨大的应用潜力。2015年,Sun等人以d-葡萄糖和l-天冬氨酸为前驱体,成功合成了胶质瘤靶向的碳点(CD-Asp),即探针48。该探针48展现出极高的生物相容性,无需引入额外的靶向分子即可实现对胶质瘤细胞的精准定位。体内成像研究进一步证实,探针48在胶质瘤部位的累积量显著高于正常脑组织,显示出其作为脑胶质瘤靶向荧光成像剂的巨大潜力(如图20所示)。此项工作不仅验证了CD-Asp在成像领域的有效性,更为构建集诊断、靶向和治疗于一体的智能纳米药物平台提供了有力的材料基础。 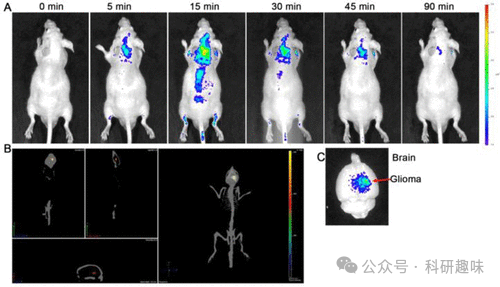 图 20.尾部静脉注射 48 号探针后胶质瘤小鼠的体内和体外成像。(A) 注射后探针 48 的全身分布与注射时间的关系。(B) 注射探针 48 20 分钟后探针 48 在大脑中分布的三维重建图。(C) 注射探针 48 90 分钟后的脑部活体成像。
图 20.尾部静脉注射 48 号探针后胶质瘤小鼠的体内和体外成像。(A) 注射后探针 48 的全身分布与注射时间的关系。(B) 注射探针 48 20 分钟后探针 48 在大脑中分布的三维重建图。(C) 注射探针 48 90 分钟后的脑部活体成像。
2015年,Gao等人基于CD平台,开发了一种针对U87胶质瘤的生物成像探针(RGD-PEG-CDs,探针49)。该探针通过RGD配体特异性地识别肿瘤细胞和新生血管细胞上高表达的αvβ3受体,并通过PEG化处理有效附着于CD表面。体内实验显示,探针49能够主动靶向U87胶质瘤,并且肿瘤切片中的荧光分布证实了其对新生血管的靶向能力,这与αvβ3的高表达相吻合。
另一项创新研究来自Yuan等人,在2022年报道了仿生物纳米探针Pdots-C6,专门用于胶质瘤的靶向检测(探针50)。他们利用三苯胺(TPA)官能化的PTZ作为电子供体,苯并噻唑(BBT)作为电子受体,在PTZTPA-BBT聚合物骨架内诱导分子内电荷转移(ICT),从而制备出具有长波长光学活性的Pdots。接着,他们将Pdots包裹在C6胶质瘤细胞膜上,不仅增强了探针50的生物相容性和同源靶向能力,还显著提升了其在近红外-II区的胶质瘤成像效果。这一工作为胶质瘤精准诊断领域提供了一种仿生物纳米平台的新思路。
2017年,Cheng及其团队设计了一种纳米探针(QD-Apt),结合了PEG量子点(QDs)与适配体(探针51)的优势,用于肿瘤靶向检测。他们选用A32这一单链DNA(ssDNA),因其能特异性结合广泛存在于胶质瘤细胞表面的表皮生长因子受体变体III(EGFRvIII)。通过将A32与QDs表面耦合,成功构建了生物素-aptamer-共轭链霉亲和素-PEG-CdSe/ZnS QDs(QD-Apt)纳米探针,实现了对肿瘤的特异性结合。探针51在体内外均展现出强烈的荧光信号,并特异性地与EGFRvIII结合。此外,该探针还能在脑瘤小鼠模型中清晰描绘出U87-EGFRvIII原位胶质瘤的肿瘤边界,为外科医生提供精确指导,以实现胶质瘤的最大限度切除。探针51及其衍生系统的进一步开发,有望为胶质瘤的分子诊断、图像引导手术和术后监测提供强有力的工具。
同年,Cheng的研究团队还合成了另一种纳米探针(NGR-PEG-QDs),旨在实现胶质瘤和肿瘤血管的靶向检测(探针52)。这些纳米探针通过识别仅存在于肿瘤血管中的丙氨酸氨肽酶CD13,实现了对胶质瘤和肿瘤血管的高特异性成像。这是通过将能特异性识别CD13的生物素化天冬酰胺-甘氨酸-精氨酸(NGR)肽与阿维丁-聚乙二醇包覆的QDs共轭实现的。如图21所示,探针52能够穿越血脑屏障(BBB),对胶质瘤和肿瘤血管进行高效成像,并且可在低毒性浓度下工作,为临床纳米药物的发展提供了新的可能性。 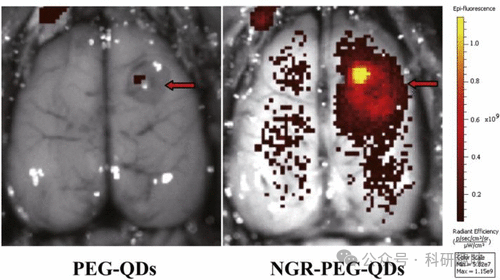 图 21.尾静脉注射 PEG-QDs 或 NGR-PEG-QDs(探针 52)8 小时后大鼠脑部肿瘤的荧光成像。
图 21.尾静脉注射 PEG-QDs 或 NGR-PEG-QDs(探针 52)8 小时后大鼠脑部肿瘤的荧光成像。
在2014年的研究中,Xu等人成功合成了纳米荧光探针AsT(探针53)。他们将肽TGN与AS1411结合,用于靶向血脑屏障(BBB)递送。AS1411是一种富含鸟嘌呤的适配体,通过与胶质瘤中过表达的核素蛋白相互作用,引导纳米粒子导向胶质瘤细胞。TGN和AS1411通过PEG连接器巧妙耦合,而在AS1411的末端,研究人员添加了3号氰基荧光标签,以便追踪AsT纳米探针的动向。体外细胞摄取实验和胶质瘤球体摄取实验均显示,探针53能够被胶质瘤和内皮细胞有效摄取,并具备穿透内皮细胞单层及被胶质瘤球体摄取的能力。进一步的体内实验进一步证实了探针53能够高效且高强度地靶向胶质瘤。
2019年,Li及其团队合成了基于NaNdF4的纳米颗粒,这种纳米颗粒展现出强大的近红外-II荧光性能,为检测正位胶质母细胞瘤提供了新的可能性(图22,探针54)。他们在NaNdF4纳米粒子表面涂覆了一层惰性的NaLuF4,并通过近红外染料(IR-808)敏化,使其常规发射强度增加了10倍。研究人员巧妙地利用聚焦超声波将这些纳米粒子有效输送至肿瘤组织,从而暂时性地打开了小鼠的BBB。荧光成像和脑组织的稀土染色结果均证实,这些纳米粒子能够特异性地针对肿瘤,从而证明了染料敏化稀土纳米粒子在胶质母细胞瘤诊断中的潜在应用价值。这一研究不仅为利用弱长波长荧光增强近红外-II成像提供了新思路,也为未来胶质瘤的诊断和治疗开辟了新的方向。 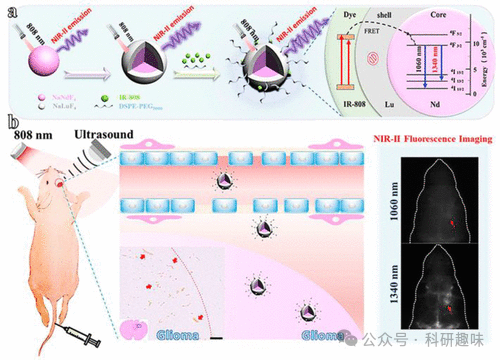 图 22.(a) 水溶性染料敏化核壳 NaNdF4@NaLuF4/IR-808@DSPE-PEG5000 NPs(探针 54)的合成及其能量传递机制示意图。(b) 这些核壳 NPs 在超声波介导的 BBB 开放情况下应用于正位胶质母细胞瘤的近红外-II 荧光成像,并在送入大脑后对脑组织进行稀土染色。
图 22.(a) 水溶性染料敏化核壳 NaNdF4@NaLuF4/IR-808@DSPE-PEG5000 NPs(探针 54)的合成及其能量传递机制示意图。(b) 这些核壳 NPs 在超声波介导的 BBB 开放情况下应用于正位胶质母细胞瘤的近红外-II 荧光成像,并在送入大脑后对脑组织进行稀土染色。
Zhang等人于2022年成功研发了一种名为YHM的纳米治疗剂,该治疗剂在原位胶质瘤的诊断与治疗领域展现出显著潜力(如图23所示,标记为探针55)。在YHM的构造中,低能声子钒酸钇(YVO4)与Nd3+粒子构成了其核心部分,而超声敏化剂血卟啉甲醚则担任了载体的角色。尤为引人注目的是,MnO2纳米片不仅为原位胶质瘤提供了近红外-II/MRI成像的功能,还作为高效声动力治疗(SDT)的关键元件。
研究数据表明,探针55能够轻松穿越血脑屏障(BBB),进而实现对胶质瘤的近红外-II荧光和MRI成像。更为重要的是,探针55能在原位对胶质瘤实施SDT治疗。在这一过程中,MnO2外壳不仅释放氧气,还同时释放Mn2+离子,这一特性显著增强了SDT的治疗效果。这一发现不仅拓宽了掺稀土离子的YVO4发光纳米粒子的应用领域,也为胶质瘤的诊疗一体化提供了新的策略。 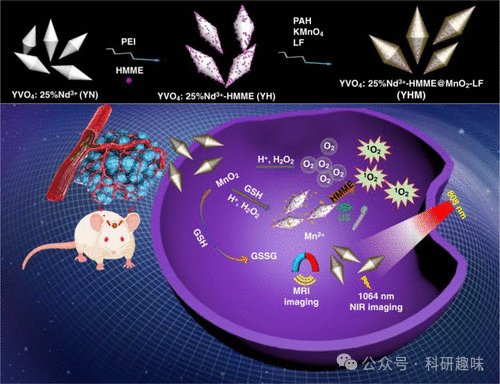 图 23.YHM 纳米疗法的组装和作用模式示意图。
图 23.YHM 纳米疗法的组装和作用模式示意图。
参考文献
Wang, X.; Ding, Q.; Groleau, R. R.; Wu, L.; Mao, Y.; Che, F.; Kotova, O.; Scanlan, E. M.; Lewis, S. E.; Li, P.; Tang, B.; James, T. D.; Gunnlaugsson, T. Fluorescent Probes for Disease Diagnosis. Chem. Rev. 2024, 124 (11), 7106–7164. https://doi.org/10.1021/acs.chemrev.3c00776.