【肿瘤微环境探针】用于神经系统疾病诊断的荧光探针
1. 引言
所有细胞生理活动都受其相应生物分子的微环境调节。pH 值、粘度、极性、温度、电子电位和机械力等关键理化特性在这种调节中发挥着不可或缺的作用。例如,pH 值会对细胞增殖、内吞和离子转运产生重大影响。 酶必须在合适的 pH 值和温度范围内才能发挥正常功能。神经元膜电位的快速变化对大脑的正常功能至关重要,而机械力则是维持细胞形状、细胞生长和迁移不可或缺的因素。微环境稳态对细胞的正常功能至关重要,而细胞微环境的变化往往与细胞功能障碍相关,有时甚至会导致疾病。 因此,检测和测量活细胞中的这些参数对生物科学和生物医学研究具有重大意义。
George Gabriel Stokes最初使用 "荧光 "一词来描述硫酸奎宁的发光。 从那时起,荧光显微镜和荧光技术就成为生物研究中不可或缺的工具,因为它们能够以高对比度提供有关生物目标的实时动态信息。它们还有助于对离子、生物分子及其相互作用进行定量测量和分析。这些优势促进了大量荧光探针的开发,如小分子荧光探针、荧光蛋白、nm传感器等。这些探针旨在识别特定目标,并在此过程中显示出荧光变化,作为检测目标的信号。其中,小分子荧光探针因其结构小巧、可调,为生物系统中微环境的侵入性检测、生物大分子和离子的分析提供了强大的工具,而且影响极小。此外,由于罗丹明衍生物等小分子荧光探针具有优异的光物理特性,因此适合用于超分辨率显微镜,从而能够在亚细胞水平上研究生物过程。
过去几十年来,人们一直致力于开发能对物理微环境变化做出反应的荧光探针。这些探针可以定性或定量地报告细胞或生物体内环境的变化。这一领域的早期进展以香豆素和荧光素衍生物等小分子荧光团为特色,它们通过直接的质子化和去质子化过程来监测细胞内的 pH 值。随着对新型荧光团探索的深入,基于光物理机制的复杂设计策略被引入。这些策略增强了对生命系统内微环境的稳健检测和量化。例如,基于分子内电荷转移(TICT)的粘度敏感探针(8,9)和以电子给体和受体之间的分子内电荷转移(ICT)为中心的极性敏感探针的开发。 这些策略性设计催生了荧光探针的诞生,它们能够在不同维度上报告活细胞的微环境,为了解关键的生物过程提供了宝贵的视角。
本综述将主要关注用于检测生物系统内物理微环境的小分子荧光探针。这包括 pH 值、粘度、极性、温度、电子电位和机械力等参数()。作者将特别强调这些探针的结构设计、反应机制和生物应用。不过,由于篇幅有限,作者无法对这一广阔而活跃的领域的所有文献进行详细概述。除了小分子探针,还有其他类型的荧光探针,包括聚合物、nm材料、碳点、过渡金属复合物等。这些探针还可以通过不同的工作机制探测生命系统中的物理微环境。为了让读者对这一领域有更全面的了解,作者在每一部分的末尾都列出了有关荧光探针的参考文献列表,作为辅助信息。
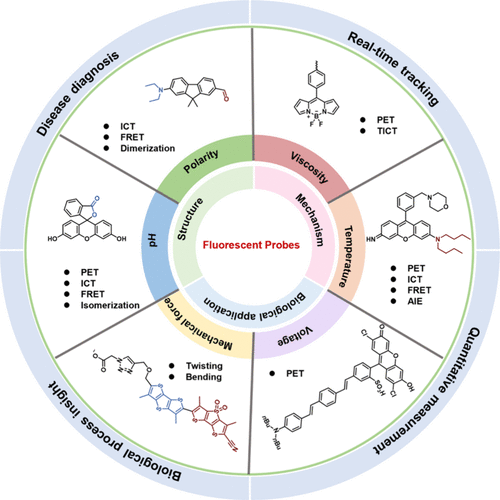 图1. 生物系统中微环境荧光探针
图1. 生物系统中微环境荧光探针
2. 用于极性检测的荧光探针
在探讨细胞微环境的关键特性——极性时,其异常波动已被科学界广泛认定为细胞功能障碍的指示器,乃至是严重病理状态的前兆。首先,细胞极性的失衡往往映射出细胞潜在的癌变倾向。癌细胞展现出异常活跃的脂质代谢速率,这一动态过程深刻影响着细胞膜结构脂质的构成、信号传导所需脂质的浓度,以及能量稳态调控中脂质合成与分解的平衡,进而可能降低癌细胞及肿瘤组织的整体极性状态。
进一步地,在蛋白质构象疾病的背景下,细胞内精细调控的蛋白质平衡网络,负责精确管理蛋白质的合成、折叠与降解过程,其脆弱性在面对衰老或有害应激时尤为显著。一旦该网络受损,蛋白质将发生错误折叠与异常聚集,这一过程不仅涉及蛋白质内部极性的显著变化,还通过蛋白质间相互作用的微妙调整,间接影响界面极性的稳定。
此外,细胞死亡机制的多样性,如细胞凋亡,亦会对细胞膜的脂质架构造成深刻扰动。凋亡过程中,膜脂质的非对称分布模式被打破,伴随着水合作用的增强,局部极性环境发生显著改变。同时,应激响应,尤其是氧化应激,能触发细胞器间极性特征的动态变化,进一步复杂化细胞微环境的调控机制。
鉴于上述复杂性,开发能够精准捕捉细胞微环境极性特征的化学探针,对于疾病的早期诊断及病理机制的深入探索具有不可估量的生物学与生理学价值。历史上,Christian Reichardt基于甜菜碱30的特定光学性质,引入了ET(30) 这一广泛应用的极性标度参数,该参数以摩尔电子转移能(单位kcal mol-1)量化,为极性评估提供了有力工具。然而,实际应用中,ET(30) 与发射波长及溶剂特性的匹配度问题时有发生,此时可转而利用Lippert-Mataga极性参数(Δf)、Taft-Kamlet极性参数(π*)、偶极矩(μ)或介电常数(ε)等多元手段进行补充。值得注意的是,在生物体系内有效应用这些参数,关键在于开发出具备高度选择性与靶向性的极性敏感探针,以实现对复杂生物样本中极性特征的精确测量。
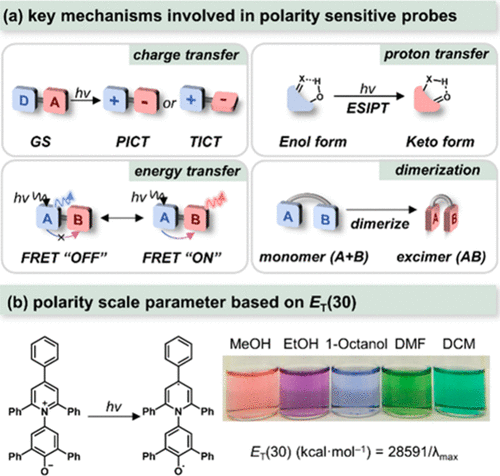 图 2. (a) 极性敏感探针涉及的主要机制。GS = 基态,PICT = 平面分子内电荷转移,TICT = 扭曲分子内电荷转移,ESIPT = 激发态分子内质子转移,FRET = 荧光共振能量转移;(b) 甜菜碱 30 的结构和作为极性标度参数的值ET(30)。这里,λmax 是可见光/近红外区域长波长吸收带的波长(nm),对应于从苯酚分子到吡啶鎓环的分子内电荷转移转变。
图 2. (a) 极性敏感探针涉及的主要机制。GS = 基态,PICT = 平面分子内电荷转移,TICT = 扭曲分子内电荷转移,ESIPT = 激发态分子内质子转移,FRET = 荧光共振能量转移;(b) 甜菜碱 30 的结构和作为极性标度参数的值ET(30)。这里,λmax 是可见光/近红外区域长波长吸收带的波长(nm),对应于从苯酚分子到吡啶鎓环的分子内电荷转移转变。
在本节中,作者将讨论极性敏感探针,根据其各自的作用机制(如 所示),可将其分为四大类。这些机制包括电荷转移(CT)、质子转移(PT)、能量转移(ET)和激发态二聚化(Excimer,激基缔合物)。这些荧光激发态过程高度依赖于局部极性,从而导致荧光特性发生剧烈变化。在进入具有独特极性的多样化细胞微环境时,探针与局部微环境之间的相互作用往往会导致荧光发射波长、强度和寿命等发生变化。为了实现定量分析的目标,作者总结了基于极性敏感探针荧光反应的 5 种主要策略来获得极性()。
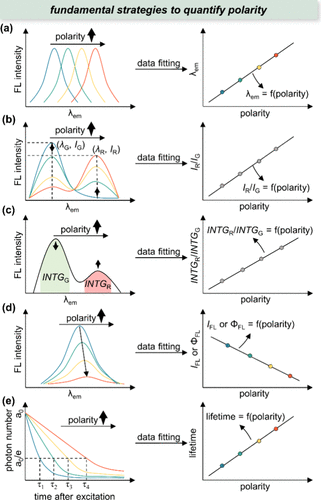
图 3. 量化生物极性的策略。INTGG = 绿色发射带强度积分;INTGR = 红色发射带强度积分;ΦFL = 荧光量子产率。
多年来,人们开发了一系列极性敏感探针,用于体外和体内的各种生物学应用。在本节中,作者试图总结这一领域的进展,并介绍极性敏感探针的各种母核、作用机制和生物学应用。
2.1. 基于分子内电荷转移 (ICT) 机制的极性敏感探针
传统的极性敏感探针,常被称为溶剂化显色染料,其核心设计在于其独特的推拉式荧光团结构,该结构融合了电子给体与受体基团。如展示,这种推拉式架构在光吸收过程中促进了电荷从给体基团向受体基团的高效转移,进而在激发态下诱导形成显著的偶极矩。当此激发态经历弛豫过程时,它会与周围溶剂分子的偶极发生相互作用,导致部分能量以非辐射形式耗散,最终表现为随着溶剂极性增强,荧光发射光谱向长波长方向(即红移)移动的现象。
众多荧光染料分子均采用了这种推拉结构设计,包括但不限于多环芳烃系列、香豆素衍生物、萘酰亚胺及其衍生物、(异)类黄酮天然产物、尼罗红和中性红等有机染料,以及吩噻嗪、咔唑(作为电子给体)和三苯胺(同样作为给体),还有喹喔啉与喹唑啉等(作为电子受体)。这些母核结构不仅丰富了极性敏感探针的多样性,也为深入研究溶剂环境对分子光物理性质的影响提供了宝贵的平台。
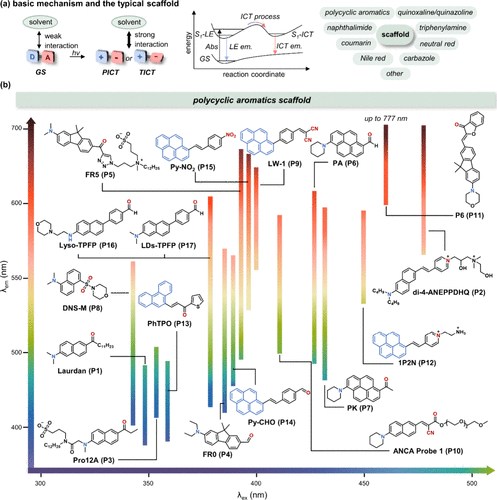
图 4. (a) 基于ICT的极性敏感探针的机理及其典型母核;(b) 基于多环芳烃母核的探针及其溶剂化显色特性示例。ICT = 分子内电荷转移;S1-LE = 局部激发态;S1-ICT = 分子内电荷转移态。
2.1.1. 多环芳烃衍生物
为了系统化地展示这些基于多环芳烃(PAH)母核构建的探针特性,作者依据其分子结构及峰值发射波长(λem)绘制了详尽的“光谱地图”()。该图通过彩虹色条直观呈现了从非极性至极性溶剂转变过程中,各探针λem的连续变化,有效映射了探针在不同极性环境下的光谱响应范围。值得注意的是,生物系统中极性变化的检测往往伴随着显著的发射波长位移,因此,彩虹色条的长度直接反映了探针的动态响应范围,这对于生物脂质体(如细胞膜与脂滴)的精确监测尤为重要。鉴于PAH母核对脂质体天然的亲和力,这些探针在生物脂质体检测及极性监控中展现出巨大潜力。
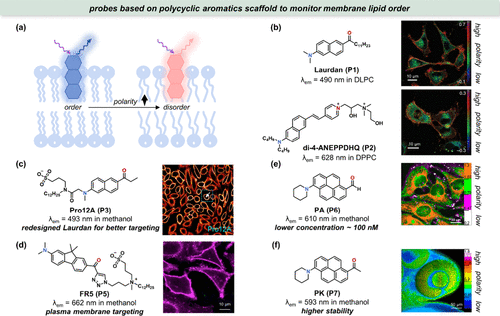
图 5. 用于膜脂有序定量成像的探针。(a) 极性敏感探针对膜脂质秩序的 λem响应;(b) 两种常用探针Laurdan(P1) 和di-4-ANEPPDHQ(P2) 的结构及其对 HeLa 细胞膜的成像;(c) Pro12A(P3) 经细胞膜靶向修饰,具有更好的靶向性;(d) FR5(P5) 的结构及其在 HeLa 细胞中的细胞膜极性成像;(e) PA(P6) 的结构及HeLa 细胞的极性成像;(f) PK(P7) 的结构及其对斑马鱼胚胎(受精后 32 h)眼球部分的极性成像。
细胞膜脂质的排列有序性(膜脂序)对于细胞生理功能具有不可或缺的作用。脂质紊乱常伴随水分含量增加及局部极性波动,针对这一现象,Gratton团队及其合作者开发了Laurdan(P1),一种基于Prodan改良的膜脂序探针()。然而,由于Laurdan 较短的吸收波长(<350 nm),其应用受限于双光子显微镜平台。随后,Loew等人引入了di-4-ANEPPDHQ(P2),该探针吸收波长红移至450-500 nm区间,发射波长则进入近红外区,极大地拓宽了其在细胞与生物体内膜脂有序性成像的应用范围()。
为了进一步提升探针性能,科研工作者致力于增强亚细胞器靶向性、提高灵敏度及开发新型分子骨架。Klymchenko团队通过向Laurdan中引入阴离子质膜靶向基团,成功设计出Pro12A(P3),该探针能特异性标记活细胞的细胞质膜()。其独特的膜靶向机制,即亲脂性十二烷基链与阴离子磺酸盐的协同作用,确保了与细胞质膜的高效结合。此外,该团队还基于芴母核FR0(P4) 开发了FR5(P5),其λem在甲苯至甲醇溶剂中的位移远超Laurdan家族及di-4-ANEPPDHQ,预示着更宽广的极性分辨能力()。
另两项值得关注的研究聚焦于基于芘母核的PA(P6) 与PK(P7) 探针。PA(P6) 在非极性膜环境中展现出高亮度与卓越的光稳定性,即便在低至Laurdan浓度20倍以下的条件下,也能实现相近的细胞膜染色效果()。尤为重要的是,PA(P6) 适用于双光子显微镜成像,波长可超800nm。然而,其醛基在生物环境中的不稳定性促使研究者开发了PK(P7),通过替换为更稳定的酮基,PK(P7) 不仅克服了PA(P6) 的缺陷,还实现了在活体斑马鱼中的直接极性成像()。
最后,基于多环芳烃母核的探针同样适用于追踪细胞内另一类关键疏水结构——脂滴(LDs)。随着极性增加,此类探针常表现为荧光强度减弱及λem红移(),为脂滴动态变化的研究提供了有力工具。 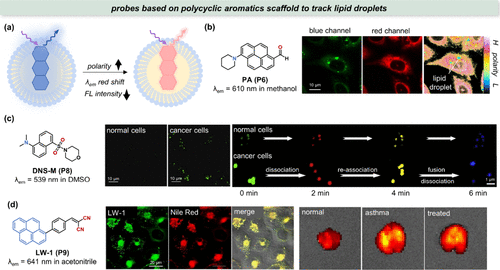
图 6. 脂滴成像探针。(a) 探针对脂滴极性变化的 λem 和强度响应;(b) PA(P6) 的结构和用于CHO 细胞中脂滴极性图的比率测量;(c) DNS-M(P8) 的结构及正常细胞(MCF 10A)和癌细胞(MCF-7)的荧光图像;(d) 左图:LW-1(P9) 的结构,中图:LW-1(P9) 和尼罗红(一种脂滴追踪器)在 HepG2 细胞中的共聚焦荧光图像,右图:正常小鼠、哮喘小鼠和富马酸酮替芬滴鼻液处理小鼠肺部的荧光图像。
Klymchenko及其团队的研究揭示了PA(P6) 探针在检测中国仓鼠卵巢(CHO)细胞质内脂滴(LDs)方面的能力。他们利用红/蓝荧光强度比作为局部极性的量化指标,通过成像技术详细分析了CHO细胞的极性分布()。在此荧光比值图中,LDs区域显示为探针染色的主要非极性脂质环境(),进一步证实了LDs在细胞极性调控中的重要性。鉴于肿瘤初期脂质代谢的显著加速,这一发现预示着PA(P6) 类探针在癌症早期诊断中的潜力。Zhang等人则通过开发DNS-M(P8) 探针,成功区分了正常细胞(如HFF-1、MCF-10A)与多种癌细胞系(A549、HepG2、MCF-7、KB)(),并揭示了癌细胞中LDs行为的动态性增强,为癌症诊断提供了新的视角。
在生物医学领域,LDs代谢异常不仅是癌症的标志,也与哮喘等呼吸系统疾病密切相关。Lin等人设计的LW-1(P9) 荧光探针,通过其高靶向选择性和对LDs极性变化的敏感性,成功应用于哮喘模型小鼠肺部的荧光成像,为哮喘的诊断和治疗监测提供了有力工具。治疗干预后荧光强度的变化(),进一步验证了该探针在评估治疗效果方面的潜力。
此外,基于多环芳香族母核的探针在神经退行性疾病如淀粉样蛋白病的研究中也展现出重要价值。Yang等人利用ANCA(P10) 探针,通过检测极性差异,成功区分了脑组织中的Aβ与朊病毒淀粉样沉积物,揭示了两者在微环境极性上的显著差异(),为疾病诊断提供了新的分子标记。
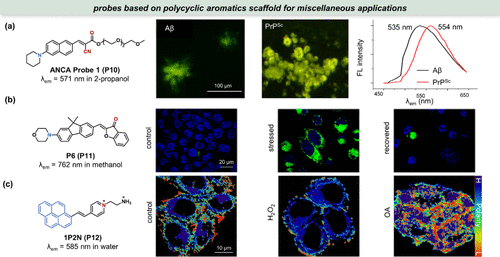
图 7. 基于多环芳烃母核的极性敏感探针的其他应用。(a) 左图:ANCA 探针 1(P10) 的结构,中图:用ANCA 探针 1(P10) 染色的组织中淀粉样蛋白沉积的真彩图像,右图:ANCA 探针 1(P10) 染色后的活体荧光光;(b) P6(P11) 用于监测 HeLa 细胞自我恢复过程中细胞聚集蛋白质组的动态清除;(c) 1P2N(P12) 的结构和用于极性绘图的比率荧光图像。
在蛋白质聚集体研究领域,Liu等人报道的P6(P11) 探针,作为FR0(P4) 的衍生物,展示了其在量化蛋白质聚集体致密性异质性和动态性方面的独特优势。该探针能够响应蛋白酶体降解抑制引起的全局蛋白质组应激,并直接反映聚集体的局部极性变化,为理解蛋白质聚集机制及细胞恢复过程提供了重要信息()。
Yu等人开发的双发射极性敏感探针1P2N(P12),通过微调其两亲性,实现了对整个细胞质极性的全面监测,并通过比率成像技术精细地揭示了不同病理条件下细胞极性的变化()。这一成果不仅丰富了细胞极性研究的手段,也为疾病机制的深入探索提供了有力支持。
最后,汇总了其他几种基于多环芳烃的极性敏感探针 (P13-P17) ,这些探针虽然在解析细胞极性方面具有类似的生物学应用,但各自独特的化学结构和性质为研究者提供了多样化的选择,进一步推动了极性敏感探针在生物医学领域的应用与发展。
2.1.2. 香豆素衍生物
香豆素,作为一种典型的荧光团骨架,其核心结构为功能化的1-苯并吡喃-2-酮母核(见),广泛存在于自然界中,特别是多种植物如甜三叶草与唐卡豆。历史上,A. Vogel于1820年首次从唐卡豆中分离出此化合物,但初期误将其鉴定为苯甲酸;随后,Nicholas Jean Baptiste Gaston Guibourt完成了相同的工作,并赋予其“香豆素”之名,这一命名源自法语中对唐卡豆的称呼(coumarou)。如今,香豆素及其衍生物可通过多种精心设计的合成路径获得,其中,水杨醛与乙酸酐的经典反应标志着香豆素化学合成领域的开创性进展。 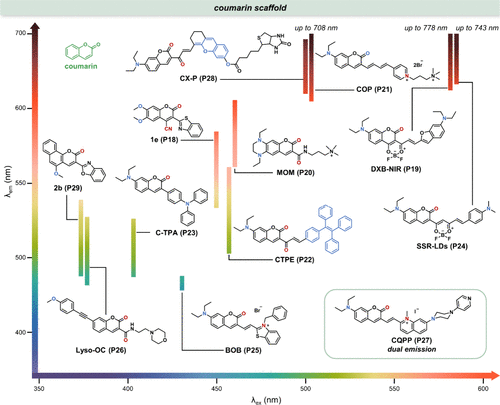 图 8. 基于香豆素母核的探针及其溶剂化显色特性示例
图 8. 基于香豆素母核的探针及其溶剂化显色特性示例
尽管香豆素在探针开发、合成策略、生物活性及荧光传感应用等方面已有广泛研究综述,但聚焦于其极性敏感特性的探讨仍显不足。因此,本文聚焦于香豆素母核衍生的极性传感器,深入剖析其在生物学领域的应用潜力。展示了若干具有代表性的香豆素类生物极性感应探针,这些探针在极性变化时展现出多样化的荧光响应模式,包括但不限于发射波长(λem ,)及荧光强度()的变化。通过精细的结构调整,这些衍生物能够实现发射波长在可见光至近红外区域的灵活调控,从而满足多样化的生物应用需求。
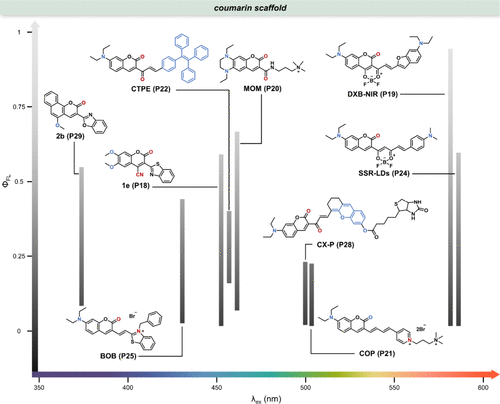
图 9. 一些基于香豆素的极性敏感探针在极性溶剂(低 ΦFL)和非极性溶剂(高 ΦFL)中的荧光量子产率(ΦFL)。
Bizzarri团队致力于开发新型香豆素衍生物,旨在提升细胞成像的分辨率。其中,1e(P18) 凭借其显著的溶剂化显色效应脱颖而出:在水等极性溶剂中几乎不发光(ΦFL = 0.01),而在二氧六环等非极性溶剂中则展现出强烈的荧光(ΦFL = 0.59,)。此外,1e(P18) 在403 nm激发下展现出双发射特性,且其比率对极性高度敏感,使之成为理想的极性比率探针。利用这一特性,研究团队成功获得了CHO细胞内的生物极性比率测量图像()。进一步地,他们发现1e(P18) 的荧光寿命同样受极性显著影响,为细胞局部极性的分析提供了另一维度的信息。通过共聚焦实验与细胞器特异性荧光染色标记物的联用,研究揭示了1e(P18) 倾向于定位于细胞膜等亲脂性区域,这一发现与其疏水结构特性相吻合,为理解其在细胞内的分布与功能提供了重要线索。
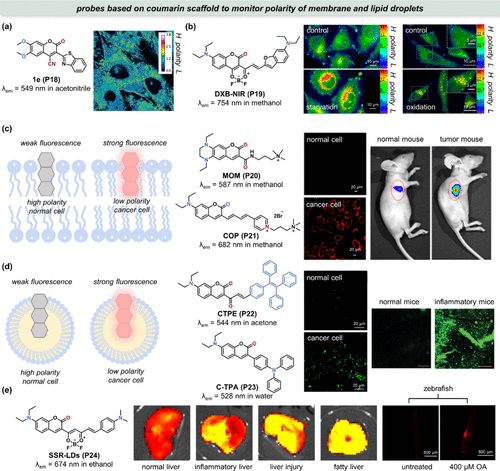
图 10. 用于膜和脂滴检测的香豆素基极性敏感探针。(a) 1e(P18) 的结构及其用于 CHO 细胞极性分析的比率图;(b) DXB-NIR(P19) 的结构以及HeLa 细胞的比率测量图像 ;(c)左图:极性敏感探针对膜的强度响应,中图:MOM(P20) 和COP(P21) 的结构,右图:正常细胞(HEK293T)和癌细胞(HeLa)共聚焦图像,以及对应的小鼠成像; (d) 左:极性敏感探针对脂滴的强度响应,中:CTPE(P22) 和C-TPA(P23) 的结构,右:正常细胞(3T3)和癌细胞(4T1)的共聚焦图像,以及正常小鼠和炎症小鼠经的组织切片成像;(e) 左图:SSR-LDs(P24) 的结构,中图:活体小鼠肝脏器官的荧光成像,右图:未处理和油酸(OA)处理斑马鱼的荧光成像。
在深入探讨细胞生物学与材料科学的交叉领域时,极性敏感探针成为了监测活细胞在复杂应激环境下极性动态变化的有力工具。Klymchenko团队研发的推拉式二氧硼烷探针DXB-NIR(P19),凭借其卓越的远红外至近红外区域溶剂化显色特性,在环己烷和二甲基亚砜中的发射波长分别在622 nm和778 nm(),为生物膜及脂滴(LDs)的研究开辟了新径。该探针被成功应用于监测HeLa细胞在饥饿与氧化应激条件下的脂质区反应,揭示了这些应激状态诱导的局部极性急剧增强的现象,并通过比率测量图像清晰地区分了各脂质区的独特特征()。
近年来,癌症研究揭示了癌细胞内多种亚细胞器(如线粒体和溶酶体)相对于正常细胞的极性降低现象,而细胞膜极性的变化机制则尚待深入探索,尤其是其可能与异常脂质代谢密切相关。为此,Feng等研究者通过精细调控香豆素母核的结构,设计了一系列具有细胞膜靶向性的探针,如MOM(P20) 和COP(P21)。这些探针不仅通过共定位实验验证了其优异的靶向性能,还揭示了它们在癌细胞膜及肿瘤组织中的特异性点亮能力()。此外,利用荧光量子产率(ΦFL)与极性之间的关联,研究进一步证实了肿瘤组织相较于正常组织具有更低的极性,这与先前多环芳烃传感器的研究结果相呼应。值得注意的是,COP(P21) 探针的近红外发射特性为其在体内成像应用提供了广阔前景()。
针对低密度脂蛋白(LDs)的特异性标记,Lin等人创新性地引入了四苯基乙烯(TPE)作为增强亲脂性的修饰分子,开发了CTPE(P22) 极性敏感荧光探针。同时,Zuo等人也采用类似策略,利用三苯胺(TPA)模块合成了C-TPA(P23) 探针。这两种探针在4T1细胞中均能与尼罗红荧光标记的LDs相符合,有效区分了正常细胞与癌细胞的LDs极性差异()。尤为重要的是,CTPE(P22) 探针在炎症小鼠模型中的应用,通过皮下组织切片的荧光图像直观展示了炎症组织中LDs极性的降低()。
为了将荧光成像技术进一步拓展至动物模型体内研究,Lin团队成功开发了SSR-LDs(P24) 这一高极性灵敏度的近红外探针。该探针不仅成功监测了肝脏病变过程中LDs极性的动态变化,还实现了对油酸(OA)处理斑马鱼的体内成像。与正常肝脏相比,病变肝脏区域显示出更强的荧光信号,进一步证实了其极性降低的结论(),与先前研究保持一致。
此外,香豆素母核探针经特定引导基团修饰后,其应用范围得以拓展至其他细胞器。Xiong等人研发的BOB(P25) 荧光探针,作为首个用于监测线粒体极性的工具,展现了独特的比率荧光成像特性。尽管其发射波长(λem )随溶剂极性变化未发生显著红移(),但其绿色通道与红色通道强度比与极性之间却呈现出良好的线性关系(),为线粒体极性变化的精确测量提供了可能。通过与MitoTracker Green FM的共定位实验,BOB(P25) 探针被证实能够精准靶向线粒体()。更重要的是,该探针不依赖于线粒体膜电位,因此在多种应激条件下均能作为稳定的极性指示剂使用。此外,BOB(P25) 还展示了在区分癌细胞与正常细胞线粒体极性方面的潜力,揭示了癌细胞线粒体极性显著降低的现象()。
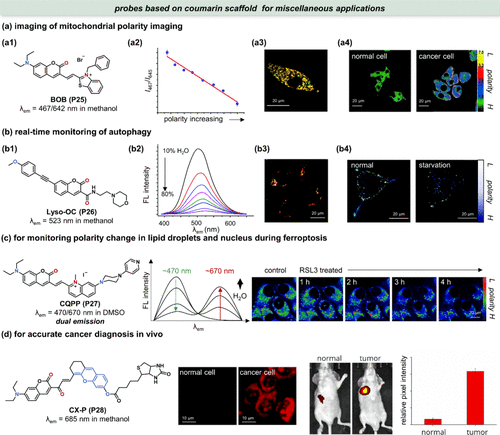
图 11. 使用香豆素极性敏感探针的其他应用。(a1) BOB(P25) 的结构; (a2)I467/I645 与溶剂极性的线性关系;(a3) MitoTracker Green FM 与 BOB (P25) 的共定位成像;(a4)正常细胞中线粒体的极性高于癌细胞; (b1) Lyso-OC (P26) 的结构;(b2)不同 H2O/THF混合物(水从 10% 到 80%)中Lyso-OC(P26) 的荧光发射光谱;(b3)LysoTracker Red 和 Lyso-OC (P26) 的共聚焦图像;(b4)饥饿状态下 MCF-7 细胞被Lyso-OC(P26) 染色的荧光强度图;(c) 左图:CQPP(P27) 的结构,中图:CQPP(P27) 的λem 和强度对极性增加的响应,右图:HT-1080细胞在铁死亡中被CQPP(P27) 染色的脂滴极性成像;(d) 左图:CX-P(P28) 的结构;中图:正常细胞和癌细胞被CX-P(P28) 染色后的共聚焦图像;右图:皮下注射CX-P(P28) 后正常小鼠和肿瘤小鼠的荧光成像及相对像素强度量化。
Meng团队率先开发了双光子探针溶酶体Lyso-OC (P26) ,该探针旨在通过捕捉溶酶体在自噬体与溶酶体膜融合期间极性的动态变化,实现对细胞自噬过程的精密监测。自噬过程始于自噬体的形成,随后通过膜融合机制将内容物递送至溶酶体进行降解。此融合事件可能因自噬体与溶酶体间的物理化学异质性而导致溶酶体极性变动。基于此机制,Lyso-OC(P26) 被精心设计以特异性追踪这一关键过程,并通过与溶酶体标记物Lyso Tracker Red的共聚焦成像验证了其高效靶向性()。实验结果显示,在饥饿诱导的自噬激活状态下,荧光信号显著减弱(),直接反映了膜融合过程中溶酶体极性的增强。然而,仅凭荧光强度变化来量化极性可能受到局部探针浓度不均的干扰。
为了克服这一局限性,Liu团队创新性地推出了LDs/细胞核双靶向比率荧光探针CQPP(P27) ,实现了对细胞微环境极性在铁死亡中的绝对量化监测。铁死亡常伴随脂质代谢的紊乱,尽管铁死亡可能影响LDs结构与极性的假说尚存争议,CQPP(P27) 的研制正是为了填补这一研究空白。该探针凭借其独特的双发射特性(λem1 ≈ 470 nm, λem2 ≈ 670 nm),在极性增加时展现出λem1 荧光减弱而λem2荧光增强的现象(),为比率成像分析极性变化提供了有力工具。在HT-1080细胞模型中,CQPP(P27) 成功捕捉到RSL3诱导铁死亡过程中LDs极性显著降低的现象,并揭示了极性梯度从LDs核心至表面递增,在铁死亡中逐渐均匀化的动态变化,有力支持了LDs极性增强的假说。从分子机制层面看,CQPP(P27) 的双发射特性源于香豆素部分的局部激发态(LE)与阳离子喹啉鎓延伸π共轭诱导的分子内电荷转移(ICT)态之间的相互作用,极性变化直接影响LE与ICT发射的相对强度()。
此外,针对细胞类型的特异性识别,Li团队开发了基于生物素受体过表达特性的极性敏感近红外探针C-XP(P28),用于癌症的体内诊断。该探针的双靶向设计极大降低了正常细胞中的背景信号,显著提升了信噪比(SNR),同时其近红外(NIR)特性使得在肿瘤小鼠模型中的实时成像成为可能()。实验结果表明,C-XP(P28) 在动物实验中保持了优异的信噪比性能。值得注意的是,尽管中展示的探针(P29) 同样具备显著的极性灵敏度,但在化学生物学应用领域的独特贡献亦不容忽视。
2.1.3. 尼罗红衍生物
尼罗红(P30),作为一种广受赞誉的荧光染料,以其独特的溶剂化变色效应在光谱学研究中占据显著地位()。其核心结构特征在于9位上连接有二乙氨基作为强电子给体,而5位则承载着羰基作为电子受体,共同构成了高效的推拉电子体系(push-pull chromophore)。这一结构特性使得尼罗红在溶剂极性变化时展现出显著的吸收与发射波长红移现象。在非极性溶剂如庚烷中,其最大吸收波长(λabs)和发射波长(λem )分别位于484nm和529nm;而当环境转换为极性溶剂如甲醇时,这两个波长则分别红移至554nm和638nm。
然而,尼罗红(P30) 在水介质中的溶解性有限,且伴随亮度急剧衰减,这一特性限制了其直接应用于水溶液环境。鉴于此,尼罗红及其衍生物在亚细胞结构如脂滴(LDs)和细胞膜的染色中发挥了重要作用。为了拓宽尼罗红的应用领域,科研界致力于探索多样化的合成策略,以实现对其母体结构的功能化修饰。
经典的尼罗红合成路径涉及亚硝基酚与萘酚之间的缩合反应,这一反应奠定了尼罗红类染料合成的基础。此外,尼罗蓝在稀硫酸中的水解反应也为尼罗红的制备提供了一种替代途径。为了进一步提升尼罗红衍生物的实用性能,当前的研究重点聚焦于优化合成策略,旨在提高衍生物的水溶性并克服其在水介质中量子产率下降的问题。这些努力不仅丰富了尼罗红家族成员的种类,也为相关领域的科学研究提供了更为多样化的工具选择。
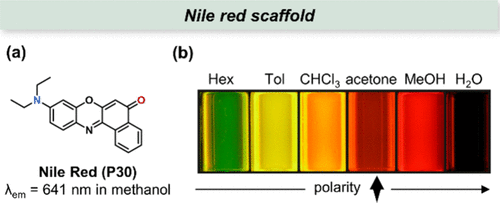
图 12. (a) 尼罗红(P30) 的结构。(b) 溶解在不同极性溶剂中的尼罗红(P30) 的荧光图像。
Klymchenko及其团队开创性地设计了一系列基于尼罗红骨架的膜靶向荧光探针(如所示),并通过一系列典型案例进行了系统性总结。细胞质膜的脂质双层结构以其独特的不对称性著称,这一特性在细胞凋亡过程中易受破坏,导致局部极性发生显著变化。尽管Annexin V-FITC作为商业探针已用于监测这种不对称性变化,但它无法直接揭示凋亡过程中的极性动态。为此,Klymchenko团队研发了NR12S(P31) 探针,该探针在极性增强时,其发射波长(λem )向长波方向移动(红移),从而通过绿色通道与红色通道强度比的变化来量化膜极性的变化。实验结果显示,经甲基-β-环糊精处理(通过胆固醇提取扰乱脂质序)及放线菌素D诱导凋亡的细胞膜均展现出增强的极性,并伴有细胞形态的典型变化,如气泡形成与细胞表面脱离,这为细胞凋亡检测提供了新的视角。 
图 13. 应用尼罗红检测膜脂序。(a) 基于尼罗红的极性敏感探针的 λem 对膜脂序变化的响应。(b) NR12S(P31) 的结构和用于外质膜小叶极性谱分析的荧光比率图。 (c) 左图:NR4A(P32) 的结构,中图:NR4A(P32) 分别不可逆或可逆地与生物膜结合,右图:COS-7 细胞质膜极性成像。 (d) NR探针(P33-P39) 的结构,右图:在2 mM H2O2(37 °C下1小时)造成的氧化应激下KB细胞细胞器膜的极性成像。
随着超分辨率显微技术的飞速发展,对能够精细描绘细胞膜组织细节的荧光探针需求日益增长。然而,NR12S(P31) 因其光稳定性和抗光漂白性能的限制,难以满足这一需求。为此,Klymchenko团队进一步开发了NR4A(P32) 探针,该探针通过缩短烷烃链实现了与细胞膜的可逆结合,并仅在结合状态下激活荧光。这种设计确保了当一个NR4A(P32) 分子因连续激发而漂白时,另一个分子能迅速替代,从而维持成像稳定性。利用NR4A(P32) 的这一优势,他们成功将其应用于SR-PAINT技术中,实现了对细胞膜脂质序异质性和nm级拓扑结构的精细解析()。
不仅如此,Klymchenko团队还拓展了尼罗红探针的应用范围,设计了一系列带有特异性细胞器靶向配体的探针 (P33-P39) ,涵盖了内质网、线粒体、溶酶体、高尔基体、质膜及脂滴等关键细胞器。这些探针展现出良好的靶向选择性,能够揭示不同细胞器间脂质序的差异。特别是在氧化应激条件下(如H2O2暴露),通过溶剂化显色效应,他们观察到LDs、溶酶体和线粒体等细胞器膜极性发生显著变化,且溶酶体、内质网和线粒体对高渗透压最为敏感。
此外,尼罗红(P30) 作为一种独特的探针,还被应用于监测蛋白质构象变化过程中的极性变化。以Melittin为例,这种两亲性短肽在低离子强度下以无规线圈形式存在,但随着浓度或离子强度的增加,会转变为有序的α螺旋构型并形成四聚体。Wolff等人的研究表明,尼罗红(P30) 能够敏锐地捕捉到Melittin四聚体形成过程中极性环境的变化,表现为光谱的显著偏移。类似地,尼罗红也被成功应用于钙调蛋白和卵清蛋白等其他蛋白质的研究中,通过与新生成的疏水结构域结合,引发光谱移动,为蛋白质折叠与组装机制的研究提供了有力工具。
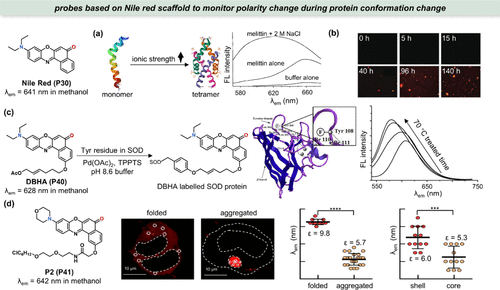
图 14. 尼罗红在检测蛋白质微极性中的应用。(a) 离子强度增加时 melittin 的构象变化以及用尼罗红 (P30) 染色后的相应荧光光谱;(b) 用尼罗红(P30) 染色的溶菌酶纤维,以监测其聚集过程;(c)DBHA(P40) 和 DHBA 标记的 SOD 蛋白的结构及成像;(d) 左图:P2 (P41) 的结构;中图:荧光成像;右图:λem 对折叠和聚集蛋白的微极性的量化。
Hammarström等人巧妙地运用了尼罗红(P30) 这一荧光染料,以监测溶菌酶淀粉样纤维形成的动态过程(),并对体外多种淀粉样纤维进行了详尽表征。相较于传统的淀粉样蛋白探针——硫黄素T(ThT),自1989年武田团队首次报道以来便作为标准染料使用的ThT,尼罗红(P30) 展现出了独特的技术优势。其首要优势在于对酸碱度的低敏感性,这使得尼罗红在酸性环境下的纤维颤动追踪中表现出色,优于ThT。此外,尼罗红的荧光特性显著,其激发与发射波长相较于ThT分别发生了90 nm和125 nm的红移,为体外纤维生长的显微镜监测开辟了新的光谱视野。然而,尼罗红(P30) 的高度亲脂性限制了其在细胞内应用,易与脂质体结合,故目前主要应用于蛋白质的体外分析。这一发现表明,尼罗红与ThT在淀粉样纤维检测上可形成有效互补。
为了特异性追踪蛋白质残基周围微环境极性的微妙变化,Ma等人创新性地采用了DBHA(P40) 探针,通过酪氨酸选择性修饰反应,精准标记了超氧化物歧化酶(SOD)蛋白中的Tyr108残基。SOD蛋白作为同源二聚体,其结构特点包括反平行的八链β管、外环及独特的Tyr108残基,后者位于接触区附近()。在蛋白质变性过程中,Tyr108微环境的极性变化尤为显著。实验结果显示,DBHA 标记的SOD在70°C加热3小时后,λem 由608 nm显著蓝移至579nm,同时荧光强度增强,这反映了Tyr108周围微环境极性降低,可能与分子间二硫键形成及β片间非共价相互作用的调整有关,是SOD热变性过程中的典型现象。
Liu等人则利用HaloTag介导的AggTag技术和HaloTag弹头探针,开发出了一种基于尼罗红的极性敏感探针P2(P41),旨在量化研究致病蛋白聚集体内部的极性分布。他们通过引入吗啉基团替代二乙氨基,显著提升了探针的水溶性,从而优化了信噪比。进一步地,借助λ-去卷积荧光成像技术,该探针揭示了细胞聚集蛋白内部极性的异质性:折叠蛋白极性高于聚集蛋白,且聚集体外壳区域的极性明显高于核心区域()。这一发现为理解细胞聚集体内部结构的复杂性提供了新视角。
此外,Ma团队还通过将尼罗红与线粒体靶向单元三苯基膦结合,合成了极性敏感的光热疗法(PTT)敏化剂NRTP(P42)。与商用MitoTracker Deep Red FM(MTDR)的共聚焦实验证实了NRTP(P42) 对HepG2细胞线粒体的高效靶向性(皮尔逊系数高达0.89)。基于这一特性,NRTP(P42) 被应用于监测光诱导细胞死亡过程中的线粒体极性变化。实验结果显示,在正常HepG2细胞中,比率测量图像呈现均匀的绿黄色伪色;而在561nm高功率激光照射5分钟后,伪色转变为蓝绿色,表明线粒体极性显著降低()。该研究首次报道了兼具极性敏感性和线粒体靶向性的PTT增感剂,为光热疗法的研究与应用开辟了新方向。 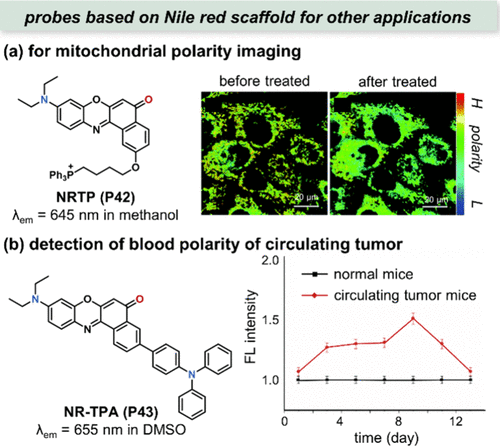 图 15. (a) NRTP(P42) 的结构及细胞成像 (b) 左图:NR-TPA(P43) 的结构及归一化荧光强度。
图 15. (a) NRTP(P42) 的结构及细胞成像 (b) 左图:NR-TPA(P43) 的结构及归一化荧光强度。
Lin及其研究团队进一步在尼罗红结构上引入了三苯胺分子,成功合成了NR-TPA(P43) 这一创新型荧光探针,该探针首次揭示了正常小鼠与循环肿瘤小鼠血液中极性动态变化的奥秘。如展示,在利用免疫缺陷小鼠(balb/c-nu)模型进行的实验中,注射HeLa细胞后,观察到归一化荧光强度逐渐上升,这一趋势在第九天达到顶峰,随后逐步回落至基线水平。鉴于循环肿瘤细胞在癌症转移机制中的核心地位,这一研究成果为开发新型肿瘤诊断探针提供了宝贵的启示与设计思路,预示着在癌症早期检测及转移监测领域具有广阔的应用前景。
2.1.4. 中性红衍生物
中性红(P44) ,作为一种经典的pH指示剂,在生物化学领域扮演着重要角色,其颜色在pH值介于6.8至8.0的范围内会由红色转变为黄色,这一特性使其广泛应用于溶酶体的特异性染色中。此外,中性红(P44) 吸收测定法凭借其高灵敏度与准确性,已成为评估细胞培养物中活细胞数量的关键手段之一,同时也是生物医学研究及环境监测中不可或缺的细胞毒性检测方法。
Ma等人通过巧妙的分子设计,将活性分子引入中性红的发色团结构中,成功合成了CGTDP(P45) 与CMTDP(P46) 两种新型探针()。其中,CGTDP(P45) 特异性地标记精氨酸残基,而CMTDP(P46) 则针对胱氨酸残基进行标记,这种精确性为后续的生物学研究提供了极大的便利。
进一步的研究表明,CGTDP(P45) 对不同极性溶剂的响应极为敏感,如所示,随着溶剂极性的增加,其荧光发射波长(λem )发生轻微红移,同时荧光强度显著下降,这一现象为探索蛋白质微环境极性变化提供了有力的工具。则展示了CGTDP标记的兔肌酸激酶(CK)在酸诱导变性过程中荧光发射光谱的动态变化,当pH值从6.3逐渐降至5.2时,光谱发生显著变化,这一结果与先前文献报道相吻合,进一步验证了CGTDP作为极性探针的可靠性。
另一方面,CMTDP(P46) 探针也在蛋白质构象研究中展现出独特价值。通过监测牛血清白蛋白(BSA)在转变过程中Cys34周围的局部极性变化,CMTDP(P46) 揭示了蛋白质构象调整时疏水残基与亲水残基相对位置的深刻变化。这一过程可能伴随着原本埋藏于蛋白质内部的疏水残基的逐渐暴露,或亲水残基被新形成的结构所包埋,为理解蛋白质功能与结构之间的关系提供了新的视角。 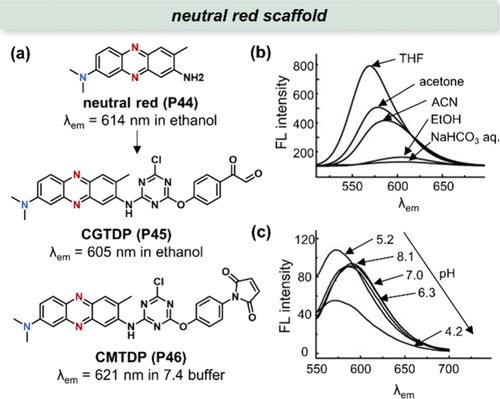
图 16. (a) 中性红(P44) 及衍生探针 CGTDP(P45) 和 CMTDP(P46) 的结构;(b) CGTDP在不同溶剂中的λem 光谱;(c) CGTDP标记的兔肌酸激酶(CK)在不同 pH 值的缓冲液中变性过程中的λem 和强度响应。
2.1.5. 酞酰亚胺和萘酰亚胺衍生物
酞酰亚胺与萘酰亚胺家族探针以其独特的溶剂化显色特性在化学传感领域占据一席之地。Imperiali团队在此基础上,创新性地合成了新型极性敏感荧光团6DMN(P47) ,旨在精准监测蛋白质间的相互作用动态。如所展示,6DMN(P47) 经过精心设计,被转化为Fmoc保护的氨基酸衍生物,并通过标准的固相肽合成技术巧妙地嵌入到肽链之中。这一标记肽在460 nm与600 nm波长附近展现出双发射带的特征,当其与特定的Src同源2(SH2)结构域结合后,长发射带的荧光强度显著增强,而短发射带则保持相对稳定,这一特性使其成为构建比率传感器的理想选择。
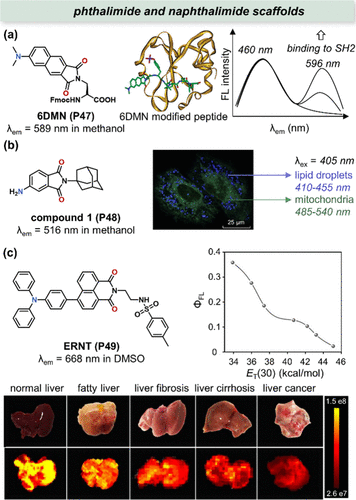 图 17. 基于萘酰亚胺母核的极性敏感探针及其生物应用。(a) 6DMN(P47) 的结构及荧光强度显著图谱;(b) 1(P48) 的结构及共聚焦图像;(c) ERNT(P49) 的结构荧光图像。
图 17. 基于萘酰亚胺母核的极性敏感探针及其生物应用。(a) 6DMN(P47) 的结构及荧光强度显著图谱;(b) 1(P48) 的结构及共聚焦图像;(c) ERNT(P49) 的结构荧光图像。
Basarić团队则另辟蹊径,开发出一种对极性变化极其敏感的荧光探针化合物1(P48)。该探针的荧光发射波长(λem )在溶剂极性变化下展现出显著的位移,从环己烷中的408nm红移至甲醇中的516nm,且在此过程中保持了较高的荧光量子产率(甲醇中为0.17)。尤为引人注目的是,当该探针应用于NCI-H460细胞时,展现出了对脂滴(LDs)与线粒体的双重靶向能力,这两者在细胞内分别代表了非极性与极性最强的区域之一。通过与尼罗红(Nile Red)和线粒体追踪染料MitoTracker Deep Red FM的共定位实验,这一双重靶向特性得到了有力证实。因此,该探针能够利用单一激发光源,通过不同荧光通道(蓝色通道410-455nm针对非极性LDs,绿色通道485-540nm针对极性线粒体)同时成像这两种细胞器,实现了“一探双得”的高效监测,如所示。
为了进一步丰富细胞器靶向探针的种类,Lin等人精心设计了ERNT(P49) 这一独特的荧光探针,专用于在多种肝损伤模型中成像内质网(ER)的极性变化。实验结果显示,随着ER极性的增加,ERNT(P49) 的荧光发射强度呈现明显的下降趋势()。此外,该探针还巧妙地引入了甲基磺酰胺分子作为ER靶向基团,这一设计进一步增强了其在内质网中的定位准确性。通过与商业探针的共定位实验,ERNT(P49) 对ER的特异性靶向能力得到了充分验证。随后,ERNT(P49) 被成功应用于多发性肝损伤模型的荧光成像中,揭示了ER极性变化与肝损伤进展之间的紧密联系。如所示,在正常肝脏中,ERNT(P49) 的荧光强度显著高于肝损伤模型组,这一发现为理解肝损伤过程中ER极性变化的生理病理机制提供了重要线索。
2.1.6. 咔唑衍生物
在化学与生物学交叉领域,众多极性敏感探针的设计巧妙融入了富电子的三苯胺或咔唑分子作为电子给体核心,赋予其独特的电子传递特性。详尽展示了这一系列探针的分子架构及其响应极性变化的能力。 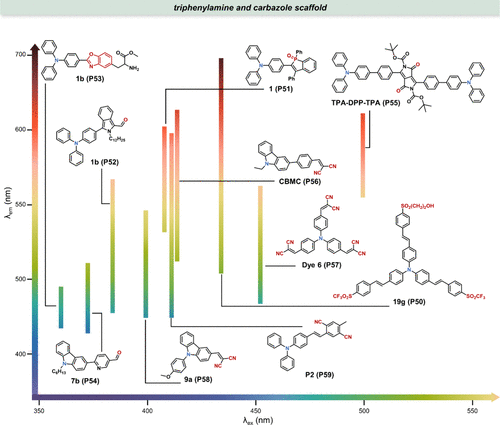
图 18. 基于三苯胺和咔唑母核的探针及其溶剂化显色特性示例。
Blanchard-Desce研究团队创新性地设计出一种Y型结构的探针19g(P50),其在极性变化中展现出极高的灵敏度,从甲苯到二甲亚砜的转换过程中,其发射波长可显著移动约200nm。尤为值得注意的是,该探针在700至1000nm的近红外区域不仅具有高亮度,还表现出双光子吸收特性,为深层组织成像提供了可能。在细胞成像实验中,这种两亲性探针倾向于特异性聚集于细胞内的特定区域(),虽初步推测为溶酶体,但尚需进一步实验验证。
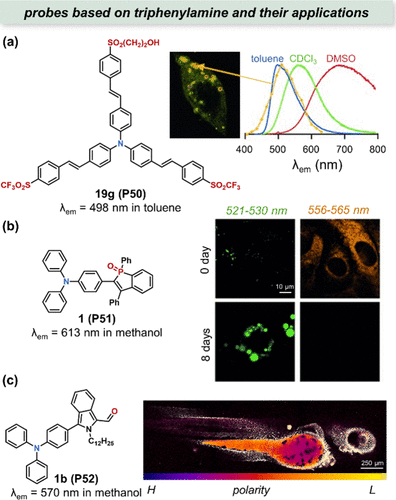
图 19. 三苯胺基探针的应用。(a) 三苯胺基 Y 型19g(P50) 的结构及其在 HEK293 细胞中的极性成像;(b) 以苯磷氧化物为电子受体的1(P51) 的结构及细胞成像;(c) 1b(P52) 和I520-800/I420-500比率图。
Yamaguchi及其同事则通过在三苯胺或甲氧基与氧化苯磷骨架之间构建连接,合成了一系列类似物,其中1(P51) 尤为引人注目。该探针不仅展现了卓越的溶剂化显色能力(环己烷中λem =508nm,甲醇中λem =613nm),而且在宽泛的极性和原生溶剂环境中均能保持较高的荧光量子产率(甲醇中ΦFL=0.22)。利用此特性,研究者成功监测了3T3-L1前脂肪细胞向脂肪细胞分化过程中脂肪的形成,通过绿色与橙色通道的划分,直观呈现了细胞内非极性与极性区域的变化趋势()。尤为重要的是,1(P51) 作为首个报道的磷基荧光染料,已成功应用于活体动物染色,展现了其在生物医学领域的巨大潜力。
针对有机染料在生物体内易降解、难以长期追踪的挑战,Jiao等人开发了基于三苯胺的探针1b(P52),旨在绘制活体脂滴(LD)的极性图谱。通过与斑马鱼共培养7天的实验,不仅验证了1b(P52) 优异的生物相容性和低细胞毒性,还展示了其即使在长时间暴露下仍能维持良好信噪比的能力,成功绘制出斑马鱼的极性分布图()。
此外,还展示了其他几种探针 (P53-P59) ,它们同样展现出显著的极性灵敏度,但在化学生物学领域的具体应用尚需进一步探索或优化,以充分发挥其潜在价值。
2.1.7. 其他衍生物
在和中,作者系统性地归纳了源自多种母核结构的极性敏感探针,这些探针在生物学极性变化监测中展现出独特的应用价值。接下来,作者将深入介绍其中几种探针,它们已成功地应用于绘制生物环境中的极性分布图。
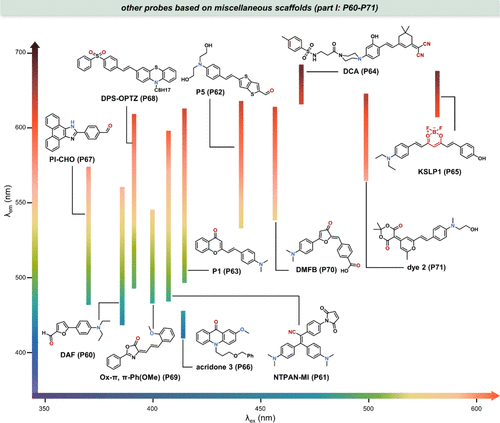
图 20. 基于各种母核的部分探针 (P60-P71) 及其溶剂化显色特性。
Klymchenko研究团队成功合成了针对脂滴(LDs)的靶向探针DAF(P60),该探针展现出强烈的正溶剂化显色效应,其发射光谱在甲苯至甲醇溶剂转换中发生了显著的119 nm位移,同时在二甲基亚砜中实现了高达0.97的量子产率。利用DAF(P60) 的这一卓越特性,通过比率成像技术(I500-600/I415-480),研究团队成功绘制了LDs的极性图,揭示了从LDs核心到表面极性逐渐增加的梯度现象,且大LDs核心区域的极性明显低于小LDs。这一研究不仅为LDs的可视化提供了新的工具,还开辟了探索LDs环境敏感性(如极性、成分、粘度等)的新领域。 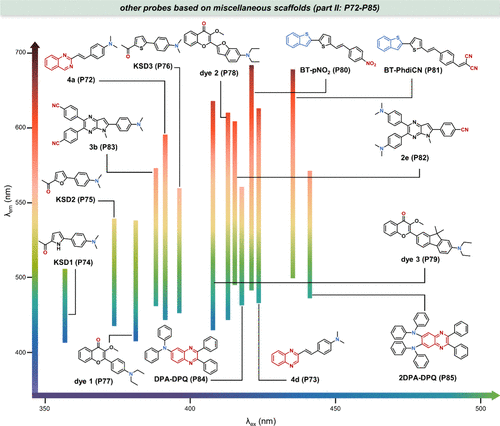
图 21. 基于各种母核的部分探针 (P72-P85) 及其溶剂化显色特性。
2020年,Hong等人报道了基于聚集诱导发光机制的荧光探针NTPAN-MI(P61),该探针用于量化蛋白质解折叠过程中亚细胞极性的变化。NTPAN-MI(P61) 通过特异性地激活标记未折叠蛋白质的暴露硫醇基团,实现了对蛋白稳态破坏的实时报告。如所示,在嘌呤霉素(一种蛋白质合成抑制剂)处理下,HeLa细胞内不同区域的极性发生了显著变化,进一步证实了NTPAN-MI(P61) 在细胞内未折叠蛋白检测中的广泛应用,特别是其首次揭示了细胞核内未折叠蛋白的存在。
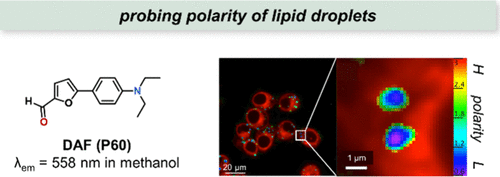
图 22. DAF(P60) 的结构及其通过比率测量图像对 KB 细胞中脂滴极性的分析
随后,Liu等人于2022年报道了另一种极性敏感探针P5(P62),其活性醛分子结构通过希夫碱反应选择性地修饰了聚集蛋白的赖氨酸残基,而非折叠蛋白。这一特性使得P5(P62) 能够揭示不同药物应激诱导下蛋白质组聚集过程中大点状与小点状之间的极性异质性()。此外,Liu团队还开发了P1(P63),该探针同时展现出极性依赖的荧光发射波长偏移和粘度依赖的荧光强度增强,通过监测这些变化,他们发现极性变化在蛋白质聚集过程中先于粘度变化发生(),为蛋白质聚集机制的研究提供了新视角。
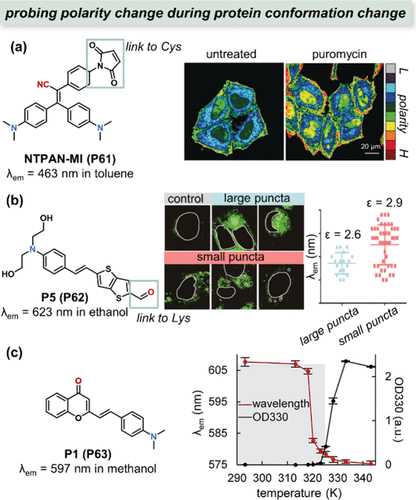
图 23. 分析蛋白质构象变化过程中极性变化的探针。(a) NTPAN-MI(P61) 的结构及极性成像; (b) P5(P62) 的结构及荧光成像;(c) P1(P63) 的结构及浊度测量。
Dong等人则聚焦于内质网(ER)膜相分离的研究,开发了一种近红外探针DCA(P64),该探针同样采用甲基磺酰胺作为ER靶向基团。通过DCA(P64) 的监测,研究团队在H2O2诱导的氧化应激下观察到ER膜脂质秩序的显著变化,表现为比率测量图像中的明显蓝移(),指示了极性降低和有序脂质域的形成。
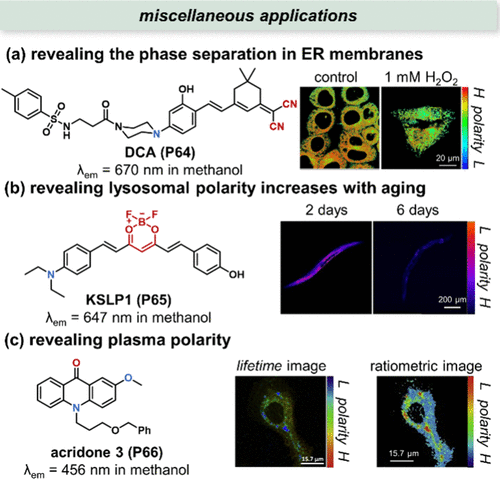
图 24. 所选探针的其他应用。(a) DCA(P65) 的结构及其对氧化应激下 HepG2 细胞 ER 膜的极性成像;(b) KSLP1(P65) 的结构及其在C. elegans衰老过程中对溶酶体的极性成像; (c) 吖啶酮 3 (P66) 的结构及其对细胞质的极性成像(寿命图像和比率图像)。
Li等人则从一系列极性敏感荧光探针中筛选出最佳候选KSLP1(P65),其与商用LysoGreen的共定位实验证实了其在溶酶体中的高度靶向性。利用KSLP1(P65),他们首 次揭示了线虫(C. elegans)溶酶体极性与衰老过程之间的紧密联系。如所示,随着年龄增长,KSLP1(P65) 的荧光强度逐渐降低,表明溶酶体极性增加,为衰老机制研究提供了新的分子标记。
Orte等人则开发了吖啶酮3(P66) 探针,用于量化细胞质的极性。通过建立ET、λem 以及吖啶酮3(P66) 荧光寿命之间的校准关系,他们成功绘制了MDA-MB-231细胞细胞质的极性图谱,尽管获取图像的参数不同,但结果的一致性证明了该方法的稳定性和可靠性()。
值得注意的是,尽管某些探针如dye3(P79) 对极性变化表现出极高的敏感性(从正己烷中的433nm变至甲醇中的632nm),但其在化学生物学领域的应用尚待开发。和中展示了这些探针的结构,旨在为未来的生物应用提供潜在的候选分子。
2.2. 基于ESIPT机制的极性敏感探针
在20世纪50年代,Weller及其同事开创性地揭示了水杨酸分子中发生的激发态分子内质子转移(ESIPT)现象。ESIPT过程通常涉及一个包含氢键给体(如-OH或-NH2)和氢键受体(如=N-或C=O)的荧光团,这些官能团间通过分子内氢键相互作用紧密相连(如所示)。在基态下,这类ESIPT荧光团主要呈现为烯醇式(E)构型。当受到光激发时,会发生超快的烯醇到酮的光异构化(kESIPT > 10-12 s-1),即激发态的烯醇形式(E*)迅速转变为激发态的酮形式(K*)。尽管已有诸多综述聚焦于基于ESIPT的探针设计,但针对其在生物极性成像中的具体应用探讨尚显不足。
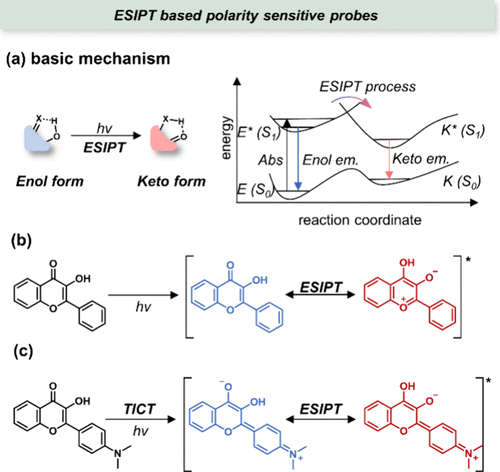 图 25. (a) 基于 ESIPT 的极性敏感探针的机理;(b) Flavonol 的 ESIPT 过程;(c) 当存在电子给体时,TICT 和 ESIPT 可同时发生。
图 25. (a) 基于 ESIPT 的极性敏感探针的机理;(b) Flavonol 的 ESIPT 过程;(c) 当存在电子给体时,TICT 和 ESIPT 可同时发生。
Flavonol 作为一种典型的ESIPT荧光团,在化学生物学领域被广泛应用于极性的可视化研究中。它遵循作者之前讨论的经典ESIPT机制(),通过光致异构化改变荧光特性。进一步地,通过在Flavonol 结构上引入额外的电子给体(例如二甲基氨基),可以设计出新型荧光团,这类荧光团在光激发下能够同时经历分子内电荷转移(ICT)和ESIPT过程(),从而展现出更为复杂的荧光响应特性。 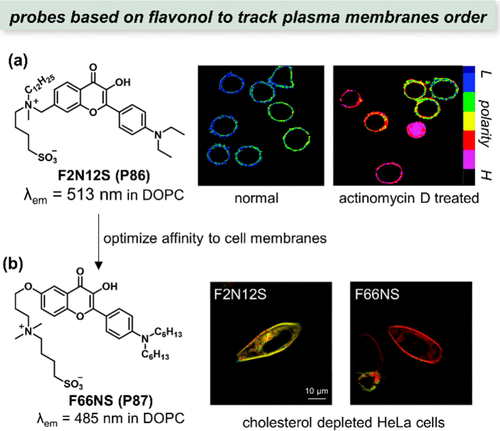
图 26. (a) F2N12S(P86) 的结构及其在正常和凋亡的人淋巴 CEM T 细胞质膜上的极性成像;(b) F66NS(P87) 的设计优化了对细胞膜的靶向性。
鉴于ESIPT过程与周围质子环境的紧密关联性,质子溶剂对基于该机制的荧光探针的光谱特性具有显著影响。这一特性使得该类探针成为监测细胞质(质子丰富)与脂质体(非质子环境)之间极性变化的有力工具。2006年,Mely与Klymchenko等人共同开发了首个比率荧光探针F2N12S(P86),该探针通过监测细胞膜极性变化来指示细胞凋亡过程。实验结果显示,经放线菌素D(一种细胞凋亡诱导剂)处理后,人淋巴CEM T细胞的细胞膜极性显著增加(),这与之前的理论预测相吻合。
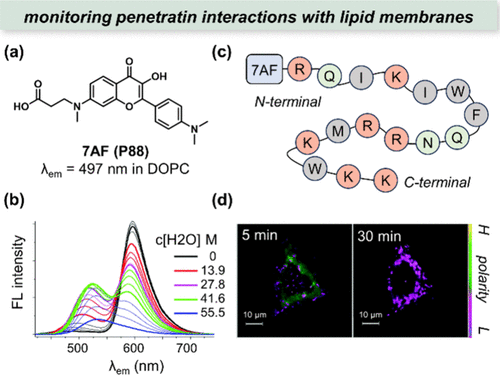
图 27. (a) 7AF(P88) 的结构; (b) 7AF(P88) 在 DMF 和水的混合物中的荧光光谱;(c) 7AF(P88) 标记的渗透蛋白序列;(d) 细胞膜相互作用时极性波动的比率图。
随后,在2013年,Klymchenko团队又报道了一种优化后的探针F66NS(P87),该探针展现出对细胞膜更高的靶向性(),进一步提升了其在细胞极性监测中的应用潜力。
2014年,Mely与Klymchenko等人继续拓展ESIPT探针的应用领域,提出了探针7AF(P88),用于监测穿透素与细胞膜的相互作用。研究发现,在DMF溶液中加入水后,7AF的酮式发射强度(长波长区域)逐渐减弱,而烯醇式发射强度(短波长区域)则逐渐增强()。随后,两个发射带的强度均有所下降,最终仅剩下烯醇式物种的发射。利用固相合成法,研究团队成功制备了N端标记有7AF的穿透肽()。在与HeLa细胞共培养后,观察到7AF标记的穿透肽周围区域极性显著降低(),这一发现为理解穿透素与细胞膜相互作用的分子机制提供了重要线索。此外,其他基于ESIPT的探针也在类似的应用场景中展现出了良好的性能。
2.3. 基于FRET机制的极性敏感探针
荧光共振能量转移(FRET)作为一种非辐射能量传递机制,其核心在于激发态给体分子通过远程的偶极-偶极相互作用,将能量高效地传递给邻近的处于基态的受体分子(如所示)。此过程中,受体分子需具备吸收给体发射波长的能力,但并不要求其随后发出荧光作为能量转移的直接证据(),这一特性在生物化学研究中尤为重要。值得注意的是,由于荧光团与溶剂分子间同样存在复杂的偶极-偶极相互作用(如所示),因此FRET过程可能受到溶剂极性变化的显著影响。

图 28. (a) 基于 FRET 的极性敏感探针的机制;(b) LCP(P89) 的结构; (c) LCP 在 1,4-二氧六环和水的混合物中的荧光光谱;(d) 用 30 μM 顺铂预培养的 HeLa 细胞在不同时间点的成像。
基于上述原理,Lin等人于2022年设计并合成了一种创新的荧光探针LCP(P89,),该探针采用双色荧光信号模式,旨在精准监测药物诱导的细胞凋亡过程中细胞膜极性的动态变化。实验结果显示,随着水分子(作为极性溶剂)的加入,LCP(P89) 的红色发射带强度显著增强,这明确指示了在溶剂极性增大的条件下,FRET过程的有效发生()。
进一步地,当LCP(P89) 被应用于顺铂处理的HeLa细胞体系时,研究者观察到了一种特征性的荧光变化模式:蓝色荧光通道的信号逐渐减弱,而红色荧光通道的信号则逐渐增强()。这一发现不仅验证了FRET探针在细胞环境中的适用性,还强有力地支持了细胞凋亡过程中细胞膜极性增加的科学假说.
2.4. 基于激基缔合物的极性敏感探针
芘,作为探究激基缔合物荧光现象的经典母体结构,其溶液中的荧光光谱展现出独特的双重特征:一是紫色发射带,它标志着独立激发(单体)状态的存在;另一则是蓝色发射带,此带源自激发态二聚体(激基缔合物)的形成,即由一个激发态单体分子与一个未激发单体分子结合而成()。基于这一荧光特性的探针设计,在生物学领域已得到广泛应用,尤其是在识别生物分子间相互作用方面。然而,这些探针在量化环境极性方面的应用尚显不足。此外,研究界还探索了超越芘母体结构的其他荧光团。
2021年,Wong等人创新性地开发了Pyr-A(P90) 探针,旨在监测生物大分子的相分离现象。Pyr-A(P90) 在疏水及高粘性环境中倾向于保持单体状态,但在水溶液中,由于其高度疏水特性,会自发坍缩形成分子内激发态复合物(所示)。这一独特的成像探针,通过其产生的特定荧光光谱模式,能够实现对体外蛋白质液滴及细胞内无膜中心体形成的相分离凝聚体的比率成像(所示)。尽管如此,关于Pyr-A(P90) 在检测和区分无膜蛋白质相分离区域极性方面的通用性和准确性,仍需进一步深入研究和验证。 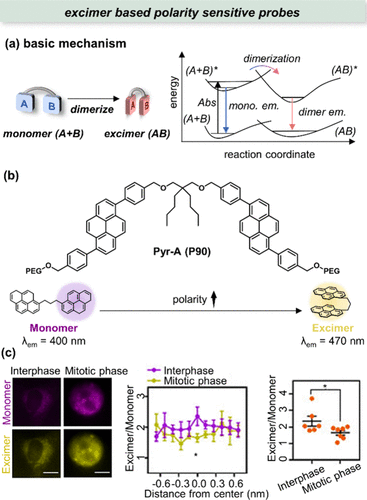
图 29. (a) 基于激基缔合物的极性敏感探针的机制;(b) Pyr-A(P90) 的结构及其对极性变化的反应;(c) HeLa 细胞极性定量。
2.5. 其他类型的极性敏感探针
在生物应用的广阔舞台上,极性敏感聚合物作为一类新兴的荧光探针,正逐步展现其独特的魅力。这类材料凭借其卓越的光学性能、生物相容性以及出色的光稳定性,近年来获得了迅猛的发展与应用。2020年,Huang团队成功开发了极性敏感聚合物碳点(PCDs),这一创新成果为观察细胞自噬期间细胞极性动态变化提供了有力工具。PCDs的制备简便高效,仅通过多巴胺、H2O2与邻苯二胺在常规烧杯中的简单混合即可实现。这些聚合物材料在响应极性变化时,展现出显著的发射波长位移,从非极性二恶烷中的507nm红移至水中的572nm,彰显了其高度的极性敏感性。
次年,Li等人进一步推进了该领域的研究,他们合成了对极性极端敏感的近红外(NIR)荧光N-对苯二胺修饰的碳点(PPh-CDs)。这种材料在二恶烷中的荧光强度竟高达水中的509倍,其卓越的极性识别能力使得它在监测斑马鱼伤口愈合过程中的极性变化中发挥了重要作用。
2022年,Li团队再次取得突破,报道了一种新型碳点——PS-CD,其中创新性地引入了2-甲酰基苯硼酸频哪醇酯作为后改性剂,极大地提升了材料对极性的响应灵敏度。通过精确分析PS-CD的最大发射波长变化,研究揭示了脂滴内部存在广泛的极性异质性,而相比之下,细胞质则展现出相对均匀的极性特征。
尽管极性敏感碳点在极性可视化方面已展现出巨大潜力,但其内在工作机制仍是一个亟待深入探索的科学问题。目前,学术界提出了多种理论模型以解释这一现象。一种观点认为,PCD激发态的能级受溶剂极性调控,从而导致发射光谱的溶剂依赖性变化。另一种解释则聚焦于溶剂分子与PCD表面间的分子间相互作用,如氢键的形成与断裂,这可能是引起极性敏感性的关键因素。此外,还有假说认为溶剂分子可能渗透PCD表层,直接影响发光中心间的距离,进而调控荧光特性。因此,未来研究需致力于构建更为全面深入的理论框架,以全面解析极性敏感PCD的工作机理。
3. 用于粘度检测的荧光探针
在真核细胞的精细调控网络中,溶酶体扮演着大分子降解、资源回收及信号转导的核心角色。任何影响其正常运作的缺陷均可能引发溶酶体功能障碍,导致大分子降解不全或残留,进而在溶酶体内异常积聚“代谢废物”,这是诱发溶酶体贮积病(LSDs)的病理基础。此类“拥挤储存”现象很可能加剧局部微环境的粘度上升。截至目前,LSDs家族已囊括逾70种疾病,通过监测溶酶体粘度的异常变化,为这些疾病的早期诊断与有效治疗开辟了新途径。
图 30. 对粘度敏感的荧光探针是评估生物环境粘度变化的有效工具。
另一方面,线粒体作为细胞的“能量工厂”,其粘度特性同样至关重要。粘度的异常波动与一系列疾病紧密相关,如线粒体粘度的增加会抑制电子传递链的效率,促进细胞色素C的释放,从而加剧动脉粥样硬化及恶性肿瘤的风险。此外,一个精密的蛋白稳态网络负责调控蛋白质的合成、折叠、再折叠及降解过程,其失衡(尤其在疾病或衰老条件下)易导致蛋白质错误折叠与积聚,形成高粘度的致密病理聚集体,这与阿尔茨海默病(AD)和帕金森病(PD)等神经退行性疾病的发病机制紧密相关。 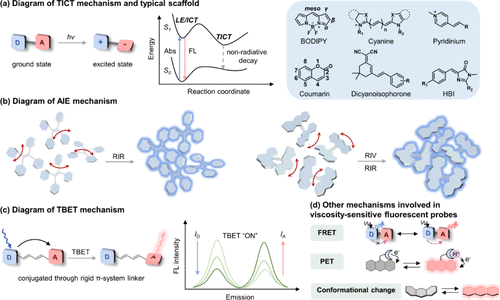
图 31. 荧光探针分析生物粘度的机制。(a) TICT 机制和典型母核的能量图;AIE (b) 和 TBET (c) 机制示意图;(d) 粘度敏感荧光探针涉及的其他机制,包括 FRET、PET 和构象变化。
为深入探究异常粘度在这些疾病中的病理生理作用,精准量化生物粘度显得尤为重要。粘度敏感的荧光探针,尤其是荧光分子转子(FMR)及其他粘度响应型探针,凭借独特的化学结构,在细胞器及生物微环境粘度测量中展现出广泛应用前景。这类探针通常由电子给体与受体基团构成,通过可旋转的π-共轭桥相连。在低粘度环境中,探针分子快速旋转,促进非辐射能量耗散,导致荧光减弱及寿命缩短;而在高粘度条件下,旋转受阻,荧光量子产率上升,寿命延长。这一机制使得粘度敏感型荧光探针成为评估生物体系粘度变化的有力工具。
对于生物粘度的量化,荧光探针技术提供了直接且并行的比较手段。然而,基于荧光强度的测量易受探针分布不均影响,尤其在细胞应激状态下,探针可能偏好性聚集于特定亚细胞区域,导致测量结果偏倚。相比之下,荧光寿命测量提供了更为可靠的绝对参数,不依赖于局部探针浓度,更能反映真实的粘度状态。结合高时空分辨率的荧光成像技术,粘度敏感荧光探针与荧光寿命成像的联合应用,为揭示生物系统中多层次、多维度的粘度信息提供了强有力的工具。
3.1. 基于TICT机制的粘度敏感型荧光探针
1973年,Grabowski及其团队在解析4-(二甲基氨基)苯甲腈(简称DMABN)展现出的独特双发射现象时,首次引入了TICT(Twisted Intramolecular Charge Transfer,扭曲分子内电荷转移)机制作为解释。如所描绘,在DMABN的局部激发态(LE态)下,电荷转移微乎其微,分子保持其平面几何构型。在此状态下,部分DMABN分子通过荧光发射过程释放能量,并随后以辐射方式回归至基态(S0态)。
与此同时,LE态中的另一部分DMABN分子则经历了额外的分子内电荷转移(ICT)过程,其核心在于N,N-二甲基氨基围绕其与苯基环间C-N单键的旋转运动,这一变化促使分子构型扭曲,形成能量状态更低的扭曲分子内电荷转移态(TICT态)。因此,观察到了DMABN在LE态与TICT态之间转换时所产生的双重荧光现象,这一现象成为了TICT机制的有力证据。
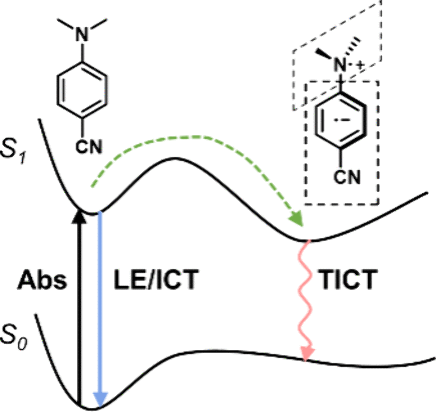
图 32. DMABN的能势面示意图。LE:局部激发;ICT:分子内电荷转移。
基于TICT原理,化学家们系统地设计并调控了电子给体与受体之间单键的旋转行为,同时深入考虑了立体效应及溶剂环境参数(如粘度和极性)的影响,成功开发出了一系列新型荧光探针与传感器。在本部分讨论中,作者聚焦于基于TICT机制的粘度敏感型探针,这些探针的构建依赖于多样化的化学母核结构,包括但不限于BODIPY、Cyanine、吡啶、香豆素、异佛尔酮、HBI等,以及其他多种创新性的母核结构,展现了TICT机制在化学传感领域的广泛应用潜力与深度创新。
3.1.1. 检测细胞器粘度的 BODIPY 衍生物
4,4'-二氟-硼二氮杂吲哚(BODIPY),作为一种前沿的荧光染料,凭借其卓越的光稳定性、高荧光量子产率及简便的合成路径,已成为设计荧光传感器时不可或缺的分子骨架。针对BODIPY核心的化学修饰,尤其是meta位或α位的精细调控,是引入旋转自由度以赋予BODIPY衍生物独特荧光旋转特性的常用策略。此外,通过引入靶向基团,BODIPY基荧光分子转子能够敏锐地响应细胞内各类细胞器粘度的微妙变化,展现了其在生物成像中的巨大潜力。
值得注意的是,部分BODIPY分子在激发态下采取弯曲构象以有效耗散能量。然而,随着外界环境粘度的增加,这种分子内弯曲受到抑制,逐渐趋向平面化,从而显著提升了荧光量子产率。因此,BODIPY荧光团的行为复杂多变,可能同时受到TICT(扭曲分子内电荷转移)机制、弯曲机制,甚至两者协同作用的影响,使得其在不同环境中展现出多样的光学性质。
Qian研究团队成功开发了一种以BODIPY为基础的红色溶酶体靶向粘度探针Lys-VBOD (P108),其吸收峰位于602 nm,发射峰则位于637 nm。该探针的独特之处在于其双旋转键设计——连接喹啉与BODIPY核心的柔性单键以及吲哚与BODIPY之间的双键,这些结构特征使得Lys-VBOD(P91) 在粘性环境中能够显著增强荧光强度()。尤为重要的是,探针中的吗啉基团确保了其对溶酶体的特异性靶向能力,使得实时监测活细胞内溶酶体粘度变化成为可能。实验中,利用地塞米松作为溶酶体膜稳定剂及酶释放诱导剂,证实了Lys-VBOD(P91) 在Bel-7402细胞中能够有效检测药物诱导的溶酶体粘度变化。 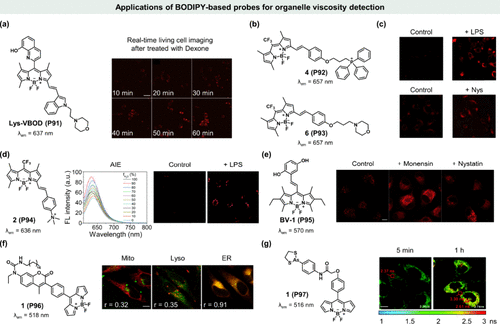
图 33. 基于 BODIPY 的探针在细胞器粘度检测中的应用。(a) Lys-VBOD (P91) 的化学结构及细胞成像; (b) 4 (P92) 和 6 (P93) 的化学结构及细胞成像;(c) 4 (P92) 或 6 (P93) 在 SH-SY5Y 细胞中的共聚焦荧光图像;(d) 2 (P94) 的化学结构及细胞成像;(e) BV-1 (P95) 的化学结构及细胞成像;(f) 1 (P96) 的化学结构及细胞成像 (g)1(P97) 的化学结构及细胞成像。
Yan及其研究团队则率先报道了两种分别针对线粒体和溶酶体的BODIPY基近红外荧光探针,通过调整靶向基团实现了对细胞器粘度的精准监测()。这些探针在657 nm处的荧光强度与粘度之间呈现出强烈的线性关系(激发波长610 nm),预示着其作为粘度探针在量化细胞器粘度变化方面的巨大潜力。通过脂多糖(LPS)和奈司他丁(Nys)等处理手段提高目标细胞器的粘度,研究证实了这两种探针在神经SH-SY5Y细胞中对粘度变化的敏感响应()。这一成果的关键在于将BODIPY核心的三氟甲基位点与不同靶向基团巧妙结合,实现了对线粒体和溶酶体的高选择性成像。
进入2022年,Yan团队再次突破,开发出一种基于阳离子BODIPY的AIE(聚集诱导发光)荧光探针,专门用于线粒体粘度成像()。实验显示,LPS预处理可显著增强SH-SY5Y细胞的荧光信号,而在对照组中则未观察到此现象,标志着基于BODIPY的近红外AIE荧光探针在细胞粘度检测领域的首次应用。同时期,Huang等人开发的BV-1(P95) 探针亦展现出与2(P94) 相当的粘度敏感性。如所示,BV-1(P95) 能够有效识别A549细胞内由莫能菌素和硝司他丁等离子诱导剂引起的线粒体粘度升高,进一步拓展了BODIPY基荧光探针在生物医学研究中的应用范围。
Kim及其研究团队成功合成了一种针对内质网(ER)膜粘度具有高度选择性的荧光传感器。该传感器巧妙地融合了BODIPY与香豆素分子,并引入长烷基链(n-C18)作为导向基团,通过监测两者荧光发射比率的变化来精准报告ER膜的粘度状态。在棕榈酸(PA)处理条件下,该传感器1(P96) 能够特异性地标记HeLa细胞中的ER膜,因为PA能够有效降低ER膜的流动性,从而为1(P96) 创造一个高粘度环境(如所示)。相较于单一荧光团传感器,这种双模比值传感器展现出了对环境变化的高度敏感性,且其响应不依赖于探针的浓度,实现了局部粘度的绝对定量测量,有效消除了荧光强度测量中可能引入的偏差。
另一方面,砷类化合物,如1,3,2-二硫代砷烷,能够特异性地与含有邻位二硫代醇的蛋白质(VDPs)发生共价结合。这类探针常被用于标记ER中富含邻位二硫醇的新生蛋白质,通过干扰蛋白质的正常折叠过程,诱导VDPs的错误折叠,进而触发网状吞噬现象。基于这一独特机制,Kim研究小组创新性地设计了一种双功能荧光分子转子1(P97),该分子不仅能够作为ER应激的触发器,通过标记VDPs启动网状吞噬过程,同时还能够作为ER粘度的实时传感器。
利用1(P97),Kim团队发现,在ER环境中,随着网状吞噬的启动,该探针的平均荧光寿命从2.36 ns显著延长至2.74 ns,伴随的粘度变化则从66 cP上升至107 cP。进一步观察显示,在细胞发生网状吞噬后,1(P97) 在ER中的寿命继续延长至2.61 ns,同时粘度也相应增加至92 cP。而当ER与溶酶体融合形成自溶体时,荧光寿命更是达到了3.3 ns,对应粘度高达188 cP(如所示)。这些实验数据有力地证明了1(P97) 不仅能够选择性地诱导网状吞噬,还能够精准地测量并反映与网状吞噬过程紧密相关的ER微粘度动态变化,为深入理解ER功能失调及相关疾病机制提供了有力的工具。
3.1.2. 使用 BODIPY 衍生物进行粘度检测的其他应用
在化学与生物学交叉领域,烯基钌(II)络合物的独特反应性,特别是其对包括一氧化碳在内的小型给体配体的快速结合能力,激发了研究者探索其作为一氧化碳(CO)探针的潜力。其中,2,1,3-苯并噻二唑(BTD)作为一种在钌(II)配合物中常见的荧光淬灭剂,其特性在于当遭遇CO时,BTD配体会迅速被CO取代,从而恢复荧光发射,这一机制为开发新型CO荧光检测化合物提供了理论基础。
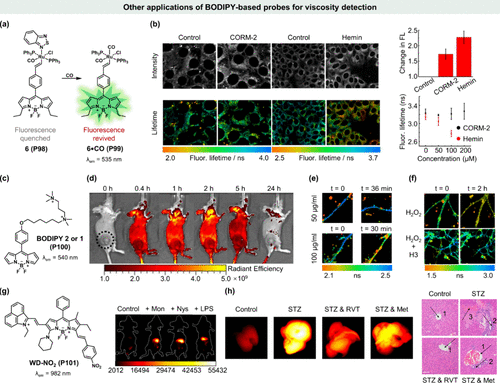
图 34. 基于 BODIPY 的探针在粘度检测方面的其他应用。(a)6 (P98) 检测 CO 和粘度的机制;(b) 6(P98) 在 MCF-7 活细胞中的荧光强度和寿命成像;(c) BODIPY 2 或 1 (P100) 的化学结构;(d) CT26 肿瘤小鼠的荧光图像;(e)神经元中BODIPY 1 (P100) 的荧光寿命图像;(f)神经元暴露于 H2O2(上)和神经保护性 H3 肽处理(下)时,BODIPY 1 (P100) 的荧光寿命;(g)WD-NO2(P101) 的化学结构和外源药物处理粘度变化的荧光成像;(h)正常小鼠肝脏和药物处理小鼠肝脏的荧光成像和 H&E 染色。
近期,James Wilton-Ely团队创新性地设计了一种粘度敏感的BODIPY荧光团,该荧光团不仅能够通过荧光寿命成像(FLIM)技术精确测量活细胞内的微观粘度变化,还能同步监测CO水平()。鉴于CO在调节活性氧(ROS)水平及由此引发的显微粘度变化中的关键作用,该探针的设计显得尤为巧妙。具体而言,当活细胞中存在CO时,探针6(P98) 中的苯并噻二唑基团被CO取代,形成6-CO(P99),并伴随荧光的恢复。值得注意的是,6(P98) 与6-CO(P99) 在寿命-粘度校准图上展现出近乎一致的特性,这为实现独立的粘度测量提供了便利()。通过这一双重灵敏度特性,6(P98) 被成功应用于MCF-7细胞中CO与粘度的同步检测。实验结果显示,在CORM-2和hemin处理下,MCF-7细胞产生CO并伴随荧光强度显著增强,而仅hemin处理组荧光寿命的缩短则揭示了不同药物诱导CO代谢过程中微粘度变化的差异性。这一发现标志着6(P98) 作为首个将荧光分子转子与金属基化学传感器相结合,同时保持粘度敏感性的探针,在CO与粘度双重检测领域的重大突破。
针对体内肿瘤微粘度的测量需求,Kuimova团队选取了经过充分表征的粘度探针BODIPY 2 (P100) 进行研究。通过静脉注射后不同时间点的荧光信号监测,发现BODIPY 2 (P100) 在肿瘤组织中的蓄积显著,表明其作为肿瘤微粘度探针的潜力()。此外,该团队还利用BODIPY 2 (P100) 通过FLIM成像技术,揭示了神经元质膜在氧化应激与神经保护作用下的微粘度变化。特别是在凯尼酸(KA)诱导的神经毒性模型中,荧光寿命随KA浓度及应激持续时间的增加而降低,揭示了兴奋性毒性对神经元膜微粘度的负面影响()。同时,神经保护肽H3的介入有效改善了H2O2诱导的细胞膜流动性增加,恢复了BODIPY 2 (P100) 的荧光寿命及所代表的神经元膜粘度()。这一研究不仅为神经元膜粘度的定量评估提供了新方法,也深化了作者对神经病理过程中细胞膜动态变化的理解。
在探索粘度敏感探针的进程中,Liu团队贡献了一系列NIR-II发射的粘度激活型探针(WD-X系列),其中WD-NO2 (P101) 以其卓越的粘度敏感性和独特的红外发射特性(λabs = 818 nm,λem = 982 nm)脱颖而出。该探针成功应用于小鼠组织在多种应激物处理下的粘度变化检测,且背景荧光极低()。进一步地,WD-NO2 (P101) 还监测了链脲佐菌素(STZ)诱导的糖尿病小鼠体内模型的粘度变化,并观察到白藜芦醇(RVT)和二甲双胍(Met)治疗对糖尿病小鼠粘度下降的缓解作用()。这一成果不仅展示了NIR-II荧光粘度敏感探针在疾病模型中的体内检测能力,也为生物粘度的精准评估提供了新的工具。
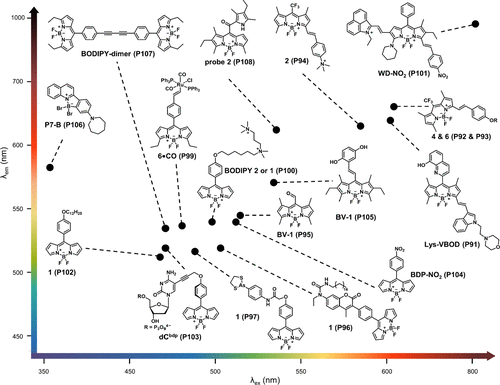
图 35. 基于 BODIPY 的探针及其光谱特性。
尽管篇幅有限,但中展示的基于BODIPY母核的多种粘度敏感探针的结构与光谱特性,无疑为作者揭示了这一领域丰富的研究成果与广阔的应用前景。这些探针在化学、材料学及生物学等多个学科的交叉融合中,正逐步成为揭示生命奥秘、促进健康诊断与治疗的重要工具。
3.1.3. 花菁类衍生物
花菁类染料,其核心构成为含双氮杂环(典型如吲哚鎓)结构,通过碳原子的共轭链紧密相连,展现出独特的荧光特性。此类荧光团因具备波长长、光吸收与发射可调谐、高消光系数、均衡的水溶性以及强大的组织穿透力等优势,在生物学领域中被广泛应用于蛋白质、抗体及小分子化合物的荧光标记技术中。尤为重要的是,其吲哚分子结构在荧光分子转子母核内能有效作为电子受体,从而在生物微环境的粘度变化显微成像中展现出巨大潜力。
细胞有丝分裂作为生物学中的核心过程,涉及多余或受损线粒体的清除与溶酶体内的降解,这一过程在神经退行性疾病与代谢性疾病的病理机制中扮演关键角色。因此,开发针对有丝分裂过程的监测工具对于揭示相关生物机制及疾病诊断生物标志物的发现具有重要意义。近期,Jiang等人基于花菁母核结构,巧妙设计了两种新型荧光分子转子——Lyso-VR1 (P109) 与 Mito-VR2 (P110) ,这两种转子不仅展现出对粘度变化的高度敏感性,还具备优异的发射光谱分离性能,并能精确靶向亚细胞区域(如所示)。实验结果显示,在诱导有丝分裂的营养剥夺条件下,两种探针的荧光信号均随时间增强(),实现了活细胞有丝分裂过程中溶酶体与线粒体粘度变化的同步成像,这一突破为细胞生物学研究提供了新视角。 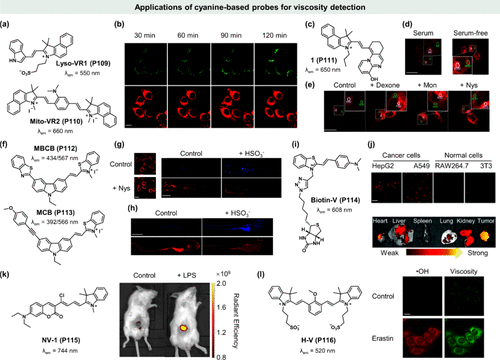
图 36. 基于花菁的探针在粘度检测中的应用。(a) Lyso-VR1 (P109)和 Mito-VR2 (P110)的化学结构;(b) 不同时间用 Lyso-VR1 (P126) 和 Mito-VR2 (P110)染色的细胞饥饿诱导有丝分裂的实时荧光成像;(c)1(P111) 的化学结构; (d) 1 (P111) 在血清和无血清培养基中的 HeLa 细胞成像;(e)HeLa 细胞与地塞米松、莫能菌素、奈替丁和 1 (P111) 培养;(f) MBCB(P112) 和 MCB(P113) 的化学结构; (g) Nystatin 诱导 HeLa 细胞的双光子图像; (h) MCB (P113) 与斑马鱼体内粘度和 SO2 衍生物的双光子图像;(i) Biotin-V (P114)的化学结构;(j) 用 Biotin-V (P114) 处理的癌细胞和正常细胞(上图)、活体器官和肿瘤(下图)的荧光显微图像;(k) NV-1 (P115) 的化学结构和活体小鼠的体内荧光成像; (l) H-V (P116) 的化学结构。 H-V (P116) 在麦拉宁诱导细胞铁突变时监测粘度变化和 -OH 生成。
受此启发,Ge研究团队进一步探索,发现了一种新型花菁化合物1(P111),该化合物能够在体外及活细胞内有效监测外源刺激与自噬条件下的粘度动态变化()。实验数据表明,相较于营养丰富的条件(如血清培养基),饥饿状态(无血清培养基)下的细胞展现出显著的荧光强度增加,且这种变化同时发生在线粒体与溶酶体区域(ROI1与ROI2),揭示了自噬过程中细胞器粘度的提升()。此外,通过药物治疗干预,进一步观察到细胞器粘度的相应变化(),表明近红外1(P111) 探针在监测不同条件下线粒体与溶酶体粘度变化中的独特价值。
针对线粒体功能异常与二氧化硫(SO2)衍生物水平升高在多种疾病中的关联,Feng团队创新性地设计并合成了两种具备双光子吸收特性的双功能荧光分子转子MBCB(P112) 与MCB(P113) ,这些分子不仅能够对粘度变化作出响应,还能检测二氧化硫衍生物。MBCB(P112) 通过咪唑与双键间单键的自由旋转实现粘度依赖性,同时其乙烯基与SO2衍生物的反应导致共轭破坏,从而通过荧光发射变化分析SO2衍生物含量()。实验显示,MBCB(P112) 在检测SO2衍生物时展现出明显的荧光比率变化,并且其荧光强度比随粘度增加而增强,成功应用于HeLa细胞线粒体粘度波动监测及斑马鱼体内SO2衍生物追踪()。MCB(P113) 则展现出类似的多功能特性(),这些特性为体内环境中粘度与二氧化硫衍生物的同时检测提供了有力工具。
在探讨癌细胞与正常细胞生物学特性的差异时,癌细胞内生物素连接酶(BiR)的过度表达成为了一个显著标志,这一现象直接导致了生物素消耗量的显著上升。鉴于此,Kong研究团队创造性地开发了一种以生物素分子为核心识别元件的荧光探针Biotin-V (P114),该探针能够实现对癌细胞及肿瘤组织粘度的双模式荧光成像(),为肿瘤组织的精准识别提供了新策略。实验结果显示,Biotin-V (P114) 在生物素受体表达阳性的癌细胞系(如HepG2和A549)中展现出强烈的荧光信号,而在生物素受体阴性的正常细胞(如RAW264.7巨噬细胞和3T3细胞)中则几乎无荧光信号,这进一步验证了其靶向特异性。共定位实验进一步揭示了该探针主要定位于线粒体内。在肿瘤小鼠模型中,Biotin-V (P114) 的荧光强度较正常组织显著增强约4倍(),且肿瘤组织的平均荧光寿命(1.468 ns,对应于106 cP粘度)明显长于肝脏组织(1.167 ns,对应于78 cP粘度),这一发现不仅证实了肿瘤组织粘度的增高,也揭示了其组织致密性的独特特征。
在生物成像领域,近红外(NIR)荧光团因其卓越的深层组织穿透能力和高成像对比度而备受青睐,这主要得益于其较小的光散射和自发荧光干扰。基于此,Lin等研究者成功构建了一种新型线粒体靶向近红外荧光探针NV-1(P115),该探针能够灵敏地响应体内粘度变化。实验数据显示,NV-1(P115) 在从低粘度甲醇至高粘度甘油的溶剂转换过程中,其在744nm波长下的荧光强度增强了14倍,展现出优异的粘度敏感性。尤为重要的是,该探针能够特异性地定位于线粒体,并成功追踪了经不同药物处理(如莫能菌素、硝司他丁)的活体HeLa细胞和斑马鱼细胞内的粘度动态变化。此外,在脂多糖(LPS)诱导的小鼠模型中,NV-1(P115) 也显示出了强烈的荧光信号增强,而对照组则信号较弱(图36k),进一步验证了其在体内应用中的潜力。因此,NV-1(P115) 作为一种近红外荧光探针,为深入探索生物系统内部复杂的微环境提供了强有力的工具。
铁死亡(Ferroptosis),作为一种由布伦特-斯托克韦尔和斯科特-J-迪克森于2012年首次描述的依赖于铁的程序性细胞死亡方式,其特征在于脂质过氧化物的积累。这一过程在细胞代谢、神经退行性疾病以及肿瘤治疗中扮演着至关重要的角色。然而,关于此过程中羟基自由基(-OH)生成及其对细胞粘度的影响机制尚不完全清晰。为了填补这一研究空白,Ma及其团队于2019年设计了一种双功能荧光探针H-V(P116) ,旨在同时监测细胞内-OH水平与粘度的变化。H-V(P116) 作为一种典型的荧光分子转子,在粘稠甘油介质中于520nm处表现出显著的荧光增强(相较于甲醇增强50倍)。当暴露于羟基自由基时,其分子结构发生特异性转化,形成多甲氧基醌共轭结构,导致荧光发射峰位移至652nm()。此外,转化后的氧化产物HV[O]仍保留粘度传感能力。因此,通过H-V(P116) 探针的双通道成像技术(),研究者能够同时追踪细胞质粘度的变化及铁死亡中-OH的水平,为深入理解铁氧体中毒机制提供了宝贵的实验依据。鉴于H-V(P116) 对-OH和粘度均展现出优异的选择性和灵敏度,该探针有望成为复杂生物系统研究中的重要工具。
此外,还展示了其他多种基于花菁的粘度敏感探针的结构与光谱特性,为相关领域的研究者提供了丰富的参考素材和扩展阅读资源。 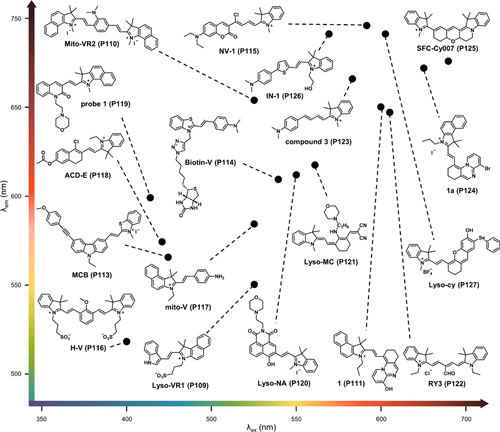
图 37. 基于花菁的探针及其荧光特性。
3.1.4. 吡啶鎓衍生物
在吡啶类化合物的化学结构中,吡啶环上的碳原子与氮原子通过sp²杂化轨道紧密连接,这种独特的键合模式确保了吡啶鎓盐中π-共轭结构的稳定性与完整性。正吡啶鎓盐的引入,不仅增强了荧光探针对带负电线粒体膜的靶向能力,还显著提升了其在水溶液中的溶解度。吡啶鎓的制备过程简便高效,常通过经典的克诺文纳格尔缩合反应实现π-共轭结构的构建。基于吡啶骨架设计的荧光探针,普遍采用D-π-A构型,作为一种高效的粘度敏感性分子转子,其独特的正电荷属性赋予了其选择性地监测线粒体内部粘度的能力。
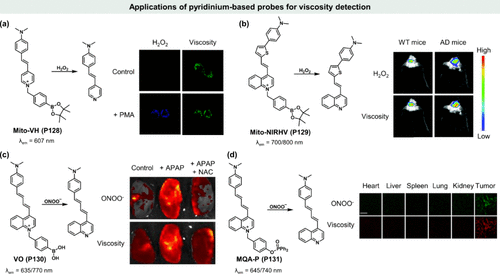

图 38. 基于吡啶的探针在粘度检测中的应用。(a)Mito-VH(P128) 的化学结构,用Mito-VH(P128) 染色的 RAW 264.7 细胞中 PMA 刺激的内源性 H2O2 的成像;(b)Mito-NIRHV(P129) 的化学结构及小鼠体内 H2O2 和粘度的成像与分析;(c) VO(P130) 的化学结构及对小鼠肝脏的成像;(d) MQA-P(P131) 的化学结构及正常组织和肿瘤组织的荧光图像。
在细胞生物学层面,线粒体作为细胞的“能量工厂”,不仅是H2O2的主要生成场所,也是氧气消耗的关键细胞器。线粒体内H2O2的异常积累可引发神经功能障碍,并伴随细胞粘度的上升。因此,开发能够同时监测线粒体内粘度和H2O2水平的探针显得尤为重要。2017年,Lin研究团队成功合成了首个基于吡啶鎓的荧光粘度敏感探针Mito-VH(P128) ,该探针能够在单一分子平台上实现对线粒体H2O2(λem = 510 nm)和粘度(λem = 607 nm)的双重检测,且两者之间的荧光干扰极小。Mito-VH(P128) 探针通过其吡啶基团与硼酸反应位点的协同作用,展现了对H2O2及其他活性氧物种的高度选择性。在灵敏度测试中,该探针在溶液中对粘度和H2O2的荧光增强分别达到了16倍和67倍,验证了其卓越的选择性与敏感性。在活体RAW264.7巨噬细胞实验中,Mito-VH(P128) 探针成功捕获了经磷酸二氢钾(PMA)刺激后细胞产生的内源性H2O2,并通过荧光信号的变化揭示了伴随的粘度增加现象,进一步确认了H2O2生成与粘度变化之间的关联。这一成果为开发新型H2O2与粘度双重成像探针提供了宝贵的设计思路。
随后,Liu研究团队在此基础上进行了创新拓展,开发出一种在近红外区域具有大斯托克斯位移的双响应探针Mito-NIRHV(P129) 。该探针作为H2O2和粘度的“点亮”荧光传感器,在700 nm处对H2O2的检测限低至3 nM,同时在800 nm处展现出粘度与荧光强度之间的强烈线性关系。这一特性使得Mito-NIRHV(P129) 在深层组织成像中具有巨大潜力。此外,其良好的血脑屏障通透性还为其在神经退行性疾病模型小鼠中的应用提供了可能。在阿尔茨海默病(AD)小鼠模型中,Mito-NIRHV(P129) 探针在H2O2和粘度检测通道均显示出比野生型(WT)小鼠更强的荧光信号,揭示了AD大脑中H2O2水平升高与粘度增加的现象。 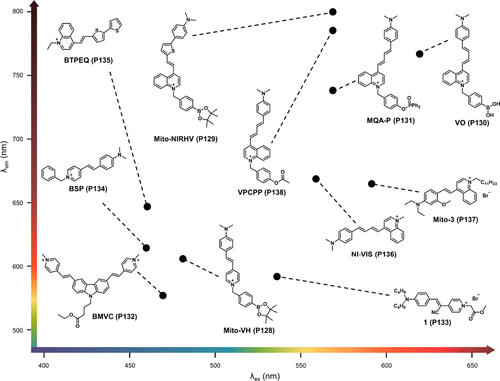
图 39. 基于吡啶的探针及其荧光特性。
除了H2O2外,高活性氧/氮物种ONOO-的异常积累同样对细胞健康构成严重威胁。Dong研究团队针对药物诱导的肝毒性问题,设计合成了一种新型远红外/近红外双靶向荧光探针VO(P130) 。该探针中的硼酸基团作为ONOO-的识别位点,同时结合TICT机制实现对细胞粘度变化的监测。VO(P130) 具有两个完全分离的远红外/近红外荧光通道(ONOO-:λex/em = 420/635 nm;粘度:λex/em = 620/770 nm),使得其能够同时追踪APAP诱导肝损伤过程中ONOO-与粘度的动态变化。在NAC修复实验中,荧光信号的下降证实了VO(P130) 在监测内源性ONOO-与粘度变化方面的有效性。
最新研究中,董晓东团队提出了一种多功能探针MQA-P(P131) ,该探针集ONOO-检测、粘度监测与极性评估于一体。MQA-P(P131) 通过激发态分子内电荷转移(ESICT)机制实现极性检测,同时利用TICT机制感知粘度变化,并借助二苯基膦酸盐作为ONOO-的特异性反应位点。在肿瘤组织切片实验中,MQA-P(P131) 在绿色通道(ONOO-)和红色通道(粘度和极性)均显示出显著的荧光信号增强,表明其在癌症诊断与监测中的潜在应用
3.1.5. 香豆素衍生物
基于香豆素骨架的荧光探针,凭借其可调谐的光学性能、简便的合成路径、卓越的细胞膜通透性以及优异的生物相容性,在生物成像领域占据了重要地位。香豆素的衍生化策略常聚焦于第3或第4位的电子吸引基团引入,以及第6或第7位的电子给予基团修饰(如所示),这种分子设计促进了推拉电子效应,进而在微环境变化时诱发红移发射并优化信噪比。这些特性使得香豆素荧光探针成为监测生物体系粘度动态变化的理想工具。
鉴于全身性炎症与线粒体粘度异常之间的紧密联系,以及这种异常在心脑血管疾病和阿尔茨海默病中的潜在作用,Lin及其团队巧妙设计了Mito-VCI(P139)——一种新颖的、基于香豆素荧光团的线粒体粘度特异性荧光探针。该探针利用线粒体靶向基团苯并吲哚盐,实现了在全身炎症条件下对线粒体粘度变化的精准追踪,通过荧光寿命成像技术揭示了细胞粘度的细微变动。尤为值得一提的是,Mito-VCI(P139) 的灵敏度高度专一于粘度变化,有效排除了pH值和极性等其他物理化学因素的干扰。在LPS诱导的炎症小鼠组织和斑马鱼模型中,该探针的荧光寿命显著延长,为全身炎症及其他微粘度相关疾病的早期诊断提供了可靠的定量检测手段(如图所示)。 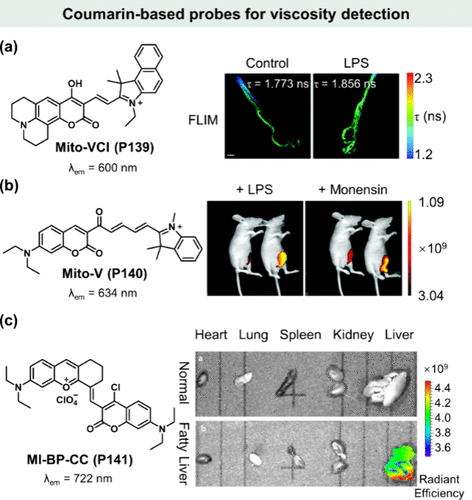
图 40. 香豆素类探针在粘度检测中的应用。(a) Mito-VCI(P139) 的化学结构及活体斑马鱼的荧光寿命图像;(b)Mito-V(P140) 的化学结构及小鼠的荧光图像;(c) MI-BP-CC(P141) 的化学结构及细胞和小鼠模型中的荧光成像。
双光子荧光探针因其在组织穿透性、空间分辨率、激发波长选择及光毒性控制方面的显著优势,正逐渐成为生物成像研究的新宠。Lin等人开发的双光子粘度敏感型荧光探针Mito-V(P140) (λem = 634 nm),不仅与Mito-Tracker展现出优异的共定位效果(PCC = 0.92),还在莫能菌素和奈司他丁处理的细胞系及斑马鱼模型中实现了荧光信号的显著增强。尤为关键的是,双光子成像模式大幅提升了图像质量,超越了传统单光子方法的性能。在LPS或莫能菌素刺激下的小鼠模型中,Mito-V(P140) 的荧光强度显著增加,直接反映了药物诱导的细胞内粘度升高(如所示),从而确立了该探针在动物模型粘度监测中的有效性和实用性。
2022年,Huo与Yin团队进一步拓展了粘度敏感荧光探针的应用范畴,报道了一种近红外探针MI-BP-CC(P141) ,该探针成功应用于活细胞及疾病小鼠模型的粘度监测。通过与Mito-Tracker Green的共定位实验(PCC=0.93),MI-BP-CC(P141) 的线粒体靶向性得到了验证。随后,该探针被应用于帕金森病(PD)细胞模型和脂肪肝小鼠模型的粘度监测中。在这两种疾病模型中,MI-BP-CC(P141) 均检测到了显著的荧光信号增强(如所示),揭示了疾病状态下线粒体粘度的异常变化,为受压活细胞和患病小鼠线粒体粘度波动的可视化研究提供了有力支持。
3.1.6. 二氰基乙烯基取代的异佛尔酮探针
异佛尔酮荧光团,以其独特的给体-π-受体构型,在功能性荧光探针的设计中占据核心地位,这些探针展现出优越的近红外发射性能、高效的分子内电荷快速转移引发的大斯托克斯位移以及独特的双光子吸收能力。特别地,近红外双氰基乙烯基修饰的异佛尔酮(DCI)染料,凭借其显著的推拉效应及对环境变化的敏锐感知,成为研究热点。
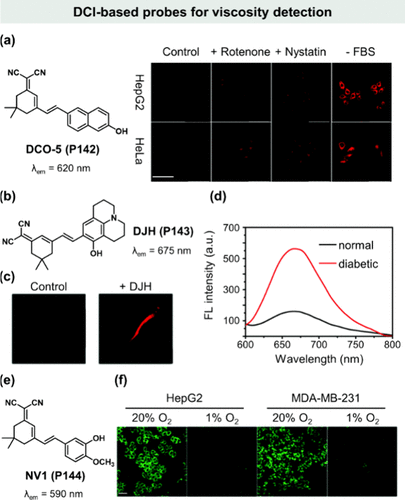
图 41. 基于 DCI 的探针在粘度检测中的应用。(a) DCO-5(P142) 的化学结构及共聚焦图像;(b)DJH(P143) 的化学结构;(c) 斑马鱼与DJH(P143) 的共焦荧光图像;(d) DJH(P143) 在正常小鼠和糖尿病小鼠新鲜血液中的荧光光谱;(e)NV1(P144) 的化学结构;(f) HepG2 和 MDA-MB-231 细胞在常氧或缺氧条件下的荧光图像。
Tang团队巧妙地将不同芳香基团作为电子给体,构建了一系列DCI分子转子,专注于细胞粘度的精准检测。其中,DCO-5(P142) 分子以其185 nm的超大斯托克斯位移(λabs = 450 nm,λem = 615 nm)脱颖而出。在鱼藤酮、硝司他丁等外界刺激及无血清饥饿条件下,DCO-5(P142) 在HepG2和HeLa细胞中均展现出显著的荧光增强,有力证明了其监测细胞内粘度动态变化的能力()。此外,该探针还成功应用于阿尔茨海默病模型PC12细胞及萘丁酸处理斑马鱼的粘度变化监测,进一步拓宽了其应用范围。
Zhu研究团队则开发了一种对粘度变化极端敏感的荧光探针DJH(P143) ,其在675 nm处的荧光强度增幅高达400倍(),这一性能在现有红色发光荧光分子转子中首屈一指(χ = 2.3)。DJH(P143) 不仅首次揭示了微塑料暴露对斑马鱼体内粘度的影响(),还成功区分了糖尿病与高血压患者的血液粘度差异(),为临床诊断提供了新颖的工具。
细胞粘度作为肿瘤微环境的关键指标,其在调控细胞生理功能,特别是细胞迁移中的潜在作用日益受到重视。Xu研究小组创新性地设计了NV1(P144) 荧光探针,以探究细胞内粘度变化与癌细胞迁移之间的复杂关系()。研究表明,缺氧环境下NV1(P144) 荧光强度的显著降低,揭示了低氧可能通过降低HepG2和MDA-MB-231癌细胞内粘度来促进细胞迁移()。这一发现为癌症转移机制的理解及潜在治疗靶点的开发提供了新视角。
为深化该领域研究,本文还汇总了基于香豆素和双花菁乙烯基母体结构的其他探针实例()。 
图 42. 香豆素和双氰基乙烯基取代的异佛尔酮探针及其荧光特性。
3.1.7. 4-羟基苯亚甲基咪唑烷酮衍生物
绿色荧光蛋白——特别是4-羟基苯亚甲基咪唑烷酮(HBI)及其类似物,在生物成像领域展现出了广泛的应用潜力。这些发色团源自自然界的维多利亚水母(Aequorea victoria),以其卓越的生物相容性著称。通过调整其共轭结构,科学家们能够开发出在可见光谱范围内具有不同发射特性的HBI基探针,这一过程巧妙模仿了Roger Tsien教授开创的荧光蛋白演变策略。值得注意的是,HBI核心结构的光诱导异构化机制在溶液中常导致荧光猝灭,但在高粘度环境中,由于分子内部旋转受限,荧光强度反而显著增强。
区别于传统的pH依赖性溶酶体靶向探针,Wang等人成功研发了一种pH稳定的溶酶体靶向探针Lys-V(P149) ,该探针通过引入两个吗啉取代基,不仅优化了亲水性,还实现了对活细胞内溶酶体的高效靶向(PCC = 0.934)。Lys-V(P149) 的独特之处在于其对pH变化的非敏感性,这使得它能够在更广泛的生物pH微环境中准确量化粘度变化。实验中,研究团队以Lys-V(P149) 为工具,动态追踪了地塞米松诱导下溶酶体粘度的变化()。 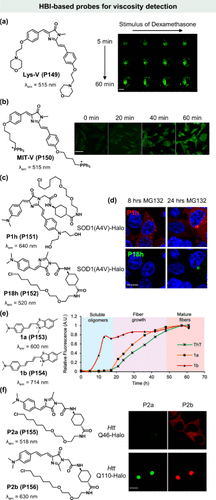
图 43. 基于 HBI 的探针在粘度检测中的应用。(a) Lys-V(P149) 的化学结构及监测 MCF-7 活细胞的荧光变化;(b)MIT-V(P150) 的化学结构及 HeLa 细胞的共聚焦显微图像;(c)P1h(P151) 和P18h(P152) 的化学结构; (d)MG132-诱导的 SOD1(A4 V)-Halo 在 HEK293T 细胞中 8 小时和 24 小时聚集的共聚焦显微图像;(e)1a(P153) 和1b(P154) 的化学结构及检测 a-突触核蛋白聚集;(f)P2a(P155) 和P2b(P156) 分别区分了 HEK293T 细胞中折叠错误的蛋白质寡聚体和不溶性聚集体。
受Lys-V(P149) 成功的启发,Liu及其团队进一步设计了MIT-V(P150) 探针,该探针整合了三苯基膦基团,实现了对线粒体的特异性靶向。通过MIT-V(P150) ,研究人员能够实时成像地塞米松诱导细胞凋亡过程中线粒体粘度的动态变化()。然而,Lys-V(P149) 与MIT-V(P150) 的发射波长较短(λem = 515 nm),这在一定程度上限制了它们在复杂生物系统如小鼠组织中的应用前景。因此,基于HBI的衍生物未来研发的重点或将聚焦于近红外发射荧光探针的开发。
在生物大分子相分离与聚集机制的研究中,化学工具的开发同样扮演了关键角色。Zhang等人在2020年的研究中,通过对HBI基荧光分子的粘度敏感性进行精细调控,实现了对折叠错误低聚物与不溶性聚集体的有效区分。他们通过调整咪唑啉酮杂环C2位置的π电子密度,合成了一系列粘度传感器,这些传感器展现出前所未有的宽范围粘度敏感性(χ值从0.28到0.68)。其中,P1h(P151) 对低粘度敏感,而P18h(P152) 则在高粘度条件下激活荧光()。这一创新使得研究人员能够首次在活细胞中直接观察并区分错误折叠低聚物与不溶性聚集体对微粘度变化的不同响应(),为蛋白质聚集过程的多步骤研究提供了新视角。
基于上述研究,Zhang团队进一步拓展了苯并噻唑、HBI及DCDHF等母核的共轭体系,通过调整探针的粘度敏感性,实现了对折叠错误蛋白质寡聚体及不溶性聚集体的精准区分。研究表明,π共轭体系的扩展增加了分子转子的旋转能垒,进而降低了其对粘度的敏感性。因此,具有延长共轭桥的荧光分子转子被优先应用于体外及细胞内低粘度环境下早期折叠错误蛋白质寡聚体的检测()。然而,当前探针的适用范围仍局限于特定感兴趣蛋白(POI),未来需开发新型探针以实现对更广泛蛋白质聚集体的选择性检测。
3.1.8. 用于粘度检测的其他支架
在探索生物环境中粘度变化及其与疾病进程关联的研究中,苯并噻唑与萘酰亚胺等母核化合物扮演了重要角色,为设计新型荧光粘度传感器提供了丰富的化学平台。这些分子不仅拓宽了检测手段,还深化了对细胞内部动态变化的理解。
细胞为维持其正常生理功能,需不断应对渗透应激的挑战。渗透压的变化,无论是低渗还是高渗,均能显著影响细胞内的粘度状态,进而影响细胞命运,包括可能触发程序性死亡。2021年,马云及其团队创新性地开发了基于查耳酮的荧光分子转子Mito-HCA(P157) ,该分子凭借其独特的D-π-A结构设计和三苯基膦线粒体靶向基团,实现了对活细胞线粒体在渗透压应激下粘度变化的精准荧光成像。实验结果显示,Mito-HCA(P157) 在低渗条件下荧光强度减弱43%,而在高渗条件下则增强56%,这一变化通过荧光寿命信号的同步监测得到了进一步验证()。此外,该探针还展现出对饥饿胁迫及离子源(如莫能菌素)诱导细胞粘度变化的检测能力,为揭示细胞胁迫响应机制的多样性提供了有力工具。 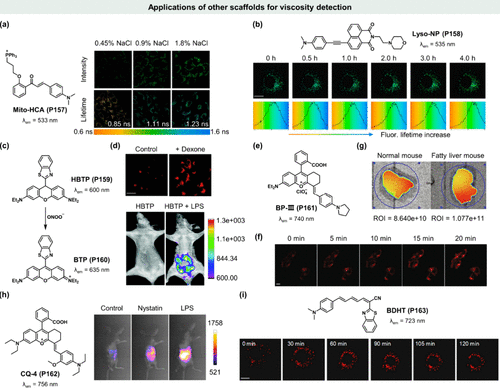
图 44. 设计用于粘度检测的荧光探针的其他母核。(a) Mito-HCA(P157) 的化学结构及荧光寿命成像;(b) Lyso-NP (P158) 的化学结构及MCF-7 细胞的双光子荧光寿命成像; (c)HBTP(P159) 和BTP(P160) 的传感机制。 (d) HeLa 细胞的荧光图像;(e)BP-III(P161) 的化学结构; (f) BP-III(P161) 在 HL-7702 细胞的共聚焦显微镜图像;(g)使用BP-III(P161) 检测正常肝脏(左)和脂肪肝(右)粘度的荧光图像; (h) CQ-4(P162) 的化学结构及荧光成像;(i) BDHT(P163) 的化学结构及实时荧光成像。
为拓宽粘度监测的细胞亚细胞范围,Meng等人首次引入了溶酶体靶向的双光子荧光探针Lyso-NP(P158),专注于自噬过程中溶酶体粘度的动态变化。Lyso-NP(P158) 的荧光强度与寿命均表现出对粘度的显著依赖性(χ = 0.47, x = 0.39),并通过共定位实验确证了其在溶酶体中的高度选择性定位。在饥饿诱导的自噬条件下,利用Hank's平衡盐溶液(HBSS)培养,Lyso-NP(P158) 的荧光信号与溶酶体粘度同步增强,荧光寿命从1513 ps延长至1710 ps,对应粘度值从46.37 cP提升至63.47 cP()。尤为重要的是,Lyso-NP(P158) 的双光子激发特性不仅降低了光毒性,还显著提升了生物成像的组织穿透深度,为深层组织中的粘度监测提供了可能。
为了进一步增强探针的多功能性,Guo等人设计合成了吡罗宁染料BTP(P160) 及其二氢衍生物HBTP(P159) ,这些分子不仅能够实现溶酶体粘度的可视化成像,还能检测内源性过亚硝酸盐。BTP(P160) 因含有强吸电子的介取代苯并噻唑基团,其荧光发射波长较传统罗丹明B蓝移(λem = 538 nm),且在高粘度甘油中展现出强烈的荧光特性(Φ = 0.33),同时保持良好的溶酶体靶向性。这一特性使得BTP(P160) 成为研究溶酶体粘度变化的理想工具。另一方面,HBTP(P159) 则通过氧化反应对ROS物种过氧亚硝酸进行特异性响应,转化为强荧光的BTP(P160) ()。在地塞米松处理的HeLa细胞中,BTP(P160) 成功追踪了溶酶体粘度的变化;而在脂多糖(LPS)诱导下,内源性过氧亚硝酸盐的生成则触发了HBTP(P159) 向BTP(P160) 的转化,生成强烈的荧光信号。这些发现表明,BTP(P160) 与HBTP(P159) 组合探针在小鼠模型中具备监测细胞内微粘度变化及探索过氧亚硝酸盐病理作用的广阔应用前景。
为了推动活体动物成像技术的发展,Huo与Yin等科研团队精心设计了一系列基于苯并芘骨架的近红外荧光探针,其中BP-III(P161) 凭借其卓越的近红外发射特性(λem = 740 nm)、优异的粘度灵敏度及极低的极性干扰脱颖而出()。实验结果显示,无论是在正常细胞还是癌细胞中,经萘丁酸处理后,BP-III(P161) 的荧光强度均随时间递增。尤为引人注目的是,在癌细胞环境中,该探针展现出了更为显著的荧光增强效应,彰显了其作为区分癌细胞与正常细胞的有效粘度响应探针的潜力()。进一步地,在脂肪肝小鼠模型中,BP-III(P161) 的整体荧光强度显著高于正常小鼠,这一发现与先前细胞实验的结果高度一致()。
基于上述研究成果,Shen和Cao等研究者进一步拓展,设计并合成了四种基于罗丹明结构的线粒体靶向荧光探针,旨在实现活细胞及小鼠体内粘度的精准检测。其中,CQ-4(P162) 以其对粘度及近红外区域(λem = 756 nm)的高灵敏度脱颖而出,成为该系列中的佼佼者。值得注意的是,CQ-4(P162) 的粘度响应极为灵敏,且其性能不受pH值、极性变化及细胞内活性物质的影响。在模拟线粒体功能障碍(如萘丁酸诱导)及生物体炎症反应(如脂多糖刺激)的实验中,CQ-4(P162) 在极短时间内(5分钟内)即展现出快速的荧光增强,直接反映了应激状态下小鼠体内粘度的增加()。这一成果不仅展示了经典罗丹明母核在新型粘度传感器设计中的巨大潜力,还强调了CQ-4(P162) 在亮度、长波长发射及活体应用方面的卓越表现。 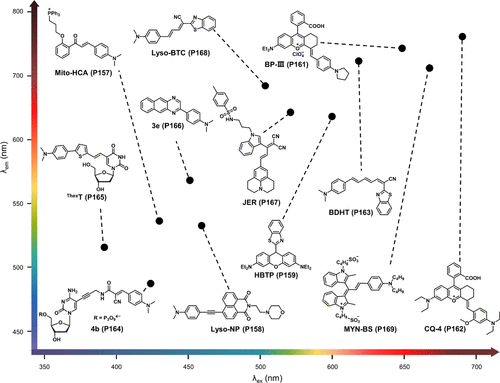
图 45. 其他基于 TICT 的探针及其荧光特性。
针对脂质过氧化与铁代谢障碍之间的复杂关系,Lin等人创新性地开发了一种针对脂滴的粘度敏感探针BDHT(P163) ,旨在揭示铁蜕变过程中脂滴粘度变化的奥秘。该探针合成简便(仅需两步),对粘度变化具有高灵敏度(χ = 0.42),并能精确靶向脂滴进行成像()。通过利用Erastin这一铁中毒诱导剂,研究团队成功模拟了胱氨酸-谷氨酸拮抗剂系统xc-的功能抑制,进而触发了过度的脂质过氧化和铁中毒。在BDHT(P163) 的监测下,麦拉宁处理的HeLa细胞展现出了细胞萎缩伴随荧光强度随时间增强的现象,直接证明了铁死亡中脂滴粘度的显著增加。此外,该探针在多种癌细胞系中的广泛应用也进一步验证了其普遍适用性。展望未来,近红外发射的BDHT(P163) (λem = 723 nm)有望成为研究活体动物模型中铁突变机制的重要工具。
3.2. 基于聚集诱导发光(AIE)机制的粘度敏感探针
鉴于荧光染料固有的高疏水性和其独特的平面共轭结构,这些分子在高浓度状态下常发生自聚集现象,这一现象往往伴随着荧光强度的减弱乃至完全淬灭,即所谓的聚集淬灭效应(ACQ),极大地限制了传统荧光材料的应用广度。2001年,Tang研究团队开创性地报道了一种特殊的硅杂环戊二烯化合物——1-甲基-1,2,3,4,5-五苯基硅杂环戊二烯(),该化合物在固态下于水环境中展现出耀眼的荧光,而一旦溶解于乙醇则失去发光能力。这一发现不仅颠覆了传统认知,更催生了聚合诱导发光(AIE)这一全新概念,其核心在于分子聚集状态下荧光强度的显著增强,归因于分子内运动受限(RIM)机制,具体涵盖分子内旋转受限(RIR)与振动受限(RIV)()。值得注意的是,AIE分子往往同时经历旋转与振动受限,与基于TICT的荧光分子相比,尽管两者均涉及分子内旋转,但AIE分子在旋转模式上展现出更为复杂的特性。鉴于此,AIEgens(基于AIE效应的荧光探针)有望成为粘度敏感型荧光传感器,用于精准测量生物微环境的粘度变化,因为高粘度环境能有效抑制RIM过程,从而增强荧光发射。 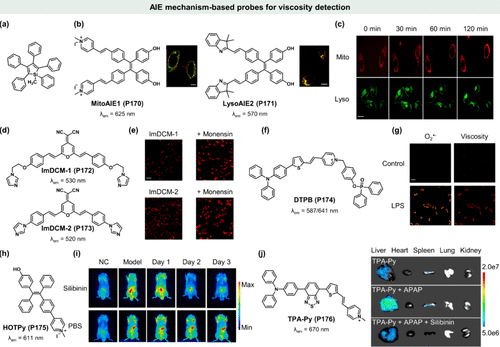
图 46. 基于 AIE 机制的粘度敏感探针。(a) HPS的化学结构;(b)MitoAIE1(P170) 和LysoAIE2(P171) 的化学结构及其共聚焦图像;(c)不同时间饥饿诱导有丝分裂过程中细胞的共聚焦荧光图像; (d)ImDCM-1(P172) 和ImDCM-2(P173) 的化学结构; (e)暴露于莫能菌素后被ImDCM-1(P172) 或ImDCM-2(P173) 染色的 HeLa 细胞的荧光图像;(f)DTPB(P174) 的化学结构; (g)DTPB(P174) 对 LPS 诱导的 MCF-7 炎症细胞中氧气和粘度的双通道成像; (h) HOTPy(P175) 的化学结构; (i)硅必宁(SILY)治疗下 AALI 小鼠的成像; (j) TPA-Py(P176) 的化学结构。
Jiang等研究者通过精细调控经典AIEgen母核——四苯基乙烯(TPE)的结构,成功设计出两款分别靶向线粒体与溶酶体的AIEgens,即MitoAIE1(P170) 与LysoAIE2(P171) 。在共定位实验中,这两款探针均展现出卓越的靶向特异性(PCC值分别达到0.93与0.92)()。尤为重要的是,通过引入两个羟基基团,有效缓解了潜在的分子自聚集问题,优化了探针的两亲平衡性,进而提升了信噪比。在饥饿诱导的有丝分裂过程中,MitoAIE1与LysoAIE2的荧光信号随时间推移逐渐增强,证实了它们能够实时追踪特定细胞器内粘度变化的能力()。这种粘度变化可能与自噬体形成及底物降解负担增加密切相关,标志着AIEgens在活细胞动态粘度监测领域的首次成功应用。未来,结合荧光寿命成像技术,这类探针有望为生物粘度的定量分析提供更为丰富的信息。
另一方面,针对传统荧光团如4-二氰基亚甲基-2,6-二甲基-4H-吡喃(DCM)及其衍生物虽具备红色发射及高量子产率等优势,但受ACQ效应困扰的问题,Qin与Huang等研究者通过巧妙改变取代基团,将DCM荧光团转化为AIE活性分子,有效降低了D-π-A系统内的电子相互作用。所得ImDCM-1(P172) (λem = 650 nm)与ImDCM-2(P173) (λem = 625 nm)不仅保留了近红外发射特性,还因引入可旋转分子结构而适用于细胞内粘度变化的检测()。以莫能菌素为例,该药物通过抑制细胞内蛋白质转运引发粘度变化,在经其处理的HeLa细胞中,ImDCM-1与ImDCM-2均展现出显著的红色荧光增强()。这一成果不仅拓展了DCM分子的应用领域,也为基于AIE效应的细胞粘度传感器开发提供了新思路。
超氧阴离子,作为活性氧(ROS)家族中的关键成员,其浓度异常与细胞粘度下降已成为诸多疾病如阿尔茨海默病及生物功能失调的预警信号。然而,当前领域内针对此类生物参数的精准检测手段仍显匮乏。鉴于此,Tian研究团队匠心独运,设计出一种集高灵敏度与双功能于一体的AIEgen——DTPB(P174) ,旨在同步监测细胞内粘度与氧气水平。该探针精妙地融合了二苯基膦酸(用于捕捉超氧阴离子O2·-)、吡啶阳离子(线粒体靶向基团)以及可旋转的π-共轭结构(响应粘度变化)三大功能组件()。实验显示,在脂多糖(LPS)诱导的炎症环境中,MCF-7细胞内不仅ROS生成激增,伴随而来的是细胞粘度显著上升,DTPB(P174) 通过其独特的双通道荧光响应(红色通道反映粘度,橙色通道指示O2·-水平)直观呈现了这一现象(),并明确指出了其主要定位于线粒体,为线粒体相关疾病的研究开辟了新路径。
急性酒精性肝损伤(AALI)由于其隐匿性强、缺乏特异性临床表现,常导致早期诊断的延误。Chen等科学家敏锐洞察到AALI早期线粒体功能障碍伴随的粘度增加,这一生物物理特性或可成为AALI诊断的关键生物标志物。他们创新性地开发出一种水溶性线粒体靶向AIEgen——HOTPy(P175) ,用于监测细胞及AALI小鼠模型中的粘度变化()。实验结果显示,酒精暴露后小鼠肝脏中HOTPy(P175) 荧光显著增强(),且经Silibinin(SILY,一种商用AALI治疗药物)治疗后,荧光强度随时间逐渐减弱,与肝损伤程度减轻相一致,彰显了其在AALI实时、原位监测中的潜力。尤为重要的是,HOTPy(P175) 的荧光稳定性在多种生物环境中均表现出色,不受极性、pH、亲电性物质、ROS等干扰,进一步巩固了其作为AALI诊断工具的可靠性。
Li等人则另辟蹊径,结合AIE效应与荧光分子转子特性的协同效应,成功研制出新型近红外粘度探针TPA-Py(P176) 。该探针不仅继承了AIEgen对粘度变化的高灵敏度和卓越水溶性,还展现出对生物系统的广泛适应性。在饥饿及雷帕霉素诱导的有丝分裂过程中,TPA-Py(P176) 精准捕捉到了细胞内粘度的动态变化,并在对乙酰氨基酚(APAP)诱导的肝损伤小鼠模型中实现了荧光成像()。保肝药物Silibinin的介入治疗有效缓解了肝损伤,伴随而来的是TPA-Py(P176) 荧光强度的显著回落,再次印证了其在监测生物系统粘度变化及评估药物疗效方面的独特价值。综上所述,TPA-Py(P176) 作为一种多功能粘度探针,为深入理解复杂生物过程及药物作用机制提供了强有力的工具。
3.3. 基于FRET和PET机制的粘度敏感探针
FRET作为一种高效的能量转移机制,在荧光功能探针设计中占据核心地位。这类探针巧妙地融合了能量给体与能量受体两部分,通过精细设计的化学连接体紧密相连。为实现高效的FRET过程,需精准控制三大要素:首先,确保给体与受体间的空间距离维持在10-100埃的适宜范围内;其次,调整给体与受体的相对偶极取向,以优化能量转移效率;最后,当给体受到光激发时,其激发能量能够借助偶极-偶极相互作用无缝传递至受体,进而激发受体的荧光发射。
在传统粘度测量领域,环境敏感型探针常因流体光学性质的复杂性和探针浓度波动而面临量化难题。为解决这一挑战,化学家们创新性地引入了基于FRET机制的比率测定探针。此类探针融合了两种功能迥异的荧光团:其一为粘度不敏感型荧光团,作为稳定的内部参照标准;其二则为粘度敏感型荧光团,负责响应粘度变化。通过比较粘度敏感部分的发射强度与参考部分的发射强度,并进行归一化处理,可获取直接反映粘度变化的量化强度比。这一比率测量策略已展现出在生物体系粘度量化中的卓越能力。
在此背景下,Emmanuel研究团队成功合成了首个比率型粘度传感器4(P177) ,该传感器精妙结合了参考荧光团7-甲氧基香豆素-3-羧酸(MCCA)与粘度敏感荧光团2-氰基-3-(4-二甲氨基苯基)丙烯酸甲酯(CMAM)。实验结果表明(如所示),CMAM的荧光峰值及其与MCCA荧光峰值的比率均随粘度增加呈现显著的线性增长趋势。值得注意的是,虽然CMAM单荧光峰强度受探针浓度影响较大,但比率值却展现出良好的浓度独立性,显著降低了溶剂折射率及染料浓度对测量结果的干扰。因此,基于FRET机制的粘度传感器通过其独特的发射比策略,实现了对流体粘度快速且精确的量化分析。
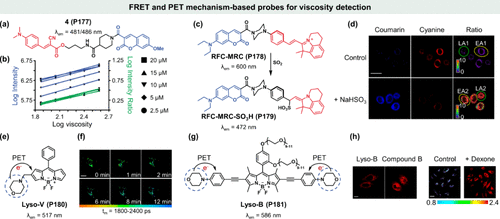 图 47. 基于 FRET 和 PET 机制的粘度检测探针。(a) 4(P177) 的化学结构; (b) 利用比率测量法减少染料浓度(2.5-20 μM)的影响; (c) RFC-MRC(P178) 对二氧化硫的反应机制;(d) SO2 在鱼藤酮诱导凋亡的 HeLa 细胞中的共聚焦荧光图像;(e)Lyso-V(P180) 的化学结构; (f)用Lyso-V(P180) 染色并用地塞米松处理不同时间的 MCF-7 细胞的荧光寿命成像;(g)Lyso-B(P181) 的化学结构; (h)用Lyso-B(P181) 和化合物 B(左)培养的活 HeLa 细胞的双光子荧光显微镜图像。
图 47. 基于 FRET 和 PET 机制的粘度检测探针。(a) 4(P177) 的化学结构; (b) 利用比率测量法减少染料浓度(2.5-20 μM)的影响; (c) RFC-MRC(P178) 对二氧化硫的反应机制;(d) SO2 在鱼藤酮诱导凋亡的 HeLa 细胞中的共聚焦荧光图像;(e)Lyso-V(P180) 的化学结构; (f)用Lyso-V(P180) 染色并用地塞米松处理不同时间的 MCF-7 细胞的荧光寿命成像;(g)Lyso-B(P181) 的化学结构; (h)用Lyso-B(P181) 和化合物 B(左)培养的活 HeLa 细胞的双光子荧光显微镜图像。
生物体内异常粘度状态与多种病理生理过程及疾病紧密相关,如糖尿病与炎症,常伴随着特定生物代谢物水平的波动。二氧化硫(SO2),作为一种关键的内源性气体信号分子,在抗氧化及肌肉松弛等生理活动中扮演重要角色。Lin的研究团队巧妙设计了一种针对粘性环境具有高度SO2响应性的比率荧光探针RFC-MRC(P178) ,该探针由香豆素(作为能量给体)与花菁类(作为能量受体)分子精妙结合而成。在高粘度介质中,香豆素受光激发后,其能量有效传递给花菁受体,引发强烈的红色荧光发射(λem = 600 nm)。然而,当环境中引入SO2时,花菁发色团的共轭结构遭破坏,FRET过程受阻,导致RFC-MRC-SO3H(P179) 的香豆素给体在472 nm波长下发出蓝色荧光()。这一独特的检测机制使得RFC-MRC(P178) 能够同步监测体外与体内的SO2浓度及粘度变化。在鱼藤酮诱导的HeLa细胞凋亡模型中,探针在凋亡晚期细胞中的荧光强度显著高于早期,这归因于细胞内粘度随凋亡进程而增加(,上)。加入NaHSO3后,DAPI通道荧光增强,TRITC通道发射减弱,整体细胞的比率荧光信号显著上升(图47d,下),尤其在早期凋亡细胞中,由于背景信号较低,荧光增强更为显著(51.2倍对比37.1倍)。这一创新设计不仅提升了SO2与粘度检测的灵敏度,还作为一种有力的分子工具,通过比率成像技术监测细胞凋亡过程。
另一方面,光诱导电子转移(PET)机制在荧光探针设计中亦占据重要地位,其核心组件包括电子给体、电子受体及连接链。PET探针依据电子转移方向可分为a-PET(受体激发PET,即电子从给体向荧光团转移)与d-PET(给体激发PET,即电子从荧光团向受体转移),两者均能有效淬灭探针激发态,降低背景荧光。
经典的PET探针设计侧重于a-PET的激活,通过非共轭连接链将识别基团(电子给体)与荧光染料相连。在无目标物结合时,PET过程导致荧光淬灭;而一旦结合,PET受阻,荧光恢复,从而实现高灵敏度与选择性检测。基于PET机制,通过引入吗啉环作为电子给体及溶酶体靶向基团,可以设计出针对溶酶体粘度的特异性荧光探针。Deng团队率先开发了首个基于PET机制的溶酶体粘度探针Lyso-V(P180) ,其核心为BODIPY荧光分子转子结构,用于粘度感知。吗啉环不仅促进探针向酸性溶酶体定向扩散,还通过质子化作用,利用PET机制淬灭BODIPY荧光()。在粘性环境中,BODIPY核心与苯基间单键旋转受限,从而响应粘度变化。Lyso-V(P180) 与商用溶酶体示踪剂中性红(NR)在MCF-7细胞中的共定位实验显示,其皮尔逊相关系数高达0.915,证实了其优异的溶酶体靶向性。此外,该探针还能实时监测药物治疗下溶酶体粘度的动态变化。例如,地塞米松通过稳定溶酶体膜及抑制酶释放,显著提高了MCF-7细胞的平均荧光寿命(从1.99 ns至2.24 ns),对应溶酶体粘度由67 cP增加至85 cP()。
在既往的研究中,荧光探针的设计往往局限于其对溶酶体粘度的单一敏感性评估,而忽视了诸如光稳定性与生物相容性等关键理化特性,这在一定程度上限制了其在生物医学领域的广泛应用。为克服这一局限,Yu及其研究团队成功研制出一种集高灵敏度与卓越光稳定性于一体的荧光探针——Lyso-B(P181) ,该探针创新性地采用双光子(TP)成像技术,实现了对溶酶体粘度的精准测量。
相较于先前开发的Lyso-V(P180) ,Lyso-B(P181) 在设计上进行了显著优化,通过引入两个乙炔基团,有效拓宽了共轭体系,从而实现了向长波方向(λem = 586 nm)的移动。尤为重要的是,探针表面接枝的两个高亲水性聚乙二醇(PEG)链,不仅大幅度降低了细胞毒性,还显著提升了其在水溶液中的溶解性和生物相容性(),为生物体内应用奠定了坚实基础。
Lyso-B(P181) 在粘度感知机制上融合了TICT与PET的协同效应,展现出独特的性能优势。在TP成像模式下,该探针能够特异性地在溶酶体内被激活并发出荧光,而对比化合物B(缺乏吗啉基团)则在整个细胞质中均匀分布,验证了其优异的靶向能力。实验进一步证实,在低光毒性激发光源(λem = 940 nm)照射下,Lyso-B(P181) 能够清晰成像溶酶体,为生物体内研究提供了强有力的工具。
在地塞米松处理的HeLa细胞实验中,Lyso-B(P181) 展现出了显著的荧光增强效应和荧光寿命延长现象()。具体而言,荧光强度与荧光寿命相较于未处理组均有显著增加,计算得出的平均寿命从1.52 ns提升至2.80 ns。结合寿命-粘度曲线拟合分析,可精确推断出溶酶体粘度从15 cP上升至159 cP,有力证明了Lyso-B(P181) 在粘度检测方面的高灵敏度与准确性。
3.4. 基于TBET机制的粘度敏感探针
在细胞内粘度测量的精确校准中,FRET效应展现出了极大的潜力,尽管其应用受限于荧光团间严格的几何排列与光谱重叠要求。FRET作为一种“空间能量转移”现象,其效率高度依赖于给体与受体间的距离(遵循r6的依赖关系)及两者过渡偶极子的相对取向,同时要求给体发射光谱与受体激发光谱间至少有30%的重叠,这为荧光团的选择设立了额外门槛。
与FRET机制相类而异的是TBET机制,其核心在于通过刚性π共轭连接体直接桥接两个荧光团,实现能量的快速传递,无需严格的光谱重叠或近距离接触。这一设计使得能量给体(常选用对粘度不敏感的荧光团)在激发时,能够通过共轭π键直接将能量传递给对粘度敏感的受体,从而随粘度变化展现出不同强度的双峰发射特性。TBET机制赋予了粘度敏感探针高灵敏度与低背景荧光的优势,正逐步成为超越传统技术束缚的新型荧光传感器。
Kim等人巧妙设计了一种集比率荧光成像与荧光寿命成像于一体的自校准双功能传感器1(P182) ,该传感器由香豆素基荧光能量给体、BODIPY基粘度敏感荧光能量受体、刚性苯基间隔物以及线粒体靶向基团三苯基膦四部分构成()。在高粘度环境中,苯基与BODIPY核心间的C-C键旋转受限,促使香豆素部分捕获能量并发射荧光。利用此特性,研究团队揭示了莫能菌素与硝司他丁通过诱导线粒体结构变化或肿胀,进而影响细胞内粘度的机制。通过荧光比率成像与荧光寿命成像的双重验证(),在对照组、莫能菌素处理组及奈司他丁处理组中,I 516/I 427的荧光比值分别为2.17、2.44和2.62,据此推算出相应粘度分别为62.8、90.5及109 cP,与荧光寿命成像结果(67.5、80.8、112 cP)高度一致。这一研究不仅证实了离子药物能够提升线粒体粘度,还彰显了基于香豆素-BODIPY的粘度传感器1(P182) 在监测线粒体粘度方面的高精确性与可靠性。
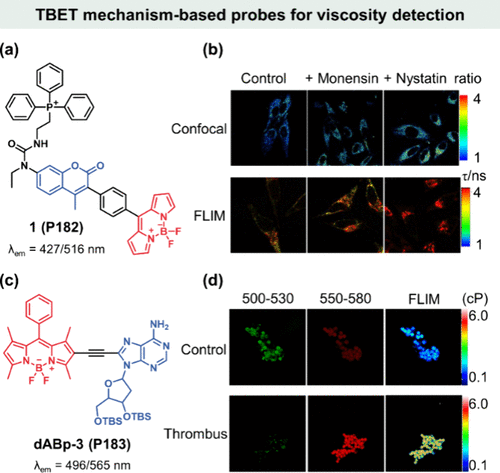
图 48. 基于 TBET 机制的粘度检测探针。(a)1(P182) 的化学结构;(b) 1(P182) 在 HeLa 细胞中的药物诱导比率图(上图)和荧光寿命图(下图);(c)dABp-3(P183) 的化学结构; (d) 对照组和血栓小鼠的双通道荧光图像和荧光寿命图像。
细胞内微粘度的异常波动,尤其是当RNA分子在其内的扩散与迁移速率相较于健康细胞状态激增5至50倍时,对RNA的功能执行构成了显著挑战,进而可能诱发心血管疾病、脑血管病变及动脉粥样硬化等严重健康问题。鉴于此,研发能够精准成像RNA微粘度变化的核苷基荧光探针显得尤为重要。
鉴于活细胞(如网状细胞)细胞质内RNA区域的微粘度变化极其细微(通常小于10 cP),对探针的灵敏度提出了极为严苛的要求。Guo与Zhang等研究团队在此领域取得了突破性进展,他们首次介绍了一种基于核苷的荧光转子探针dABp-3(P183) ,该探针在双光子激发模式下,展现出了对RNA微粘度变化的高选择性与高灵敏度成像能力。
dABp-3(P183) 探针的独特设计融合了2′-脱氧腺苷与BODIPY荧光团。其中,2′-脱氧腺苷作为靶向分子,能够特异性地结合RNA,并通过刚性的乙炔键作为能量传递的桥梁,将激发能量高效地输送至粘度敏感的BODIPY核心(如所示)。这一设计不仅确保了探针的靶向精准性,还优化了能量转移效率,从而提升了检测灵敏度。
网状红细胞作为富含RNA的未成熟红细胞,其内部微粘度的微妙变化往往与血栓等血液系统疾病密切相关。通过荧光比值成像与荧光寿命成像技术的联合应用,研究团队发现,在卡拉胶诱导的血栓小鼠模型中,其网状细胞RNA区域的微粘度显著高于正常小鼠()。这一发现强有力地证明了dABp-3(P183) 探针能够精确捕捉并量化网状细胞内RNA区域微粘度在1.8至6.0 cP范围内的细微变动,为深入探究血液疾病发生机制及早期诊断提供了有力的工具。
3.5. 基于其他机制的粘度敏感探针
3.5.1. 异构化
在2015年的研究中,Jerker等人巧妙地运用了亲脂性染料——Merocyanine 540(简称MC540,P184) ,通过其特有的反式-顺式异构化机制来监测生物膜的微观粘度特性(所示)。该过程中,随着膜粘度的增加,与异构化反应相关联的弛豫时间显著延长,直接导致异构化速率的减缓;反之,粘度降低则加速异构化过程。
为了深入评估MC540(P184) 在捕捉膜粘度动态变化方面的能力,研究团队将其应用于在不同温度条件(24°C、30°C、37°C)下培养的MCF7细胞体系中,并借助高级的数学推导方法进行了成像分析。所展示,随着培养温度的逐步上升,观察到 kISO (即异构化速率常数)呈现出增大的趋势,这表明异构化反应速率加快,进而间接反映了细胞膜粘度的降低。
这一系列发现不仅强化了MC540(P184) 作为膜粘度或流动性变化敏感探针的可靠性,还揭示了其异构化速率与膜物理状态之间的直接关联,为细胞膜生物物理特性的研究提供了一种新颖且有效的手段。 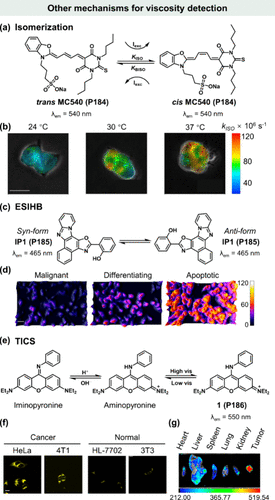
图 49. 检测粘度的其他机制。(a) MC540(P184) 的顺反异构化; (b)TRAST 分析获得的kISO 图像;(c)室温下IP1(P185) 的两种不同构象;(d)IP1(P185) 在恶性、分化、凋亡的 U87 细胞中的三维交互强度图; (e) pH 触发的氨基吡咯啉和亚氨基吡咯啉的转化及粘度传感机制; (f) 癌细胞(HeLa,4T1)和正常细胞(HL-7702,3T3)与探针 1 (P186) 孵育后的荧光图像;(g)尾静脉注射探针1(P186) 后,肿瘤小鼠器官和肿瘤的荧光图像。
3.5.2. 激发态分子内氢键(ESIHB)
当前,癌症已成为威胁人类健康的重大医学难题,其高死亡率往往与化疗过程中普遍出现的耐药性和疾病复发紧密相关。鉴于化疗药物主要通过诱导细胞凋亡来发挥其治疗作用,深入研究肿瘤细胞内的凋亡水平对于评估化疗药物的有效性具有举足轻重的意义。为了深化对肿瘤细胞凋亡机制的理解,Singh等科学家基于激发态分子内氢键效应(ESIHB)原理,创新性地设计并合成了一种荧光分子转子IP1(P185) ,该探针旨在精准区分恶性细胞、分化细胞及凋亡状态的癌细胞()。
IP1(P185) 的独特之处在于其构象平衡(即手性的转换)高度依赖于环境的粘度变化。通过PES和MEP实验的深入剖析,证实了IP1(P185) 对粘度的敏感性受到激发态羟基氢键的精细调控。具体而言,随着环境粘度的增加,IP1(P185) 更倾向于采取Syn构象,这一发现为粘度敏感型荧光探针的设计提供了新的视角。
进一步将这一粘度敏感探针应用于三种不同生理状态的细胞体系时,结果显示出显著的差异:凋亡细胞的粘度最高,分化细胞次之,而恶性细胞的粘度则相对较低(图)。这一发现与先前的研究报道高度一致,不仅验证了IP1(P185) 探针在区分细胞状态方面的有效性和准确性,也预示着通过合理设计与调控此类易于合成的荧光探针,可能为化疗药物的疗效评估开辟新的途径,为癌症治疗策略的优化提供有力的技术支持。
3.5.3. TICS
Li及其研究团队在癌症可视化领域取得了重要进展,他们成功设计并开发了一种基于酸激活机制的溶酶体靶向探针(1,P186) ,该探针能够依据细胞内酸碱度及粘度差异,精准区分癌细胞/肿瘤与正常细胞/器官。探针1(P186) 在酸性溶酶体环境中会发生质子化反应,实现从亚氨基吡咯宁到带正电荷的氨基吡咯宁的形态转变(如所示)。由于细胞膜对阳离子的选择性通透性,探针的氨基吡咯宁形态被有效截留并主要定位于溶酶体内。
值得注意的是,探针1(P186) 的核心荧光团吡氨酸,作为罗丹明类似物,其特定衍生物在激发状态下展现出一种独特的电荷转移与分离模式,这与传统的TICT机制不同。此过程涉及分子内约90°的旋转运动,并伴随着受体与给体之间的动态电荷交换,即TICS现象。在探针1(P186) 中,TICS机制通过苯胺(作为受体)与烯基季铵盐(作为给体)之间的单键自由旋转实现,这一过程在低粘度环境下促进激发态能量的耗散;而在高粘度条件下,TICS过程受阻,导致荧光强度显著增强。
实验结果显示(),癌细胞因溶酶体内较低的pH值及较高的粘度环境,展现出远高于正常细胞的平均荧光强度,这表明探针1(P186) 能够高效识别并区分癌细胞与正常细胞。此外,该探针在肿瘤组织及其他器官中的测试结果也保持了一致性(),进一步验证了其作为pH活化型溶酶体靶向探针在癌症检测中的有效性。综上所述,探针1(P186) 不仅丰富了癌症可视化诊断的技术手段,也为溶酶体相关的生物学研究提供了新的工具与视角。
3.6. 对粘度敏感的聚合物材料
近年来,荧光聚合物在粘度传感领域展现出独特魅力,其独特的重复结构单元能够促使激发能量沿聚合物链有效传递,进而诱发显著的“信号放大”效应,即荧光增强现象,这一特性显著优于传统小分子荧光探针。荧光聚合物以其卓越的光学性能著称,包括但不限于较宽的发射波长范围、高效的量子产率以及出色的光稳定性。2011年,Kwak研究团队率先开发了首个荧光聚合物探针PTMSDPA ,该探针不仅拥有较高的粘度灵敏度(χ = 0.50),还展现出快速响应的优异性能,成功应用于多种液体粘度的精确评估。PTMSDPA 对粘度的高度敏感性,可从其分子层面的多孔结构及π-π堆叠作用机制得以阐释。
另一研究亮点在于,Li与Qu等研究者巧妙地利用柠檬酸中的羧基与羟基官能团,通过脱水碳化工艺制备出碳核,随后在碳点表面引入吡咯烷基残基作为分子转子,创新性地开发出一种对粘度敏感的碳点材料。这一新型材料被成功应用于监测线粒体粘度及线粒体膜电位(MMP)的动态变化,深刻揭示了药物应激条件下细胞内线粒体粘度上升与MMP下降的复杂生理过程。
此外,Zhang与Qu等研究者还利用瞬态吸收光谱技术与计算模拟手段,深入探讨了粘度对碳nm管溶解弛豫过程的复杂影响机制。研究发现,在粘性介质中,溶剂分子与碳nm管间的强偶极-偶极相互作用会诱导形成密集的摩擦网络,这一结构变化直接影响了碳nm管的溶解弛豫动力学,进而导致了发光信号的显著变化。这一系列研究不仅拓宽了荧光探针在生物医学领域的应用范围,也为深入理解粘度调控下的分子间相互作用提供了宝贵的实验与理论依据。
4. 用于 pH 值检测的荧光探针
细胞内水合离子平衡的精确调控对于维持细胞各项功能的正常运作至关重要,其核心在于保持细胞各区域适宜的pH值环境,这一过程受到高度精细的生理调节。不同亚细胞器,如著名的溶酶体,通过独特的机制调节其内部pH值至4.5-5.5的酸性范围,以支持其内含水解酶的高效运作;而线粒体则相反,其内部pH值通常维持在较高的8.0左右,以适应其能量代谢的需求。鉴于各细胞器对特定pH值范围的严格要求,任何偏离这一平衡的状态都可能引发细胞功能障碍。例如,在正常生理条件下,健康细胞的胞内pH值维持在约7.2,而胞外空间则略高,约为7.4。然而,在癌细胞中,这一平衡被打破,表现为胞外pH值上升超过7.4,同时胞内pH值则降至6.7至7.1之间,这一变化与癌细胞的代谢异常和侵袭性密切相关。
为了深入探究水合离子平衡在生理与病理过程中的作用机制,科研人员开发了多种类型的pH探针,这些探针具备高时空分辨率,能够直接监测并量化不同生物系统内pH值的动态变化()。本章节将聚焦于几类具有代表性的pH探针,详细阐述它们如何通过荧光信号的特异性变化来响应并反映pH值的波动,从而为作者理解细胞内外环境微调的复杂性提供有力工具。 
图 50. 从不同支架中选取的 pH 值荧光探针。
4.1. 基于ICT机制的比率探针
在化学与生物学领域,基于分子内电荷转移(ICT)机制的pH探针设计,其核心结构巧妙地融合了一个电子给体、一个电子受体以及连接两者的π共轭体系。此类探针的响应机制依赖于质子的加入或移除(即质子化或去质子化过程),这一过程导致给体(具备强化电子给予能力)或受体(拥有增强的电子接受能力)的极性显著增强,进而引发偶极矩的显著变化。此偶极矩的变异强化了ICT效应,表现为探针的吸收光谱和/或发射光谱发生特征性的位移,这种光谱位移现象成为了定量检测pH值变化的可靠比率信号(如所示,特别体现在发射光谱的偏移上)。
值得注意的是,由于此类比率探针所依赖的光谱位移特性与探针在局部环境中的浓度无关,这一特性极大地提升了其在复杂生物体系中的应用价值,尤其是能够准确提供活细胞内pH值的定量信息,为细胞生物学、生物医学研究等领域提供了强有力的分析工具。
图 51:通过分子内电荷转移 (ICT) 机制设计的 pH 探针。
4.1.1. 基于羟基去质子化和质子化的 ICT 探针
在荧光探针的设计中,荧光团内羟基的去质子化过程是一个关键步骤,它促使氧阴离子的形成。这一氧阴离子作为增强的电子给体,通常能够显著影响荧光团的光谱特性,导致明显的红移现象。因此,将羟基作为电子给体巧妙地引入荧光母核结构中,为开发多样化的pH敏感荧光探针提供了极大的便利。
值得注意的是,羟基的质子化与去质子化过程紧密围绕其pKa 值进行,这一值界定了特定pH探针的有效检测范围。换言之,pKa值成为了定义探针敏感性的关键参数。为了实现对不同pH环境的精准监测,研究者们可以通过化学手段调整pH探针的结构,进而精细调控其pKa值。这一过程不仅拓宽了探针的应用范围,还使得探针能够针对特定的pH检测需求进行优化设计。
接下来,本文将进一步围绕荧光团母核展开,深入探讨这些基于羟基去质子化机制的pH探针的构造原理、性能特点及其在生物化学分析中的应用潜力。
4.1.1.1. 香豆素衍生物
香豆素类衍生物,如所展示的4-甲基伞形酮(4-Mu, P187) ,作为基于分子内电荷转移(ICT)机制的最早一批pH探针之一,其研究具有重要意义。在羟基去质子化作用下,P187在445nm波长处展现出强烈的荧光特性,其pKa值为7.78,因此被广泛用于细胞内pH值的监测。例如,Walker及其团队利用P187深入研究了小牛肠道碱性磷酸酶的动力学特性。然而,P187的激发与发射波长较短,加之其溶解性限制,一定程度上阻碍了其在生物领域的进一步应用。
为解决这一问题,Sames等科学家开发了Mini202(P188) 这一新型香豆素基探针,通过在羟基的正交位置引入氯原子,成功将pKa值降低至6.4,同时引入的烷基胺基团进一步优化了其亲脂性。在碱性条件下,P188的羟基去质子化后,其最大激发波长从335nm显著红移至370nm,分别对应其质子化酚态与去质子化苯酚态。尤为重要的是,P188在双光子显微镜(TPM)下展现出卓越的光稳定性和亮度,这一特性使得长波长激发成为可能,不仅提升了成像深度,还显著降低了对细胞的潜在损伤,从而在生物成像领域展现出巨大潜力。随后,P188被成功应用于PC-12细胞中儿茶酚胺分泌泡pH值的双光子成像测量,通过合并两个不同激发波长(692 nm和760 nm)下的图像,获得了令人满意的pH值比率信号()。
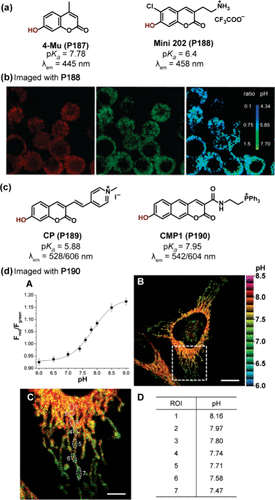 图 52. (a, c)基于香豆素衍生物的 ICT 探针; b)通过双光子荧光显微镜用P188测量 PC-12 细胞中儿茶酚胺分泌泡的 pH 值;左图:(d)(A)P190标记的 HeLa 细胞在不同 pH 值下的双光子滴定;(B)用P190染色的 HeLa 细胞的伪彩色比率 TPM 图像;(C)(b)中白色方框区域的放大图;(D)图(c)中白色圆圈所示感兴趣区(ROI)的估计 pH 值。
图 52. (a, c)基于香豆素衍生物的 ICT 探针; b)通过双光子荧光显微镜用P188测量 PC-12 细胞中儿茶酚胺分泌泡的 pH 值;左图:(d)(A)P190标记的 HeLa 细胞在不同 pH 值下的双光子滴定;(B)用P190染色的 HeLa 细胞的伪彩色比率 TPM 图像;(C)(b)中白色方框区域的放大图;(D)图(c)中白色圆圈所示感兴趣区(ROI)的估计 pH 值。
鉴于香豆素衍生物短波长激发与发射的局限性,研究者们通过扩展其π-共轭结构,实现了光谱的红移,开发出了一系列适用于红色发射窗口的探针。Yu等人在7-羟基香豆素CP(P189) 中引入了缺电子的吡啶鎓基团,使其最大发射波长分别达到了528nm(质子化态)和606nm(去质子化态)。在pH 4.0至10.0的广泛范围内,P189的吸收与发射光谱均发生了显著红移,且在pH 5.0至7.0区间内,荧光强度比I528/I606呈现出良好的线性关系。此外,其吡啶基团还赋予了P189线粒体靶向能力,使其成为首个用于线粒体pH值检测的比率型pH探针。
Kim及其团队则报告了另一种红色发射香豆素衍生物CMP1(P190) ,其中2-萘酚在碱性条件下的去质子化显著增强了ICT过程,并伴随光谱的红移。P190的pKa值为7.86 ± 0.05,非常适合于监测线粒体pH值的变化。利用双光子显微镜技术,当线粒体pH值(pHmito)从6.0变化至9.0时,P190的发射波长从542nm红移至604nm。特别值得注意的是,比率型双光子显微镜成像揭示了pHmito在亚细胞水平上的异质性分布,即在细胞核周围区域观察到较高的pHmito值,这一发现为细胞生物学研究提供了新的视角()。
4.1.1.2. 芘衍生物
芘类化合物中,8-羟基-1,3,6-芘三磺酸盐(HPTS,P191),作为一种pH敏感探针(如所示),以其独特的化学性质在生物学研究中占据重要地位。该探针展现出显著的pH依赖性,其pKa值精确测定为7.22 ± 0.04,这一特性使其能够精准捕捉生理pH范围内(约为7.2-7.4)的微妙变化。在碱性环境条件下,随着pH值从4逐渐升高至10,P191分子中的羟基发生去质子化反应,直接导致其在510nm波长处的荧光强度发生显著增强。相较于其他同类早期探针,P191不仅拥有理想的pKa值,还兼具高水溶性、出色的量子产率以及较大的斯托克斯位移,这些优势使得它成为生理pH条件下理想的荧光探针选择。 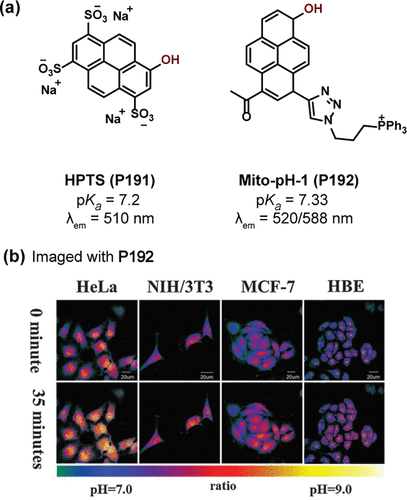
图 53. (a) 基于芘衍生物的 ICT 探针; (b) 不同种类的细胞的比率图。
进一步地,Petter及其研究团队巧妙地利用P191探针,实现了对神经元内体-溶酶体途径中pH值的精确量化测量,这一成果为神经生物学领域的研究提供了有力的工具支持。
与此同时,Yang及其同事则聚焦于线粒体pH值的检测,他们开发出了一种新型芘衍生物——Mito-pH-1 (P192 )。该探针设计巧妙,将羟基与线粒体靶向基团融入芘分子结构之中,实现了对线粒体pH值的高度特异性响应。在pH 4.0至11.0的宽广范围内,P192 在520nm和588nm波长处的荧光强度呈现出良好的比率响应关系。其pKa值经测定为7.33 ± 0.04,与线粒体在生理及病理状态下的pH值变化范围高度契合。因此,P192 被成功应用于多个细胞系在H2O2刺激下线粒体pH值(pHmito)的定量测定,如所示,这一研究不仅深化了对线粒体功能及其调控机制的理解,也为相关疾病的诊断与治疗提供了新的视角和策略。
4.1.1.3. 氮杂-BODIPY 衍生物
氮杂-BODIPY衍生物作为一类关键的荧光团母体,其独特的近红外发射特性使其成为生物成像领域中的宝贵资源。特别是在深红及近红外光谱窗口内工作的荧光探针,对于提升组织及活体动物成像的效能至关重要。这些探针能够显著削弱生物体内自发荧光的干扰,并有效增加成像的穿透深度。
Klimant及其研究团队成功合成了一系列基于氮杂-BODIPY结构的近红外荧光探针,这些探针的发射波长覆盖了680至740nm的范围。其中,2(P193) 的探针(如所示)展现了优越的生理适应性,其pKa值为7.01,在羟基去质子化过程中,其最大激发波长从668nm显著红移至734nm,体现了ICT机制的显著作用。 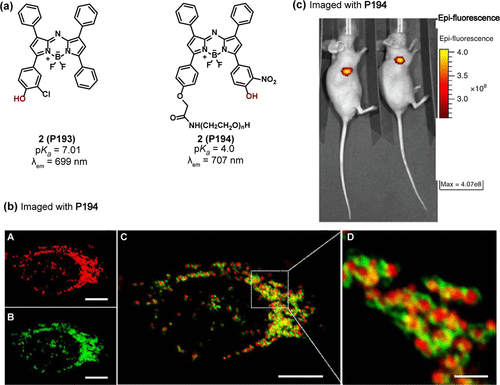
图 54. (a) 基于杂-BODIPY 衍生物的 ICT 探针; (b) 2(P194) 的溶酶体定位;(c) 2(P194) 的近红外荧光成像。
随后,O'Shea及其同事进一步拓展了这一领域,开发了具有相似特性的探针2(P194) 。该探针的最大发射波长设定在707nm,其独特之处在于羟基的正交位置引入了一个具有强吸电子能力的硝基基团。这一设计不仅加速了羟基的去质子化过程,还导致了pKa值的显著降低至4.0,使得P194能够精准地响应酸性溶酶体中的pH值变化。
为了验证P194的靶向能力,研究团队在表达有溶酶体绿色荧光蛋白(GFP)融合膜蛋白的HeLa细胞中进行了共聚焦显微成像实验。实验结果显示,P194能够特异性地标记溶酶体(如所示),证明了其优异的溶酶体靶向性。
此外,在模型小鼠的近红外荧光成像实验中,研究人员采用了PEG修饰的P194探针。实验结果(如所示)清晰表明,由于癌细胞微环境的酸性特征,P194能够高效地定位于癌细胞区域,为癌症的早期诊断及靶向治疗提供了有力的技术支持。
4.1.1.4. 半花菁衍生物
半花菁衍生物作为近红外pH探针的核心结构,展现出其独特的价值。Ma及其研究团队贡献了一项重要成果——近红外pH比率探针Lyso-pH(P195) ,该探针在pH 4.0至6.0范围内,其I670/I708 比率展现出卓越的线性响应特性。特别地,在pH 5.0条件下,P195的pKa精确测定为5.00 ± 0.01,且其量子产率Φf达到0.16,这一性能使得它成为研究细胞热应激反应的理想工具。实验证明,P195成功监测了HeLa与MCF-7细胞在41°C及45°C热休克条件下溶酶体pH的变化趋势,揭示了随着温度升高,溶酶体pH值相应上升的现象,并通过直观的颜色变化(从橙色转为黄色)加以佐证。此外,热恢复实验进一步确认了这些pH变化在生理上的不可逆性。 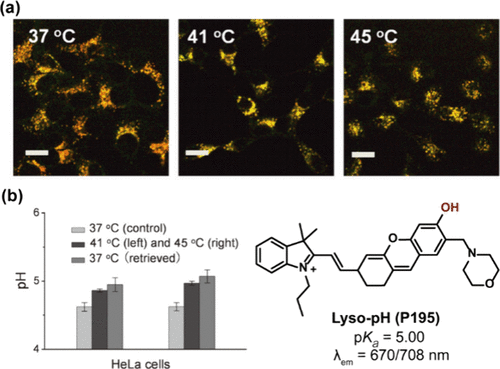
图 55. (a) Lyso-pH(P195) 的荧光图像;(b) 左图:HeLa 细胞溶酶体 pH 变化的可逆性,右图:P195 的结构。
Jia及其同事则另辟蹊径,设计了基于半花菁母核的CPH(P196) 探针,其最大发射波长在pH 3.0至11.0范围内从522nm显著红移至559nm,pKa值优化为6.44,预示了其作为溶酶体靶向荧光探针的潜力。通过引入吗啉基团,他们进一步开发出CPY(P197) 探针,实现了对溶酶体pH变化的特异性比率检测,拓宽了探针的应用范围。 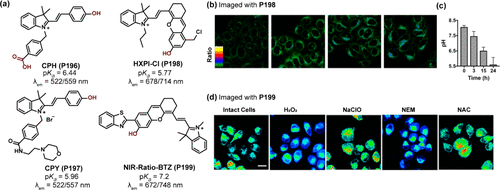
图 56. (a) 基于半花菁衍生物的 ICT 探针;(b) 在雷帕霉素诱导的丝裂过程中,HXPI-Cl(P198) 比率图像;(c) 线粒体的 pH 值随时间的变化;(d)NIR-Ratio-BTZ(P199) 的比率图像。
Ma团队的研究并未止步,他们结合半花菁衍生物与苄基氯,创制了P198(HXPI-Cl) 近红外探针,该探针pKa值为5.77,能在678nm和714nm处进行比率测量,有效追踪线粒体在有丝分裂过程中的pH动态。
Yang及其团队则致力于半花菁近红外探针的多样化探索,通过调整羟基正交位置上的供电子与吸电子取代基,精细调控探针的pKa值与发射特性。其中,NIR-Ratio-BTZ(P199) 探针因其高达76nm的斯托克斯位移和适中的pKa值(7.2),在672nm和748nm波长下展现出优异的比率测量能力,成功应用于HeLa细胞在不同刺激条件下的pH值监测,展示了该类探针在生物学研究中的广泛应用前景。
4.1.1.5. 其他母核
Manderville及其研究团队报道了一种创新的C8酚嘌呤核苷加合物4(P200) (如所示),该化合物在生理pH范围(6.0至8.0)内展现出显著的pH敏感性荧光特性。与传统核苷的微弱荧光不同,酚类加合物的引入赋予了这一系列嘌呤荧光探针在390nm波长下的发光能力,其量子产率介于0.25至0.56之间。特别地,P200的pKa值精确测定为7.29,进一步验证了其作为pH传感器的潜力。 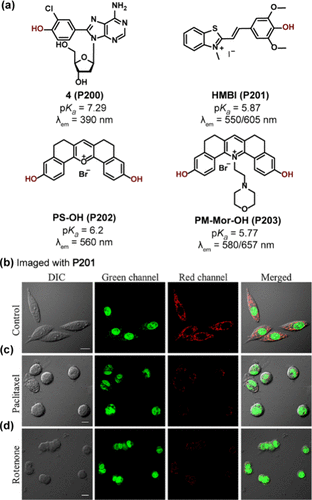
图 57. (a) 基于其他母核的 ICT 探针(b-d) SiHa 细胞在不使用(b)或使用紫杉醇(c)和鱼藤酮(d)处理后,用HMBI(P201) 染色的共聚焦荧光图像。
在pH感知机制的设计中,花菁母核上羟基的引入成为关键。以细胞核和线粒体靶向pH探针HMBI(P201) 为例,它是通过pH敏感的羟基半花菁与细胞核DNA特异性结合的苯并噻唑盐巧妙组合而成。在pH值从8.0降至4.0的过程中,随着羟基的去质子化,P201的荧光强度比(I550/I605) 显著增强了350倍,这一特性使其成为监测细胞内部pH动态变化的有力工具。在SiHa细胞实验中,P201被用于观察紫杉醇和鱼藤酮两种药物作用下的pH变化()。紫杉醇通过结合微管诱导细胞凋亡,而鱼藤酮则干扰线粒体电子传递链,两者均导致线粒体pH值上升,表现为红色荧光信号的显著减弱,而细胞核pH相对稳定,绿色荧光保持不变。
Ajayaghosh等人则探索了另一种母核结构——五环吡喃荧光团PS-OH(P202) 。在酸性条件下,P202在560nm处展现出强烈的黄色荧光,并伴有高达100nm的斯托克斯位移,其pKa值为6.2 ± 0.03。然而,在生理pH(pH=7.4)下,由于羟基的去质子化作用,P202几乎不发光,这种“开-关”荧光响应特性使其成为检测A547细胞中pH值变化的理想选择。进一步地,通过向P202中引入吗啉基团,成功制备了线粒体靶向探针PM-Mor-OH(P203) 。该探针的核心是一个具有二羟基功能的吡啶鎓,它能通过质子化和去质子化过程对pH值变化作出响应。在pH值从8.5降至4.0的过程中,P203的去质子化形式在657nm处发出红色光,而质子化形式则在580nm处发出黄色光,这种比率荧光响应(I657/I580)为精确测量细胞内部pH变化提供了可靠依据。
4.1.2. 基于含氮母核质子化和去质子化的 ICT 探针
在化学与生物学研究中,含氮母核结构(涵盖氨基、烷基胺、吡啶、喹啉及多种含氮杂环)展现出对pH值变化的高度敏感性,能够通过质子化或去质子化过程调节其电子给予或接受能力。在ICT探针的设计中,氨基通常扮演电子给体的关键角色。然而,当氨基发生质子化转变为季铵盐时,其性质发生根本性转变,成为ICT过程中的电子受体,这一变化直接影响了探针的吸收光谱与发射光谱特性。因此,这类含氮母核成为了ICT探针中不可或缺的pH响应元件。
接下来,作者将依据荧光团母核的类别,深入探讨含有上述含氮母核结构的探针。这些探针利用含氮基团在不同pH条件下的电子性质变化,实现了对目标环境pH值的精确监测与响应,为生物学研究、药物筛选及环境监测等领域提供了强有力的工具。
4.1.2.1. 香豆素衍生物
香豆素,凭借其卓越的光物理性能和结构可调性,在荧光探针设计中占据了举足轻重的地位,成为了构建ICT探针的理想母体结构。近年来,科研人员已成功开发出多种携带不同取代基的香豆素基ICT探针(),这些探针在生物分析领域展现出巨大的应用潜力。
Zhou及其研究团队创新性地设计了一种香豆素基荧光分子Lyso-pH(P204) (),该分子在510nm波长处发射荧光,并具备精确的pKa值(4.17),使其能够特异性地靶向溶酶体。其高共定位系数(PCC=0.96)确保了其在溶酶体pH监测中的准确性和可靠性,为观察细胞溶酶体pH的动态变化提供了有力工具。 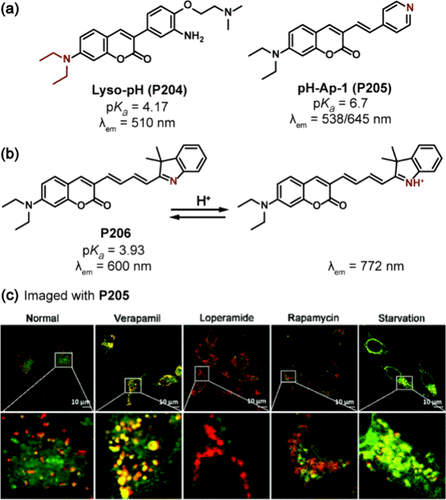
图 58. (a) 基于香豆素衍生物的 ICT 探针;(b) P206的 pH 响应机制; (c) P205的细胞成像图
Yu及其同事则另辟蹊径,开发出了一种新颖的香豆素基探针pH-Ap-1(P205) ,该探针巧妙地引入了吡啶基团,赋予其pKa值为6.7的特性。在pH 5.6至8.0的宽范围内,P205的吸光度比(A365/A485)展现出良好的线性关系,同时,其发射率比(I538/I645)在pH从5.0升至8.0的过程中激增了80倍,这一特性使其能够在药物处理和饥饿诱导自噬等复杂生物过程中,实现对细胞pH变化的精准比率测量()。
为了进一步提升香豆素基pH探针的实用性和灵敏度,Ge及其合作者通过引入甲基水杨碱,成功地将P206探针的发射光谱拓展至近红外区域,实现了在600nm和722nm波长处的比率发射()。这一设计不仅拓宽了探针的应用范围,还赋予了P206优异的pKa值(3.93),使其能够直观、准确地监测KB和HeLa细胞溶酶体内pH的细微波动,为细胞生物学研究提供了强大的技术支持。
4.1.2.2. 喹啉衍生物
喹啉作为一种成熟且广泛应用的荧光母体结构,在化学与生物学领域展现出了独特的价值。其氮原子的质子化特性使得喹啉在酸性环境中能够发出强烈的荧光信号,因此常被用作荧光量子产率测定的标准参考物质,如硫酸奎宁。基于喹啉骨架的分子设计已深入渗透到pH探针的研发之中(),为细胞及亚细胞器内部酸碱度的精确监测提供了有力工具。
Jiang及其研究团队成功合成了一种喹啉衍生物PQ-Lyso(P207) ,该探针在pH 3.0至6.0范围内展现出显著的荧光强度比变化(R = I494/I570 nm,R/R0 = 105),且与溶菌酶的高共定位系数(PCC = 0.81)证明了其溶酶体靶向性。通过P207,研究者们能够定量监测NIH 3T3细胞在不同刺激条件下溶酶体pH的动态变化,如经10 mM NH4Cl处理后pH从4.25升至5.26,以及100 μM H2O2处理后的中间变化。
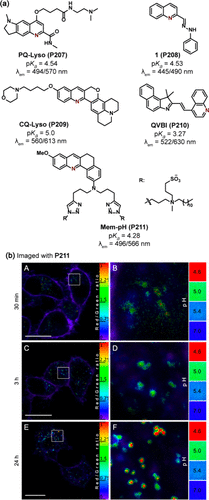 图 59. (a) 基于喹啉衍生物的 ICT 探针;(b) KB 细胞与 Mem-pH(P211) 孵育 1 小时后的比率测量图像,
图 59. (a) 基于喹啉衍生物的 ICT 探针;(b) KB 细胞与 Mem-pH(P211) 孵育 1 小时后的比率测量图像,
另一项研究聚焦于喹啉腙类探针P208,该探针在445和490nm波长下通过比率检测法精确指示HeLa细胞内的pH值,其pKa值为4.53,进一步丰富了喹啉基pH探针的家族成员。
针对奎宁因小π-共轭结构导致的发射波长限制,Song及其合作者通过在喹啉2位引入芳基,创新性地开发出比率pH探针CQ-Lyso(P209) 。该探针不仅pKa值调整至5.0,更在溶酶体中展现出优异的定位能力,能够在560和613nm波长下实现溶酶体pH的定量测量与成像。
Dong团队则贡献了一种红色发射的比率测定探针QVBI(P210) ,其在2.0至3.8的pH范围内呈线性响应,pKa值低至3.27,特别适用于Escherichia coli细胞内极端酸性环境的成像。
值得注意的是,基于喹啉的探针往往具有较低的pKa值,这使其成为监测亚细胞器低pH值范围的理想选择。科洛特及其合作者设计的Mem-pH(P211) 探针,以细胞膜为靶标,通过监测囊泡酸化过程,在496和566nm波长下实现了比率检测,其pKa值为4.28。在KB细胞实验中,P211清晰地呈现了细胞膜与更酸性囊泡之间的pH值差异图像(见),为细胞生物学研究提供了新的视角和工具。
4.1.2.3. 咔唑衍生物
基于咔唑衍生物的ICT探针,凭借其短激发波长与卓越的光稳定性,在双光子荧光成像领域被视为极具潜力的候选材料()。Meng及其研究团队成功设计了一种融合咔唑与苯并咪唑母核的比率型探针Lyso-MPCB(P212) 。在此探针中,苯并咪唑氮原子的质子化效应显著促进了发射光谱的红移现象(由410nm迁移至475nm),使得P212能够借助双光子显微镜(λex = 760nm)精确监测溶酶体内pH值的细微波动。实验结果表明,在MCF-7细胞经历饥饿诱导的自噬过程中,溶酶体pH值从5.2下降至4.6,这一变化被P212准确捕捉并记录。
Wong团队同样利用了苯并咪唑这一pH敏感基团,开发出了一种新型双光子比率探针BIMC(P213) 。通过引入甲基卡必醇取代基,P213实现了对溶酶体的特异性靶向。该探针展现出4.46的pKa值,并在碱性条件下(发射波长454nm)与酸性条件下(发射波长514nm)呈现出显著的荧光特性差异。在750nm激发光下,P213能够同时在两个荧光通道(430-470nm、500-540nm)内进行双光子比率成像,从而有效监测HeLa细胞在H2O2和NAC处理下溶酶体pH值的变化。
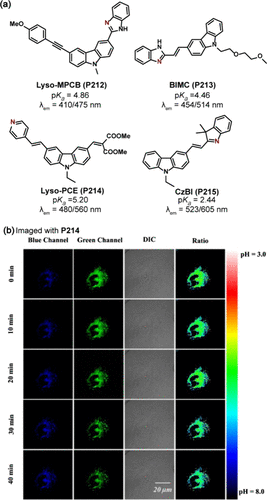
图 60. (a) 基于咔唑衍生物的 ICT 探针;(b) 在氯喹刺激下,Lyso-PCE(P214) 在 HeLa 细胞中的双光子荧光图像。
Meng等人进一步拓展了双光子探针的设计思路,报道了结合吡啶与咔唑特性的比率计量探针Lyso-PCE(P214) 。其中,吡啶基不仅作为pH反应的关键位点,还兼具溶酶体靶向功能。在pH 9.5至2.6的广泛范围内,吡啶基的质子化促使P214的最大发射波长从480nm显著红移至560nm,同时荧光强度比(I560/I480)激增81倍。利用双光子显微镜(λex = 820nm),P214能够选择性地追踪氯喹作用下溶酶体pH的动态变化(范围从4.9到6.1),为细胞生物学研究提供了有力工具()。
Dong及其合作者则另辟蹊径,采用吲哚衍生物作为pH响应单元,设计合成了比率探针CzBI(P215) 。该探针在pH 1.50至3.60的范围内展现出线性响应特性,且荧光强度比(I605 nm/I523 nm)显著提升。P215的pKa值为2.44,使其能够精确监测在不同pH条件(如3.0、4.0、7.4)下培养的HeLa细胞内pH值变化,以及在极端酸性环境(pH 1.0至4.0)下大肠杆菌细胞的pH状态,为微生物学与细胞生物学研究提供了新的视角。
4.1.2.4. BODIPY 衍生物
BODIPY衍生物凭借其在生物成像领域的卓越性能与多功能性,成为研究热点。这类荧光团不仅展现出高量子产率与杰出的光稳定性,还具备狭窄且可控的吸收与发射光谱带,以及优越的生物相容性,确保了其在复杂生物环境中的稳定性与适用性。尤为突出的是,BODIPY衍生物的结构具有高度可变性与灵活性,为科研人员提供了广阔的改性空间,以调整其光谱特性至特定需求范围。 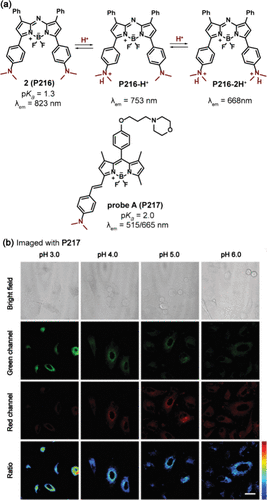
图 61. (a) 基于 BODIPY 衍生物的 ICT 探针;(b) A549 细胞中的探针A (P217) 在不同 pH 值下的荧光图像。
O'Shea团队及其合作者通过巧妙设计,合成了一系列基于氮杂-BODIPY的荧光团,这些荧光团在650至850nm的近红外区域展现出独特的光谱特性。尤为引人注目的是,他们利用二甲基氨基作为pH敏感基团,成功实现了对荧光性质的pH依赖性调控。其中,化合物2(P216) 在最大近红外发射波长823nm处表现优异,且在酸性环境中经历两步质子化过程,分别导致发射光谱蓝移至753nm(P216-H+) 和668nm(P216-2H+) ,这一过程伴随着显著的表观pKa值变化(1.3),为精确监测pH变化提供了可能()。
Jiang等人进一步拓展了这一研究,他们采用类似的二烷基氨基策略,开发出一种基于BODIPY的比率型pH探针A(P217) ,其pKa值精确设定为2.0。在pH范围从6.83降至0.82的过程中,P217的二甲基氨基发生质子化,导致最大发射波长从665nm显著蓝移至515nm,并伴随荧光强度比(I515/I665)高达300倍的增强。这一特性使得P217能够作为强大的工具,用于实时、无创地监测活体A549细胞内pH值在3.0至6.0范围内的动态变化(见),为细胞生物学、药物筛选及疾病诊断等领域的研究开辟了新途径。
4.1.2.5. 花菁衍生物
花菁衍生物因其独特的π共轭体系扩展能力,特别是通过增加双键数量,能够轻松调节其最大发射波长至近红外区域,从而成为制备高性能pH探针的优选材料()。Gregory团队及其合作者创新性地开发出一种基于五甲氧基花菁的荧光探针Cy5(P218) ,其最大发射波长设定在665nm,且因氮原子的去质子化作用,在碱性pH条件下表现出荧光猝灭特性。该探针的pKa值为7.5,使其对6.0至8.0的pH范围具有高度敏感性。随后,Kalinka团队通过引入不同取代基(如硫基和羧基)的策略,进一步优化了这一系列探针的pKa值,其中CypHer5(P219) 探针的pKa调整至6.1,成功应用于监测CHO细胞内吞过程中G蛋白偶联受体(GPCR)与配体的动态相互作用。具体而言,当P219标记于细胞表面特定GPCR(如c-myc-d-opioid受体)时,其在质膜中性环境(pH=7.4)下保持非荧光状态;而一旦GPCR被激动剂激活并内化至内体(pH 5-6),P219随即质子化并激活荧光,实现了对受体活化的实时追踪。 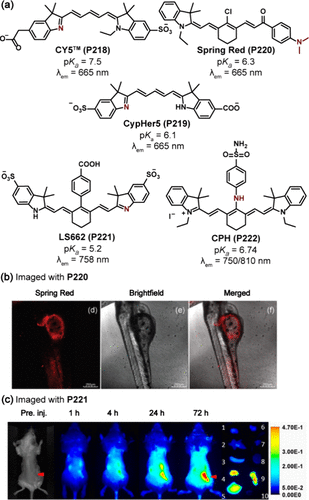
图 62. (a) 基于花菁衍生物的 ICT 探针(b) 斑马鱼体内Spring Red (P220) 的共焦荧光成像;(c) LS662(P221) 的小鼠成像。
然而,传统花菁类染料中柔性和可旋转烯链的存在往往促进了非辐射跃迁过程,进而降低了量子产率和光稳定性。为此,Tang团队研发出新型花菁探针Spring Red (P220) ,该探针通过引入刚性环己烷结构显著提升了分子刚性,从而有效抑制了非辐射衰减。P220展现出680nm的最大发射波长及150nm的斯托克斯位移,同时以二甲基氨基作为pH响应位点,pKa值为6.3。在酸性条件下,二甲基氨基的质子化导致荧光减弱,源于氮原子孤对电子与荧光团p-π共轭作用的破坏;而在碱性环境中,荧光则得以恢复,实现了“关-开”型荧光信号转换。尤为值得一提的是,P220在线粒体中实现了高效定位,与MitoTracker Green的共定位系数高达0.91,进一步验证了其作为线粒体靶向探针的潜力。此外,斑马鱼模型实验也揭示了P220在生物体内的应用前景(),其心脏区域的显著荧光可能与该区域高浓度的线粒体有关。 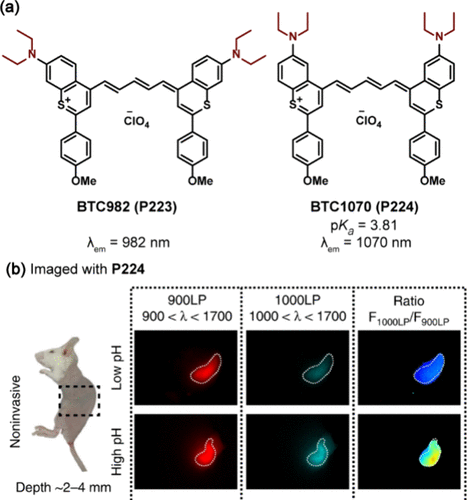
图 63. (a) 近红外花菁荧光团的结构;(b) 胃 pH 值小鼠和解剖胃的活体比率荧光成像。
Achilefu团队则报道了另一种融合环己烷结构的探针LS662(P221) ,该探针在细胞外酸性pH环境下通过质子化作用发出近红外荧光,特别适用于实体瘤的精准显像。在中性和碱性条件下,P221的近红外荧光强度较低,最大吸收波长位于503nm;而当pH降至6以下时,其在768nm处的荧光显著增强,并伴有最大吸收波长的红移至750nm。P221的pKa值为5.2,使得其在小鼠模型中对多种肿瘤类型均展现出优异的显像效果,最早在注射后1小时即可在4T1/luc皮下肿瘤中检测到荧光信号,且在72小时内肿瘤区域与正常组织的对比度达到最大(),肿瘤选择性对比度值高达15.7±0.3。
针对NIR-II窗口(1000-1700nm)荧光探针面临的溶解色素淬灭挑战,Zhang团队成功合成了一系列花菁衍生物(),这些衍生物不仅克服了上述难题,还展现出超过1000nm的吸收和发射特性。其中,BTC982(P223) 和BTC1070(P224) 通过引入两个二乙氨基,实现了在NIR-II窗口的高效发射,最大发射波长分别达到982nm和1070nm。特别地,P224被应用于体内胃pH的比率测量成像,其无创成像能力不仅能够清晰识别腹部左外侧组织深处(2至4毫米)的胃部轮廓,还能通过鲜明的伪彩色对比准确区分不同pH环境(),为临床诊断和治疗提供了有力支持。
此外,Tang团队还开发了针对高尔基体的靶向探针CPH(P222),该探针携带苯磺酰胺基团,兼具荧光和光声成像功能。通过共定位实验验证,P222与Golgi-Tracker Red的共定位系数高达0.90,展现了其作为高尔基体特异性成像工具的巨大潜力。
4.1.2.6. 其他母核
在化学与生物学交叉领域,噁唑与苯并噻唑等杂环化合物凭借其独特的电子给体与受体特性,成为构建ICT探针的关键组件()。Kim研究团队及其合作者创新性地设计了一系列源自苯并咪唑的比率型双光子荧光探针,旨在精准监测酸性pH环境。其中,BH1L(P225) 探针展现出5.82的pKa值,并在溶酶体中实现了高度特异性定位(PCC=0.95),进一步验证了其在实时追踪HeLa细胞溶酶体内pH动态变化方面的应用价值()。尤为突出的是,P225在740nm激发光下,能够深入活体大鼠脑组织进行双光子显微成像,揭示了大脑DG区域相较于CA区域更富集的酸性pH分布特征()。 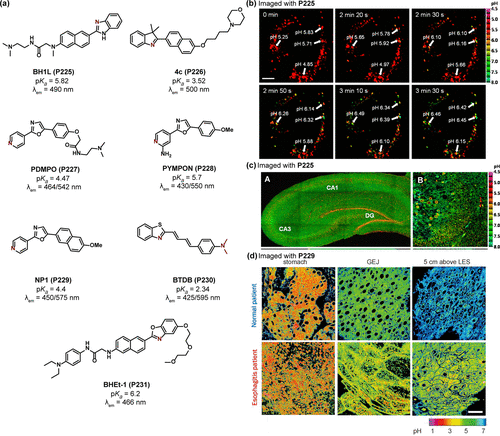
图 64. (a) 基于其他荧光团的 ICT 探针; (b) BH1L(P225) 标记的 HeLa 细胞的双光子图像;(c) 用 P225 染色的大鼠海马切片的伪彩色比率 TPM 图像;(d)用NP1(P229) 标记的胃和食管炎组织的比率TPM图像。
沿着这一研究方向,Perez团队则另辟蹊径,开发了含有萘与吲哚骨架的探针4c(P226) ,该探针巧妙引入吗啉作为溶酶体靶向基团,确保了高效的细胞器定位(PCC=0.84)。P226凭借其氮原子的质子化特性,展现出优异的“关闭-开启”荧光响应模式,在pH 7.0至1.2的宽泛范围内,实现了以500nm为中心的最大发射波长变化。
此外,Haugland及其合作者通过引入噁唑啉分子结构,设计出PDMPO(P227) 探针,该探针内置吡啶基团(pKa=4.47)作为pH敏感单元,能够在极端pH条件下(pH 14.0至1.0)分别展现出442nm与542nm的特征发射峰。P227的低pKa特性使其适用于监测MDCK细胞溶酶体内的pH波动。
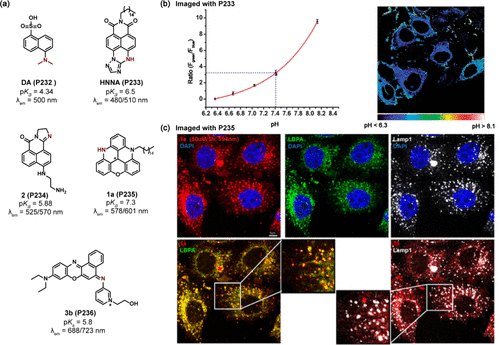
图 65. (a) 基于其他荧光团的 ICT 探针; (b) 根据使用HNNA (P233) 获得的校准曲线(左)计算出的未处理 MCF-7 细胞的 pH 图(右);(c) 用 P235 处理 HeLa 细胞并用 PFA 固定。然后用 LBPA 和 Lamp1 抗体标记细胞,再用二抗标记,最后用荧光显微镜分析。细胞核用 DAPI 染色。
Jullien团队则在吡啶分子的2位引入氨基,创制出PYMPON(P228) 探针,其高pKa值(6.9)赋予了其在pH 3.0至8.0范围内作为比率测定探针的能力,发射波长覆盖430nm至550nm。基于相似的设计思路,Cho团队开发了NP1(P229) 探针,利用吡啶基团(pKa=4.4)实现了对人体胃及食道组织深层(90-180毫米)pH的双光子比率成像,为评估正常人与食管炎患者之间胃与食道pH差异提供了有力工具()。
在苯并噻唑基pH探针领域,BTDB(P230) 以其低pKa值(2.34)在pH 1.2至7.0范围内对大肠杆菌细胞酸度监测展现出显著优势,同时在425nm与595nm处呈现出特征性的比率发射光谱。Cho团队进一步拓展了这一领域,开发出BHEt-1(P231) 双光子pH敏感探针,其最大发射波长位于466nm,pKa值为6.2,能够基于酸性囊泡比例差异有效区分癌细胞与非癌细胞。
Yang及其同事则贡献了一种结构简洁的小分子探针DA(P232) (),该探针利用二甲基氨基的质子化效应,实现了在pH 7.00至2.00范围内的“关-开”荧光信号转换,且在284nm激发下,500nm处的荧光强度可增强131倍,而在320nm激发时则表现出显著的荧光淬灭现象,为水溶液pH监测提供了新的策略。
1,8-萘酰亚胺,作为一种广泛应用的荧光团骨架,在上官及其研究团队的努力下,被成功转化为一种创新的比率型pH探针HNNA(P233) ()。该探针在pH 5.0至8.0的生理范围内,通过N-H键的可逆去质子化与质子化过程,实现了光谱从480nm向510nm的有效红移。为了优化其在细胞膜上的定位效果,P233被巧妙地设计了长烷基链。在MCF-7细胞实验中,萘酰亚胺基团在细胞内外空间的随机分布通过荧光强度比(I510/I480)测定,得出了平均pH值为7.41 ± 0.06的精确数据,如图65b所示。然而,值得注意的是,许多1,8-萘酰亚胺衍生物因水溶性不佳而限制了其在生物成像领域的广泛应用。为此,研究人员通过乙二胺分子的引入,显著提升了P234探针在水溶液中的溶解度,其pKa值被精确调控至5.88,从而使其更适合于活细胞内溶酶体pH的精确测量。
除了溶酶体之外,针对晚期内体的特异性探针开发也取得了重要进展。Lacour及其团队报告了一种pKa值为7.3的探针P235,该探针在酸性和碱性条件下分别展现出578nm和601nm的双发射特性。通过P235与LBPA和LAMP1的共定位实验,进一步证实了其在HeLa细胞中对晚期内质体区域(pH 5.0-5.5)的特异性靶向能力()。
此外,Ihara及其合作者则另辟蹊径,基于吩噁嗪母核设计并合成了一系列近红外荧光探针。这些探针通过引入吡啶分子衍生物,实现了pKa值的广泛调控,覆盖2.7至7.1的宽范围。其中,P236作为代表性探针,其发射波长位于687nm,pKa值为2.7,已成功应用于监测HeLa细胞在不同缓冲液(pH 4.0至7.4)条件下的细胞内pH变化,为细胞生理学研究提供了有力的工具。
4.2 利用 PET 机制设计的 pH 值敏感探针
基于ICT机制的探针在pH监测中展现出比率成像的优势,它们通过吸收和/或发射光谱的位移来灵敏地反映pH环境的变化。然而,许多此类探针在提升信噪比方面存在局限,尤其是缺乏“关闭-开启”型荧光响应,后者在生物检测中对于提升数据质量至关重要。为此,科学家们引入了PET机制来设计pH探针,该机制能够依据pH变化调控荧光行为。
PET机制的核心在于荧光团与其电子给体或受体之间的能级匹配,使得当给体或受体的HOMO(最高占据分子轨道)或LUMO(最低未占据分子轨道)能级与荧光团相近时,发生快速电子转移,从而有效淬灭荧光。一旦这一电子转移路径被阻断,荧光即被激活。在PET型pH探针设计中,给体和/或受体同时作为pH敏感单元,具备特定的pKa值,能够响应质子化或去质子化过程。这些探针在常态下由于活跃的PET过程而呈现荧光淬灭状态,但在特定pH范围内,质子化/去质子化作用会抑制PET过程,导致荧光信号的显著“关闭-开启”转变(如所示)。
此类PET基pH探针的荧光发射强度与所监测区域的pH值之间存在定量关系,为精确测量生物体内或环境中的pH变化提供了可靠手段。接下来,作者将深入探讨几种利用PET机制精心设计的pH响应荧光探针的实例。 
图 66:通过光诱导电子转移 (PET) 机制设计的 pH 探针。
4.2.1. BODIPY 衍生物
如所展示,BODIPY通过在第8位引入芳基基团,有效促进了光致电子转移(PET)机制,因此成为开发PET基探针的优选平台。2009年,Kobayashi团队报道了一种pH响应探针DiEtNBDP(P237) (),其pKa值精确测定为6.0。在酸性环境中,P237展现出绿色荧光(λem = 536 nm),这是由于二乙氨基的质子化阻断了从苯胺基团至BODIPY核心的PET过程。P237在NIH3T3 HER2+细胞溶酶体中实现了特异性染色,并通过与LysoTracker Red的共定位实验得以验证。相比之下,采用苯基取代的PhBDP(P238) 探针,由于缺乏pH敏感位点,对溶酶体无显著选择性()。
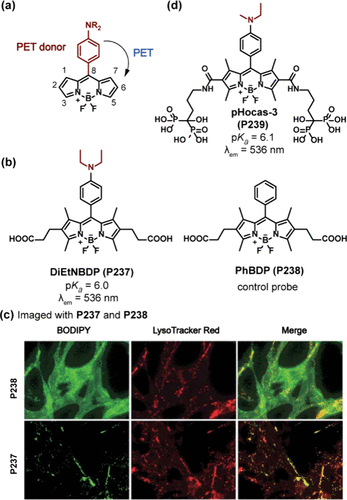
图 67. (a) 在 BODIPY 的 8 位上含有苯胺基团作为 PET 给体的 pH 探针的结构;(b) DiEtNBDP(P237) 和 PhBDP(P238) 的结构;(c) NIH3T3 HER2+ 细胞的双色荧光显微图像;(d)pHocas-3(P239) 的结构。
随后,Kikuchi及其研究团队开发了pHocas-3(P239) ,这是一种基于BODIPY的pH激活探针。P239巧妙地利用甲基/乙基取代的氨基作为PET给体,并整合了双膦酸基团以增强与骨组织的亲和力()。其pKa值为6.1,在酸性pH条件下,氮原子的质子化作用促使在536 nm处发出清晰可辨的荧光信号,从而被应用于破骨细胞活性的定量评估。
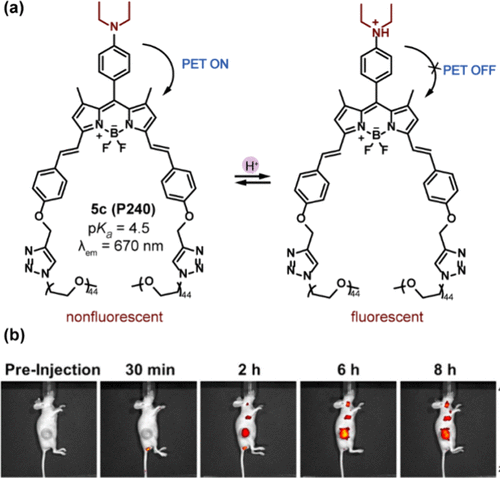
图 68. (a) P240的结构和 pH 响应机制;(b) 5c(P240) 的体内荧光图像。
沿袭此设计理念,Siegwart及其同事引入了水溶性探针P240,该探针采用二乙氨基作为PET给体()。在碱性条件下,由于PET过程的有效运作,P240保持非荧光状态。其pKa值为4.5,意味着在酸性pH环境中会被激活,并在670 nm处发射红色荧光,这一特性使其成为体内肿瘤检测的有力工具,尤其在低背景信号条件下表现优异。如所示,P240在注射至携带皮下肿瘤的小鼠体内6小时后,于肿瘤区域发出强烈且逐渐增强的荧光信号。
此外,羟基作为PET给体也被巧妙地应用于苄基修饰的pH探针设计中(),其在碱性条件下的去质子化可形成更具电子给体特性的阴离子。Boens团队合成了一系列羟基位于酚取代基不同位置的BODIPY衍生物,其中含氯取代基的P241()在pH由10.48降至5.30时,荧光强度激增130倍,pKa值为7.49。Resch-Genger团队则报道了类似结构的P242 (),其m-酚基赋予该探针高达10.31的pKa值,在酸性pH下于506 nm处发射强烈荧光,归因于质子化形式下PET过程的有效抑制。
Jiang及其合作者则开创性地开发了基于氮杂-BODIPY的探针9A(P243) 。在碱性条件下,P243中的多巴胺基团氧化为醌基团,后者作为电子给体启动PET过程()。而当pH值降至酸性范围时,醌基团还原为多巴胺,从而抑制PET并显著增强729 nm处的近红外荧光发射,覆盖了pH 8.0至4.0的广泛区间。通过将P243与DGL-PEG-pHLIP(DPP)共轭,制得的DPP-P243探针成功实现了对乳腺癌细胞酸性胞外环境的靶向检测。 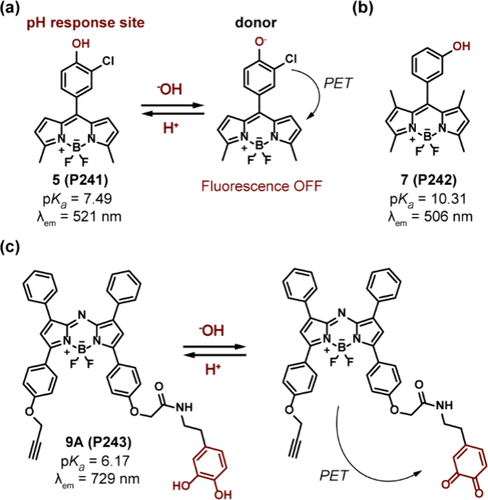
图 69. 含有酚基的 pH 探针的结构;(a)5(P241) 的结构和 pH 响应机制;(b) 7(P242 ) 的结构;(c) 9A(P243) 的结构和 pH 响应机制。
在BODIPY衍生物的设计中,吗啉与哌嗪基团同样扮演了关键的光致电子转移(PET)给体角色()。Liu及其研究团队介绍了一种基于吗啉结构的探针C(P244) ,该探针在酸性pH环境下展现出独特的荧光响应特性。具体而言,在pH值较低时,P244的荧光发射较为微弱,但随着pH值的升高(范围从3.02至9.49),其荧光显著增强,并在665nm处达到峰值。理论计算深入揭示了这一现象背后的机制:在中性和碱性条件下,由于吗啉基团的HOMO(最高占据分子轨道)与LUMO(最低未占据分子轨道)能级与荧光团的不匹配,导致吗啉无法作为PET的有效给体或受体。然而,当吗啉基团在酸性环境中质子化后,发生了从荧光团向质子化吗啉基团的PET过程,进而引发荧光的淬灭。这一特性使得P244能够成功应用于监测HUVEC-C细胞内pH值的变化,覆盖从5.5到8.5的广泛范围。
此外,Wu及其同事也采用类似策略,开发了一种基于哌嗪基团的近红外探针6(P245) ,该探针以哌嗪作为PET给体。P245的pKa值被精确测定为5.08,在酸性条件下,氮原子的质子化促使其在786nm处发出荧光。为了进一步验证其细胞器靶向能力,研究人员进行了共定位实验,结果显示P245能够选择性地染色溶酶体及晚期内质体,证明了其在细胞器成像中的潜在应用价值。
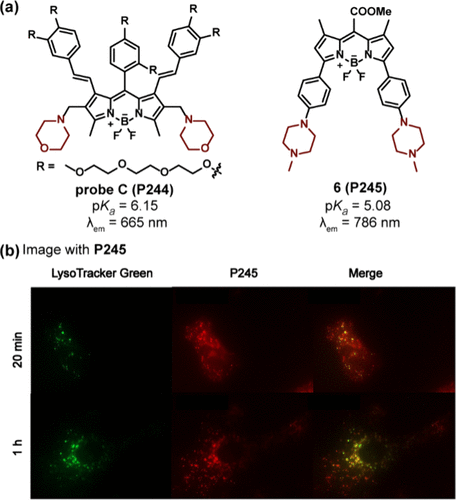
图 70. (a) 含有吗啉和哌嗪基团作为 PET 给体的 pH 探针的结构;(b) 6(P245) 和 Lysotracker Green DND-26 的染色实验。
4.2.2. 1,8-萘酰亚胺衍生物
Kim及其研究团队成功设计了一种集成哌嗪基团的pH敏感探针P246(),该探针创新性地结合了萘酰亚胺作为荧光团,哌啶基团作为pH响应位点和PET给体,以及三苯基膦基团作为线粒体靶向基团。P246通过氮原子的质子化过程对酸性pH环境产生响应,其pKa值为6.18,在最大发射波长525 nm处展现出增强的荧光强度。此增强归因于氮原子质子化后PET和TICT过程的抑制。为了优化标记效率,团队通过氯化苄取代苯基的策略合成了探针P247,该探针随后被应用于线粒体内部pH值的精确测量。如所示,随着pH值从5升至8,P247的荧光强度逐渐减弱,而MitoTracker Red的荧光则保持稳定,从而提供了以强度比作为pH检测依据的可靠比率信号。通过选取四个感兴趣区域(ROI)进行定量分析(),结果显示ROI 1和ROI 3因P247而呈现增强的绿色荧光,对应平均pH值约为4.63,而ROI 2和ROI 4则显示微弱的绿色荧光,对应平均pH值约为8.05。 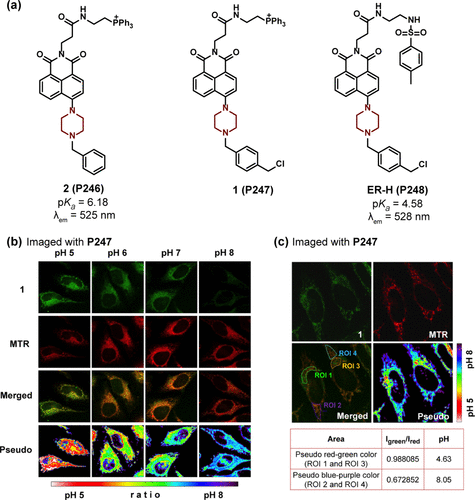
图 71. (a) 含有哌嗪基团作为 PET 给体的 1,8-萘酰亚胺基 pH 探针的结构;(b) P247和MTR分别在 pH 值为 5、6、7 和 8 时在固定细胞中的共聚焦显微镜图像;(c) P247和 MTR 在完整细胞中的图像。
沿着这一研究方向,Tang及其合作者将类似荧光团与内质网(ER)靶向基团相结合,开发出探针ER-H(P248) 。P248拥有4.58的pKa值,展现出对ER的高度选择性,共定位系数高达0.90,成功应用于监测斑马鱼体内从pH 7.0至3.0的酸化过程。
Lin及其研究团队则报告了另一种创新探针BN-lys(P249 ),该探针融合了生物素分子与吗啉基团,后者既作为PET给体又承担溶酶体靶向功能(图72a)。P249 在pH 9.0至3.0范围内,于531 nm波长处呈现显著的“关闭-开启”荧光变化,被有效用于监测氯喹刺激下溶酶体pH值的上升。
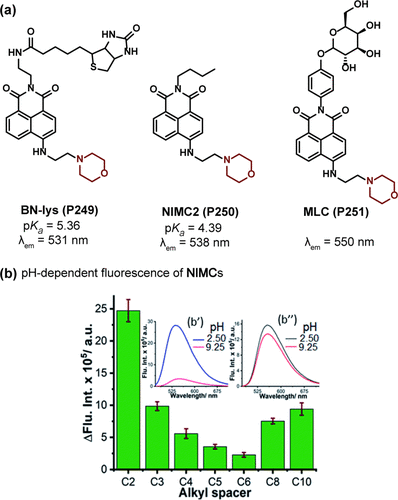
图 72. (a) 含有吗啉基团作为 PET 给体的 1,8-萘酰亚胺基 pH 探针的结构;(b) NIMCs的发射曲线与 pH 值的关系。
此外,Koner及其合作者通过调控烷基间隔物的长度,将吗啉分子与萘酰亚胺连接,合成了一系列pH敏感的探针。研究发现,烷基链的长度直接影响探针的pH敏感性。特别地,具有两碳烷基间隔的NIMC2(P250) 在pH 9.25至2.50范围内表现出显著的荧光响应,pKa值为6.6,并通过与LysoTracker Deep Red的共定位实验(PCC=0.88 ± 0.02)验证了其高效的溶酶体定位能力。然而,当烷基间隔增加至六碳时,探针的荧光强度几乎不受pH变化影响(),这是由于长链构象在给体与受体之间创造了显著的空间隔离,有效抑制了PET过程,导致荧光强度对pH变化的敏感度降低。
最后,Hou及其合作者报道了一种针对pH敏感的β-gal可激活探针MLC(P251),该探针能够特异性地与β-gal在活体内反应,并在pH 6至4.5范围内,于550 nm处展现出显著的荧光增强。这一特性使得MLC成为观察不同pH条件下(5至8)卵巢癌细胞中β-gal活性的有力工具。
4.2.3. 花菁衍生物
花菁衍生物在光致电子转移(PET)探针设计中也占据了重要地位()。Wang及其研究团队创新性地推出了一种适用于近中性pH环境的近红外荧光探针Tpy-Cy(P252) ,该探针巧妙融合了Cy3与吡啶衍生物的结构特性。其中,吡啶母核作为PET受体,在碱性条件下能够有效淬灭荧光。尤为显著的是,通过吡啶的质子化作用,P252在pH值从10.0逐渐降至6.0的过程中,于750nm波长处展现出了增强的荧光强度,这一特性使其能够在较低背景信号干扰下,精准监测HepG2细胞与HL-7702细胞内的pH值动态变化。
另一方面,Nagano及其研究伙伴则聚焦于基于花菁衍生物的近红外探针系列开发,这些探针具备对不同pKa值(范围在5.5至8.7之间)进行比率检测的能力。该系列探针的创新之处在于引入了多样化的二胺基团作为pH响应位点,通过理论计算预测二胺母核的pKa值,进而实现了pKa值的精准调控。这种方法为设计高效、精准的近红外pH探针提供了一条便捷而有效的途径。 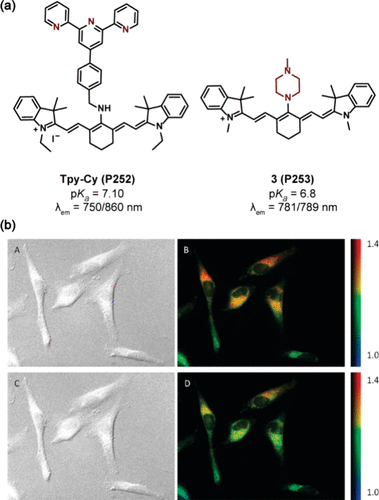
图 73. (a) 基于花菁衍生物的 PET 探针;(b)3(P253) 的HeLa 细胞 pH比率图像。
特别地,该系列中带有哌嗪基团的探针3(P253) 被成功应用于监测HeLa细胞在NH4Cl处理下溶酶体pH值的变化()。实验结果显示,加入NH4Cl后,仅在短短1分钟内,溶酶体的荧光比值即发生显著变化,而线粒体的荧光比值则保持相对稳定,这一发现为细胞器pH值的实时监测提供了有力工具。
4.2.4. 罗丹明衍生物
罗丹明荧光团因其卓越的亮度与光稳定性,在生物荧光探针领域占据重要地位。Hirose研究团队及其合作者成功设计出一系列基于罗丹明且以哌嗪作为pH敏感开关的探针。在酸性环境下,氮原子的质子化有效抑制了光致电子转移(PET)过程,从而触发了显著的“关闭-开启”荧光信号转变。具体而言,RhP-EF(P254) 探针在560nm波长附近的荧光强度增强了58倍。进一步地,通过引入N,N-二甲基氨基,研究团队开发了aRhP-EF(P255) 探针,该探针能够特异性地靶向RBL-2H3细胞的颗粒,并实现了对这些颗粒的动态连续观察()。延时共聚焦成像技术结合P255与液相标记物Alexa647的应用,清晰地揭示了某些颗粒荧光随时间消失的现象,这直接对应于细胞的外吞过程。
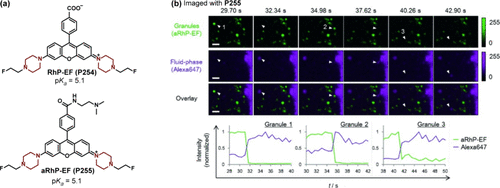
图 74. (a) 基于罗丹明衍生物的 PET 探针;(b) 用 aRhP-EF (P255) 观察 RBL-2H3 细胞的外吞动态。
在探索更先进荧光探针材料的道路上,硅基罗丹明因其较长的发射时间成为研究热点。Urano研究团队报道了一组基于不对称罗丹明的比率测定探针,通过调节哌嗪上的取代基,实现了探针pKa值(5.5-6.7)的精准调控。其中,SiRpH5(P256) 探针采用2,4-二磺苄基取代,pKa值为6.1,最大发射波长位于690nm(),与全Tfn共轭后,成功应用于蛋白质转运过程中细胞内区域pH值的延时成像()。此外,磷取代的氧杂蒽探针NEt2POF(P258) 展现出优异的近红外特性(λem = 730 nm),pKa值为6.8,与葡聚糖结合后,能够在小鼠静脉注射后1小时内对皮下肿瘤进行比率成像(),结果显示肿瘤区域pH值为6.8,而正常组织则为7.4(),验证了其在体内pH值监测中的潜力。 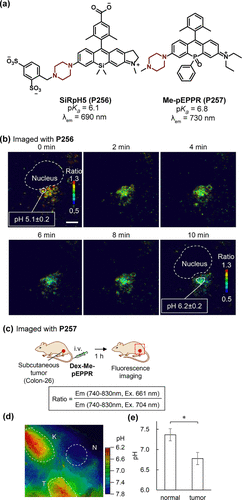
图 75. (a) 硅烷基和膦酰基罗丹明衍生物的结构;(b) 用P256-Tfn 培养 COS-1 细胞的延时荧光比率图像;(c-e)使用Dex-P257对肿瘤pH值的体内荧光成像;(c) 肿瘤 pH 值成像;(d) 患有皮下肿瘤的小鼠的荧光比率图像;(e)通过荧光成像测量正常组织和肿瘤的 pH 值。
Yamaguchi研究团队则另辟蹊径,利用炔基修饰的磷杂蒽染料开发了一类新型pH探针。这些荧光团在特定pH范围内展现出独特的“关-开-关”响应模式,归因于其质子化与去质子化平衡的可逆转变。以NEt2POF(P258) 为例(),在pH 3.7和7.4时荧光微弱,而在pH 5.5时发射强度激增14倍。这一变化机制涉及二乙氨基的质子化对PET过程的阻断,以及羟基去质子化对荧光团内电荷转移(ICT)过程的增强,共同定义了约3至8的活性pH范围。随后,P258与葡聚糖共轭,用于监测内吞作用形成的细胞酸性区pH变化。通过分别在640nm()和488nm()激发下对P258-dex染色的HeLa细胞进行成像,合并图像清晰揭示了溶酶体和内体等酸性细胞器的pH值范围在4到7之间()。 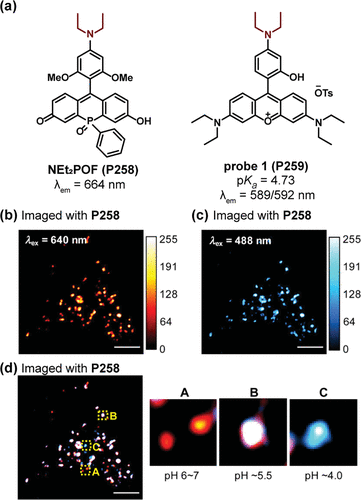
图 76. (a) NEt2POF(P258) 和探针 1(P259) 的结构; (b-d) HeLa 细胞与P259葡聚糖衍生物培养后的荧光图像。
最后,Ge及其同事报告了一种基于罗丹明的探针1(P259),该探针巧妙地利用二乙氨基作为PET给体,在酸性条件下于592nm处的荧光强度激增400倍。P259不仅成功应用于HeLa细胞内pH值的观测,还展现出对溶酶体的特异性定位能力。
4.2.5. 其他母核
4-硝基-2,1,3-苯并噁二唑(NBD)衍生物,凭借其低分子量、高强度荧光发射以及在多变环境下展现出的寿命特性,已成为荧光探针领域中的佼佼者。Zhao及其研究团队报道了一种创新的NBD基溶酶体靶向探针NBDLyso(P260) (如所示),该探针巧妙利用吗啉基团作为光致电子转移(PET)给体,在酸性环境中激活,导致530nm波长处荧光强度激增100倍。P260展现出了对溶酶体的高度选择性染色能力(PCC = 0.92),并成功应用于监测氯喹与巴佛洛霉素刺激下HeLa细胞溶酶体pH值的上升过程。 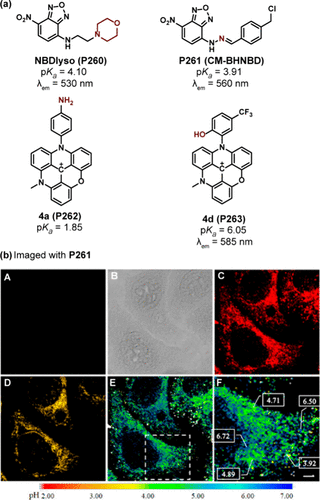
图 77. (a) 基于其他荧光团的 PET 探针;(b) 使用探针CM-BHNBD(P261) 和 MitoTracker Red 测定 HeLa 细胞 OSS 模型的线粒体 pH 值。
进一步地,You及其同事开发了另一种基于NBD的探针CM-BHNBD(P261) ,旨在精确测量粘膜内部及线粒体环境的pH值。在此探针设计中,亚胺氮原子的质子化过程有效阻断了从亚胺到NBD的PET过程,使得560nm波长处的荧光强度显著增强,增幅高达148倍。P261与MitoTracker Red(PCC = 0.92)展现出良好的共定位效果,使其成为监测氧化应激条件下线粒体pH值变化的有力工具()。通过构建营养缺乏的HeLa细胞与肉豆蔻酸乙酸薄荷酯共培养模型,以模拟氧化应激饥饿(OSS)状态,并结合P261与线粒体追踪红作为内参,研究揭示了线粒体在氧化应激下的异质性酸化现象。
此外,So̷rensen及其研究团队在探索pH敏感探针方面亦取得了重要进展,他们开发了一系列基于DAOTA并融合了不同受体的探针。这些探针的pKa值(从1.85到9.14)受到受体电负性的显著影响,展示了广泛的pH响应范围。具体而言,带有氨基的4a(P262) 探针具有极低的pKa值(1.85),而引入三氟甲基的4d(P263) 探针则展现出较高的pKa值(6.05)。通过合理调配这些探针的混合比例,可以构建出能够覆盖广泛pH值范围的pH传感器,为生物化学及生物医学研究提供更为精细的pH监测手段。
4.3 基于荧光团异构化的 pH 敏感探针
前文所述的pH探针,其核心设计原理聚焦于特定反应位点的可逆质子化与去质子化过程,此机制不依赖于荧光团化学结构的直接转变。除了这一策略外,有机化合物在酸碱环境中发生的异构化现象,同样构成了检测pH值变动的高效工具。这类pH探针的独特之处在于其结构设计,它们能够在不同pH条件下实现从非共轭、非荧光状态向共轭、荧光状态的转变,进而在特定pH范围内展现出“关闭-开启”的荧光信号变化。本章节将依据这些探针所依托的母核类型,逐一介绍几种代表性的探针。
首先,作者聚焦于基于特定母核结构的pH探针。这些探针通过巧妙的结构设计,使得在酸性或碱性环境中,其分子内部的电子排布和共轭体系发生显著变化。如所示,随着pH值的变化,探针分子从原本的非共轭、荧光淬灭状态转变为高度共轭、荧光增强的状态,这一转变过程直接反映在荧光信号的“关闭-开启”上,为精准监测pH变化提供了直观依据。
接下来,作者将按照探针母核的不同,分别阐述其工作原理及应用特点。每种母核都有其独特的化学性质和反应活性,使得基于这些母核设计的pH探针在灵敏度、响应速度、稳定性等方面展现出各异的性能优势。通过深入分析这些探针的分子结构与性能表现之间的内在联系,作者可以更好地理解并优化pH探针的设计策略,推动其在生物化学、材料科学及环境监测等领域的广泛应用。 
图 78. 通过异构化设计的 pH 探针。
4.3.1. 荧光素衍生物
荧光素衍生物在生物学领域中被公认为追踪生物系统pH值变化的高度可靠探针,如所示。荧光素(P264) ,最初由Baeyer在1871年通过间苯二酚与邻苯二甲酸酐的Friedel-Crafts反应合成,其分子结构中包含一个羧基和一个羟基,这两个官能团作为pH敏感的反应位点。在不同pH条件下,P264 经历复杂的开环与闭环平衡过程,伴随多步骤质子化与去质子化反应()。完全去质子化状态的荧光素展现出高荧光强度,而闭环螺内酯形式则几乎无荧光,此过程受三个特征pKa值(2.08、4.31、6.43)的精细调控。在低pH值(<2.0)时,荧光素几乎不发光;随着pH值上升,其荧光强度逐步增强,达到中等荧光水平(4.31-6.43,Φf = 0.37)及至高荧光状态(>6.43,Φf = 0.93)。

图 79:基于荧光素衍生物的 pH 探针;(a) 不同 pH 条件下荧光素的质子化和去质子化平衡;(b) 从荧光素衍生的部分 pH 探针。
基于荧光素的异构化机制,科学家们开发了系列pH响应探针。Poole及其团队报告了一种利用异硫氰酸荧光素(FITC,P265) ()标记的葡聚糖技术,实现了细胞内pH值在4.0-7.0范围内的精确测量。此研究揭示了溶酶体内活跃的质子积累机制,进一步支持了溶酶体通过质子捕获累积弱碱的理论模型。随后,荧光素的其他衍生物如羧基荧光素(CF,P266) 和二醋酸荧光素(CFA)2(P267)被合成用于细胞内pH监测。Racker等人利用P267成功测定了艾氏腹水肿瘤细胞的胞内pH,其中乙酰基在体外稳定了荧光素的闭环无荧光形态,而在活细胞中经酯酶水解后,P267恢复其pH依赖的荧光特性。然而,P267在淋巴细胞中的pKa值偏低(6.3),限制了其在生理pH监测中的应用。
为克服这一局限,Pozzan团队合成了新型荧光素衍生物BCECF(P268),其引入的烷基羧酸链使pKa值提升至6.97,与生理pH值更为匹配,从而有效指示淋巴细胞内pH变化。
此外,荧光素的光物理性质也经过优化,包括提升光稳定性和调整发射波长。豪格兰等研究者开发了含氟荧光素衍生物系列,显著增强了光稳定性并降低了pKa值。例如,P269 (OG)含有两个氟取代基,在pH 9.0时pKa值为4.8,量子产率高达0.97。对于生物成像应用,长波长发射荧光团尤为重要。Prendergast团队报道了一系列改性荧光素衍生物,具备长波长发射特性,支持通过激发与发射光谱比值分析进行pH检测。多数探针的pKa值落在7.6至7.9范围内,如SNAFL-1(P270) 在质子化与去质子化状态下分别展现539 nm和624 nm的最大发射波长,而二甲基氨基取代的SNARF-1(P271 ) 则表现出类似光谱特性但伴有红移(583 nm和631 nm)。
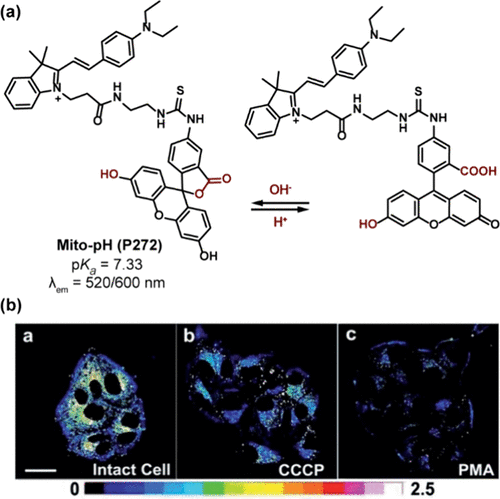 图 80. (a) Mito-pH(P272 ) 的 pH 值依赖性异构化;(b) MCF-7 细胞在不同刺激剂存在下负载 P272 的比率图。
图 80. (a) Mito-pH(P272 ) 的 pH 值依赖性异构化;(b) MCF-7 细胞在不同刺激剂存在下负载 P272 的比率图。
在进一步优化与拓展pH响应探针性能的过程中,核心关注点聚焦于调整pH响应位点的pKa值。Guo及其研究团队成功设计出一种名为Mito-pH(P272) 的荧光素基比率测定探针,专门用于监测线粒体内pH值的动态变化。该探针巧妙融合了可响应pH变化的荧光素单元与对pH不敏感的半花菁母核,后者同时作为线粒体靶向基团,确保了探针的精准定位。Mito-pH(P272) 的pKa值为7.33,通过双发射波长(520nm与600nm)机制工作(如所示)。在特定激发波长(490nm与560nm)下,该探针在600nm波长下的荧光强度比值(I490/I560)与pH值(5.02至9.65范围内)展现出优异的线性相关性。如图80b所示,Mito-pH(P272 ) 被应用于检测MCF-7细胞在羰基氰m-氯苯腙(CCCP)和乙酸磷脂酰肉豆蔻酸酯(PMA)刺激下线粒体pH值的下降。CCCP通过破坏氧化磷酸化并诱导线粒体氧化应激,导致pHmito在13分钟内从7.9 ± 0.1显著下降至7.1 ± 0.1。类似地,PMA通过促进活性氧(ROS)生成,也触发了pHmito的降低(从7.9 ± 0.1降至6.8 ± 0.1)。
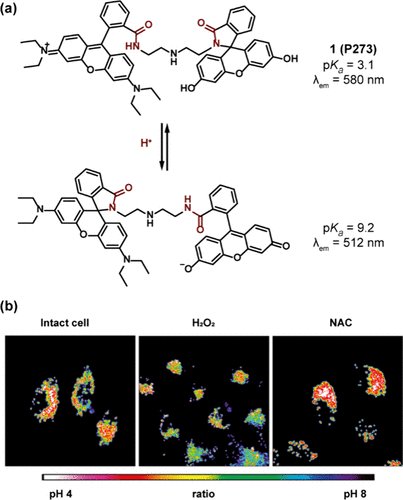
图 81. (a) 1(P273 ) 的 pH 依赖性异构化;(b) P273 染色 HeLa 细胞的共聚焦显微镜图像。
此外,荧光素母核与其他荧光团的结合策略进一步推动了比率测量成像技术的发展。Kim及其同事创新性地利用二乙烯三胺间隔物将荧光素与罗丹明连接起来,成功合成了比率测量探针1(P273)。在这一设计中,荧光素结构在碱性环境中被激活,其pKa值为9.2,最大发射波长位于512nm;而罗丹明结构则在酸性条件下发挥作用,pKa值为3.1,最大发射波长为580nm(如所示)。通过共定位实验,P273 的红色荧光信号主要定位于溶酶体,而绿色荧光则与细胞质中的碱性区域相关联。在HeLa细胞的不同刺激条件下,P273 被用于进行胞内pH变化的比率测量()。实验结果显示,H2O2处理导致溶酶体等细胞器的pH值显著上升,从5.7 ± 0.2增加至6.6 ± 0.4;相反,NAC处理的细胞则表现出pH值的明显下降,降至4.9 ± 0.1。这些发现不仅深化了对细胞内pH动态变化机制的理解,也为相关疾病的诊断与治疗提供了新的工具与视角。
4.3.2. 罗丹明衍生物
罗丹明衍生物作为pH探针的显著特点在于它们通常在酸性环境中被激活,并展现出长波长发射和高光稳定性,这些优势极大地推动了其在生物传感领域的发展。Peng团队开创性地设计了Rlyso(P274) 探针,该探针融合了罗丹明荧光团与甲基卡必醇这一新颖的溶酶体靶向基团。在酸性pH条件下,P274 发生开环转变,其pKa值为5.47,最大发射波长位于578nm(),成功应用于定量监测氯喹处理引起的溶酶体pH值上升(),结果显示溶酶体pH显著提升至1.20 ± 0.04。
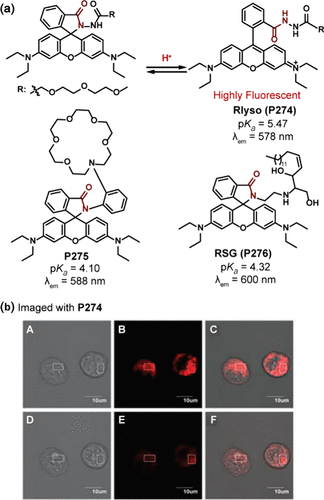
图 82. (a) 基于罗丹明衍生物的 pH 探针的结构;(b) Rlyso(P274) 在氯喹刺激下的小鼠巨噬细胞中的荧光图像;(A-C)氯喹刺激前染色细胞的图像;(D-F)(A-C)中暴露于 100 μM 氯喹 2 分钟的细胞图像。
Yoon团队则开发了P275 探针,该探针巧妙结合了罗丹明与氮杂-18-冠醚-6母核,当pH从7.0降至4.0时,其在588nm处的荧光强度显著增强。在HeLa细胞中,P275 与LysoTracker Deep Red展现出高度的共定位性,皮尔逊相关系数(PCC)高达0.90。此外,通过引入鞘氨醇作为高尔基体靶向基团,研究还制备了高尔基体特异性探针RSG(P276 )。
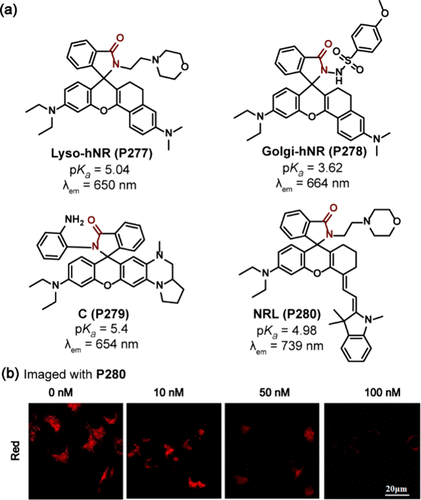
图 83. (a) 基于罗丹明衍生物的 pH 值依赖性探针的结构;(b) 活体 HeLa 细胞先用 0、10、50 和 100 nM 的巴佛洛霉素 A1 培养 6 小时,再用 1 μM NRL (P280) 培养 1 小时后的荧光显微镜图像。
为了进一步拓宽罗丹明衍生物的应用范围,研究者们通过扩展π-共轭体系,开发了长波长发射的Lyso-hNR(P277) 和Golgi-hNR(P278) 探针。P277 在650nm处表现出强烈的荧光发射,且其荧光强度在pH 7.0至4.0范围内增强了280倍以上,成为溶酶体pH变化的灵敏指示器。而P278 则以其664nm的最大发射波长,实现了对高尔基体内pH值(3.0至7.4)的精确监测,其pKa值为3.62,确保了在不同刺激条件下的实时跟踪能力。
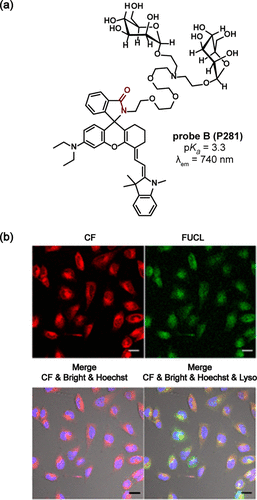
图 84. (a) 探针 B(P281) 的结构; (b) 用P281 在缓冲液中培养 HeLa 细胞的 CF 和 FUCL 图像。
在罗丹明母核上引入额外胺基团或融合环的策略,同样促进了发射波长的红移。Liu团队开发的C(P279) 探针,在654nm处展现长波长发射,pKa值为5.4,有效监测了氧化应激下溶酶体pH的动态变化。Cao团队则进一步推出了近红外探针NRL(P280) ,其最大发射波长达到739nm,pKa值为4.98,能够灵敏响应巴佛洛霉素A1处理引起的溶酶体pH升高()。特别地,Liu团队还报道了探针B(P281) ,该探针集荧光与单光子频率上转换发光(FUCL)于一体,通过甘露糖残基的引入,实现了在酸性条件下荧光与FUCL强度的双重增强,为近红外荧光与FUCL双模态检测溶酶体pH提供了新方法()。
此外,通过引入苯酚或苄醇分子,罗丹明衍生物的酸碱转换特性得到了进一步优化。Yang团队开发了一系列具有高希尔系数(>4)的罗丹明基探针,如PHX2(P282) ,其狭窄的酸碱转换宽度(约0.9个pH单位)和独特的pKa值(6.83),使其能够精确区分微小的pH变化。这一过程涉及二乙氨基的质子化及氧阴离子基团的进一步稳定,形成了正协同作用的pH响应机制。P282 在575nm处的强发射,使其在区分新鲜活检癌细胞与正常细胞方面展现出快速、高对比度的优势。
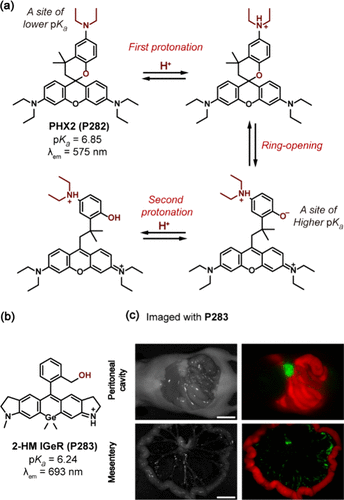
图 85. (a) P282 的结构和拟议的 pH 响应机制,在质子化过程中表现出正合作性; (b) P283 的结构;(c) 用P283 标记的小鼠模型中 SHIN3 细胞腹膜转移的荧光成像。
Urano及其同事则探索了基于羟甲基锗-罗丹明(HMGeR)的近红外探针在生物医学成像中的应用,特别是探针2-HM IGeR(P283) 的阿维丁衍生物,成功用于小鼠腹膜扩散模型中肿瘤的观察(),进一步拓宽了罗丹明衍生物在癌症诊断与治疗监测中的潜力。
4.3.3. 恶唑烷和螺螺烷衍生物
恶唑烷及其螺环衍生物作为一类重要的化合物,其独特的闭环与开环平衡机制受pH条件深刻影响,使之成为设计pH响应性探针的理想母核结构。Wong团队的研究贡献了一种基于恶唑烷-咔唑共轭结构的探针PSIOH(P284) ,该探针的pKa值为6.6,能够在pH 9.18至4.49的宽范围内展现出从435nm至604nm的显著红移发射光谱。在酸性环境中,P284 的螺环结构通过氧原子的质子化作用转变为开环形态,这一过程伴随着π共轭体系的扩展(如所示),从而引发荧光光谱的显著红移。P284 不仅被应用于监测HeLa细胞在不同刺激下的pH动态变化,还展现出在区分肝组织及小鼠模型中癌细胞与肿瘤组织的潜力()。
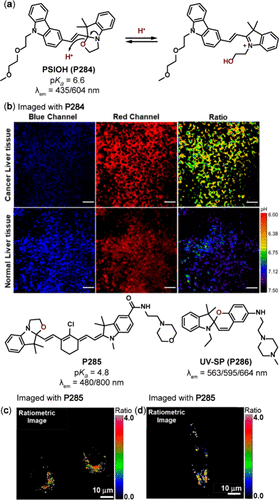
图 86. 基于螺线管的 pH 依赖性探针;(a) PSIOH(P284) 在酸性条件下的异构化;(b) 加载P284 后,癌症和正常小鼠肝脏切片中 pH 值的 TP 比率荧光图像。在探针 P285 的双重激发下,活体(c)HeLa 和(d)A549 癌细胞的伪彩色比率测量 CLSM 图像。
Guha及其合作者则通过将花菁衍生物与恶唑烷母核创新性地融合,开发出了一种近红外比率测定探针P285 。该探针在酸性条件下被激活,其最大发射波长位于800nm,且在pH 10.4至1.65的范围内实现了高达320nm的红移,展现出优异的酸度敏感性。P285 能够特异性地靶向酸性溶酶体,并成功应用于活细胞中溶酶体的可视化与追踪(),为细胞生物学研究提供了有力工具。
此外,Zhang团队设计了一种光活化荧光探针UV-SP(P286) ,该探针通过光激活后,能在不同pH条件下展现出循环可逆的分子内电荷转移(ICT)特性,生成多种比率的荧光发射信号(如I563/I595和I664/I595)。在紫外线照射下,P286 由螺环形式转变为半花菁形式,在595nm处达到最大发射。随着pH条件的变化,氨基的质子化或羟基的去质子化会分别影响ICT过程,导致发射波长在酸性条件下蓝移至563nm,而在碱性条件下则红移至664nm。基于这些独特的性质,P286 被成功应用于检测程序性细胞死亡过程中紫外线照射诱导的细胞内pH变化,为细胞凋亡机制的研究提供了新的视角。
4.3.4. 其他母核
Tang及其研究团队在荧光探针的设计领域取得了新进展,他们创新性地引入了四苯基乙烯(TPE)与花菁的加合物——TPE-Cy(P287) 。这一设计巧妙地利用了TPE的优异荧光性质与花菁的化学反应活性,构建了一个能够在不同pH条件下展现出独特光谱特性的荧光母核。
具体而言,P287 在酸性和中性环境(pH≤10)中均能稳定发出红色荧光,其最大发射波长精准地位于615nm,这一特性使得该探针在生物成像及化学传感领域具有广泛的应用潜力。然而,当环境转变为强碱性条件(pH > 10)时,氢氧根离子(OH⁻)作为强亲核试剂,对P287 中的 半花菁部分发起攻击,发生亲核加成反应。这一化学反应的发生导致了探针分子结构的显著变化,进而引发荧光光谱的蓝移现象,最大发射波长移动至489nm(如图87所示)。
此蓝移现象不仅揭示了P287 在pH变化下的高灵敏度响应能力,还展示了其作为pH传感器的巨大潜力。通过监测P287 在不同pH条件下的荧光发射波长变化,研究人员可以实现对溶液酸碱度的精确测量,为生物化学、环境科学及材料科学等领域的研究提供有力的技术支持。同时,TPE-Cy(P287) 的设计思路也为未来荧光探针的开发提供了新的灵感和方向。
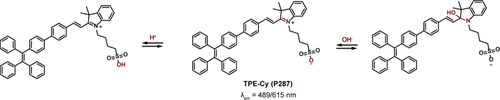
图 87:TPE-Cy(P287) 的 pH 依赖性异构化。pH 响应点用红色表示。
4.4 基于 FRET 机制的 pH 敏感探针
在生物化学领域,福斯特共振能量转移(FRET)作为一种高效且精准的分析技术,其核心在于实现给体分子的发射光谱与受体分子的吸收光谱之间的有效重叠。利用这一特性,FRET过程中的pH敏感性开关机制被巧妙地设计并应用于FRET探针的构建中。
一种创新的策略是将pH响应位点巧妙地整合到受体母核结构中,这里的受体母核通常选用的是原本不具备FRET信号产生能力的醌类受体。这一设计使得探针能够在特定pH条件下,通过调控受体的荧光恢复,进而触发FRET信号的再现。具体而言,当环境pH值达到预设阈值时,受体的荧光性质发生转变,由非荧光或弱荧光状态转变为可发射荧光的状态,此时给体与受体之间的能量转移得以恢复,产生可检测的FRET信号。
此策略不仅提高了FRET探针的灵敏度和特异性,还通过比率荧光信号的形式,即同时监测给体与受体的荧光强度变化,有效降低了背景干扰,提升了检测的准确性和可靠性(如所示)。因此,基于pH开关机制的FRET探针在生物传感、细胞成像以及药物筛选等领域展现出了广阔的应用前景。
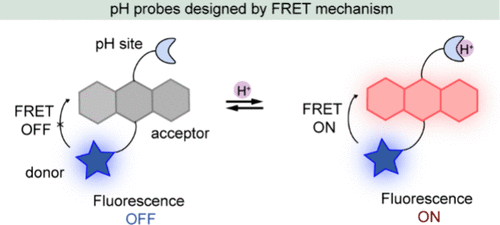
图 88. 利用 FRET 机制设计的 pH 探针。
4.4.1. 作为 FRET 受体的罗丹明衍生物
罗丹明衍生物因其独特的绿色荧光发射特性,成为构建FRET系统时理想的受体分子(如所示)。在化学环境中,罗丹明展现出依赖于pH值的“闭环”与“开环”构象平衡,这一性质为设计pH敏感的FRET探针提供了基础。当给体分子连接至非荧光的罗丹明闭环形态时,由于能量转移受阻,FRET信号被有效抑制。然而,在酸性条件下,罗丹明转变为开环状态并恢复荧光,此时能够作为有效的FRET受体,使信号重新显现。
基于上述机制,Peng团队成功开发了以萘酰亚胺为给体、罗丹明为受体的FRET探针NR1(P288) 。在pH 6.20至2.00的范围内,P288 在580nm处的荧光强度显著增强,同时I580/I538nm的比值增加,实现了对pH值的比率检测。
Zhao及其团队则提出了另一种类似的探针RNL(P289) ,该探针巧妙地将吗啉基团引入荧光团,既作为溶酶体靶向基团,又充当PET过程的给体。在酸性环境下,PET过程受到抑制,从而激活罗丹明荧光并恢复FRET信号,导致529nm和580nm波长处的荧光强度增加。P289 被成功应用于监测HeLa细胞在磷酸盐缓冲盐水(PBS)中pH值从4.0到7.0的变化。
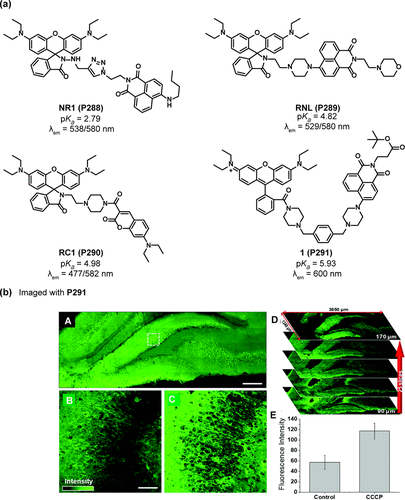
图 89. (a) 用罗丹明衍生物作为受体的 FRET pH 探针;(b) 用探针1(P291) 染色的大鼠海马切片的 TPM 图像; (A) 沿 z 方向在 90-170 μm 深度的成像;(B 和 C)CCCP 处理前和处理后(B)中白色方框的放大图像。(D) 在深度为 90-170 μm 处获得的面板(A)的代表性 TPM 截面图像;(E) 图表(B)和(C)的荧光强度柱状图。
此外,Zhao团队还开发了FRET探针RC1(P290) ,采用香豆素作为给体、罗丹明作为受体()。P290 具有pKa值为4.98的酸敏感性,能在酸性条件下被激活,于477nm和582nm处提供比率信号,适用于监测如地塞米松等诱导细胞凋亡过程中细胞内pH值的变化。
Lee及其合作者则创新性地结合了萘酰亚胺、罗丹明与哌嗪母核,设计出比率测定探针1(P291) 。P291 在pH 9至3的宽范围内表现出pH依赖的荧光特性,支持在410nm和560nm的激发波长下进行比率成像。该探针主要定位于线粒体,能够灵敏地检测到CCCP(羰基氰化物间氯苯腙)和营养饥饿诱导下HeLa细胞中线粒体pH值的变化,并具备穿透组织深层观察CCCP处理引起pH波动的能力()。
4.4.2. 作为受体的其他荧光团
在FRET pH探针的设计中,1,8-萘酰亚胺衍生物展现出作为高效受体的潜力。Lin及其研究团队成功构建了一种比率型探针CN-pH(P292) ,该探针融合了香豆素作为给体与萘酰亚胺母核作为受体的创新组合()。P292 独特地集成了两个pH响应位点,通过ICT-PET-FRET三重机制,在不同pH环境下展现出复杂的荧光行为()。具体而言,在酸性条件下,吗啉基团的质子化阻断了PET过程,进而恢复了FRET信号,伴随530nm处荧光发射的显著增强()。相反,在中性pH下,吗啉作为PET给体,有效淬灭了受体荧光,导致香豆素荧光占据主导。而在碱性环境中,香豆素羟基的去质子化促进了ICT过程,使得香豆素在454nm处的荧光显著增强,同时萘酰亚胺的荧光被去质子化的吗啉通过PET机制抑制,最终呈现出以香豆素为主的荧光发射,且亮度远超中性条件。P292 通过酸性条件下的I530/I454发射比率与碱性条件下的反向比率(I454/I530),实现了与pH值的广泛线性响应,并成功应用于监测氯喹处理下溶酶体pH值的变化()。
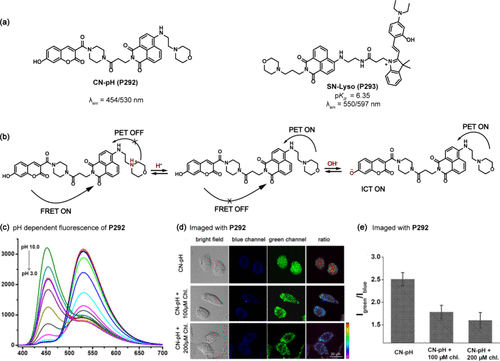
图 90. (a) 不同种类 FRET 探针的结构;(b) 探针CN-pH(P292) 的 pH 响应机制;(c) P292 在不同 pH 值下的吸收光谱。(d) 在氯喹刺激下 HeLa 细胞溶酶体 pH 变化的荧光成像;(e)(d)组图像中Igreen/Iblue的量化相对荧光比。
此外,Yin及其合作者提出了一种新颖的FRET探针SN-Lyso(P293) ,该探针利用萘酰亚胺作为给体与半花菁衍生物作为受体。在碱性pH条件下, 半花菁转化为非荧光性的螺丙烷结构,有效阻断了FRET过程。而当环境转为酸性时,半花菁的共轭效应被激活,恢复了FRET信号,这一特性为pH敏感的检测提供了有力工具。
图 91. 基于 FRET 过程的PF(P294) 的结构和对 pH 值的响应机制。
另一方面,荧光素衍生物同样在FRET探针领域展现出重要价值。Yu及其团队开发的FRET系统PF(P294) 创新性地以芘为给体,荧光素为受体()。该系统在pH 3.0至10.0的宽范围内,通过荧光素从闭环非荧光态向荧光态的转变,实现了从芘激基缔合物到荧光素的能量转移,并在459nm和526nm处生成了可用于比率测量的荧光信号。
4.5 通过其他机制设计的 pH 敏感探针
4.5.1. 基于 ESIPT 机制的 pH 敏感探针
激发态分子内质子转移(ESIPT)是一种化学现象,其中质子在分子被激发至高能态时,从一个特定的化学位点迁移到另一个位点。这一过程往往伴随着光谱特征的显著红移,成为设计具有独特荧光特性的探针时常用的策略之一。Liu及其研究团队报道了一种创新的比率型荧光探针BNO(P295) ,该探针巧妙地结合了分子内电荷转移(ICT)与ESIPT机制()。在中性或弱碱性环境下,质子从羟基基团转移至苯并咪唑部分,导致荧光发生淬灭。然而,在酸性或强碱性条件下(后者增强了ICT效应),当质子位于羟基位置时,P295 的荧光强度显著增强,其最大发射波长分别在520nm和495nm处呈现(),这一特性为pH依赖的荧光检测提供了基础。
Tang及其合作者则开发了一种具有聚集诱导发光(AIE)特性的荧光剂3(P296) ,该AIEgen在不同pH值下展现出484nm或551nm的特征发射波长。值得注意的是,P296 具有两个明确的pKa值,分别为7.3和8.6,这一特性使得它能够直接应用于HeLa细胞内pH值变化的成像研究(),为细胞生物学研究提供了有力的工具。
此外,基于ESIPT机制的进一步探索,Jang及其研究团队报道了基于羟基噻吩的探针T2(OH)B(P297)。在中性条件下,由于质子从苯并噻唑向羟基的转移,P297展现出微弱的荧光,并表现出溶剂依赖性的发射特性。相比之下,甲氧基取代的类似物T2(OMe)B(P298) 在不同溶剂中保持一致的发射光谱,这一对比实验有力地证实了P297中ESIPT过程的存在。尤为重要的是,在碱性条件下,由于羟基的质子转移,P297的荧光强度显著增强,表明氢氧根离子在此过程中充当了强电子给体的角色,进一步丰富了作者对ESIPT机制的理解及其在荧光探针设计中的应用潜力。
图 92. 基于 ESIPT 机制的 pH 探针。(a) 基于 ESIPT 机制的BNO(P295) 随 pH 值变化的发射;(b) 用 P296 和不同 pH 缓冲液培养 HeLa 细胞的共聚焦荧光图像。
4.5.2. 基于 TBET 机制的 pH 敏感探针
TBET机制特指在共价键直接相连的给体与受体之间发生的能量传递过程。Liu及其研究团队通过将花菁官能团与四苯基乙烯(TPE)这一典型的聚集诱导发光(AIE)活性基团结合,成功设计并合成了AIE探针Cassette A(P299)()。随着pH值的升高,P299中的羟基发生去质子化反应,导致其聚合度降低,进而削弱了AIE效应,使得荧光发射减弱。该团队还利用罗丹明作为受体与TPE给体结合,合成了另一种类似的探针C(P300)()。P300展现出特定的pKa值为4.8,并在最大发射波长641nm处显示出强烈的荧光响应。特别地,当pH值从7.58降至3.18时,其荧光强度显著增强了131倍,彰显了其在pH敏感检测中的潜力。
Burgess及其合作者则开发了一种新颖的TBET探针1(P301),该探针巧妙融合了BODIPY与荧光素两种荧光团()。在pH值高于6.5的条件下,荧光素经历去质子化过程,促进了分子内电荷转移(ICT)的增强,从而在525nm附近产生强烈的荧光发射。相反,在酸性环境(pH值小于6)下,荧光素的质子化抑制了ICT过程,使得能量更有效地转移到BODIPY上。因此,在荧光素吸收峰附近激发时,P301能够在600nm处发出红色荧光()。进一步地,P301被成功与牛血清白蛋白(BSA)共轭,形成BSA-P301探针,用于监测COS-7细胞内pH值的变化()。通过载体肽(Pep-1)的介导,BSA-P301能够有效地被COS-7细胞摄取,并在不同温度(37℃与4℃)下展现出不同的分布模式与pH响应特性。具体而言,在4℃条件下,BSA-P301主要沉积于相对碱性的细胞质中;而在37℃时,则更多地分布于内质体中,表现出pKa值的差异(内质体中为5.4,细胞质中为7.4),这一发现为细胞内pH值的空间分布与动态变化研究提供了有力的工具。
图 93. (a) pH 探针采用 TBET 机制;(b) 基于 BODIPY 的探针1(P301) 的 pH 依赖性能量转移; (c) 在 (A) 37 °C 和 (B) 4 °C 下培养 1 小时后,COS-7 细胞摄取了 Pep-1 介导的BSA-P301。
4.6. pH 响应探针概述
小分子荧光探针作为生物体系中pH值监测的关键工具,其独特的光物理特性与精确的pKa值(表1所示)为pH值的可视化与量化分析提供了强有力的支持。除了这些经典的小分子探针外,领域内还涌现出多种新型pH响应探针,进一步拓宽了应用范围与性能边界。
其中,nm传感器与碳点凭借其卓越的光稳定性、高亮度输出以及广泛的pH响应区间,在生物成像与传感领域展现出巨大潜力。这些nm级材料不仅能够抵抗光漂白,还能在复杂生物环境中稳定工作,为长时间、高分辨率的pH监测提供了可能。
此外,融合了荧光团与聚合物平台的共聚物体系为生物体系内的pH感知带来了新的视角。这类材料通过精确调控聚合物链的结构与功能,实现了对pH变化的灵敏响应与特异性识别,为细胞内微环境研究提供了有力的技术支持。
值得注意的是,一系列pH敏感的荧光蛋白也被开发并应用于pH传感领域。这些天然或工程化改造的蛋白质不仅具有优异的生物相容性,还能在细胞内原位表达,实现对活细胞内部pH环境的实时监测,为生命科学研究提供了宝贵的工具。
此外,金属有机框架(MOFs)与过渡金属复合物等先进材料同样展现出对pH值变化的敏感响应能力。这些材料通过其独特的结构特性与化学性质,实现了对pH值的精确识别与量化分析,为化学传感与材料科学领域带来了新的发展机遇。
鉴于篇幅所限,本文未能详尽介绍所有类型的pH响应探针。作者诚挚地建议读者参考相关领域的综述文章,以获取更多关于这些先进探针的详细信息与最新研究进展。
Table 1. Photophysical and p_K__a_ Values of Selected Probes
| Probe | λAbs (nm) | λem (nm) | p_K__a_ | Linear response pH range | Target | | :: | :-: | :: | :: | :-: | :--: | | P187 | 355 | 445 | 7.78 | – | intracellular pH | | P188 | 335/370 | 458 | 6.4 | – | secretory vesicles | | P189 | 400/467 | 528/606 | 5.88 | 5.0–7.0 | mitochondria | | P190 | 370/453 | 542/604 | 7.95 ± 0.04 | – | mitochondria | | P191 | 400/450 | 510 | 7.22 ± 0.04 | – | intracellular pH | | P192 | 410/500 | 520/580 | 7.33 ± 0.04 | 7.0–9.0 | mitochondria | | P193 | 668/734 | 699 | 7.01 | – | – | | P194 | 685 | 707 | 4.0 | – | lysosome | | P195 | 635 | 670/708 | 5.00 ± 0.01 | 4.0–6.0 | lysosome | | P196 | 439/535 | 522/559 | 6.44 | – | lysosome | | P197 | 430/538 | 522/557 | 5.96 | – | lysosome | | P198 | 610/694 | 678/714 | 5.77 | 4.6–6.6 | mitochondria | | P199 | 608/718 | 672/748 | ∼ 7.2 | 6.5–7.8 | intracellular pH | | P200 | – | 390 | 7.29 | – | – | | P201 | 420/550 | 550/605 | 5.87 | – | nucleus/mitochondria | | P202 | 490 | 560 | 6.2 ± 0.03 | 5.6–7.2 | intracellular | | P203 | 480 | 580/657 | 5.77 | – | mitochondria | | P204 | 330/410 | 510 | 4.17 | – | lysosome | | P205 | 365/485 | 538/645 | 6.7 | 5.46–7.46 | intracellular pH | | P206 | 474/572 | 600/772 | 3.93 | – | intracellular pH | | P207 | 405 | 494/570 | 4.54 | – | lysosome | | P208 | 374/436 | 445/490 | 4.53 | – | intracellular pH | | P209 | 397/501 | 560/613 | 5.0 | 4.0–6.0 | lysosome | | P210 | 374/434 | 522/630 | 3.27 | 2.0–3.8 | intracellular pH | | P211 | 397/476 | 496/566 | 4.28 | – | membrane/vesicle | | P212 | 340/385 | 410/475 | 4.86 | 4.6–6.2 | lysosome | | P213 | 359/397 | 454/514 | 4.46 | 3.8–5.0 | lysosome | | P214 | 318/410 | 480/560 | 5.20 | 4.2–6.2 | lysosome | | P215 | 400/505 | 523/605 | 2.44 | 1.50–3.60 | intracellular pH | | P217 | 558/605 | 515/665 | 2.0 | – | lysosome | | P218 | 630 | 665 | 7.5 | – | – | | P219 | 500/655 | 665 | 6.1 | – | – | | P220 | 530 | 665 | 6.3 | – | mitochondria | | P221 | 503/750 | 758 | 5.2 | – | tumor microenvironment | | P222 | 610/800 | 750/810 | 6.74 ± 0.02 | 5.9–7.7 | Golgi apparatus | | P223 | 932 | 982 | – | – | – | | P224 | 1014 | 1070 | 3.81 | 1–4 | gastric pH | | P225 | 368 | 490 | 5.82 | – | lysosome | | P226 | 337/401 | 437/500 | 3.52 | 2.50–4.50 | lysosome | | P227 | 329/385 | 464/542 | 4.47 | – | lysosome | | P228 | 326/355 | 430/550 | 5.7 | – | – | | P229 | 350/410 | 450/575 | 4.4 | 3.5–5.0 | lysosome | | P230 | 354/418 | 425/595 | 2.34 | 2.3–4.0 | lysosome | | P231 | 377 | 466 | 6.2 | – | lysosome | | P232 | 320 | 500 | 4.34 | – | intracellular pH | | P233 | 440/480 | 480/510 | ∼6.5 | 5.0–7.5 | intracellular pH | | P234 | 420 | 525/570 | 5.88 | – | intracellular pH | | P235 | 575 | 578/601 | 7.3 | – | late endosome | | P236 | 597/630 | 688/723 | 5.8 | – | intracellular pH | | P237 | 490 | 536 | 6.0 | – | tumor microenvironment | | P239 | 940 | 536 | 6.1 | – | osteoclasts | | P240 | 648 | 670 | 4.5 | – | lysosome | | P241 | 508 | 521 | 7.49 | – | – | | P242 | 498 | 506 | 10.31 | – | – | | P243 | 640 | 729 | 6.17 | | tumor cell membrane | | P244 | 565 | 665 | 6.15 | – | – | | P245 | 688 | 786 | 5.08 | – | late endosome | | P246 | 391/411 | 525 | 6.18 | 5–7.5 | mitochondria | | P248 | 395/415 | 528 | 4.58 | 4–5 | endoplasmic reticulum | | P249 | 443 | 531 | 5.36 | – | lysosome | | P250 | 441 | 538 | 4.39 | – | lysosome | | P251 | 450 | 550 | – | – | lysosome | | P252 | 648/792 | 750/860 | 7.10 | 6.7–7.9 | intracellular pH | | P253 | 667/750 | 781/789 | 6.8 | – | intracellular pH | | P254 | 534 | ∼560 | 5.1 | – | intravesicular pH | | P256 | 554 | 690 | 6.1 | | – | | P257 | – | 730 | 6.8 | | – | | P258 | 640 | 664 | 4.91/6.11 | – | lysosome | | P259 | 554/565 | 589/592 | 4.73 | – | lysosome | | P260 | 445 | 530 | 4.10 | 3.4–4.8 | lysosome | | P261 | 495 | 560 | 3.91 | – | mitochondria | | P263 | 553 | 585 | 6.05 | – | – | | P266 | – | 525 | 6.3 | – | intracellular pH | | P268 | 500 | 530 | 6.98 | – | intracellular pH | | P269 | 492 | 514 | 4.8 | – | – | | P270 | 480/537 | 539/624 | 7.75 | – | – | | P271 | 515/573 | 583/631 | 7.62 | – | – | | P272 | 490/560 | 520/600 | 7.33 ± 0.02 | 6.15–8.38 | mitochondria | | P273 | 495/563 | 512/580 | 3.1/9.2 | – | intracellular pH | | P274 | 559 | 578 | 5.47 | – | lysosome | | P275 | 570 | 588 | 4.10 | 4.2–6.0 | lysosome | | P276 | 570 | 600 | 4.32 | 3.8–5.4 | Golgi apparatus | | P277 | 610 | 650 | 5.04 | 4.4–5.6 | lysosome | | P278 | 615 | 664 | 3.62 | 3.0–4.2 | Golgi apparatus | | P279 | 587 | 654 | 5.4 | – | intracellular pH | | P280 | 720 | 739 | 4.98 | 4.00–5.80 | lysosome | | P281 | 713 | 740 | 3.3 | – | lysosome | | P282 | 553 | 575 | 6.85 | – | intracellular pH | | P283 | 679 | 693 | 6.24 ± 0.10 | – | intracellular pH | | P284 | 340/491 | 435/604 | 6.6 | 6.2–7.0 | intracellular pH | | P285 | 418/780 | 480/800 | 4.8 | – | lysosome | | P286 | 365/487 | 563/595/664 | – | 3.87–7.32 7.53–8.46 | intracellular pH | | P287 | 430 | 489/615 | – | – | – | | P288 | 430 | 538/580 | 2.79 | – | lysosome | | P289 | 500/560 | 529/580 | 4.82 | – | lysosome | | P290 | 420/561 | 477/582 | 4.98 | 4.20–6.00 | lysosome | | P291 | 410/560 | 600 | 5.93 ± 0.08 | – | mitochondria | | P292 | 380 | 454/530 | – | 4.0–6.5 | lysosome | | P293 | 560 | 550/597 | 6.35 | – | lysosome | | P294 | 358 | 459/526 | 6.65 | – | intracellular pH | | P295 | 375 | 474/520 | 5.69 | – | intracellular pH | | P296 | 365 | 484/551 | 7.3/8.6 | – | intracellular pH | | P297 | 363/419 | 468 | 8.03 | – | mitochondria | | P299 | 350/720 | 780 | – | – | intracellular pH | | P300 | 405 | 481/641 | 4.8 | | intracellular pH | | P301 | 488 | 525/600 | – | – | intracellular pH |
5. 用于温度检测的荧光探针
温度作为一个核心变量,在广泛的物理、化学及生物进程中扮演着不可或缺的角色,其重要性不言而喻。尤为显著的是,近年来累积的诸多证据表明,人体病理生理状态与温度波动之间存在着深刻的内在联系。细胞作为生命活动的基本单元,能够敏锐地感知环境温度的变化,并据此调整其基因表达谱,以适应环境变化。例如,当遭遇高温胁迫时,细胞会启动热休克反应,上调特定基因的表达,促进热休克蛋白的合成,这些蛋白质对于维护细胞结构的完整性和蛋白质分子的正确折叠状态至关重要。
此外,细胞代谢活动的速率与效率亦受到温度的深刻影响。酶作为生物体内催化化学反应的关键分子,其活性水平可随环境温度的细微变化而进行精细调节,以确保细胞功能的优化和能量转换的高效进行。因此,实现对生物体内原位温度的精确测量,对于深入理解温度如何调控这些复杂生物过程具有至关重要的意义。
为了满足这一需求,科学界长期致力于开发高效、灵敏的温度分析技术,尤其是在活体及生物微环境中的应用。其中,荧光探针作为一类极具潜力的温度传感器——“荧光温度计”,因其独特的优势而备受关注。(415-418) 这类探针涵盖了温度敏感的有机染料、金属配合物、量子点、聚合物nm粒子以及荧光蛋白等多种类型,它们能够在目标生物环境中以高空间和时间分辨率实时监测温度波动,为揭示生物大分子动态行为及其调控的细胞事件提供了宝贵的洞察。
5.1. 基于 ICT/TICT 机制的温敏探针
基于扭曲分子内电荷转移(TICT)原理设计的温度敏感荧光探针,其核心结构巧妙融合了给体(D)与拥有π共轭体系的受体(A),如所示。在光激发下,系统跃迁至局部激发态(LE),此时D与A部分保持平面构型,形成稳定的激发态结构。LE态可通过辐射途径返回基态,伴随荧光发射。此外,LE态亦能经历分子内单键的旋转,导致D与A间的构象重排,进而转化为非平面的TICT态。TICT激发态的辐射衰减过程伴随着能量耗散,其荧光发射相较于LE态通常发生红移现象。
TICT型荧光温度计的工作原理深植于微环境参数(尤其是极性)与温度之间的微妙关联,或是温度直接触发的环境变化,这些变化进而调控探针在LE与ICT/TICT状态间的构象平衡。随着温度的波动,这类探针展现出荧光强度或荧光寿命的显著变化,成为研究温度效应的敏感探针。
本节将聚焦于ICT/TICT机制,依据不同分子骨架(或称为母核)的特点,对温度敏感荧光探针进行分类探讨。通过深入剖析各类探针的结构特征与温度响应行为,旨在揭示其内在机制与应用潜力。
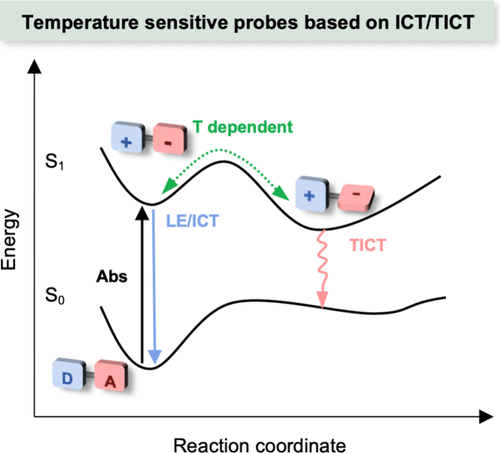
图 94. 基于分子内电荷转移/扭曲分子内电荷转移(ICT/TICT)机制的温度敏感探针。
5.1.1. 罗丹明衍生物
罗丹明及其衍生物因其在温度变化下展现出的独特荧光特性而广受瞩目。特别是,Mau等人开创性地报道了基于罗丹明B的有机荧光温度计,其乙醇溶液中的荧光量子产率与温度呈显著相关性,这一特性根源于温度诱导的扭曲分子内电荷转移(TICT)机制。在光激发下,罗丹明B中的二烷基氨基部分可绕C-N键旋转,进入TICT状态,此过程伴随非辐射衰减的增加,从而导致荧光强度的减弱。随着温度的升高,键旋转速率加快,罗丹明B探针更倾向于通过TICT路径衰减,荧光量子产率随之下降。这一发现为基于罗丹明骨架的温度敏感荧光探针设计提供了理论依据与策略指导。
图 95. 基于罗丹明衍生物的温度敏感探针。
线粒体,作为细胞内的“能量工厂”,其动态变化与细胞代谢状态紧密相连,其微小温度变化是评估细胞健康与功能的重要指标。因此,开发能够精准监测线粒体温度的荧光探针成为研究热点。2015年,Chang研究团队通过筛选多样化的荧光库(DOFL),成功识别出一种名为线粒体温度黄(MTY,,P302)的小分子荧光探针,该探针不仅能够有效靶向线粒体,还能清晰成像细胞内温度梯度。MTY的温度敏感性主要受到其结构中N,N-二丁基氨基取代基旋转自由度的调控。随着温度的升高,该取代基的旋转加速,促进了激发态的非辐射TICT衰减,进而削弱了荧光信号。进一步研究表明,MTY在多种细胞系中均表现出良好的温度敏感性和荧光响应一致性,尽管其较窄的斯托克斯位移及高内源性背景荧光限制了其在体内成像的应用潜力。
图 96. 罗丹明衍生物在线粒体微温检测中的应用。(a) 线粒体热黄(P302)的化学结构;(b1) RhBIV (P303) 的化学结构; (b2) 小鼠静脉注射 RhBIV(10 毫克/千克)1 小时后的生物分布;(c1) Mito-RTP (P304) 的化学结构; (c2) 罗丹明 B(红色)和 CS 近红外染料(绿色)在各聚焦点的荧光图像;(c3) 添加 FCCP 之前(t = -90s)和之后(t = 330s)的比率图像(罗丹明 B/CS 近红外染料)。
为克服MTY的局限性,Shen等研发了RhBIV这一新型小分子荧光温度计(,P303),其温度响应机制与MTY相似,但结构上的优化带来了显著的性能提升。具体而言,RhBIV采用正交取代的哌啶环设计,增强了向染料核心给体的电子转移能力,导致发射波长红移至592nm,预示着更强的深层组织穿透能力。在小鼠模型实验中,通过尾部静脉注射RhBIV后,探针迅速分布至全身,并随时间推移在肝脏中显著积累,而在肾脏和淋巴结中的分布则较少()。值得注意的是,RhBIV的季铵化特性使其能够特异性地靶向线粒体,这得益于其正电荷与线粒体负膜之间的静电相互作用。此外,RhBIV展现出优异的荧光亮度和光稳定性,为线粒体温度的体内外长期监测提供了强有力的工具。
在复杂生物环境中,单独依赖单一荧光传感器的强度来量化温度往往受限于局部探针浓度波动及成像聚焦精准度,从而引入误差。为解决此问题,Shinji Takeoka研究团队创新性地提出了一种比率型温度敏感荧光探针Mito-RTP (,P304),该探针巧妙融合了罗丹明B与CS近红外染料,通过六亚甲基二氨基连接桥接。罗丹明B的荧光响应展现出随温度升高而线性减弱的特性,而CS近红外染料则因其分子结构限制,荧光强度在不同温度下保持恒定()。因此,利用两者荧光强度比(罗丹明B/CS近红外染料)作为温度指标,实现了随细胞外温度上升而线性下降的趋势,且该比率不受pH值(4-10范围内)或离子强度(0-500 mM KCl)变化的干扰。Mito-RTP特异性靶向线粒体,在活细胞内作为热敏元件运作,同时有效校正了由细胞运动引起的z轴离焦效应,确保了基础荧光强度比的稳定性。实验显示,当使用FCCP(氧化磷酸化解耦剂)处理细胞后,ATP合成与氧化磷酸化耦合受阻,伴随线粒体产热增加,Mito-RTP通过荧光比率成像直观展现了这一温度变化过程(),实现了线粒体节律温度的精确量化,排除了环境因素的干扰。
图 97. (a) Mito-TEM(P305) 的化学结构; (b) Mito-TEM 2.0 (P306) 的化学结构; (c) 利用 Mito-TEM 2.0 实时监测斑马鱼受外源诱导剂胁迫时的温度变化。
鉴于带正电荷的罗丹明衍生物倾向于富集于带负电的线粒体膜上,且线粒体膜电位在病理状态下常发生异常,Xiao等人设计了一种新型可固定荧光温度计Mito-TEM(,P305),该探针通过苯甲醛基团与线粒体蛋白的氨基发生希夫碱反应,实现化学固定,增强了在线粒体内的驻留能力。其温度敏感机制与罗丹明B相似,但为克服单一荧光强度测量的局限性,研究团队进一步开发了基于佛斯特共振能量转移(FRET)机制的比率型探针Mito-TEM 2.0(,P306)。在此设计中,BODIPY作为温度不敏感的内参,而FRET受体罗丹明B则随温度升高荧光减弱,导致Ired/Igreen强度比下降。Mito-TEM 2.0的应用不仅简化了激发光源需求,还成功实现了活体细胞及斑马鱼炎症模型中线粒体温度变化的动态可视化(),为生物学研究提供了强有力的工具。
5.1.2. 其他 D-A 型荧光团
在探索温度敏感型荧光探针的广阔领域中,除经典的罗丹明母核结构外,研究者们还精心设计了多种基于给体-受体(D-A)构型的双极性荧光分子。其中,Chapman及其团队率先揭示了NBD-FA(,P307)与Laurdan(6-十二碳酰基-2-二甲氨基萘) 作为活细胞光学温度计的应用潜力。NBD-FA的独特之处在于其ICT与TICT(扭曲分子内电荷转移)状态间的能级差足够大,有效阻止了激发态平衡,使得TICT状态易于通过热扩散达到,进而实现了荧光发射强度随温度上升的渐进性减弱。相比之下,Laurdan则遵循更为复杂的分子间多步过程,其响应时间预期较长。NBD荧光团与磷脂或脂肪酸的共价结合策略,为监测不同细胞膜区域的温度波动提供了可能,如在中国仓鼠卵巢(CHO)细胞质膜中的成功应用,其检测分辨率可达约2°C,且得益于NBD机制的快速分子内特性,使得微辐照效应下的温度变化监测得以在纳秒至皮秒时间尺度内进行。
Uwe Pischel团队则报道了一类新颖的基于芳基化芳基异喹啉(BAI)染料的ICT荧光团(,P308),展现出在生理相关温度窗口(283-323 K)内的高灵敏度(-1.2至-1.8% K-1)。这些BAI染料的温度敏感性被归因于ICT状态与TICT状态间随温度变化的相互转换,类似于NBD体系,但B-N键的低温互作与高温解离特性进一步丰富了其机制。此外,BAI染料基态结构的温度依赖性为局部温度的直接监测提供了可能,尽管目前尚未在生物体系中得到验证。同时,硼酸酯作为具有温度计功能的生物相关碳水化合物候选物,其潜力亦不容忽视。
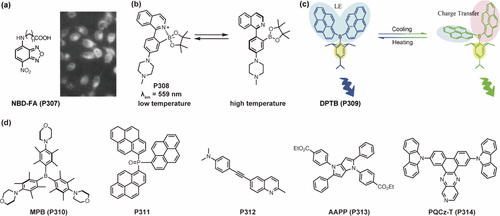
图 98. 用于温度检测的其他 D-A 型荧光团。(a) NBD-FA(P307) 的结构(左)和用其标记的 CHO 细胞的荧光图像(右);(b) P308的结构及其平面形态(左)和扭曲形态(右)之间的基态平衡;(c) DPTB(P309) 的发射随温度变化的机理。(d) 对温度敏感的荧光探针P310-P314的各种结构。
为解决传统荧光温度计在固态聚合物中应用的局限,Yang团队于2011年提出了具有分子转子特性的三芳基硼基荧光温度计DPTB(,P309)。该探针在LE(局部激发态发射)与TICT激发态发射间实现热平衡,展现出从-50至+100°C的宽温度适用范围及高稳定性与可逆性。其缺电子硼原子与富电子芘基团间的电子转移特性,促进了激发态下的ICT过程,而温度升高则促使TICT向LE转变,导致发射颜色由绿转蓝。然而,DPTB在固态聚合物中的使用受限,因高粘度阻碍了构象变化。
为克服这一障碍,同一研究团队开发了MPB(,P310),一种新型三芳基硼化合物,通过减少庞大取代基的使用,降低了激发态构象交换所需的自由体积,从而实现了对固体聚合物自由体积变化的响应。MPB在-50至+100°C范围内表现出良好的性能,但在高温长期检测中稳定性不足,归因于高活性缺电子硼原子的存在。为此,他们进一步研发了基于三芳基氧化膦的空气稳定热敏比率传感器(,P311),通过氧化膦基团完全占据电子轨道,实现了LE与CT(电荷转移)发射的双重荧光变化,展现出宽比率温度范围及环境空气中的高稳定性,预示着在复杂生物应用中的广阔前景。
Xu及其研究团队创新性地研发了一种正温度依赖系数荧光温度计P312(),该温度计在二甲基亚砜(DMSO)溶剂体系中展现出显著的TICT(扭曲分子内电荷转移)发射特性。据推测,P312之所以呈现出这种非典型的正温度系数行为,是由于其能够激活TICT状态的振动带,从而在温度上升时显著促进TICT发射的非辐射衰减过程。鉴于不同波长TICT荧光对温度的差异化响应,这些双重发射的荧光强度比成为了推断环境温度的有效工具。尽管P312在生物领域的应用尚待探索,但其作为比率荧光温度计的潜力预示着在生物系统局部温度定量测量中的广阔应用前景。
Tang及其科研伙伴则成功开发了一种兼具TICT特性与聚集诱导发光(AIE)特性的新型探针AAPP(,P313),该探针被设计为一种可逆的荧光温度计。在四氢呋喃(THF)溶剂中,AAPP的荧光强度与10°C至60°C范围内的温度变化呈现出良好的线性关系。这种温度敏感性的根源在于TICT发光体对热激活及溶剂极性变化的双重响应,导致其在分子内发生LE(局部激发态)至TICT状态的转变。随着四氢呋喃溶剂极性随温度升高而减弱,AAPP的荧光强度逐渐增强,并伴随发射光谱的低色度偏移。尽管该研究强调了AAPP在温度敏感性及中性pH条件下镉离子检测的应用潜力,但其在生物体系中的实际应用效果尚需进一步评估。
Abhijit Patra及其团队则设计了一类新颖的T型和V型D-A-D分子结构(如中P314所示),这些分子以吡啶喹喔啉作为受体,咔唑作为给体。在温度变化条件下,PQCz-T分子的荧光颜色发生显著变化,覆盖了整个可见光区域,这一特性在双发射TICT化合物中得到了验证。具体而言,温度降低时,能量较低的TICT状态得以稳定,导致发射光谱发生红移;而加热过程中,分子运动加剧,克服了TICT与LE状态之间的热势垒,使得LE态占据优势,从而在较高温度下观察到发射光谱的蓝移现象。这一发现为通过荧光颜色变化精确感知环境温度提供了新的思路。
5.1.3. 共聚物
在温敏荧光探针的设计领域,除了小分子探针外,由温度敏感材料与荧光染料共聚而成的聚合物也被广泛探索并应用于荧光温度计的开发。其中,聚(N-异丙基丙烯酰胺)(PNIPAM,)作为最具代表性的温度响应材料之一,其在水溶液中的相变特性尤为显著,具体表现为在接近其较低的临界溶液温度(LCST,约32°C)时,聚合物构象由溶胀态转变为紧缩态,形成纳米级胶体颗粒。这一相变过程可通过与环境敏感性染料的结合,转化为温度敏感的荧光信号,为构建荧光温度传感系统提供了有力支撑。
2003年,Uchiyama团队率先在PNIPAM中引入4-N,N-二甲基氨基-7-N,N-二甲基氨基磺酰基-2-1-3-苯并噁二唑(DBD-NMe2)或其衍生物,开发了一系列基于PNIPAM的荧光温度计。这些温度计通过微环境极性随温度变化的机制,调控DBD单元的荧光发射波长,实现了对温度的灵敏响应。随后,该团队进一步将此类荧光纳米凝胶温度计(FNT)应用于细胞内温度测量,通过交联剂促进纳米尺度凝胶化,并利用硫酸基团的高亲水性防止纳米凝胶在细胞内的非特异性聚集,确保了其在细胞内的有效运作。FNT在活细胞中的成功应用,展示了其作为细胞内温度计的潜力,尽管其尺寸较大和亲水性限制了在细胞内的均匀扩散。
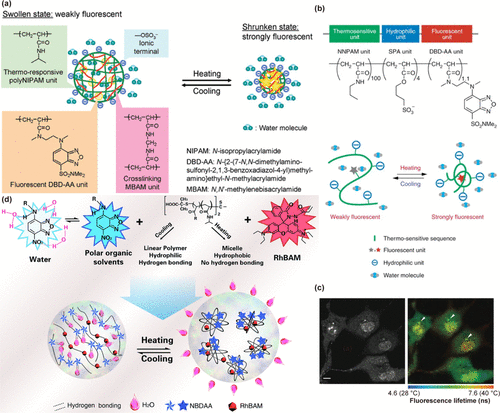
图 99. 作为荧光温度计的 PNIPAM 和荧光染料共聚物。(a) FNT各组分的示意图和化学结构; (b) FPT的化学结构和在水介质中的功能图;(c) COS7 活细胞中的温度分布图:FPT的共聚焦荧光图像(左)和荧光寿命图像(右); (d) RFPs的示意图和化学结构。
为克服FNT的局限性,研究团队进一步开发了基于荧光聚合物温度计(FPT)的细胞内温度测绘技术,结合时间相关单光子计数(TCSPC)系统的荧光寿命成像显微镜(FLIM),实现了对细胞内温度分布的高精度解析。FPT在化学设计和工作机制上与FNT相似,但凭借其更小的尺寸和更优的亲水性,实现了在细胞内的快速有效扩散,成功在COS7细胞中实现了细胞器水平的温度测绘。然而,FPT在哺乳动物细胞中的递送仍面临挑战,需通过微注射等可能损伤细胞的方法。为此,研究团队通过引入pH不敏感的季铵阳离子单元,设计出一种能够自发进入酵母细胞的改进型FPT(NN-AP2.5),展示了其在不同细胞类型中的应用潜力。
此外,基于PNIPAM的比率荧光聚合物(RFPs)也通过可逆加成-碎片转移(RAFT)聚合法制备而成,利用两种不同荧光染料作为比率探针,实现了对温度的双重荧光信号检测。Mao及其合作者的研究中,RFPs由PNIPAM、极性敏感荧光染料(NBDAA)和荧光不敏感的罗丹明B衍生物(RhBAM)组成,通过避免荧光染料间的FRET效应,确保了测量的准确性。在加热过程中,RFPs展现出荧光“开启”反应,其温度分辨率低于1.0°C,彰显了其高热敏性和在温度测量中的高精度。
5.2. 基于 FRET 机制的温敏探针
荧光共振能量转移(FRET)现象,作为一种分子间能量传递过程,发生在被激发的给体荧光团与接收能量的受体荧光团之间。这一过程的关键在于给体发射的荧光光谱与受体吸收光谱的有效重叠,从而触发受体荧光团的发射。基于FRET机制设计的经典荧光温度计,其构建策略通常涉及将给体荧光团与淬灭剂或受体荧光团共价连接到具有温度响应性的聚合物基质上,如聚(N-异丙基丙烯酰胺)(PNIPAM)。
此类荧光温度计的工作原理深刻体现了FRET与热致伸缩材料特性的结合。随着环境温度的变化,PNIPAM等热致伸缩材料会经历显著的相转变,这一过程直接导致给体与受体之间相对距离的变化。具体而言,温度的上升或下降会诱导PNIPAM聚合物链的收缩或伸展,进而调节给体与受体荧光团间的距离。这种距离的变化是调控FRET效率的关键因素,因此能够触发荧光信号的开关行为(如所示)或产生荧光颜色的切换现象(如所示),从而实现对温度的精确响应和可视化监测。
综上所述,基于FRET机制的荧光温度计不仅融合了化学荧光标记的灵敏性与高分子材料的热响应性,还通过精巧的分子设计实现了对温度变化的精确感知与直观表达,为生物学、材料科学及化学传感等领域的研究提供了强有力的工具。
图 100. 基于荧光共振能量转移(FRET)机制的温度敏感探针。
5.2.1. 作为温敏单元的 PNIPAM
Hong及其团队成功研发了一种基于热诱导荧光共振能量转移(FRET)机制的比率荧光温度计()。该传感器创新性地结合了芘作为荧光团与富勒烯作为淬灭剂,两者均被锚定于温度敏感的聚(N-异丙基丙烯酰胺)(PNIPAM)基质上。在低于PNIPAM的较低临界溶液温度(LCST)时,PNIPAM链在水溶液中呈现伸展状态,增大了芘与富勒烯之间的距离,从而“激活”了芘的荧光发射。相反,当温度超过LCST时,PNIPAM链收缩成球状,导致芘的荧光被有效“关闭”。这一设计巧妙地利用了PNIPAM的热敏性,实现了荧光强度随温度变化的负向响应。
相较于依赖单一荧光团的传感系统,比率荧光探针因其内置的参比染料而具备自校准能力,能提供更可靠的读数。Liu团队通过DPTB标记PNIPAM,开发了一种兼具亲水性的荧光温度探针PNDP-NR()。该探针利用DPTB与尼罗红(NR)之间的FRET效应,实现了比率信号的输出。PNDP-NR纳米凝胶的独特结构,包含亲水与疏水区域,使得NR在疏水域中分布。在405 nm光激发下,DPTB发出绿色荧光,部分能量通过FRET传递给NR(λem = 625 nm)。随着温度升高,绿色荧光在470 nm处增强,而由于亲疏水区域分离加剧,FRET效率下降,导致NR在625 nm处的荧光略有减弱。这一绿色与红色荧光强度的比值,在34至56°C范围内与温度呈线性关系,展现出宽温度范围、高线性度及优异的温度分辨率。尤为值得一提的是,PNDP-NR在30-55°C范围内荧光颜色显著变化,且能成功应用于NIH/3T3细胞的单细胞温度监测。
图 101. 基于 FRET 的荧光温度计。(a) 芘和富勒烯端基官能化 PNIPAM 在 LCST 以上的温度诱导淬灭机制; (b) 高效 FRET 系统 PNDP-NR 的设计; (c) 利用热响应 DHBC 制备聚合物比率荧光温度计; (d) L-DNA 的结构(左)和基于 L-MB 的细胞内纳米温度计的原理(右)。
Hu等人则报道了一系列基于一步或两步级联FRET机制的聚合物比率测温仪,这些测温仪由热致伸缩性双亲水嵌段共聚物(DHBCs)构建,具体包括CMA、NBDAE及RhBEA标记的PEG-b-P(NIPAM-co-X)结构(,X代表不同荧光团)。相较于一步式FRET温度计,两步级联FRET温度计通过引入NBD作为能量传递桥梁,实现了从CMA到RhBEA的高效荧光能量转移,显著提升了在活细胞内温度成像的检测灵敏度。这一系列创新设计不仅丰富了荧光温度计的种类,也为细胞内温度监测提供了更为精细和灵敏的工具。
5.2.2. 作为温敏单元的 L-DNA
在材料科学与生物技术的交叉领域,特别是核酸纳米技术领域,Ke 等人在 2012 年的一项研究中,引入了一种创新的细胞内温度感测装置,该装置基于左旋脱氧核糖核酸(L-DNA)——作为自然界中普遍存在的右旋脱氧核糖核酸(D-DNA)的立体异构体,构建了分子信标(L-MBs)。这些L-MBs展现出独特的发夹状DNA结构,其两端精心地结合了荧光团与淬灭剂,形成了高效的荧光调控系统。
回溯至1995年,Tyagi 与 Kramer 首次设计了分子信标(MBs)用于监测RNA的动态,其原理在于与目标RNA特异性杂交后能触发荧光信号的开启。在L-MB系统中,荧光团与淬灭剂间的空间距离成为温度变化的敏感指示器。具体而言,在较低温度下,由于发夹结构紧密闭合,荧光团与淬灭剂相距较近,导致荧光发射受到有效抑制,呈现低荧光状态。然而,随着环境温度的逐渐升高,发夹结构趋于打开,荧光团与淬灭剂之间的距离增加,荧光信号随之增强,实现了对温度变化的直接响应。
尤为关键的是,L-MBs通过脂质体介导的转染技术成功递送至活HeLa细胞内,并显示出对细胞核的选择性定位能力。实验结果显示,在温度从20℃逐渐提升至37℃的生理温度范围内,L-MBs探针能够显著增强荧光输出,成为监测细胞内温度变化的有力工具。
采用非天然的L-DNA作为构建基块,对于确保分子信标在复杂的细胞内环境中保持结构稳定及功能活性至关重要。相比之下,基于D-DNA的传统分子信标(D-MBs)常面临细胞内快速降解的挑战,且其结构特性限制了其对温度变化的敏感性,难以胜任细胞内温度监测的任务。因此,L-MBs的开发不仅拓展了分子信标的应用范围,也为细胞内环境的高精度监测提供了新的思路和技术手段。
5.3. 基于 PET 机制的温度敏感探针
在化学与材料科学,利用光致电子转移(PET)机制构建的荧光探针,其核心设计策略是将荧光团与电子给体或受体通过匹配的最高占据分子轨道(HOMO)或最低未占据分子轨道(LUMO)能级相连接。基于这一机制,可以精巧地设计出荧光温度计,以实现对温度的敏感响应。
在众多PET基荧光团中,C8-苯基取代的BODIPY(4,4-二氟-4-硼-3a,4a-二氮杂-s-茚并[1,2-b]噻吩-3-酮)母核因其独特的性能而备受青睐。在大多数条件下,随着环境温度的升高,C8-苯基在BODIPY母核上的构象会经历一个有利的旋转过程。这一旋转不仅促进了非辐射跃迁的发生,还增强了从C8-苯基到BODIPY核心的光致电子转移效率,两者共同作用,导致了荧光强度的显著降低,即荧光淬灭现象()。
然而,在特定条件下,C8-苯基在BODIPY母核上的分子内旋转可能会受到限制。这种旋转受阻的现象会阻碍电子从C8-苯基向BODIPY核心的有效迁移,从而打破了原有的PET过程,使得荧光强度得以恢复。这一发现不仅丰富了作者对PET机制的理解,也为设计具有复杂温度响应特性的荧光探针提供了新的思路。
综上所述,通过精细调控C8-苯基在BODIPY母核上的旋转行为,结合PET机制,可以开发出具有独特温度敏感性的荧光温度计,为生物学、材料科学及化学分析等领域的研究提供强有力的工具。
图 102. 基于光诱导电子转移 (PET) 机制的温度敏感探针。
5.3.1. 温度依赖系数为负的 BODIPYs
在化学与材料科学的融合研究中,BODIPY母核凭借其卓越的光学稳定性、生物兼容性和合成便捷性,成为了设计荧光温度计的理想平台。Chang研究团队历经精心筛选,从1,500种候选分子中鉴定出12种温度敏感性超过1%/°C的染料。其中,ER thermo yellow(,P315,λex = 559 nm,λem = 581 nm)凭借其在内质网(ER)中的精确定位、高光稳定性、亮度及显著的温度敏感性,被选定为最优候选物。研究采用1064nm近红外激光,在微观尺度上通过聚焦铝粉团块于玻璃微针尖端,创造了局部温度梯度,同时维持细胞外环境于37°C。实验观察到,随着细胞受激光加热,ER thermo yellow的荧光强度显著下降,这归因于温度升高加速了BODIPY母核上C8-苯基的旋转,进而增强了非辐射跃迁及C8-苯基至BODIPY核心的PET效率,导致荧光淬灭。通过调整激光功率,成功在单细胞内绘制出温度梯度图(,右),并验证了ER thermo yellow在监测HeLa细胞内Ca²⁺介导产热过程中的应用潜力。
荧光寿命成像(FLIM)以其独特的优势,在成像领域崭露头角,其测量的荧光寿命不受样品位置、染料浓度及光源强度变化的影响。Itoh等人开创性地展示了ER thermo yellow在活体C2C12肌管中作为温度传感器的FLIM能力,发现其荧光寿命随温度升高而缩短()。为进一步提升光稳定性,Kriszt团队通过去除α-氯,开发了ERthermAC(,P316),该衍生物在高激光强度下展现出卓越的抗漂白性能,同时保留了ER靶向特异性,并在细胞毒性研究中展现出显著的应用潜力()。

图 103. 基于 BODIPY 的探针在微温检测中的应用。(a) ER thermos yellow(P315) 的结构(左),基于红外激光共焦激光扫描显微镜的检测系统示意图(中),通过不同的激光功率获得ER thermo yellow的温度分布图(右图);(b) 25 和 37 °C 下装载了ER thermo yellow的活 C2C12 肌管的荧光寿命图像;(c) ERthermAC(P316) 的结构(左),所有细胞在 FCCP 处理后ERthermAC强度急剧下降,没有任何滞后期,表明细胞内温度升高(右); (e)P319的结构(左图),P319在 11 至 37 °C不同温度下在 U2OS 细胞中的荧光成像(右图:上图为荧光强度图像,下图为 FLIM 图像)。
Martí团队则另辟蹊径,合成了PEG-BODIPY(,P317),其荧光特性与温度及粘度密切相关。通过精细调控甲基的立体阻碍位置,有效限制了苯环旋转,从而提升了P317的荧光寿命和量子产率,并降低了对低粘度环境的超敏感性。然而,其绿色荧光特性限制了深层组织成像的应用。Kuimova小组通过扩展BODIPY的α位共轭(引入菲基团),成功开发出红色发光的P318,该探针专注于微温变化而非粘度,但遗憾的是,其细胞渗透性受限。
为克服上述局限,同一研究团队创新性地引入了环丙基,合成了P319(),这一设计不仅提升了生物相容性和细胞渗透性,还通过增加激发态S1势垒高度,显著降低了粘度敏感性,实现了基于荧光寿命的精准温度传感。P319在U2OS细胞中的FLIM成像实验(11-37°C范围内)有力证明了其高效内化及细胞内温度感知能力(),为生物医学领域的温度监测提供了强有力的工具。
5.3.2. 温度依赖系数为正的 BODIPYs
在化学与材料科学的探索中,除了先前讨论的展现负温度系数的BODIPY衍生物外,Kuang研究团队于2014年取得了显著进展,成功合成了一系列具有独特正温度系数热膨胀特性的两亲性BODIPYs,这些化合物携带了不同的亲水取代基(左侧所示的P320)。这一突破性发现颠覆了传统认知,因为这些BODIPYs在温度升高时展现出荧光强度的增强,而非减弱。深入研究表明,其正温度依赖性的根源在于加热诱导的分子内旋转受限以及PET淬灭途径的受阻。具体而言,在低温条件下,疏水性的BODIPY荧光团能够自由旋转,而随着温度的升高,PEG(聚乙二醇)基团发生脱水并缠绕于荧光团周围,有效地“关闭”了PET过程(),从而促进了荧光的增强。
图 104. (a) P320和溶酶体靶向 P321 的结构;(b) 机理图,说明 P320 如何对温度做出反应;(c) 用 P321 和溶酶体追踪红(LTR)染色的 HeLa 细胞的共聚焦实验。P321的共聚焦图像(左);LTR的共聚焦图像(中);合并图像(右)。
更令人瞩目的是,P320不仅在水溶液中展现出作为荧光温度计的潜力,还成功应用于活体HeLa细胞的成像研究中,为细胞内温度变化的实时监测提供了有力工具。次年,该团队再次发力,报告了一种新型荧光温度计P321(图),该化合物创新性地引入了额外的吗啉基团,这一设计赋予了P321在HeLa细胞中独特的溶酶体靶向能力()。这一发现不仅拓展了BODIPY荧光探针的应用范围,也为细胞生物学研究中溶酶体功能及温度调控的深入研究开辟了新的途径。
5.4. 基于 AIE 机制的温度敏感探针
聚集诱导发光作为一种独特的光物理现象,由Tang及其研究团队于2001年首次揭示。该现象描述了一类分子在溶解状态下几乎不发光,但一旦形成聚集体则能显著增强荧光发射的特性。这一现象的核心机制通常归因于分子内旋转限制(Restriction of Intramolecular Rotation, RIR)。通过将AIE发光体与温度敏感材料如聚N-异丙基丙烯酰胺(PNIPAM)结合,可以设计出创新的荧光温度计。这类温度计的工作原理基于AIE发光体在不同温度条件下其分散或聚集状态的转变,这些转变由PNIPAM等热致伸缩材料的温度诱导相变所调控,进而实现荧光的“开启”与“关闭”(见图105)。
图 105. 基于聚集诱导发光(AIE)机制的温度敏感探针,RIR = 限制分子内旋转。
Tang及其合作者成功构建了一种基于AIE的荧光温度计系统,以P322为例()。该系统通过自由基聚合反应,将四苯基乙烯(TPE)荧光剂标记于PNIPAM链上,在中性条件下合成。P322展现出对温度变化的非线性荧光响应特性()。具体而言,当溶液温度从15℃升至25℃时,PNIPAM链开始经历脱水过程,但此初期变化微弱难以察觉。而在29℃至34℃区间内,PNIPAM发生显著的线圈-球状转变,伴随整个聚合物链的广泛脱水,这一相变强烈激活了TPE荧光单元的RIR机制,导致荧光强度急剧增加。然而,当温度进一步上升至34℃以上时,由于相变已达低临界溶解温度(LCST)稳定状态,聚合物聚集体结构变化有限,同时高温加剧了TPE分子的内旋转与振动,共同作用下荧光发射效率下降。尽管未直接验证其生物应用潜力,但这一研究首次报道了基于AIE原理的荧光温度计概念。
图 106. 基于 AIE 的温度检测探针的应用。(a) P322的结构(左)和P322在 468 nm波长处的荧光强度(I)对温度的响应(右);(b) 树枝状聚合物 D4的结构(左)及其构象和荧光变化示意图(右);(c) TRF NPs的制造策略图。
另一方面,树枝状聚合物作为一类高度支化的分层大分子,展现出独特的物理化学性质。Li小组开发的以四苯基乙烯(TPE)为外围修饰的聚(氨基胺)(PAMAM)树枝状分子(如D4,)便是例证。依据TPE的AIE机制,温度变化诱导树枝状聚合物骨架的膨胀或收缩,进而调控TPE分子的内旋转自由度,实现荧光强度的可逆调控。这种温度诱导的构象转变赋予了树枝状聚合物作为“呼吸”大分子及潜在荧光温度传感器的潜力。此外,树枝状聚合物的荧光发射特性还受到溶剂质量及质子化状态的影响,这些因素通过改变外围结构的紧密程度来调控荧光性质。
为提升生物成像中的深层组织穿透能力并减少背景自发荧光干扰,Meng等人开发了基于分子内电荷转移(TICT)机制的近红外(NIR)比率荧光温度计,具体为热敏性TBB与罗丹明110共封装于两亲性聚合物F127基质中的纳米粒子(TRF NPs,)。TRF NPs展现出随温度变化的双重发射特征,其中TBB贡献的680 nm处荧光强度随温度升高而降低,归因于非辐射衰变率增加及辐射衰变率降低;而罗丹明110在520 nm处的荧光则保持相对稳定,作为内部校准。在光热治疗(PTT)过程中,TRF NPs成功监测了HepG2细胞温度从25℃至53℃的变化,展示了其在生物温度测量中的广阔应用前景。
5.5. 其他温度敏感探针
Lou及其研究团队进一步引入了两种基于激基缔合物机制的温度敏感荧光探针——PMPBA与PMPAA(如所示,分别对应P323和P324)。在20°C至100°C的宽广温度区间内,这两种探针的激基缔合物发射效率展现出下降趋势,与此同时,其单体形态的发射效率则维持相对稳定()。为了精确分析温度效应,研究团队采用了归一化处理策略,即将激基缔合物的发射信号与单体发射信号进行比例校准,有效剔除了因浓度波动、光强变化或光路长度差异等外部因素可能引入的偏差。
经分析发现,激基缔合物与单体之间的荧光强度比(IE/IM)与温度的倒数(1/T)之间存在显著的线性关系,这一发现为利用激基缔合物随温度变化而发生的形成与解离动态过程作为温度监测手段提供了坚实的理论基础。具体而言,随着温度的升高,激基缔合物的稳定性减弱,导致其发射强度相对单体而言逐渐降低,这一特性使得PMPBA与PMPAA成为极具潜力的温度敏感荧光探针,在化学传感、材料科学及生物学研究等领域展现出广泛的应用前景。
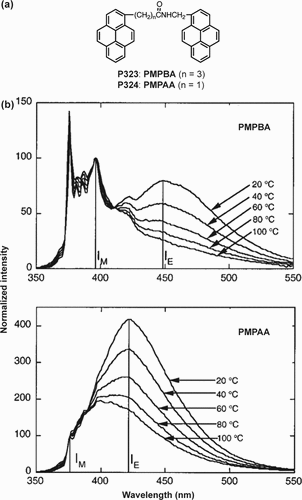
图 107. (a) P323和 P324通过激基缔合物机制的结构;(b) 0.33 μM 荧光团在十二烷中的发射光谱:(上)PMPBA 和(下)PMPAA。
6. 用于电压检测的荧光探针
膜电位,作为调控细胞活力与新陈代谢活动的核心微环境参数,构成了多种细胞过程的基础框架,尤其在神经与肌肉等可兴奋性组织中,对信号传导起着举足轻重的作用。深入理解膜电位,尤其是神经细胞群体中的电位动态,对于揭示信号转导等细胞事件的复杂机制至关重要。传统上,依赖电极的方法被广泛应用于膜电位的测量与监测,然而,这类方法往往受限于其侵入性操作及空间分辨率的不足。
与此同时,荧光成像技术以其独特的优势,能够绘制出高空间分辨率的神经元电活动图谱,展现了在监测细胞间通信方面的巨大潜力。在这一背景下,电压敏感染料(Voltage-Sensitive Dyes, VSDs),作为一类历史悠久的膜电位指示剂有机染料,成为了研究焦点。VSDs可根据其响应速度分为“快速”与“慢速”两大类别。
“快速”染料,通过电致变色或激发态质子转移机制展现电压敏感性,其快速反应动力学允许对神经元动作电位进行实时追踪,尽管在某些情况下可能面临灵敏度相对较低的挑战。“慢速”染料则依赖亲脂离子在膜上的迁移来实现电压敏感性,这类染料通常展现出更高的电压灵敏度,但伴随而来的是对膜电容的潜在扰动以及较慢的反应动力学,从而限制了它们在快速电信号事件监测中的应用。
6.1. 基于电致变色机制的电压传感器
电致变色染料,常被誉为“快速”染料,其独特之处在于通过发色团与外加电场之间的直接作用,展现出对电压变化的敏锐光谱响应。这类染料的核心结构通常由给体(D)、受体(A)以及连接它们的π共轭体系构成。在激发状态下,电致变色染料经历电子再分布过程,当电荷转移方向与外加电场平行时,发色团偶极子的能级随之调整。这一过程遵循线性斯塔克效应,导致吸收带与发射带发生显著偏移(),从而实现了电场对发色团能级的直接调控。这种机制赋予了电致变色染料超快的(飞秒至皮秒级)吸收与发射位移能力,远超过解析神经元快速尖峰事件及动作电位所需的时间尺度。
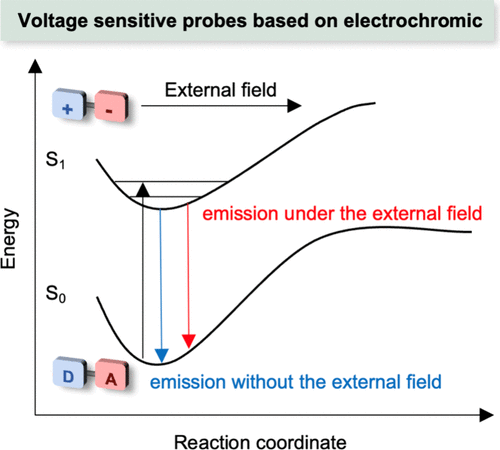
图 108. 基于电致变色机制的电压敏感探针。激发时,电致变色染料会发生电子再分布。当电荷转移的方向与外场平行时,发色团偶极子的能级会发生相应的变化。在线性分子斯塔克效应的引导下,吸收带和发射带随之移动。
回溯至20世纪70年代初,Ken及其研究团队通过筛选上百种染料,成功发现了花菁素540(,P325),该染料以2:1的信噪比展现出电压敏感荧光特性,首次实现了对轴突动作电位的非侵入性追踪。这一发现为在无法应用电极的生物系统中监测膜电位开辟了新途径。随后,Loew团队进一步开发了一系列半花菁染料,基于激发诱导的电荷从吡啶到苯胺的转移机制,深入探索了这些染料的光谱特性,并奠定了电压相关光谱特性的理论基础。其中,ANEPPS(,P326)因对电位变化高度敏感(每100mV电压变化导致高达8%的荧光变化)且光谱特性对称,被广泛应用于神经元活动的长期成像研究中。
图 109. 部分基于电致变色的荧光电压探针及其在电压检测中的应用。(a) 花菁素 540 (P325)、ANEPPS (P326) 和JPW-1114 (P327) 的化学结构; (b) ANBDQPQ(P328) 的化学结构; (c) 在生理性血液循环下猪心电活动;(d)Rh-1692(P329) 的化学结构(左)和使用Rh-1692成像的区域信号;(e)ANNINE-6(P330) 和ANNINE-6plus(P331) 的化学结构; (f) ANNINE-6plus对巨脂泡和 HEK293 细胞的染色;(g)di-4-AN(F)EPPTEA(P332) 的化学结构,以及小脑切片的双光子荧光图像(深度为 70 μm)。
为了克服di-4-ANEPPS 在深部组织成像中的局限性,研究者们通过延长共轭连接区,从JPW-1114(,P337)的一个双键扩展至二烯基连接,设计出了di-4-ANBDQPQ(,P328)。这一创新使得光谱红移至近红外区域,有效避开了血液和心脏组织自发荧光的干扰,实现了在人工血液循环条件下对猪心原位的光学绘图()。
另一类备受瞩目的“快速”氧杂酚类染料Rh 1692(,P329),其吸收光谱巧妙地避开了血红蛋白的吸收峰,成为体内成像的理想选择。Rh 1692不仅适用于麻醉和觉醒状态下的大脑皮层动态成像,还展现出极高的信噪比(),为神经科学研究提供了有力工具。
Fromherz实验室则另辟蹊径,合成了含有六个苯环的齐聚物染料ANNINE-6(,P330)。该染料虽不具备光对位性或光异构性,但其溶剂化显色现象表明分子内电荷位移显著,预示其在生物膜电压瞬变监测中的潜力。然而,ANNINE-6的水溶性极差,限制了其应用。为此,他们进一步合成了ANNINE-6plus(,P331),通过引入双正电荷发色团和两个溴化反离子,显著提升了染料的水溶性和膜结合亲和力,成功实现了在巨脂囊泡和HEK293细胞上的染色(),为神经元激发的光学记录提供了新方案。
此外,Leow团队还开发了一系列含氟半花菁染料,通过氟化提升染料的光稳定性,并通过调整氟原子位置调控电子密度分布,实现吸收与发射光谱的蓝移或红移。这些新型电压敏感染料的单光子激发波长覆盖440nm至670nm范围,且部分染料如EPPTEA(,P332)还展现出双光子激发下的光学电生理记录能力,为深层组织及复杂神经网络的电活动研究提供了有力支持。
6.2. 基于 FRET 机制的电压传感器
在基于荧光共振能量转移(FRET)机制的电压敏感探针设计中,其经典架构巧妙融合了固定的给体部分与可动态移动的受体部分。这一机制核心在于采用具有高度疏水性的荧光阴离子作为FRET受体,该受体能够依据Nernst方程()的预测,在细胞膜两侧之间实现快速且有效的再分布。
在细胞的静息状态下,膜电位呈现出细胞内为负、细胞外为正的典型特征。此时,带负电荷的FRET受体因电荷吸引作用,主要定位于细胞外膜表面,与给体分子紧密相邻,从而触发显著的FRET效应,产生强烈的FRET信号。这一过程确保了探针在静息状态下能够准确反映细胞膜电位的基线状态。
然而,当细胞发生去极化时,膜电位发生变化,细胞内电位逐渐趋近于甚至超过细胞外电位,导致原有的电荷分布平衡被打破。在这一转变过程中,FRET受体随之发生迁移,从细胞外膜表面转移至细胞内结合位点。由于受体与给体之间的空间距离增大,FRET效率显著降低,表现为给体分子的荧光发射强度增强,而受体分子的荧光发射则相应减弱。
综上所述,基于FRET机制的电压敏感探针通过巧妙地利用受体分子的电荷依赖性再分布特性,实现了对细胞膜电位动态变化的实时监测与记录。这一机制不仅提高了电压敏感探针的灵敏度和响应速度,还为深入理解细胞电生理活动提供了强有力的工具。
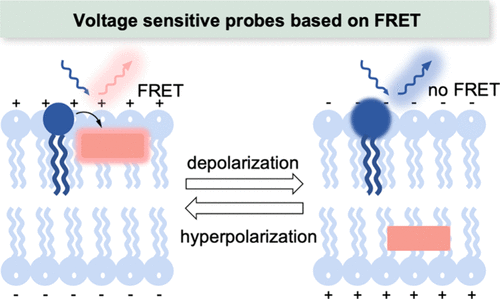
图 110. 基于荧光共振能量转移(FRET)的电压敏感探针。在静息膜电位下,带负电荷的 FRET 受体主要与细胞外膜表面结合,产生大量 FRET 信号(左图);去极化后,FRET 受体转位到细胞内结合位点,FRET 信号减弱,导致给体发射增强,受体发射减弱(右图)。
6.2.1. 双组分 FRET
电致变色染料在追踪神经元动作电位时面临灵敏度受限的挑战,这主要归因于其在电场感应中单位电荷移动距离相对较短,仅覆盖分子长度的一小部分,且分子长度又仅为跨膜距离的一小片段。为克服此局限,Tsien实验室创新性地设计了基于荧光共振能量转移(FRET)的双组分电压传感器,该传感器由荧光素标记的小麦胚芽凝集素(FL-WGA)作为FRET给体和带负电的疏水氧杂菁衍生物作为FRET受体构成。在细胞去极化过程中,氧杂吲哚分子从细胞外重新分布至细胞内,导致FL-WGA与氧杂环戊烯间的FRET信号减弱,FL-WGA荧光增强而氧杂环戊烯发射减弱。尽管这种双组分FRET机制在多种细胞中实现了显著的荧光比率变化(4%至34%每100毫伏去极化),但其反应时间受限于阴离子转位速度,通常在微秒级,故有时被称为“慢”染料。
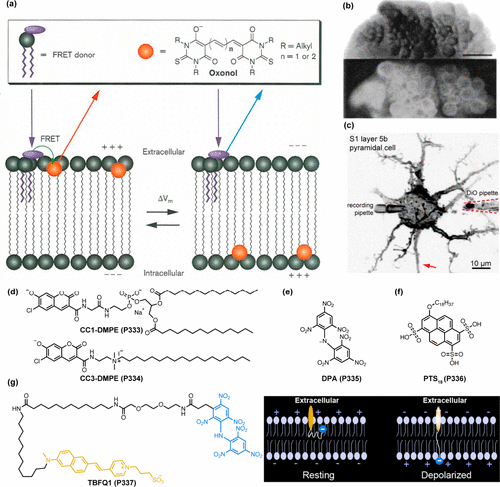
图 111. 基于 FRET 的荧光电压探针的组成及其在电压检测中的应用。(a) FRET 机制示意图;(b) 中神经节背侧的全分辨率数字图像;(c)双光子激发DiO/DPA可检测 L5 锥体细胞的动作电位;(d)P333 和 P334(FRET 给体)的化学结构;(e)DPA(P335) 的化学结构; (f) PTS18(P336) 的化学结构; (g) TBFQ1(P337) 的结构(左)和 TBFQ 电压敏感染料对膜电位变化的反应图(右)。
为提升FRET效率,Tsien实验室进一步优化了染料设计,采用荧光磷脂CC1-DMPE替代FL-WGA,使给体荧光团更接近膜-水界面,显著缩短了给体与受体间的距离,从而提高了电压灵敏度并加速了信号响应(时间常数小于0.4毫秒)。Cacciatore等人的研究表明,通过光学成像与频域分析,利用此类FRET双组分系统可有效识别出具有节律性电活动的神经元。特别地,CC3-DMPE因其优异的生物相容性和灵敏度,在高达160 μM的浓度下仍不损害细胞膜电阻,成为理想的探针选择。
DiGregorio小组则另辟蹊径,开发了以DiO为FRET给体、二丙烯胺(DPA)为FRET受体的新型光学双组分方法。在HEK-293细胞及神经元培养和脑组织切片中,DiO/DPA对展现出极高的灵敏度,能够捕捉到单个神经元棘突的动作电位诱导荧光瞬态及颗粒细胞树突的阈下突触输入。此外,他们还通过直接离子透入法实现了DiO对多个神经元的标记,并验证了DiO/DPA与双光子成像技术的兼容性。
针对传统FRET电压染料系统中香豆素荧光给体激发光谱受pH值影响的问题,Maher等人引入了pH值不敏感的芘磷脂PTS18作为FRET给体。该分子通过酸性亚砜基团牢固嵌入膜磷脂-水界面,不仅消除了生理pH范围内的荧光敏感性,还因其带电基团和长烃链结构增强了水溶性并防止了激基缔合物的形成,为酸敏感通道的研究提供了有力工具。
6.2.2. 单组分 FRET
在探索电压敏感探针的多样性方面,Leow及其团队突破性地引入了基于FRET机制的单组分膜电位检测技术。他们巧妙地选用了Di-4-ANEPPS(,P326),这一在快速压敏染料中广泛应用的分子,作为FRET给体,并搭配DPA(,P335)作为FRET受体。通过创新的跨膜疏水连接体,这两部分被共价键合,形成了一种新颖的“系链双色荧光团淬灭剂(TBFQ)‘电压敏感染料。此类TBFQ电压敏感染料以其前所未有的高电压灵敏度和快速的响应能力脱颖而出,为动作电位的精确检测提供了强有力的工具。
然而,尽管TBFQ电压敏感染料在电压敏感性方面表现出色,但其最佳代表(,P337)却面临一个显著的挑战:荧光量子产率相对较低,仅为1.6%。这一技术瓶颈在一定程度上限制了P337在复杂生物环境中,如体内电活动快速高分辨率成像方面的应用潜力。尽管如此,作为第一代TBFQ电压敏感染料,其在体外环境中的应用,如基于细胞的药物筛选试验中,仍展现出令人满意的亮度表现,为科学研究提供了宝贵的实验手段。
综上所述,Leow团队的研究不仅丰富了电压敏感探针的设计思路,也为未来开发更高性能、更适用于体内成像的电压敏感染料指明了方向。通过不断优化荧光团的选择、连接体的设计以及整体分子结构的调整,有望克服现有TBFQ电压敏感染料的局限性,推动电压敏感探针技术在生物医学研究中的广泛应用。
6.3. 基于 PET 机制的电压传感器
近十年来,科研界聚焦于开发基于光诱导电子转移(PET)原理的传感器,这类传感器旨在兼具迅速响应动力学与对细胞膜电位动态变化的敏锐捕捉能力。在PET传感器架构中,荧光报告分子通过精心设计的“分子桥梁”与富电子淬灭基团紧密相连。荧光报告分子被精确定位在质膜表面,而富电子淬灭基团则巧妙地嵌入至双层膜内部,二者之间的PET效率受到细胞膜电位状态的精细调控。
具体而言,在细胞处于静息状态时,跨膜电场的方向与潜在的电子转移路径形成反平行配置,这一构象极大地促进了淬灭基团通过分子桥梁对激发态荧光团实施高效的PET过程,从而有效淬灭了荧光信号。然而,当细胞发生去极化时,电场方向逆转,抑制了电子的转移路径,导致PET过程受阻,进而释放出被抑制的荧光()。
值得注意的是,PET过程中的电子转移发生在光子吸收后的极短时间内,通常为皮秒至纳秒级,且随后在微秒时间尺度内迅速恢复至基态。尽管这一速度相较于电致变色机制略显迟缓,但在生物体系的动力学时间框架内,其响应速度已足以满足绝大多数生物学研究与应用的需求。
尤为值得一提的是,与电致变色探针相比,PET型探针在灵敏度方面展现出了显著的优势,这一特性使得其在探索细胞电生理活动、神经信号传导等前沿领域具有更为广阔的应用前景。近十年来,科研界聚焦于开发基于光诱导电子转移(PET)原理的传感器,这类传感器旨在兼具迅速响应动力学与对细胞膜电位动态变化的敏锐捕捉能力。在PET传感器架构中,荧光报告分子通过精心设计的“分子桥梁”与富电子淬灭基团紧密相连。荧光报告分子被精确定位在质膜表面,而富电子淬灭基团则巧妙地嵌入至双层膜内部,二者之间的PET效率受到细胞膜电位状态的精细调控。
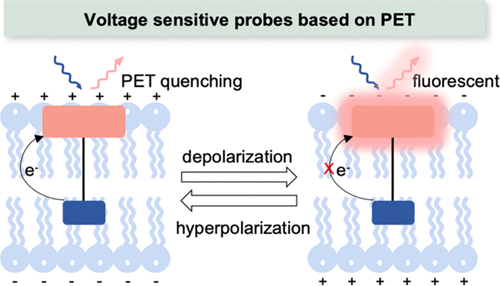
图 112. 基于光诱导电子转移(PET)机制的电压敏感探针。静息电位时,跨膜电场与电子转移方向反平行,导致淬灭剂与激发态荧光团之间产生有效的 PET,从而淬灭其荧光。去极化时,反向电场抑制电子转移,释放荧光。
具体而言,在细胞处于静息状态时,跨膜电场的方向与潜在的电子转移路径形成反平行配置,这一构象极大地促进了淬灭基团通过分子桥梁对激发态荧光团实施高效的PET过程,从而有效淬灭了荧光信号。然而,当细胞发生去极化时,电场方向逆转,抑制了电子的转移路径,导致PET过程受阻,进而释放出被抑制的荧光()。
值得注意的是,PET过程中的电子转移发生在光子吸收后的极短时间内,通常为皮秒至纳秒级,且随后在微秒时间尺度内迅速恢复至基态。尽管这一速度相较于电致变色机制略显迟缓,但在生物体系的动力学时间框架内,其响应速度已足以满足绝大多数生物学研究与应用的需求。
尤为值得一提的是,与电致变色探针相比,PET型探针在灵敏度方面展现出了显著的优势,这一特性使得其在探索细胞电生理活动、神经信号传导等前沿领域具有更为广阔的应用前景。
6.3.1. 荧光素/呫吨衍生物
在2012年,Tsien实验室开创性地融合了电致变色技术与基于荧光共振能量转移(FRET)的电压敏感探针的卓越特性,设计出了VoltageFluor (VF) 染料系列(,P338-P340),该系列染料利用光诱导电子转移(PET)机制精准监测神经元的电压动态。此设计中,负电性的磺基荧光素被巧妙选为荧光报告基团,有效阻止染料内化,确保其在质膜外表面稳定附着。同时,对苯基乙烯(PPV)作为分子导线,而苯胺分子则扮演PET给体的角色,二者协同作用,通过亲脂性分子导线和烷基苯胺分子的深入嵌入,实现了对脂质双分子层的深度渗透。
研究表明,VF2.4.Cl成功地对原代培养的海马神经元进行了染色,并有效检测了其诱发的动作电位()。此外,VF2.1.Cl也被应用于水蛭Retzius细胞自发活动的光学成像中,展现了其广泛的应用潜力()。
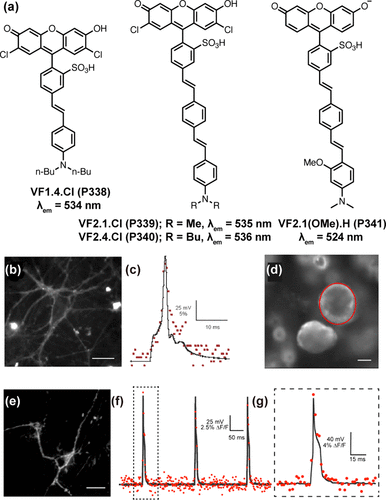
图 113. 电压荧光染料在电位检测中的应用。(a) P338-P341的结构;(b) 用 2 μM VF2.4.Cl染色 15 分钟的大鼠海马神经元显示出强烈的膜染色;(c) VF2.4.Cl在单次试验中检测到大鼠海马神经元的诱发动作电位;(d)使用VF2.1.Cl染料对水蛭 Retzius 细胞的自发活动进行光学成像;(e-g)应用VF2.1(OMe).H(P341) 感应培养神经元的动作电位。
与传统的电致变色及FRET基光学电压传感技术相比,基于PET机制的VF染料在性能上的优势在本研究中得到了详尽阐述,并在表2中进行了系统总结。2015年,该研究团队进一步通过系统的化学取代策略,优化了VF染料的电压灵敏度,成功合成了10种新型结构相关的VoltageFluors。他们创新性地引入(ΔGPET + w)作为衡量PET驱动力的关键参数,基于实验测定的PET给体与受体氧化还原电位,精确计算出各探针的(ΔGPET + w)值。
在这些新型探针中,VF2.1(OMe).H(,P341)脱颖而出,其电压灵敏度达到每100 mV变化下ΔF/F为48%,在HEK细胞、离体大鼠皮质神经元及药用水蛭神经节中的应用中,电压灵敏度较之前版本提升了两倍。最终,研究团队还证实了VF2.1(OMe).H能够高效监测培养神经元的动作电位,且信噪比显著优于先前的VF染料,为神经科学研究提供了更为精准、高效的工具()。
Table 2. Comparison of Voltage Sensitive Dyes Based on Electrochromic, FRET, and PET Mechanisms. Reproduced with Permission from . Copyright 2012 National Academy of Science.
| Attribute | Electrochromic | FRET | PET | | | -- | - | -- | | nature of translocating charge | electron | lipid soluble anion | electron | | fractional charge × fraction of total voltage | ∼0.1 | 0.4–0.6 | ∼0.5 | | Δ energy for 100 mV ΔV | 0.003–0.02 eV | 0.06 eV | 0.05 eV | | extended rigid fluorophore needed? | yes | no | no | | use full ex/em band | no | yes | yes | | sensitivity ΔF/F per mV | low | high | high | | speed | fs | ms–s | ns−μs | | capacitative loading | none | significant | none |
Miler研究团队作为PET基电压敏感荧光探针领域的先驱,显著推动了该技术在电压变化检测方面的研发与应用,特别是他们开创性地将小分子电压指示剂与基因编码元件相结合的策略,为领域发展树立了新的里程碑。鉴于已有详尽综述对此进行了全面梳理,本文不再重复赘述已有内容。
直观展示了基于PET原理的荧光电压探针的性能概览,通过最大荧光发射波长(横轴)与响应灵敏度(纵轴,以每100 mV的ΔF/F表示)进行量化比较。团队在荧光素/荧蒽骨架的基础上,设计并报告了一系列采用荧光素分子线作为电压传感核心结构的荧光电压指示剂。这类基于芴的指示剂,尽管在膜电位变化检测中展现出相对较低的电压灵敏度(在HEK细胞中,每100 mV的ΔF/F约为5-13%,相较于VF2.1.Cl的约27%灵敏度),但其亮度却显著优于其亚苯基-亚乙烯同类物。尤为值得一提的是**fVF 2**(. P342),该探针在细胞内展现出卓越的灵敏度和极高的亮度,能够精准记录神经元及心肌细胞的动作电位波形,同时在心肌细胞应用中显著降低了光毒性。此外,Miler团队还通过在芴分子线骨架中巧妙引入单个乙烯基间隔物,实现了电压灵敏度的大幅提升,最高可达传统芴基电压探针的3.5倍。除了经典的磺基VF染料外,他们还成功开发了首例适用于细胞内成像及膜电位传感的PhosVF2.1.Cl(.P343),该探针以其卓越的膜定位能力、细胞亮度及电压灵敏度(每100 mV达26% ΔF/F)而著称。
在荧光团的创新探索上,团队并未止步于荧光素,而是进一步拓展至砜基碳荧光素染料系列。这类染料相较于传统荧光素,其激发与发射光谱均实现了约50 nm的红移,为电压成像提供了更为灵活的光谱窗口。其中,carboVF2.1(OMe).Cl(. P344)在HEK细胞100 mV去极化条件下的ΔF/F响应更是超过了30%,展现了其作为新一代电压敏感荧光探针的巨大潜力。

图 114. 选定的基于 PET 的荧光电压探针。横轴:最大荧光发射波长。纵轴:响应灵敏度(每 100 mV ΔF/F)。
6.3.2. BODIPY 衍生物
为了验证基于光诱导电子转移(PET)机制的电压传感器的广泛适用性,Miler研究团队创新性地展示了将BODIPY荧光团与苯乙烯分子线核心相结合,成功构建出了一种新型的电压敏感指示剂。在这一系列染料中,有一款尤为引人注目的产品,在HEK细胞中每100 mV电压变化下展现出高达48%的荧光强度变化率(ΔF/F),然而,其相对较低的细胞亮度成为了限制其在细胞电压成像领域广泛应用的一个主要因素。
为了克服这一局限,研究团队进一步开发了BODIPY VF TMmOMe(,P345所示),该染料在保持稳定的33%荧光强度变化率(ΔF/F)的同时,还展现出了优异的信噪比特性,使其成为电压监测中的理想报告分子。尤为重要的是,在长时间成像实验(连续成像60秒)中,TMmOMe展现出了极低的光毒性效应,这是在对多种BODIPY衍生物进行长时间光照测试后得出的结论。在这些严苛的测试条件下,TMmOMe的光稳定性与先前广泛应用的VF2.1.Cl染料相当,进一步巩固了其在电压成像技术中的应用前景。
6.3.3. 红色至近红外发射荧光团
在探索高灵敏度电压传感技术的进程中,尽管VF、fVF及BODIPY-VF染料系列展现出了卓越的电压响应特性,其激发波长范围(480-515 nm)却不幸与多种关键光学工具(如GFP、Oregon Green BAPTA、GCaMP系列Ca²⁺传感器及ChannelRhodopsin2等光遗传学工具)存在显著的重叠,加之蓝光对生物组织的潜在损伤性,促使科学家们寻求更低能量光子需求的解决方案。2015年,Miler研究团队突破性地报道了伯克利跨膜电位红色传感器1(BeRST 1,,P346),该探针基于磺化硅罗丹明(Si-rhodamine)荧光团,不仅具备出色的光稳定性,还实现了远红外至近红外区域的激发与发射,展现出明亮的膜定位荧光()。然而,相较于VF染料,BeRST 1的电压灵敏度(每100 mV下24% ΔF/F)稍显不足,且其合成路径效率较低。次年,团队进一步优化,推出了RhoVR 1(,P347),该探针在HEK细胞中实现了每100 mV高达47%的ΔF/F电压灵敏度,足以精准捕捉培养神经元的动作电位。尽管其发射波长较BeRST 1有所缩短,但仍能与蓝色指示剂(如GCaMP或GFP)兼容,为多色成像技术开辟了新途径。
为进一步拓展电压成像的波长范围至700nm以上,Miler团队开发了近红外膦氧化物罗丹明系列,这些染料展现出多样化的电压灵敏度(HEK细胞中每100 mV下13%至43% ΔF/F),其中poRhoVR 14(,P348)更是成功记录了大鼠海马神经元的自发动作电位,并实现了与ChannelRhodopsin2的全光学电生理调控()。
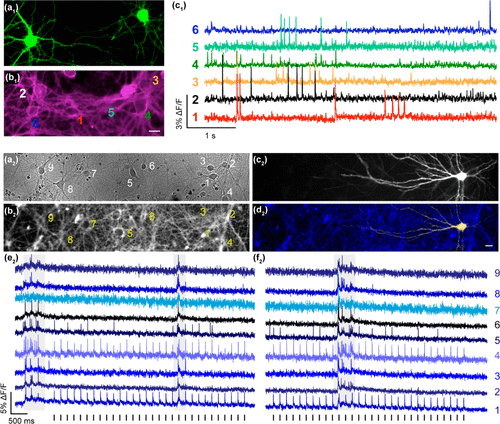
图 115. (a1-c1)带有BeRST 1(P346) 的 GFP 标记细胞的自发电压成像;(a2)-(f2) 使用 poRhoVR 14 (P348) 和 ChR2 的全光学电生理学。
Miler团队的研究并未止步于质膜电压检测,他们还将PET电压传感机制应用于亚细胞器膜电位的监测。2021年,团队推出了SPIRIT RhoVR 1(,P349),作为RhoVR 1(,P347)的改良版本,通过将羧基修饰为乙酰氧甲基(AM)酯,实现了对线粒体电化学电位(ΔΨm)变化的特异性报告。SPIRIT RhoVR 1不仅是首个基于PET机制的线粒体ΔΨm荧光探针,也是首个不依赖于ΔΨm累积过程的可逆荧光探针。该探针进入线粒体后,经酯酶作用去除AM酯,进而锚定于线粒体内膜,可逆地反映ΔΨm的波动()。此外,SPIRIT RhoVR 1还兼容多色成像技术,能够同步观测细胞膜Ca²⁺、质膜电位及线粒体ΔΨm的动态变化。
针对内质网(ER),这一占据细胞膜总面积50-60%的关键细胞器,Miler团队于2022年研发了Ligation Unquenched for Activation and Redistribution rhodamine-based Voltage Reporter(LUnAR RhoVR),首次实现了活细胞内ER管腔膜电位变化的光学监测。该技术基于四嗪淬灭的RhoVR 1(,P350)与反式环辛烯(TCO)共轭神经酰胺(Cer-TCO)的特异性结合,通过点击化学反应在ER内形成共价加合物,从而恢复荧光并实现对ER管腔的靶向电压感应。研究进一步揭示了ER膜电位与质膜电压之间的动态关联。
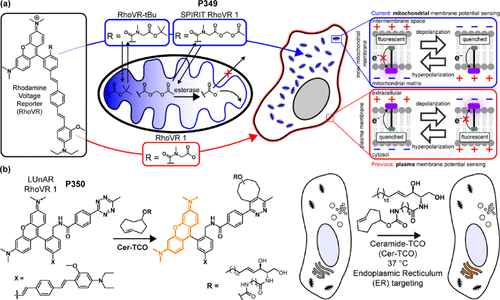
图 116. 测量亚细胞器膜电位的探针。(a)用可渗透的SPIRIT RhoVR 1 (P349) 指示剂成像线粒体膜电位动态;(b)LUnAR RhoVR 1 (P350) 和 cer-TCO的结构,用于将 rhoVRs定向递送至亚细胞器。
6.3.4 d-PET VF 染料
上述提及的VF染料系列均巧妙运用了含苯胺的分子骨架,在受体光诱导电子转移(a-PET)设计中实现了对电压的高灵敏度响应,其中荧光团扮演了电子受体的角色(如左侧所示)。近期,研究团队又取得了突破性进展,他们报道了一种基于给体型光诱导电子转移(d-PET)机制的VF探针(右侧)。在这一新型VF设计中,荧光团转变为电子给体,通过引入电子吸收基团而非传统的电子富集分子线来执行电压成像任务。
这类含有电子吸收基团的VF染料展现出了独特的电压敏感荧光特性,其响应模式与先前设计相反:细胞膜的超级化(Vm超极化)状态现在会导致荧光强度的增加。为了精确调控这一新型响应机制,研究团队综合运用了理论计算与实验验证的方法,成功设计并合成了五种d-PET VF探针。其中,4-NO2-VF(,P351)与2,4-diNO2-VF尤为引人注目,它们均对电压变化敏感,且作为超级化状态的开启指示剂,能够在细胞膜超级化时显著增强荧光信号。
图 117. (a) 荧光素与(左)富电子分子线(表现出受体激发 PET(a-PET))或(右)缺电子分子线(表现出给体激发 PET(d-PET))共轭的前沿分子轨道图;(b)用于活细胞成像的P351的结构。
6.3.5. FRET-PET 级联机制
2019年,Delehanty研究团队及其同事创新性地提出了一种水溶性聚(芴-亚苯基)共轭聚合物电解质FsPFc10(),该聚合物被巧妙地设计为一种高效的荧光共振能量转移(FRET)给体,能够与基于光诱导电子转移(PET)机制的电压敏感染料FluoVolt()结合,形成FRET对,用于实时监测活细胞膜电位的变化()。
图 118. 基于 FRET-PET 级联机制测量膜电位的探针对。(a) 阴离子共轭聚合物 FsPFc10 的分子结构。 (b) 用 FsPFc10 和 FluoVolt 标记的 HEK 293T/17 细胞中膜电位变化的 FRET 成像;(c)FsPFc10(蓝色支线)和FluoVolt与质膜结合的示意图。
FsPFc10的独特之处在于其两亲性设计,使得该聚合物既能溶于水也能嵌入细胞膜中,从而实现了在细胞环境中的稳定存在与功能发挥。在FRET配置下激发时,FsPFc10能够显著放大FluoVolt在溶液中的荧光发射信号,增强幅度高达7倍。这一特性在细胞实验中得到了进一步验证:当使用FsPFc10-FluoVolt FRET对标记细胞,并在细胞膜电位完全去极化的条件下观察时,FluoVolt的荧光发射强度相较于单独使用FluoVolt作为成像探针时,增加了额外的14%(即总增幅达30%,而单一FluoVolt探针增幅仅为16%)。
这一结果表明,基于FRET-PET级联效应的探针系统相比传统的仅依赖PET机制的单一成分探针,在检测细胞膜电位变化方面展现出了更高的灵敏度与更强的信号放大能力,为细胞电生理学研究提供了更为精准和有效的工具。
6.4. 基于 AIE 机制的电压传感器
基于聚集诱导发光(AIE)机制的电压敏感探针通常构建于一个四苯乙烯(TPE)基团(作为典型的AIE发光体)与阳离子基团的共轭结构上,这类探针在生物学应用中主要聚焦于线粒体膜电位(ΔΨm)的追踪。其特异性靶向能力源自阳离子基团与线粒体膜负电荷之间的强静电相互作用,这种相互作用促进了探针在膜电位作用下的聚集,进而增强了荧光强度()。
图 119. 基于聚集诱导发光(AIE)的电压敏感探针,RIR = 限制分子内旋转。
线粒体,作为真核细胞的核心细胞器,不仅负责ATP的合成,还参与多种生理功能的调控。线粒体膜电位作为衡量线粒体功能状态的关键生理指标,与细胞健康、损伤及多种生理过程紧密相关。因此,开发高效、精准的线粒体膜电位监测技术对于生物学研究具有重要意义。尽管传统阳离子荧光染料如TMRE/TMRM和JC-1已被用于ΔΨm的示踪,但这些染料的光稳定性和浓度淬灭问题限制了其广泛应用。近年来,基于AIE机制的电压传感器因其独特的发光特性,逐渐成为线粒体膜电位监测的新宠。
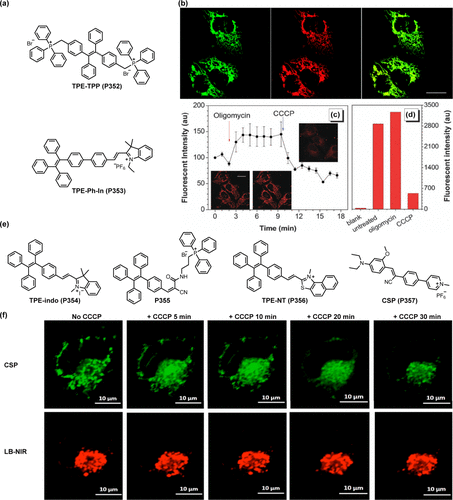
图 120. AIE 发光体在线粒体电位检测中的应用。(a)TPE-TPP(P352) 和TPE-Ph-In(P353) 的结构。 (b) HeLa 细胞的共焦图像;(c) 寡霉素和 CCCP 处理后发射强度的变化;(d)细胞的荧光强度;(e)P354-P357的结构; (f) 在 CCCP诱导下HeLa 细胞的实时荧光图像。
2012年,Tang团队成功开发了TPE-TPP(,P352),一种AIE发光体,用于线粒体成像,但该探针并未展现对膜电位变化的响应性。随后,同一研究小组进一步研发了TPE-Ph-In(,P353),这是一种红色发射的AIE活性线粒体探针,首次实现了对膜电位变化的敏感性,且表现出高度的线粒体选择性和非自淬特性。通过共聚焦显微镜观察,TPE-Ph-In能够实时追踪活细胞中ΔΨm的原位变化(),并显示出作为小鼠精子细胞活力监测荧光探针的潜力。此外,Jiang小组也发现TPE-indo(,P354)这一经典分子在AIE机制下,不仅靶向线粒体,还能通过荧光信号响应ΔΨm的变化。
基于上述机制,科研人员还开发了其他线粒体靶向电压传感器。例如,Li等人报道的P355()通过优化TPP基团与AIE发光体的连接方式,实现了对ΔΨm的选择性检测。同时,为减少生物背景荧光的干扰,Wang团队开发了近红外发射的TPE-NT探针(,P356),其大斯托克斯偏移(>200 nm)和高粘度线粒体膜特异性激活特性,确保了ΔΨm变化的高保真实时监测。
2021年,Dong团队创新性地提出了线粒体-溶酶体迁移探针CSP(,P357),该探针利用近红外固态发射特性,实现了对线粒体膜电位变化的原位实时跟踪。CSP通过甲基吡啶阳离子盐与线粒体膜的静电作用实现特异性聚集,并在膜电位变化时发生线粒体至溶酶体的迁移。通过共聚焦显微镜观察及与商用溶酶体特异性染料(LB-NIR)的共定位分析(),CSP展示了其在活细胞中线粒体与溶酶体间实时可逆迁移中的卓越性能,为细胞器间动态交互研究提供了有力工具。
6.5. 基于其他机制的电压敏感探针
Klymchenko及其团队除了电致变色染料领域的贡献外,还开创性地报道了一种基于激发态分子内质子转移(ESIPT)机制的“快速响应”荧光探针——di-SFA(,P358)。该探针展现出了独特的双重荧光特性,即存在两个明显的发射带,分别对应于其初始激发的正常态(N*)以及ESIPT反应后生成的同分异构体(T*)状态()。这两种发射态由于具有显著的偶极矩差异,使得di-SFA的双发射特性对其周围微环境的极性和电场变化极为敏感。
因此,di-SFA展现出了显著的荧光比率响应特性,在细胞膜电位(Vm)发生变化时,其两个发射带的强度比会发生显著变化。该探针不仅响应速度极快(小于1毫秒),而且灵敏度极高(每100毫伏变化可达15%的响应率)。这一特性使得di-SFA在快速检测脂质囊泡以及人类淋巴母细胞CEM细胞的跨膜电位变化中展现出了巨大的应用潜力。通过利用di-SFA的这一独特性质,研究人员能够更精确地监测和分析生物膜电位的动态变化,为细胞生物学、神经科学以及药物研发等领域的研究提供了有力的工具。
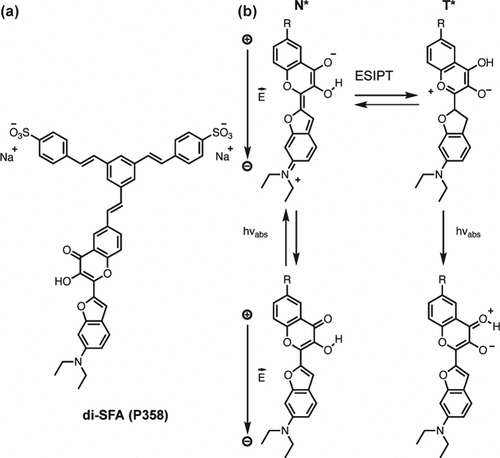
图 121. (a) P358的结构;(b) 作为探针对电场响应机制的di-SFA荧光团中的 ESIPT。
7. 用于机械力探测的荧光探针
在生物学领域内,机械力扮演着至关重要的角色,深刻影响着诸多细胞层面的过程。具体而言,机械力参与调控细胞膜张力的动态平衡,这一机制已被广泛证实能够精细调节细胞形态塑造、囊泡运输以及细胞迁移等多种细胞行为。进一步地,细胞内部的机械传导路径对于细胞增殖与运动能力的维持具有不可或缺的意义。鉴于此,开发能够精准检测和量化生物系统中机械力的化学探针成为了科研界的一大热点与迫切需求。
当前,多数针对机械力敏感的小分子探针设计思路在于利用其在受到局部机械力作用时发生的扭曲、弯曲等形变响应。这些形变过程往往伴随着分子结构的平面化与去平面化转变,进而触发荧光团的光谱特性(如吸收与发射光谱)发生显著变化,从而实现对机械力的间接测量。然而,尽管这一领域展现出巨大的潜力,但截至目前,仅有少数高性能的机械敏感探针被成功研制并成功应用于生命体系的成像研究中。
本节内容旨在深入剖析这些开创性的研究成果,通过详细介绍这些探针的设计原理、工作机制及其在生物成像中的应用实例,旨在为机械敏感探针的未来发展路径提供宝贵的思路与启示。作者相信,随着材料科学、化学合成技术以及生物成像技术的不断进步,机械敏感探针的研发将迎来更加广阔的前景,为揭示生命系统中复杂而精细的机械调控机制提供强有力的工具支持。
7.1. 基于分子内扭转机制的机械敏感荧光探针
在化学与材料科学领域,荧光团中单键的自由旋转往往触发构象的微妙转变,这些构象变化紧密关联于其荧光性质的动态调整。具体而言,当荧光团经历单键旋转导致分子平面化时,通常会促进一个更为广泛的π共轭体系的形成,这一过程直接反映在光谱特征上,即发生红移现象()。值得注意的是,荧光团的平面化过程往往伴随着克服相邻取代基间立体排斥所设置的能量壁垒的挑战。正是这一能量障碍的克服,赋予了荧光团对微观环境中机械力变化的敏感性,使得它们能够作为机械敏感探针。
此类探针的核心机制在于其能够响应并转化机械力为可检测的荧光信号,这一过程依赖于荧光团克服能量障碍以实现平面化的能力。接下来,作者将遵循荧光团类型的逻辑顺序,深入探讨这些机械敏感探针的设计原理、性能表现及其在生物学、材料科学等领域中的潜在应用。
图 122. 基于分子内扭转机制的机械敏感探针。
7.1.1. FliptR 的开发
2012年,Matile研究团队及其合作者创新性地报告了一种基于推拉式四联噻吩骨架的荧光探针,该探针能够敏锐地通过光谱位移监测膜流动性的减弱及膜电位的上升。这一荧光响应机制根植于噻吩骨架在膜张力变化驱动下发生的扭转运动()。实验中,探针1(P359,)被整合至二棕榈酰磷脂酰胆碱(DPPC)构成的大单层囊泡(LUV)体系中。随着温度从25°C升至41°C,囊泡由凝胶态转变为流动态,DPPC的凝胶态引发的张力增加促使P359从非平面构象转变为共面构象,并伴随激发与发射光谱的红移现象。特别地,在55°C至25°C的冷却过程中,P359在DPPC LUV中的最大激发波长显著地从467nm红移至487nm()。相比之下,在DOPC LUV中加入P359后,其激发光谱未展现出明显位移()。值得注意的是,P359在DPPC LUV中经历加热-冷却循环时,其光谱变化表现出良好的可逆性,而在DOPC LUV中则未观察到类似现象(),这强有力地证明了P359作为机械敏感探针的潜力,尽管其量子产率相对较低(0.05),但为后续研究奠定了坚实基础。
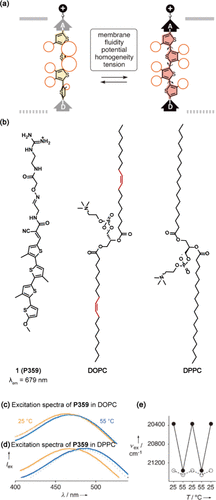
图 123. 用于检测膜张力的机械敏感探针。(a) 推拉探针的结构;(b) 1(P359)、DOPC 和 DPPC 的结构;(c、d)P359 在 DOPC(c)和 DPPC 囊泡 (d)中的激发光谱;(e)P359在 DOPC(○)和 DPPC(●)中加热-冷却循环过程中的激发最大值。
为了进一步优化探针性能,Matile团队通过引入二噻吩及其S,S-二氧化物,扩展了原有探针的π共轭体系,成功开发出首个荧光翻转器2(P360)。P360通过在更新后的母核上添加吸电子基团(醛基)和电子给体基团(亚甲基),显著增强了推拉效应,从而在机械力诱导的构象变化中展现出显著的荧光寿命变化()。在DOPC LUVs中,P360表现出特定的吸收与发射特性;而在DPPC LUVs中,其荧光寿命随膜硬度增加而延长,从2.2 ns(扭曲形态)增至4.3 ns(共面形态)。此外,P360还被应用于由鞘磷脂(SM)/DOPC/胆固醇(CL)组成的巨型单层脂质囊泡(GUVs),通过共聚焦成像技术清晰区分了柔性液相-有序相(Ld)与刚性固相-有序相(So),进一步验证了其机械敏感性。
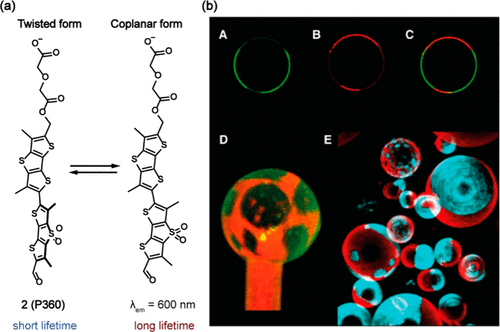
图 124. (a) P360的结构和非平面形态与共平面形态之间的转变; (b)用P360标记的 GUV 图像
鉴于P360在细胞内因活性醛基和酯母核的水解而表现出化学不稳定性,研究团队进行了结构改良,以花菁和三唑衍生物取代原有基团,创制出新型探针P361()。P361对机械力的响应表现为最大激发波长的显著红移,从Ld DPPC中的435nm(扭曲形态)移至So DPPC中的485-525nm(共面形态)。在MDCK细胞膜的观测实验中,P361展现了其高选择性染色质膜(PM)的能力,尽管初期由于化学不稳定性导致的快速细胞内显现(),但优化后的P361则稳定地定位于质膜,显示了其作为生物膜探针的巨大潜力。
图 125. (a) P361的结构;(b) 加入 P360或 P361 2 分钟后 MDCK 细胞的图像。
Roux及其研究团队随后引入了FliptR(P362)()作为一种先进的荧光脂质张力敏感探针,通过荧光寿命成像显微镜(FLIM)技术深入探究其性能。在纯DOPC构成的巨型单层脂质囊泡(GUV)中,P362展现出3.75 ± 0.08 ns的荧光寿命,这主要归因于其分子在膜内的扭曲构象。当GUV的组成调整为DOPC与胆固醇(CL)以60:40比例混合时,由于脂质有序性的增强,P362的荧光寿命延长至5.31 ± 0.12 ns,表明共面构象的贡献增加。进一步地,在由脑鞘磷脂(SM)与CL以70:30比例构成的GUV中,P362的荧光寿命显著增长至6.39 ± 0.09 ns,形成了更为有序的液态相(),这一特性使得P362成为观察HeLa细胞中脂质组分及膜张力变化的理想工具。
图 126. 作为荧光膜张力探针的FliptR(P362)。(a) P362的结构;(b)用P362标记的 GUV 的荧光寿命图像;(c,d)等渗条件(Iso)和高渗冲击(Hyper)后 HeLa 细胞膜的荧光寿命图像;(e)相应的寿命直方图。
利用P362,研究者们能够清晰地描绘出HeLa细胞在等渗条件()与高渗冲击()下膜张力的动态变化。实验结果显示,高渗休克后,P362的平均荧光寿命明显缩短(从约5纳秒缩短至4.2纳秒)(),直接反映了膜张力的下降,验证了P362对膜张力变化的敏感性。

图 127. (a) 探针P363-P365的结构; (b)2(P363)、1(P364) 和3(P365) 的 HeLa Kyoto 细胞图像;(c)高渗休克前和(d)后 HeLa Kyoto 细胞中 P363、P364 和 P365 的 FLIM 图像;(e)P364的平均(红色)和去卷积(灰色)寿命直方图;(f)高斯拟合的P363、P364和P365(从左到右)在高渗冲击前(红色)和后(蓝色)的平均寿命直方图。
P362之所以展现出卓越的机械敏感性,其核心在于其主偶极子的存在。一旦通过结构修饰去除主偶极子,该探针在活细胞中的机械敏感性便不复存在。为了深入探究主偶极子对机械敏感性的关键作用,研究团队合成了三种探针():推拉探针1(P364) 及两种缺失主偶极子的类似物P363和P365。在高渗休克条件下,通过共聚焦激光扫描显微镜(CLSM,)和FLIM成像()分析,发现P364的荧光寿命显著缩短(),这一变化与膜张力的降低紧密相关。相反,缺乏主偶极子的P363和P365则无法响应膜张力的变化()。
此外,分子动力学模拟进一步揭示了P363在有序膜与无序膜中分布模式的差异,以及其二面角与脂质有序度的紧密联系。这些发现不仅巩固了主偶极子在鳍状探针机械敏感性中的核心地位,也强调了鳍状探针作为体内膜张力报告器的实用价值与潜力。
7.1.2. 以感兴趣的膜为目标的探针
为了精准地将探针导向目标膜结构,科研团队基于P362(FliptR)平台,成功研发出Flipper探针10(P366)(),该探针能够特异性地识别并结合膜表面的神经节苷脂。P366利用其硼酸基团与神经节苷脂的羟基形成动态共价硼酸酯键,实现靶向结合。在由液态有序结构域(Ld)与富含神经节苷脂(GM)的液态有序结构域(Lo)混合而成的大单层脂质囊泡(LUV)体系中,随着GM浓度的增加,P366的激发波长发生红移,荧光强度亦随之增强。这一现象归因于P366与GM结合后,从Ld向Lo结构域的迁移,导致探针在更高有序度的环境中平面化程度增加,进而延长了激发波长和荧光强度。
图 128. (a) 10(P366) 和3(P367) 探针的结构;(b-d)HeLa Kyoto 细胞的 CLSM 图像。
另一项有效的膜靶向策略则利用了链霉亲和素作为生物素化探针与其靶标之间的桥梁,实现了多功能连接。P367,一种含有生物素母核的探针,被设计用于监测HeLa细胞中生物素化质膜的动态变化。通过将P367-链霉亲和素-去硫代生物素复合物引入先前与生物素化脂质孵育的HeLa细胞,共聚焦显微图像清晰地展示了P367通过特异性结合膜上生物素化脂质,在质膜上实现了选择性染色()。相比之下,未与生物素化脂质孵育的细胞则未展现出明显的荧光信号()。进一步地,FLIM图像()揭示了在高渗条件下,由于膜张力的降低,HeLa细胞的荧光寿命缩短(从5.50 ns减至4.95 ns),表明P367的短寿命扭曲形式增加。
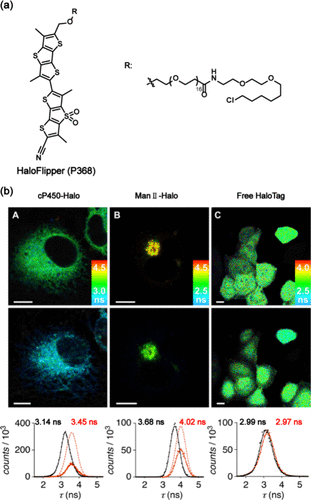
图 129. (a) 探针 HaloFlipper(P368) 的结构。 (b) 等渗(上图)或高渗(中图)条件下细胞的FLIM 图像,以及相应的寿命直方图。
此外,自标记蛋白质作为一种创新的成像工具,被成功应用于特定膜结构的可视化研究中。HaloFlipper(P368)()探针搭载了HaloTag反应弹头,能够共价标记携带有HaloTag的融合蛋白,进而实现对内质网()、高尔基体()及细胞核()等亚细胞器膜张力的实时监测。例如,在高渗环境下,探针的荧光寿命显著下降(从约3.45 ns降至3.14 ns),直接反映了内质网膜张力的降低。
为了精确检测任何感兴趣膜(MOI)中的膜张力变化,研究团队创新性地采用了超分子化学策略,通过基因编码的超分子标签将探针精确定位并可控释放至MOI中。P369()与去硫生物素配体相连后,能够在表达链霉亲和素的细胞器中有效积累。随后,通过加入与链霉亲和素具有更高亲和力的生物素,触发P369从载体上释放并进入MOI,这一过程伴随着细胞整体平均荧光寿命的增加(τav≈3.7 ns,,A-C)。值得注意的是,释放后的探针对膜张力下降的响应表现为荧光寿命的缩短(Δτav ≈ 0.5 ns,),为膜张力变化的实时、精准监测提供了有力支持。
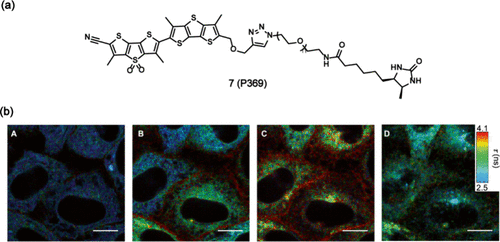
图 130. (a) 探针 7(P369) 的结构;(b) 用P369标记的 HeLa 细胞的 FLIM 图像。
7.1.3. 以细胞器为目标的探针
通过巧妙地将P362(FliptR)与多样化的靶向分子融合,作者成功构建了一系列细胞器靶向膜张力探针(),这些探针借助FLIM成像技术,深刻揭示了细胞器内特异性变化及膜张力的动态波动特性。具体而言,利用探针P370、P371及P372分别实现了FliptR在COS7细胞溶酶体、内质网(ER)及线粒体中的精准定位。在高渗休克处理前后,FLIM分析明确展示了不同细胞器膜张力由高到低的排序规律,依次为质膜、溶酶体、内质网及线粒体(),这一发现为细胞器膜动力学的深入研究提供了重要依据。

图 131. (a) 细胞器靶向膜张力探针的结构; (b) COS-7 细胞的 FLIM 图像;(c)相应寿命直方图。
Matile及其研究团队则通过引入取代的苄胺作为靶向基团,创新性地报道了一种针对早期内质网的高度特异性探针P373()。鉴于P373的pKa值(9.8)显著高于早期内质网的典型pH值(≈6.3),该探针能够稳定滞留于早期内质网中,并通过其独特的机械响应机制——在生命周期内从扭曲形态转变为共面形态——来监测膜张力的变化。在高渗冲击条件下,P373被用于监测HeLa MZ细胞膜张力的动态变化,FLIM图像直观展示了细胞平均荧光寿命由约4.42 ns显著下降至4.21 ns(),进一步验证了其优异的膜张力敏感性。此外,当结合A647-葡聚糖作为晚期内质网时(),研究观察到早期内质体在高渗休克期间发生了显著的寿命变化(约0.4 ns),进一步强调了P373在亚细胞器膜张力研究中的独特价值。
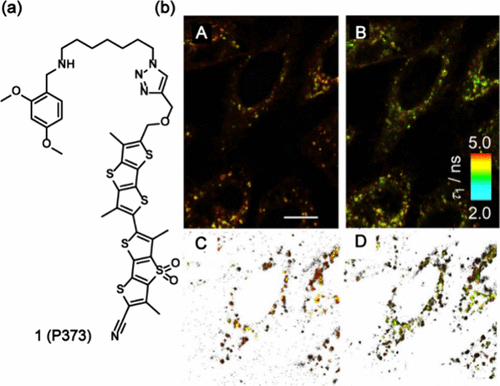
图 132. (a) 内质体靶向膜张力探针1(P373) 的结构; (b) P373 在 HeLa MZ 细胞中的 FLIM 图像和 EE 过滤图像
此外,作者还设计并合成了ER靶向膜张力探针P374,该探针创新性地实现了膜压缩与水合状态的同步监测。P374的设计精髓在于其能够响应机械力诱导的平面化与去平面化过程,产生两种可区分的亮态荧光寿命(分别为3和5纳秒),同时,三氟乙酰基团的水合作用则导致两种暗态的出现,这些暗态可通过荧光寿命频率直方图中的光子计数差异进行辨识()。通过应用P374于HK细胞,作者成功观测到了细胞膜及ER的水合状态变化(),充分证明了该探针在不受MOI性质影响的情况下,对膜张力变化的强烈响应能力,为细胞生物学及材料科学领域的深入研究开辟了新的路径。
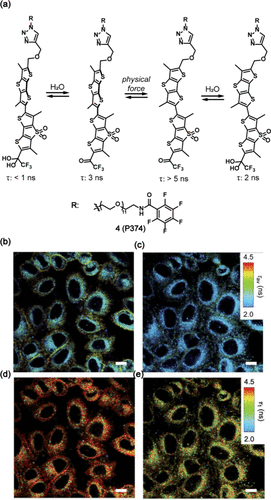
图 133. (a) 用P374标记的 HK 细胞在高渗冲击前(a, c)和后(b, d)的 FLIM 图像
7.1.4. 用于超级分辨率显微镜的探针
Matile及其研究团队进一步研发了一种名为P375的荧光探针,该探针专为活细胞膜的膜张力进行单分子水平的超分辨率成像而设计。此技术的核心在于P375探针能够在亮态酮与暗态水合物、半乙酸酯及半硫代乙酸酯之间实现可逆转换(),这一过程精妙地利用了酮分子内部的扭曲机制,生成了两种亮态,分别对应于探针的扭曲与共面构象;同时,酮的水合作用则诱导形成暗态的半乙酸酯和半硫代乙酸酯。
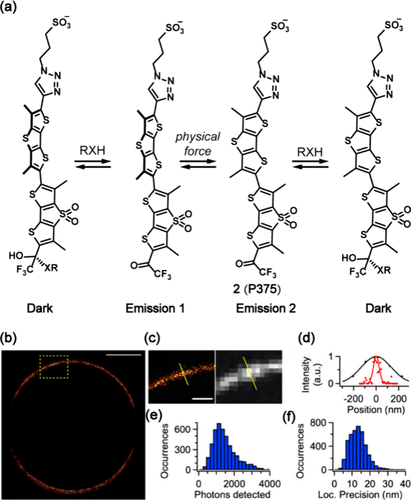
图 134. (a) 2(P375) 在不同条件下的结构变化。(b) GUV 的 PAINT 超分辨率图像。(c)(b)中方框内区域的放大图。(d) (c)中线条所示的 GUV 膜横截面。(e)每帧检测到的P375单分子光子的分布。(f)根据(e)中的光子分布计算出的定位精度分布。
为了实现这一目标,P375被集成于PAINT-SMLM技术中,用于GUV(巨型单层囊泡)的点累积成像。该技术通过对样品表面上的特定点或位置进行多次精准测量,逐步构建出高分辨率的图像。得益于P375的独特性能,成功实现了GUV膜的超分辨率成像(),其成像结果揭示了膜上约40nm横截面的半最大全宽(),极大地提升了膜结构细节的可见度。
在每次定位检测过程中(),P375展现出了优异的定位精度,其值约为15 ± 10 nm(),这一表现与传统PAINT探针相当,但在膜张力成像的特异性和灵敏度方面则更胜一筹。这一研究成果不仅推动了膜生物物理学的发展,也为材料科学和生物化学领域提供了强有力的研究工具。
7.1.5. 可光电裂解的探针
Matile及其研究团队针对探针在应用中常因靶向基团干扰其特性这一挑战,创新性地设计并合成了可光裂解的荧光膜张力探针P376()。P376的核心构成在于一个机械敏感的探针,其上巧妙结合了光活性的-硝基苄基基团与特定的靶向基团。该探针的设计初衷是实现在生物体内对目标膜结构(MOI)的精准靶向,并在365nm光照射下,通过-硝基苄基的光裂解反应,促使探针的鳍状部分得以释放,进而精确标记MOI。
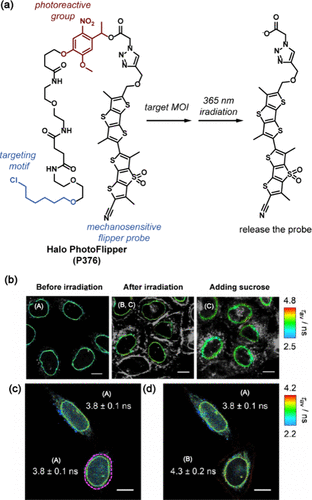
图 135. (a)Halo PhotoFlipper(P376) 的结构; (b) 稳定表达标记有P376的 HaloTag-NLS 的 HK 细胞的屏蔽 FLIM 图像;(c)在标记区域照射后,每个细胞的荧光寿命。
这一光诱导的快速释放机制,赋予了P376在质膜、核包膜及分泌途径等复杂生物环境中进行时空精准控制的能力,且这一过程有效规避了靶向基团可能带来的干扰。如所示,在利用P376对表达HaloTag-NLS的HK细胞进行标记后,通过FLIM成像技术观察到,在光照射作用下,随着探针成功释放并嵌入膜中,核膜的荧光寿命由初始的3.92 ns(,(A))显著提升至4.25 ns(,(B))。进一步地,在高渗压力条件下,该荧光寿命又回落至4.08 ns(,(C)),这一变化直接反映了核膜张力的相应降低。
类似的现象在所示的特定标记区域内也得到了验证,当该区域受到光照时,探针的荧光寿命同样经历了从约3.8 ns至4.3 ns的显著增加(),再次有力证明了P376探针在膜张力监测中的高效性与准确性。这一系列发现不仅加深了作者对细胞膜动态变化的理解,也为材料科学与生物学交叉领域的研究提供了新的有力工具。
7.2. 基于分子内弯曲机制的机械敏感荧光探针
在机械应力的作用下,荧光发色团的构象经历从弯曲非平面态向平面化及去平面化的动态转变。具体而言,机械力诱导的弯曲形式平面化能够促使π共轭体系扩展至更为共面的结构,这一过程在光谱上表现为吸收与发射光谱的红移现象(),其背后涉及克服由键角从稳定向不稳定构型转变所带来的能量壁垒。因此,此类探针能够灵敏地响应于平面与弯曲形态间的转换,进而在光谱上展现出红移或蓝移的特征变化。
图 136. 基于分子内弯曲机制的机械敏感探针。
基于上述机制,Tian等人设计并报道了一种新型机械敏感探针DPAC(P377),该探针采用了N,N′-二取代二氢二苯并[a,c]吩嗪作为核心结构,并融入了给体-受体构型()。由于N,N′-取代基的空间位阻效应,P377在基态时呈现出非平面的扭曲构象。然而,在受到激发后,其“弯曲”形式能够转变为π共轭增强的共面形式,从而触发显著的发射光谱红移(>11,000 cm⁻¹),这一过程体现了构象的平面化耦合变化()。
Matile及其研究团队进一步扩展了这一策略,将此类基于弯曲-非弯曲机制的化合物应用于膜探针的开发()。实验结果显示,随着机械环境从水溶液中的胶束过渡到固体支持膜(So、Ld)及至体膜中的单体状态,探针P378的发射光谱经历了从459 nm(弯曲态)到592 nm(平面态)的显著红移()。利用双光子激发荧光显微镜(TPEFM),研究者们还观察到在不同GUV(巨型单层囊泡)中,随着膜张力由Lo DOPC向SM/CL (7/3)增加,P379(与P378类似)的发射颜色从黄色逐渐转变为绿色(),揭示了膜无序度增加时伴随的探针平面化现象,这是膜张力降低的直接证据。
图 137. (a) DPAC (P377) 的结构; (b) P377 的激发态平面化。
此外,一种推挽式结构的N,N′-二苯基二氢二苯并[a,c]吩嗪探针P380被设计出来,其特点在于引入了甲氧基作为给体和氰基作为受体()。在25°C时,P380在有序DPPC LUV(大型单层脂质囊泡)中展现出较短的发射波长(515 nm),对应于弯曲形态;而当温度升高至55°C,导致膜无序度增加时,其发射波长延长至592 nm,反映出平面化构象的形成()。值得注意的是,尽管两种温度下的激发光谱保持不变,这一结果有力证明了Papillon探针在激发态下能够通过弯曲-非弯曲过程响应机械力的变化。此外,P380虽具有较低的荧光量子产率(小于0.04),但其独特的响应机制为其在生物学领域的应用提供了潜力。
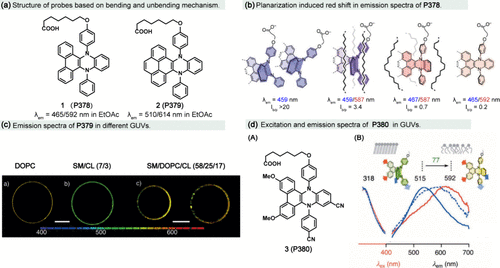
图 138. 基于分子内弯曲机制的机械敏感探针。(a) papillon 探针的结构;(b) 1(P378) 的结构、发射最大值和强度比 Ib/p ;(c) TPEFM 图像(λex = 720 nm);(d) 3(P380) 的结构及归一化激发和发射光谱。
8. 视角
8.1. 极性敏感探针
随着生物学与病理学领域研究的深入,越来越多的证据表明细胞极性异常波动与多种人类疾病的细胞行为紧密相关。这一发现不仅强调了追踪细胞极性对于理解生物过程的重要性,还揭示了局部极性作为疾病诊断与预后评估潜在生物标志物的巨大潜力。迄今为止,科学家们已开发出多种极性敏感探针,这些工具为荧光极性传感器的化学设计策略奠定了坚实基础,使得在不同层次(从亚细胞器如脂滴、蛋白质聚集体到活体模型如斑马鱼、小鼠疾病模型)上精细描绘细胞极性变化成为可能。
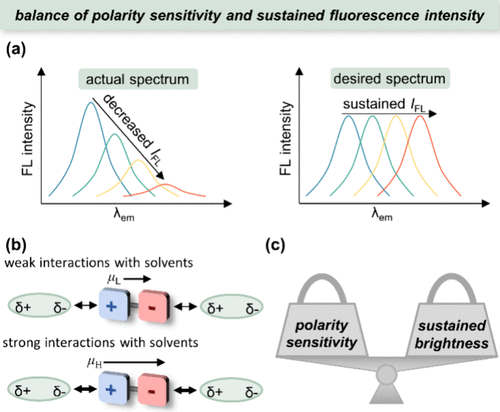
图 139. 平衡极性灵敏度和持续荧光强度。(a) 极性增加时,极性敏感探针的经典荧光光谱和理想荧光光谱。不同极性溶剂中的荧光强度往往与荧光灵敏度之间存在权衡。(b) 激发态电荷转移时偶极矩较大的探针往往会与相邻溶剂分子产生更大的相互作用,从而导致发射波长偏移和量子产率下降。FL 强度 = 荧光强度;μL:低电荷转移态偶极矩;μH:高电荷转移态偶极矩。(c) 理想的极性敏感探针应进行微调,以平衡在非极性溶剂和极性溶剂中的灵敏度和持续亮度。
然而,在新型极性传感器的研发过程中,化学家仍面临多重挑战。首要挑战在于如何在保持荧光强度的同时,提升探针的极性灵敏度。传统上,随着溶剂极性的增加,探针的荧光发射常伴随红移及荧光强度的显著下降,这限制了在高极性环境(如水溶液)中的精确测量。因此,设计能在非极性与极性溶剂中均保持高亮度的探针成为关键。解决这一难题的关键在于深入理解探针基态结构与其激发态行为(特别是电荷转移过程中的激发态偶极矩)之间的复杂关系。通过优化π-共轭核心(如延长π-共轭链、引入杂环取代)、调整电子给体与受体的性质与位置、以及构建刚性结构等策略,可以在一定程度上平衡探针的极性敏感性与荧光稳定性。
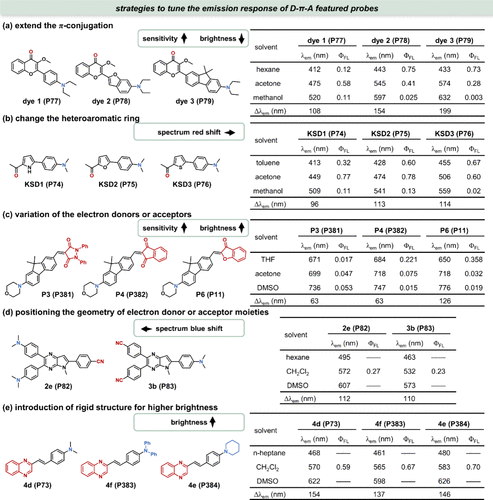
图 140. 调整 D-π-A 特色探针发射响应的化学策略和示例。(a) 扩展类黄酮衍生物的 π-共轭作用可提高灵敏度,但在极性溶剂中亮度较低。(b) 改变 KSD 系列溶变色染料的杂环会导致荧光光谱红移。(c) 适当改变电子受体可同时提高灵敏度和亮度。(d) 电子给体和受体分子的几何位置会影响发射。(λem 是最大发射波长;Δλem 是极性溶剂和非极性溶剂中 λem 的差值;ΦFL = 荧光量子产率。
另一项挑战在于提升探针的光稳定性,以抵御光诱导化学反应导致的荧光漂白。探针在激发状态下发生的电荷分离会产生高反应性的中间体,这些中间体易与周围分子(如氧气、水、生物大分子)发生副反应,从而破坏探针的荧光性能。为应对这一问题,研究人员可借鉴前人的经验,通过替代反应位点、遮蔽正负电荷中心、引入杂原子、抑制分子内电荷转移等策略,减少光诱导化学反应的发生,提高探针的光稳定性。
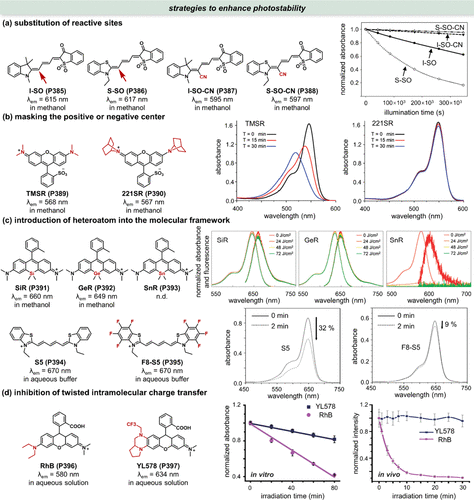
图 141. 提高探针光稳定性的化学策略和实例。(a) 取代 I-SO (P385) 和 S-SO (P387) 的活性氢原子可防止它们被光氧化。(b) 掩蔽正中心可减少其与相邻溶剂分子的相互作用。(c) 在分子框架中引入杂原子也会影响荧光探针对光漂白的耐受性,这可能是由于 LUMO 能级的稳定。同时,适当位点的氟化可使探针不易受辐照过程中产生的活性物种的影响。(d) 抑制扭曲的分子内电荷转移过程可显著改善 RhB (P396) 在体外和体内的光稳定性。
最后,为了确立细胞极性波动与生物信号通路之间的牢固因果关系,需要在转录和蛋白质组水平上对细胞进行全面剖析。尽管已有研究表明细胞极性在特定生物过程中会发生变化,但这些研究多停留在表型观察层面,对于极性变化背后的分子机制及其生物学后果的揭示尚显不足。因此,未来的研究应致力于深入探讨极性波动的内在机制,及其在病变细胞和组织中的病理意义,以期发现新的生物标志物,为疾病诊断与治疗提供新的思路与工具。
8.2. 粘度敏感探针
在过去的数十年间,粘度量化领域见证了荧光探针技术的显著进步,其应用范围已跨越细胞器至活体动物模型,实现了从定性分析到精准定量测量的飞跃。这些探针以其覆盖可见光至近红外区域的多样化发射波长以及兼容单光子与双光子成像模式的特性,构建了一个强大的工具集,为微观至宏观环境粘度的多维度解析提供了可能。尤为关键的是,它们揭示了粘度异常与疾病之间的紧密联系,预示着作为疾病诊断与治疗新靶标的潜力。
然而,粘度敏感探针的进一步发展仍面临诸多技术瓶颈,亟需化学领域的持续创新与突破。当前,大多数粘度传感器的设计依赖于荧光分子转子机制,其灵敏度深受激发态平面构型与暗态扭曲构型间旋转能垒(Ea)的调控。具体而言,转子共轭体系的扩展及可旋转键数量的增加虽能提升旋转能垒,却往往以降低粘度敏感性和荧光强度为代价,反映出灵敏度与亮度间的固有矛盾。为此,O-Pil Kwon等人开创性地提出,通过引入双重旋转基团(如烷氧基与苯基),并优化其旋转能力与电子供能特性,成功设计出PO1至PO9系列探针,相较于单一苯基旋转基团的PH探针,实现了荧光强度与灵敏度的双重提升(),为平衡这一矛盾提供了新思路。
此外,如何在复杂细胞环境中实现粘度特异性响应,同时有效屏蔽极性、pH值及温度等干扰因素,是粘度探针开发的另一重大挑战。比率荧光探针因其自我校准能力,在减少外部干扰方面展现出显著优势,未来研究或将聚焦于基于FRET和TBET机制的比率粘度敏感探针的开发。同时,针对BODIPY荧光团衍生物的研究表明,通过巧妙设计减少电子给体与受体间的相互作用,可促进TICT途径的能量耗散,从而增强粘度选择性。
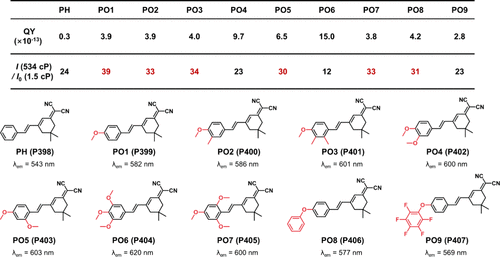
图 142. 带有两个旋转器(一个苯基和一个烷氧基)的荧光分子粘度传感器优化了荧光强度与灵敏度之间的权衡。
光稳定性作为荧光探针性能的另一关键指标,亦需通过化学结构优化加以提升。环糊精等保护策略虽能有效隔绝氧气,却牺牲了粘度敏感性。而氟化、花菁化等精细化学修饰,则在不牺牲敏感性的前提下,显著提高了荧光团的光稳定性。例如,氮杂环丁烷取代罗丹明中的二甲胺基团,不仅增强了抗光漂白能力,还优化了单分子显微镜成像效果,尽管这在一定程度上牺牲了粘度灵敏度。因此,在提升光稳定性与保持粘度敏感性之间寻求最佳平衡点,成为探针设计的重要考量。
综上所述,通过精心设计的化学策略,如双重旋转基团的引入、比率荧光机制的应用以及光稳定性增强的化学修饰,可以开发出既对粘度变化具有高度选择性响应,又具备优异光物理特性的荧光探针,从而更加精准地适应复杂多变的细胞微环境需求。
8.3 pH 敏感探针
在化学与生物学交叉领域,针对生物系统内pH值动态与定量监测的荧光探针技术取得了显著进展。初期研究中,以HPTS及荧光素衍生物为代表的pH探针,为精确测定活体细胞内生理pH范围内的变化提供了有力工具。随后,通过化学修饰手段,特别是优化探针分子的pKa值,极大地拓宽了其检测范围,并提升了信噪比。同时,增强光稳定性、量子产率及亮度等光物理特性的研究亦不断深入,其中,近红外发射特性的探针尤为引人注目,它们能够穿透更深层组织,实现活体或复杂样本中的高效成像。
尽管已取得诸多成就,但适用于近红外区域的pH探针种类仍显匮乏。引入大型π共轭体系虽可改善某些性能,却常伴随光稳定性下降、量子产率降低及生物相容性不佳等问题。花菁衍生物虽被广泛探索,其光稳定性与量子产率瓶颈仍待突破。硅基罗丹明染料虽亮且稳定,但难以直接应用于近红外波段。氮杂-BODIPY作为新兴候选材料,亦面临相似挑战。鉴于pH监测在肿瘤学等生物医学领域的关键作用,开发新型高效近红外pH探针显得尤为重要。
针对特定细胞器内pH变化的精准检测,科研人员已开发出多种探针,能够响应不同刺激与生理过程,实现细胞器内pH的可视化与定量测定。此外,探索能够反映生物大分子(如RNA、DNA及酶)微环境pH变化的新型探针与方法,亦成为当前研究热点。
在活体系统pH成像中,探针浓度不均导致的荧光强度波动是制约定量监测精度的主要因素。为此,比率探针应运而生,通过引入内部参照峰,有效抵消了浓度波动的影响,实现了活体pH的准确测量。然而,其双通道检测特性限制了多路复用成像的应用潜力。相比之下,荧光寿命成像(FLIM)技术不受探针浓度与激发强度影响,无需内部参照,更适用于活体系统中的pH定量测量与多路复用成像。然而,目前适用于FLIM的pH探针种类有限,未来应加大对该领域的研究投入。
此外,现有pH探针的线性响应范围普遍较窄(通常小于3个pH单位),这主要归因于其pKa值附近的线性响应特性。在活细胞环境中,大多数常用pH探针的pKa值集中在4至8之间,难以满足更广泛pH范围监测的需求。因此,开发具有更宽响应范围的新型pH探针,仍是当前及未来研究的重要方向。
8.4. 对温度敏感的探针
总之,在调控从酶催化反应、蛋白质折叠至细胞新陈代谢乃至机体稳态等广泛生物进程中,温度扮演着举足轻重的角色。生物体系中的荧光温度计,凭借其高空间与时间分辨率特性,已成为监测生物热动态变化的有效工具。当前,基于罗丹明、NBD、BODIPY、TPE等多种荧光团母核的荧光温度计,通过ICT/TICT、FRET、PET及AIE等复杂机制,展现出多样的温度响应能力。与单荧光团成像技术相比,采用双波长(不同发射或激发)比率式荧光温度计,为活细胞内局部温度的精确量化提供了更为可靠的手段。此外,荧光寿命成像显微镜(FLIM)技术,其独特的优势在于不依赖于探针浓度及激发光强,亦能精准量化细胞内温度波动。
值得注意的是,多数现有荧光温度计,如罗丹明与NBD衍生物,展现负温度系数特性,即发射强度或寿命随温度上升而减弱。然而,正温度系数荧光探针的开发仍具挑战性,因其有望在高温环境下有效抑制背景干扰。近二十年来,温度敏感材料(如PNIPAM)与荧光染料的共聚设计,因具备正温度响应特性,在荧光温度计领域展现出广阔应用前景。
展望未来,细胞内荧光测温技术的优化方向可聚焦于以下几点:首先,研发具备优异光物理特性的新型荧光团,如增强光稳定性、提升量子产率并拓宽温度响应范围;其次,开发低毒或无毒的生物相容性荧光团,以减小对生物体的潜在危害;再者,开发高灵敏度的近红外荧光探针,用于深层组织及活体动物的温度监测,同时需克服大共轭体系带来的溶解性问题;此外,鉴于多数现有温度计存在多参数敏感性,开发仅对温度敏感的单一响应温度计成为关键任务;最后,扩展荧光温度计的应用范围至其他亚细胞器,通过细胞器靶向策略,结合多通道成像技术,实现不同细胞器内温度的同步监测。同时,深入探究温度参数在细胞事件中的具体作用机制,对于理解生物过程的温度调控具有重要意义。
8.5. 电压敏感探针
总之,电压敏感探针在神经科学研究领域引发了革命性的变革,它们通过可视化膜电位的变化,为直接、实时地监测细胞、组织乃至整个生物体的电活动提供了强有力的工具。这些探针依据不同的物理与化学机制运作,包括但不限于电致变色效应、荧光共振能量转移(FRET)、光诱导电子转移(PET)、聚集诱导发光(AIE)以及激发态分子内质子转移(ESIPT)。
在探针的发展历程中,早期的电致变色染料尽管响应迅速,但灵敏度有限。随后,基于FRET的电压敏感探针展现了卓越的灵敏度,但其反应动力学相对迟缓。而PET基电压敏感探针则巧妙地平衡了快速反应动力学与灵敏监测膜电位动态的能力,特别是在Miller等人的研究中得到了显著推进。然而,值得注意的是,AIE发光剂在监测细胞膜电位以外的应用场景,如等离子体膜或其他细胞器膜电位方面,尚存局限。鉴于AIE的独特性质,未来亟需开发更多针对膜电位检测的AIE探针。
尽管电压敏感探针展现出巨大的应用潜力,但仍需克服一系列挑战。首先,提升探针的快速反应动力学与信噪比,以实现对微弱电压变化的精确捕捉,并增强在深层组织中的成像深度与清晰度。其次,近红外窗口工作的电压敏感探针稀缺,开发具备高灵敏度且能在近红外区域工作的荧光探针是当前研究的重要方向。再者,基于PET的电压敏感探针在双波长比率测量领域的应用尚待探索,这一领域的发展有望减少探针浓度与激发强度变化对测量结果的影响。
此外,当前多数膜电位荧光指示剂的应用主要集中于质膜电位的监测,对于细胞内各种细胞器膜电位的成像或多通道成像,仍有广阔的探索空间。这一问题可通过将荧光探针与特异性标记蛋白及细胞器膜蛋白融合的策略加以解决。最后,将电压敏感探针与光遗传学等先进成像技术相结合,有望揭示电活动与其他细胞过程之间的复杂相互作用,为深入理解神经动态提供新的视角与工具。
8.6. 机械敏感探针
在生物科学领域,开发能够可视化生物系统内机械力作用的小分子荧光探针,相较于其他生物探针而言,仍是一项极具挑战性的科研任务。Flipper衍生物因其独特的性质——在机械压缩作用下能引发分子平面化及极化现象,并伴随光谱特性与荧光寿命的显著变化,而被视为活体细胞膜张力监测的理想候选。这些探针通过整合多样化的靶标策略,如细胞器特异性靶标基团及标签蛋白的融合,实现了对特定膜结构张力的高效、精准检测,其应用潜力已引起学术界的广泛兴趣,并有多篇综述文献对此进行了深入探讨。(531-533)
尽管Flipper衍生物类探针在膜张力可视化方面展现出巨大潜力,但其信噪比性能仍有待进一步优化,以确保更高精度的测量结果。分子内弯曲机制为提升此类探针的性能提供了新颖的思路与机会,然而,目前探针的响应特性与信噪比水平尚需通过深入研究加以改进。鉴于生物系统中机械敏感探针的稀缺性,从材料科学领域广泛存在的机械敏感分子中汲取灵感与机制,成为推动该领域发展的关键途径。通过跨学科合作,整合化学、材料学及生物学的最新研究成果,有望开发出性能更优、应用更广的机械力可视化探针,为生物力学研究开辟新的篇章。
8.7. 应用说明
生物系统内部蕴含着一个错综复杂的微观环境,其中多种物理特性如粘度、极性、pH值等相互交织,共同作用于系统内部。值得注意的是,许多荧光探针由于其设计的敏感性,可能不仅限于对单一物理特性的响应,而是同时对多种特性产生反馈,这无疑增加了数据分析与结论推导的复杂性。以TICT(Twisted Intramolecular Charge Transfer)探针为例,它们虽以粘度为主要响应对象,但其特有的不对称D-A(Donor-Acceptor)结构亦赋予了它们对极性变化的敏感性。因此,许多粘度敏感的TICT探针在实际应用中往往展现出对粘度和极性双重特性的响应,导致发射光谱信号的变化变得复杂。具体而言,粘度主要影响量子产率而不改变发射波长,而极性则能同时影响这两者。
在极性与粘度双敏感探针的设计中,二烷基胺基团常作为D-A结构中的电子给体,扮演着重要角色。此外,这类基团在酸性pH条件下易发生质子化,其工作机制与常见的pH传感探针存在相似之处,但具体表现在pKa值的差异上。
鉴于此,对于荧光探针的开发与应用研究人员而言,需高度重视上述现象对实验结果的影响。为确保分析结果的特异性和结论的可靠性,建议采取以下谨慎措施:首先,开发人员和用户应全面评估探针在不同物理条件下的响应特性,包括但不限于粘度、极性、pH值等,以明确其响应图谱。例如,通过设计并测试粘度探针的结构变体,可以详细探究其对粘度和极性的敏感度,为特定应用场景下的探针选择提供科学依据。其次,应积极探索并创新荧光探针的设计思路,旨在开发出对特定物理特性具有高度特异性的探针,同时有效抑制或最小化对其他非目标特性的响应。这可能需要引入新型荧光团母核、优化传感机制或采用先进的分子设计策略,以实现更为精准和高效的生物系统监测。