专注于生物医学应用的那些近红外二区小分子
摘要
人体器官功能的最佳状态是维系复杂生理平衡与整体健康的核心基石。然而,一系列内外因素,涵盖固有的生理变异及外部环境的影响,可能显著扰乱器官功能,引发诸如中风、癫痫、肝细胞癌、肾功能损害、心肌梗死、肺炎、结直肠癌及血栓形成等严重疾病,这些病理状态削弱了器官效能,乃至导致功能丧失。因此,在疾病演进与治疗过程中,实现对器官功能的无创且持续监测,对于深入理解病理生理机制及评估治疗效果具有不可估量的价值。
近年来,荧光探针技术在体内成像领域崭露头角,以其独特的优势满足了实时监测的严苛需求,同时保持了生理过程的自然流畅。荧光探针以其快速响应、高灵敏度、强选择性、非侵入性成像能力及实时高分辨率时空成像等特点,在生物医学研究中展现出巨大潜力。依据发射波长的不同,荧光探针大致可划分为可见光区、近红外一区(NIR-I,700-900 nm)及近红外二区(NIR-II,1000-1700 nm)三大类。
尤为值得注意的是,相较于NIR-I荧光成像,NIR-II荧光成像凭借其更低的组织光散射、更少的生物自发荧光干扰,实现了更深的组织穿透力,极大地拓宽了生物成像的应用边界,为临床提供了更为精准、高效的诊断与治疗工具,尤其适用于早期疾病的干预与管理。
鉴于此,这个系列聚焦于NIR-II有机荧光探针,依据其在不同病变器官(如肿瘤、血管系统、脑部、淋巴结、肝脏、肺部、肾脏及胃肠道等)中的成像能力进行分类,并全面梳理了其在各类疾病诊断与治疗中的生物学应用实例。同时,我们也深入剖析了NIR-II有机荧光探针的现存局限,并展望了其在生物医学研究及药物开发领域的广阔前景,以期为推动该领域的进一步发展贡献力量。
1. 引言
近数十年间,恶性肿瘤的发病率持续攀升,其高复发率和低生存率已成为全球公共卫生领域的重大难题,对人类健康构成了严峻挑战。在此背景下,探索高效且低副作用的癌症诊断与治疗策略成为科研界亟待攻克的难关。当前主流的肿瘤治疗手段,诸如手术切除与化学疗法,虽能在一定程度上控制病情,却不可避免地伴随着机体损伤与诸多副作用,加之微小肿瘤转移灶的难以彻底清除,致使肿瘤复发成为常态。
尤为值得关注的是,大脑作为人体中枢神经系统的核心,负责调控语言、记忆、认知及情感等关键功能,其任何程度的损伤都可能对个体的生命质量与生存状态造成灾难性影响,乃至危及生命。图1直观展示了多种常见的脑部疾病,其中神经退行性疾病(阿尔茨海默病、癫痫、中风等)尤为突出,它们以认知能力的持续性、渐进性衰退为特征,最终可能导致记忆丧失与功能衰退。
此外,外部环境的多变因素与免疫系统功能的缺陷,还广泛作用于人体各个系统,诱发包括动脉粥样硬化、肝损伤、急性肾损伤(AKI)、淋巴水肿及肿瘤淋巴转移、心肌损伤、肺结核与肿瘤肺转移、结肠癌、胃炎、骨肉瘤(OS)、关节炎等在内的多种疾病,这些疾病跨越多个器官系统,影响深远。
鉴于此,发展一种能够实现无创、实时、高时空分辨率成像监测的技术,对于深入探究上述疾病的病理机制、精准评估治疗效果及优化治疗方案具有不可估量的价值。这一技术的实现,将为临床医学带来革命性的变革,推动疾病诊断与治疗迈向更加精准、高效的未来。
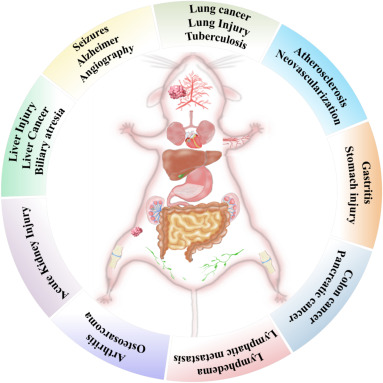
图1. 不同器官及相关疾病
相较于其他临床成像技术,如磁共振成像(MRI)、计算机断层扫描(CT)、光声成像(PAI)及超声成像等,荧光成像技术凭借其卓越的灵敏度、高度的特异性、无创特性、无电离辐射危害及实时高空间分辨率成像能力,在生物医学领域占据了举足轻重的地位。在众多荧光成像造影剂之中,包括量子点、掺稀土纳米粒子、荧光蛋白及有机小分子等,有机荧光小分子以其灵活可调的化学结构、优异的生物相容性、较低的生物安全风险以及高效的代谢能力脱颖而出,展现出了巨大的生物医学应用前景及临床转化潜力。
自吲哚菁绿(ICG)被美国食品和药物管理局(FDA)批准为首个近红外外源性荧光探针临床造影剂以来,基于近红外-I区域的有机荧光探针在生物光子成像技术中的应用便获得了广泛的关注与迅猛发展。然而,尽管近红外荧光成像研究取得了显著进展,但近红外-I区(700-900 nm)荧光探针的短发射时间及有限的穿透深度(1~3毫米)限制了其在深部器官成像中的应用。
相比之下,近红外-II窗口(1000-1700 nm)荧光成像技术展现出了非凡的潜力。由于此波段内光子散射和生物组织自发荧光的显著降低,使得光在组织中的穿透深度大幅提升至约5-20毫米,并伴随着更高的时空分辨率。因此,近红外-II有机荧光探针成为了满足深层组织荧光成像需求的理想选择,为生物医学成像技术开辟了新的篇章。
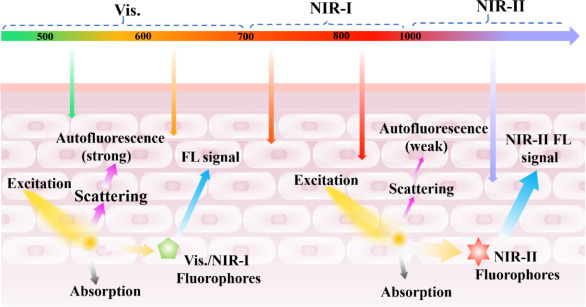
图2. 生物组织中不同波长光的穿透深度及传播
当前,医疗领域面临的一大挑战在于治疗与诊断技术之间的显著割裂,这限制了疾病管理的效率与效果。值得庆幸的是,新兴的近红外二区(NIR-II)有机小分子荧光探针通过整合诊断与治疗模式,为疾病的早期识别与干预开辟了新途径,展现出巨大的应用潜力。具体而言,NIR-II 有机分子中π-共轭体系的扩展虽可能导致荧光强度因辐射跃迁减弱,但非辐射衰变过程伴随的热效应预示着其作为光热治疗剂的潜在价值。此外,得益于有机小分子结构的可调性,它们能够灵活地与功能分子结合,实现更为精准和高效的诊断与治疗协同效应,从而微妙地平衡了NIR-II荧光成像(FLI)与治疗性能之间的关系。
推动NIR-II FLI技术跨越“近红外-I窗口”至“近红外-II窗口”的关键在于兼容仪器的快速发展。近年来,NIR-II荧光探针的设计取得了显著进展,依据其化学结构可分为花菁染料、BODIPY衍生物、苯并双噻二唑(BBTD)基小分子、罗丹明染料及二酮吡咯并吡咯(DPP)衍生物等类别。这些探针凭借其卓越性能,已广泛应用于生物体内目标病变组织的NIR-II FLI观测中,为疾病的精准识别提供了有力工具。
众多研究聚焦于NIR-II荧光成像技术的各个方面,包括荧光材料的多元化分类(涵盖无机纳米结构、荧光蛋白及分子荧光团)、成像机制的深入探索、荧光探针构建策略的创新(如量子产率提升、受体配体工程、聚集诱导发光荧光团的设计等)、多模态成像技术的发展(如荧光/光声成像)以及成像模式的拓展(从解剖成像到病理生理、分子成像乃至光疗与手术导航)。特别是在癌症治疗与脑成像等领域,NIR-II荧光探针的光疗作用更是得到了广泛关注。
2. 近红外-II 有机荧光探针的分类和设计策略
基于染料分子化学结构的差异性,当前文献所报道的近红外二区(NIR-II)有机分子可被细致归类为几大类,包括但不限于苯并二噻二唑(BBTD)基小分子、花菁染料、呫吨染料以及BODIPY(硼二吡咯亚甲基)衍生物等。这些不同类型的化学结构为NIR-II荧光探针的定制合成提供了多样化的基础,并赋予了它们独特的物理化学性质与构建路径。
近年来,科研界聚焦于如何通过精确调控NIR-II荧光探针的化学结构来优化其光学性能,成为了一个活跃的研究领域。这一努力旨在通过分子设计与修饰,实现荧光分子在荧光量子产率、化学稳定性及水溶性等方面的显著提升。经过精心设计的荧光探针不仅能够穿透更深的组织层,实现器官内部的高分辨率荧光成像,还为复杂疾病的早期诊断与精准治疗提供了强有力的工具。这些进展不仅推动了生物医学成像技术的发展,也为材料科学与化学合成领域带来了新的挑战与机遇。
2.1. 基于苯并二噻二唑(BBTD)的小分子化合物
如图3所示,苯并[1,2-c:4,5-c']双噻二唑(BBTD)基团作为一类独特的荧光团,因其卓越的光物理特性,包括出色的光稳定性、高消光系数、长发射波长,以及可调控的化学结构和固有的分子内电荷转移(ICT)效应,在构建对称型近红外二区(NIR-II)D-A-D荧光分子方面取得了显著进展。D-A-D结构的设计核心在于电子供体(D)、受体(A)以及π桥段的巧妙结合,其中BBTD因其强大的电子亲和力和较低的能隙,常被用作核心受体单元。π桥则多由噻吩衍生物构成,共同构成了具有大共轭体系的荧光分子。
通过调整供体和受体的强度,可以灵活调控BBTD染料的能隙,进而优化其光学性能。增加受体数量可促使荧光行为从聚集导致的淬灭(ACQ)转变为聚集诱导发光(AIE),并显著提升摩尔吸收系数(ε)。此外,在BBTD受体单元中引入替代元素如硒(Se)替代硫(S),可有效减小能隙,导致D-A-D染料的发射波长发生红移,同时增强荧光性能。

图 3. 基于 BBTD 的 NIR-II 有机荧光染料及其衍生物。
电子受体基团的选择对BBTD衍生物的光谱特性具有重要影响。增强供体的电子供体能力不仅可实现发射波长的红移,还能提升吸收强度。值得注意的是,具有扭曲分子结构的NIR-II荧光分子在极性溶剂中展现出独特的激发态电子转移特性,导致发射波长进一步延长。同时,缩短D-A间距等策略也被证实能有效促进发射峰的红移。
然而,大π-共轭D-A-D染料在水溶液中易因分子间π-π堆叠而发生ACQ,导致荧光淬灭。相比之下,具有扭曲结构的AIE分子则展现出更高的量子产率(QY)。因此,将AIE活性分子引入设计中,可有效抑制ACQ现象。但需注意,扭曲结构可能会破坏分子共轭平面,降低摩尔消光系数,进而影响吸收性能。因此,合理设计结合扭曲AIE结构与π-π共轭体系的分子,是开发高吸收、高QY NIR-II荧光团的关键策略。
此外,在D-A-D骨架中引入屏蔽基团(如二烷氧基改性苯或芴),构建S-D-A-D-S型染料,也是一种有效的性能优化方法。这些屏蔽基团能够防止骨架链的聚集,减少水分子对荧光的淬灭作用,从而进一步提升量子产率(QY)。
2.2. 聚甲基染料
聚甲基染料,作为一种独特的分子结构,由一条聚合的亚甲基主链及两个功能化的末端基团构成,其中一端为带正电的杂环作为电子受体,另一端则为电子供体杂环。如图4所示,这种分子设计在受到激发时,其中心C=C双键会经历伸长与旋转,破坏了主链的共轭对称性,进而触发分子内电荷转移(ICT)过程,产生明亮的近红外二区(NIR-II)荧光发射。聚甲基染料因其高吸收系数和可调的化学结构,成为优化光学特性的理想平台。
为了将聚合染料的光谱特性推向NIR-II区域,研究者们采取了多种策略,包括延长亚甲基桥的共轭长度或调整末端基团的电子特性(如通过引入更强的电子给体与受体杂环)。其中,延长共轭链是经典的红移方法,它能增加离域π电子的数量,减小HOMO-LUMO能隙,从而延长染料的最大吸收与发射波长。然而,这一过程也可能伴随着量子产率(QY)的下降、稳定性降低以及电子离域性的不对称损失。
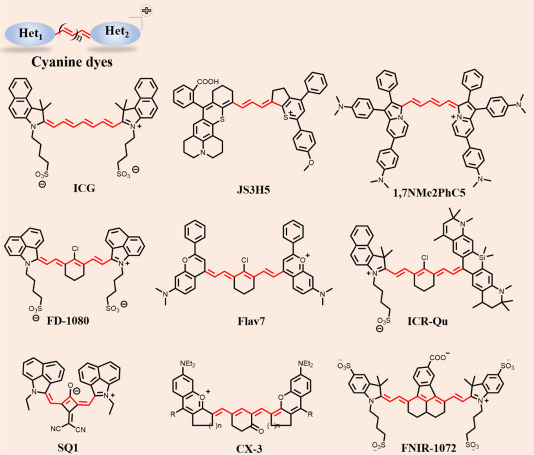
图 4. 基于聚亚甲基的 NIR-II 有机荧光小分子及其衍生物。
此外,对聚甲基链进行结构修饰,如引入环己烯基或环戊基等,能显著改变吸收光谱的位置。杂环的进一步改性,如扩展其共轭体系或添加电子供体基团,同样是调节NIR-II发射的有效手段。值得注意的是,将杂环中的氧原子(强电负性)替换为其他电负性较弱的元素,虽能引发吸收光谱的移动,但重原子效应可能加剧系统间相互作用,影响QY。
在生物应用中,聚甲基染料的稳定性和抗光漂白性至关重要。光氧化反应易导致分子与氧气反应,生成活性氧(ROS),进而氧化裂解亚甲基链,影响其性能,尤其在长波长发射时更为显著。为克服这一问题,研究者们采取了多种策略,如引入氟(F)等拉电子基团和立体阻碍基团,以降低电子密度,减少C=C键的氧化风险。同时,将染料封装于聚合物基质中的超分子策略,通过增强分子刚性,显著提升了QY。
2.3. 氧杂蒽染料
呫吨类染料,典型代表如罗丹明、荧光素及其多种衍生物(如图5所示),以其卓越的性能著称,包括高摩尔吸光系数、杰出的光稳定性、低细胞毒性、优异的荧光量子产率(QY)、良好的官能化潜力以及可调谐的发光性质。长期以来,科研人员致力于探索将呫吨染料的光吸收与发射波长拓展至近红外I区(NIR-I)乃至更远的NIR-II区的方法。
一种经典且有效的策略是通过增强氧杂蒽染料的π-共轭体系来实现发射波长的红移,这一过程被称为π-扩展法。具体而言,将萘环、苯乙烯等基团融入氧杂蒽骨架中,并扩大其π-共轭范围,能够成功设计出新型近红外I/II区发射的氧杂蒽染料。然而,这种共轭体系的扩展也伴随着挑战,如水溶性下降、QY降低以及可能发生的聚集诱导淬灭(ACQ)现象。
为应对上述挑战,研究者们进行了深入探索,并提出了一系列解决方案。通过引入两亲性基团,可以有效提升染料的水溶性和脂溶性,从而改善其在生物体系中的应用性能。此外,增强分子结构的平面刚性也是一种有效策略,如在氧杂蒽醌骨架上引入茱利定环或四氢喹啉(THQ)等刚性取代基,可以限制氮原子周围的旋转,抑制扭曲分子内电荷转移(TICT)效应,进而提升QY并显著增加斯托克斯位移。
另一种制备近红外Xanthene染料的常见方法是利用元素取代策略。具体而言,将氧杂蒽支架中10号位的中心氧原子替换为硫(S)、硒(Se)、磷(P)、硅(Si)/锗(Ge)/锡(Sn)/碲(Te)等元素,或者引入PO2、POR、SO2等官能团,均能有效调节染料的光谱性质,实现发射波长的红移及光学性能的优化。这些策略不仅丰富了Xanthene染料的种类,也为其在生物医学成像、材料科学等领域的应用提供了更为广阔的空间。
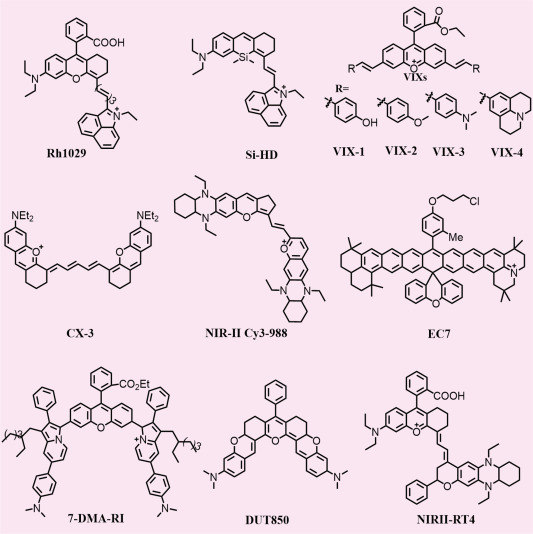
图 5. Xanthene NIR-II 有机荧光分子及其衍生物。
2.4. BODIPY 衍生物
BODIPY(氟硼二吡咯)衍生物凭借其可调节的荧光量子产率(QY)、卓越的光稳定性、低细胞毒性以及高摩尔消光系数等优异特性,成为了化学、材料科学及生物学领域中备受瞩目的多功能染料。这些特性赋予了BODIPY衍生物在生物传感与成像、光动力/光热疗法制剂以及太阳能电池技术等多个前沿领域的广泛应用潜力。
如图6所示,根据化学结构特征,BODIPY染料主要分为传统型与氮杂型两大类。氮杂BODIPY染料通过中心碳原子的氮取代,显著降低了其能隙,进而实现了更长波长的近红外吸收与发射。此外,BODIPY分子的第2与第6位因其富电子特性,易受到卤化等亲电反应的影响。为克服这一限制,科研人员通过在第2、6位引入亲水基团以及在硼原子上附加铵基等手段,有效提升了氮杂BODIPY染料的水溶性,避免了复杂的封装或PEG改性步骤。
另一方面,BODIPY染料的第3与第5位因其相对缺电子特性,为甲基取代基与苯甲醛衍生物之间的醛缩反应提供了有利条件,进而实现了π系统的扩展。更为重要的是,BODIPY的中心结构作为一种缺电子受体,能够通过与电子捐赠基团(D)的结合,构建出“D-π-A-π-D”型分子结构。这种设计促进了分子内电荷转移(ICT)过程,使得BODIPY染料能够在近红外-II区域展现出显著的发光性能。
鉴于BODIPY染料拥有丰富的修饰位点,研究人员能够通过在其核心结构中引入多样化的官能团,赋予其不同的功能特性。除了作为高效的近红外荧光探针外,BODIPY染料还可进一步发展为集光声成像(PAI)、光动力疗法(PDT)及光热疗法(PTT)于一体的治疗诊断平台。在PDT中,BODIPY染料作为光敏剂,能够吸收光能并激活产生活性氧(ROS),进而诱导肿瘤细胞或其他病变细胞的死亡。而在PTT过程中,BODIPY染料则能将吸收的近红外光转换为热能,通过局部加热实现对肿瘤细胞的精准破坏。因此,基于BODIPY染料的多功能化改性,为疾病的早期诊断、精确定位及有效治疗提供了创新性的解决方案与潜在价值。
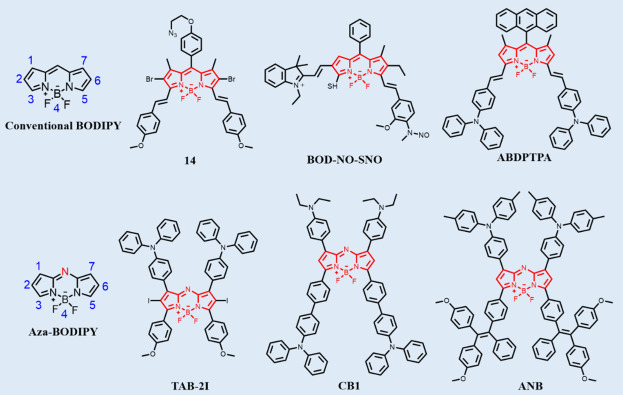
图 6. BODIPY NIR - II 有机荧光分子及其衍生物。
3. 用于血管的近红外-II 有机荧光探针
血管功能障碍,这一复杂病理现象,与血管结构的异常、血流动力学紊乱及生物标志物表达的失调密切相关,是多种疾病发生发展的重要诱因。得益于其卓越的空间分辨率与穿透深度,近红外二区荧光成像(NIR-II FLI)技术为实时、精准地剖析血管解剖结构、血流动力学状态及功能特性提供了强有力的工具,显著促进了血管异常病变的早期诊断与疗效评估进程。
近期,Tang研究团队于2023年成功研发了基于聚集诱导发光(AIE)效应的NIR-II荧光分子(TPAQ、TPATQ及DPITQ,如图7所示),通过精细调控电子供体策略,实现了对细胞膜与线粒体的双重靶向,为肿瘤治疗开辟了新途径。该系列分子中,DPITQ被巧妙地封装于生物相容性优异的DSPE-MPEG2000共聚物纳米颗粒内,实现了在模型小鼠体内的高效血管NIR-II荧光标记,尤其是腹腔内血管成像质量的显著提升。
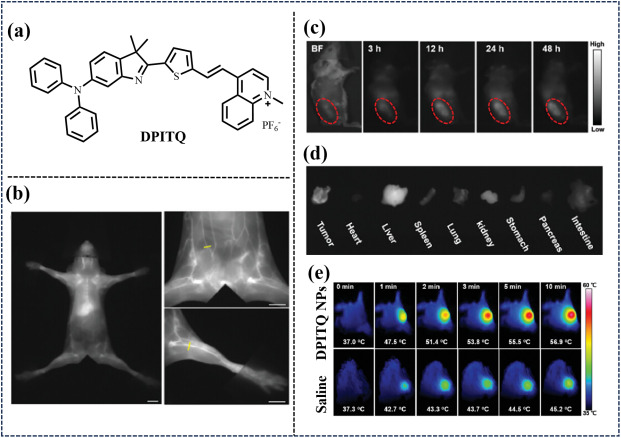
图 7:(a)探针DPITQ的结构。(b)使用DPITQ NPs对全身血管/腹部/股动脉进行近红外-II荧光成像。(c) 处理DPITQ NPs后 4 只 T1 肿瘤小鼠的近红外-II荧光成像。(d) 注射 DPITQ NPs 48 小时后,4 只 T1 异种移植小鼠不同器官的近红外-II FLI。(e) 使用DPITQ NPs 或生理盐水的模型小鼠的光热图像。
与此同时,Liu研究小组聚焦于动脉粥样硬化(AS)这一慢性动脉炎症疾病,设计了一系列具有高光稳定性与大斯托克斯位移的NIR-II荧光染料。这些染料在808纳米激光的精确控制下,能够释放一氧化氮(NO),有效促进AS斑块的脂质清除、炎症缓解、内皮细胞再生及血栓形成抑制。特别是RBT-NH染料经DSPE-mPEG5000包封后形成的RBT3-NO-PEG纳米材料,进一步结合血小板伪装策略(RBT3-NO-PEG@PM),实现了深层组织的NO精准递送与释放。
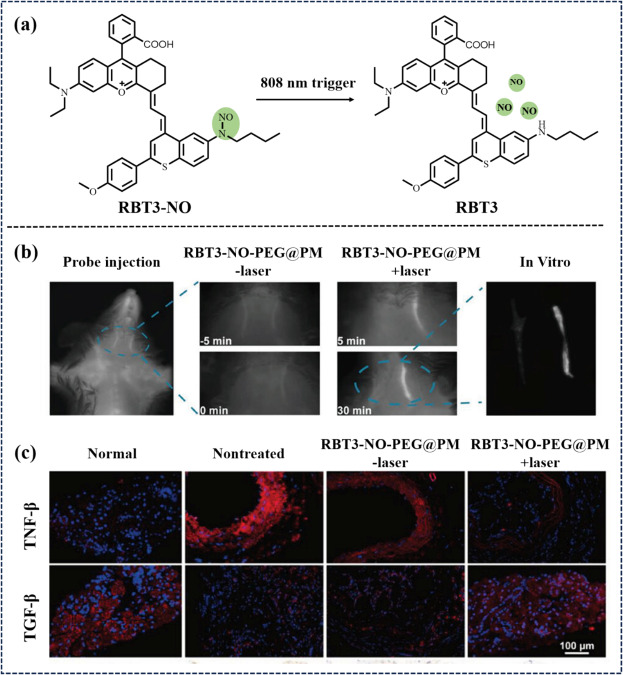
图 8:(a)纳米药物RBT3-NO-PEG@PM 的光触发示意图; (b)注射RBT3-NO-PEG@PM 后小鼠的近红外-II FLI;(c)NO 处理后血管切片中 TNF-α 和 TGF-β 的免疫荧光成像。
Wang等人在2023年报道了一种基于吡咯-吡咯氮掺杂BODIPY荧光团的聚合物纳米颗粒(PTPE3 NP),该纳米颗粒展现出高度稳定的AIE特性,为血管靶向光动力疗法(V-PDT)中的血管反应监测提供了直观、实时的成像手段。PTPE3 NP凭借其优异的NIR-II荧光性能,首次实现了V-PDT过程中肠系膜及肿瘤血管功能障碍(如血栓形成、血管闭塞、出血)的动态可视化与追踪。
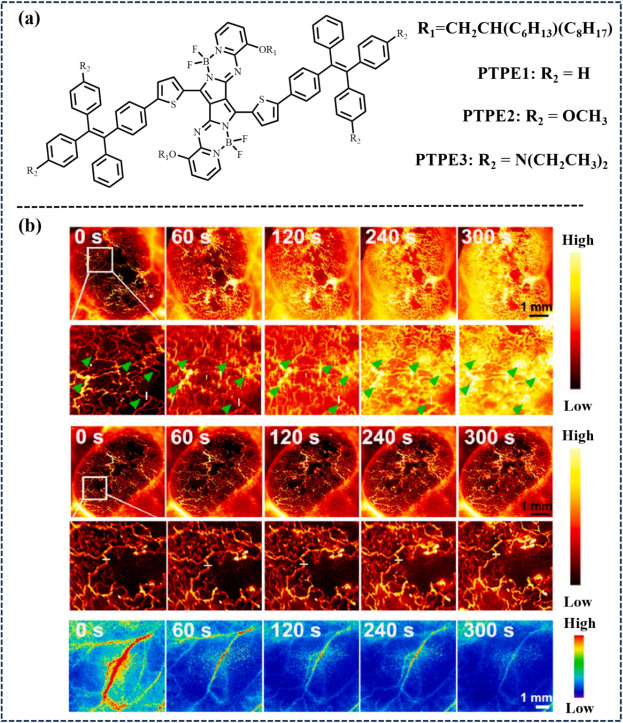
图 9:(a)PTPE 1-3 的分子结构;(b)PTPE3 NPs在 V-PDT 治疗下肿瘤血管破坏的近红外-II FLI。
进入2024年,Zheng研究团队通过理论计算,深入探讨了62个多芳香族吡咯(MAP)体系在可见光至NIR-II区间的光谱特性,揭示了关键描述因子与光谱吸收/发射特性的强相关性。通过精准调整MAP的供受体部分及吡咯环取代位置,实现了光谱从短波长向NIR-II区的连续红移。与商用染料ICG相比,新设计的MAP23-BBT在区域及深层组织血管成像中展现出更高的时空分辨率(图10)。
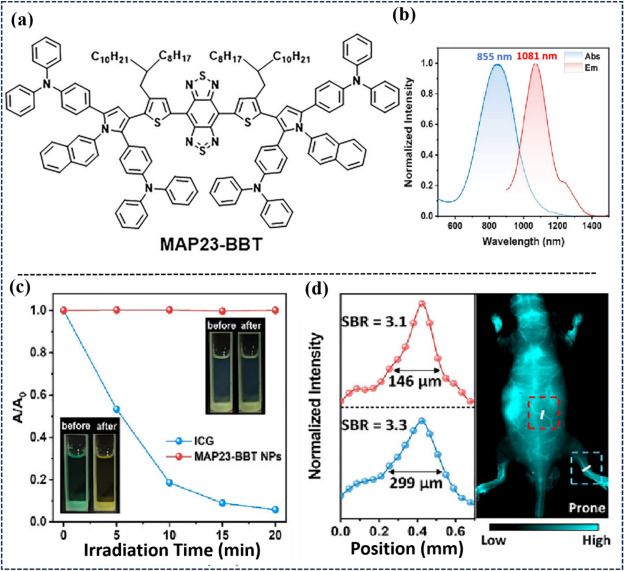
图 10. (a) 新设计的MAP23-BBT的化学结构。(b) MAP23-BBT NPs 在 H2O 中的归一化紫外-可见吸收光谱和聚光光谱。(c) MAP23-BBT NPs 和 ICG 在持续暴露于 808 纳米辐照(0.5 W/cm2,20 分钟,10-5 mol/L)下的吸收强度变化。(d)静脉注射MAP23-BBT NPs(200 μL,2 mg/mL)后的全身近红外-II 荧光血管造影。
同年,Li研究小组创新性地开发出一种针对NIR-II荧光引导光动力免疫疗法的空间扭曲线粒体靶向光敏剂——I2HCy-TPE纳米颗粒(NPs)。该光敏剂融合了七甲基氰与四(4-苯基乙烯基)乙烯(TPE),TPE有效抑制了分子间π-π堆积,确保了高效的NIR-II荧光发射。同时,重金属碘的引入显著提升了单线态氧(1O2)的产率,使I2HCy-TPE能够精准靶向癌细胞线粒体,通过PDT诱导线粒体损伤并触发免疫性细胞死亡,最终在TNBC模型中实现了高达91%的肿瘤抑制率。
4. 用于脑部疾病活体成像的近红外-II 有机荧光探针
脑部疾病的全球性流行已成为不容忽视的健康挑战,迫切要求我们在其诊断和治疗手段上取得突破。然而,开发无创且高灵敏度的脑部疾病诊断技术仍面临巨大障碍。这些疾病,包括但不限于创伤性脑损伤(TBI)、脑肿瘤、以及一系列神经退行性疾病(如阿尔茨海默病(AD)、帕金森病(PD)、脊髓损伤(SCI)和中风),常导致严重的认知、行为及生理功能障碍。近年来,非侵入性光学成像技术,尤其是近红外II区(NIR-II)有机荧光成像技术,在探索复杂神经结构及早期神经系统疾病症状监测方面展现出巨大潜力,引起了学术界的广泛关注。随着研究的深入,活体NIR-II荧光成像技术有望彻底革新我们对脑部疾病的理解与管理方式,为新型诊断与治疗策略的开发开辟新途径。
2022年,Liao等研究团队设计了一系列基于D-π-A结构的NIR-II荧光探针(图11),其中DMP2探针通过独特的π桥连接电子供体(N, N-二甲基氨基苯基和噻唑)与电子受体,展现了对Aβ纤维的强亲和力。通过抑制TICT效应,DMP2在与Aβ纤维结合时特异性激活其NIR-II荧光,成功实现了AD小鼠体内Aβ斑块的精准识别,为Aβ斑块的可视化提供了一种有前景的NIR-II荧光探针。
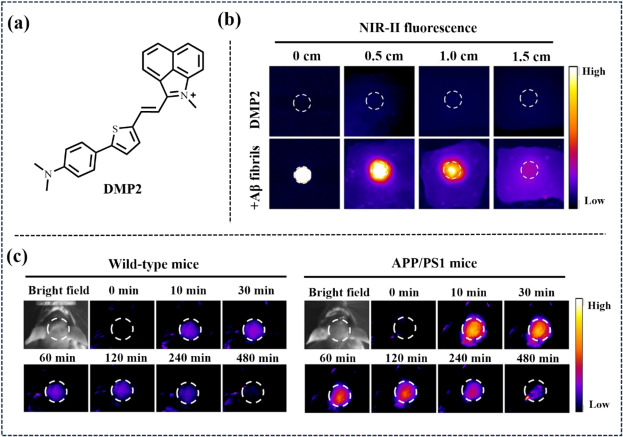
图 11. (a) DMP2的分子结构。(b) 通过覆盖不同厚度的鸡组织,对DMP2与 Aβ 纤维相互作用前后进行近红外-II荧光成像。(c)注射DMP2前后,宽小鼠(左)和APP/PS1小鼠(右)脑部近红外-II荧光成像的时间依赖性。
同年,Xiao等人创新性地合成了具有可调光物理性质、超高光稳定性、卓越生物稳定性及高亮度的二氟化硼偶氮二吡咯并二乙烯近红外染料(BF2)。与常规大分子框架染料相比,BF2染料分子结构紧凑,特别是经吗啉修饰的偶氮二吡咯烷荧光团,展现出增强的血脑屏障穿透能力,实现了穿透皮肤与颅骨的脑内NIR-II荧光成像。在胶质瘤模型中,这些BF2氮杂吡咯烷荧光团有效区分了肿瘤与正常脑组织。
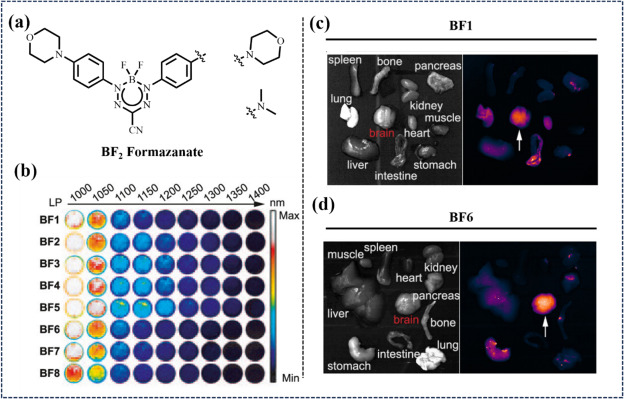
图 12. (a) BF2甲臢的分子结构。(b) 50 μM 时 BF1-BF8 的假色图像。(c, d) 注射 BF1 和 BF6 2 小时后心脏、肺、肾、脾、肝、脑、肠、胃、骨、肌肉和胰腺的荧光图像。
Cheng研究小组在2022年通过受体工程策略,设计了一种新颖的NIR-II D-A-D探针,引入了新型电子受体TQT(图13)。TQT在碱性环境中表现出卓越的化学稳定性,基于此设计的FT-TQT探针实现了快速、高分辨率的活体血管可视化。FT-TQT@FBS复合物更是结合了FBS,有效用于脑血管、肿瘤血管及CA4P治疗后的血管损伤静态与连续成像,为TQT基NIR-II荧光探针的开发奠定了坚实基础。
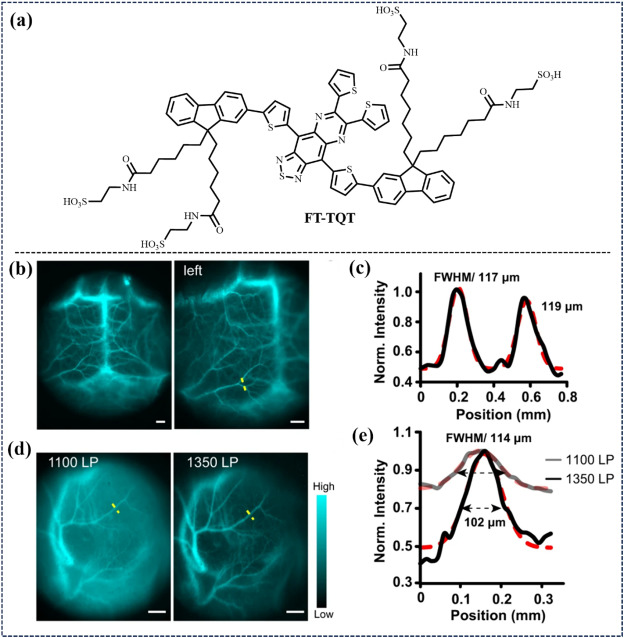
图 13. (a) FT-TQT的分子结构。(b) 注射FT-TQT@FBS后脑血管的近红外-II荧光成像。(c) 沿(b)图中黄线的横截面荧光强度曲线。高斯函数拟合数据(带 FWHM)也以红色显示。 (d) 使用 FT-TQT@FBS 在 1100 nm 和 1350 nm LP 滤光片下对肿瘤血管进行近红外-II荧光成像。(e)沿面板中黄线的横截面荧光强度剖面图(和高斯拟合图(红色),箭头表示 FWHM)。
Song等人开发了一种ROS响应的NIR-II比率荧光探针BBT-IR/Se-MN,该探针具有协同放射增敏特性。与ROS反应后,其FRET效应受阻,导致荧光比值显著变化,实现了小鼠胶质瘤模型中-OH的原位实时监测。通过二硒化物的引入,BBT-IR/Se-MN提高了-OH水平,阻断了电离辐射诱导的DNA损伤修复,促进了胶质瘤的协同放射增敏治疗。
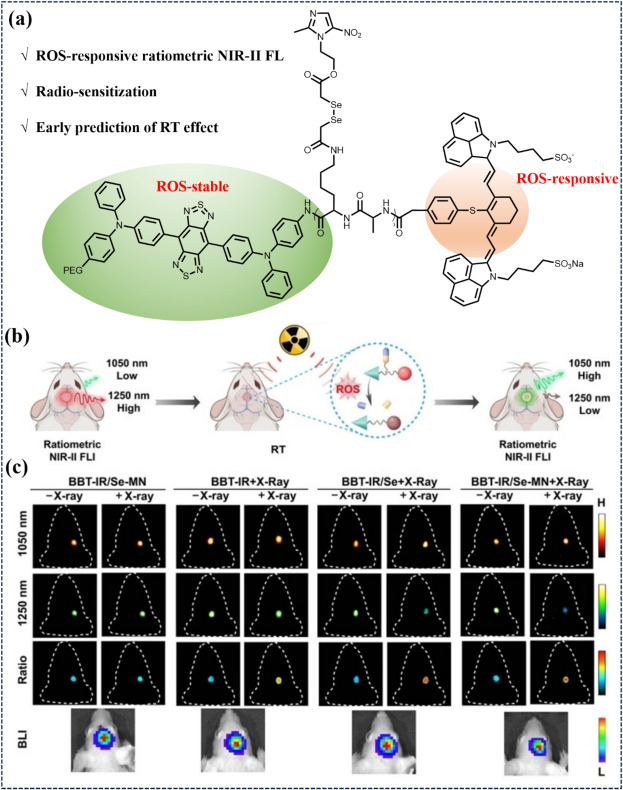
图 14. (a) ROS 激活的比率测量近红外-II FL 探针的构造。(b) RT 过程和比率法 NIR-II FLI 的示意图。(c) 小鼠在不同治疗下的代表性近红外-II荧光成像、比率荧光成像和生物发光图像。
2023年,Xiong课题组通过在传统BODIPY框架的特定位置引入吸电子基团,成功合成了高亮度的NIR-II J-聚集体NOBDP-NO2。该策略通过增强分子间静电斥力与氢键相互作用,提升了J-聚集体的NIR-II荧光性能。在1065 nm波长下,NOBDP-NO2展现出强大的荧光发射,固态绝对量子产率高达3.21%。结合1319 nm激光,NOBDP-NO2NPs实现了脑血管系统的高分辨率动态NIR-IIa荧光成像,增强了成像引导的淋巴结手术效果。
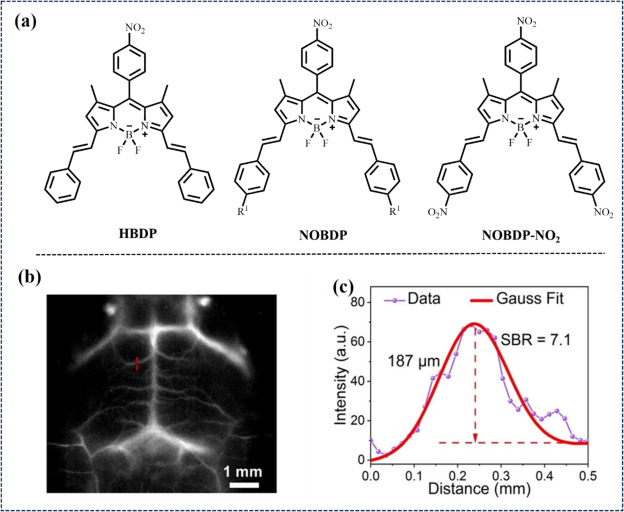
图 15. (a) HBDP、NOBDP 和 NOBDP-NO2 的分子结构。(b) 大脑皮层的放大荧光图像。(c) 沿 b 中红色虚线测量的横截面强度剖面图。
2024年,Zhang等人利用空间阻碍淬灭剂(SHQ)构建了可激活的“OFF-ON”传感系统(图16),实现了癫痫小鼠海马体及高散射脑组织区域ClO生成的实时可视化。SHQ对ClO敏感,能在特定区域释放明亮的NIR-II信号,为癫痫病理过程的研究提供了新视角。
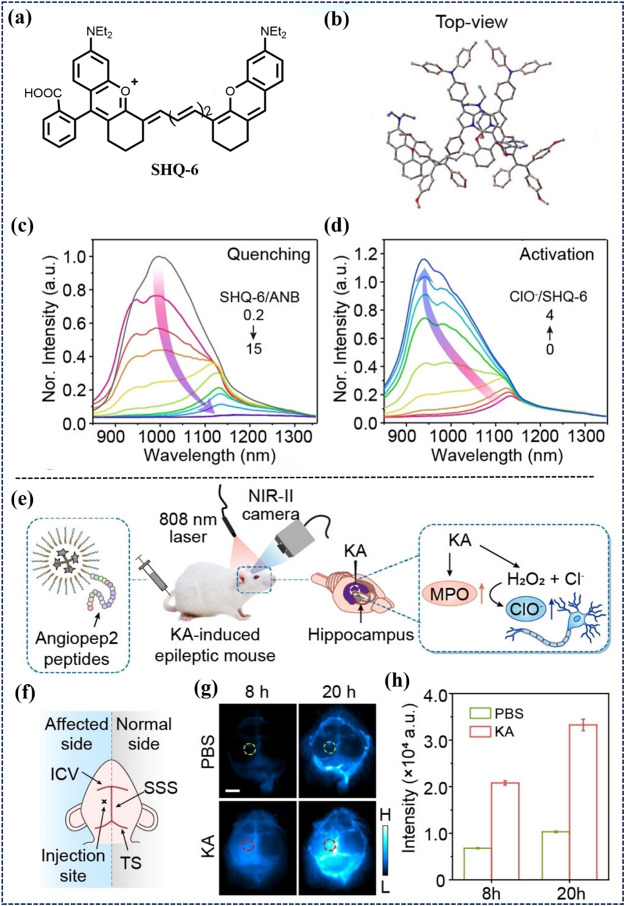
图 16. (a) SHQ-6的化学结构。(b) 通过 DFT 计算估算出ANB和SHQ-6之间的分子间堆积状态。(c) SHQ/ANB 比率为 0.2 至 15 时,ANB-SHQ-6 传感器的归一化发射光谱。 (d) 加入 ClO- 时,ANB-SHQ-6 传感器(ANB:SHQ-6 = 1:4)的归一化发射光谱恢复。传感器浓度: ANB 和 SHQ-6 分别为 1 × 10-5 M 和 4 × 10-5 M。(e) 利用ANB-SHQ-6-pep传感器观察凯尼酸(KA)诱发癫痫的活体示意图。(f) KA 治疗小鼠的大脑结构示意图。分别在注射ANB-SHQ-6-pep传感器前 8 小时和 20 小时,正常小鼠和癫痫小鼠大脑的近红外-II FLI(g)和信号强度(h)。ICV:大脑下静脉;SSS:上矢状窦;TS:横窦。
同年,Wu研究团队开发了一种极性敏感的NIR-I/NIR-II纳米荧光团NT-850,具备宽发射带、优异的光化学稳定性及高量子产率(水溶液中超过4.5%)。该有机纳米粒子由D-A-D型NIR-I/NIR-II荧光团组成,封装于商用两性分子基质中,实现了脑血管的高分辨率成像,并成功应用于小肿瘤的高灵敏度识别,展现了在早期癌症精准荧光引导手术中的巨大潜力。
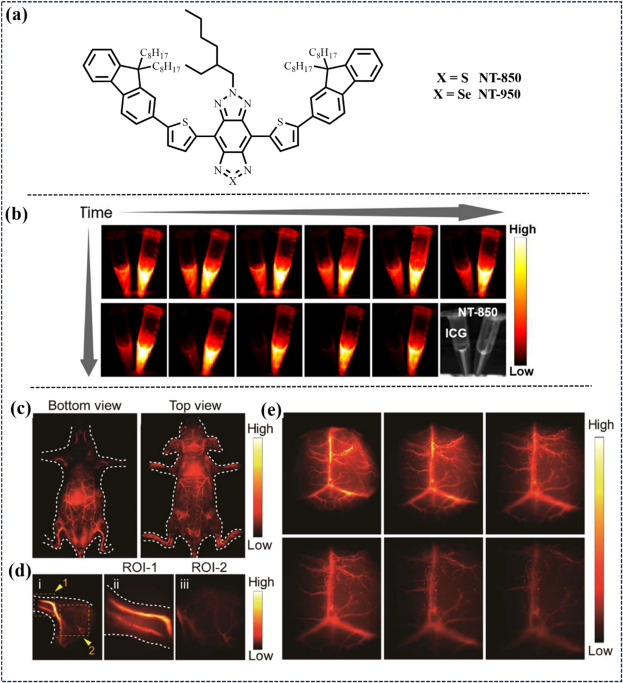
图 17. (a) 新型 NT-850 和 NT-950 的化学结构。(b) 中等体积荧光团 ICG 在不同时间间隔照射NT-850 纳米点和水溶液后的近红外-II FLI。(c) 从角度记录的全身近红外-II荧光成像。(d)后肢和(e)大脑血管的近红外-II荧光成像。
Tang等人则基于BBTD受体单元与侧烷基链取代的噻吩桥基,设计出两种具有治疗潜力的近红外-II区(NIR-II)聚集诱导发光分子(AIEgens),分别命名为3和6。其中,3分子的末端2,2′-二氮杂苄基(乙烷-1,2-二醇)基团能够特异性地与阿尔茨海默病(AD)中的Aβ淀粉样蛋白纤维结合(图18)。为了进一步增强其治疗功能,研究团队利用ROS激活的硫内酯(TK)模板(DSPE-TK-PEG)将这两种AIEgens共同组装成纳米复合体Ang-NC。这种创新的分子设计与共组装策略,不仅实现了对AD大脑靶点的精准定位,还促进了Aβ纤维的降解及ROS水平的调节,为解决AD这一全球性健康难题提供了有力的工具。
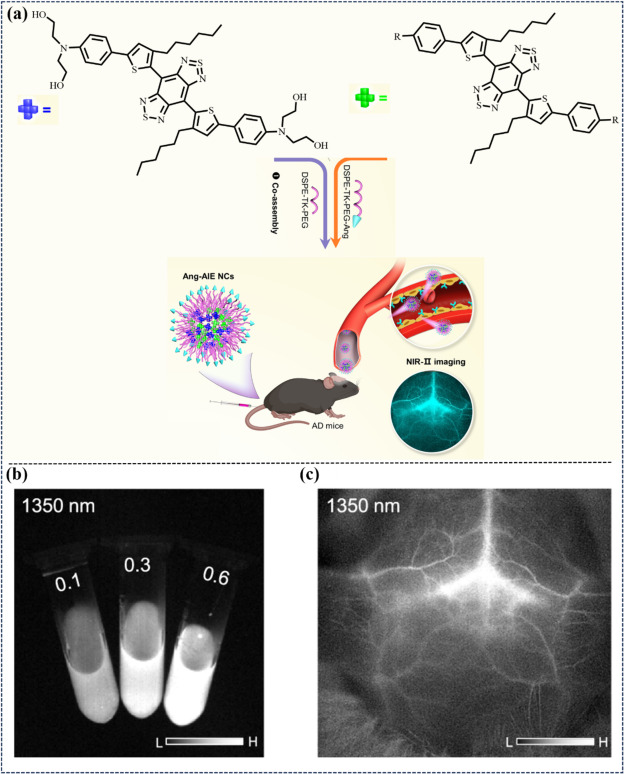
图 18. (a) Ang-NCs的制备和生物应用。(b) Ang-NCs(0.1、0.3 和 0.6 mg/mL)在 1350 纳米波长处的近红外-II FLI 浓度依赖性。(c) 注射Ang-NCs后小鼠脑血管的近红外-II荧光成像。
综上所述,近年来在NIR-II荧光成像技术领域取得的这些进展,不仅加深了我们对脑部疾病复杂机制的理解,更为开发高效、无创的脑部疾病诊断与治疗策略开辟了新道路。随着研究的不断深入和技术的持续进步,NIR-II荧光成像技术有望在神经科学及临床医学领域发挥更加重要的作用,为人类健康事业贡献更多力量。
5. 用于肝脏成像的近红外-II 有机荧光探针
肝脏,作为机体内关键的代谢与解毒枢纽,对维持生理稳态具有不可或缺的作用。然而,药物性肝损伤、肝细胞癌、肝纤维化、缺血再灌注损伤及脂肪肝等病理状态严重削弱了肝脏的正常功能,对人类健康构成了严峻威胁。因此,实现对肝病进程的实时监控与疗效评估成为医学研究的紧迫任务。近年来,新兴的近红外-II(NIR-II)荧光探针技术为病理生理机制探索、肝病药物研发及诊断治疗策略的制定提供了强有力的工具,为持续监测肝脏健康状态搭建了动态平台,推动了新型治疗方法的快速发展。
2022年,Luan研究团队通过巧妙地在含氧蒽结构中引入1,4-二乙基-10H-喹嗪基团,成功开发出新型NIR-II荧光探针(命名为“近红外-II Cy3s”,见图19)。这一创新设计不仅拓宽了荧光波长范围,还构建了针对次氯酸(HClO)与活性硫(RSS)的可逆反应位点,为追踪病理条件下由HClO/RSS介导的氧化还原循环提供了多功能研究平台。近红外-II Cy3-988探针在急性炎症及肝损伤/修复模型中展现了出色的氧化环境动态监测能力。
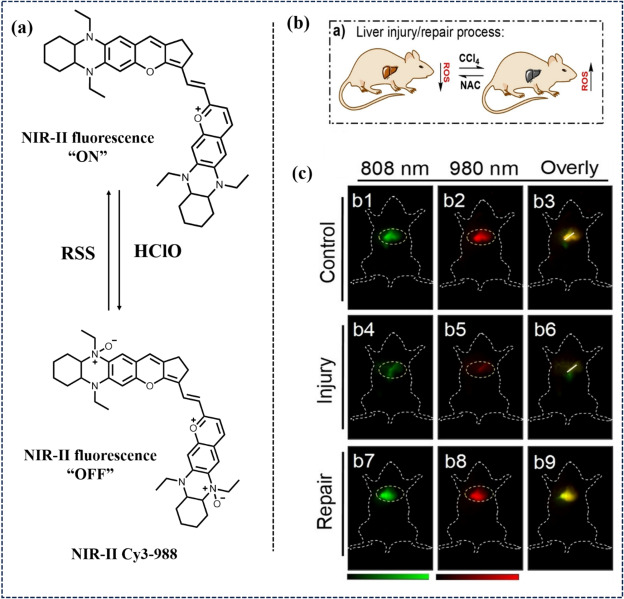
图 19. (a) NIR-II 荧光探针 NIR-II Cy3-988 的识别机制。(b) 四氯化碳(CCl4)和 NAC 介导的肝损伤/修复过程;(c) 小鼠肝脏的近红外-II荧光成像,ICG(绿色)和近红外-II Cy3-988(红色)经不同物质处理:生理盐水(对照)b1-b3,CCl4 40%(损伤)b4-b6,NAC + CCl4 40%(修复)b7-b9。
同年,Chen等人设计并合成了不对称D-A核结构的NIR-II有机荧光探针TQT 1009,并通过聚乙二醇(PEG)自组装策略制备出超长体内循环时间(超过96小时)的纳米颗粒TQPns(图20)。与常用荧光染料ICG相比,TQP 10 K在静脉注射后能够持续提供长达96小时的NIR-II荧光信号,显著优于ICG的短半衰期表现。这一特性使得TQP 10 K能够在急性肝损伤模型中实现对肝功能损伤的动态实时成像。
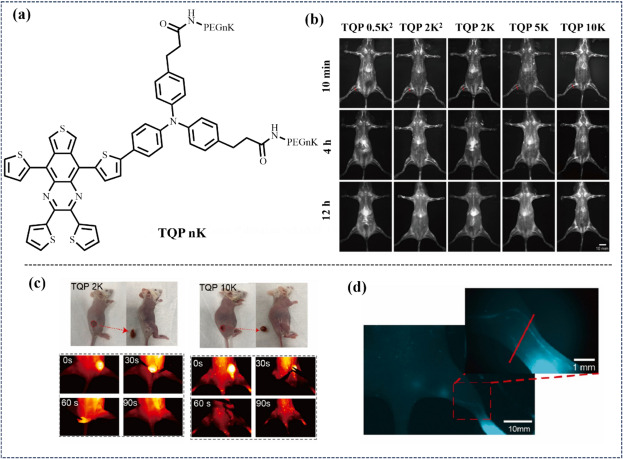
图 20 (a) TQP nK 的结构。(b) 正常 BALB/c 小鼠的近红外-II 成像。(c) 手术前后注射 TQP 2 K 和 TQP 10 k 后的照片,以及 24 小时后 NIR-II FLI 引导下的切除图像。
2023年,Zhang研究团队报道了一种专为肝细胞癌(HCC)设计的可逆NIR-II比率荧光探针CX-RATP(图21),该探针能够高效、快速地(5分钟内)响应ATP,并在生理浓度范围内(0-10 mM)实现精准检测。CX-RATP在原位条件下有效区分HCC病灶与正常组织,展现了作为HCC早期诊断与监测工具的巨大潜力,推动了光学生物成像在肝病精准医疗领域的应用。
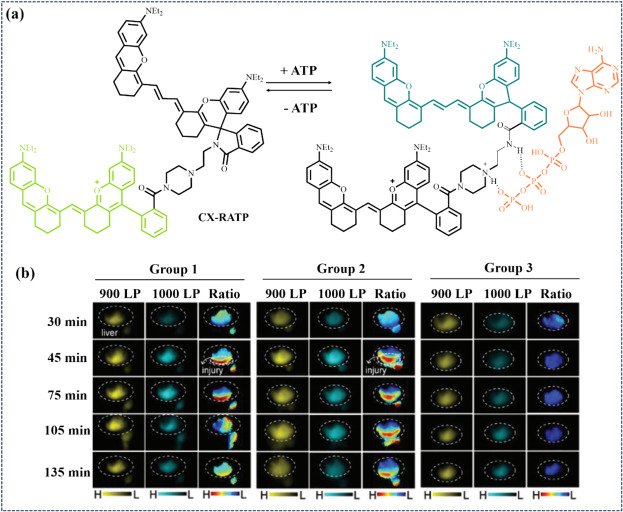
图 21. (a) CX-RATP对 ATP 的反应机制。(b) 小鼠的近红外-II FLI 和相应的比率测量图像以及相应的比率测量图像。
同年,Tang小组合成了基于AIE效应的NIR-II荧光探针DPXBI(图22),该探针通过苯并噻唑磺酸盐与二(苯基氨基)氧蒽基团的独特连接,构建了对粘度变化高度敏感的分子转子系统。DPXBI凭借其固有的旋转特性、优异的水溶性和化学稳定性,成功实现了对肝脏粘度变化的精确检测,并在药物性肝损伤及肝缺血再灌注损伤模型中展现出优异的成像效果。此外,该研究还探索了DPXBI作为无创NIR-II FL肝病治疗剂的潜力。
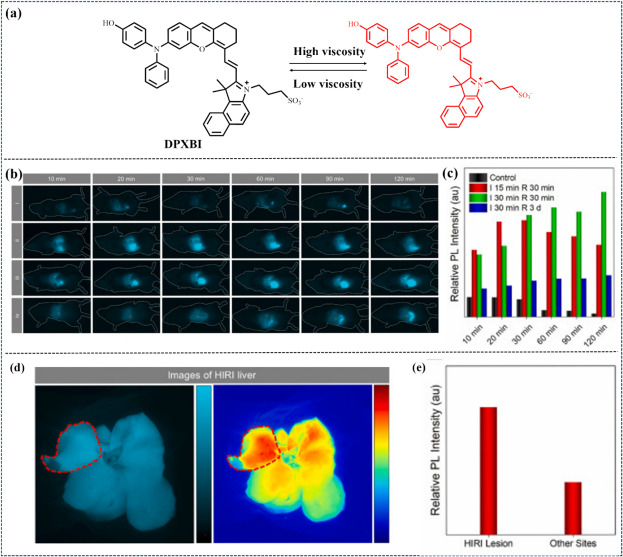
图 22. (a) DPXBI的分子结构和拟议的粘度反应机制。(b) 不同缺血时间 HIRI 的 NIR-II FLI。(c) 注射 DPXBI 后不同时间段 HIRI 小鼠肝脏的相应荧光强度。(d) 注射 DPXBI 后 HIRI 肝脏的近红外-II荧光成像。(e)HIRI 病变和其他部位的相应荧光强度。
Ma研究小组在2023年采用可变π组装与亲水羧基结合的策略,成功开发出针对亮氨酸氨肽酶(LAP)的水溶性NIR-II荧光探针(图23)。通过将识别分子中的羟基转化为烯醇形式,制备了水溶性良好的酶活探针NIR-II-F2LAP。该探针在与LAP作用后发生识别基团裂解,释放NIR-II荧光团,显著增强荧光信号。这一创新设计在药物诱导的小鼠肝损伤模型中实现了LAP波动的活体成像,为肝损伤的早期诊断与监测提供了新途径。
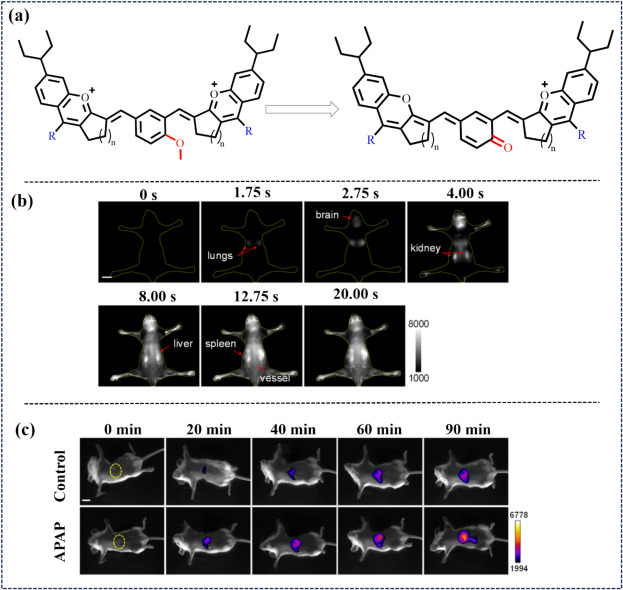
图 23. (a) 近红外-II 荧光探针的组合设计策略。(b) 高时间分辨率小鼠动态近红外-II成像。(c) 小鼠在口服生理盐水(对照组)或 300 mg-kg-1 APAP 后静脉注射NIR-II-F2LAP的荧光图像。来源于参考文献。102],版权归英国皇家化学会 2023 年所有。 2024年,Lin等人研发了新型NIR-II荧光探针NYR-1,该探针巧妙融合了含氧蒽与苯并吡啶结构。NYR-1首次将NIR-II荧光成像与比值光声(PA)信号相结合,利用双模式成像技术实现了对钯(II)离子(Pd²⁺)的无创检测。这一技术突破在小鼠肝脏Pd²⁺过载检测中展现出显著效果,为生物成像领域的靶向诊断应用开辟了新方向。

图 24. (a) NYR-1对 Pd2+ 的反应机制。(b) 在大腿 PA720 和 PA808 处拍摄的光声图像。(c) 用探针系统(10 μM)和不同浓度的 Pd2+(0、5、15 和 30 μM)处理活体小鼠的近红外-II FLI。Ex = 808 纳米,LP = 880 纳米。
6. 用于肾脏活体成像的近红外-II 有机荧光探针
随着全球范围内肾病发病率与死亡率的持续攀升,其已成为医疗领域亟待攻克的重大挑战,尤其是急性肾损伤(AKI),其诱因复杂多样,涵盖败血症、低血压、多器官功能衰竭、肾结石及药物过量暴露等。因此,肾病的早期诊断显得尤为关键。药物进入体内后,若含有不可生物降解的纳米颗粒,则易在体内累积,可能随血液循环引发急性或慢性毒性反应。相反,可生物降解药物则遵循肝脏、胆道或肾脏的特定代谢途径排出体外,其代谢效率深受药物自身属性如粒径、形态、表面电荷等因素的调控。肾脏的清除机制包括经肾小球滤过膜(GFM)的快速筛分、肾小管转运,并最终通过输尿管排入膀胱。在此背景下,近红外-II(NIR-II)荧光成像技术以其独特的优势,为区分健康与病变肾脏提供了有力工具,极大地推动了肾脏疾病的早期诊疗进程。
近年来,Wu等研究团队在卟啉荧光骨架中创新性地引入了电子吸收硼基团(即响应基团),成功研制出PEG3-HC-PB荧光探针。该探针展现出卓越的光稳定性及肾脏清除效率(见图25),在NIR-II窗口(900-1200 nm)内呈现出显著的荧光淬灭特性,并具备良好的水溶性。尤为重要的是,PEG3-HC-PB能够在H2O2生物标记物的触发下激活,产生强烈的光声信号及NIR-II荧光信号,使其成为利用多光谱光声断层成像(MSOT)与双模态NIR-II荧光成像技术监测AKI的理想工具。研究通过该探针实现了对不同缺血再灌注时长诱导AKI模型的有效荧光成像。
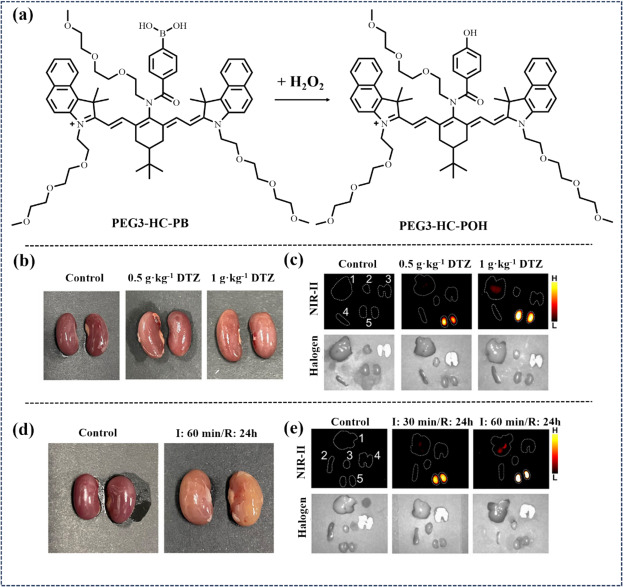
图 25. (a) PEG3-HC-PB和 PEG3-HC-POH的化学结构以及探针对 H2O2 的反应。 (b) 不同处理的小鼠肾脏照片。(c) 注射探针 5 小时后小鼠器官的近红外荧光图像。(d) 小鼠注射PEG3-HC-PB后 5 小时的近红外-II 荧光图像。(e)不同缺血时间的小鼠肾脏图片。
为进一步克服长共轭分子常见的聚集、光漂白、光谱蓝移、稳定性不足及水溶性差等问题,Wu团队于2024年提出了“同源二聚体策略”并辅以外部水合层设计。他们通过柔性连接体将两个Cy7单体巧妙结合,开发出HD-FL-4PEG9-N同源二聚体探针(见图26),并增强了聚乙二醇链的数目以增强其生物活性。该探针不仅适用于AKI的注射成像,还展现出作为细菌感染伤口可视化喷雾探针的潜力。在NO生物标记物的原位激活下,探针恢复了NIR-II荧光,有力证明了其在AKI实时监测中的应用前景。
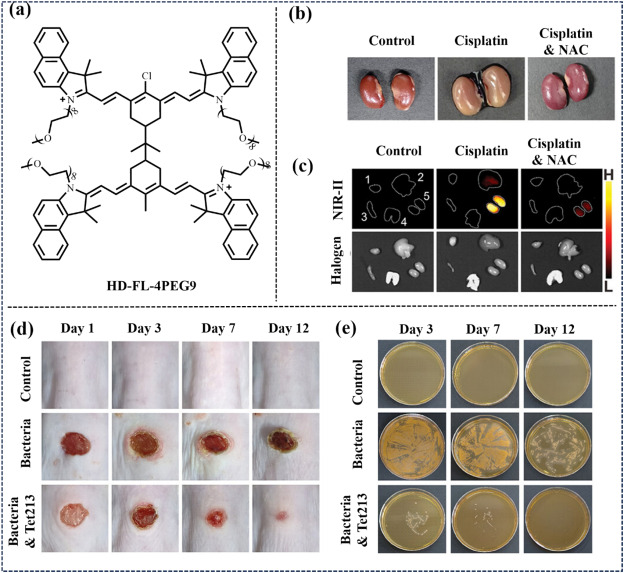
图 26. (a) 探针 HD-FL-4PEG9的化学结构。(b) 各组肾脏的照片。(c) 注射HD-FL-4PEG9-N 6 小时后器官的 NIR-II FL 图像。(d) 不同组小鼠在不同处理后伤口愈合期间的照片。(e) 不同组小鼠皮肤伤口细菌负担的照片。
同年,Li等人则另辟蹊径,将IR-808与Nd3+离子融入超小型聚合物基质中,基于TICT与FRET机制,设计出一种稳定的NIR-II荧光探针(见图27)。该探针能够生成高分辨率的荧光分子,在小鼠模型中实现了对血管及脑动脉闭塞的高对比度NIR-II荧光成像。尤为突出的是,该探针在正常肾脏中能实现快速排泄(约65%在4小时内随尿排出),而在AKI小鼠肾脏中则表现出显著的滞留效应。这些卓越特性使其成为肾损伤NIR-II荧光成像(FLI)检测的有力候选。
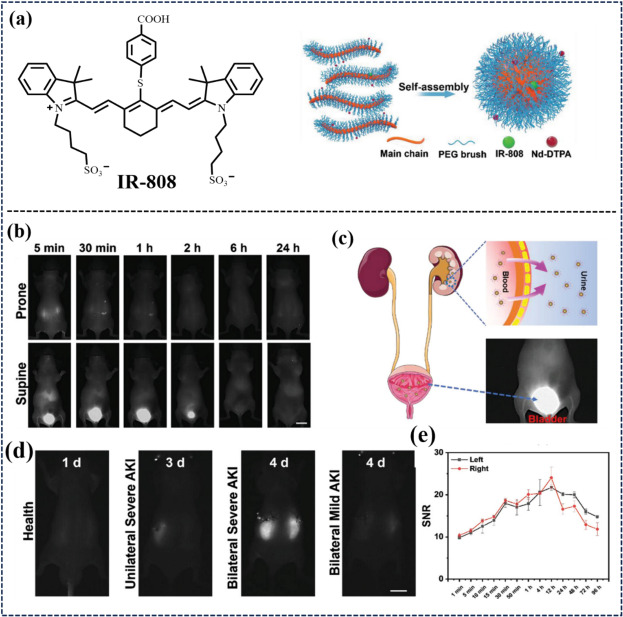
图 27. (a) MA-IR-808和 **P(PEGMAx-(Nd-DTPA)y-co-(IR-808)z)**的合成。(b) NIR-II FLI 和 P-Dye-Nd-2样品在健康小鼠体内不同时间间隔的药代动力学。(c) P-Dye-Nd-2样品在肾脏的快速清除示意图。(d) 不同缺血条件下 AKI 小鼠的近红外-II FLI(比例尺 = 10 毫米),以及 (e) 双侧严重 AKI 小鼠相应的肾脏信号变化(n = 3)。
7. 用于淋巴成像的近红外-II 有机荧光探针
淋巴结(Sentinel Lymph Node, SLN)作为癌症转移的首要门户,其状态对于淋巴系统疾病的肿瘤分期、预后评估及精准诊断/治疗策略的制定具有不可估量的临床价值。近年来,近红外-II(NIR-II)有机荧光探针成像技术因其卓越的组织穿透深度与高时空分辨率特性,吸引了科研界的广泛关注。这一技术的革新为淋巴结的精细观测开辟了新途径,显著提升了诊断精度,并为疾病治疗干预提供了更为有效的指导。因此,NIR-II成像技术的研发与应用已成为医学影像学与肿瘤学领域的研究热点。
2022年,Zhu团队通过巧妙地将花菁染料IR-780共价结合至β-乳球蛋白(β-LG)的疏水腔内,成功合成了纳米复合物β-LG@IR-780(图28)。β-LG的引入有效遏制了IR-780分子的非辐射跃迁,显著增强了其NIR-II荧光发射效率。该复合物不仅实现了大脑及后肢血管的高分辨率NIR-II荧光成像(NIR-II FLI),还成功应用于腋窝与腹股沟淋巴管的成像,清晰揭示了淋巴水肿的病理变化。
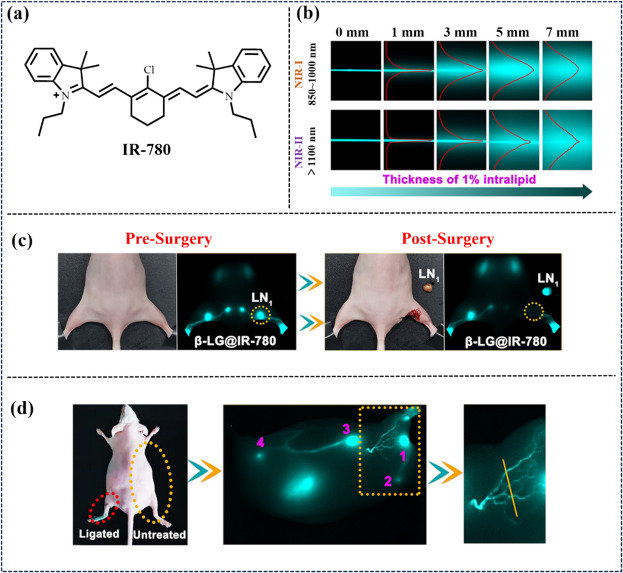
图 28. (a) 探针IR-780的结构。 (b) 含有β-LG@IR-780溶液的毛细血管在覆盖深度可调的 1%内部脂质前后的近红外-I 和近红外-II FLI。(c) 使用β-LG@IR-780进行近红外-II FLI 引导的淋巴结成像和手术切除。(d) **β-LG@IR-780对继发性淋巴水肿的成像。
同年,Martin等人通过结构创新,将萘二醇环与芳基结构融合,拓展了NIR-II发光磺基吲哚菁染料的光化学与水解稳定性至更长波长范围,开发出FNIR-866与FNIR-1072等新型染料,并构建了与抗表皮生长因子受体(EGFR)单抗帕尼单抗(panitumumab)的共轭物(FNIR-872-Pan与FNIR-1072-Pan)(图29)。此外,他们还创新性地引入了1300 nm反射LED通道,结合用户界面设计,实现了四通道实时可视化。利用这些探针,研究团队成功实现了肿瘤与淋巴结的精准解剖成像,为肿瘤学研究提供了有力工具。
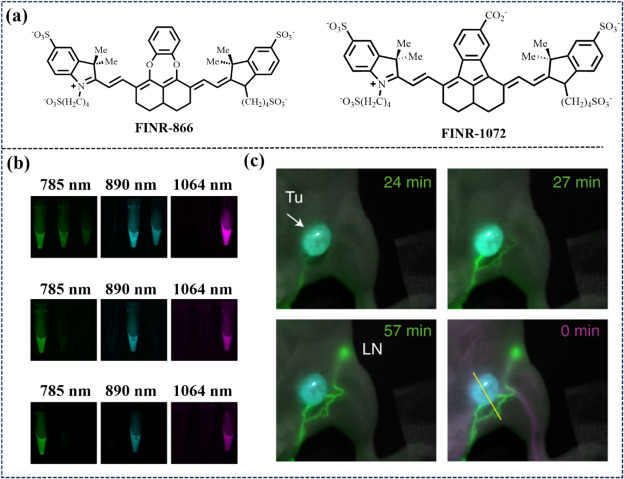
图 29. (a) 探针FINR-866和FINR-1072的结构。(b) 探针比较、复用策略和单色单克隆抗体成像。(c) 肿瘤、淋巴和血管的纵向三/四通道多色近红外-II FLI。
2023年,Zhu团队鉴于β-乳球蛋白(β-LG, 18.4 kDa)与牛血清白蛋白(BSA)在肝脏与肾脏清除途径上的差异,将两者分别与IR-780染料共轭,制备出β-LG@IR-780与BSA@IR-780两种NIR-II有机探针(图30)。这些探针在淋巴结定位、淋巴管描绘方面展现出高灵敏度与特异性,同时能够超敏检测淋巴水肿与肿瘤转移,并意外揭示了模型小鼠原发性淋巴水肿的高发率。
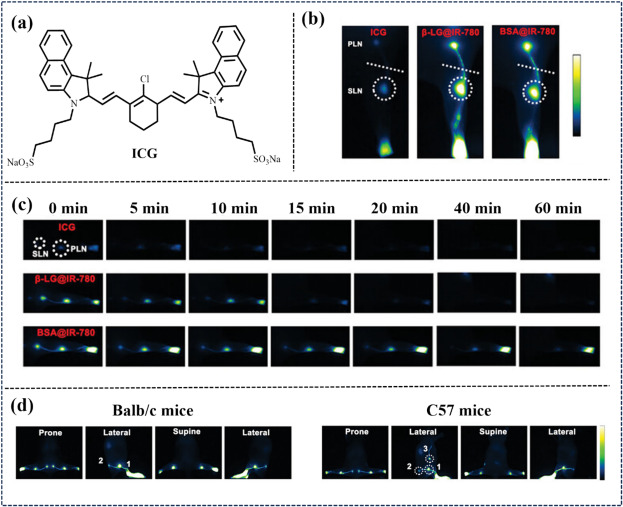
图 30. (a) 探针ICG的结构。 (b) 使用ICG、URL-LG@IR-780和BSA@IR-780对淋巴进行近红外-II FLI。(c) 使用 ICG、β-LG@780 和 BSA@IR-78 对不同时间点连续照射的淋巴结进行成像。(d) Balb/c 和 C57 小鼠足垫注射β-LG@IR-780后的淋巴近红外-II FLI。
2024年,Zhu团队在温和生理条件下,利用合成蛋白质作为NIR-II发色团,通过位点特异性亲核取代策略,将CO-1080染料与人血清白蛋白(HSA)等生物标签结合,创制出生物启发的近红外-II荧光蛋白(HSA@CO-1080 FPs)。该探针不仅亮度显著提升,且具备优异的化学与光稳定性(图31)。其在小鼠淋巴系统与血管成像中的超高对比度表现,彰显了基于蛋白质的系统在提升生物成像灵敏度与耐用性方面的巨大潜力。
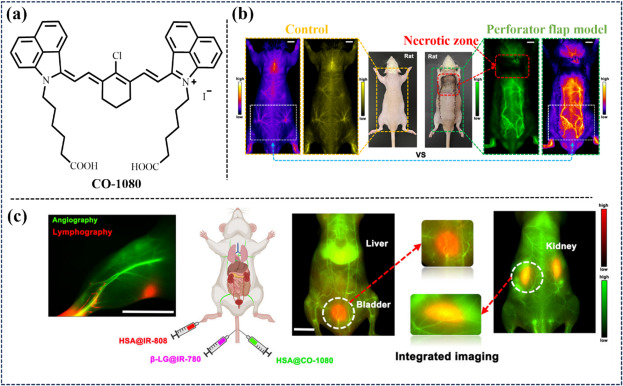
图 31. (a) 探针CO-1080的结构。(b) 通过注射HSA@CO-1080 FPs,对正常小鼠和穿孔器皮瓣模型小鼠进行近红外-II荧光成像。(c) 通过HSA@IR-808 和HSA@CO-1080 FP对淋巴和血管进行双色近红外-II荧光成像。
同年,Zhang团队设计了一种针对体内G4结构检测的小分子荧光探针NIRG-2(图32)。NIRG-2通过形成稳定的氢键与强π-π相互作用,有效抑制了TICT效应,实现了对G4结构的选择性照亮。该探针在淋巴结转移的可视化方面取得了突破性进展,为肿瘤精准切除提供了有力支持,深刻改变了肿瘤检测的传统模式,极大地丰富了医学诊断工具库,特别是在G4相关疾病(如癌症)的研究中,加深了我们对这些疾病及其进展机制的理解。
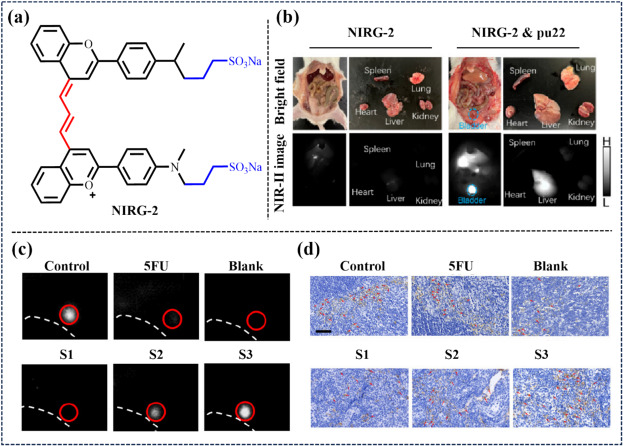
图 32. (a) 探测器NIRG-2的结构。(b) 静脉注射 NIRG-2、NIRG-2 和 Pu22 10 分钟后,健康 BALB/c 小鼠的代表性明场、外_和近红外-II FLI。(c) 注射NIRG-2 30 分钟后脚垫的近红外-II FLI。(d) 淋巴结(LN4)切片中 CD206 的免疫组化图像。
8. 用于肺部活体成像的近红外-II 有机荧光探针
肺部,作为循环系统的核心器官,不幸成为癌症转移的高发区域,其涉及的病例约占所有癌症扩散的半数。此外,急性肺损伤(ALI)这一严重的肺部炎症反应,可由多种复杂因素诱发,加之肺部作为呼吸系统的关键组成部分,极易遭受病毒侵袭,如引发肺结核等严重疾病。鉴于此,研发能够实时监测肺功能、追踪肿瘤转移及病毒感染动态的NIR-II荧光探针,为肺部恶性肿瘤、损伤及病毒感染的早期诊断与干预策略提供了前所未有的机遇与希望。这些先进的成像工具已成为肺部相关疾病治疗干预的宝贵平台。
在2023年,Fan团队通过巧妙地将苯并噻唑衍生物荧光团与四精氨酸(PSar)臂结合,成功合成了一种高性能的近红外-II小分子聚合物(TQF-PSar),如图33所示。该聚合物不仅展现出优异的量子产率(1%)和延长的血液循环半衰期(t1/2 = 36.9小时),还具备“隐形”特性,能有效规避巨噬细胞的快速清除机制,从而实现对乳腺癌肺转移的高效成像。在乳腺癌肺转移小鼠模型中,低剂量的TQF-PSar即展现出了卓越的肺转移成像效果,彰显了其强大的肿瘤靶向能力。
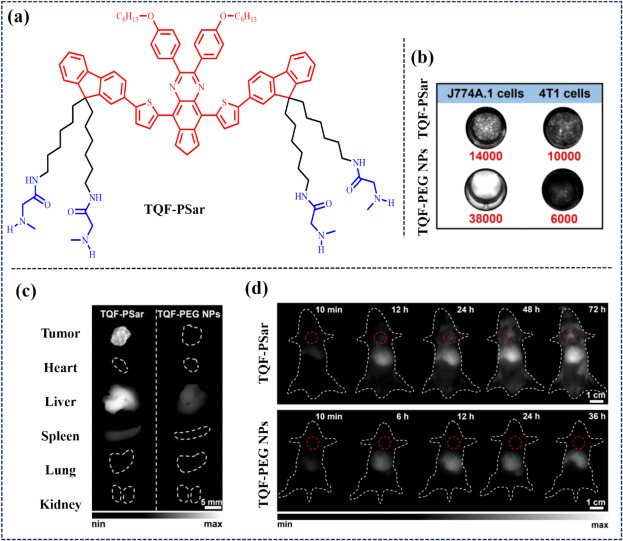
图 33. (a) TQF-PSar 的结构。 (b) 分别用相同浓度的 PBS、TQF-PSar 和 TQF-PEG NPs 培养 RAW 细胞和 4T1 细胞 12 小时的近红外-II FLI。(c) 用TQF-PSar和TQF-PEG NPs处理的小鼠主要器官的近红外-II LI。(d) 用TQF-PSar和TQF-PEG NPs治疗后 4 个 T1 癌肺部转移灶的近红外-II FLI,红色虚线圆圈指向肺部区域。
进入2024年,Shen等人在多孔普鲁士蓝(PB)纳米催化剂(PBNP)的基础上,创新性地引入了二甲基氨基取代的AIE分子,并将其封装于M1巨噬细胞膜内,显著增强了肿瘤特异性(图34)。这一设计不仅构建了一种集NIR-II荧光成像(FLI)与光声成像(PAI)于一体的光动力疗法治疗剂,还实现了对高度恶性乳腺癌术后残余肿瘤的精准追踪,有效抑制了术后局部肿瘤复发及肺转移的发生。
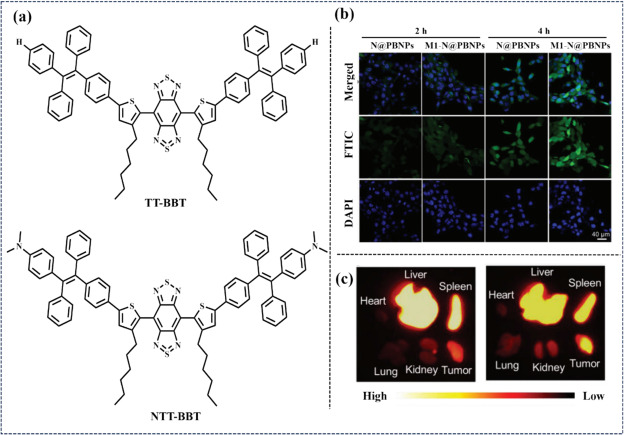
图 34 (a) TT-BBT和 NTT-BBT的结构。(b) 用 FITC 标记的 N@PBNPs 或 M1-N@PBNPs 培养的 4 个 T1 细胞的 FLI。(c) 静脉注射N@PBNPs或M1-N@PBNPs后器官和肿瘤的相应强度分析。
同年,Liao团队则探索了预活化巨噬细胞膜包被纳米颗粒在结核病光热治疗(PTT)中的应用。他们通过将苯并噻唑基荧光分子TPE-BT-BBTD负载于聚乳酸-共聚乙醇酸(PLGA)纳米颗粒上,并随后包裹于_Mycobacterium marinum_预活化巨噬细胞的细胞膜内,制备出BBTD@PM NPs(图35)。在H37Ra诱导的肺结核模型中,静脉注射BBTD@PM NPs后,该纳米颗粒能迅速在肺肉芽肿中富集,实现病灶的实时可视化。更重要的是,在外部1064 nm激光照射下,BBTD@PM NPs展现出强大的靶向光热效应,有效清除了结核分枝杆菌,展示了其在非侵入性肺结核治疗中的巨大潜力。
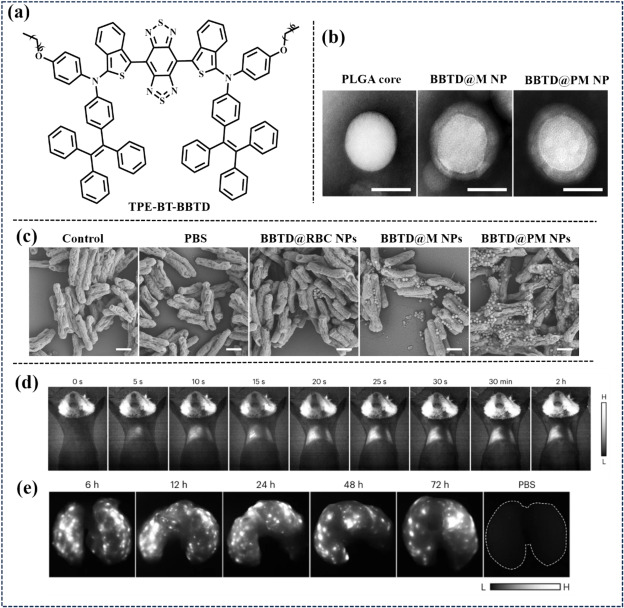
图 35. (a) TPE-BT-BBTD的结构。(b) PLGA 内核、BBTD@M NP 和 BBTD@PM NP 的 TEM 图像。(c) 不同 NPs 与 H37Ra 杆菌表面结合的扫描电镜图像。 (d) 注射 BBTD@PM NPs 后,患结核病的小鼠的近红外-IIb 时间依赖性荧光成像。(e) 患有肺结核的小鼠在注射BBTD@PM NPs后不同时间间隔的近红外-IIb FLI。
此外,2023年Zhang等人提出了一种创新的J-聚集策略,通过促进结构沉淀染料(HPQ)与半全氟(SNARF)共轭体系的原位自组装,构建了一系列可激活且高度稳定的近红外-II J-聚集体(图36)。其中,特别设计的ONOO-响应性探针HPQ-Zzh-B,在长时间原位肿瘤成像中表现出色,并在NIR-II成像引导下实现了肿瘤的精确切除,有效减轻了肺转移的风险,为肿瘤治疗开辟了新的途径。
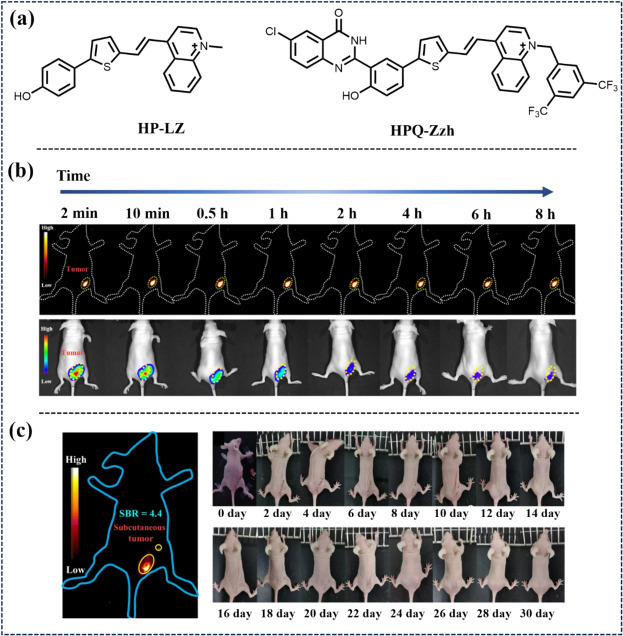
图 36. (a) 新型 J 聚合物发色团的开发。(b) 基于近红外-II 和近红外-I 荧光的肿瘤区域抗扩散实验。(c) 小鼠术后恢复过程照片。
9. 用于胃肠病学体内成像的近红外-II 有机荧光探针
胃肠道(GI)系统,作为消化与免疫系统不可或缺的交互界面,其复杂性使得该区域极易遭受各类病理侵袭,包括但不限于炎症性肠病(IBD)、胃溃疡、肠胃炎及结直肠癌等,这些疾病的根源往往深植于营养不良或免疫调节失衡的土壤之中。尽管胃肠道内极端酸性环境对近红外-II(NIR-II)荧光探针的开发构成了严峻挑战,但科研人员仍不懈努力,旨在开发出高灵敏度与精确度的NIR-II荧光探针,以期在GI疾病的早期诊断、手术导航及疗效评估中发挥关键作用。
面对胃部极端环境的考验,Wang等人于2022年成功研制出一种口服型NIR-II荧光探针——LC-1250 NP(图37),该探针在1250纳米波长处展现出强烈的NIR-II荧光发射特性。尤为引人注目的是,当与结肠炎生物标志物H2O2相互作用时,LC-1250 NP能够发生分子内环化反应,导致1150纳米波段荧光信号增强而1250纳米波段减弱,这一独特的荧光比率变化为肠道炎症及胃部病变的精准识别提供了可靠依据。
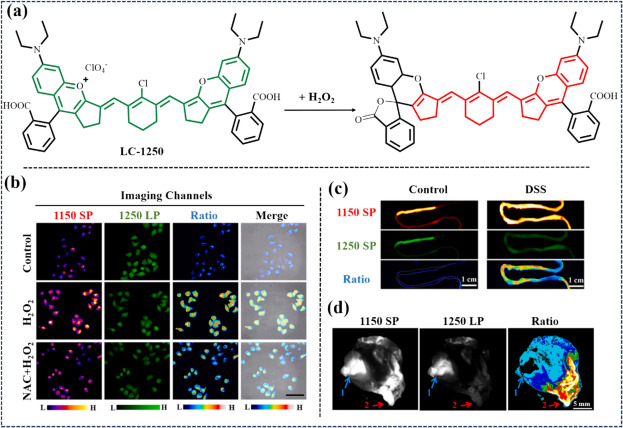
图 37. (a) LC-1250与 H2O2 的反应机理。 (b) Hepa1-6 细胞在 PBS(对照组)、H2O2 和 NAC + H2O2 中的近红外-II FLI 和相应比率 FLI。(c) 健康小鼠(对照组)和肠道炎症小鼠(DSS 组)剖开肠道的近红外-II FLI 和比率图像。(d) 损伤后胃区的近红外-II荧光成像和比值荧光图像。
次年,Sun等人通过在卟啉环的2号位引入多样化的电子供体,巧妙设计出了一系列发射波长可调谐的花菁染料(图38)。这些染料不仅具备高亮度与显著的斯托克斯位移特性,还实现了对染料发射波长的精细调控。借助这些先进染料,研究人员成功实现了小鼠体内全面的NIR-II荧光血管造影,不仅清晰呈现了全身血管网络,还实时捕捉到了口服YH-1a NPs后肠道蠕动的动态变化,彰显了其在精准生物医学成像领域的巨大潜力。
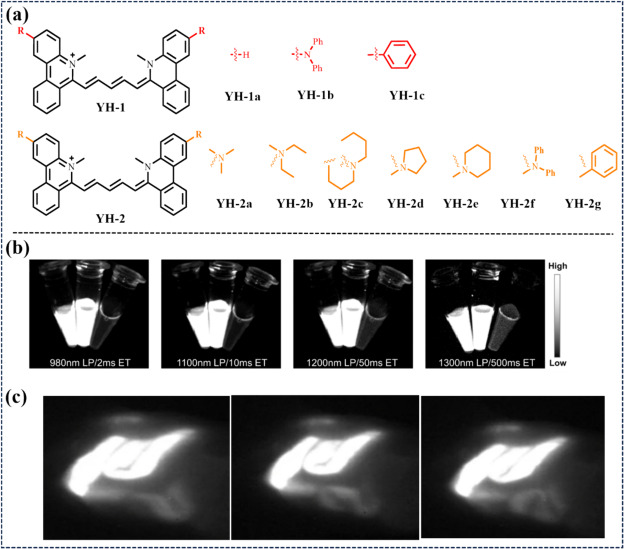
图 38. (a) YH染料的构建策略。(b) YH-1a NPs、YH-1c NPs和ICGs在 808 纳米激光照射下的亮度比较,分别使用 980 纳米、1100/1200/1300 纳米长通滤光片。(c) 尾静脉注射YH-1c NPs 后的肠道近红外-II FLI。
与此同时,熊氏研究小组在2023年采用不对称策略,构建了新型NIR-II不对称卟啉染料平台——NSCyanine(图39)。该平台对生物环境的酸碱度及粘度变化高度敏感,展现出独特的“ON-OFF”NIR-II荧光响应特性,并可通过“双键锁定”机制激活。其中,NSCy-980在急性胃炎模型中展现了非侵入性的荧光激活能力,而酸响应型NSCy-1015染料则通过光热疗法(PTT)有效清除了细菌感染,并实现了光动力与化疗的协同抗肿瘤作用。
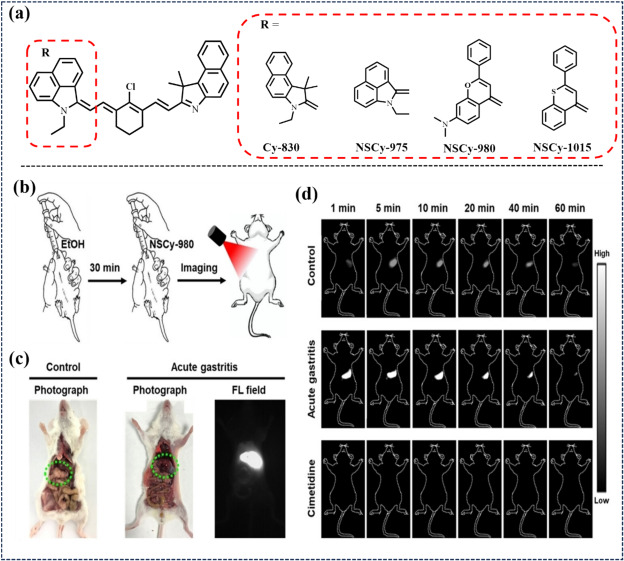
图 39. (a) NIR-II NSCyanine染料的结构。(b) 使用 NSCy-980 进行急性胃炎成像的过程。(c) 正常小鼠和急性胃炎小鼠的照片和 NIR-II FLI。(d) 正常小鼠/急性胃炎组/治疗组的时间依赖性近红外-II荧光成像。
进入2024年,Hu等人将基于苯并噻唑的荧光基团NIR-II@PS巧妙负载于PS纳米颗粒之中,有效限制了分子旋转,从而显著提升了FIGS的荧光量子产率至12.6%(图40)。在注射NIR-II@PS后,该探针在肿瘤组织内迅速积累并持续发出NIR-II荧光信号,最早在注射后22-26小时内即可清晰区分肠道肿瘤与正常组织边界,预示着其在实时肿瘤界定方面的广阔应用前景。
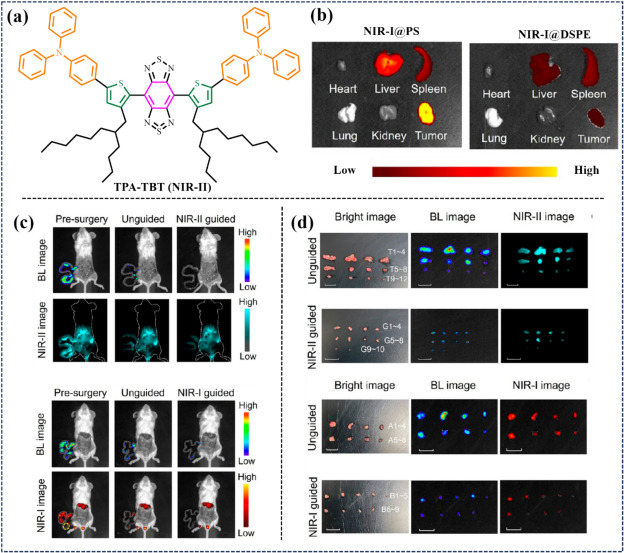
图 40. (a) TPA-TBT(NIR-II)的结构。 (b) 静脉注射 NPs 24 小时后小鼠肿瘤和器官的NIR-II FLI。(c) 通过NIR-II@PS 图和NIR-I@PS 图对腹腔肿瘤小鼠进行手术前、无引导手术后的 BL 和 NIR-II FLI。(d) 无引导、NIR-II@PS和NIR-I@PS引导下切除肿瘤的近红外-II FLI。
同年,Huang等人则构建了一种集生物降解性、NIR-II光热响应性及氧化还原敏感性于一体的有机聚合物纳米粒子——PTEQ(图41)。该纳米粒子由PTc单体、季铵阳离子(QAC)聚合物及PEG2000组成,不仅能够作为核酸载体,还能在体内激发有效的免疫反应。通过PTEQ激活肿瘤微环境(TME)中的免疫反应,并联合装载靶向程序性细胞死亡配体-1(PD-L1)的小干扰RNA(siRNA),成功打破了免疫耐受机制,使免疫疗法得以恢复其应有的疗效。此外,PTEQ纳米粒子的NIR-II光热响应性还促进了局部PTT的精准实施,实现了对肿瘤组织的深度穿透及对周围正常组织的低损伤治疗。
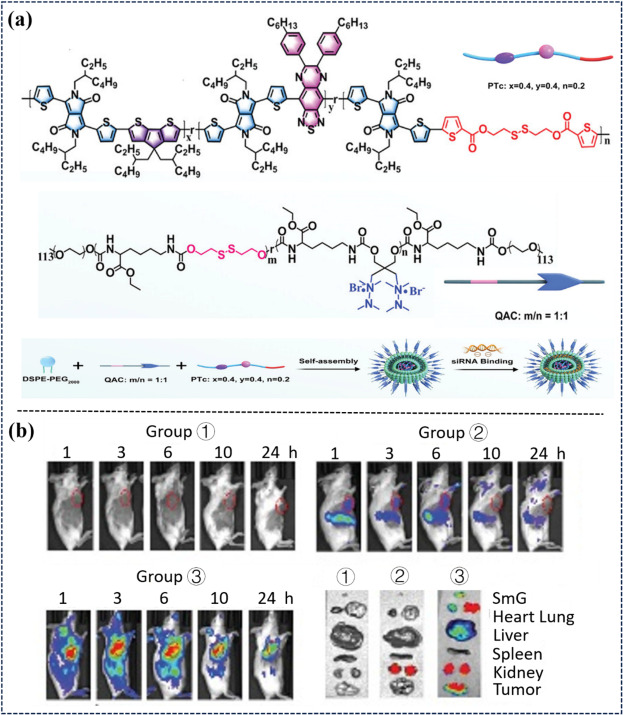
图 41. (a) PTc和 QAC的化学结构以及 SPTEQ的制备过程。字母 "r "表示共聚单体沿聚合物骨架随机排列。(b) CT-26 肿瘤小鼠的荧光图像:1 PBS;2 裸 Cy5-siRNA;3 PTEQ/Cy5-siRNA(Cy5-siRNA:0. 在注射后 1、3、6、10、24 h 采集不同器官(颌下腺(SmG)、心、肺、肝、脾、肾)和肿瘤组织的 NIR-II FLI。
10. 用于体内骨骼成像的近红外-II 有机荧光探针
骨骼,作为身体运动系统的核心支撑结构,其功能异常往往导致慢性疼痛及一系列严重并发症,最终可能引发关节损害乃至永久性残疾。常见的骨骼疾病,诸如外伤性骨折、类风湿性关节炎(RA)等慢性自身免疫介导的炎症性疾病,以及如骨肉瘤(OS)等原发性骨恶性肿瘤,均对公众健康构成了严峻挑战。鉴于此,实时、无创的近红外-II(NIR-II)荧光成像技术在骨骼相关疾病的早期诊断、手术精准导航及术后效果评估中展现出巨大潜力,尤其对于OS患者而言,这一技术有望显著提升其长期生存率,凸显了其在骨病治疗领域的重要性。
2022年,Xiao等人通过二乙酰基取代的二酮吡咯吡咯合成了一种高性能的NIR-II荧光探针(DT),该探针不仅具备优异的光物理性质,还能有效产生活性氧(ROS)。进一步地,DT与DNA损伤抑制剂AZD-2461及DSPE-MPEG5000-FA结合,形成了靶向递送系统DTA点。在808 nm近红外激光照射下,DTA点展现出强大的光动力效应,实现了体内NIR-II荧光成像与图像引导下的OS协同化学光动力治疗,显著增强了DNA损伤,为OS的联合治疗开辟了新途径。
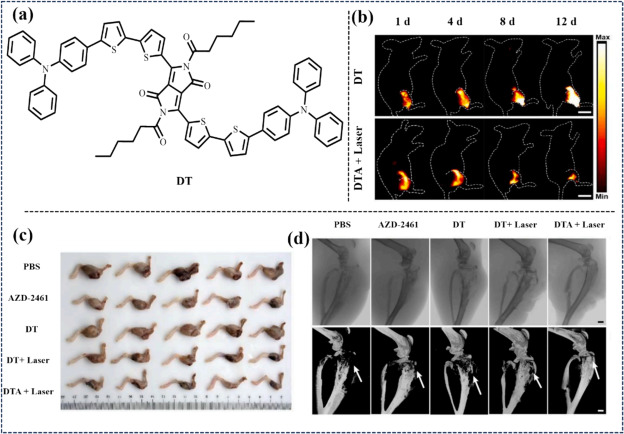
图 42. (b) 143B 荷尔蒙裸鼠(n = 3)的实时近红外-II FLI。(c) 切除肿瘤的照片。(d) 受影响肢体的代表性三维重建图像。
同年,Zhou等人利用蒽-9-基苯甲酸和2,4-二苯基噻吩等化合物,设计并合成了四种不对称聚甲胺(AEBF1119、AJBF1112、AETP1117、AJTP1110),并将其与具有抗聚集引起猝灭(ACQ)特性的半导体聚合物Pttc-TTQ封装,成功提升了近红外-II荧光(NIR-II FL)强度达十倍之多。其中,AEBF1119 Pdots作为代表性探针,通过静脉注射进入小鼠体内后,在1064 nm激光激发下,能在短时间内照亮全身血管网络并精确描绘肿瘤边界。尤为值得注意的是,该Pdots还能对脊髓及骨骼结构进行清晰成像,这得益于其较小的粒径(30-50纳米)。
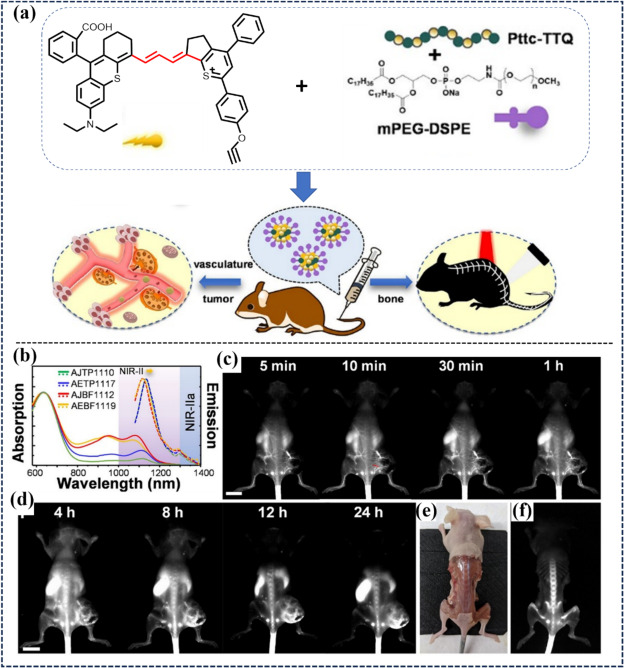
图 43. (a) 脂质涂层 Pdot 的制备和深层组织成像。(b) Pdot 的吸收和发射光谱。(c) 注射 AEBF1119 Pdots 后 4T1 肿瘤模型血管结构的实时近红外-II FLI。(d) 4T1 肿瘤模型注射 AEBF1119 Pdots 后肿瘤和骨骼的实时近红外-II荧光成像。(e)小鼠整个骨骼系统的明视野和(f)近红外-II荧光成像。
2023年,Sheng等人针对类风湿性关节炎(RA)这一顽固性自身免疫性疾病,开发了一种叶酸受体靶向的NIR-II双模态纳米探针(FA-CF-NPs),用于RA巨噬细胞的多尺度成像(图44)。RA进程中,巨噬细胞通过累积与分泌细胞因子加速疾病发展。该研究中,高吸收性、NIR-II发射的疏水小分子染料(CF)被封装于叶酸受体靶向脂质体纳米颗粒中,分子聚集导致荧光红移至NIR-II区域。通过叶酸-叶酸受体特异性相互作用,FA-CF-NPs能够选择性地识别RA生物标志物巨噬细胞,实现了RA模型小鼠的NIR-II荧光成像诊断,展现出巨大的临床应用潜力。
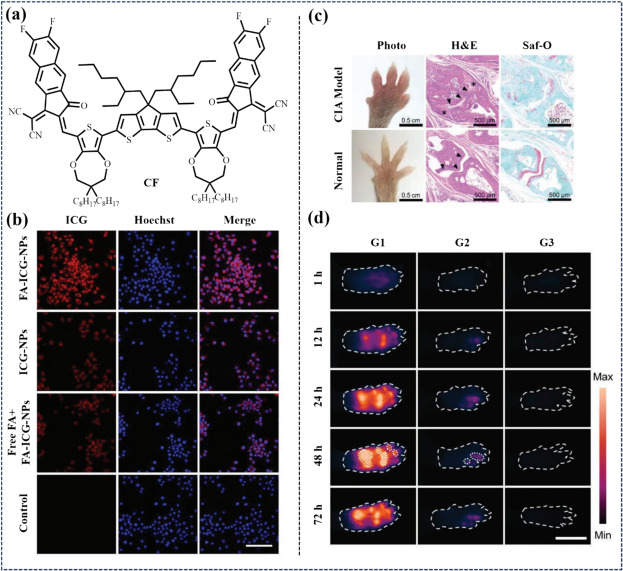
图 44. (a) **CF**的结构 (b) RAW264.7 共聚焦荧光成像显示细胞对 FA-CF-NPs的吸收 (c) CIA 模型/正常小鼠前爪的 H&E 和 Saf-O 染色。(d) 三组(G1-G3)小鼠前爪的 NIR-II FLI。
同年,Wu等人设计了一种多功能纳米探针TPC-U@HAT,旨在治疗类风湿性关节炎(RA)。该探针集成了AIE活性NIR-II荧光团TPY、NF-κB/NLRP3抑制剂咖啡酸苯乙酯(CAPE)及骨靶向透明质酸链载体HAT,形成了集多靶点、双刺激响应及按需释药于一体的治疗系统。静脉注射后,TPC-U@HAT通过主动与被动靶向机制在RA病灶处有效积聚。RA微环境中H2O2浓度升高激活了AIE荧光团TPY,增强了NIR-II荧光发射以监测RA区域。同时,CAPE与upadacitinib的释放抑制了NF-κB/NLRP3及JAK-STAT信号通路,实现了对RA的有效治疗。
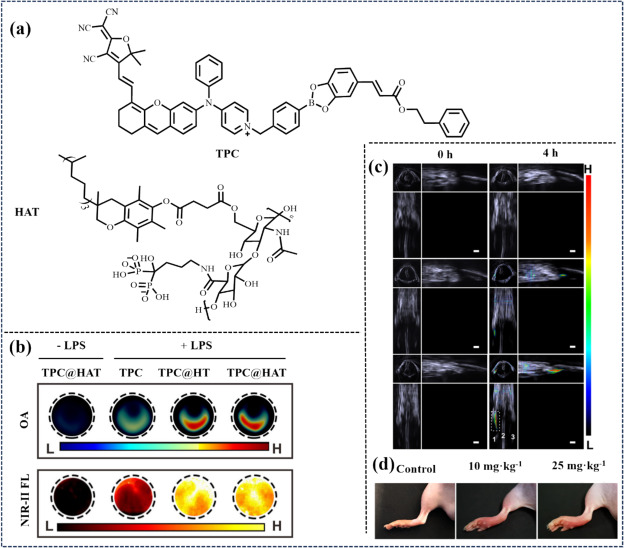
图 45. (a) TPC和 HAT的结构。(b) 光声图像(750 nm 激发)和近红外-II FL 图像。(c) 用TPC@HAT治疗小鼠 0 小时和 4 小时后的正交视角三维 MSOT 图像。(d) ZIA 模型小鼠和对照组左腿的照片。
此外,Huang等人于2023年报道了一种用于无创操作系统治疗的气体/光热诊断纳米复合材料NA1020-NO@PLX。该材料结合了热敏性一氧化氮(NO)供体、NIR-II发射基团Aza-BODIPY及两亲性质子F127。在1064 nm激光诱导的低温光热治疗(PTT)条件下,NO释放诱导线粒体及DNA损伤,促进肿瘤细胞凋亡。同时,NIR-II辐射精确定位肿瘤并监测PTT疗效,为肿瘤治疗提供了一种创新策略。
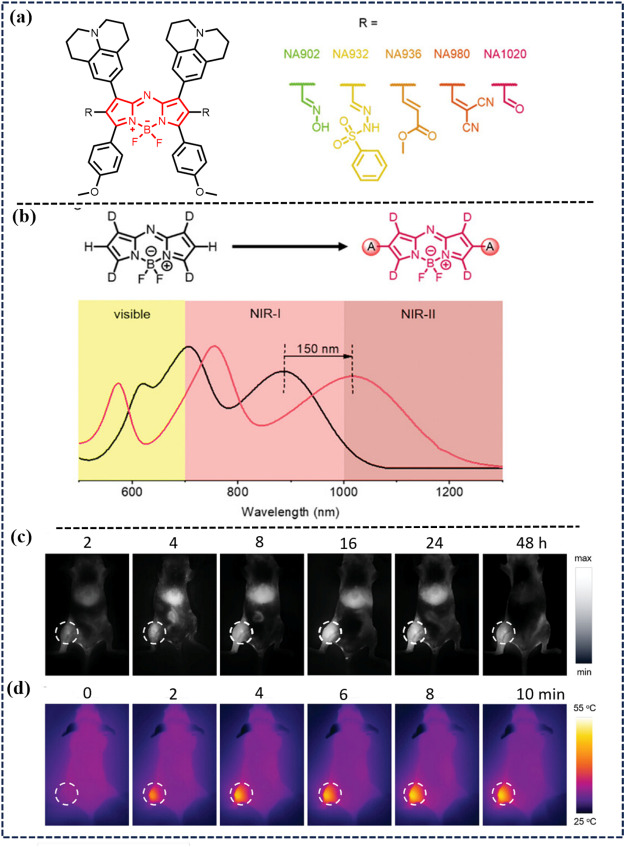
图 46. (a) NA902、NA932、NA936、NA980 和 NA1020的发展。(b) 基于增强的信息和通信技术策略设计光谱红移的 aza-BODIPYs 。(c) 使用NA1020@PLX的肿瘤模型小鼠的全身近红外-II FLI。(d)肿瘤的热图像。(1064 nm, 0.5 W-cm-2)。
11. 用于其他病灶器官体内成像的近红外-II 有机荧光探针
进一步地,科学界已报道了针对特定器官病理状态(诸如胆道疾病、子宫病变、膀胱问题及皮下移植肿瘤等)的专门化近红外-II(NIR-II)有机荧光探针的研发。这些研究成果凸显了NIR-II有机分子在多种器官疾病早期诊断与精准治疗干预中的巨大潜力和广阔前景。此类NIR-II族有机分子不仅为医学诊断与治疗领域开辟了一条创新路径,还极大地丰富了生物医学成像与治疗手段的可能性,预示着前所未有的技术革新。
具体而言,2022年,Lee等研究者凭借先进的原子编程策略,成功设计出了一系列具有可调谐NIR-IIb发射特性(即发射波长跨越1500纳米阈值)的高性能成像探针(见图47)。这些探针以其卓越的发光亮度、出色的光稳定性以及优异的生物相容性脱颖而出。在动物实验中,通过注射这些探针,研究人员能够在活体小鼠体内实现高空间分辨率与高信噪比(SBR)的微观结构清晰可视化,覆盖了包括后肢血管网络、胆管系统以及膀胱结构在内的关键生理区域,展现了其在精准医学成像中的巨大应用潜力。
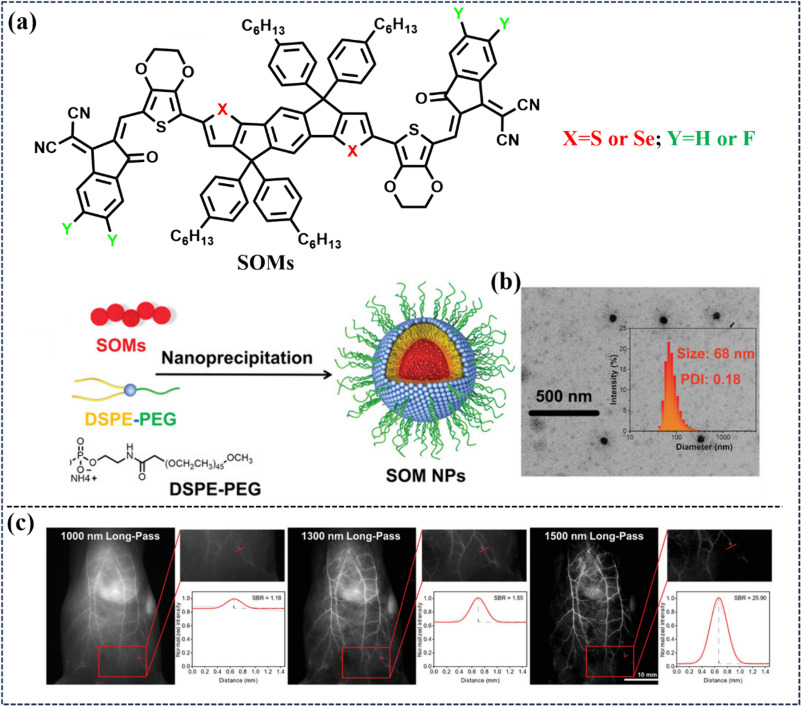
图 47. (a) SOMs NPs 的制备。(b) IDSe-IC2F NPs的 TEM 图像和 DLS 数据。(c) IDSe-IC2F NPs 标记血管的全身 NIR-II FLI。
在2023年的研究中,Tang等人创新性地引入了一种基于苯并噻唑衍生物的聚集诱导发光(AIE)荧光团策略,特别是聚焦于一种名为BBT-C6T-DPA-OMe的AIE活性分子(图48),并巧妙地将其封装于以F-127为基质的纳米光敏载体之内。这一设计显著提升了纳米粒子在近红外-II光谱区域的吸收能力,实现了更高的量子产率(QY)以及前所未有的光稳定性。得益于BBT-C6T-DPA-OMe NPs的显著亮度增强特性,研究者们成功实现了对深层组织器官的高时间分辨率灌注成像,同时保持了高帧率(HFR)的动态成像效果。尤为重要的是,近红外-II荧光成像技术在此项研究中展现出了构建荧光强度与血流速度之间直接线性关系的强大能力,这一突破使得非侵入性地精确测量小鼠心率成为可能。
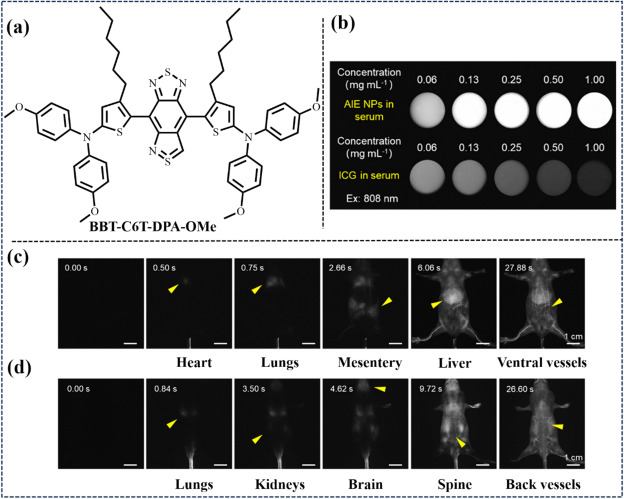
图 48. (a) 探针 BBT-C6T-DPA-OMe的结构。(b) 不同浓度的 BBT-C6T-DPA-OMe NPs 和 ICG 的 NIR-IIa FLI。(c) 注射 BBT-C6T-DPA-OMe NPs 后 0、0.5、0.75、2.66、6.06 和 27.88 秒从腹侧位置拍摄的近红外-IIa FLI。(d) 注射BBT-C6T-DPA-OMe NPs后 0、0.84、3.5、4.62、9.72 和 26.6 秒从背侧位置进行的 NIR-IIa FLI。
在2023年的研究中,Xiao等人成功研制出一种创新型的近红外-II荧光探针HZL2,该探针在小鼠模型实验中展现出了卓越的性能表现(如图49所示)。具体而言,HZL2探针根植于苯并噻唑类近红外-II荧光团的核心结构,这一设计赋予了其高量子产率(QY)、卓越的生物相容性、极低的细胞毒性,以及通过肝脏与胆道系统实现高效快速清除的显著优势。鉴于上述特性,HZL2探针在胆道闭锁这一罕见且病情严重的疾病诊断中展现出了巨大的应用潜力。胆道闭锁通常要求患者接受肝脏移植手术以挽救生命,而HZL2探针的成功应用则预示着它可能成为实现此类疾病早期检测与有效治疗的关键诊断工具。
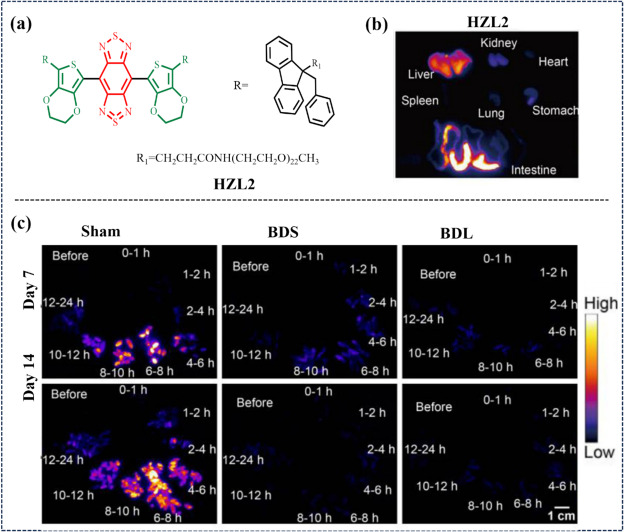
图 49. (a) HZL2的结构。(b) KM 小鼠尾静脉注射HZL2 6 小时后解剖器官(心、肝、脾、肺、肾、胃和肠)的代表性_体外_近红外-II FLI。(c) 不同时间段收集的粪便的代表性近红外-II荧光图像(每组3只小鼠)。
在2023年的研究中,Shi研究团队凭借其在化学领域的深厚造诣,创新性地设计并合成了一种基于新型苯乙烯基取代草氰基荧光团的特异性脾脏积聚近红外二区(NIR-II)荧光探针VIX-S。这一突破性成果旨在优化NIR-II荧光成像引导下的脾脏手术流程(如图50所示)。实验中,研究人员将VIX-S探针(剂量为200微升)精确注入BALB/c裸鼠的脾脏损伤模型中,以评估其在体内的分布特性与靶向效率。结果显示,该探针在脾脏与肝脏之间展现出了显著的荧光信号差异,具体表现为脾脏区域的NIR-II荧光强度显著高于肝脏,这一发现凸显了VIX-S对脾脏组织的高度选择性和特异性。进一步分析显示,脾脏与肝脏的荧光信号比率(S/L比率)约为2.2,这一数据不仅验证了探针的优异性能,也为后续的精准手术定位提供了可靠的依据。
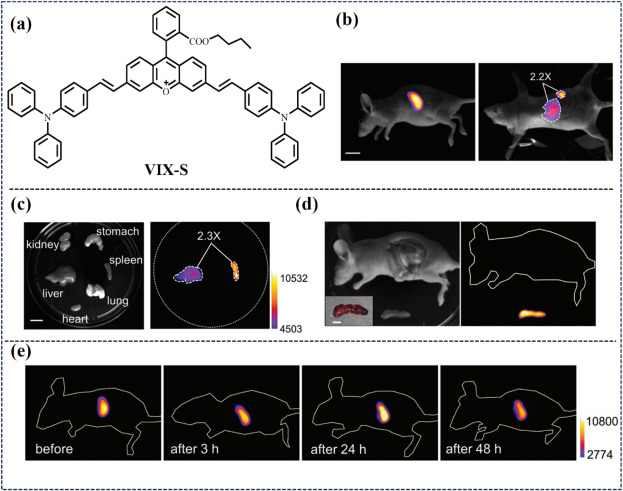
图 50. (a) VIX!single bondS. 的结构 (b) 含有 VIX-S 的 BALB/c 小鼠的近红外-II FLI。左侧为侧视图,右侧为腹视图。(c) 主要器官切除后的图像(左:明视场;右:近红外-II FLI)。(d) 小鼠脾脏切除后的宽视野图像(左)和荧光图像(右)。 (e) 注射生理盐水后脾脏的荧光变化。
在2023年的研究中,Tang团队巧妙地采用了一种创新策略,旨在提升电子供体能力并缩短D-A(给体-受体)间距,进而成功开发出一种集聚集诱导发光(AIE)特性、高量子产率(QY)及最大发射波长超越1200纳米于一体的近红外二区(NIR-II)荧光小分子探针(如图51所示)。该探针的核心设计基于BBTD受体结构,通过引入特定的分子构型,实现了显著的分子畸变,并形成了超过8埃的扩展分子间堆积距离。这一设计精妙地规避了常见的π-π堆积现象,从而在保证高效能量传递的同时,实现了在1400纳米以上波段的强烈荧光发射。得益于其独特的物理化学性质,该NIR-II FL探针在生物医学诊断领域展现出了巨大的应用潜力。具体而言,它能够在无需开腹手术的情况下,利用超高的信噪比(SBR,超过100)甚至接近零背景干扰的NIR-II荧光成像技术,对高含水量的人体病变器官(如膀胱、结肠和子宫)进行高精度、非侵入式的诊断。这一技术的实现,不仅极大地提升了诊断的准确性与安全性,也为未来精准医疗的发展开辟了新的道路。
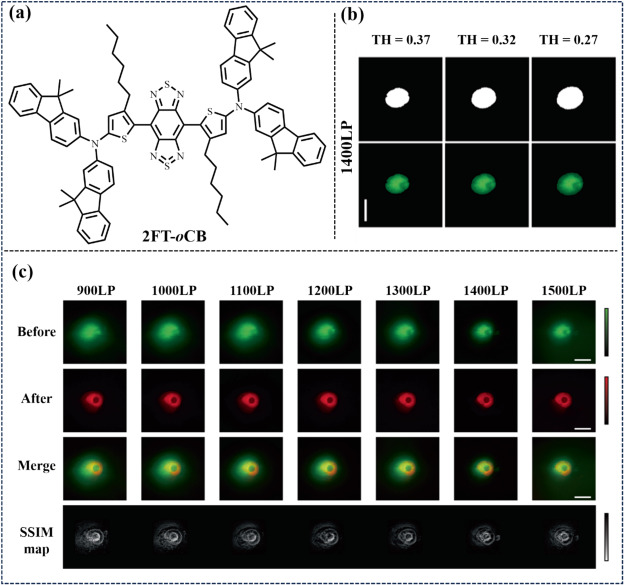
图 51. (a) 2FT-_o_CB. 的结构 (b) 二值和分割后的 NIR-IIx + NIR-IIb FL 膀胱图像的 TH 值分别为 0.27、0.32 和 0.37。(c) 打开前后膀胱造影的 NIR-IIb FLI、经 Image J 处理的合并图像以及 MATLAB 输出的 SSIM 地图。
2023年,Zhu及其研究团队精心设计与合成了系列基于卟啉骨架的近红外二区(NIR-II)荧光探针,这些探针展现出对血清蛋白的低亲和力特性(如图52所示),这一设计策略有效规避了潜在的共价结合作用,进而显著提升了荧光信号的亮度与稳定性。此外,该特性还促进了染料分子在血液循环中的快速清除与体外排泄,提高了生物相容性与安全性。在众多合成的探针中,IR-808Ac染料尤为引人注目,其能够在超过1300纳米的成像窗口内精准识别受损血管。实验结果显示,受损血管区域的荧光信号相较于正常血管呈现出显著减弱,这一发现有力证明了IR-808Ac的高选择性与灵敏度。鉴于IR-808Ac在小鼠背部复杂血管网络(包括胸背动脉(TDA)、肋间后动脉(PICA)、髂深环动脉(DCIA)及臀下动脉(IGA))中的精确NIR-II成像能力,该探针被进一步应用于评估血管阻塞后的区域扩张与新生血管形成过程,以精准判断皮瓣移植手术的存活率。在大鼠背侧皮瓣移植模型中,通过多次注射IR-808Ac,研究团队能够清晰地观察到血流减少的区域,这些区域在荧光图像中呈现为暗区,而皮瓣内的荧光信号则完全源自血管结构,未在任何发炎或结痂的病变组织中观察到非特异性的荧光积累。这一研究成果不仅深化了对皮瓣移植术后血管再生机制的理解,也为未来临床评估皮瓣存活状态提供了强有力的工具。
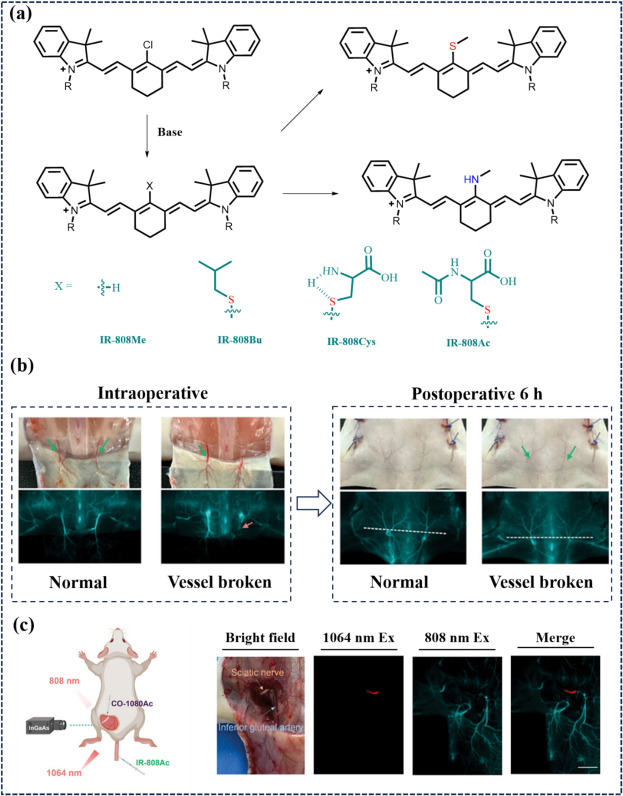
图 52. (a) 含氯花菁染料不同取代基的取代结构。(b)术中和术后观察到的臀下动脉(IGA)损伤的近红外-II 血管造影。绿色箭头表示 IGA,红色箭头表示断裂的血管。(c) 坐骨神经(SN)和 IGA 的双色近红外-II FLI。包括坐骨神经和 IGA 的双色 NIR-II FLI。
Tang等人巧妙地融合了聚集诱导发光(AIE)原理,设计出了一系列多功能的光热诊断与治疗剂。这些创新制剂的核心构建模块是一种独特的四苯基乙烯-三苯胺(TPE-TPA)结构单元,该单元被精心设计为高效的电子供体,能够在分子体系中发挥关键作用。另一关键组成部分则是化合物BETT-2,其内含一种特殊的电子受体——硒二唑并[3,4-f:2,5]噻二唑(SBTD),这一独特的结构赋予了BETT-2独特的光电性质。随后,研究人员将BETT-2精心封装成纳米颗粒形式,即BETT-2 NPs。这些纳米颗粒在受到1064纳米激光激发时,展现出了令人瞩目的近红外二区(NIR-II)荧光成像(FLI)强度,同时表现出优异的活性氧(ROS)释放能力以及较高的光热转换效率(PCE)。在NIR-II FLI的引导下,BETT-2 NPs实现了荧光(FL)、光声(PA)与光热(PT)多模式成像技术的整合,这一集成平台极大地促进了光动力治疗(PDT)与光热治疗(PTT)在_原位_4T1肿瘤模型中的联合应用。该研究不仅深化了光热诊断与治疗领域的科学理解,还为未来精准医疗技术的发展提供了宝贵的思路与实验基础。
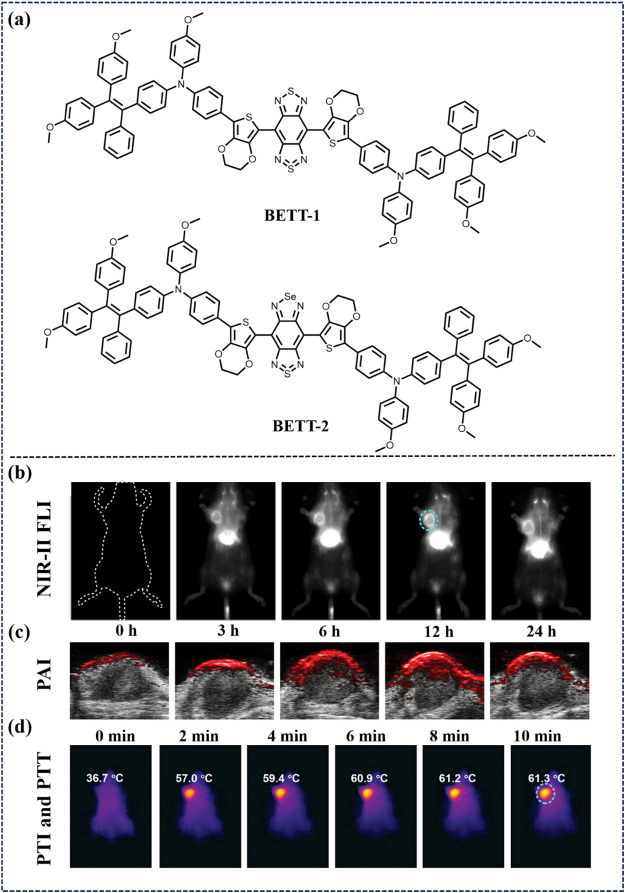
图 53. (a) 探测器 BETT-1 和 BETT-2 的结构。(b) 时间依赖性近红外-II FLI。(c) 用BETT-2 NPs治疗正位 4T1 乳腺肿瘤小鼠的 PAI。(d) 注射BETT-2 NPs 12 小时后,肿瘤在 1064 纳米激光照射下的温度变化。
2022年,Peng研究团队成功合成了一种具备正电荷特性的近红外二区(NIR-II)噁二唑基染料DUT850,该染料的核心结构展现出一个庞大的刚性平面V型构象(如图54所示)。这一独特设计赋予了DUT850与细胞质内特定CL(如心磷脂)结构域高效且迅速结合的能力。在癌细胞环境中,DUT850与CL的相互作用触发了类似“滚雪球”的级联反应,导致活性氧(ROS)的急剧生成、细胞内Ca²⁺稳态的失衡以及ATP能量的耗竭,这一系列生物化学变化协同作用,激活了凋亡信号通路,有效抑制了肿瘤细胞的转移潜能。值得注意的是,DUT850不仅展现出适中的NIR-II荧光发射特性,还具备强烈的NIR-I吸收能力,同时其内部庞大的电子转移系统赋予了它卓越的光热转换效率(PCE),具体表现为高达60%的光热转换率(η)。这些优异的光学性能使得DUT850在光动力疗法(PDT)和光热疗法(PTT)中均展现出非凡的治疗效果和极高的光稳定性。进一步地,通过将DUT850封装于牛血清白蛋白(BSA)中,形成DUT850@BSA复合物,研究团队在肿瘤异种移植模型中成功实现了NIR-II荧光导航下的PDT与PTT协同治疗策略。这一创新方法不仅提高了治疗的靶向性与精准度,还显著增强了治疗效果,为癌症治疗领域提供了新的思路与手段。
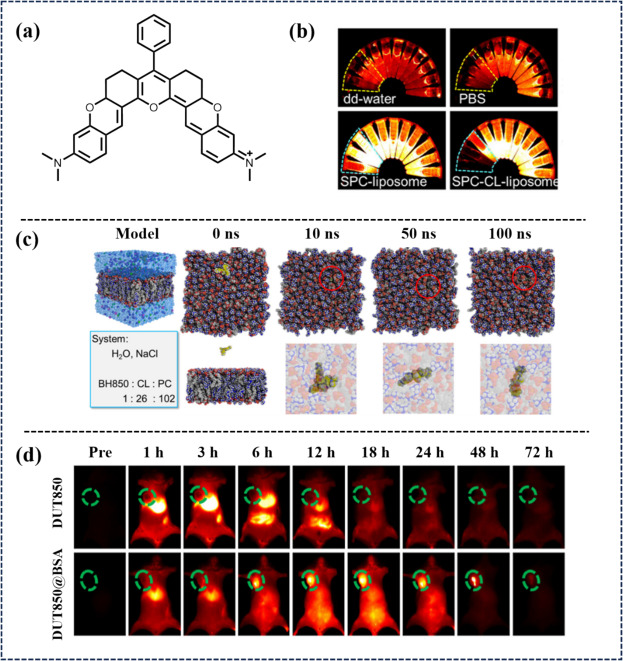
图 54. (a) DUT850的近红外-II荧光探针。 (b) DUT850(0-100 μM)在不同体系中的近红外-II荧光成像。(c) 磷脂双层上DUT850轨迹的分子动力学(MD)模拟。(d) 4 只罹患 T1 肿瘤的小鼠在不同间隔静脉注射DUT850@BSA NPs 和 PBS 中的DUT850时的近红外-II FLI。
Tan研究团队发表了一项重要研究成果,介绍了一种创新的近红外二区(NIR-II)荧光探针——TPA-BD。该探针巧妙地融合了二硫键与BODIPY(硼二吡咯甲川)荧光团,赋予了其强大的光动力治疗(PDT)潜力(如图55所示)。在癌细胞内部环境中,TPA-BD能够迅速响应谷胱甘肽(GSH)的存在并发生降解,这一特性为实现精准肿瘤治疗提供了可能。为了进一步提升治疗效果,研究团队将ROS敏感聚合物(P1)、DSPE-PEG2000(一种常用的生物相容性聚合物修饰剂)以及抗癌药物仑伐替尼与TPA-BD共同组装成复合纳米粒子(Combo-NP)。在辐射暴露下,ROS敏感聚合物被特异性分解,从而释放出TPA-BD和仑伐替尼。随后,TPA-BD在细胞内生成大量活性氧(ROS),触发免疫原性细胞死亡(ICD),这是一种能够激活免疫系统以攻击肿瘤细胞的强大机制。值得注意的是,细胞内过量的GSH进一步促进了TPA-BD的降解,这一自我调节过程有助于减少潜在的副作用并优化治疗效果。此外,Combo-NP还展现出改善肿瘤微环境的能力,通过修复受损的肿瘤血管来缓解缺氧状态,进而增强了PDT的治疗效果。
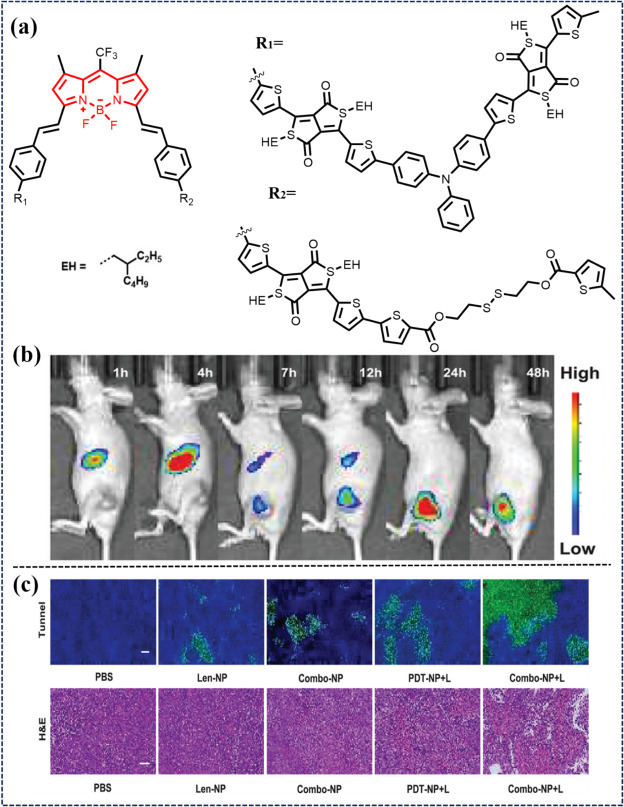
图 55. (a) TPA-BD的构建。(b) 通过 NIR-II FLI 对 OCM1 诱导模型经 Combo-NP@Cy7.5 处理后Combo-NP的生物分布。(c) H&E 染色和 TUNEL 检测。来源于参考文献。
Tang研究团队在化学领域取得了显著进展,他们利用二噻吩并[3,2-b:2',3'-d]吡啶这一创新结构,成功设计出一种高效的近红外二区(NIR-II)光敏剂——DTP-In。通过精心调控分子结构,减小了DTP-In的能隙,这一优化策略显著提升了其在光激发下产生活性氧(ROS)的效率,进而增强了其作为光动力治疗(PDT)试剂的潜力。更为独特的是,DTP-In分子能够在水溶液中自发组装,形成带有正电荷的纳米聚集体。这种自组装行为不仅增强了其在生物环境中的稳定性,还为其在细胞或组织中的有效分布与靶向提供了便利。
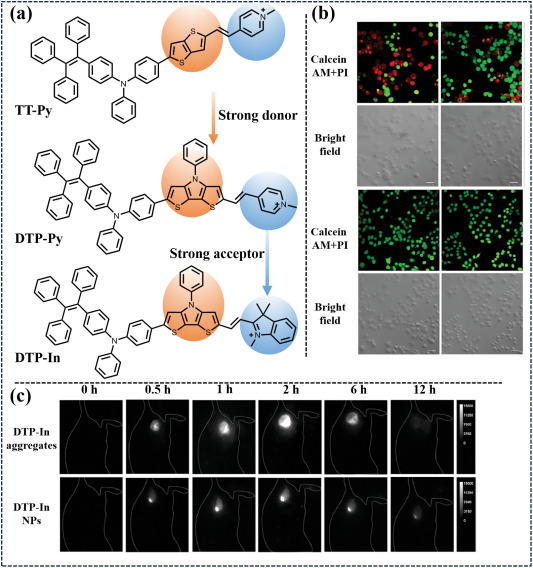
图 56. (a) 近红外荧光探针 DTP!single bondIn的设计策略。(b) 以 Calcein-AM 和 PI 为指示剂,在不同条件下用 DTP-In聚合物/纳米颗粒或 PBS 培养 4T1 细胞后,对活细胞/死细胞进行共染分析。(c) 模型小鼠在不同时间间隔体内注射DTP-In聚合物和 NPs 后的 4T1 NIR-II FLI。
在2023年,Li及其研究团队成功设计出一种兼具卓越光稳定性与高效近红外二区(NIR-II)发射性能的新型探针——ICR(如图57所示)。其中,特别值得一提的是ICR-Qu变体,其展现出令人印象深刻的光热转换效率(PCE),高达81.1%,这一数据显著优于同类材料。为进一步优化ICR-Qu的性能并拓展其应用领域,研究团队创新性地采用纳米技术,将ICR-Qu封装成纳米颗粒形态,即ICR-QuNPs。这一转变不仅保留了ICR-Qu原有的高光稳定性和高效NIR-II发射特性,还赋予了其多模态成像能力,包括荧光成像(FLI)、光声成像(PAI)以及潜在的光热治疗(PTI)功能,实现了诊断与治疗的有机结合。尤为重要的是,ICR-QuNPs在乳腺癌的精准治疗方面展现出巨大潜力。通过精确靶向并定位于乳腺癌组织,ICR-QuNPs能够有效辅助手术切除,并显著抑制肿瘤的生长与扩散。此外,研究还揭示了ICR-QuNPs与免疫检查点抑制剂α-PD-1结合的可能性,这一发现为开发新型、简便且高效的免疫疗法光疗工具开辟了新途径,有望在未来癌症治疗中发挥重要作用。
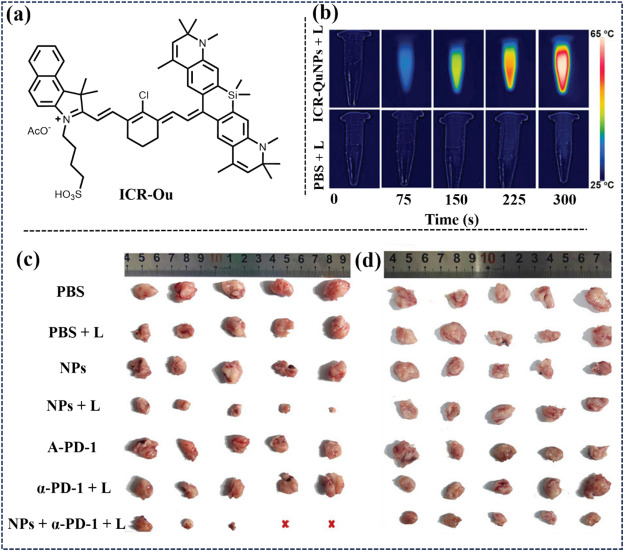
图 57. (a) 探针 ICR-Ou. 的结构 (b) 不同照射时间下 ICR-QuNPS (10 μm)的照片。(c) 原发肿瘤。(d) 不同治疗下远处肿瘤的照片。
2024年,Wang研究团队在材料科学与生物医学领域取得了重要突破,他们巧妙地将苯并噻吩并[c]噻吩作为π共轭桥段,设计并合成了一种具有聚集诱导发光特性的新型近红外二区(NIR-II)荧光探针——BT-NS(如图58所示)。该探针展现出了卓越的NIR-II荧光发射性能、高效的活性氧(ROS)释放能力以及优异的光热转换效率(PCE)。为了提升BT-NS在生物体内的稳定性和靶向性,研究团队采用DSPE-mPEG2000作为载体基质,通过纳米技术成功将其封装为均匀的纳米颗粒,即BT-NS NPs。这种纳米结构不仅保持了BT-NS原有的优异性能,还通过增强渗透性和滞留(EPR)效应显著提高了其在肿瘤组织中的富集度。BT-NS NPs凭借其强大的ROS生成能力和高光热转换效率,在NIR-II荧光成像(FLI)、光声成像(PAI)以及光热治疗(PTI)的多模态引导下,实现了对PDT(光动力治疗)/PTT(光热治疗)的高效协同作用。这一创新疗法在4T1肿瘤小鼠模型中取得了显著成效,成功实现了肿瘤的根除,为癌症治疗领域带来了新的希望与可能。
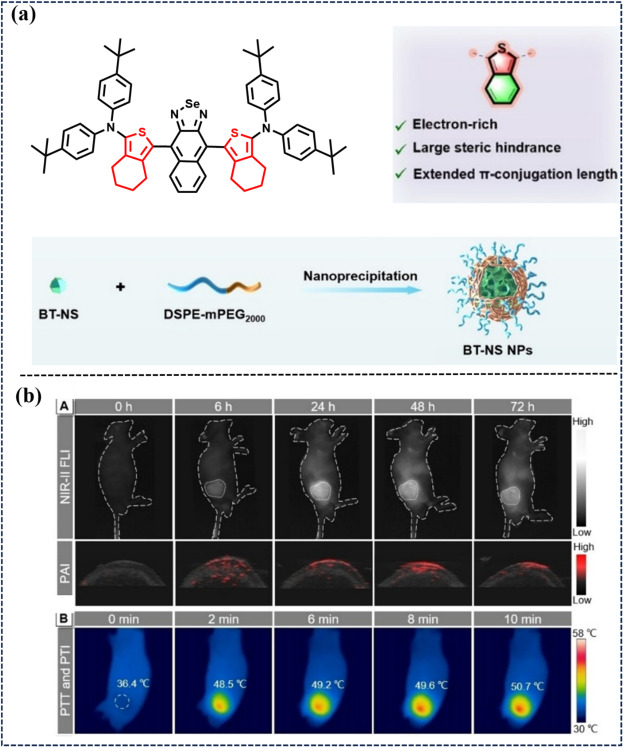
图 58. (a) BT-NS的化学结构和纳米 BT-NS NPS的制备。(b) NIR-II FL/PA 生成和肿瘤模型中的光热疗法。
12. 结论与展望
近红外二区(NIR-II)有机荧光团在活体器官实时成像领域,以其无创性及高时间/空间分辨率的特性,展现了非凡的应用潜力,特别是在临床前与临床病理研究、疾病诊断与治疗策略中展现出巨大前景。本综述聚焦于NIR-II有机荧光探针在多样化器官疾病成像中的最新进展,并深入剖析了当前面临的挑战与未来发展方向。
挑战与机遇
1. 拓展应用领域
目前,NIR-II荧光探针主要集中在实体肿瘤与血管成像,而在膀胱、生殖器官、脾脏及胆管等器官的应用研究尚显不足。此外,针对心脏疾病(如心力衰竭、心肌梗塞)、呼吸系统疾病(哮喘、肺纤维化)及甲状腺疾病的NIR-II成像探索亦亟待加强,以拓宽其临床应用范围。
2. 血脑屏障穿透性
在脑成像领域,血脑屏障(BBB)构成了外源性分子进入脑组织的重大障碍。开发能够主动穿透BBB的小型NIR-II荧光分子,减少对外部辅助的依赖,是实现高效脑内蓄积与明亮荧光成像的关键。
3. 主动靶向能力
提高NIR-II荧光分子对特定器官的主动靶向能力是提升成像分辨率与诊断准确性的重要途径。当前,静脉给药后肝脏快速代谢限制了其在其他器官的有效蓄积。因此,开发具有内在靶向机制的NIR-II荧光团,以延长循环时间并增强特异性累积,对疾病模型的精准诊断至关重要。
4. 病变精准识别
现有NIR-II荧光团多表现为“常亮”状态,难以区分病变组织与正常组织。开发基于生物标志物触发的“OFF-ON”型NIR-II荧光分子,实现病变区域的特异性点亮,是提升成像精度的关键。同时,探索多生物标志物同时检测的能力,将进一步提升诊断的全面性与准确性。
5. 探针设计优化
新型NIR-II荧光探针的设计需综合考虑生物标志物识别、水溶性与亲油性平衡、化学与光稳定性、体内循环时间及生物毒性等因素。通过整合蛋白质、脂质体或细胞膜等材料,赋予探针多功能性,如光疗、靶向药物递送等,以扩大其在生物医学领域的应用潜力。
6. 多模式成像技术
为克服单一成像模式的局限性,发展集成光声、光热、计算机断层扫描(CT)等多模态成像探针成为趋势。结合高分辨率成像光学技术的发展,将显著提升诊断的灵敏度与时空分辨率,为复杂疾病的精准诊断提供有力支持。
7. 加速临床转化
鉴于小型动物模型与人类器官结构的差异,采用大型动物或非人灵长类动物作为研究模型,将更贴近临床实际,加速NIR-II有机荧光探针的临床转化进程。
总结与展望
尽管NIR-II有机荧光团在器官成像领域面临诸多挑战,但随着高量子产率(QY)荧光分子的开发以及多功能成像系统的不断进步,其在更广泛器官与疾病成像及治疗中的应用前景将更加广阔。未来,通过持续的创新与优化,NIR-II有机荧光团有望成为生物医学研究与临床应用中的强大工具。