荧光探针大家族
外源性荧光探针的种类繁多,各具特色。本节将重点介绍在生命科学研究中应用最广泛的三大主流探针类别:有机小分子染料、荧光蛋白和量子点,并简要介绍一些新兴的探针技术。
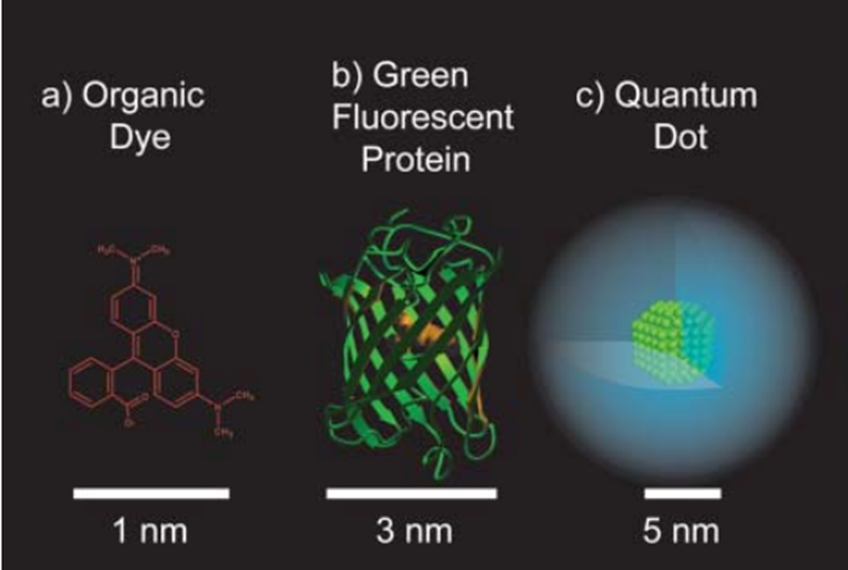
图5-1. 外源性荧光探针。(图片来源:10.1039/B600562B)
有机小分子染料
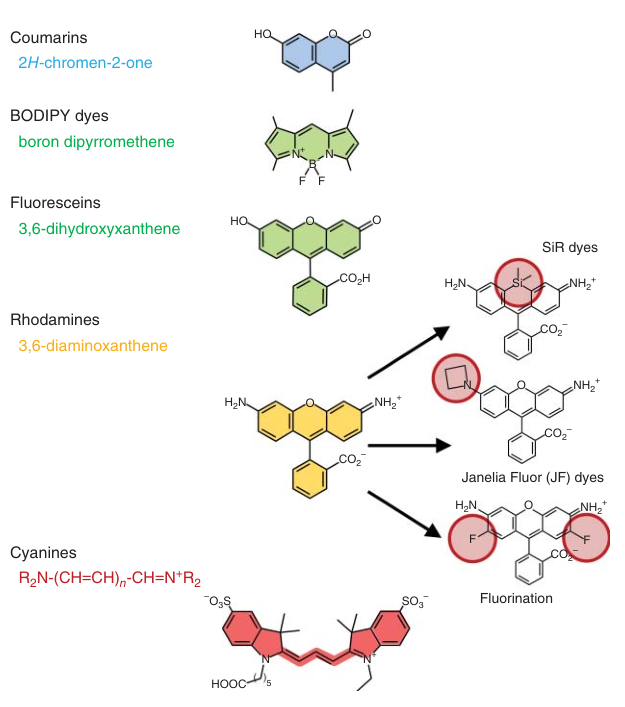
图5-1. 几种常见有机荧光探针的结构
香豆素(Coumarins)
香豆素及其衍生物是一类重要的杂环化合物,其母体结构为苯并-α-吡喃酮。它们作为荧光染料的历史悠久,以其优异的光物理性质、易于合成与修饰以及对环境的敏感性而著称,是蓝绿光波段最常用的一类染料。
化学结构与发光机理
香豆素(Coumarin)类染料是一大类重要的荧光分子,它们均基于一个共同的核心化学骨架------2H-chromen-2-one(图 6‑1)。该骨架本身的荧光非常微弱,但其真正的价值在于它提供了一个极具潜力的化学修饰平台,通过在其苯环和吡喃酮环上引入不同的官能团,科学家们可以对其光物理性质进行广泛而精细的调控,从而衍生出性能各异的荧光探针。
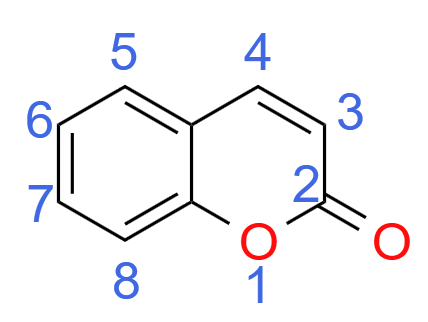
图 6‑1. 香豆素的结构
香豆素(Coumarin)母核本身荧光微弱甚至不发荧光,但通过在其结构上引入合适的取代基,可合成出在可见光区域具有高效荧光的香豆素衍生物。自20世纪80年代以来,香豆素染料以其优异的光物理性质,成为众多科学家关注的焦点,特别是在开发用于特定波长的高效激光染料方面。为了实现这一目标,大量的研究投入到对香豆素基染料光物理性质的系统性探索、理解与优化中。得益于其高荧光量子产率、可调谐的发射波长以及对微环境极性的高度敏感性,数百种香豆素衍生物已被成功开发为光学增白剂、分散染料和激光染料等各类荧光材料的核心组分。尽管许多报道的香豆素激光染料并未得到广泛应用,但迄今仍有数十种不同类型的香豆素染料在商业上作为激光染料出售,证实了其独特的价值。
前人对荧光香豆素光物理性质的系统性研究,揭示了至关重要的结构-性质关系,这不仅对激光染料的优化至关重要,也为设计高效的荧光化学传感器提供了核心指导。研究表明,通过在香豆素母核上进行不同位置的取代,可以有效调控其荧光发射波长,使其发生蓝移或红移。具体而言,在6位或7位引入强供电子基团,或在3位、4位引入吸电子基团,均能显著导致荧光发射波长的红移。值得注意的是,7-氨基香豆素衍生物的荧光量子产率,与其7位氨基官能团的取代模式密切相关。通过系统测量这些香豆素在不同极性溶剂中的荧光量子产率和寿命,研究者得以构建并验证一个重要的非辐射衰变模型。该模型提出,当分子处于激发态时,其平面化的分子内电荷转移(ICT) 结构会转变为非荧光性的扭曲分子内电荷转移(TICT) 结构。这种扭曲过程是一种主要的非辐射衰变途径(参见图6-2,展示了两种几何构象的共振形式)。因此,通过引入特定结构来空间位阻或抑制这种扭曲过程,可以显著提高分子的荧光量子产率。
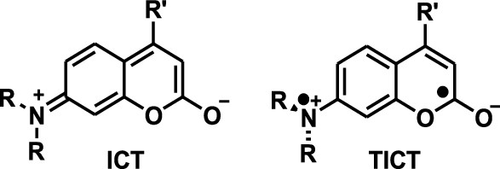
图6-2 激发态氨基香豆素两种几何形状的共振形式 (10.1021/acs.chemrev.9b00145)
光物理性质
香豆素类染料的光物理性质表现出几个鲜明的共同特征。在光谱范围上,它们的吸收光谱通常位于350至450纳米的紫外至紫光区域,而发射光谱则分布在400至550纳米的蓝光至绿光区域,具有中等大小的斯托克斯位移(通常为50-100纳米)。在发光效率方面,许多香豆素衍生物在非质子溶剂中表现卓越,其量子产率常常可以接近完美的1.0,但在水等质子溶剂中,由于氢键的形成等相互作用会为激发态提供额外的能量耗散途径,其量子产率通常会显著下降。
然而,香豆素染料最为人称道和广泛应用的特性是其对环境的敏感性。首先,它们对溶剂极性高度敏感(即溶剂化显色效应)。由于其"分子内电荷转移"(ICT)激发态具有很强的极性,当溶剂的极性增加时,这个激发态会得到更有效的稳定化,从而能量降低,导致其发射光谱发生显著的红移。这一特性使得香豆素成为一类探测生物体系中微环境极性(例如细胞膜的疏水内部或蛋白质的活性口袋)的理想分子探针。
其次,特定结构的香豆素还表现出对pH值的敏感性。其中最经典的例子是7-羟基香豆素(又称伞形酮)。在酸性或中性条件下,其7位的羟基使其发出蓝色荧光;而一旦环境变为碱性,羟基便会去质子化形成一个酚氧负离子。这个负离子是比羟基强大得多的给电子基团,从而极大地增强了整个分子的"推拉电子"效应和共轭程度。其直接后果是,分子的吸收和发射光谱都发生显著的红移,荧光颜色从蓝色转变为绿色,并且通常伴随着荧光强度的急剧增加。正是这种对pH值灵敏的"开关"式或颜色变化式响应,使得7-羟基香-豆素及其衍生物成为了用于测定和可视化体系酸碱度变化的经典荧光pH探针。
合成与修饰
香豆素的合成方法非常成熟,最经典的是Perkin缩合反应(图2‑2):邻羟基苯甲醛(水杨醛)与乙酸酐和无水乙酸钠在180℃共热而制得香豆素;此外还有Perchman反应(图 2‑3)**:苯酚与β-酮酸类化合物如乙酰乙酸乙酯在浓硫酸存在下缩合,得到香豆素。
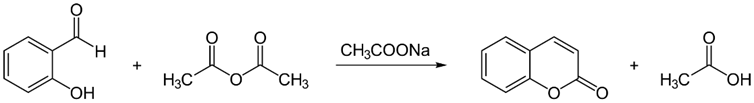
图 2‑2 Perkin缩合反应制备香豆素
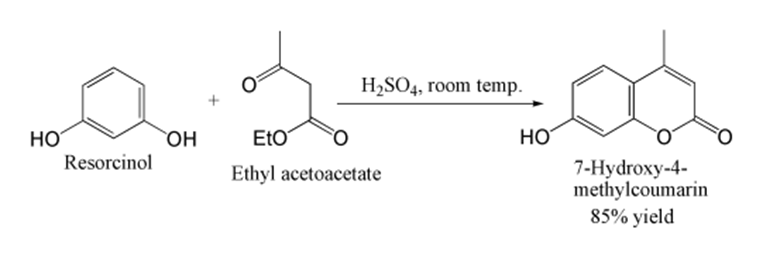
图 2‑3 Perchman反应制备香豆素
基于传统的制备方法,香豆素可以非常容易的进行各种官能团的修饰:
7位修饰:通过选择不同的取代苯酚,可以方便地引入各种给电子基团。
4位修饰:通过改变β-酮酸酯,可以在4位引入不同基团。例如,引入三氟甲基(-CF₃)可以增强吸电子性,使光谱蓝移,同时提高光稳定性和量子产率。
3位修饰:通过Knoevenagel缩合反应,可以在3位引入氰基、酯基等吸电子基团,有效实现光谱红移。
引入反应基团:在香豆素骨架上引入马来酰亚胺、N-羟基琥珀酰亚胺酯(NHS ester)、异硫氰酸酯(ITC)等基团,可以使其与生物大分子(如蛋白质、核酸)上的氨基、巯基共价连接,实现特异性标记。
优缺点
香豆素类染料之所以在荧光探针领域经久不衰,源于其一系列突出的优点。首先,它们通常具有很高的量子产率和良好的光稳定性(特别是引入三氟甲基等基团后),确保了信号的明亮与持久。其次,它们对微环境(如溶剂极性、pH值)的高度敏感性,使其成为构建各类功能性分子传感器的优良骨架。在化学应用层面,香豆素的合成方法非常成熟,化学家们可以灵活地对其结构进行多样化修饰,以优化性能或引入靶向基团。此外,其普遍较小的分子量赋予了它们良好的细胞膜渗透性,便于在活细胞成像中应用。
然而,香豆素染料也存在一些固有的缺点和应用限制。其最主要的局限在于,它们的发射光谱绝大多数集中在蓝光至绿光区域。这个波段不仅容易受到细胞和组织样本自身发出的蓝色或绿色自发荧光的严重干扰,从而降低信噪比,而且这些短波长的光在生物组织中的穿透深度也非常有限,不适合用于深层组织或活体成像。另外,正如前述,它们的发光性能在水相缓冲液中有时会因发生淬灭而有所下降。最后,对于一些为实现特定功能而设计得结构较为庞大复杂的香豆素衍生物,在生物应用中可能会出现非特异性结合的问题,增加了背景信号的干扰。
应用
得益于香豆素染料多样且可调的光物理化学性质,它们的应用领域极为广泛,横跨了从基础生命科学到前沿材料科学的多个学科。
在生物成像与传感领域,香豆素的核心价值得以充分体现。它们被广泛用作结构性探针,用于标记和可视化特定的细胞器,如线粒体和溶酶体。同时,它们也是一类重要的酶活性检测试剂,例如,无荧光的香豆素衍生物可以被设计成特定酶(如GUS基因报告系统中的β-葡萄糖醛酸苷酶)的底物,一旦被酶催化裂解,就会释放出强荧光的香豆素分子,从而实现对基因表达或酶活性的灵敏检测。更进一步,利用其环境敏感性,化学家们设计了大量精巧的分子探针,这些探针的荧光信号能够对环境中特定的分析物做出响应,例如,通过与金属离子(如Hg²⁺, Cu²⁺)或活性氧(ROS)物种结合而实现荧光的"开启/关闭",或是通过信号的比例变化来定量检测酶的活性。
在生物领域之外,香豆素在物理与材料科学中同样扮演着重要角色。许多香豆素衍生物(如Coumarin 460, Coumarin 540A)因其极高的发光效率和良好的光稳定性,成为了性能卓越的激光染料,是可调谐染料激光器中的核心增益介质。近年来,在有机光电子学领域,香豆素分子凭借其强烈的蓝色发射和良好的电荷传输性能,被成功应用于有机发光二极管(OLED)技术中,担当蓝色发光层中的关键发光材料或主体材料,为下一代显示和照明技术的发展贡献力量。
罗丹明(Rhodamines)
罗丹明类染料是呫吨类染料的杰出代表,以其极高的摩尔吸光系数、优异的量子产率和出色的光稳定性而闻名于世。它们是生物学、分析化学和材料科学中应用最广泛的荧光染料之一,主导着橙红光(550-650 nm)区域。
图 2‑4 经典罗丹明的结构
化学结构与发光机理
罗丹明染料的基本骨架是呫吨(Xanthene)环,其两端连接着被烷基化的氨基。
核心结构:三环并合的呫吨结构提供了刚性的平面共轭体系。两端的氨基作为强给电子基团,而呫吨环上的氧原子则起到调节电子云分布的作用。
螺环内酰胺结构:许多罗丹明探针被设计成"螺环"形式。在这种形式下,呫吨的共轭体系被破坏,分子无色且不发荧光(关态)。当与特定分析物(如金属离子)反应时,螺环打开,恢复共轭的呫吨结构,释放出强烈的荧光(开态)。这是设计"turn-on"探针的经典策略。
电荷状态:罗丹明分子通常带正电荷,这使得它们具有良好的水溶性,并倾向于在线粒体等负电位富集的细胞器中积累。
经典代表包括罗丹明B(Rhodamine B)和罗丹明6G(Rhodamine 6G)。它们的区别在于羧基的形式:罗丹明B的羧基是游离的,而罗丹明6G的羧基被酯化了。这一微小差异导致了它们在不同溶剂中光谱行为和聚集行为的显著不同。
光物理性质
罗丹明(Rhodamine)类染料是荧光成像领域中一类基石性的、性能卓越的荧光分子,其光物理性质表现出多个显著的优点。它们的核心工作区域位于可见光光谱,通常在540至580纳米的绿黄光区有强烈的吸收,并在560至620纳米的黄-橙-红光区发射荧光。罗丹明最为人称道的特性是其极高的亮度,这源于其通常超过100,000 M^-1^cm^-1^的超高摩尔吸光系数,以及在乙醇等有机溶剂中常常接近1.0的量子产率。
在稳定性方面,罗丹明同样表现出色。首先,它们具有非常出色的光稳定性,远优于传统的荧光素和许多香豆素衍生物,这一特性使其成为需要长时间、高强度光照的应用(如单分子追踪、共聚焦扫描和超高分辨率成像)的理想选择。其次,罗丹明在很宽泛的pH范围内(通常是pH 4-10)其光谱性质都保持高度稳定,几乎不受pH变化的影响。这在生理条件复杂多变的生物学实验中是一个巨大的实践优势,确保了信号的可靠性和可重复性。
然而,罗丹明也存在一些需要注意的缺点。其最主要的短板是斯托克斯位移非常小,通常仅有20至30纳米,这使得其吸收光谱和发射光谱有显著重叠。这种重叠在高浓度下容易导致发射的荧光被周围其它染料分子重新吸收(即自吸收或淬灭效应),从而影响信号的线性度和定量准确性。此外,在水溶液中,罗丹明分子易于通过疏水作用形成无荧光的H-二聚体,这也会导致其量子产率有所下降。尽管如此,凭借其无与伦比的亮度、光稳定性及pH稳定性,罗丹明家族至今仍是荧光技术中应用最广泛、最重要的染料之一。
合成与修饰
罗丹明染料的成功不仅在于其优异的光物理性质,还在于其高度灵活的化学合成与修饰潜力,这使其能够从一个基础骨架衍生出性能各异、功能繁多的探针库。其经典的合成路线是通过间氨基苯酚衍生物与邻苯二甲酸酐(或其衍生物)在酸性条件下加热缩合而成,而现代化学家们则在此基础上发展了多种策略,以精确地调控其性能和功能。
在光谱调控方面,主要有几种关键策略。其一,通过延长共轭体系,例如在核心的呫吨环结构上稠合上苯环或其他共轭基团,可以有效地使染料的吸收和发射光谱发生红移。其二,一项革命性的进展是硅原子取代策略,即将呫吨环上的桥氧原子替换为硅原子,构建成"硅罗丹明"(Si-rhodamine)。由于硅原子的d轨道能够参与共轭,显著降低了分子的LUMO能级,因此这一改造可以将光谱大幅红移至更有利于生物应用的近红外区域(大于650纳米),使得硅罗丹明成为当前近红外活体成像领域的研究热点。此外,通过改变或限制氨基的结构,例如将其环化以减少分子的非辐射跃迁途径,可以显著提高染料的量子产率和光稳定性,著名的德州红(Texas Red)染料就是基于此类优化策略的衍生物。
在功能化修饰方面,罗丹明结构中苯环上的羧基提供了一个极其便利的"化学手柄"。通过成熟的化学反应,研究人员可以轻松地对这个羧基进行改造,从而将各种功能性模块连接到染料上。这包括连接上用于共价标记生物分子的活性基团(如NHS酯、马来酰亚胺),连接上特异性的生物靶向基团(如多肽、小分子配体),或是连接上其他探针单元以构建更复杂的响应性探针。正是这种强大的合成与修饰灵活性,使得罗丹明家族能够不断焕发新的活力,满足日益增长的荧光应用需求。
优缺点
罗丹明家族染料凭借其一系列几乎无可匹敌的优点,在荧光探针领域中占据着核心地位。它们最为人称道的便是极高的亮度和量子产率,以及卓越的光稳定性,这两者结合确保了其在严苛的成像条件下依然能提供强烈而持久的荧光信号。在应用便利性上,它们不仅具有良好的水溶性,而且在很宽的pH范围内性质都保持稳定,极大地简化了在生理缓冲体系中的使用。此外,罗丹明成熟的化学修饰技术催生了庞大的衍生物库,为各种特异性标记应用提供了丰富的选择。
然而,罗丹明染料也存在一些需要使用者特别注意的缺点。其固有的小斯托克斯位移是最主要的物理限制,这不仅容易在高浓度下引发自吸收问题,还可能在荧光共振能量转移(FRET)实验中带来背景干扰。同样与浓度相关的是,罗丹明分子在浓度较高时有明显的聚集倾向,而这种聚集往往会导致荧光信号的猝灭(即ACQ效应),反而使信号减弱。在生物应用层面,部分罗丹明衍生物显示出一定的细胞毒性,这在长时间的活细胞观察中是需要考量的重要因素。最后,由于许多罗丹明分子本身带正电荷,它们可能会被细胞内膜电位为负的线粒体非特异性地富集,从而产生可能被误解的背景信号。因此,在使用时需充分权衡其各项特性,以实现最佳的成像效果。
应用
罗丹明染料凭借其卓越的综合性能,在科学研究与技术应用的多个前沿领域中扮演着不可或缺的角色。在生物标记与成像中,它们是最常用和最可靠的荧光标记物之一。通过共价连接到抗体、核酸探针或多肽上,罗丹明衍生物被广泛应用于免疫荧光染色、流式细胞术分析以及荧光原位杂交(FISH)等核心生物学技术中,用以实现对特定蛋白质或基因序列的精确定位与定量。此外,利用其本身带正电荷的特性,特定罗丹明衍生物(如TMRM, TMRE)能够被线粒体负膜电位特异性地富集,使其成为一类经典的、用于监测线粒体健康状态的荧光探针。
在尖端光学成像领域,罗丹明的超高光稳定性和高光子产出使其成为超高分辨率成像技术(如STORM, PALM)中的"明星分子",能够承受超分辨技术所需的严苛激光照射条件。而在物理学领域,罗丹明6G等衍生物是效率最高、应用最广的激光染料之一,是可调谐染料激光器中的核心增益介质。
此外,罗丹明独特的化学结构也使其成为构建化学传感器的理想平台。通过巧妙地设计一个螺环"开关"结构,可以使罗丹明染料在初始状态下处于无色、无荧光的"关闭"状态。当它与特定的分析物,如金属离子(Cu²⁺, Fe³⁺等)、质子(H⁺)或活性氧物种结合后,螺环结构会发生可逆的开环反应,从而恢复其完整的共轭体系并释放出强烈荧光。基于这一精巧的"识别-响应"机制,科学家们开发了大量用于高选择性、高灵敏度检测重要化学物质的荧光探伸。
荧光素(Fluorescein)
荧光素是历史上发现最早、也是迄今为止最重要的荧光染料之一,由Adolf von Baeyer于1871年首次合成。其衍生物,特别是荧光素异硫氰酸酯(FITC),开启了免疫荧光技术的时代。它以其极高的吸收系数、高量子产率和与生物分子良好的相容性而著称。
图 2‑5 荧光素的结构
化学结构与发光机理
荧光素(Fluorescein)是另一类经典的呫吨(xanthene)类染料,其核心化学结构与罗丹明非常相似,都共享一个刚性的平面共轭呫吨骨架,这也是其能够高效发光的基础。然而,两者在结构上的关键区别在于,荧光素呫吨环两端的官能团是羟基(-OH),而非罗丹明的氨基。这个看似微小的差异,导致了两者光物理性质上的根本不同,其中最核心的一点便是荧光素的荧光信号严重依赖于其所处环境的pH值。
这种深刻的pH敏感性源于荧光素分子上两个酚羟基的存在,使其在不同酸碱度的溶液中会以多种不同的质子化形式存在,例如酸性下的阳离子形式、弱酸性下的中性内酯形式,以及碱性条件下的单阴离子和双阴离子形式。在这些形态中,只有双阴离子(dianion)形式才具有强烈的荧光。其内在机理是,当环境pH值升高,两个酚羟基都发生去质子化,转变为给电子能力极强的酚氧负离子。这两个强大的给电子体能够极大地激活整个分子的共轭体系,使其高效地吸收和发射光子。相比之下,其中性的内酯形式则几乎不发荧光。
荧光素的pKa值(即半数分子发生去质子化的pH值)约为6.4,这个数值恰好落在生理pH(约7.4)的敏感响应区内。这一特性使其成为一把"双刃剑":一方面,这使得荧光素及其衍生物成为一类测量和指示生理范围内pH值变化的绝佳探针;但另一方面,这也成为了它作为通用型荧光标记物的一个显著缺点。因为细胞内不同细胞器(如中性的细胞质和酸性的溶酶体)的pH环境差异巨大,这会导致荧光素标记的分子在不同区域的荧光强度不稳定,给准确定量分析带来了巨大的挑战。
光物理性质
荧光素的光物理性质呈现出典型的"高亮度和低稳定性"的特点,并且其最优性能严格依赖于环境的pH值。在碱性水溶液(其荧光最强的条件)中,荧光素的吸收光谱在490纳米(蓝绿光)附近达到峰值,而其发射光谱的峰值则位于约515纳米处,发出明亮的绿色荧光。它的卓越亮度源于两个关键参数的完美结合:一是其非常高的摩尔吸光系数(通常在70,000至90,000 M⁻¹cm⁻¹之间),保证了其对激发光的高效捕获;二是在最佳条件下其极高的量子产率,可高达0.95,使其成为已知亮度最高的有机染料之一。然而,与罗丹明类似,它的斯托克斯位移也较小,约为25纳米。
图 2‑6 荧光素的激发和发射光谱
尽管具有无与伦比的亮度,荧光素的一个致命缺点是其极差的光稳定性。在荧光显微镜的强光照射下,荧光素分子非常容易发生不可逆的化学分解,即光漂白,导致荧光信号快速衰减。这一特性严重限制了其在需要长时间或高强度光照的现代成像技术中的应用,例如长时间活细胞追踪或共聚焦扫描,这也是它逐渐被新一代高光稳定性染料所取代的核心原因。更值得关注的是,荧光素的光漂白过程会产生活性氧(ROS),这些高活性化学物质不仅会破坏染料自身,更会对活细胞产生显著的光毒性,可能干扰细胞的正常生理活动,甚至导致细胞死亡。
合成与修饰
荧光素的化学合成与修饰技术非常成熟,这极大地拓展了其应用范围,并针对其固有缺点进行了有效改良。其经典的合成方法是通过间苯二酚与邻苯二甲酸酐在酸催化剂(如氯化锌)和加热条件下进行缩合反应。在此基础骨架上,化学家们发展出多种修饰策略以调控其性能或赋予其新功能。
图 2‑7 荧光素的合成
在光物理性质调控方面,一个重要的策略是卤代化。通过在荧光素的呫吨环上引入氯、溴、碘等重原子,可以显著增加分子发生"系间窜越"(ISC)的速率。这一过程会大大降低分子的荧光发射效率,但相应地增加了磷光和单线态氧的产率。基于此原理的两个著名衍生物就是四溴荧光素(即红色染料曙红/伊红 Eosin)和四碘荧光素(赤藓红 Erythrosin),它们虽然荧光很弱,但却是非常高效的光敏剂,在生物学染色和光动力学治疗等领域有重要应用。此外,为了克服荧光素本身pKa过高和光稳定性差的缺点,科学家们也通过结构衍生开发出了俄勒冈绿(Oregon Green)和东京绿(Tokyo Green)等改良型探针,它们具有更低的pKa值(从而在生理pH下更稳定)和更佳的光稳定性。
在功能化以实现生物标记方面,荧光素最著名也最关键的修饰是引入反应性基团。其中,FITC(荧光素异硫氰酸酯)和荧光素-NHS酯是两个里程碑式的衍生物。这两种分子分别带有一个高活性的异硫氰酸酯基或NHS酯基,它们能够高效、特异性地与生物大分子(主要是蛋白质)表面的伯氨基(如赖氨酸残基的侧链氨基)发生反应,形成非常稳定的硫脲键或酰胺键。正是通过这种共价连接的方式,明亮的荧光素分子得以被牢固地"挂"到抗体、酶或其他目标蛋白上,使其成为生物共轭技术中最 foundational 的荧光标记物之一。
优缺点
荧光素作为最早被广泛应用的荧光标记物之一,其成功源于一系列显著的优点。首先,它拥有极高的亮度,在最佳条件下其量子产率接近完美,能够提供非常强的荧光信号。在实用性方面,它的合成方法简单,生产成本低廉,同时具有良好的水溶性和生物相容性,这使其易于在生物缓冲体系中使用。得益于其成熟的化学修饰技术(特别是FITC的出现),荧光素的衍生物种类繁多,共价标记技术非常成熟,使其成为了一个经典的生物标记工具。此外,其对pH的敏感特性也被巧妙地利用,使其成为一类设计和应用最为广泛的细胞内pH指示探针。
然而,荧光素的缺点也同样突出,并直接导致了其在许多现代高端成像应用中被逐步替代。其最致命的弱点是极差的光稳定性,在光照下极易发生光漂白,无法满足长时间观察或高强度照射的需求。其次,其荧光性质对pH的强烈依赖性是一把双刃剑;当作为通用标记物时,这一特性便成为严重缺陷,因为在进入溶酶体、内体等酸性细胞器后,其荧光会发生猝灭,导致信号丢失或对定位信息的误读。在光学性质上,它还存在斯托克斯位移小的通病。最后,其发射光谱相对较窄且固定在绿色通道,非常容易与细胞生物学中另一个明星分子------绿色荧光蛋白(GFP)发生光谱重叠,即串色,给多色成像实验带来了巨大挑战。
应用
尽管荧光素存在光稳定性和pH敏感性等缺点,但凭借其极高的亮度、成熟的标记技术和低廉的成本,它在许多经典应用中至今仍扮演着重要角色,并催生了多种功能强大的衍生物。
在生物标记领域,FITC(荧光素异硫氰酸酯)是免疫荧光染色技术中最经典、使用最广泛的绿色荧光标记物,是无数实验室入门和常规蛋白定位研究的首选试剂。在细胞示踪与增殖分析中,其衍生物CFDA-SE是一个里程碑式的探针。该分子本身无荧光且可以自由穿透细胞膜,进入细胞后,其乙酸酯基团会被胞内普遍存在的酯酶水解,生成具有强荧光的羧基荧光素(CFSE),此过程不仅"点亮"了探针,也使其无法再次穿透细胞膜而被"捕获"在胞内。与此同时,其琥珀酰亚胺酯(SE)基团会与胞内的蛋白质共价结合。这样一来,荧光信号便被牢牢地固定在细胞中,并随着细胞的每一次分裂而平均分配给两个子代细胞。通过流式细胞术检测荧光强度的"半衰"式下降,研究人员便可精确追踪细胞的迁移和计算其增殖的代数。
此外,利用其固有的pH敏感性,荧光素是开发细胞内pH传感器的基础分子。在分析化学领域,它被用作信号报告分子,广泛应用于荧光偏振免疫分析(FPIA)和酶联免疫吸附试验(ELISA)等高灵敏度检测技术中。不仅如此,荧光素在临床医学中也有一席之地,其钠盐是眼科诊断中进行眼底血管造影的标准造影剂,医生通过观察其在视网膜血管中的流动和渗漏情况,来诊断各种视网膜病变。
BODIPY
BODIPY是"boron-dipyrromethene"(硼-二吡咯甲川)的缩写,是一类于1968年被发现,但在近几十年才大放异彩的荧光染料。它们以其尖锐的吸收和发射峰、高量子产率、对环境不敏感以及优异的化学和光稳定性而脱颖而出,被誉为"性能可与罗丹明媲美,但结构修饰性更强"的染料。
图 2‑8 BODIPY的结构式
化学结构与发光机理
BODIPY(硼二吡咯甲川)染料是一类现代、高性能的荧光分子,其独特的化学结构是其一系列优异光物理性质的根源。它的核心结构是一个由二吡咯甲川配体(即两个吡咯环通过一个甲川桥连接)与一个二氟化硼(BF₂)单元螯合而成的络合物。这种结构设计赋予了整个分子一个刚性的、近乎完全平面的π共轭骨架,有效地抑制了非辐射能量的耗散,为其高效率的发光奠定了坚实基础。
BODIPY染料最突出的特点之一是其无与伦比的化学修饰灵活性。其核心骨架上几乎所有的位置,包括吡咯环上的8个碳原子(1, 2, 3, 5, 6, 7, 8号位)乃至中心的硼原子,都可以作为修饰位点进行化学衍生。这种高度的模块化特性,使得化学家能够像搭积木一样,通过精细的化学调控来系统地、可预测地调节其吸收发射波长、溶解性、反应活性等关键属性,从而定制出满足各种特定需求的荧光探针。
在发光机理上,BODIPY染料与许多环境敏感性探针(如香豆素)存在根本不同。它的荧光主要来源于局域激发(Locally Excited, LE)态的衰变,而非分子内电荷转移(ICT)态。在LE跃迁过程中,分子的电子云分布在基态和激发态之间没有发生剧烈的重排,即激发态的极性与基态相差不大。这一机理的直接结果就是,BODIPY染料的光谱性质对溶剂的极性依赖性极小。无论是在非极性的正己烷中,还是在强极性的水溶液里,它们都能保持强烈、稳定的荧光发射,这一环境不敏感性在复杂的生物体系应用中是一个巨大的优势。
光物理性质
BODIPY染料家族展现出一系列近乎理想的、非常优异的光物理性质,使其在高性能荧光探针的设计中备受青-睐。其最为标志性的特征之一是尖锐且对称的光谱峰形,它们的吸收和发射峰的半峰宽(FWHM)通常很窄,且彼此之间的重叠很小,这有利于信号的精确分离和检测。凭借其高度可修饰的化学骨架,BODIPY染料的光谱范围可以被系统地调节,形成了一个覆盖从绿光到近红外(约500-800纳米)的庞大染料库。
在发光效率方面,BODIPY染料是当之无愧的佼佼者。它们不仅拥有非常高的摩尔吸光系数(通常在70,000至100,000 M⁻¹cm⁻¹范围),还具备极高的量子产率,在多种溶剂中其产率都稳定地接近1.0,这两者的结合赋予了它们极高的分子亮度。在稳定性方面,它们表现出卓越的光稳定性,通常优于荧光素甚至部分罗丹明衍生物。更重要的是,如前所述,它们对溶剂极性和pH变化等环境因素不敏感,确保了在复杂多变的生物环境中依然能够提供稳定、可靠的定量荧光信号。
然而,BODIPY染料也存在一个较为突出的固有缺点,那就是其斯托克斯位移通常很小(仅10-30纳米),这给激发光和发射光的分离带来了一定的技术挑战。不过,化学家们已经发展出相应的解决策略,例如通过在分子的特定位置引入具有较大空间位阻的基团,可以有效诱导激发态的几何构象发生变化,从而显著增大其斯托克斯位移。
合成与修饰
BODIPY染料的合成化学非常成熟且高度模块化,这使得科学家们能够基于其核心骨架,通过精确的位置选择性修饰,系统地调控其光物理性质。其合成路线通常清晰地分为两步:首先,通过吡咯或其衍生物与相应的醛或酰氯进行缩合反应,构建出核心的二吡咯甲川配体;随后,将此配体与三氟化硼乙醚(BF₃·Et₂O)等氟化硼源在碱性条件下反应,完成与BF₂单元的络合,最终得到稳定的BODIPY染料。
这里是图片18.png){width="4.231213910761155in" height="1.6122134733158355in"}
图 2‑9 BODIPY的合成
基于这一合成框架,化学家们已经建立了一套行之有效的光谱调控策略,即通过在骨架的不同位置进行修饰来改变其颜色:
8位修饰(甲川桥位):这是调控BODIPY光谱最常用、也是最有效的位点。在此处引入芳基、乙烯基等π共轭基团,能够显著地将吸收和发射光谱向长波方向(红移)推动。
3, 5位修饰:这两个位置为光谱的微调或大幅调整都提供了可能。引入简单的吸电子或给电子基团可以进行小幅度的波长微调;而引入苯乙烯基等更长的共轭臂则可以实现显著的光谱红移。
2, 6位修饰:在这两个位置引入氰基等强吸电子基团同样可以使光谱红移。此外,一个非常重要的功能化策略是在此引入溴、碘等卤素重原子,这会极大地促进分子发生系间窜越,从而有效"关闭"其荧光通道,使其从一个荧光染料转变为一个能够高效产生活性氧的光敏剂,用于光动力学治疗等领域。
稠环策略:这是另一种实现大幅红移的有力手段。通过将苯环或其他芳香环直接"并"到BODIPY的核心骨架上(即稠环),可以极大地扩展整个分子的π共轭体系,是获得在红光乃至近红外区域发射的BODIPY衍生物的关键策略。
优缺点
BODIPY染料之所以被誉为一类"明星"荧光分子,是因为它们集成了众多理想的优点。首先,它们具备"三高"的光学特性:高亮度、高量子产率和高摩尔吸光系数,这保证了其在单分子水平上都能产生强烈的光信号。其光谱峰形通常非常尖锐,大大减少了在多色成像中不同通道间的串扰问题。在稳定性方面,它们不仅光稳定性极佳,能够耐受长时间和高强度的光照,其化学性质也非常稳定。更重要的是,它们的光谱性质对溶剂极性、pH等环境因素不敏感,确保了在复杂生物环境中信号的稳定和可靠。最后,BODIPY无与伦比的结构修饰性赋予了其宽广的光谱可调范围和功能化潜力,而其核心骨架的疏水性也使其更容易穿透细胞膜进入活细胞内部。
然而,BODIPY染料也存在一些需要通过化学策略来克服的缺点。其最主要的固有光学局限是斯托克斯位移通常较小。另外,其疏水性是一把双刃剑,虽然有利于穿膜,但也导致了其在水溶液中的溶解度极差,并有很强的聚集倾向,而聚集往往会导致荧光猝灭。因此,在将其应用于生物体系时,必须通过化学修饰(例如引入磺酸基、季铵盐等亲水基团)来改善其水溶性。最后,相较于一些经典染料,BODIPY的合成步骤通常更为复杂,这也增加了其生产成本。
应用
BODIPY染料凭借其优异且高度可调的性能,在多个前沿科技领域中找到了广泛而深入的应用。
在生物成像领域,利用其核心骨架的疏水性,BODIPY染料天然地适合作为一类高效的荧光探针,用于标记细胞内的疏水结构,如脂滴和细胞膜。通过进一步的功能化修饰,引入特定的靶向基团,还可以精确地将其导航至线粒体、溶酶体等几乎所有细胞器,实现高对比度的结构可视化。
在荧光探针与化学传感方面,BODIPY的化学多样性得到了淋漓尽致的发挥。科学家们利用其丰富的修饰位点,引入各种识别基团,或者巧妙地利用其中心硼原子上氟原子可以被取代的反应特性,设计和开发了大量用于高灵敏、高选择性检测特定分析物的"智能"探针,检测对象涵盖了金属离子、活性氧(ROS)、pH值,乃至微观物理参数如粘度和温度。
此外,BODIPY尖锐的光谱特性使其成为构建高效荧光共振能量转移(FRET)能量对的理想选择,无论是作为能量供体还是受体,都能有效降低光谱串扰,提高FRET检测的信噪比。在光动力疗法(PDT)应用中,通过在BODIPY骨架上引入碘、溴等重原子,可以将其从一个优异的荧光分子"改造"成一个高效的光敏剂,在光照下能够大量产生活性单线态氧,从而实现对癌细胞等病变组织的靶向杀伤。
最后,在材料科学领域,BODIPY染料同样占有一席之地,它们被用作高性能的染料激光器增益介质,并在有机发光二极管(OLED)技术中作为高效的发光材料使用。
菁染料(Cyanine Dyes)
菁染料,通常称为花青染料,是一类以聚甲川链连接两个含氮杂环为特征的合成染料。它们是近红外(Near-Infrared, NIR, 700-1700 nm)荧光成像领域中当之无愧的主角。NIR光具有组织穿透深、自发荧光干扰小、光损伤低等优点,因此NIR菁染料在活体成像中具有无与伦比的优势。
这里是图片19.gif){width="2.8554910323709537in" height="2.6870374015748033in"}
图 2‑10 经典Cy3和Cy5的结构式
化学结构与发光机理
菁染料(Cyanine dyes, 简称Cy染料)是一类在长波长(红光至近红外)荧光成像领域中占据核心地位的有机染料。其核心化学结构为一个典型的"推-拉"电子体系,通用结构式可表示为 D-(CH=CH)n-CH=A⁺。该结构由一个给电子基团(D)和一个吸电子基团(A⁺)通过一条长度可变的共轭聚甲川链(polymethine chain)连接而成。其中,D和A通常是同一种含氮杂环(如吲哚啉、苯并噻唑),但A处于季铵盐的正离子形式,使得整个分子通常带一个正电荷。
菁染料最引人注目和最具应用价值的特性是,其光谱位置(颜色)主要由中间的聚甲川链的长度精确决定。根据伍德沃德-费歇尔规则的延伸,聚甲川链的长度与吸收波长之间存在一个非常清晰的线性关系:链上每增加一个乙烯基单元(-CH=CH-),染料的最大吸收波长便会系统性地红移大约100纳米。这一高度可预测的"分子标尺"效应,使得菁染料的颜色可以被精确地设计和合成。这一规律在经典的菁染料系列中得到了完美体现:
Cy3 的共轭链含有三个碳原子,其发射峰位于约570纳米的橙色区域。
Cy5 的共轭链延长至五个碳原子,其发射峰便红移至约670纳米的远红光区域。
Cy7 的共Git轭链进一步延长至七个碳原子,其发射峰则进入了约770纳米的近红外区域。
除了起决定性作用的共轭链长度,两端的杂环种类(如使用吲哚、噻唑或喹啉等不同环系)也会对光谱位置进行微调,并影响染料的刚性、光稳定性等其他重要性质。正是这种高度模块化和可预测的光谱调控能力,使得菁染料家族成为了构建覆盖从可见光到近红外光谱的全系列荧光探针的理想平台。
好的,这是对您提供的关于菁染料(Cyanine dyes)所有内容的全面梳理、整合与段落形式输出:
光物理性质
菁染料最引以为傲的特性是其无与伦比的摩尔吸光系数,通常高达150,000至250,000 M⁻¹cm⁻¹,是所有有机染料中最高的之一。这意味着它们具有极强的光子捕获能力,能够产生非常强的吸收信号。然而,与此形成鲜明对比的是,它们在水溶液中的量子产率普遍不高(通常低于0.3),且光稳定性也仅为中等偏下。这两种缺陷的根本原因都指向其柔性的聚甲川链:链的顺反异构化为激发态能量提供了一条高效的非辐射衰变途径,从而降低了量子产率;同时,这条富含电子的共轭链也容易受到活性氧的攻击而氧化断裂,导致光漂白。此外,它们也具有斯托克斯位移较小的通病(20-40 nm)。
合成与修饰
面对菁染料固有的缺陷,化学家们发展出了一系列行之有效的性能优化策略。菁染料的合成通常通过含活泼甲基的杂环季铵盐与特定长度的聚甲川链前体缩合而成,这为结构改造提供了便利。为了提高其量子产率和光稳定性,最核心的策略是在易于扭转的聚甲川链上引入环己烯环等刚性结构,通过"锁住"构象来抑制非辐射性的顺反异构化。为了解决其在水溶液中溶解度差、易聚集的问题,则通过引入磺酸基(-SO₃⁻)等亲水基团来大大改善。通过这些化学修饰,菁染料的综合性能得到极大提升。其中最成功的典范是吲哚菁绿(Indocyanine Green, ICG),它经过磺化改善水溶性,是目前唯一被美国FDA批准可用于临床人体的近红外荧光造影剂。
应用
菁染料的独特优势------即工作在组织穿透深、背景荧光干扰小的"光学窗口"------使其应用范围极其广泛。
在基础生物学研究中,Cy3(橙色)、Cy5(远红色)和Cy7(近红外)是应用最广泛的荧光标签之一,被用于DNA测序、蛋白质印迹(Western Blot)和多色细胞成像。其中,Cy3和Cy5更组成了一对经典的FRET能量对,被广泛用于研究蛋白质相互作用和构象变化。而在超高分辨率成像领域,高光子产出和优异光开关特性的Cy5及其衍生物,是dSTORM技术中最核心、最常用的染料。
在活体与临床成像中,近红外菁染料是当之无愧的主力。它们被用于动物模型的肿瘤成像、血管造影和淋巴结示踪。临床上,ICG被常规用于肝脏功能评估和眼科的视网膜血管造影。
在疾病治疗领域,许多近红外菁染料还展现出强大的光热治疗(PTT)潜力。它们吸收的近红外光子能量可以高效地转化为热能,从而在激光照射下实现对肿瘤等病变组织的局部加热消融,展现了其作为"诊疗一体化"分子的巨大前景。
聚集诱导发光(AIE)材料
聚集诱导发光(AIE)是一种颠覆性的光物理现象,由中国科学家唐本忠院士团队于2001年首次发现并命名。它与传统荧光染料普遍遵循的"聚集导致猝灭"(Aggregation-Caused Quenching, ACQ)规律完全相反。传统染料(如罗丹明)在溶液中浓度升高或固态下聚集时,荧光会因分子间作用而猝灭;而AIE分子则表现出独特的行为:它们在良溶剂中以单分子形式存在时荧光极其微弱甚至不发光,但当它们在不良溶剂中聚集形成纳米颗粒,或是在固态下,其荧光会被"点亮",强度可增强成百上千倍。
化学结构与发光机理
聚集诱导发光(AIE)是一种与传统"聚集导致猝灭"(ACQ)现象完全相反的光物理过程。其核心机理是分子内运动的限制(Restriction of Intramolecular Motion, RIM)。AIE分子的典型化学结构特征是包含多个可自由旋转的动态单元,最经典的例子是四苯基乙烯(TPE),其四个苯环连接在中心的乙烯双键上,形成一种"螺旋桨"式的三维结构。在良溶剂中,这些分子以单分子形式自由分散,其分子内的"螺旋桨"单元可以快速旋转或振动,这种剧烈的分子内运动为激发态能量提供了一条高效的非辐射耗散通道,使能量以热能的形式被消耗,因此分子不发光或荧光非常微弱。然而,当分子在不良溶剂或固态下聚集时,紧密的空间位阻和分子间相互作用会物理性地"锁住"这些内旋运动,极大地抑制了非辐射能量耗散通道。此时,激发态的能量只能通过辐射跃迁的方式释放,从而迸发出强烈、明亮的荧光。
分子设计与修饰
AIE分子的设计哲学可以概括为"动态"与"拥挤"的统一:即在分子中引入可活动的动态单元,同时确保其在聚集时能够形成拥挤的、限制这些运动的环境,并避免ACQ式的紧密π-π堆积。实现这一目标的设计策略主要包括:构建以四苯基乙烯(TPE)或硅杂环戊二烯(silole)为代表的"螺旋桨"式结构;设计本身具有扭曲、非平面构象的共轭骨架;或是在共轭体系中引入可以自由旋转的C-C单键。通过这些策略,可以有效地构建AIE核心。更进一步地,通过将这些AIE核心骨架与传统的发色团(如香豆素、BODIPY、菁染料等)进行化学偶联,科学家们已经成功设计出覆盖整个可见光到近红外光谱范围、性能各异的新型AIE染料(AIEgens),极大地拓展了其功能与应用。
光物理特性
由其独特的发光机理所决定,AIE材料展现出一系列卓越的光物理性质。其最突出的优势是极高的固态/聚集态发光效率,从根本上解决了传统染料在固态应用中的荧光猝灭难题。其从"暗"到"亮"的"Turn-on"发光特性,提供了其他染料难以比拟的极高信噪比。由于其激发态和发射态的分子几何构象差异较大,AIEgens通常具有数百纳米的巨大斯托克斯位移,有效避免了自吸收问题。在聚集状态下,由于分子运动被限制,其发生光化学降解的概率大大降低,因此普遍具有优异的光稳定性和抗光漂白能力。此外,AIEgens的荧光对聚集状态、粘度、温度、压力等物理刺激高度敏感,使其成为构筑多功能智能材料的理想基元。
优缺点
AIE材料的优点非常突出,使其在许多领域具有颠覆性的潜力。其优点包括:完美的"Turn-on"发光模式带来的极高信噪比;彻底解决了ACQ问题,在固态和聚集态下发光效率高;巨大的斯托克斯位移避免了信号的自吸收;以及卓越的光稳定性。这些特性使其能够被用于构建对各种物理和化学刺激进行响应的智能探针。然而,AIE材料也存在一些实际应用中需要考量的缺点:它们的分子量通常较大;其疏水性导致在水中的溶解和分散较为困难,通常需要借助表面活性剂包裹或共价连接亲水基团,以纳米颗粒的形式应用于生物体系;此外,早期的AIEgens的摩尔吸光系数相对较低,但这一问题在新一代AIEgens的设计中已得到显著改善。
应用
AIE材料的应用领域极其广泛,并且正以前所未有的速度持续扩展。在生物医学领域,其"无背景"的Turn-on特性使其成为高对比度生物成像的理想工具,在细胞器靶向、细菌检测、肿瘤精准成像等方面表现出色,通常无需洗涤步骤即可获得清晰图像。同时,它也被广泛用于构建对离子、小分子、酶、DNA等特定分析物进行响应的化学与生物传感器。在材料与光电领域,AIE材料是解决有机发光二极管(OLEDs)固态效率滚降问题的理想材料,已在高效非掺杂OLED器件中取得创纪录性能。此外,利用其对聚集状态的敏感性,它还可以用于实时监控结晶、聚合、凝胶化等物理化学过程,并在智能材料领域中用于开发力致变色、热致变色、信息加密等前沿技术。
染料类别 主要发光区 亮度 (ε·Φ_F) 光稳定性 斯托克斯位移 关键特征
香豆素 蓝-绿 高 中等 中等 (50-100 环境敏感(极性, pH)
nm)
罗丹明 橙-红 极高 非常高 小 (20-30 nm) 高光稳定性,pH不敏感
荧光素 绿 极高 差 小 (20-30 nm) pH敏感,生物相容性好
BODIPY 绿-近红外 极高 高 小 (10-30 nm) 光谱尖锐,环境不敏感
菁染料 红-近红外 极高 (ε) 中等偏下 小 (20-40 nm) 近红外发射,组织穿透深
AIE材料 全光谱 高(固态) 极高 巨大 (>100 聚集诱导发光,无ACQ nm)
: 表格 2‑2 几种常见有机荧光染料的特性
荧光蛋白 (Fluorescent Proteins, FPs)
在现代生命科学的宏伟殿堂中,荧光蛋白(FPs)无疑是最耀眼的明星工具之一。它们就像是生物学家手中的"分子灯塔"或"GPS定位器",能够被精确地安装到活细胞或生物体内的特定蛋白质、细胞器乃至整个细胞上,通过发射不同颜色的荧光,实时、动态、无损地揭示生命过程的奥秘。从单个分子的运动轨迹,到细胞内部的精细结构,再到生物体内的肿瘤生长与转移,荧光蛋白的应用几乎无处不在。
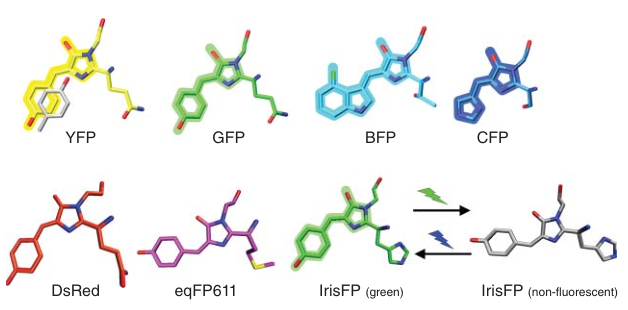
这一领域的革命性突破,源于20世纪60年代日裔美籍科学家下村脩(Osamu Shimomura) 从维多利亚多管发光水母(Aequorea victoria)中分离纯化了绿色荧光蛋白(Green Fluorescent Protein, GFP)。随后,马丁·查尔菲(Martin Chalfie) 首次证明了GFP基因可以在其他生物(如线虫)中表达并自发产生荧光,展示了其作为通用遗传标记的巨大潜力。而美籍华裔科学家钱永健(Roger Y. Tsien) 则通过精妙的蛋白质工程,对GFP进行了系统性的改造,不仅创造出了蓝色(BFP)、青色(CFP)、黄色(YFP)等多种颜色的荧光蛋白,还进一步从珊瑚中发现了红色荧光蛋白(RFP)并将其改造为单体,最终凑齐了整个"光谱调色盘",并开发出能响应细胞内环境变化的生物传感器。为了表彰他们"发现和发展了绿色荧光蛋白",这三位科学家共同分享了2008年的诺贝尔化学奖。
荧光蛋白的基本原理与核心结构
荧光蛋白(Fluorescent Proteins, FPs)发挥其强大生物示踪功能的基础,在于其独特且自给自足的发光机制,这主要依赖于两大结构要素的精妙协作:位于核心的生色团(Chromophore)和作为保护壳的β-桶状结构(β-barrel)。
荧光蛋白的发光核心是其内部的生色团,这是一个特殊的共轭π电子体系。与萤光素酶等生物发光蛋白需要外源性底物才能发光不同,绿色荧光蛋白(GFP)及其衍生物的生色团是完全内源性的,由其自身多肽链上的一段特定氨基酸序列,经过一系列自催化的翻译后修饰而形成,此过程无需任何外部酶或辅助因子的参与。在经典的野生型GFP中,这段序列由第65位的丝氨酸(Serine, S)、第66位的酪氨酸(Tyrosine, Y)和第67位的甘氨酸(Glycine, G)组成。其形成过程严谨有序:首先,新合成的多肽链必须正确折叠成其标志性的β-桶状结构;随后,在精确的构象下,G67的氮原子对S65的羰基碳发起亲核攻击,发生环化反应并脱去一分子水;最后,在分子氧的参与下,Y66的α-β碳键发生脱氢氧化,最终形成一个包含对羟基苯亚甲基咪唑啉酮的大型共轭体系。这个完整的共轭结构就是成熟的、能够吸收特定波长的光并发出更长波长荧光的生色团。整个过程所需的时间被称为成熟时间(Maturation Time),是评价荧光蛋白性能的关键指标之一,因为它直接决定了实验中何时能观察到有效的荧光信号。
docs/Fluobasic/05-荧光显微成像/01-第二章:/IMG-20250823
图 2‑11 荧光蛋白的结构
生色团虽然是发光之源,但其化学性质非常脆弱,若直接暴露于细胞环境中,荧光极易被淬灭。因此,所有GFP家族的蛋白都演化出了一个高度保守且坚固的β-桶状结构来保护它。这个结构由11条反平行的β-折叠片层紧密围绕而成,形成一个近乎完美的圆柱形桶,将生色团严密地包裹在桶的中心轴上。这个刚性的疏水环境起到了多重关键作用:首先,它像一个分子盾牌,将生色团与外界的水分子、离子等淬灭剂隔绝开来;其次,它提供了一个稳定的支架,将生色团锁定在最有利于发光的平面构象上;最后,也是最重要的一点,桶壁内侧朝向生色团的氨基酸残基,可以通过氢键、π-π堆积等非共价相互作用,精细地调控生色团周围的微环境。科学家们正是通过基因突变来改变这些关键位置的氨基酸,从而微调生色团的电子云分布,进而系统地改变荧光蛋白的吸收和发射光谱,创造出从蓝色到红色的各种颜色的荧光蛋白。
为了在众多荧光蛋白中做出选择以适应不同的实验需求,需要通过一系列关键参数来综合评价其性能。这些参数包括:
光谱特性(Spectral Properties):即蛋白质能吸收和发射的光的波长范围,通常由吸收峰值(λabs)和发射峰值(λem)来定义,这决定了其"颜色"和与其他荧光分子共用时的可区分性。
亮度(Brightness):直接影响信号的信噪比,它由摩尔消光系数(ε)(代表捕获光子的能力)和荧光量子产率(QY)(代表将吸收的光子转化为荧光光子的效率)的乘积(ε × QY)决定。
光稳定性(Photostability):指荧光分子在持续光照下抵抗不可逆的光漂白(Photobleaching)的能力,对于需要长时间观察的活细胞成像实验至关重要。
成熟特性(Maturation):包括成熟速度(通常用半成熟时间 t1/2 表示)和成熟效率。快速且高效的成熟对于标记快速表达的蛋白或在低温(如在某些模式生物中)条件下进行实验尤为重要。
pH敏感性:多数荧光蛋白的荧光强度会受pH值影响,其pKa值(荧光强度降至一半时的pH)是衡量其在不同酸碱环境(如中性的细胞质与酸性的溶酶体)中工作稳定性的指标。
寡聚状态(Oligomerization):天然的荧光蛋白倾向于形成二聚体或四聚体,这在作为融合标签时可能导致靶蛋白的人为聚集和功能异常。因此,经过改造的单体(Monomer)形式是理想工具蛋白的首选属性。
分子大小(Size):作为约27 kDa的标签,荧光蛋白自身的大小有时可能会对与之融合的宿主蛋白的折叠、定位或功能产生干扰,因此开发更小的荧光标签也是该领域的一个持续努力的方向。
绿色荧光蛋白(GFP)家族
野生型绿色荧光蛋白(wtGFP)源自维多利亚多管发光水母,是所有荧光蛋白技术的鼻祖,但其天然形式作为广泛应用的科研工具存在着诸多限制。其光谱特性尤为复杂,具有一个位于395nm(紫外光)的主吸收峰和一个位于475nm(蓝光)的次吸收峰,这两种吸收状态分别对应其生色团的质子化和去质子化形式,导致其激发效率低下且光物理行为难以预测。此外,wtGFP还面临着光稳定性差、成熟速度缓慢,以及在哺乳动物细胞培养的常规温度(37°C)下折叠效率低下等问题,同时还表现出微弱的二聚化倾向,可能干扰宿主蛋白的正常功能。
这里是图片21.jpeg){width="5.154457567804024in" height="3.8670516185476815in"}
图 2‑12 绿色荧光蛋白
为了克服wtGFP的天然缺陷,使其成为一个真正强大而可靠的生物学工具,钱永健(Roger Y. Tsien)实验室通过开创性的蛋白质工程改造,创造出了第一个里程碑式的变体------增强型绿色荧光蛋白(EGFP)。EGFP的巨大成功主要归功于两个关键的氨基酸突变。首先是S65T(第65位丝氨酸变为苏氨酸),这一精准的改变极大地优化了光谱特性。它通过稳定生色团的构象,彻底消除了395nm的紫外吸收峰,将所有吸收能力集中在488nm处形成一个单一、尖锐的吸收峰,这不仅完美匹配了当时实验室最常用的氩离子激光器波长,还将吸收效率提升了数倍。同时,该突变还加速了生色团的氧化成熟过程。第二个关键突变是F64L(第64位苯丙氨酸变为亮氨酸),它显著改善了蛋白质的整体折叠效率,特别是解决了在37°C下难以正确折叠的难题。这两个突变的协同作用,使得EGFP的亮度相较于wtGFP提升了惊人的35倍,并且能够在哺乳动物细胞中快速、高效地表达和成熟。EGFP凭借其优异的性能迅速取代了wtGFP,成为全球分子生物学实验室的"标准配置",它的诞生雄辩地证明了通过基因突变对蛋白质进行定向改造的巨大潜力,从而开启了后续荧光蛋白工程化改造的黄金时代。
从GFP衍生出的多色荧光蛋白
在EGFP的成功基础上,科学家们通过对GFP进行更深入的蛋白质工程改造,开创性地发展出了一个覆盖大部分可见光光谱的多色荧光蛋白工具箱。实现颜色变化主要依赖两种核心策略:一是直接改变构成生色团的氨基酸,二是精细调控生色团周围的微环境。
第一种策略,即直接改造生色团,催生了蓝色和青色荧光蛋白。**蓝色荧光蛋白(BFPs)**的诞生源于一个关键突变------将生色团核心的Y66(酪氨酸)替换为H66(组氨酸)。组氨酸的咪唑环相较于酪氨酸的苯酚环,共轭程度更低,这导致生色团的吸收和发射光谱整体发生显著的"蓝移"。然而,早期的EBFP版本亮度极低且光稳定性差,限制了其应用,直至后续开发的mTagBFP和Sirius等才大幅改善了性能。与此类似,**青色荧光蛋白(CFPs)**则是将Y66突变为W66(色氨酸),色氨酸的吲哚环使得光谱蓝移程度介于GFP和BFP之间。早期的ECFP虽亮度尚可,但其发射光谱存在干扰性的肩峰,后来的Cerulean及拥有接近完美量子产率(0.93)的mTurquoise2等版本,则提供了更纯净、更明亮、更稳定的青色荧光。
这里是图片22.jpeg){width="3.734542869641295in" height="2.965317147856518in"}
图 2‑13 黄色荧光蛋白
第二种策略则更为精巧,它保留了GFP原生的S-Y-G生色团,转而通过改变桶状结构内邻近的氨基酸来微调其光物理特性。**黄色荧光蛋白(YFPs)**的产生便是这一策略的典范。其核心突变是在GFP基础上引入T203Y,这个新引入的酪氨酸(Y203)残基的苯环能够与生色团核心发生π-π堆积。这种额外的相互作用稳定了生色团的激发态,降低了其能量,从而导致其吸收和发射光谱发生"红移",呈现出黄色。尽管早期的EYFP亮度很高,但对pH和氯离子极为敏感,这一缺陷在后续的Venus和Citrine等改进型中被成功克服,后者同时还拥有更快的成熟速度。
这些不同颜色的荧光蛋白极大地拓展了生物成像的能力,使研究者可以同时追踪多个生物过程。特别值得一提的是,CFP和YFP因其发射与吸收光谱之间存在理想的重叠,共同构成了一对经典的荧光共振能量转移(FRET)供体-受体对,被广泛应用于在活细胞内实时、动态地检测蛋白质之间的相互作用。
红色荧光蛋白(RFP)
绿色、蓝色、青色、黄色的荧光蛋白都源于水母GFP,但要获得波长更长的橙色和红色荧光蛋白,则需要全新的模板。科学家们将目光投向了色彩斑斓的珊瑚。
1999年,荧光蛋白的光谱范围被革命性地拓展到了红色区域。科学家们从菇珊瑚(Discosoma sp.)中发现了第一个天然红色荧光蛋白DsRed,其发射峰位于583 nm。其独特的红色来源于比GFP更复杂的两步生色团成熟机制:由Q66-Y67-G68序列形成的生色团在达到绿色荧光状态后,会经历第二次氧化,形成一个吖啶酮结构,从而进一步延伸共轭体系,导致光谱显著红移。然而,DsRed这个强大的新工具有两个几乎是致命的缺陷:首先,它是一个强制性的稳定四聚体,当作为标签融合到宿主蛋白时,会迫使靶蛋白发生非正常的聚集,常常导致功能异常、错误定位甚至细胞毒性;其次,其成熟过程缓慢且会经过一个发绿光的中间体,这对于需要精确颜色区分的多色成像实验是严重的干扰。
为了"驯化"DsRed,使其成为一个对细胞友好的单体工具,钱永健实验室开启了一场里程碑式的蛋白质工程攻关。第一代成果是mRFP1,科学家通过引入多达33个氨基酸突变,成功破坏了四聚体间的相互作用界面,获得了首个真正意义上的单体红色荧光蛋白。尽管这是概念上的巨大突破,但mRFP1的性能付出了惨重代价,其亮度、光稳定性和成熟效率都远不及天然的DsRed,实用性有限。
真正的飞跃来自于在mRFP1基础上,通过多轮定向进化筛选出的第二代单体RFP------"水果系列"(mFruits)。这一系列蛋白的性能实现了质的飞跃,其中mCherry(发射峰610 nm)凭借其高亮度、快成熟和优良光稳定性的均衡表现,成为了迄今为止应用最广泛、最成功的单体红色荧光蛋白之一。该系列还包括了其他多种颜色的蛋白,如发射波长更长的mPlum(发射峰649 nm),这类远红光蛋白发出的光能更深地穿透生物组织,并能有效避开细胞自身的自发荧光,因此在深层组织和活体动物成像中极具优势。此外,该系列还诞生了设计巧妙的tdTomato,它通过基因串联的方式将两个弱二聚体连接成一个多肽链,使其在不引起靶蛋白聚集的前提下(行为上类似单体),亮度能达到单体的两倍,是目前最亮的红色荧光工具之一。从问题重重的DsRed到高性能单体mCherry及其家族的诞生,这条"驯化"之路是蛋白质工程的经典范例,它最终为生物学研究提供了强大可靠的红色系荧光标签,彻底扫清了多色活细胞成像的一大障碍。
超越彩虹------功能特异性荧光蛋白
超越了单纯的颜色变化,荧光蛋白工程的深入发展催生了一系列具有特殊功能的"智能探针"。它们不再仅仅是被动发光的"灯塔",而是能够响应外界刺激或报告特定细胞事件的精密分子工具,极大地拓展了生物学研究的维度。
其中一类是光控荧光蛋白,它们的光学状态可被特定波长的光精确操纵,是突破光学衍射极限的超高分辨率成像技术(如PALM/STORM)的基石。这包括了从"暗"到"亮"不可逆激活的光激活蛋白(如PA-GFP);从一种颜色不可逆转变为另一种颜色(如从绿变红)的光转化蛋白(如EosFP),其在细胞谱系追踪和蛋白质命运研究中作用巨大;以及能在"亮"态和"暗"态间可逆切换的光开关蛋白(如Dronpa)。这些蛋白使得研究者可以通过时序控制,对单个分子进行定位,从而以前所未有的分辨率观察亚细胞结构。
另一大类是生物传感器荧光蛋白,它们被巧妙设计成细胞内的"告密者",其荧光信号能特异性地响应特定分子浓度或生理状态的变化。其构建主要有两种策略:一种是基于FRET的传感器,如经典的钙离子探针Cameleon,它将一对供体/受体(如CFP/YFP)通过传感结构域连接,信号分子的结合改变二者距离,从而导致颜色比例发生变化,实现对信号的动态、比率式检测。另一种是基于单荧光蛋白的传感器,以革命性的钙离子探针GCaMP系列为代表。GCaMP通过将传感结构域插入一个环状排列的GFP(cpGFP)中,钙离子结合引起的构象变化能直接修复荧光蛋白的桶状结构,使其荧光强度发生数十倍的剧增。因其单色、高信噪比和巨大的动态范围,GCaMP系列已成为神经科学领域的标准工具,实现了大规模神经元活动的实时可视化。
此外,还涌现了更多满足特殊实验需求的荧光蛋白。例如,具有巨大斯托克斯位移的蛋白(如mKeima),其吸收峰和发射峰间隔极远,能有效避免光谱串扰,简化多色成像;对pH值变化超敏感的pHluorins,可精确报告突触囊泡的胞吐和内吞事件;以及荧光颜色能随时间自发地从一种转变为另一种的计时器蛋白(Timer FPs),为研究蛋白质的年龄和降解速率提供了直观的视觉工具。这些功能各异的荧光蛋白共同构成了一个强大而精密的分子影像工具箱,推动着生命科学向更深、更精细的层次发展。
量子点 (Quantum Dots, QDs)
量子点的基本概念与核心物理原理
量子点(Quantum Dots, QDs),又称为半导体纳米晶(Semiconductor Nanocrystals),是20世纪80年代被发现的一类全新的纳米材料。从物理学的维度来看,它是一种将电子和空穴在三个空间维度上都限制在纳米尺度(通常为2-10纳米)内的半导体材料。这种三维空间上的束缚,使其在物理学上被归类为"零维材料",因为载流子(电子和空穴)在任何方向上都不能像在宏观材料中那样自由移动,它们的运动状态由量子力学规律主导。
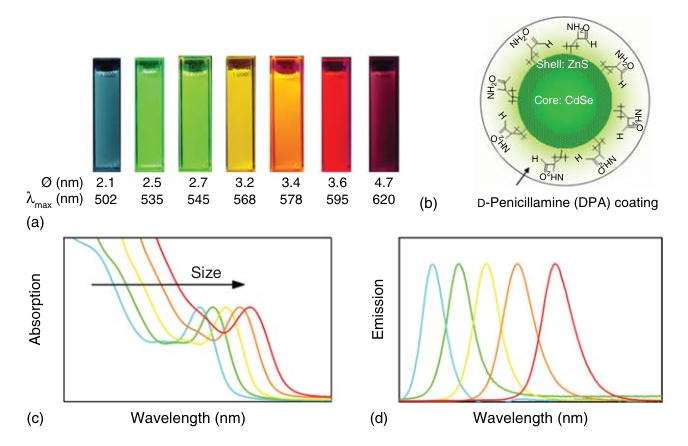
图 2‑14 不同颜色的量子点
为了更直观地理解"零维"的概念,我们可以做一个类比。宏观的块状半导体材料是"三维"的,电子可以在长、宽、高三个方向上自由运动。当我们将其中一个维度限制在纳米尺度,就形成了"二维"的量子阱(Quantum Well),电子只能在一个平面内自由运动。再将一个维度限制,就得到"一维"的量子线(Quantum Wire),电子只能沿着一条线运动。最终,当三个维度都被限制在纳米尺度时,就形成了"零维"的量子点,电子被"囚禁"在一个极小的空间内,失去了所有方向上的自由度。此时,这个微小的晶体在电子行为上表现得更像一个独立的、巨大的"人造原子"(Artificial Atom),而不是一块传统的半导体。正是这种从"无限"到"有限"的转变,孕育了量子点一系列与宏观材料截然不同的、迷人的物理化学性质。
量子点的所有独特性质,几乎都源于一个核心的物理现象------量子限域效应(Quantum Confinement Effect)。当半导体材料的物理尺寸进入纳米量级,并小到一定程度时,其内部载流子(电子和空穴)的运动会受到物理边界的强烈限制,从而导致其能量状态发生显著变化。
"盒子中的粒子"模型与能级分立化
量子限域效应最经典的物理解释可以借助量子力学中一个著名的模型------"无限深势阱"或"盒子中的粒子"(Particle in a Box)。在宏观半导体中,由于晶格的周期性排列,电子的能级形成连续的能带,主要分为价带(Valence Band)和导带(Conduction Band),两者之间由禁带(Band Gap)隔开。电子可以占据能带中的任意一个连续的能量状态。
然而,在量子点这个纳米"盒子"中,情况发生了根本改变。电子和空穴的运动被限制在晶体的物理边界之内。根据量子力学原理,当一个粒子被限制在有限空间内时,它的能量不能再连续取值,而只能取一系列分立的、量子化的数值。这就像吉他的琴弦,被固定在两端后,只能发出特定频率(基频和泛音)的音,而不能发出任意频率的声音。
因此,量子限域效应使得原本连续的导带和价带,转变为一系列分立的、原子般的能级。导带底和价带顶之间最低的两个能级之间的能量差,定义了量子点的有效带隙(Effective Band Gap)。这种能级的分立化是量子点被称为"人造原子"的根本原因,也是其所有光学和电学特性的物理起源。
激子与激子波尔半径(Exciton Bohr Radius)
要理解量子限域效应发生的临界尺寸,必须引入一个关键的物理概念------激子(Exciton)。当一个半导体吸收一个能量足够大的光子时,价带中的一个电子会被激发到导带,在价带中留下一个带正电的空穴。这个导带电子和价带空穴会因为库仑引力而相互束缚,形成一个类似氢原子的束缚对,这个电子-空穴对就被称为"激子"。
这里是图片24.png){width="2.988439413823272in" height="2.988439413823272in"}
图 2‑15 Frenkel 激子,束缚电子-空穴对,空穴定位在晶体中黑点代表的位置上
在宏观材料中,这个激子对有一定的平均空间距离,这个距离被称为激子波尔半径(Exciton Bohr Radius, a~B~)。这个参数是材料的固有属性,取决于其介电常数和电子/空穴的有效质量。例如,CdSe的激子波尔半径约为5.6 nm,而PbS的则高达20 nm。
激子波尔半径是判断量子限域效应是否显著的"标尺"。
当半导体晶体的尺寸(R)远大于其激子波尔半径(R >> a~B~)时,激子可以在晶体内部自由运动,几乎感受不到边界的存在,材料表现出与宏观块材无异的性质。这被称为弱限域区。
当晶体尺寸减小到与激子波尔半径相当或更小(R ≤ a~B~)时,激子的运动被物理边界强行压缩,电子和空穴被迫更紧密地挤在一起。此时,它们的能量状态受到尺寸的强烈调制,材料进入强限域区。我们通常所说的量子点,就是指处于强限域区的半导体纳米晶。
1.2.3 尺寸与带隙的函数关系
在强限域区,量子点的有效带隙能量 (E~g~(R)) 与其尺寸(R)之间存在着明确的反比关系。一个简化的有效质量近似模型给出了如下关系式:
其中:
E~g~(R) 是尺寸为R的量子点的有效带隙。
E~g,bulk~ 是相应块状材料的带隙。
ℏ 是约化普朗克常数。
R 是量子点的半径。
和 分别是电子和空穴的有效质量。
最后一项是激子束缚能的修正项。
这个公式的核心思想是:量子点的尺寸越小,其有效带隙越大。由于半导体发光的能量约等于其带隙能量(E=hc/λ),这意味着尺寸越小的量子点,发出的光波长越短(能量更高,颜色偏蓝);尺寸越大的量子点,发出的光波长越长(能量更低,颜色偏红)。
量子限域效应衍生的独特性质
基于上述核心物理原理,量子点展现出一系列卓越且实用的性质,使其在众多纳米材料中脱颖而出。
- 尺寸可调的光致发光(Photoluminescence)
这是量子点最核心、最引人注目的性质。对于同一种半导体材料(如CdSe),传统上它只能发出特定颜色的光。但通过将其制备成不同尺寸的量子点,我们就可以像"调色盘"一样,精确地控制其发光颜色。例如,将CdSe量子点从约2纳米逐渐增大到约6纳米,其发光颜色就可以从绿色平滑地过渡到红色。这种**"一种材料,多种颜色"**的特性,是传统有机染料或荧光蛋白难以企及的,为多色应用提供了极大的便利。
- "宽谱吸收,窄谱发射"的理想荧光特性
量子点的光谱特性非常理想。
宽谱吸收:由于量子点的能级是分立的,但高能级之间间隔非常密集,趋向于连续,形成所谓的"准连续态"。因此,任何能量大于其有效带隙的光子都可以被吸收,将电子激发到某个高能级上。这使得量子点的吸收光谱非常宽广,从其带边吸收峰(第一激子吸收峰)一直延伸到紫外区域。
窄谱发射:被激发到高能级的电子会通过极快的(皮秒量级)非辐射弛豫过程,迅速"掉落"到导带的最低能级。随后,它再与价带最高能级的空穴进行辐射复合,发出一个光子。由于这个发光过程涉及的是两个明确、分立的能级,所以发射出的光子能量非常集中,表现为非常狭窄、对称的发射峰(半峰全宽FWHM通常仅20-30 nm)。
这一"宽进严出"的特性具有巨大的应用优势。它意味着我们可以使用单一波长的激发光(例如一束蓝光或紫外光),同时激发所有不同颜色(尺寸)的量子点,而它们各自会发出颜色纯度极高、互不干扰的窄带荧光。这极大地简化了多色生物成像、流式细胞术和显示技术中的光学系统设计。
- 卓越的光稳定性与高量子产率
高光稳定性:量子点的核心是稳定的无机半导体晶格,其原子间的化学键能远高于有机荧光染料中的共价键。因此,它们在持续强光照射下不易发生光化学降解(光漂白),可以持续发光数小时甚至更长,而传统有机染料在几秒到几分钟内就会失效。这种耐久性对于需要长时间观测的生物成像和要求长寿命的显示应用至关重要。
高荧光量子产率(QY):量子产率定义为发射的光子数与吸收的光子数之比,是衡量发光效率的关键指标。量子点表面的原子由于配位不饱和,会形成大量的"悬挂键",这些悬挂键如同"能量陷阱",会捕获激子并诱导其通过非辐射途径(如产热)复合,从而猝灭荧光。通过现代化学合成技术,在量子点核(Core)的表面包覆一层更宽带隙的半导体材料(Shell),形成核-壳结构,可以有效地钝化这些表面缺陷。这极大地抑制了非辐射复合,使得电子-空穴对主要通过辐射复合(发光)的方式回到基态,从而使量子点的量子产率可以从裸核的不足10%轻松提升至90%以上,甚至接近100%。
- 独特的电学性质:"人造原子"与库仑阻塞
量子点的"人造原子"特性不仅体现在光学上,也体现在电学上。
分立能级:如同原子一样,其分立的能级结构是制造高性能量子点激光器的基础,因为它可以实现高效的粒子数反转和受激辐射。同时,它也是实现单光子源的理想平台。
库仑阻塞(Coulomb Blockade):由于量子点尺寸极小,其自身电容也极小。根据公式 E=e^2^/(2C),向一个电容为 C 的小岛充入一个电子 e 所需的能量与电容成反比。对于量子点,这个充电能非常大。当一个电子通过隧穿效应进入量子点后,其产生的静电排斥力会强烈地阻止第二个电子的进入,除非施加足够大的外部电压来克服这个排斥能。这种现象就是库仑阻塞,它是构筑单**电子晶体管(Single-Electron Transistor)**的物理基础,使得精确控制和操纵单个电子的运动成为可能。
合成与制备方法
量子点的物理化学性质由其尺寸、形状和表面化学精确决定。因此,能够精确、可控地制造出这些纳米结构的方法论,是整个量子点科学与技术领域的基石。纵观其发展历程,量子点的制造方法主要遵循两条截然不同却又相得益彰的路径:"自下而上"(Bottom-up)的化学合成和"自上而下"(Top-down)的物理制备。前者如同用原子和分子作为"砖块",精心搭建起一座纳米建筑;后者则像一位雕塑家,从一块完整的晶圆材料上,通过精雕细琢,刻画出所需的纳米结构。本章将深入探讨这两种方法的原理、技术细节及其各自的适用领域。
"自下而上"的化学合成法
"自下而上"的化学合成,特别是胶体化学法,是制备独立、分散的量子点(即胶体量子点)最主流、最成功的方法。这类方法在液相环境中,通过化学反应将原子前驱体转化为单体,再通过成核与生长过程,最终形成表面包裹着有机配体的纳米晶体。这些量子点可以像"分子染料"一样溶解在溶剂中,具有优异的光学性能,是生物成像、显示技术、太阳能电池等领域的核心材料。
- 高温热注入法(Hot-injection)
1993年,Bawendi研究组发表的论文完善了高温热注入法,这一方法至今仍是合成高质量、单分散(尺寸均一性好)胶体量子点的"黄金标准"。其巨大的成功源于它巧妙地将一个经典的物理化学理论------拉末模型(LaMer Model)------付诸实践。
- 拉末模型(LaMer Model)
拉末模型描述了从过饱和溶液中形成新相(在此即纳米晶体)的动力学过程,其核心思想是将晶体的形成清晰地划分为两个独立且在时间上分离的阶段:成核(Nucleation)和生长(Growth)。
第一阶段:单体浓度积累与过饱和。反应开始时,前驱体在溶液中分解,形成构建晶体的基本单元------单体。单体浓度(图中曲线C)持续上升,当超过其在该温度下的溶解度(Cs)后,溶液进入过饱和状态。
第二阶段:爆发式成核。单体浓度继续攀升,直至达到一个更高的临界成核浓度(Cnuc)。此时,体系的自由能极不稳定,会通过形成大量的晶核来迅速降低能量。这个过程是短暂而剧烈的,被称为"爆发式成核"(Burst Nucleation)。大量的晶核在几乎同一瞬间形成,消耗掉溶液中大量的单体,使得单体浓度迅速下降。
第三阶段:扩散控制的生长。爆发成核后,单体浓度迅速跌落至临界成核浓度以下,但仍高于溶解度。此时,体系能量不足以形成新的晶核,成核过程停止。反应进入生长阶段,溶液中剩余的单体通过扩散的方式,沉积到已经存在的晶核表面,使其逐渐长大。由于所有晶核几乎是同时"起跑",并且在相同的单体浓度环境中生长,它们最终的尺寸会非常均一。
高温热注入法的精髓,就在于通过一个简单的实验操作------快速注入,完美地实现了拉末模型所描述的成核与生长的分离。实验中,将一种前驱体(通常是阴离子前驱体)在室温下溶解后,通过注射器快速注入到含有另一种前驱体(阳离子前驱体)的高温溶液中。这种"冷"溶液的注入,一方面会引起体系温度的瞬间骤降,另一方面会使前驱体迅速分解,导致单体浓度在极短时间内飙升,瞬间超过临界成核浓度,从而触发"爆发式成核"。随后,体系温度回升并稳定在一个较低的生长温度,反应便平稳地进入生长阶段。
- 合成三要素
高温热注入法的成功,离不开对化学体系中三个关键组分的深刻理解和精妙调控。
前驱体(Precursors):它们是构成量子点的元素来源。通常分为金属阳离子前驱体和非金属阴离子前驅體。例如,在合成经典的CdSe量子点时,阳离子前驱体可以是氧化镉(CdO)、乙酸镉(Cd(Ac)₂)等;阴离子前驱体则是将硒(Se)粉或硫(S)粉溶解在如三辛基膦(TOP)的溶剂中形成溶液。前驱体的反应活性是控制合成动力学的关键。高活性的前驱体分解速度快,容易引发快速的爆发式成核,有利于形成小尺寸、高浓度的晶核。反之,低活性的前驱体则有利于后续缓慢、可控的生长。通过选择不同种类和活性的前驱体,可以对量子点的成核速率和生长速率进行精细调控。
表面活性剂/配体(Surfactants/Ligands):如果说前驱体是"砖块",那么配体就是整个合成过程的"灵魂"与"建筑师"。它们通常是具有一个极性头基(如羧基-COOH, 氨基-NH₂, 膦氧基-P=O)和一个长长的非极性烷基链的两亲性分子,例如油酸(OA)、油胺(OAm)、三辛基氧化膦(TOPO)等。其作用至关重要且多方面:
动态控制生长:配体分子通过其极性头基,动态地吸附和脱附在纳米晶体的表面,形成一个动态的有机保护层。这个保护层如同一个"软壳",调节着溶液中单体扩散到晶体表面的速率,从而精确地控制晶体的生长速度,并抑制"奥斯特瓦尔德熟化"(即大颗粒"吃掉"小颗粒)等导致尺寸分布变宽的现象。
防止团聚:长长的非极性烷基链伸展到溶剂中,形成一层空间位阻屏障。当两个量子点相互靠近时,它们表面的烷基链会相互排斥,有效阻止了纳米晶体在高温下发生不可控的聚集和沉淀。
提供胶体稳定性:这层"油性外衣"使得最终得到的量子点能够稳定地分散在非极性有机溶剂(如甲苯、己烷)中,形成澄清、透明的胶体溶液。对于后续应用,这层原始配体还可以通过配体交换技术,替换为水溶性配体,使其能够应用于生物环境中。
- 溶剂(Solvent):溶剂为整个化学反应提供了一个高温、化学惰性的环境。因此,通常选择高沸点(>250°C)的有机溶剂,如十八烯(ODE)、石蜡油等。高温不仅是分解许多前驱体所必需的,也对晶体的结晶质量至关重要------高温有利于原子在晶格上进行重排和退火,从而形成缺陷更少的、高质量的晶体。
- 其他化学合成方法简介
除了高温热注入法,还发展出了多种其他化学合成方法,以适应不同材料体系或特定应用需求:
水相合成法:直接在水溶液中进行合成,通常使用硫醇类分子(如巯基乙酸)作为稳定剂。这种方法环境友好、成本低,得到的量子点天然具有水溶性,非常适合生物应用。但通常,水相法合成的量子点结晶质量和光学性能(特别是量子产率和发射峰宽度)不如有机相法。
溶剂热/水热法:将反应物置于密封的反应釜(高压釜)中,利用溶剂在高温高压下的独特性质进行反应。这种方法可以合成一些在常压下难以结晶的材料。
微波辅助合成法:利用微波辐射对反应体系进行快速、均匀的加热,可以极大地缩短反应时间(从数小时缩短至数分钟),是一种高效、节能的合成方法。
"自上而下"的物理制备法
与化学合成法截然相反,"自上而下"的物理制备法从大块的、高质量的半导体晶圆出发,利用半导体工业中成熟的微纳加工技术,通过"雕刻"或"生长"的方式,在指定位置制造出量子点。这类方法制造出的量子点被固定在芯片上,是构筑固态量子器件(如激光器、单光子源、量子计算机)的基础。
- 电子束光刻与刻蚀技术
这是一种典型的"雕刻"式方法。其过程类似于版画制作:
a. 在半导体晶圆(如GaAs)表面旋涂一层对电子束敏感的光刻胶。
b. 使用高精度的电子束光刻机(EBL),像用一支"电子笔"一样,在光刻胶上直接"绘制"出纳米级的量子点图案。
c. 用特定显影液洗去被电子束曝光(或未曝光)的光刻胶,在晶圆表面留下一个纳米尺寸的"掩膜"图案。
d. 最后,使用等离子体反应离子刻蚀(RIE)或湿法化学腐蚀,将未被掩膜保护的半导体材料去除掉,最终只留下与掩膜形状一致的、孤立的纳米柱或纳米点结构,即量子点。
这种方法的最大优点是位置、尺寸和形状的确定性控制,可以像设计电路一样,精确地将量子点阵列集成在芯片的任何位置。但其缺点是成本极高、产量极低,且刻蚀过程容易在量子点侧壁引入损伤和表面缺陷,影响其光学和电学性能。
- 分子束外延(MBE)与金属有机物化学气相沉积(MOCVD)的自组织生长
这是一种更为精巧的、基于晶体外延生长的"自下而上"与"自上而下"相结合的方法,特别是一种被称为斯特兰斯基-克拉斯坦诺夫(Stranski-Krastanov, S-K)生长模式的自组织技术。
其原理是利用两种不同半导体材料之间晶格常数的不匹配。例如,在晶格常数较大的GaAs衬底上,通过MBE或MOCVD技术,以原子层级的精度,沉积晶格常数较小的InAs材料。
起初,InAs会以"层状"模式逐层生长,但由于晶格不匹配,InAs薄层会受到来自衬底的巨大压应力。当这个应变能积累到一定程度(通常在生长几个原子层厚度之后),体系为了寻找能量更低的状态,连续的薄膜会自发地破裂,并重组成一个个三维的、金字塔状或透镜状的纳米岛。这些在原子级别上与衬底晶格完美匹配、没有位错的应变岛,就是高质量的量子点。
通过S-K模式自组织生长的量子点,其晶体质量极高、缺陷密度极低,且内嵌于半导体矩阵中,表面纯净无污染。这使得它们具有卓越的电学性能和激子相干性,是制造高性能量子点激光器、红外探测器和量子信息技术中单光子源的核心技术。
特性 "自下而上"化学合成法 "自上而下"物理制备法
基本原理 原子/分子自组装 宏观材料微纳加工
最终产物 胶体纳米晶,可分散在溶剂中 固定在芯片衬底上的固态结构
控制重点 尺寸、形状、表面化学的精确控制 空间位置的精确控制(光刻法)或晶体质量的极致追求(外延法)
晶体质量 普遍较高,但存在表面缺陷 极高,特别是外延法,接近完美晶格
规模与成本 易于大规模、低成本生产 产量低,设备昂贵,成本高
典型应用 溶液基应用:生物成像、QLED显示、太阳能电池、荧光探针 芯片基应用:半导体激光器、单光子源、量子计算、红外探测器
: 表格 2‑3
量子点家族
在掌握了量子点的基本物理原理与核心制备方法论之后,我们将深入探索构成这个"纳米宇宙"的"繁星"------形形色色的量子点材料家族。每一个家族都拥有其独特的化学组成、物理特性、合成挑战和应用前景。它们的演进故事,不仅是一部材料科学不断自我超越的奋进史,也深刻反映了科技发展在追求卓越性能与满足安全、环保需求之间所做的权衡与创新。
含镉(Cadmium-based)量子点家族
含镉量子点是整个领域的"开山鼻祖"和"黄金标准"。自20世纪90年代初高质量胶体合成方法被建立以来,以CdSe为代表的含镉量子点就成为了研究得最深入、性质理解得最透彻、光学性能最优异的典范体系。它们如同生物学领域的"果蝇"或"大肠杆菌",几乎所有关于量子点的新概念、新现象、新应用,最初都是在含镉体系上得以验证和展示的。
含镉量子点是研究最为广泛和成熟的一类量子点材料,其中硒化镉(CdSe)是核心代表。CdSe量子点因其适中的激子波尔半径,在易于合成的尺寸范围内展现出强烈的量子限域效应,通过精确调控尺寸,其荧光发射可以覆盖从绿色到红色的核心可见光谱区域,且其合成化学成熟可控,使其成为理想的模型体系。为了拓展光谱范围,研究人员开发了CdSe的"兄弟"材料:碲化镉(CdTe)和硫化镉(CdS)。CdTe的发射波长更长,可覆盖至近红外区域,在深层生物成像中优势显著;而CdS的发射波长更短,处于蓝紫光区,更常作为构建高性能核-壳结构的理想壳层材料。
为了克服裸量子点核因表面缺陷导致荧光效率低和稳定性差的根本问题,核-壳结构应运而生,这是量子点从实验室走向现实应用的关键一步。通过在CdSe等核心外层包覆一层晶格匹配且带隙更宽的半导体(如ZnS),可以有效钝化表面、消除缺陷,将电子和空穴牢固地限制在核内。这种结构不仅能将量子产率从不足10%提升至接近100%,还能像一层"化学盔甲"一样保护核心,极大地增强其化学稳定性和光稳定性。
尽管含镉量子点性能卓越,但其发展始终受制于镉元素的生物毒性和环境危害这一"阿喀琉斯之踵"。镉作为一种受严格管控的重金属,其潜在的泄露风险使其无法用于植入式生物医学领域,并且在消费电子产品中也面临着欧盟RoHS指令等日益严格的环保法规限制。因此,开发高性能、环境友好的无镉量子点已成为整个领域最重要和最紧迫的战略发展方向。
无镉(Cadmium-free)量子点家族的探索
为了应对含镉量子点的毒性与环境风险,开发高性能的无镉替代品已成为该领域的核心方向。在这场"绿色"革命中,III-V族的磷化铟(InP)基量子点被视为最有希望的继承者。尽管InP的合成因其更强的共价键、危险的前驱体和复杂的表面化学而极具挑战,但经过近二十年的技术攻关,通过开发温和的磷源和设计复杂的核-壳-壳结构,研究人员已成功制备出量子产率超过90%的高质量InP量子点。其光学性能已能与含镉量子点相媲美,并成功应用于商业化的高端显示产品中。
除了InP,研究人员也在探索其他无镉体系。一类是II-VI族的宽带隙半导体,如硒化锌(ZnSe)和硫化锌(ZnS),其本征发光位于蓝光和紫外区。它们的一个重要应用是通过掺杂过渡金属离子(如锰或铜)来实现颜色调控。这种发光机制源于掺杂离子的内部电子跃迁而非量子限域效应,能够产生高效、稳定且斯托克斯位移大的长波长光,展现出独特的应用优势。
另一大方向是硅(Si)和锗(Ge)等IV族元素半导体量子点。这类材料拥有无与伦比的生物相容性、环境友好性以及与现有微电子工艺的兼容性。然而,它们面临着一个根本性的物理瓶颈------间接带隙特性。这一特性导致其本征发光效率极低,辐射复合速率非常缓慢。尽管量子限域效应和表面工程能在一定程度上提升其性能,但其发光效率仍远不及直接带隙的量子点,因此目前更多地被探索用于光伏、光电探测等对发光亮度要求不那么严苛的领域。
特种量子点材料家族
除了主流的量子点材料外,还存在一些具有特殊组成的"奇兵",它们极大地拓展了量子点的应用版图。首先是以硫化铅(PbS)和硒化铅(PbSe)为代表的铅盐量子点,它们因其极大的激子波尔半径,在近红外(NIR)波段展现出无与伦比的性能。通过尺寸调控,其发射光谱可轻松覆盖800-2000 nm范围,使其成为生物深层组织成像(NIR-II窗口)和高效近红外太阳能电池(具有多激子效应潜力)中不可替代的核心材料。然而,铅元素的剧毒性是其走向广泛应用,尤其是临床应用的最大障碍。
其次是近年来异军突起的钙钛矿量子点,它们几乎在所有光学指标上都刷新了纪录。这类材料无需复杂包覆即可实现近乎100%的量子产率,具有前所未有的极窄发射峰(极致色纯度),并且可以通过简单调整化学组分实现全光谱调色。其独特的缺陷容忍性是其高性能的关键原因。然而,与卓越性能形成鲜明对比的是其致命的弱点------极差的稳定性。钙钛矿量子点对水、氧、光、热都非常敏感,极易分解失效,如何提升其稳定性是当前阻碍其商业化的核心挑战。
最后是碳基量子点,包括碳点(CDs)和石墨烯量子点(GQDs),它们是"绿色"材料的典范。由碳元素构成,它们具有优异的生物相官容性和低毒性,且原料来源广泛廉价,易于在水中分散。尽管发展迅速,但碳基量子点面临着一个核心的科学挑战:其发光机理至今悬而未决,存在多种理论且可能是多机制协同作用。这种机理上的不确定性导致其光学性质的可重复性差,发射峰较宽,性能难以精确预测和调控,这是其走向高性能应用前必须解决的关键问题。
功能性荧光探针
在探索微观生命世界的征程中,科学家们早已不满足于仅仅"看见"细胞的静态结构。他们渴望"听懂"细胞的语言,"感知"其内部瞬息万变的动态信息------温度的起伏、pH值的波动、离子的奔流、分子的合成与降解。功能性荧光探针(Functional Fluorescent Probes),正是实现这一宏伟目标的核心工具,它们是化学家和生物学家联手创造的、能够深入细胞内部并实时报告特定信息的"分子信使"或"微型传感器"。
与仅仅用于标记和定位的传统荧光染料(如DAPI染细胞核)不同,功能性荧光探针是一类"智能"分子,其自身的一种或多种荧光特性------如荧光强度、发射波长、荧光寿命或偏振------会随着其所处微环境中特定分析物浓度或物理参数的变化而发生可预测、可测量的响应。当探针报告特定信息时,就如同生命过程在对我们"开口说话",将不可见的化学或物理变化,转化为了我们通过显微镜可以捕捉到的、绚烂的光学信号。
功能性荧光探针的设计原理与核心策略
一个成功的荧光探针,其核心在于一个精巧的分子开关机制,能够将对特定分析物的"识别"事件与荧光信号的"开启/关闭/转换"事件高效地联系起来。经过数十年的发展,科学家们已经建立了一套成熟的设计"工具箱"。
核心信号转导机制
光诱导电子转移(Photoinduced Electron Transfer, PeT)
a) 原理:这是设计"开/关"型探针最经典的机制。探针分子由一个荧光团(Fluorophore)和一个识别基团(Receptor)通过一个短的间隔基(Spacer)连接而成。识别基团本身也是一个电子供体或受体。在"关闭"状态下,当荧光团被激发后,识别基团会迅速向其提供一个电子(或从其夺取一个电子),通过这种非辐射的电子转移过程使激发能猝灭,导致无荧光或荧光很弱。当识别基团与目标分析物结合后,其电子云密度或氧化还原电位发生改变,PeT过程被抑制,非辐射通道关闭,荧光团恢复其固有的强烈荧光,实现信号"开启"。
b) 应用:广泛用于设计离子、活性氧(ROS)等探针。
分子内电荷转移(Intramolecular Charge Transfer, ICT)
a) 原理:这类探针通常具有"给电子体-π桥-受电子体"(D-π-A)的推拉电子结构。光激发后,电子密度从给电子体(D)向受电子体(A)转移,形成一个大偶极矩的激发态。当识别位点(通常是D或A的一部分)与分析物作用时,会改变D的给电子能力或A的受电子能力,从而显著影响ICT激发态的能量。这种能量的变化直接导致荧光发射波长的移动(红移或蓝移),从而实现比率型(Ratiometric) 测量。
b) 应用:pH探针、极性探针、部分离子探针的核心机制。比率型测量使用两个波长的荧光强度比值作为信号,可以消除由探针浓度、激发光强波动等因素带来的误差,定量更准确。
荧光共振能量转移(Fluorescence Resonance Energy Transfer, FRET)
a) 原理:利用两个荧光团------一个供体(Donor)和一个受体(Acceptor)之间的非辐射能量转移。当供体和受体的发射/吸收光谱有适当重叠且二者空间距离足够近(通常小于10 nm)时,被激发的供体可以通过偶极-偶极相互作用,将能量转移给受体,导致供体荧光猝灭而受体发出敏化荧光。
b) 设计:将供体和受体连接在一个对分析物敏感的"柔性接头"两端。当分析物存在时,接头发生构象变化(如折叠或伸展),改变了供体-受体间的距离,从而调控FRET效率。
c) 应用:设计生物传感器的"黄金标准"。用于构建钙离子、激酶活性、机械力等探针。
聚集诱导发光(Aggregation-Induced Emission, AIE)
a) 原理:与传统染料的聚集导致猝灭(ACQ)相反,AIE探针在分散状态下由于分子内运动(如旋转)消耗了激发能而不发光,但在与分析物作用或环境变化导致其聚集时,分子内运动受限,辐射跃迁通道打开,从而发出强烈荧光。
b) 应用:提供了一个天然的"从无到有"的信号模式,具有极高的信噪比。用于设计酶活性、离子、生物大分子等探针。
化学反应介导的机制
a) 原理:探针分子与分析物之间发生高度特异性的化学反应(如断键、成键、重排等),该反应直接导致荧光团的生成、破坏或其共轭体系的改变,从而引起荧光信号的剧烈变化。这是一种不可逆的探针机制。
b) 应用:是设计对活性小分子(ROS、RNS、硫醇等)探针的最主要策略,选择性极高。
理想探针的关键性能指标
高选择性(Selectivity):只对目标分析物响应,不受细胞内其他共存物质的干扰。
高灵敏度(Sensitivity):在生物学相关的浓度范围内(通常是纳摩尔到微摩尔级别)有显著的信号变化。
快速响应(Response Time):能够实时追踪快速的生物学过程。
比率型 vs. 强度型:比率型(Ratiometric)探针通过波长或寿命的变化来报告信号,可进行原位校准,定量更可靠。强度型(Intensometric)探针设计简单,但易受多种因素干扰。
长波长与近红外(NIR):激发和发射波长越长(>650 nm),细胞自发荧光的干扰越小,光毒性越低,组织穿透深度越深,越适合活体成像。
高光稳定性:能抵抗长时间光照而不发生光漂白。
良好的生物相容性:低细胞毒性,高水溶性,高细胞膜通透性(或具有靶向能力)。
环境响应型探针
细胞内的物理环境,如温度、pH、粘度等,是决定生命活动状态的关键参数。
温度探针 (Temperature Probes)
细胞内的温度与新陈代谢速率、酶活性、细胞分裂等密切相关。线粒体等细胞器是"产热中心"。精确测量亚细胞水平的温度,对理解细胞热动力学和相关疾病至关重要。
基于热敏聚合物:将温敏聚合物(如聚N-异丙基丙烯酰胺, PNIPAM)与对环境极性敏感的荧光团(如丹磺酰胺)结合。PNIPAM在特定温度(LCST,低临界溶解温度)附近会发生从亲水到疏水的相变,导致荧光团周围的微环境极性剧变,从而引起荧光强度和波长的显著变化。
基于分子内旋转/振动:
双荧光团比率型探针:将一个对温度不敏感的荧光团(作为参比)和一个对温度敏感的荧光团(其非辐射跃迁速率随温度升高而显著增加)共价连接。通过监测二者荧光强度的比值来精确测温。例如,罗丹明B的衍生物常被用作温度敏感单元。
荧光高分子温度计:利用两种单体共聚,一种提供荧光信号,另一种提供温敏性,通过温度调控聚合物链的构象变化来改变荧光。
基于荧光寿命:某些镧系元素配合物(如铕Eu³⁺, 铽Tb³⁺)的磷光寿命对温度非常敏感,可用于构建高精度的温度探针,并通过荧光寿命成像(FLIM)进行测量,排除了浓度的干扰。
遗传编码探针:通过定向进化,筛选出荧光强度或光谱对温度敏感的荧光蛋白变体,如T-Sapphire的某些突变体。
pH探针 (pH Probes)
pH是细胞内最重要的离子环境参数。不同细胞器具有特征性的pH值(如溶酶体pH 4.5-5.0,线粒体基质pH ~8.0,细胞质pH ~7.2),pH的稳态对维持其功能至关重要。肿瘤微环境的酸性也是其重要特征。
基于荧光团的质子化/去质子化:这是最经典的设计。荧光团结构中含有酸性或碱性基团(如酚羟基、芳香胺),其质子化状态随pH变化,直接改变了分子的共轭体系和ICT特性。
荧光素(Fluorescein)及其衍生物:如BCECF (2',7'-Bis-(2-Carboxyethyl)-5-(and-6)-Carboxyfluorescein),是应用最广泛的胞内pH探针。其酚羟基的pKa在生理pH附近,去质子化后荧光大大增强。BCECF具有双激发峰,可进行比率测量。
SNARF和SNAFL系列:(Seminaphthorhodafluor/Seminaphthofluorescein) 是更优秀的比率型pH探针。它们在酸性和碱性条件下具有不同的发射峰,通过监测双波长发射强度的比值来精确测定pH。
遗传编码探针:
- pHluorins:基于GFP改造而来的pH探针。通过突变生色团周围的氨基酸,使其质子化状态对pH敏感。pHluorins有多个版本,有的在pH升高时荧光增强(ratiometric pHluorin),有的则发生激发光谱的移动,它们被广泛用于监测突触囊泡的胞吐和内吞循环。
粘度探针 (Viscosity Probes)
细胞内是一个高度拥挤的环境,其粘度反映了生物大分子的浓度和相互作用。粘度的异常变化与细胞凋亡、蛋白质聚集、衰老和疾病(如阿尔兹海默症)密切相关。
分子转子(Molecular Rotors):这是设计粘度探针的绝对主流策略。这类分子包含一个荧光核心和一个可以相对其自由旋转的部分。
工作原理:在低粘度环境中,激发态分子可以通过快速的分子内旋转,以非辐射的方式高效地释放能量,导致荧光很弱。在高粘度环境中,溶剂的"粘性拖拽"阻碍了这种旋转,关闭了非辐射通道,激发态能量只能通过辐射跃迁(荧光)释放,导致荧光强度急剧增强。其荧光强度或寿命与粘度呈正相关。
经典分子:BODIPY、DCVJ (4-(Dicyanovinyl)julolidine)、噻吩并吡咯等骨架常被用来构建分子转子。通过引入靶向基团,可以实现对特定细胞器(如线粒体、内质网)粘度的精确测量。
压力/机械力探针 (Mechanical Force Probes)
机械力在细胞迁移、分化、组织发育和疾病进展(如癌症转移)中扮演着核心角色。测量活细胞内特定蛋白质上承受的皮牛(pN)级别的张力,是理解力学生物学的关键。
基于FRET的张力探针:这是目前最成功的策略。
设计:将一对FRET供体/受体(如CFP/YFP或Cy3/Cy5)通过一个"弹性接头肽"(如来自蜘蛛丝蛋白的序列或波形蛋白的重复序列)连接起来,然后将整个"模块"插入到目标蛋白(如黏着斑蛋白vinculin)的非关键区域。
工作原理:在没有外力时,接头肽处于自然卷曲状态,FRET对距离很近,FRET效率高。当细胞骨架收缩等活动通过目标蛋白传递张力时,弹性接头被拉伸,FRET对距离变远,FRET效率降低。通过荧光寿命或双通道荧光强度的比率变化,可以定量计算出蛋白质上承受的张力大小。
基于化学反应的力敏探针(Mechanophores):
- 螺吡喃(Spiropyran):螺吡喃在无张力时是无色闭环结构,在机械力作用下可以发生开环反应,转变为有色的、具有荧光的部花青(merocyanine)形式。将其嵌入高分子材料或蛋白质中,可以报告宏观或微观的力学事件。
物种响应型探针
细胞内充满了各种离子和活性小分子,它们是信号传导和代谢调控的关键执行者。
离子探针 (Ion Probes)
钙离子(Ca²⁺)探针:
Ca²⁺是最重要、最普适的第二信使,调控着肌肉收缩、神经递质释放、细胞凋亡等几乎所有生命活动。
化学探针:
BAPTA类螯合剂:核心设计是将一个对Ca²⁺有高选择性、高亲和力的螯合剂BAPTA与一个荧光团结合。
强度型探针:如 Fluo系列(Fluo-3, Fluo-4)。BAPTA与荧光素偶联,结合Ca²⁺后发生构象变化,抑制了PeT猝灭,荧光强度急剧增强。
比率型探针:如 Fura-2(双激发)和 Indo-1(双发射)。结合Ca²⁺后,其激发或发射光谱发生显著移动,通过比率测量可以精确定量胞内钙离子浓度。
遗传编码钙指示剂(GECIs):
GCaMP系列:目前最流行的GECIs。其结构为环状排列的GFP(cpGFP)、钙调蛋白(CaM)和M13肽。无钙时,结构松散,荧光微弱。钙离子结合CaM后,CaM-M13相互作用,引起cpGFP构象恢复,荧光急剧增强(ΔF/F可达数十倍)。GCaMP的不断优化,极大地推动了神经科学的发展,实现了大规模神经元活动的在体记录。
Cameleon系列:基于FRET的钙探针,结构为CFP-CaM-M13-YFP。
其他金属离子探针:
锌离子(Zn²⁺):作为第二信使和酶的辅因子,也非常重要。探针如Zinpyr系列,通常是基于荧光素骨架,连接一个对Zn²⁺特异性的二(2-吡啶甲基)胺(DPA)螯合基团。
铁离子(Fe²⁺/Fe³⁺):对于研究铁死亡等过程至关重要。探针设计通常利用铁离子能有效猝灭多种荧光的特性(关断型),或通过铁催化的反应来开启荧光。
重金属离子(Hg²⁺, Pb²⁺, Cu²⁺):多用于环境监测和毒理学研究。设计常利用重金属与硫醇的强相互作用(如引起罗丹明螺环内酰胺的开环)或催化特定化学反应。
活性小分子探针
- 活性氧/氮物种(ROS/RNS)探针:
科学意义:ROS/RNS是细胞代谢的副产物,在低浓度下是重要的信号分子,在高浓度下则会引起氧化应激损伤。
设计策略:利用ROS/RNS独特的化学反应活性。
超氧阴离子(O₂⁻):二氢乙锭(DHE) 是经典探针,被O₂⁻氧化后生成能嵌入DNA的红色荧光产物。MitoSOX是其线粒体靶向版本。
过氧化氢(H₂O₂):最成功的策略是利用硼酸酯作为识别基团。H₂O₂可以选择性地氧化硼酸酯,切断其与荧光团的连接,释放出荧光分子。如Peroxy Orange 1 (PO1)。
次氯酸(HClO):利用其强氧化性,氧化探针分子中的对甲氧基苯酚或硫醚等结构,引起荧光变化。
一氧化氮(NO):DAF系列(二氨基荧光素) 是经典探针。NO(需先被氧化)可以与邻二胺结构反应,生成高度荧光的苯并三唑衍生物。
过氧亚硝酸盐(ONOO⁻):一种强氧化剂和硝化剂,探针设计思路与H₂O₂/HClO类似。
- 生物硫醇(GSH, Cys, Hcy)探针:
科学意义:谷胱甘肽(GSH)是细胞内最重要的抗氧化剂,维持着细胞的还原性环境。
设计策略:利用硫醇的强亲核性。
迈克尔加成反应:探针分子中含有一个缺电子的烯酮或丙烯腈结构(迈克尔受体),它会猝灭荧光。硫醇可以与其发生加成反应,破坏猝灭效应,点亮荧光。
亲核取代/断裂反应:利用一些对硫醇敏感的保护基,如2,4-二硝基苯磺酰基。硫醇的亲核攻击可以切断该保护基,释放荧光团。
- 神经递质探针:
科学意义:实时监测神经元突触间隙的神经递质(如谷氨酸、多巴胺、乙酰胆碱)的动态变化,是理解大脑功能的关键。
遗传编码探针的革命:
iGluSnFR:第一个成功的谷氨酸探针。其设计为将cpGFP插入到细菌的谷氨酸结合蛋白(GltI)中。当谷氨酸结合时,GltI发生"蚌壳式"关闭运动,挤压cpGFP使其荧光增强。
GRAB系列:基于GPCR(G蛋白偶联受体)改造的通用平台。将cpGFP插入到特定神经递质的GPCR的第三个胞内环。当受体与配体(如多巴胺)结合并发生构象变化时,cpGFP的荧光被调控。该平台已成功开发出针对多巴胺、乙酰胆碱、去甲肾上腺素等多种递质的探针。
靶向特定细胞结构的探针
为了研究特定细胞器内的生理生化过程,必须将功能性探针精确地递送到目标位置。
细胞器靶向探针
设计原理:将一个荧光报告单元与一个细胞器靶向基团共价连接。
线粒体:靶向基团通常是亲脂性阳离子,如三苯基膦(TPP⁺)、罗丹明、吡啶盐等。它们可以利用线粒体内膜巨大的负电位(约-180 mV)而被富集。MitoTracker系列是商业化探针的典范。
溶酶体/内涵体:靶向基团通常是弱碱性基团,如吗啉环(LysoTracker系列)。它们以中性形式穿过细胞膜,但在溶酶体的酸性环境中被质子化,带上正电荷后被"困在"溶酶体内。
内质网:靶向基团通常是疏水性的、能与内质网膜蛋白结合的分子,如格列本脲(一种磺酰脲类药物),其衍生物被用作ER-Tracker。
脂滴:靶向基团是高度疏水、电中性的荧光团,如BODIPY 493/503和尼罗红(Nile Red)。它们根据相似相溶原理,特异性地分配到脂滴的中性脂质核心中。
细胞核:利用能与DNA结合的基团,如Hoechst或DAPI,它们能嵌入DNA小沟。
高尔基体:利用与高尔基体有亲和力的分子,如基于神经酰胺的荧光衍生物。
酶活性探针
设计原理:将荧光团通过一个能被特定酶识别和切割的"底物链接臂"与一个猝灭基团相连,或者将底物作为荧光团的"封盖"基团。
工作模式:在酶作用之前,探针无荧光或荧光很弱。当目标酶对底物进行催化反应(如水解、氧化、还原)后,链接臂断裂或"封盖"被移除,荧光团被释放,发出强烈荧光。
实例:
半胱天冬蛋白酶(Caspases)活性探针:Caspase-3是细胞凋亡的关键执行者,其识别底物序列为DEVD。可以设计FRET探针(如Ac-DEVD-pNA),或设计一个被DEVD肽"封盖"的荧光团。当细胞凋亡启动,Caspase-3被激活,它会切断DEVD肽,从而点亮荧光。
β-半乳糖苷酶探针:β-半乳糖苷酶(由LacZ基因编码)是经典的报告基因。其探针FDG (Fluorescein di-β-D-galactopyranoside) 本身无荧光,被酶水解掉半乳糖基团后,释放出强荧光的荧光素。
**
**