🚀 【Angew. Chem.】癌症治疗新革命!近红外激活,效率暴增15.6倍的“光控导弹”,如何实现**99.1%**的超高肿瘤抑制率?
✨文章标题:Simultaneously Enhancing NIR-II Emission, Type-I, and Type-II Photosensitization Through Acceleration of Charge-Separated-State Formation for Tumor Phototheranostics ✉️作者: Prof. Dugang Chen, Prof. Duo Mao, Prof. Fang Hu, Prof. Wenbo Wu 等 📚期刊:Angew. Chem. Int. Ed. 🔗链接:https://doi.org/10.1002/anie.202521182
一、从“热疗”瓶颈到“光控”突破:为什么这个研究至关重要?
在现代抗癌战役中,光热疗法(PTT) 和光动力疗法(PDT) 因其无创、精准的特点,被寄予厚望。简单来说,PTT就像用激光给肿瘤“加热”,将癌细胞烧死;而PDT则更像激活“化学炸弹”,利用光敏剂产生活性氧(ROS) 来毒杀癌细胞。当这两种疗法——即光疗——协同作用时,治疗效果往往能实现“1+1>2”的飞跃。
然而,理想很丰满,现实很骨感。用于光疗的药剂,尤其是那些能被穿透力更强的近红外光(NIR) 激发的药剂,存在一个致命的**“能量缺口定律”限制。这导致了一个难以调和的矛盾:它们在吸收NIR光后,大多选择通过非辐射衰变**(即产热,进行PTT)来释放能量,却难以高效地产生能杀伤细胞的活性氧(PDT)或发出明亮的荧光(成像引导)。
这就好比我们制造了一枚高精度的“光控导弹”,却发现它的导航系统(荧光) 不亮,战斗部(活性氧) 威力有限,大部分能量都浪费在了无用的“助推器热量”上。这种“顾此失彼”的性能瓶颈,极大地限制了光诊疗一体化(Phototheranostics) 制剂的联合治疗效果。
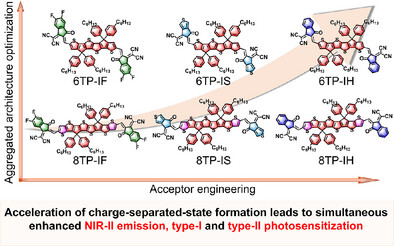
今天,来自天津大学等机构的研究团队,在《德国应用化学》上发表了一项颠覆性突破,提出了一个全新的“加速电荷分离态形成”策略,成功打破了这一物理限制。他们研发出的新型光诊疗剂6TP-IH,不仅NIR-II荧光成像强度提高了15.6倍,同时其活性氧生成效率也提高了3.38倍,最终在动物模型中实现了惊人的**99.1%**肿瘤抑制率。
二、核心方法与技术细节解密:“加速电荷分离态”的量子奥秘
🎯 什么是“电荷分离态”?
要理解这项突破,我们必须先进入分子的量子世界。
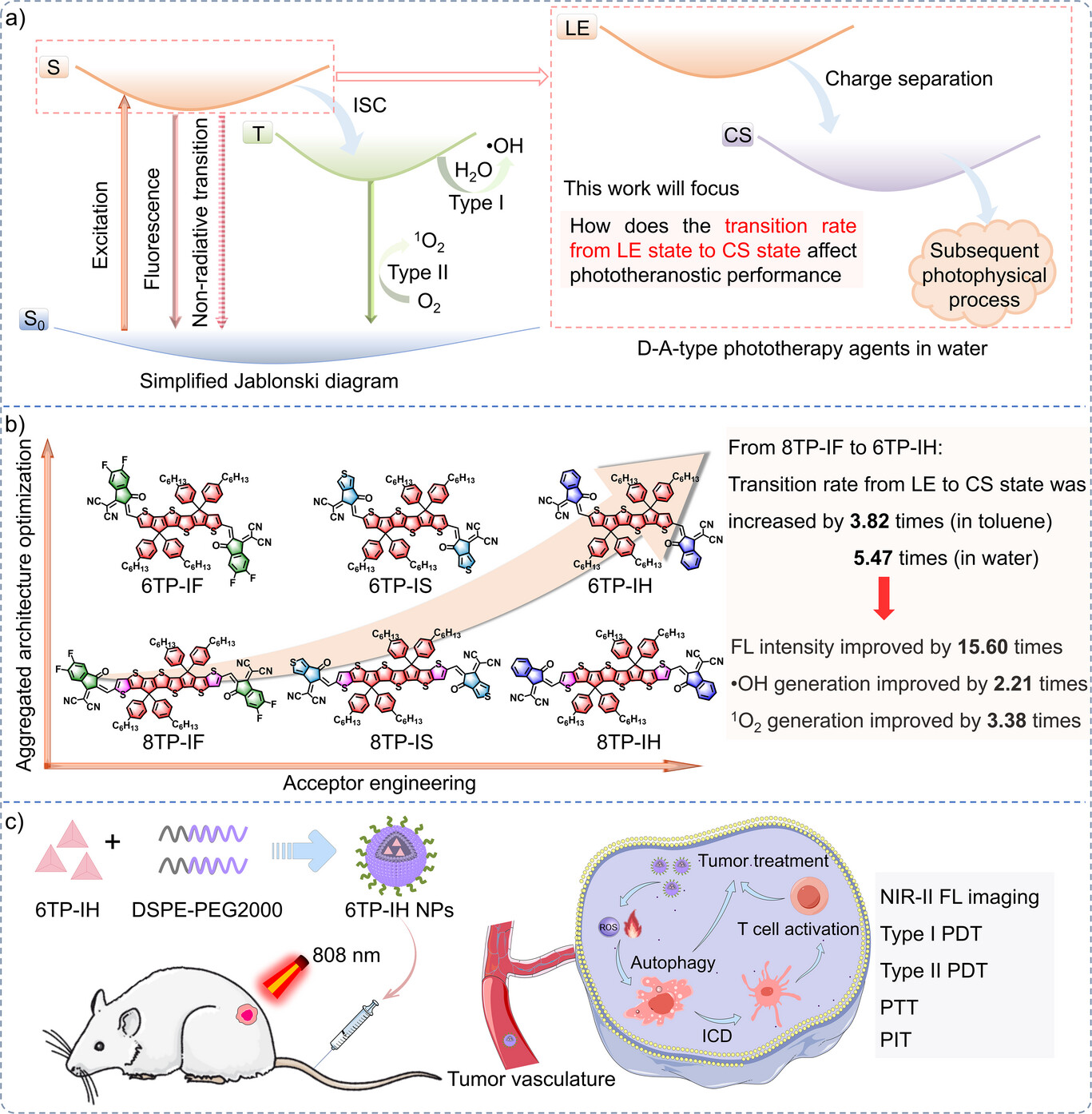
想象一下光敏剂分子像一座小型核电站。当它被光(NIR光)击中时,电子会被激发,从基态(S₀) 跃迁到局域激发态(LE state)。这个LE态就是最初的能量源头。
对于D-A型(给体-受体型)光敏剂(这是目前NIR吸收剂的主流结构),LE态的能量接下来会经历一个关键的转变:电子会从给体(D)移动到受体(A),形成一个正负电荷分离的中间状态,我们称之为电荷分离态(CS state)。
CS态就像是LE态通往最终“战斗” 的关键分岔路口。只有高效、快速地形成CS态,分子才能接着进行后续的光物理过程:
发出荧光: 实现精准的成像引导。
产生单线态氧(¹O₂): 强力杀伤癌细胞的Type-II PDT。
产生羟基自由基(·OH): 同样能有效杀伤癌细胞的Type-I PDT。
产生热量: 进行PTT。
过去的研究大多侧重于调节分子从三线态(T) 到产生活性氧的效率(即系间窜越,ISC),但往往忽略了更前一步:LE态到CS态的转变效率。
⚙️ 核心创新:两步走的“速度与激情”策略
该团队的核心创新,正是提出了 “加速电荷分离态形成” 这一策略,并通过两步精妙的分子工程来实现:
1. 受体工程:优化“电荷高速公路”
研究人员首先从一个有前景的起始分子8TP-IF开始,对其分子末端的受体结构进行了精细调控,逐步优化到了8TP-IH。
他们通过飞秒瞬态吸收光谱(fs-TAS) 这一“超高速摄像机”技术,精确捕捉了LE态到CS态的转变速度。结果显示,通过受体优化,在水溶液中,8TP-IH的转变速率达到了,比最初的8TP-IF()提高了近1.2倍 。
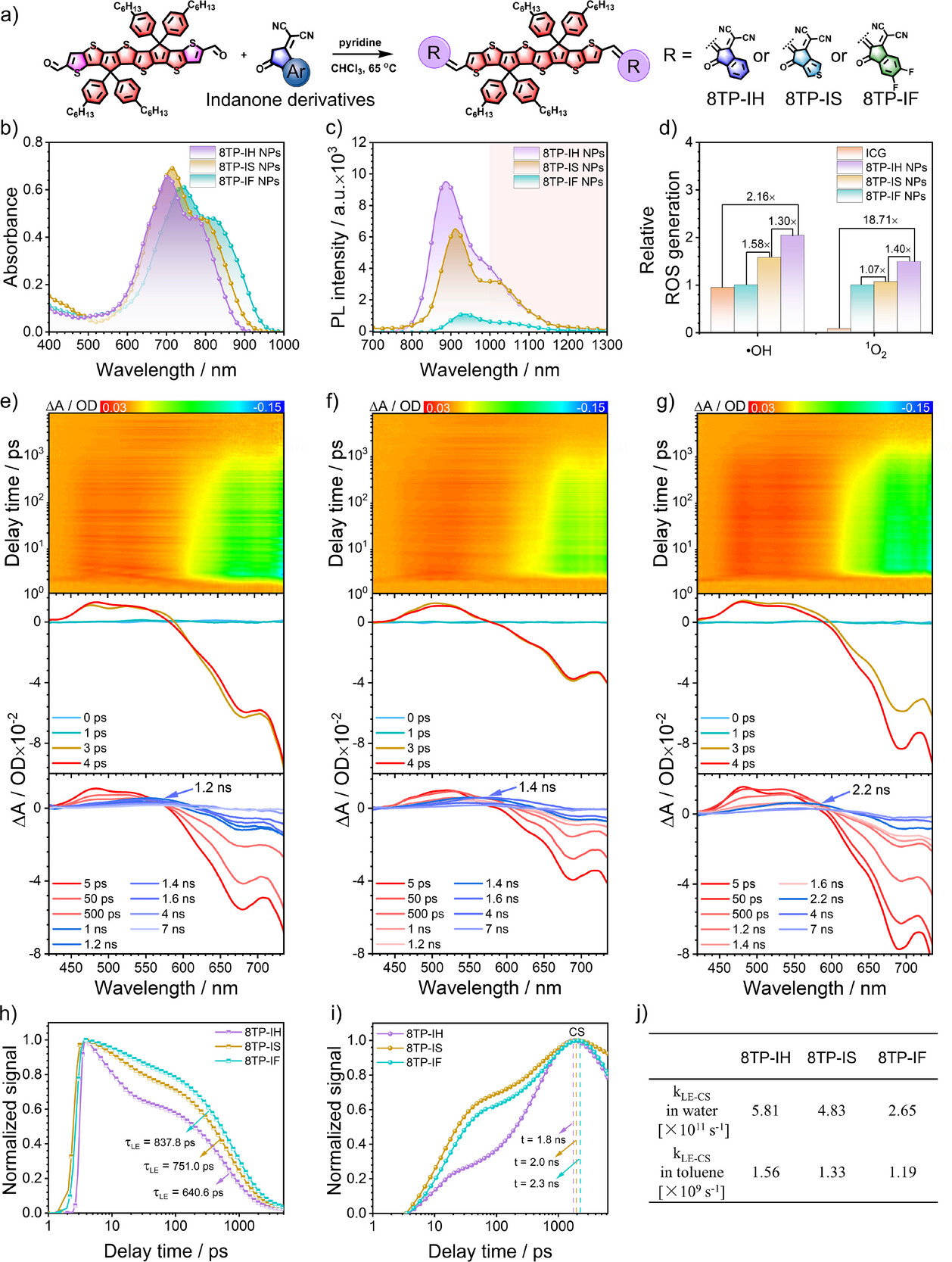
这个速度的提升直接带来了性能的提升:8TP-IH的荧光强度提高了8.8倍,¹O₂和·OH的生成效率也分别提高了1.50倍和2.05倍。这证明了,加速形成CS态是同时增强荧光和活性氧生成的关键因素。
2. 聚集结构优化:打造“松弛”的分子堆叠
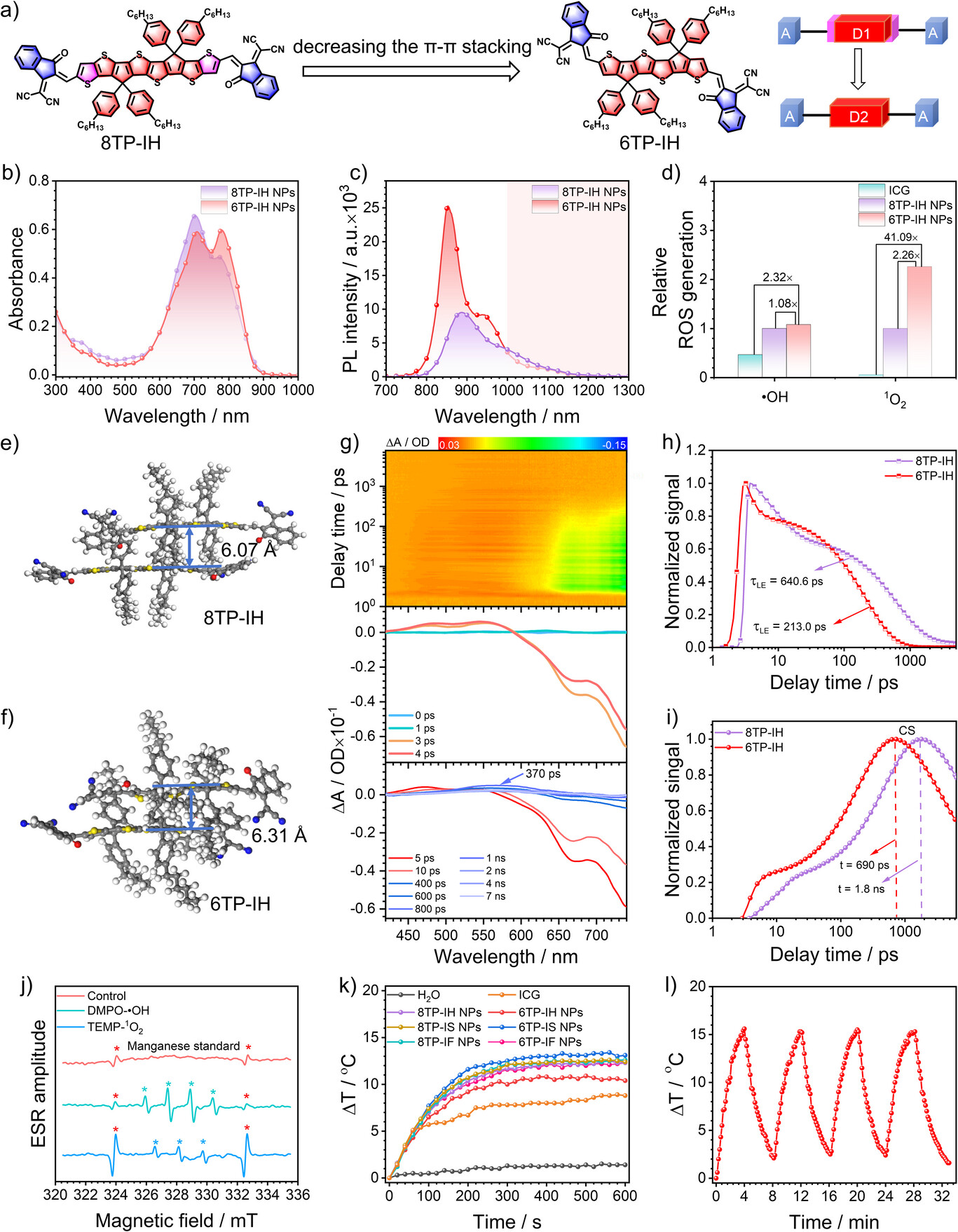
在第一步的基础上,研究人员发现,分子之间紧密的 -堆叠会阻碍电子的流动和电荷转移,就像高速公路太过拥挤。
于是,他们进行了第二步优化:将分子骨架中稠环的数量从8个减少到6个,得到了最终的分子6TP-IH 。
通过分子动力学模拟证明,减少稠环数量成功实现了 “松弛”的分子堆叠,使得分子间的 -堆叠距离从6.07 增大到了6.31 。这种松弛的结构更有利于与水分子相互作用,进一步促进了电荷转移。
这一优化再次大幅提升了速度:6TP-IH在水溶液中的LE到CS转变速率被极速加速到 。
最终的性能对比是惊人的: 从最初的8TP-IF到最终的6TP-IH,LE到CS态的转变速率在水溶液中被提高了约5.47倍( vs )。
三、数据背后的创新与颠覆性分析:超高效率的“全能”药剂
这项研究最引人注目的地方,在于它实现了光诊疗剂性能的**“鱼与熊掌兼得”:在一个分子中同时大幅增强了荧光成像、Type-I PDT、Type-II PDT和PTT**这四项核心功能。
🌟 性能大飞跃:碾压级优势
为了体现6TP-IH的优势,研究人员选择了经典的近红外光疗剂ICG(吲哚菁绿) 以及他们自己的起始分子8TP-IF作为对照。
| 核心性能指标 | 6TP-IH NPs相对于8TP-IF NPs的提升倍数 | 6TP-IH NPs相对于ICG的提升倍数(细胞实验) | 关键数据来源 |
|---|---|---|---|
| NIR-II荧光强度 | 15.6倍 | N/A | 149, 1164 |
| 羟基自由基(·OH)生成效率 | 2.21倍 | 2.32倍 | 150, 420 |
| 单线态氧(¹O₂)生成效率 | 3.38倍 | 41.09倍 | 150, 420 |
| PTT光热转换效率 | N/A (保持高值) | N/A | 595, 1165 |
| 肿瘤抑制率(In Vivo) | 远超(99.1% vs 16.8%) | 远超 | 1010, 1013 |
| IC50 (癌细胞半数抑制浓度) | 1.58倍 ( vs ) | 7.9倍 ( vs ) | 611 |
特别是与ICG的对比,ICG是临床上常用的光疗剂,但6TP-IH NPs在细胞内¹O₂生成效率上达到了ICG的41.09倍,在 ·OH生成效率上也达到了ICG的2.32倍 。这显示了6TP-IH在活性氧生成方面的碾压级优势。
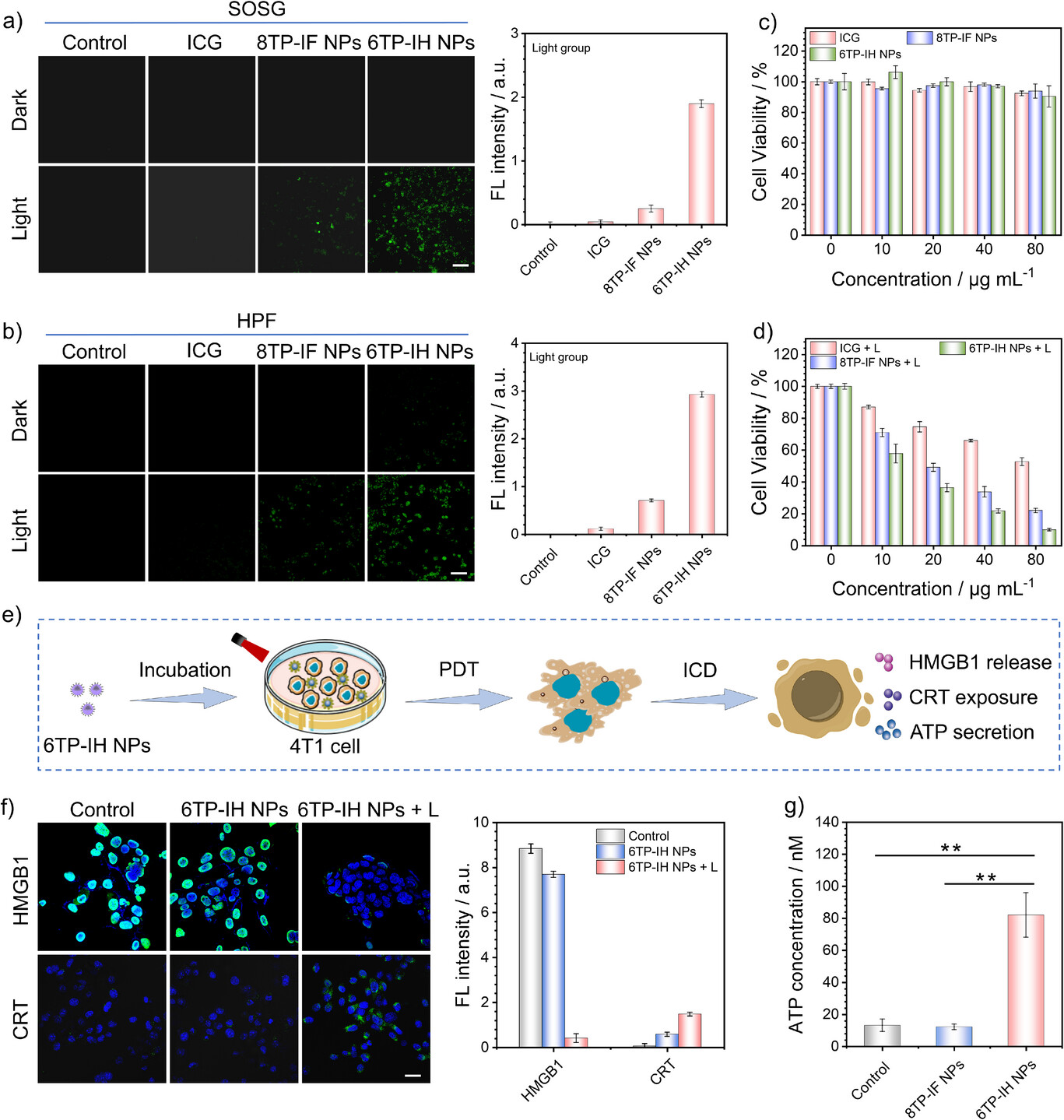
🛡️ 协同作战:激活抗癌免疫力
6TP-IH的价值不仅在于直接杀伤癌细胞,更在于它能**“唤醒”人体的免疫系统**。
研究团队证实,6TP-IH NPs介导的光疗能够成功诱导癌细胞发生免疫原性细胞死亡(ICD)。ICD的标志是释放HMGB1、暴露CRT和分泌ATP等“吃掉我”信号。通过6TP-IH NPs和激光照射,4T1细胞内的ATP浓度显著增加了6倍以上 。
这种免疫激活在活体实验中得到了清晰体现:
T细胞大军出动: 在“6TP-IH NPs + L”治疗组中,细胞毒性T淋巴细胞( cells)的比例比对照组高出1.93倍 。这些是直接杀伤癌细胞的“主力军”。
抑制免疫逃逸: 治疗显著减少了调节性T细胞(Tregs) 和M2巨噬细胞的浸润,Tregs从对照组的51.2%降低到12.8% 。这有效抑制了肿瘤的免疫逃逸机制。
炎症因子激增: 血清中TNF- 和IFN- 等抗肿瘤细胞因子水平显著升高。
简而言之,6TP-IH的作用机理是:“加速的CS态” → “超高效率的PDT/PTT” → “直接消灭大量癌细胞” → “诱导ICD,激活免疫系统” → “免疫系统协同作战” → “实现高效、彻底的肿瘤清除”。
📈 临床价值:NIR-II成像引导与超高抑制率
在4T1肿瘤模型小鼠实验中,6TP-IH NPs被证明可以高效地在肿瘤部位富集,并通过NIR-II荧光成像进行精准导航。
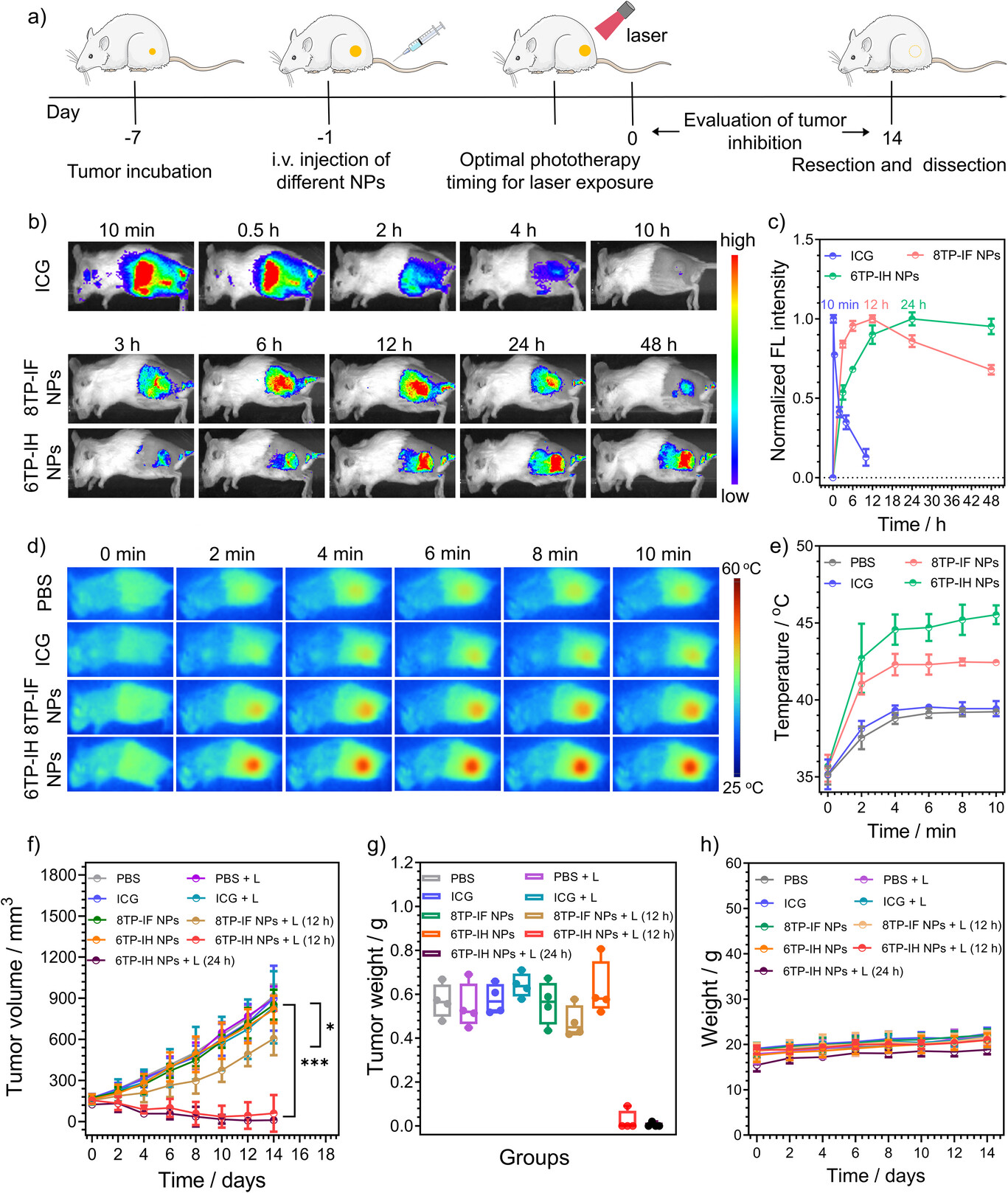
最终的治疗结果令人振奋:在仅接受了5分钟808 nm激光照射(功率密度330 mW ,低于安全标准)后,“6TP-IH NPs + L”组实现了高达99.1%的肿瘤抑制率。作为对比,在同样的治疗时间点,8TP-IF NPs的抑制率仅为16.8% 。这证实了“加速CS态形成”策略对体外和体内疗效的巨大提升。
更重要的是,小鼠在14天的治疗期内,体重保持稳定增长,主要器官无明显损伤,血液生化指标正常,证明了6TP-IH NPs具有良好的生物安全性和低毒性。
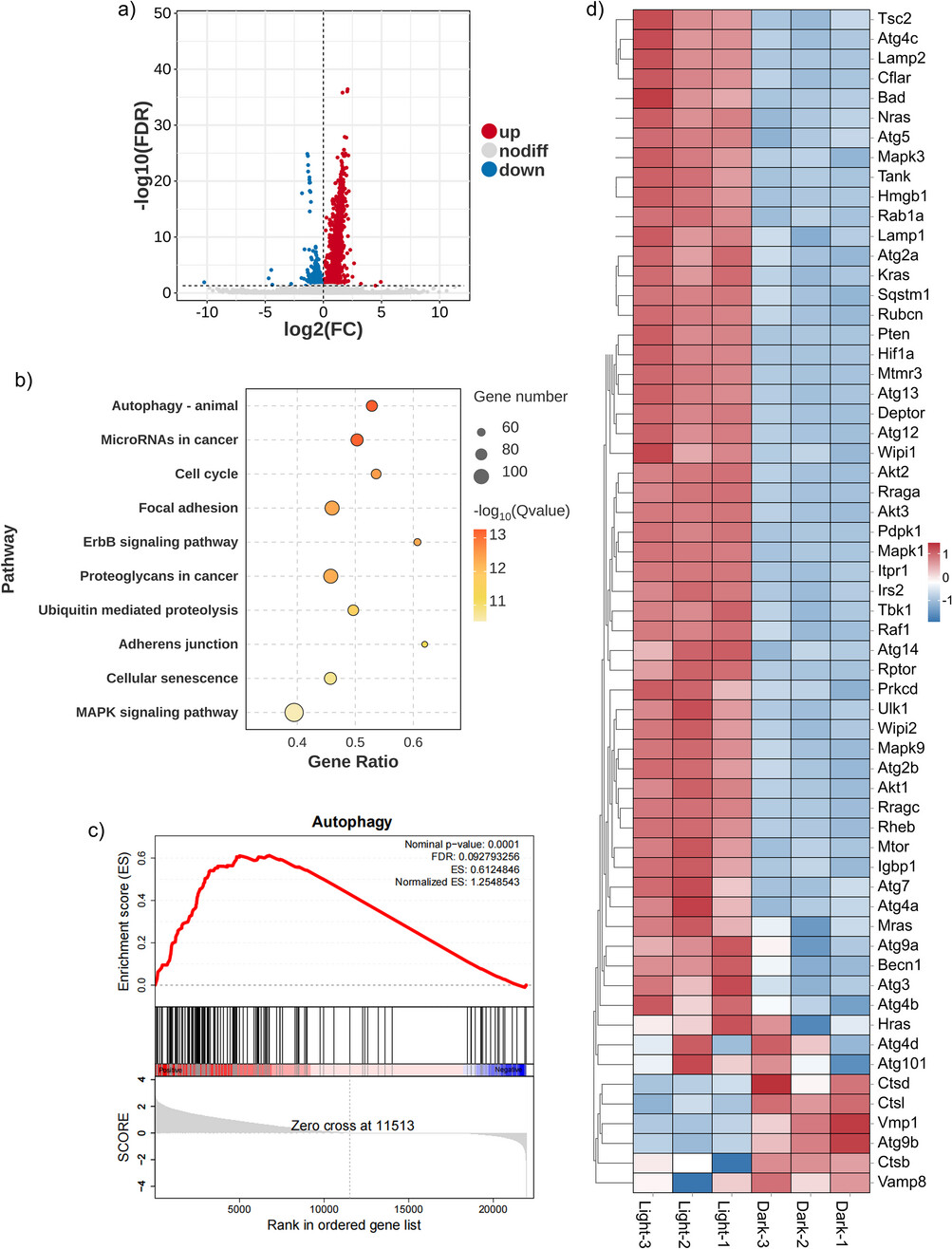
四、应用展望、局限性与未来路线图
这项研究成功地通过优化分子的初级光物理过程(LE到CS态的转变),找到了同时提升光诊疗剂成像和治疗性能的通用策略,为未来高性能NIR光诊疗剂的设计指明了方向。
🚀 应用展望
精准医学导向的光疗: 6TP-IH NPs的高亮度NIR-II成像能力,可以实现对肿瘤的实时、高分辨率可视化,确保激光照射的精确性,将光疗的精准度提升到新高度。
PDT/PTT-免疫协同疗法: 这种强大的协同效应,意味着它可以用于对抗那些对单一疗法产生耐药性或免疫抑制的复杂肿瘤,尤其适用于原位免疫激活的治疗方案。
🚧 局限性与未来路线图
虽然研究成果令人瞩目,但作为一项基础科研突破,仍存在一些局限性:
人体试验与长期毒性: 目前的研究是在小鼠模型上完成的,6TP-IH NPs在人体内的代谢、长期安全性和免疫反应还需要更深入的临床前研究,特别是其生物体内的降解途径和最终产物是否安全。
PTT与PDT的精细平衡: 尽管新策略在增强荧光和活性氧方面效果显著,但理论上,这两个过程的增强会“抢占”部分用于产热的能量。虽然实验中光热效果的降低非常有限(仅降低),但在更复杂的生理环境中,如何根据不同肿瘤类型对PTT和PDT的需求,进一步精细调控三者之间的能量分配,是未来的重要研究方向。
规模化生产与稳定性: 复杂的有机分子合成往往意味着高成本和困难的规模化生产。未来需要探索更简便、高产率的合成方法,并进一步优化纳米粒子的批次稳定性,以推动其走向临床应用。
这项研究不仅提供了一种全新的、高效率的光诊疗剂6TP-IH,更重要的是,它揭示了 “电荷分离态形成速率” 这一被长期忽视的分子光物理过程,在设计下一代NIR光诊疗剂中的核心指导作用。它为我们打开了一扇通往更高效、更安全、更智能的癌症联合治疗的大门。