【Angew.Chem.】双通道荧光 “探针”:给膜活性肽做 “功能 CT”,1 次实验辨清 2 种核心机制
✨文章标题:Dual-Channel Fluorescence Assays with Supramolecular Host-Dye Reporter Pairs for Membrane Activity Mapping of Peptides ✉️作者:Prof. Dr. Werner M. Nau, Prof. Dr. Andreas Hennig 等 🔗链接:https://doi.org/10.1002/anie.202517709
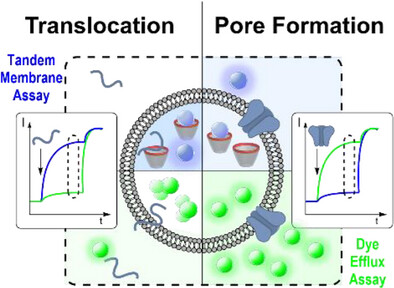
在抗生素耐药性日益严峻、药物递送技术亟待突破的今天,膜活性肽(MAPs)被寄予厚望 —— 它们既能像 “细胞快递员” 一样递送药物,又能像 “抗菌战士” 一样破坏病菌细胞膜。但长期以来,科学家们一直被一个难题困扰:如何快速区分一种膜活性肽是擅长 “悄悄穿越” 细胞膜,还是会 “暴力打孔” 破坏膜结构?
德国奥斯纳布吕克大学与 Constructor 大学的联合团队给出了答案。他们开发的双通道荧光检测技术,首次实现了在同一实验中同步观测膜活性肽的两种核心行为,让原本需要多次实验才能完成的机制分析,一次就能搞定。这项发表在《德国应用化学》(Angewandte Chemie International Edition)的研究,为肽类药物研发提供了 “加速神器”,也让我们对这些微观世界的 “膜上行者” 有了更清晰的认知。
一、先搞懂:为什么膜活性肽的 “行为鉴定” 这么重要?
要理解这项研究的价值,得先明白膜活性肽到底在做什么。我们可以把细胞想象成一个 “密封的快递盒”,细胞膜就是包裹盒子的 “塑料膜”—— 它的核心作用是隔绝内外环境,只允许特定物质进出。
而膜活性肽,就是能和这层 “塑料膜” 互动的特殊分子,主要分为两大派:一派是细胞穿透肽(CPPs),相当于 “高明的小偷”,能悄悄穿过细胞膜,把药物等 “赃物” 带进去,却不破坏膜的完整性;另一派是抗菌肽(AMPs),相当于 “暴力劫匪”,会在细胞膜上打洞,让细胞内部物质外泄而死亡,这也是它们对抗耐药菌的核心原理。
还有一种特殊的 “静默穿透肽(SMTPs)”,更是 “隐形小偷”,能神不知鬼不觉地穿越细胞膜,传统检测方法根本捕捉不到它们的踪迹。
问题的关键在于,这些肽的行为并不是非黑即白的,而是处于一个 “机制连续体” 中 —— 有的肽主要靠穿越发挥作用,偶尔会打个小孔;有的肽以打孔为主,却也能少量穿越。如果无法精准区分它们的核心行为,药物研发就会像 “盲人摸象”:想开发递送药物的 “快递员”,却不小心选了会破坏细胞的 “劫匪”;想找对抗病菌的 “战士”,却挑了只会悄悄溜进去的 “小偷”。
传统检测方法的短板更让这个问题雪上加霜。常用的 “染料渗漏法”,就像在 “快递盒” 里装了个警报器 —— 只有膜被打洞,染料漏出来,警报才会响。但它完全检测不到 “悄悄穿越” 的肽,因为这些肽不会触发染料渗漏。而后来出现的 “超分子串联膜检测法”,虽然能捕捉到穿越行为,却没法判断肽是否同时在打孔。
科学家们迫切需要一种 “一站式检测工具”,能同时看清膜活性肽的两种行为 —— 这正是双通道荧光检测技术要解决的核心痛点。
二、核心突破:两个 “荧光探针” 联手,一次实验看全两种行为
这个新方法的巧妙之处,在于把两种传统检测技术 “拧成一股绳”,在同一个样本中同步观测,既保留了各自的优势,又弥补了彼此的短板。我们可以把这个实验装置想象成一个 “双摄像头监控系统”,两个摄像头各有分工,共同记录膜活性肽的完整行为。
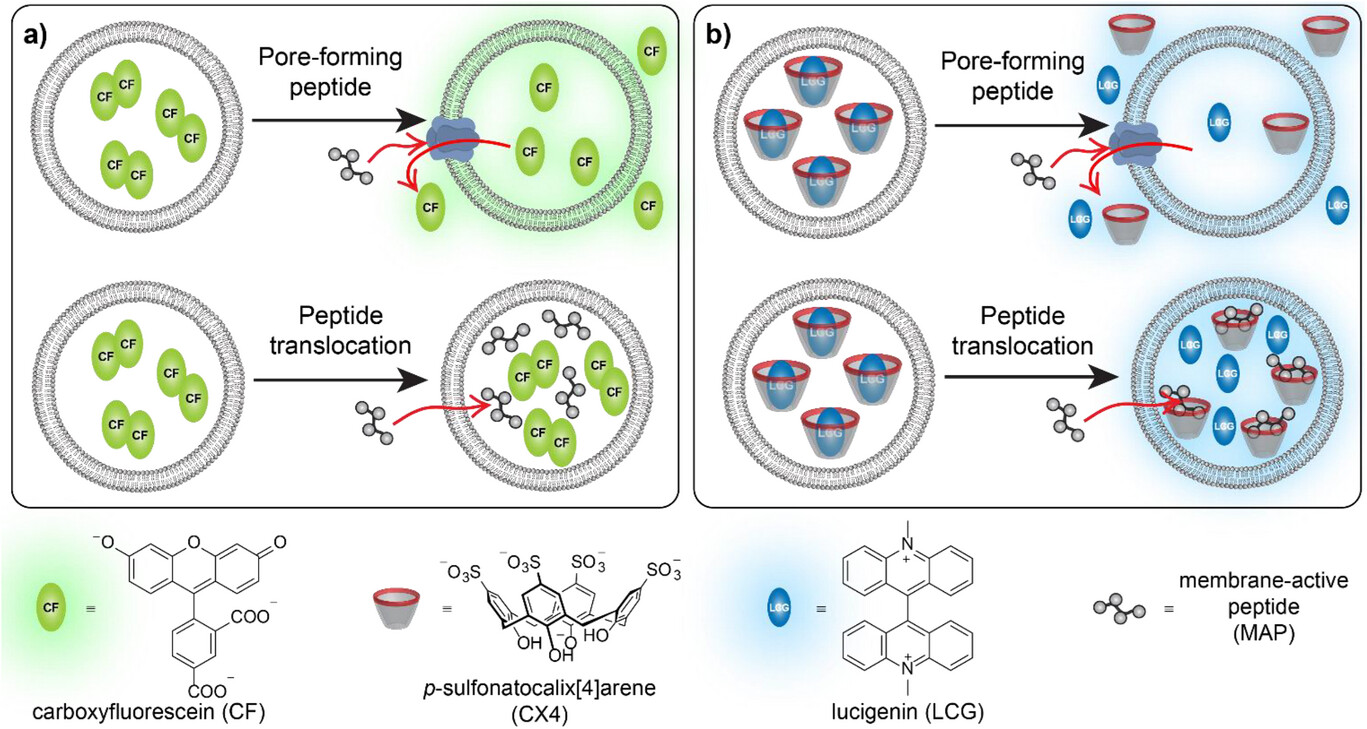
3.1 第一个摄像头:传统染料渗漏法(CF 通道)—— 监控 “膜是否被打孔”
这个通道的核心原理很简单,就像在 “快递盒” 里装满了 “荧光小球”(羧基荧光素 CF)。当 “小球” 装得足够满时,它们会相互挤压,荧光就会被 “熄灭”;如果膜被打洞,“小球” 会漏到外面,分散开来,荧光就会重新亮起。
这个通道的作用很明确:专门检测膜是否被破坏、是否形成了足够大的孔。只要荧光变强,就说明肽在细胞膜上打了孔,而且孔的大小足以让 CF 染料漏出来。它的优势是操作简单、信号直观,是检测 “打孔型” 肽的黄金标准。
3.2 第二个摄像头:超分子串联膜检测法(CX4/LCG 通道)—— 捕捉 “肽是否穿越”
这个通道的设计更精巧,相当于在 “快递盒” 里放了一个 “荧光开关”。这个开关由两部分组成:一个叫 “杯芳烃(CX4)” 的 “分子杯子”,和一个叫 “光泽精(LCG)” 的 “荧光小球”。平时 “小球” 会乖乖坐在 “杯子” 里,此时荧光会被抑制;当有肽穿越细胞膜进入 “快递盒”,肽会和 “杯子” 结合,把 “小球” 挤出去,荧光就会瞬间亮起。
这个通道的核心价值是:专门捕捉 “悄悄穿越” 的肽,哪怕它们没有在膜上打孔,只要成功进入细胞内部,就会触发荧光信号。对于那些 “静默穿透肽” 来说,这是首个能清晰捕捉它们踪迹的检测方法。
3.3 关键创新:让两个 “摄像头” 同步工作
要让两个检测系统在同一个样本中和谐共存,可不是简单把试剂混在一起就行。研究团队解决了两个核心难题:
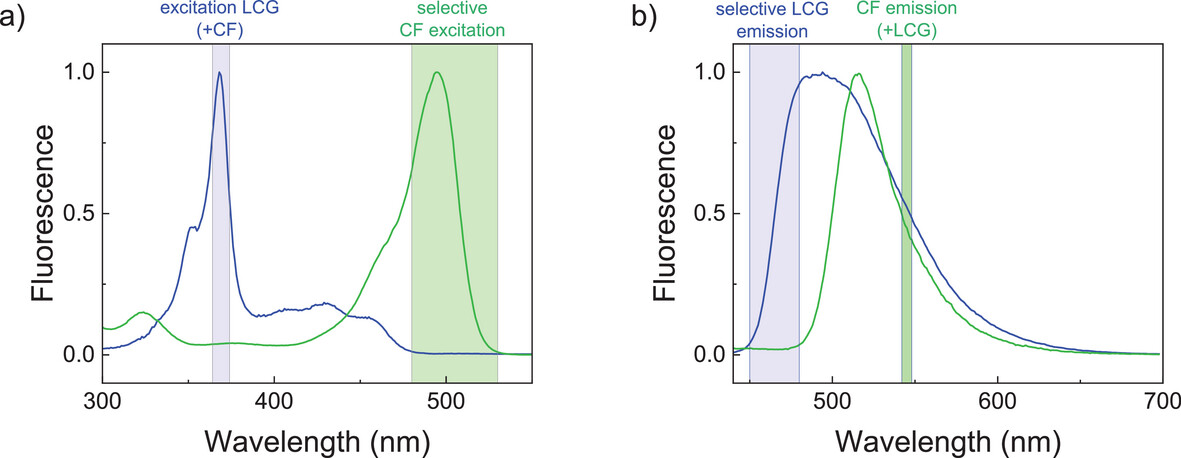
首先是渗透压匹配。CF 染料在 “快递盒” 内浓度很高,需要在外部加入电解质维持渗透压,否则 “盒子” 会破裂;但 CX4/LCG 系统里的 LCG 荧光会被电解质中的氯离子 quenching。团队最终找到了解决方案 —— 用葡萄糖代替氯化钠作为渗透压调节剂,既保证了 “快递盒” 的稳定,又不影响两个通道的荧光信号。
其次是光谱分离。CF 和 LCG 的荧光光谱有重叠,直接检测会相互干扰。团队通过精准调节激发和发射波长,让两个通道 “井水不犯河水”:CF 通道用 525nm 激发、545nm 检测,LCG 通道用 369nm 激发、475nm 检测,彻底消除了信号串扰。
经过优化后,这个双通道系统实现了 “一次实验,双重检测”:既能通过 CF 通道判断肽是否打孔,又能通过 CX4/LCG 通道判断肽是否穿越,两种行为的检测结果可以直接对比,无需额外控制变量。
三、数据说话:5 类经典肽的 “行为鉴定”,颠覆传统认知
为了验证这个新方法的可靠性,研究团队测试了 8 种经典的膜活性肽,涵盖了打孔肽、细胞穿透肽、静默穿透肽三大类。实验结果不仅证实了方法的有效性,还揭示了一些此前被忽略的肽类行为细节。
4.1 细胞穿透肽:穿越能力远超打孔能力
对于 penetratin、Pep-1 这些经典的细胞穿透肽,实验结果呈现出一致的趋势:CX4/LCG 通道的荧光信号显著高于 CF 通道(统计分析 p<0.001,意味着差异具有极高的可信度)。
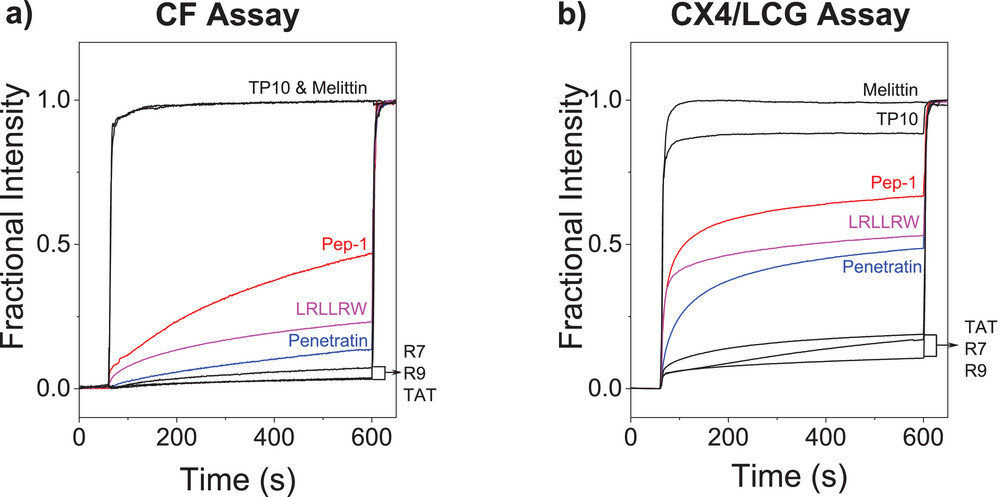
以 penetratin 为例,在 15μM 浓度下,它在 CX4/LCG 通道的膜活性值达到 0.6 以上,而在 CF 通道仅为 0.2 左右。这说明这些肽的核心能力是 “穿越细胞膜”,而不是 “打孔”—— 它们能高效进入细胞内部,却不会对细胞膜造成明显破坏,这也正是细胞穿透肽作为药物递送载体的理想特性。
更有意思的是寡精氨酸肽(R7、R9)和 TAT 肽,它们在 CF 通道几乎没有明显信号,说明它们几乎不会在细胞膜上形成足以让 CF 染料渗漏的孔,但在 CX4/LCG 通道却有清晰的信号。这印证了科学家们的猜想:这些肽是通过 “不破坏膜结构” 的方式穿越细胞,而不是传统认为的 “形成小孔”。
4.2 打孔肽:打孔能力强,穿越信号弱
作为对比,打孔肽的实验结果完全相反。蜂毒肽(melittin)是经典的打孔肽,能在细胞膜上形成无序的环形孔道。实验显示,它在 CF 通道的荧光信号极强,而在 CX4/LCG 通道的信号却很弱。
这背后的原因很简单:蜂毒肽在膜上打的孔虽然能让小分子 CF 染料漏出,但孔的大小不足以让 CX4/LCG 这个 “分子开关”(分子量超过 500Da)漏出,也无法让足够多的肽穿越进入细胞内部。这种 “打孔强、穿越弱” 的特征,正是打孔肽的典型标志 —— 它们的核心作用是破坏膜结构,而不是进入细胞。
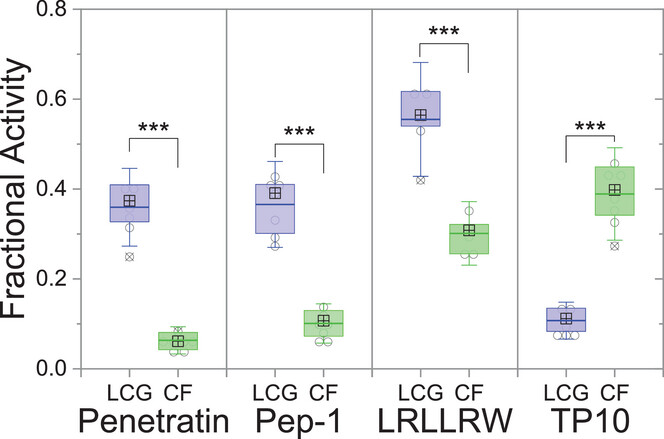
4.3 特殊案例:TP10 的 “双重人格”
TP10 是一个特殊的疏水细胞穿透肽,实验结果颠覆了传统认知。它在 CF 通道的荧光信号竟然高于 CX4/LCG 通道,这与其他细胞穿透肽截然不同。
进一步研究发现,TP10 的穿越机制确实与众不同 —— 它是通过 “形成瞬时小孔” 的方式穿越细胞膜。这些小孔足够大,能让 CF 染料漏出(所以 CF 通道信号强),但由于孔是暂时的,且尺寸有限,CX4/LCG 这个 “大分子开关” 无法漏出,肽的穿越效率也不如其他细胞穿透肽(所以 CX4/LCG 通道信号弱)。
这个发现也解释了为什么 TP10 既能作为药物递送载体,又会对部分细胞造成毒性 —— 它的 “穿越” 和 “打孔” 是同时发生的,只是打孔行为更为显著。
4.4 静默穿透肽:终于 “显形” 了
LRLLRW 是典型的静默穿透肽,此前用传统的 CF 染料渗漏法完全检测不到它的膜活性,因此被称为 “沉默的穿越者”。但在双通道检测中,它在 CX4/LCG 通道呈现出清晰的荧光信号,而 CF 通道信号几乎为零。
这正是双通道技术的核心优势之一:它能捕捉到传统方法无法检测的 “静默穿越” 行为。实验数据显示,LRLLRW 的穿越能力不亚于 Pep-1,但完全没有打孔活性,这让它成为潜在的、低毒性的药物递送载体 —— 此前因为检测技术的局限,这类优秀的候选分子可能被轻易忽略。
4.5 进阶功能:区分 “瞬时孔” 和 “稳定孔”
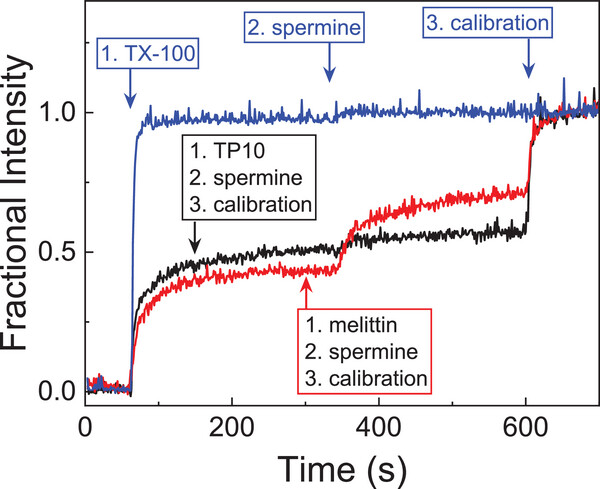
除了区分穿越和打孔,这个方法还能进一步判断孔的类型 —— 是暂时存在的 “瞬时孔”,还是长期开放的 “稳定孔”。
研究团队在肽与膜作用一段时间后,加入了 spermine(精胺)—— 一种能和 CX4 强力结合的小分子。如果是 TP10 形成的 “瞬时孔”,此时孔已经关闭,spermine 无法进入细胞内部,荧光信号不会变化;如果是蜂毒肽形成的 “稳定孔”,spermine 能通过孔进入细胞,与 CX4 结合并挤出 LCG,让荧光信号进一步增强。
实验结果完美验证了这一点:加入 spermine 后,TP10 组的荧光信号没有明显变化,而蜂毒肽组的信号显著上升。这一功能让检测从 “是否打孔” 升级到 “打什么样的孔”,为肽类机制研究提供了更精细的工具。
四、应用展望:从实验室到产业界,这个技术能改变什么?
双通道荧光检测技术的价值,不仅在于解决了基础研究的 “鉴定难题”,更在于它能加速肽类药物的研发进程,推动更多膜活性肽从实验室走向临床应用。
5.1 加速肽类药物筛选
在药物研发初期,科研人员需要从成千上万种肽中筛选出有潜力的候选分子。传统方法需要分别检测穿越能力和打孔活性,耗时耗力,且无法排除实验条件差异带来的误差。
双通道技术让筛选效率提升数倍 —— 一次实验就能同时获得两种核心性能数据,快速区分 “穿越型”“打孔型”“双重功能型” 肽,大大减少了后续验证实验的工作量。对于高 - throughput 筛选(HTS)来说,这种 “一站式检测” 能显著降低研发成本,缩短研发周期。
5.2 指导肽类分子设计
了解肽的核心行为机制后,科研人员可以有针对性地改造分子结构。比如想开发药物递送载体,就可以强化肽的穿越能力、削弱打孔活性;想开发新型抗生素,就可以优化肽的打孔效率,让其更精准地破坏病菌细胞膜。
研究中发现,Pep-1 在阴离子脂质存在时,穿越能力会增强,这一信息可以指导科研人员设计出更适合肿瘤细胞(细胞膜阴离子脂质含量更高)的递送载体。而 TP10 的 “瞬时孔” 机制,也为设计 “低毒性、高效率” 的穿透肽提供了新思路。
5.3 助力对抗抗生素耐药性
抗菌肽是对抗耐药菌的重要武器,但部分抗菌肽因为同时具有一定的细胞毒性,限制了其临床应用。双通道技术可以精准评估抗菌肽的 “打孔特异性”—— 只破坏病菌细胞膜,而不影响人体细胞。
通过筛选 “对病菌打孔强、对人体细胞打孔弱” 的肽类分子,能显著提升抗菌肽的临床安全性,推动更多新型抗生素的研发,缓解抗生素耐药性带来的医疗危机。
5.4 现存局限性与未来方向
当然,这项技术也并非完美。目前最大的短板是 CX4/LCG 系统与生物体内的离子强度不兼容 —— 生理环境中的氯离子会抑制 LCG 的荧光,限制了技术在活细胞实验中的直接应用。
未来,科研团队需要开发更稳定的宿主 - 染料复合物,让其能在生理条件下工作。此外,进一步提升检测的灵敏度,实现单分子水平的穿越和打孔行为观测,也是重要的发展方向。
五、结语:微观世界的 “行为记录仪”,开启肽类研究新范式
膜活性肽的研究之所以困难,核心在于我们难以在不干扰其行为的前提下,精准捕捉它们与细胞膜的互动细节。双通道荧光检测技术就像给这些微观分子装上了 “行为记录仪”,第一次让我们能同步、清晰地看到肽的 “穿越” 和 “打孔” 两种核心行为。
这项技术的突破,不仅是检测方法的革新,更在于它建立了一种新的研究范式 —— 从 “单独观测一种行为” 到 “同步解析多种机制”,从 “定性描述” 到 “定量对比”。它让我们对膜活性肽的认知更全面、更精准,也为肽类药物研发提供了更高效的工具。
随着技术的不断优化,未来我们或许能看到更多基于膜活性肽的新型药物:能精准递送抗癌药物的 “细胞快递员”、能攻克超级细菌的 “靶向抗生素”、能穿越血脑屏障的 “神经药物载体”…… 而这一切,都始于我们对微观世界分子行为的更深刻理解。
科学的进步往往源于 “看清” 原本看不清的东西,双通道荧光检测技术做到了这一点 —— 它让膜活性肽的神秘行为变得清晰可见,也为生物医药领域的创新打开了一扇新的大门。