【Angew.Chem.】穿透110微米深层组织的“光之手术刀”:三光子催化技术如何将二氧化碳转化率提升至治疗级?
✨文章标题:Near-Infrared-Activated Multiphoton Photocatalytic System for Synergistic Therapy via CO Generation and •OH Production ✉️作者:Xianshun Sun, Dandan Li, Hai-Long Jiang 等 🔗链接:https://doi.org/10.1002/anie.202524756
[!note]
1. 研究背景与核心痛点
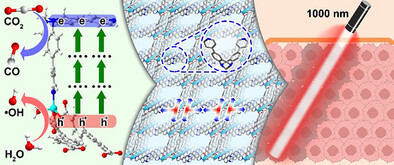
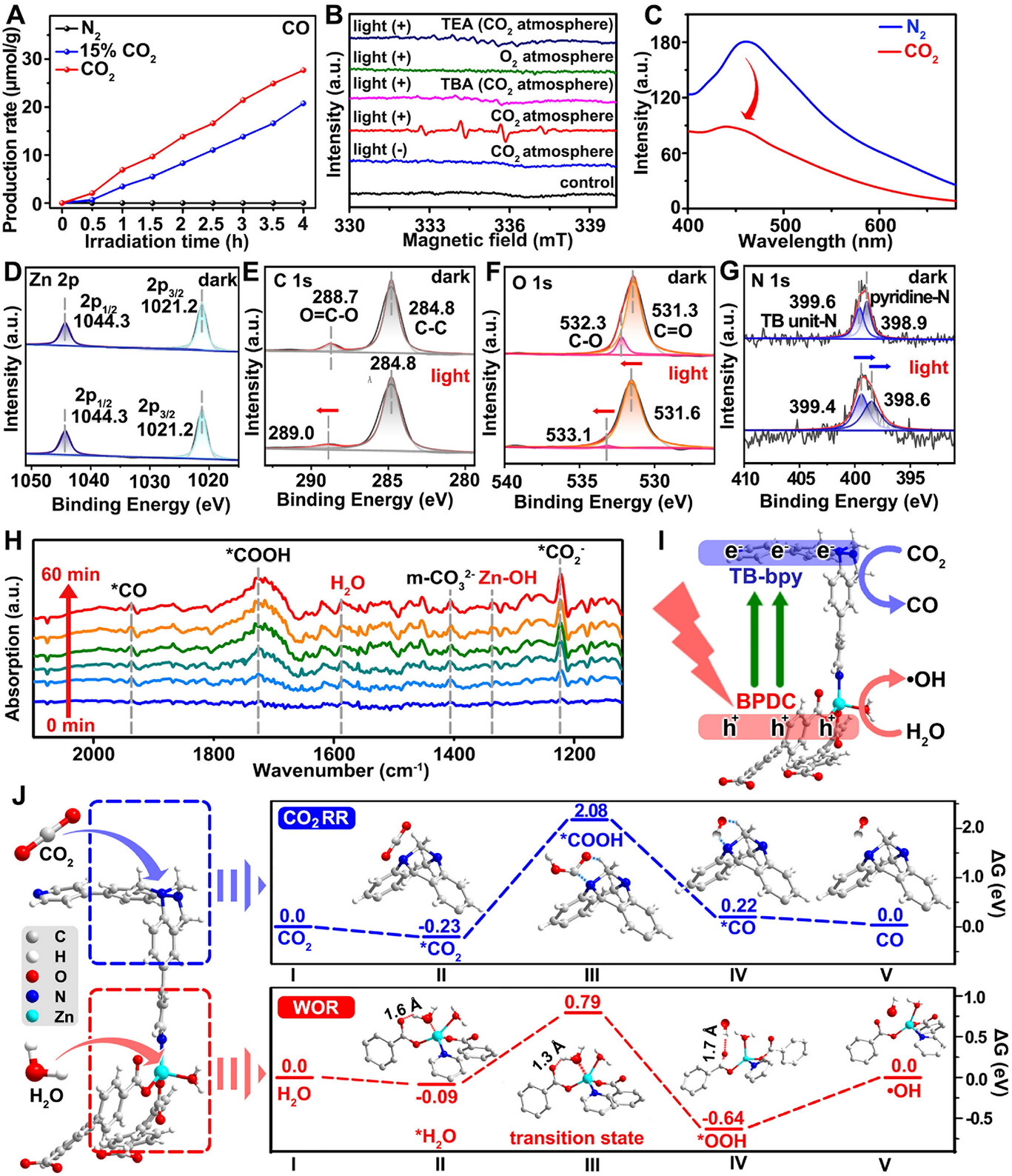
一氧化碳(CO)在生物医学中被证明具有强大的抗肿瘤潜力,它能通过干扰线粒体呼吸链、增加活性氧(ROS)水平和诱导细胞凋亡来杀死癌细胞。然而,现有的CO递送手段面临两大瓶颈:一是传统光催化技术依赖可见光,导致组织穿透深度有限,难以触及深层肿瘤;二是肿瘤内部二氧化碳()浓度虽然高于正常组织,但相对于工业催化而言仍属于“稀薄状态”,导致原位转化效率极低,往往需要额外补充外部气体。
2. 核心创新点:ZnTBH 金属有机框架
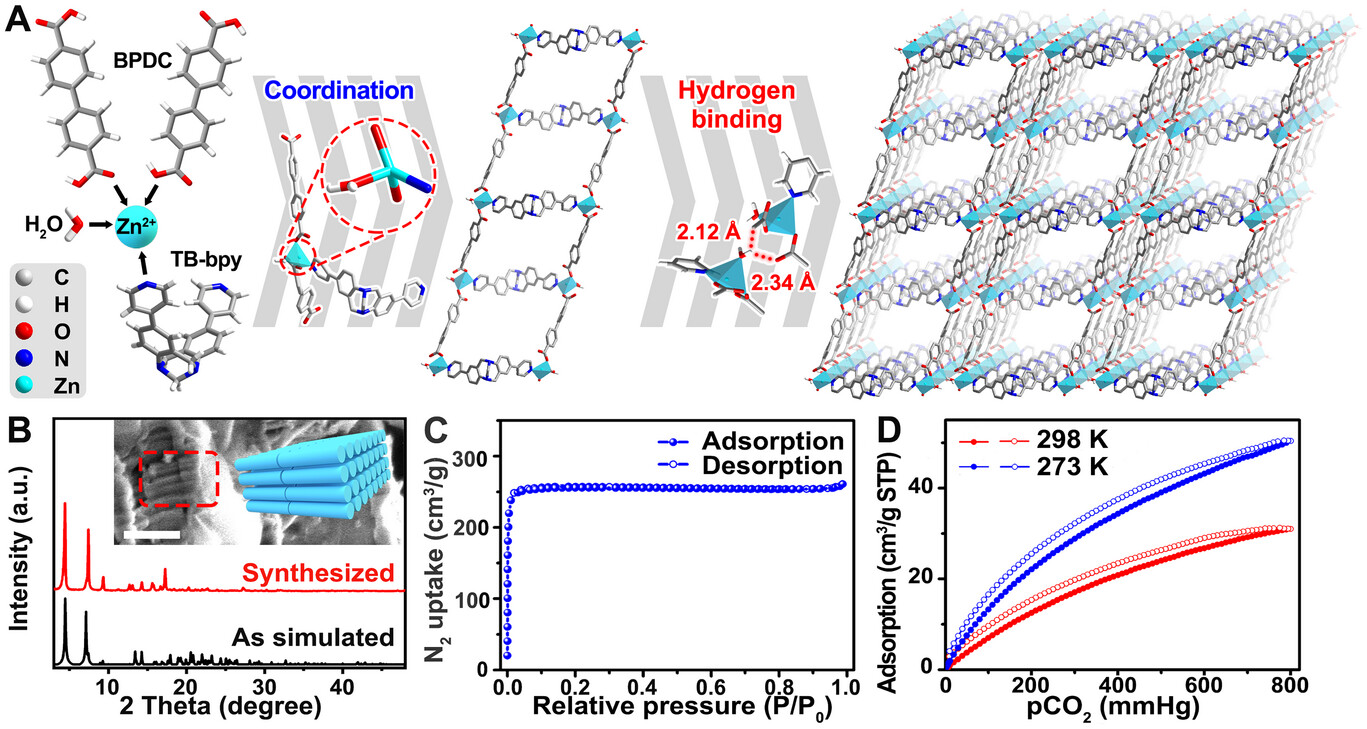
研究团队设计并合成了一种名为 ZnTBH 的新型锌基金属有机框架(MOF)。该材料具有三个核心设计维度:
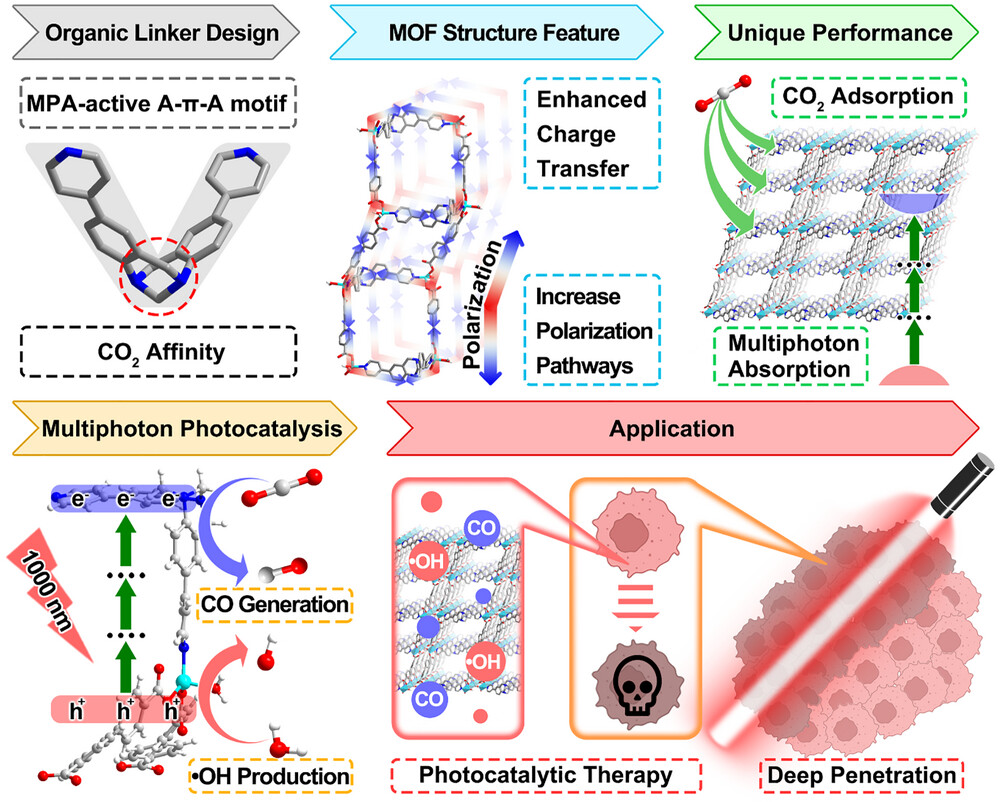
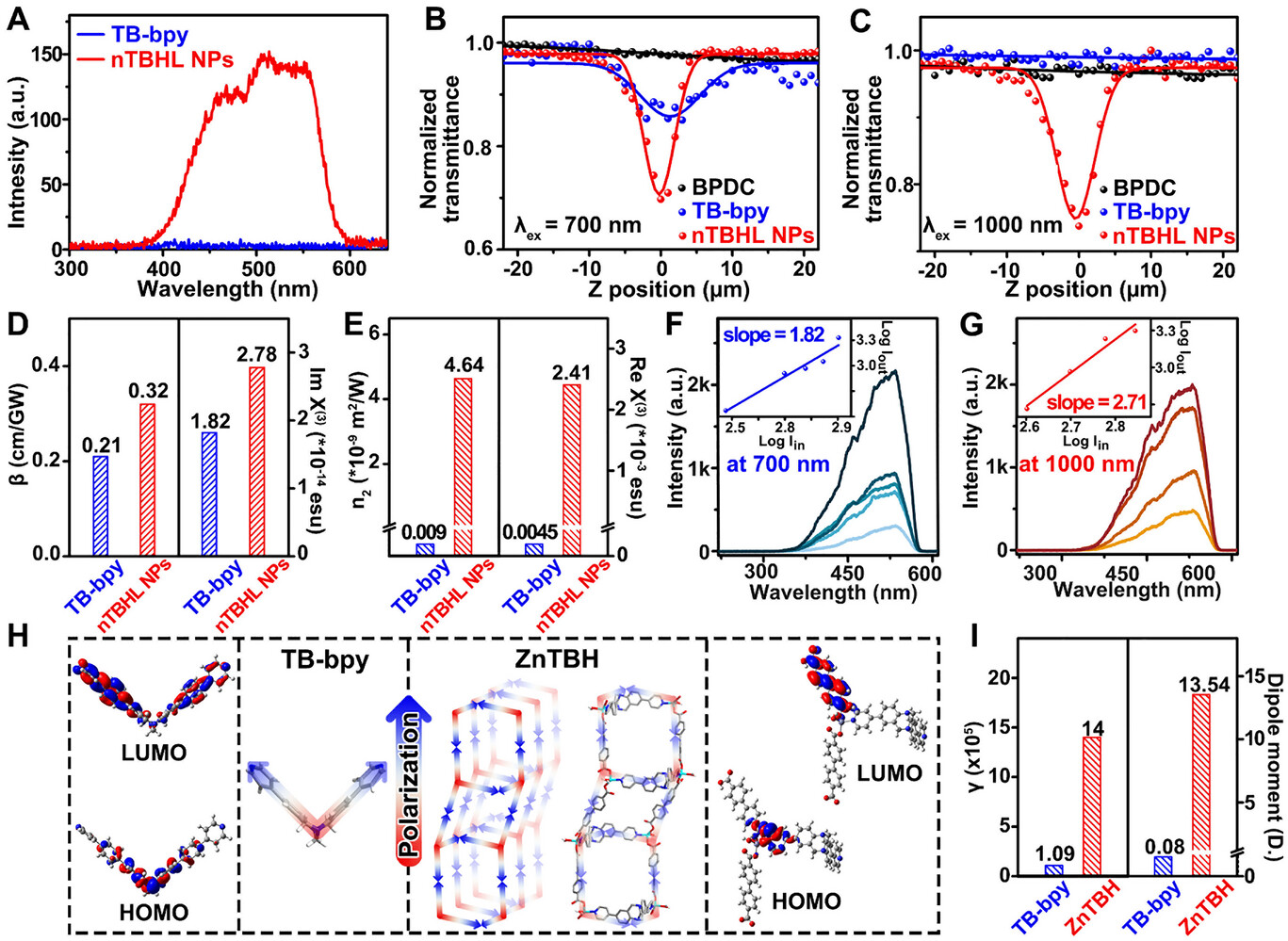
- 分子级设计: 引入了具有 V 型 A--A 构型的特罗格碱(Tröger's base, TB)衍生物作为有机配体。这种结构不仅赋予了材料极强的 亲和力,能像“磁铁”一样吸附肿瘤内微量的二氧化碳,还使其具备了卓越的多光子吸收(MPA)特性。
- 能量转化机制: 借助多光子催化技术,该系统可以使用 1000 nm 的近红外(NIR)光 激发。相比于传统光,这种长波长光具有极强的组织穿透力,能直达深层肿瘤。
- 双重协同治疗: 在光照射下,ZnTBH 能实现“一箭双雕”。其光生电子将吸附的 还原为 CO 气体 进行气疗;同时,光生空穴将水()氧化生成 羟基自由基(·OH) 进行光动力治疗(PDT)。
3. 主要实验数据与结果
- 催化性能: 在模拟肿瘤的低浓度 环境中(5%–15%),ZnTBH 展现出远超传统材料的 CO 产量。
- 穿透力测试: 实验证实,在 1000 nm 三光子激发下,该系统在组织 110 m 深度处的发光强度和治疗效果显著优于传统的单光子或双光子系统。
- 抗肿瘤效果: 在 H22 荷瘤小鼠模型中,通过静脉注射经脂质体修饰的纳米颗粒(nTBHL),在近红外光照射 14 天后,肿瘤生长受到显著抑制,且未表现出明显的系统性毒性。
4. 结论与意义
该研究成功构建了一个由近红外光驱动的多光子光催化平台,通过将内源性 转化为治疗性 CO 气体并同步产生毒性自由基,为深层肿瘤的精准、安全治疗开辟了新路径。
一、从“痛点”到“突破”:深层肿瘤治疗的“光影瓶颈”
在肿瘤治疗的战场上,光动力疗法(PDT)曾被寄予厚望,但它在面对深层肿瘤时却常常“望洋兴叹” 。最核心的瓶颈在于,传统的可见光在生物组织中的穿透深度极其有限,能量在抵达病灶前就已被皮肤和组织吸收殆尽 。与此同时,一氧化碳(CO) 作为一种新兴的信号分子,虽能通过干扰线粒体呼吸链精准诱导癌细胞凋亡,但如何实现安全、控速、局部的释放,一直是医学界的难题 。
传统的二氧化碳()转化技术在肿瘤环境中还面临着 “底物稀薄” 的尴尬——尽管肿瘤内的二氧化碳分压(约 80 mmHg)高于正常组织,但对于大多数光催化剂而言,这种浓度依然难以维持高效的催化反应 。近期,安徽大学与中国科学技术大学的研究团队在《Angewandte Chemie International Edition》上发表了颠覆性成果 。他们开发出一种名为 ZnTBH 的新型锌基金属有机框架(MOF),利用1000纳米近红外光(NIR)驱动的多光子催化技术,不仅让光线深入“敌营”,更巧妙地将肿瘤内的二氧化碳废气直接转化为杀伤利器 。
二、核心方法与技术细节:打造微观层面的“全能化工厂”
1. 分子级精准编织:特罗格碱(TB)的妙用
研究团队在构建这种 MOF 材料时,创新性地引入了具有 V型 A--A 构型的特罗格碱(Tröger's base)衍生物作为有机配体 。这种独特的空间结构赋予了材料极强的二氧化碳亲和力,它能像“化学磁铁”一样,在肿瘤这种二氧化碳相对稀薄的环境中,主动抓取并聚集底物分子,克服了气体扩散受限的难题 。
2. 多光子累积机制:让低能量光子“积少成多”
ZnTBH 最硬核的特性在于其多光子吸收(MPA)能力 。传统的单光子激发需要高能量的短波长光,而多光子机制允许材料同时捕获两到三个低能量的近红外光子 。通过这种能量累积,波长高达 1000 纳米的近红外光也能激活催化反应 。这种长波长光处于生物组织的“透明窗口”,散射更低,穿透力更强 。
3. 协同作战逻辑:电子与空穴的“空间分工”
在光照射下,ZnTBH 内部发生了精密的工作交接 :
- 电子还原路线:光生电子迅速迁移至特罗格碱单元,将吸附的二氧化碳还原为 CO 气体,诱导肿瘤细胞线粒体功能障碍 。
- 空穴氧化路线:光生空穴则在联苯二甲酸(BPDC)配体上聚集,驱动水分发生氧化反应,产生强氧化性的羟基自由基(·OH),实现同步的光动力攻击 。
- 空间分离优势:这种分工明确的电荷转移机制有效抑制了电子与空穴的复合,极大地提升了光能利用率 。
三、数据背后的创新与颠覆性:硬核指标刷新纪录
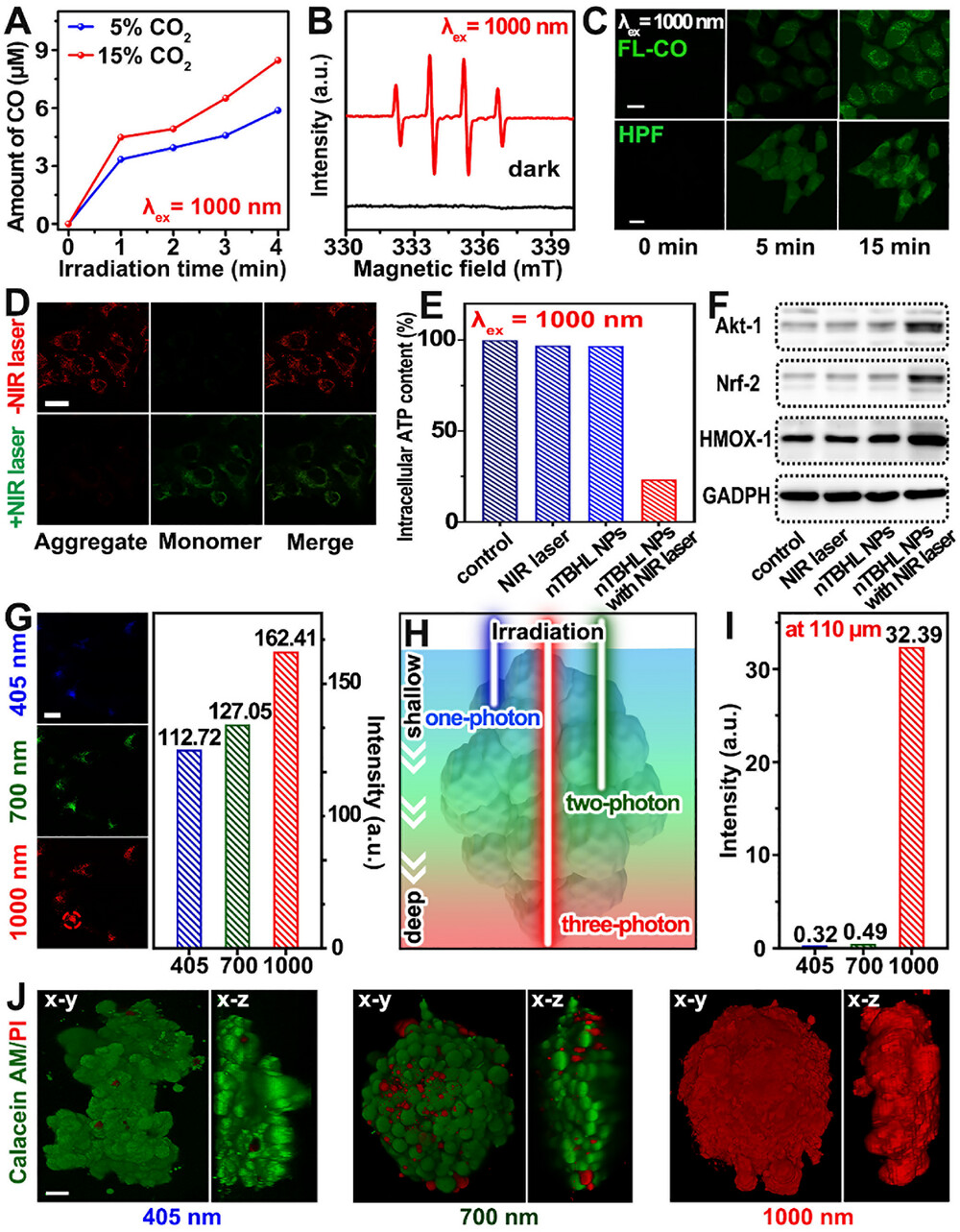
1. 稀薄环境下的“逆袭”转化率
在模拟肿瘤环境的 15% 甚至 5% 低浓度 下,ZnTBH 依然展现出惊人的活性 。实验数据显示,其一氧化碳产生速率不仅远超现有的可见光催化剂,更在 1000 纳米激发下达到了 0.101% 的表观量子产率 。这意味着该系统无需额外补充外部气体,即可实现“因地制宜”的高效治疗 。
2. 刷新深度记录的穿透力测试
研究团队通过组织切片实验对比了不同激发模式的极限深度 。在组织深度达到 110 微米处:
- 传统的 405 纳米单光子激发信号几乎消失,强度仅为 0.32 。
- 700 纳米双光子激发的信号也微乎其微,强度仅为 0.49 。
- 而 1000 纳米三光子激发下的 ZnTBH 依然保持着 32.39 的高强度荧光,性能提升了数十倍 。 这一数据有力地证明了该系统在深层病灶治疗中的绝对优势 。
3. 线粒体定向“爆破”的实证
在细胞层面,实验观察到受试细胞内的一氧化碳特异性荧光与羟基自由基荧光大幅增强 。通过生物电镜观察,治疗后的小鼠肿瘤细胞出现了显著的线粒体萎缩、膜破裂及脊消失现象 。与此同时,细胞内的 ATP(能量货币)水平骤降,彻底切断了癌细胞的能量供应,从根源上诱导其凋亡 。
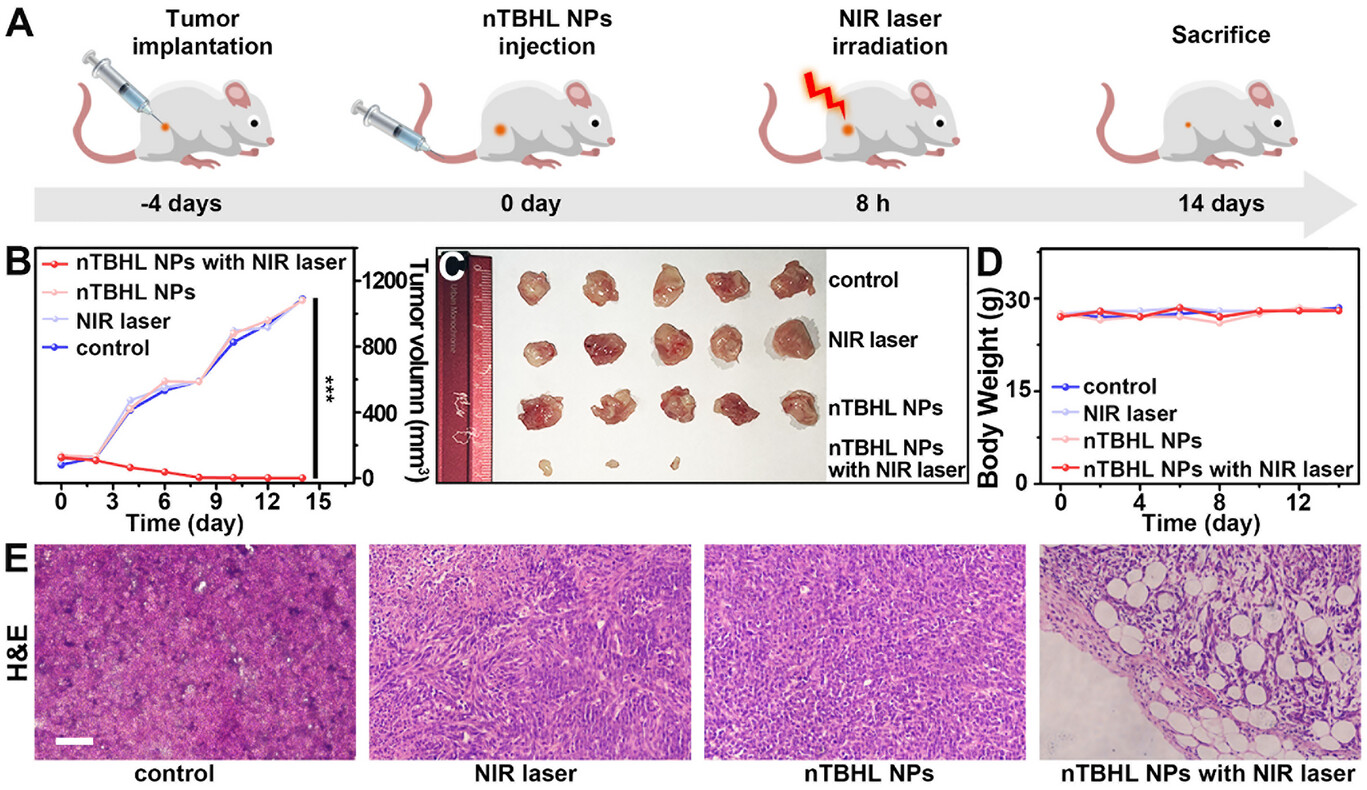
4. 荷瘤小鼠的完美答卷
在活体实验中,科研人员将材料封装入脂质体(nTBHL)进行静脉注射 。结果显示,纳米颗粒能精准聚集于肿瘤部位,在 14 天的治疗周期内,肿瘤体积生长被完全抑制,而对照组肿瘤则疯狂扩张 。最令人振奋的是,治疗组小鼠的体重及主要器官(心、肝、脾、肺、肾)均未表现出任何毒副作用,证明了该疗法的高生物安全性 。
四、应用展望、局限性与未来路线图:开启“精准气疗”新纪元
1. 多样化的临床应用前景
ZnTBH 系统的开发,标志着我们拥有了一种无需手术即可触及深层组织的“光之手术刀” 。未来,这种技术不仅可用于治疗深位实体瘤,还可能扩展到抗炎、血管扩张等需要受控释放一氧化碳的更广泛医疗领域 。
2. 行业挑战与客观局限
尽管实验室表现优异,但该系统迈向临床仍需跨越几座大山 。首先,多光子激发通常需要功率较高的超快脉冲激光器,设备成本和便携性是未来产业化的瓶颈之一 。其次,虽然短期安全性已获验证,但 MOF 材料在人体内的长期降解机制与代谢途径仍需更深入的研究 。
3. 未来路线图:从“高效”走向“普适”
下一步的研究将聚焦于优化 MOF 框架的柔性与稳定性,以进一步提升非线性光学响应效率,尝试在更低的光功率下实现同等的治疗深度 。同时,研究人员计划开发具有多重靶向功能的配体,让“全能化工厂”能更精准地降落在癌细胞表面,为深层肿瘤的绿色、精准化疗提供一套完整的“中国方案” 。