🔦 【Angew. Chem.】标题策略:光控逆转!中国科学家首次实现发光模式“一键切换”,生物成像寿命暴增106%!
✨文章标题:Photoexcitation-Induced Chiral Self-Assembly for Phosphorescence-to-Thermally Activated Delayed Fluorescence Transformation ✉️作者: Prof. Dr. Xu-dong Wang, Prof. Dr. Liangliang Zhu 等 🔗链接:https://doi.org/10.1002/anie.202516591
🚀 从“痛点”到“突破”:发光界的“变脸大师”
在现代科技的诸多领域,从高清显示屏、智能照明到精准生物医学成像,发光材料无疑扮演着“隐形英雄”的角色。而在众多的发光机制中,**磷光(Phosphorescence, P-type)和热活化延迟荧光(Thermally Activated Delayed Fluorescence, TADF)是目前最受关注的两大顶尖技术路径 。它们都具备高效和长寿命的优势,特别是对于时间分辨生物成像(TRI)而言,长寿命发光能有效滤除细胞的短寿命自发荧光(Autofluorescence)**干扰,极大提升成像的信噪比和分辨率 。
然而,一个长期存在的行业痛点是:如何在同一个分子内,实现这两种重要的发光模式的 “在位”(in situ)、“实时”且“动态”的相互转换? 想象一下,如果我们的发光探针能像“变色龙”一样,根据需要实时切换工作模式,那将彻底颠覆我们对动态成像和智能材料的控制能力 。但由于这两种模式的物理基础差异巨大,实现这种“一键转换”被认为是极具挑战性的科学难题 。
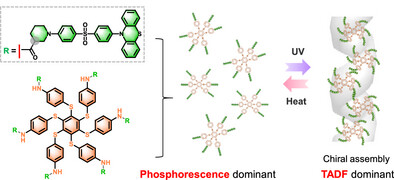
最近,来自复旦大学等机构的中国科学家们给出了一个颠覆性的解决方案 。他们巧妙地设计了一种手性分子,通过温和的紫外光照射,诱导分子发生 “手性自组装” 。令人震撼的是,正是这一光诱导的自组装过程,成功地将原本以磷光为主的发光模式,实时、原位地切换成了以TADF为主的模式 。这项突破不仅解决了转换的难题,更重要的是,在实际的生物成像中,他们通过这一转换,成功将材料的平均发光寿命从16毫秒提升至33毫秒,实现了高达106%的动态增强 ,为未来自适应、高分辨率的生物医学成像铺平了道路 。
🔬 核心方法与技术细节解密:分子内的“变形金刚”
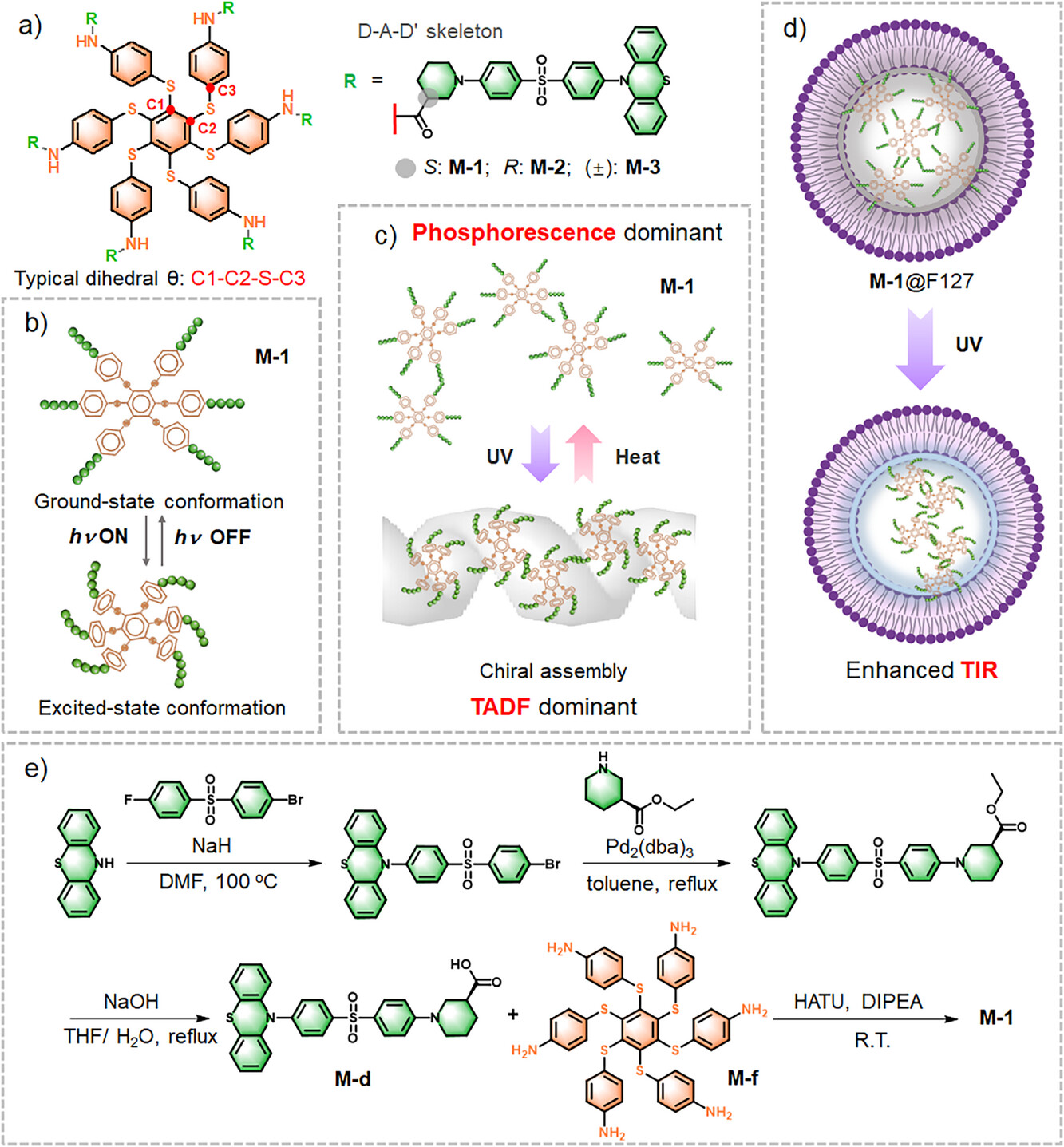
这项研究的核心,是其巧妙的分子设计(M-1) 和独特的光激发诱导手性自组装(PEIA) 机制 。
D-A-D’结构与“六硫苯”骨架的精妙结合
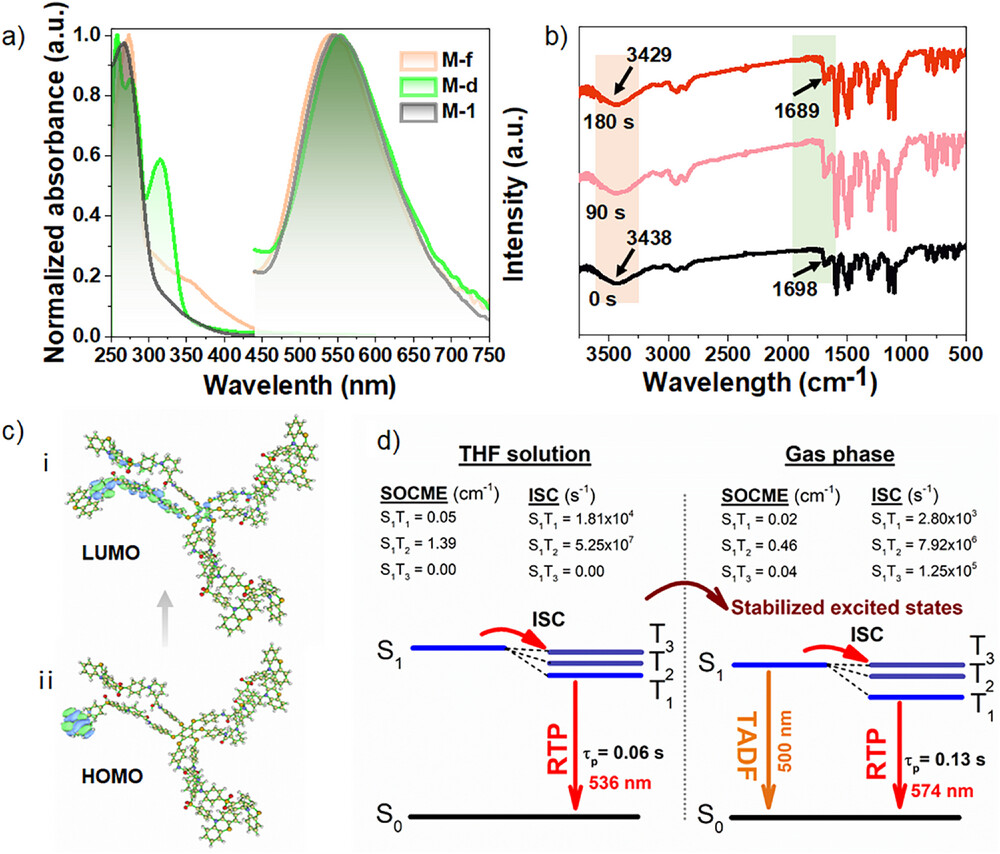
科学家们构建了一个具备D-A-D'(供体-受体-供体) 结构的分子,并将其共价键合到一个六硫苯(Hexathiobenzene)骨架上 。如果你觉得这些名词太“硬核”,不妨将其想象成一个复杂的“发光乐高”积木 。D-A-D’结构是TADF发光的基础,它通过扭曲的分子构型来缩小单线态(S1)和三线态(T1)之间的能量差 。而六硫苯骨架则是一个独特的“光控开关”,它本身具有磷光特性 ,并且在光激发下能发生显著的分子构象变化,从而驱动分子间的聚集或自组装 。
更重要的是,研究者们特意在分子中引入了 “手性原子中心” 。这就像给“乐高”积木加上了一个 “定向螺纹”。手性(Chirality)是一种重要的空间属性,左右手互为镜像但不能重叠。这个手性中心成为了分子自组装时的 “导航仪” ,确保分子在聚集时不仅仅是随机堆叠,而是按照特定的螺旋方向进行手性自组装 。
光照下的“变脸”过程:从分散到螺旋
当分子M-1最初分散在溶液中时,它主要展现出磷光特性 。磷光是一种由三线态(T1)到基态(S0)的辐射跃迁,效率受限于自旋禁阻,且极易被氧气等猝灭 。
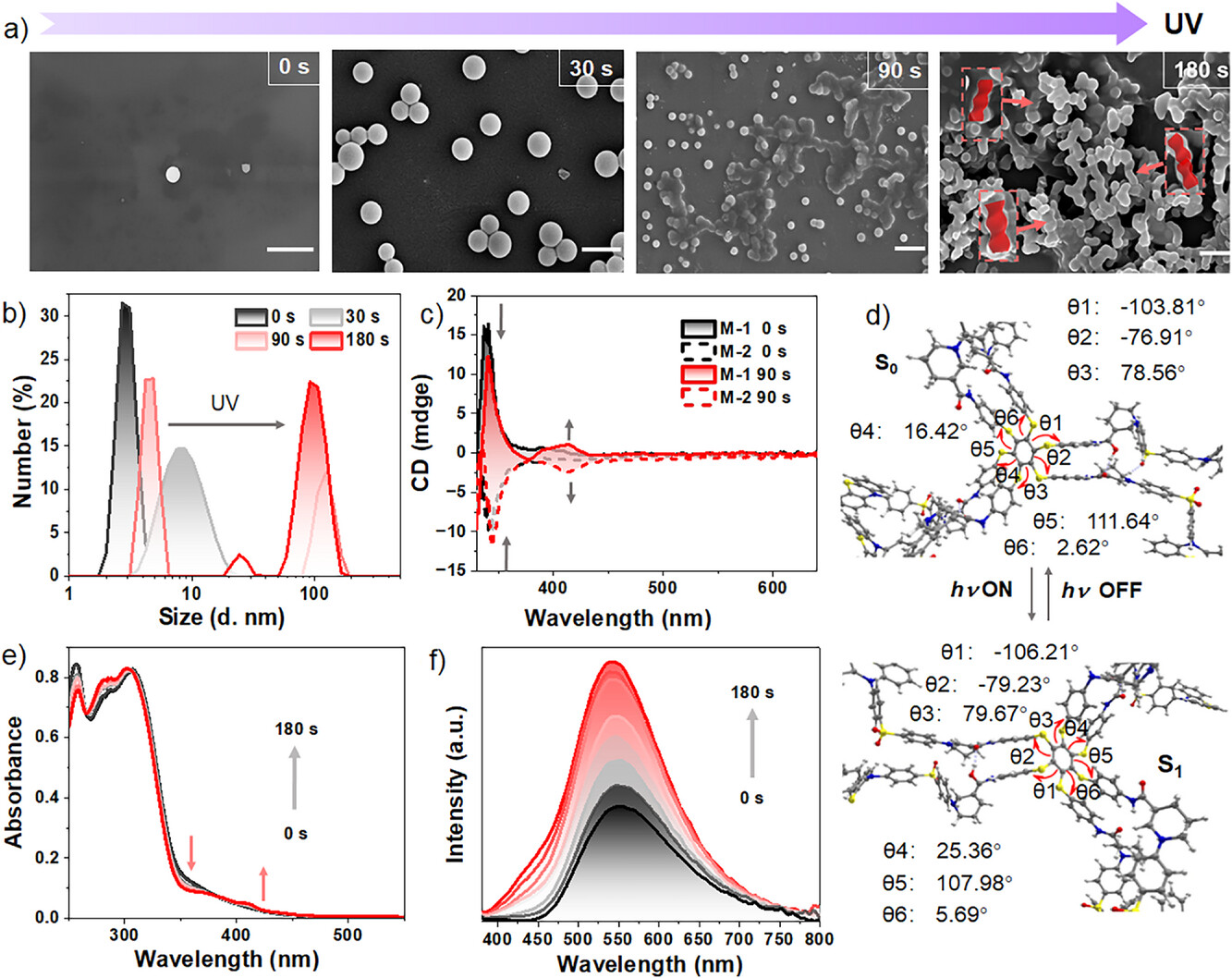
转折点发生在光照(例如紫外光)的瞬间 。光照触发了六硫苯骨架的构象变化(Ground-state Excited-state conformation) 。这种激发态的构象变化,加上手性中心的定向引导,导致了分子迅速地从分散态转化为手性自组装体(Chiral Self-Assembly) 。研究人员通过扫描电子显微镜(SEM) 观测到,仅仅30秒的紫外光照射,M-1就从分散的颗粒迅速聚集,并在180秒后进一步发展成清晰可见的螺旋结构(Helical Structures) 。
这一自组装过程不仅是简单的聚集,更是发光模式的物理切换 。
机制转换的物理学奥秘: 的缩小
在手性自组装形成后,分子间紧密的非共价相互作用(如增强的氢键)被放大 。这种相互作用导致了分子在聚集态下的激子状态被稳定 。
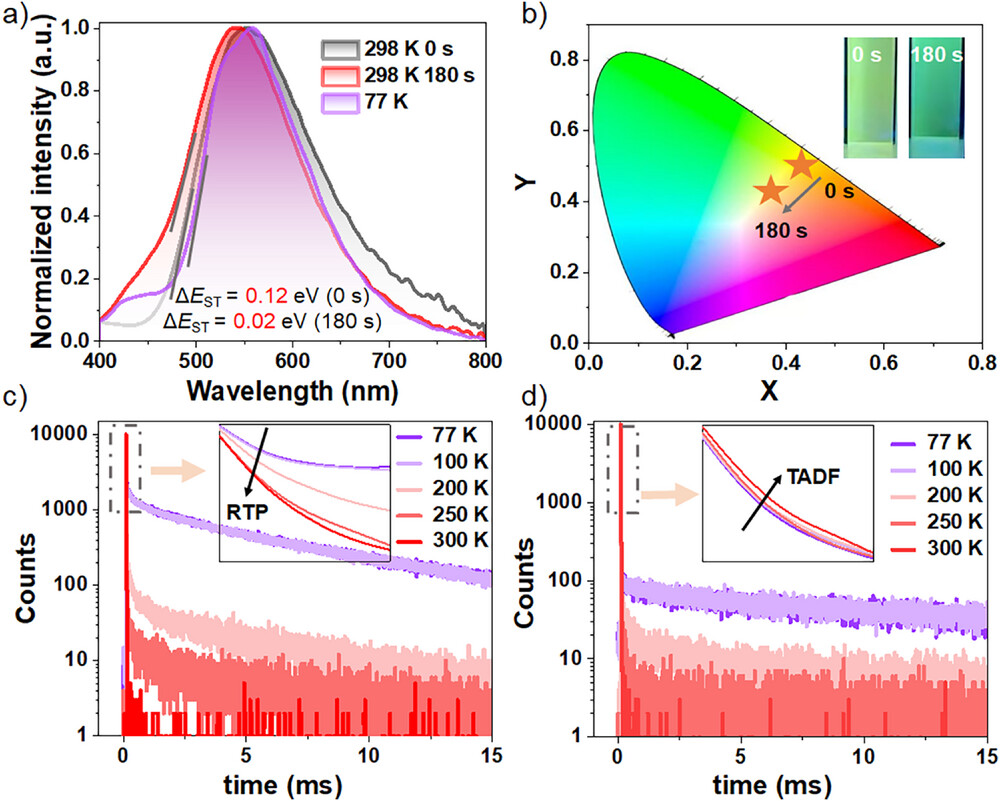
物理学计算和实验结果显示,光照前,分子体系的单线态和三线态之间的能量差 约为 0.12 eV 。这一能量差虽然小,但仍导致了主要的发光模式是磷光(RTP) 。然而,在手性自组装形成后,分子间的堆叠和稳定作用进一步将 缩小到仅有 0.02 eV 。
的急剧缩小,使得体系能够高效地利用热能(即室温下的热活化)将三线态激子(T1) 重新推回到单线态(S1),这一过程被称为反向系间窜越(RISC) 。RISC成功后,分子就从S1态发射出延迟荧光,从而完成了磷光向TADF的转变 。换句话说,手性自组装就像一个 “能量扳手”,它锁定了分子的激子状态,将能量差调整到了TADF所需的极小值 。
📊 数据背后的创新与颠覆性分析:双倍的“续航”与无惧氧气的“护甲”
这项研究的颠覆性不仅在于实现了发光模式的切换,更在于切换后性能的巨大提升,这在应用层面具有非凡的意义。
性能暴增:发光寿命翻倍
在实际应用,特别是时间分辨生物成像(TRI)中,发光寿命是决定成像质量的关键参数 。寿命越长,就越能延迟接收信号的时间,从而彻底避开细胞的纳秒级自发荧光干扰,实现“背景全黑”下的清晰成像。
研究人员将手性分子 M-1 封装到生物相容性好的纳米乳液(M-1@F127)中,与活细胞(PC12细胞)共同孵育进行实验 。
光照前: 在初始状态下,尽管F127的包裹已经形成了一定程度的聚集,但主要发光信号的平均寿命约为16微秒(µs) 。
光照后: 经过紫外光照射诱导形成手性自组装后,平均发光寿命显著延长,达到了惊人的33微秒(µs) 。
这意味着,仅仅通过光照这一非接触式、在位的操作,就让探针的 “续航时间”延长了106% 。这种动态、可控的寿命调节能力是前所未有的,因为它允许研究人员实时、选择性地调整成像参数,以适应不同的生物环境和时间/空间分辨率需求 。
机制增强:手性“护甲”抵御氧气猝灭
TADF和磷光的一个共同“敌人”是氧气 。氧分子(特别是其三重态)极容易与发光分子的三重态激子发生碰撞,导致能量损失,即 “猝灭”,从而大大降低发光效率和寿命 。
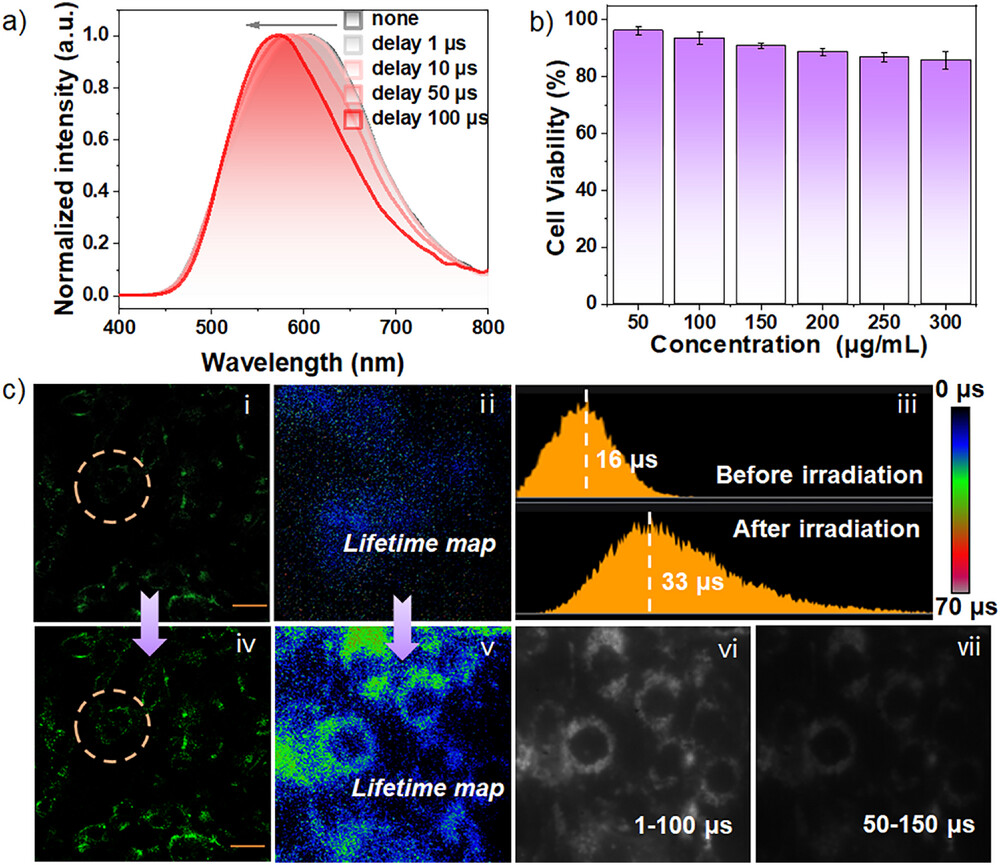
本研究的另一个颠覆性贡献在于,这个光诱导形成的手性螺旋自组装结构,就像给发光分子穿上了一层密不透风的“护甲” 。这个规则、紧密的螺旋结构将发光中心(即激发态分子)“物理隔离” 在了组装体的内部 。
保护效应: 这种隔离极大地减少了氧气分子与三重态激子接触的机会 。
结果: 在细胞成像实验中,发光信号的强度和寿命都得到了显著增强 。即使在存在氧气的细胞微环境中,TADF发射仍能保持长寿命,这有力地证明了手性自组装的保护效果 。
对比分析:手性与消旋体的决定性差异
为了证明“手性”的必要性,研究人员使用了消旋体(Racemic Compound, M-3) 作为对照 。消旋体是左右手两种镜像分子等量混合物,理论上失去了净的手性。
实验结果清楚地表明了手性的决定性作用:
形态: 消旋体M-3在光照下仅表现出增强的聚集现象(形成球形聚集体),但没有形成扭曲的螺旋结构 。
发光: M-3在光照后,PL寿命的变化不符合典型的TADF趋势,而是在高温下重新下降 。
结论: 这一对比实验无可辩驳地证明,只有具备手性中心的M-1才能在光照下形成规则的、具备保护作用的“手性自组装” ,从而实现磷光到TADF的稳定、高效转换和性能的增强 。
因此,这项工作不仅是“发光模式的切换”,更是利用手性自组装的“几何力量” 来物理调控和增强发光性能的突破 。
🌟 应用展望、局限性与未来路线图:从细胞到下一代显示
这项“光控变脸”的发光技术突破,为多个前沿领域带来了激动人心的应用前景 。
潜在应用场景:动态自适应生物成像
最直接的应用是动态增强的时间分辨成像(TRI) 。未来的生物学家和医生可以通过简单、无创的光照操作,实时地:
“一键提速”成像: 在需要精细结构和高对比度时,通过光照诱导TADF,将发光寿命动态提升到微秒级,彻底消除背景荧光,实现超清晰的细胞结构和分子示踪 。
微环境探针: TADF对环境极性敏感 。光诱导的TADF转换可以作为一种**“开关信号”**,用于实时监测细胞内环境(如粘度、氧浓度等)的动态变化,因为自组装的形成和稳定性也与环境相关 。
局限性与未来路线图
如同所有前沿科研成果一样,该研究也存在其局限性,并指明了未来的研究方向 。
主要局限性:
光刺激依赖: 转换过程依赖于紫外光激发 ,虽然温和,但在某些深层组织成像中,紫外光穿透性有限。未来的工作需要探索可见光或近红外光(NIR)诱导的自组装机制,以实现更深层的应用 。
可逆性与稳定性: 文献中提到,光激发诱导的手性自组装是可逆的,通过加热可以恢复到原始分散状态 。虽然可逆性是动态控制的基础,但在实际应用中,需要进一步研究其热稳定性和重复循环寿命,确保在体温和多次使用下的可靠性。
未来发展路线图:
红移策略: 优化分子结构,将TADF发射波长进一步推向红光或近红外区,以获得更低的生物毒性和更深的组织穿透深度。
通用性拓展: 将这种**“手性-光激发-模式转换”的策略推广到其他类型的发光分子体系,验证其作为一种普适性动态调控手段**的潜力 。
多功能集成: 将光控发光探针与药物载体等功能模块集成,开发出集精准诊断、实时监测和光控治疗于一体的多功能智能纳米系统 。
这项由光激发的微观“舞蹈”所带来的发光模式转变,不仅是基础科学领域的重大突破,更预示着一个由 “智能光控材料” 驱动的未来。正如该研究的核心目标所指,它为在同一分子内实现两种重要发光途径的在位转换提供了切实可行的解决方案 ,无疑将在动态发光和精准探测领域,掀起一场新的革命 。