💡【Angew.Chem.】一个激光染料让抗癌药筛选效率提高10倍,还能精准识别98% 的微管蛋白结合位点?
✨文章标题:Coumarin-30 Enables Site-Resolved Detection of Tubulin Ligands by Microscale Thermophoresis ✉️作者:Prof. Dr. Igor V. Trushkov, Prof. Dr. Olga A. Ivanova, Prof. Dr. Nikita B. Gudimchuk 等 🔗链接:https://doi.org/10.1002/anie.202517086
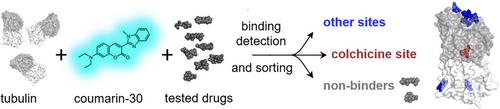
从“痛点”到“突破”:抗癌战场上的“阿喀琉斯之踵”
在人类对抗癌症的漫长战役中,微管蛋白(Tubulin)一直是化疗药物最成功、最重要的靶点之一。你可能对它感到陌生,但它在我们身体里的作用就像搭建摩天大楼的脚手架——微管。这些由微管蛋白构成的“脚手架”在细胞分裂,特别是癌细胞的快速增殖过程中,扮演着至关重要的角色。一旦这些“脚手架”被药物破坏(例如著名的紫杉醇和秋水仙碱类药物),癌细胞的分裂就会被阻止,最终凋亡。
然而,癌细胞远比我们想象的狡猾。随着药物的广泛使用,耐药性这座大山迅速崛起,成为化疗的“阿喀琉斯之踵”。癌细胞通过改变微管蛋白的亚型、药物结合口袋发生突变,或干脆把药物泵出细胞,让很多经典的抗癌药功亏一篑。为了开发出能绕开耐药机制的新型疗法,科学家们迫切需要一种“神眼”,能够快速、准确地找到那些结合在微管蛋白上不同口袋的新型分子。
传统的药物筛选方法,如基于荧光增强的检测,往往依赖于一些老旧的探针,比如秋水仙碱的荧光类似物MTC。这些探针存在灵敏度低、荧光信号弱、或无法兼容多种检测技术的缺点,导致新药研发的进程缓慢且成本高昂。
现在,来自俄罗斯等地的科研团队带来了一个颠覆性的好消息:他们发现了一种被广泛使用的激光染料——香豆素-30(Coumarin-30),不仅本身是一种高效的微管破坏剂,其荧光特性更使得它成为新一代药物筛选的“超级探针”。基于此,他们开发出了一种C-MST(Coumarin-30-based Microscale Thermophoresis) 检测技术,这不仅仅是“更快”或“更准”,而是一场彻底的方法论革命。
核心方法与技术细节:从“激光染料”到“超级神探”
这个研究的核心突破,在于找到了香豆素-30(Coumarin-30)这个“关键先生”。
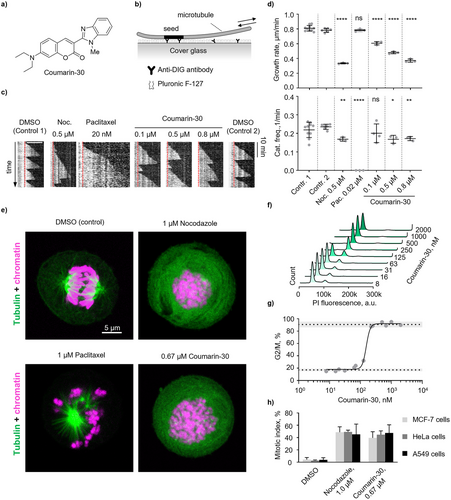
1. 香豆素-:隐藏在染料界的微管“杀手”
香豆素-30最初是通过COMPARE算法(一种根据药物抗癌活性谱预测作用机制的算法)在超过60种癌细胞系上的抗癌数据中被识别出来的。它的抗癌活性谱与经典的微管抑制剂秋水仙碱高度相关,相关系数高达,并且对癌细胞的半数最大生长抑制浓度()低至。这表明它可能是一个潜在的微管蛋白抑制剂。
实验验证进一步证实了它的“杀手”身份。在体外微管动力学实验中,香豆素-30以亚微摩尔浓度()就能有效抑制微管的生长速率,并显著增加微管的“灾难频率”(即微管崩解的频率),其作用方式与知名的微管去稳定剂诺考达唑类似。在癌细胞中,它也展现出强大的效果:它能诱导微管解聚,并导致A549、MCF-7和HeLa等多种癌细胞株发生有丝分裂阻滞(Mitotic arrest),其半数最大抑制浓度()甚至更低,仅为。
2. 荧光增强的秘密:被“锁住”的旋转
香豆素-30之所以能成为“超级探针”,在于它卓越的荧光特性。当香豆素-30与可溶性微管蛋白结合时,它的荧光发射峰值竟然增强了约9倍。这是一个巨大的信号!
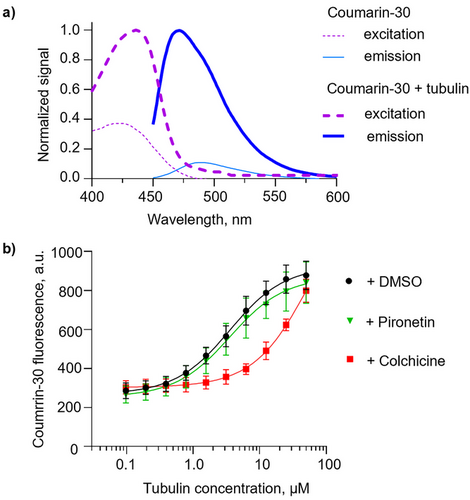
科学家解释说,在水等极性溶剂中,激发态的香豆素-30会发生扭曲分子内电荷转移(TICT)效应,其分子中的二乙氨基团会旋转,导致激发能量以非辐射形式耗散,荧光很弱。但是,当它进入微管蛋白分子的秋水仙碱结合口袋时,这个口袋提供了一个非极性、脱水且刚性的微环境。在这个狭窄的口袋里,二乙氨基团的旋转被限制了,TICT效应被抑制,非辐射衰变减少,荧光量子产率急剧增加,从而发出明亮的荧光。
这种“结合即发光”的机制,使得香豆素-30成为比传统探针MTC灵敏度更高的探针。更重要的是,与秋水仙碱或MTC不同,香豆素-30即使在溶液中也具有显著的荧光,这使它兼容荧光各向异性(Fluorescence Anisotropy)等高级技术,进一步提升了筛选精度。
3. C-MST:热泳动带来的位点分辨能力
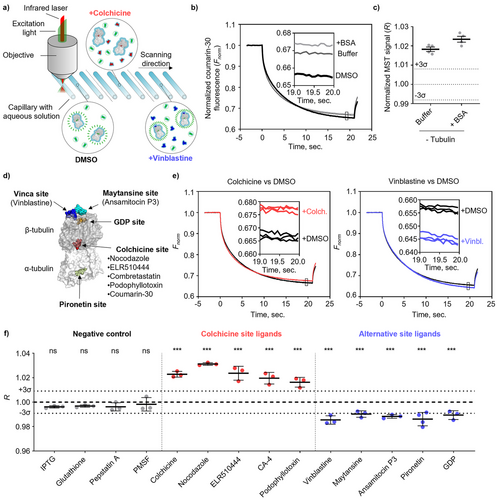
研究人员将香豆素-30的优异荧光特性与微量热泳动(Microscale Thermophoresis, MST) 技术完美结合,开发出了C-MST检测法。
MST是一种通过测量荧光分子在局部加热溶液中所产生的热扩散变化,来表征分子间相互作用的技术。当一个荧光分子与一个大分子(如蛋白质)结合时,它的热扩散速度会改变,从而改变荧光信号。
C-MST的创新之处在于,它利用了香豆素-30作为探针和秋水仙碱位点结合剂的双重身份。它不仅能检测到配体与微管蛋白的结合,还能区分结合位点:
秋水仙碱位点结合剂(Colchicine site binders): 比如诺考达唑和鬼臼毒素。它们会与香豆素-30竞争相同的结合口袋,将香豆素-30从微管蛋白上“挤出去”。被挤出的香豆素-30在溶液中的热泳动特性会发生变化,导致C-MST信号(R值)高于对照组水平。
非秋水仙碱位点结合剂(Alternative site binders): 比如长春花碱、美登素和吡罗那定。它们结合在微管蛋白的其他口袋(如Vinca位点、Maytansine位点等)。它们不会把香豆素-30“挤出去”,而是结合到已形成的“微管蛋白-香豆素-30”复合物上,从而改变整个复合物的尺寸和水合层,进而改变复合物的热泳动特性,导致C-MST信号(R值)低于对照组水平。
这种独特的信号差异(高于对照组 vs. 低于对照组)使得C-MST成为第一个能够同时检测配体结合并对结合位点进行分类的快速、低成本方法。这对于早期药物筛选,尤其是对付耐药性癌细胞寻找新结合位点配体而言,具有不可估量的价值。
数据背后的创新与颠覆性:快、准、狠的药物筛选新纪元
C-MST检测法在准确性和效率上展现出了对现有技术的颠覆性优势,为新药研发开启了一个“快、准、狠”的新纪元。
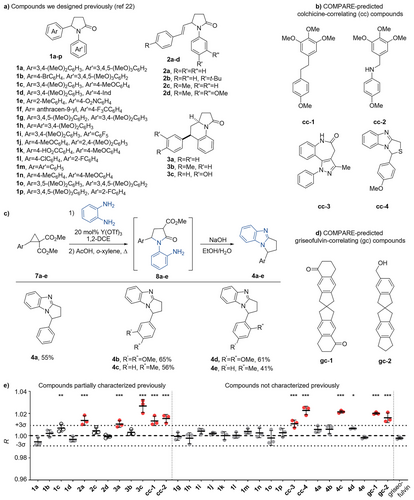
1. 经验证的超高准确率:高达98%的分类精度
研究团队对C-MST检测法进行了广泛的验证。他们不仅测试了10种已通过X射线晶体学确定结构(PDB可查)的参考化合物,还测试了30多种具有不同结合亲和力的化合物。
验证结果显示:
准确度: 在88%到98% 的范围内。
特异性: 接近100%。
这种高准确度和特异性,意味着C-MST能够极大程度地减少筛选过程中的假阳性或假阴性,尤其是在区分最常见的秋水仙碱位点结合剂与更稀有、更具突破潜力的其他位点结合剂时。在药物筛选的最初阶段就能对配体进行位点分类,这是其他快速方法目前无法实现的。
2. 区分新旧位点:发现非聚合物抑制剂
C-MST的另一个颠覆性贡献是它能够超越传统的“微管动力学”检测范式,发现那些结合在微管蛋白上、但不影响微管聚合的新型配体。
发现新型秋水仙碱位点结合剂: 通过C-MST,研究人员从NCI(美国国家癌症研究所)化合物库中筛选出了cc-3、cc-4、gc-1、gc-2等几种新型的聚合抑制剂。其中,gc-1和gc-2属于结构独特的螺环化合物,与已知的秋水仙碱位点结合剂截然不同。通过体外微管动力学实验证实,这些化合物确实能将微管生长速率降低约50%,并在纳摩尔到微摩尔级别(介于至)诱导A549细胞有丝分裂阻滞,证实了C-MST的强大预测能力。
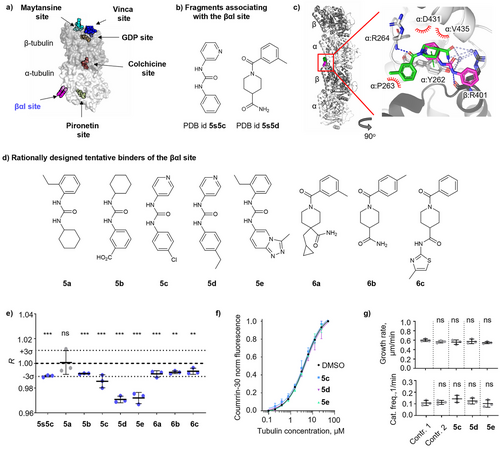
识别 I 位点配体: 更具突破性的是,研究人员利用C-MST成功识别了一组结合在微管蛋白上新型 I 位点的配体(如5b-e, 6a-c)。这个位点是最近通过晶体学片段筛选发现的,靠近微管蛋白二聚体界面。关键在于,这些化合物并不会影响微管的聚合动力学。传统的基于微管聚合的筛选方法会直接错过这些化合物,而C-MST凭借其热泳动变化信号,成功将它们识别为“非秋水仙碱位点结合剂”(R值低于对照组)。
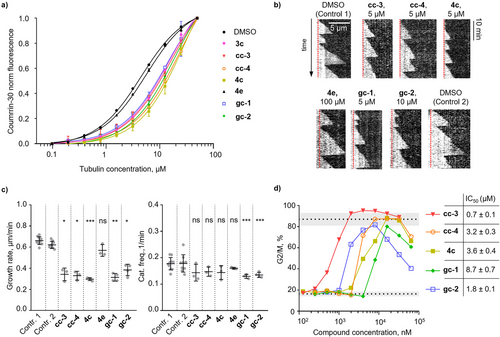
这意味着C-MST开辟了寻找新型微管调节剂的可能性,这些调节剂可能不直接破坏微管结构,而是阻断微管与其它伴侣蛋白(effector proteins)的相互作用。这种“非破坏性”的调节剂可能具有更少的副作用,为未来的化疗药物提供了一个全新的研发方向。
3. 成本与效率优势: 的微量筛选
在实际应用中,C-MST的成本效益和速度优势是巨大的。
微量化: C-MST每次测量仅需要 的样品体积。
速度: 它可以将多个样品排列在单个托盘上,进行并行阵列分析。
相比于传统、耗时的结构生物学方法(如晶体学或NMR)来确定结合位点,C-MST提供了一个快速、准确且成本效益高的筛选工具。对于那些希望快速推进早期药物发现的实验室和企业而言,C-MST极大地缩短了从化合物库到高潜力先导化合物的筛选周期。
应用展望、局限性与未来路线图
这项研究无疑为微管蛋白靶向药物的开发注入了新的活力,但作为一个严谨的科学发现,我们也需要客观地看待其局限性和未来的发展方向。
1. 当前局限性
虽然C-MST在区分秋水仙碱位点和非秋水仙碱位点方面表现出色,但它目前无法进一步区分所有非秋水仙碱位点的细微差别。例如,它将长春花碱(Vinca位点)和吡罗那定(Pironetin位点)都归类为R值低于对照组的非竞争性结合剂。因此,对于已分类为“非秋水仙碱位点结合剂”的配体,研究人员仍需借助传统的晶体学、NMR或其他生物物理方法来精确确定其结合的具体口袋。
此外,香豆素-30的结合亲和力虽然适中,但在某些极端情况下,如果配体的亲和力远低于这个值,可能会影响C-MST的检测灵敏度。
2. 应用场景与未来路线图
C-MST技术的诞生,最直接的应用场景在于高通量药物筛选(High-throughput screening, HTS)的前端。
早期药物筛选: 它可以作为一种初筛工具,快速对大规模化合物库进行“三分类”:秋水仙碱位点结合剂(R高)、其他位点结合剂(R低)、和非结合剂(R接近对照组)。这种预分类能让科学家将精力集中于最具前景的化合物上。
靶向新位点: 通过R值低于对照组的化合物,可以高效筛选出结合在如 I 位点等新型位点上的配体。这些配体可能是下一代抗耐药性药物的关键,尤其是那些不影响微管聚合、而是调节微管-伴侣蛋白相互作用的分子。
新型探针的开发: 香豆素-30作为探针的成功经验,将鼓励科学家寻找更多具有类似“结合即增强荧光”特性的分子,用以开发针对微管蛋白其他位点或细胞内其他重要靶点的位点特异性探针。
展望未来,科研团队可以进一步优化C-MST,尝试引入其他位点的荧光探针,以实现对多个非秋水仙碱位点的多重分辨。毫无疑问,这项基于一个普通激光染料的创新技术,将作为一款强大、准确、高性价比的工具,加速抗癌药物研发的进程,为战胜癌症带来更多新的希望。