🔦【Angew. Chem.】癌症监测进入“声光”时代:中科院团队将超声发光信号强度暴增78.7倍**,实现肿瘤精准实时追踪!**
✨文章标题:Energy Interception-Enhanced Ultrasound-Induced Luminescence Enables Efficient Anticancer Monitoring ✉️作者:Youjuan Wang, Qin Wu, Weihong Tan等 🔗链接:https://doi.org/10.1002/anie.202517880
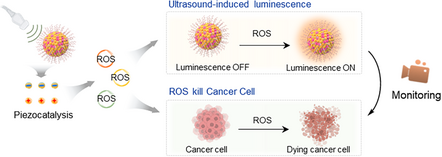
🚀 从“痛点”到“突破”:给超声影像装上“分子眼睛”
在癌症诊断和治疗领域,我们都在追求一个理想状态:实时、精准、深度地“看见”病灶的分子活动。传统的荧光成像技术,虽然灵敏度高,但受制于光线穿透深度不足(通常小于 1 厘米)和组织自发荧光干扰,导致“信噪比”极低,根本无法用于对深层肿瘤的监测。
为了克服这些限制,科研人员一直在探索“无激发光”的光学成像新模式。比如大家常听说的化学发光、生物发光、或者X射线诱导发光等。它们各有优势,但也存在局限,比如需要高剂量放射性示踪剂,或者光穿透深度仍然受限。
近年来,一种全新的技术——超声诱导发光(Ultrasound-induced Luminescence, UIL)成像脱颖而出。这项技术利用超声波的机械能来激发材料发光,巧妙地避开了传统光学成像的固有缺陷,具备深度穿透组织和零背景信号的潜力。但这项技术在走向临床应用之前,面临三大核心挑战:可用的发光分子库有限、发光机理含糊不清,以及最关键的——发光强度太低。
现在,来自中科院的研究团队带来了一个颠覆性的解决方案。他们不仅系统性地扩大了 UIL 分子库,更重要的是,他们设计了一种精妙的 “能量拦截” 策略,将超声诱导发光的信号强度直接提升了 78.7倍!这一突破性进展不仅让深层肿瘤的分子监测成为现实,还将其与癌症的声动力疗法(SDT)完美结合,开创了实时监测治疗效果的新篇章。
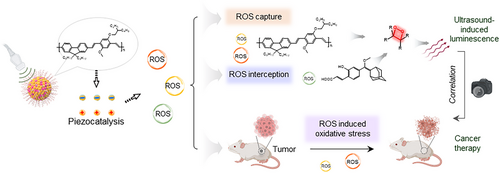
🔬 核心方法与技术细节:一场超声波驱动的“能量接力赛”
要理解这项研究的惊人之处,我们首先要弄明白超声波是如何在分子层面引发“发光”的。这背后涉及一个复杂的、被称为 “机械化学能转换” 的精巧过程。
🔌 步骤一:机械能到化学能的转换——压电催化效应
超声波本质上是一种频率高于 20 kHz 的机械能。它无法像可见光或X射线那样,直接被分子电子吸收,从而跃迁到激发态并产生发光。那么,超声波是如何驱动发光的呢?
研究团队揭示,他们筛选出的核心材料——一种名为 PFPV(聚[(9,9'-二辛基-2,7-二乙烯基芴基)-交替-2-甲氧基-5-(2-乙基己氧基)-1,4-亚苯基)] 的半导体聚合物纳米粒子(PFPV-NPs)——发挥了关键作用。
当超声波作用于 PFPV-NPs 时,它会诱导材料内部产生压电催化行为。简单来说,就像某些晶体在受到压力时会产生电荷一样,PFPV-NPs 在超声波的机械振动下,会将机械能转化为化学能。
这种化学能的具体载体,就是活性氧物种(Reactive Oxygen Species, ROS)。ROS 是一系列高度活泼的含氧分子,它们在肿瘤治疗中是关键的细胞毒性介质,在诊断中则是重要的实时治疗生物标志物。通过实验,研究人员确实检测到 PFPV-NPs 在超声激发下产生了大量的 ROS,这一步完成了 “机械能”向“化学能” 的转化.
✨ 步骤二:化学能到光子能的转换——“能量拦截”放大器
接下来,就是这场“能量接力赛”中最关键的一棒:如何高效地将储存在 ROS 中的化学能转化为可检测的光子能(即发光)。
传统的 UIL 机制中,生成的 ROS 会直接氧化 PFPV 自身的烯键等不饱和键。这个氧化过程会形成高能中间体(比如二氧乙烷酮),这些中间体裂解时会释放能量,进而激发分子发光。
然而,PFPV 本身与 ROS 的反应活性是相对较低的。这意味着大量的化学能会随着 ROS 的失活而白白浪费,无法转化为光子,导致最终的 UIL 信号微弱。这就是 UIL 信号一直不高的根本原因。
研究团队天才地设计了 “能量拦截策略”,引入了一种名为 HBA 的小分子底物(化学名称为 3-(4-(((1r,3r,5R,7S)-金刚烷-2-亚基)(甲氧基)甲基)-2-羟基苯基)丙烯酸)。
HBA 的巧妙之处在于:它对 ROS 具有极高的化学反应活性。当研究人员将 HBA 分子掺杂到 PFPV-NPs 中,形成 PFPV@HBA-NPs 后,情况彻底改变了。
当 ROS 被 PFPV-NPs 生成时,它会优先且高效地与反应活性更高的 HBA 发生氧化反应,从而形成更多的、高能的二氧乙烷酮中间体。这就像在赛道上放置了一个高效率的“能量拦截器”和“转换加速器”。HBA 成功地 “拦截” 了原本会耗散失活的化学能,并将其高效地转化为光子,极大地提高了化学能向光子能的转移效率,实现了发光信号的惊人放大。
通过这种双重协同作用(PFPV 负责高效生成 ROS,HBA 负责高效捕捉 ROS 并放大发光),PFPV@HBA-NPs 成为了一个集声敏剂和增强型 UIL 纳米报告器于一身的 “诊疗一体化” 平台。
📈 数据背后的创新与颠覆性:78.7倍的信号提升意味着什么?
这项研究的价值,要通过其硬核数据来量化和衡量。
🌟 性能飞跃:78.7倍的信号提升与最优筛选
首先,在材料筛选阶段,研究人员测试了包括酞菁(PC、Zn PC、Mg PC)和半导体聚合物(PFPV、PFBT、PFVA)在内的六种分子。结果显示,PFPV-NPs 在所有测试的纳米粒子中,展现出最强的 UIL 强度。
然而,真正的突破来自 HBA 的引入。研究表明,在相同的超声激发条件下,PFPV@HBA-NPs 的 UIL 强度比没有掺杂 HBA 的 PFPV-NPs 高出了整整 78.7倍。这个巨大的数字不仅是实验桌上的一个数据点,它从根本上解决了 UIL 技术信号弱的瓶颈问题。
💡 “所见即所得”:发光强度与癌症疗效的完美关联
78.7倍的信号提升,其终极价值在于赋予了 UIL 成像**“实时监测”**治疗效果的能力。
ROS 不仅是 UIL 信号的来源,也是声动力疗法(SDT)中杀死癌细胞的“武器”。高活性的 ROS 能够显著提高细胞内的氧化应激水平,最终导致肿瘤细胞凋亡和坏死。
体外实验(细胞层面):
研究人员在 4T1 乳腺癌细胞上进行了验证。他们发现:
UIL强度与ROS产量的强关联: 随着超声激发时间的延长,PFPV@HBA-NPs 的 UIL 信号强度逐渐增强,同时 ROS 产量也逐渐增加。定量分析显示,UIL 强度与 ROS 产量之间具有惊人的线性相关性()。
UIL强度与细胞死亡率的完美关联: 随着 PFPV@HBA-NPs 浓度的增加,超声激发的 UIL 信号增强,同时癌细胞的活力逐渐下降(即死亡率上升)。计算显示,UIL 强度与细胞抑制率之间同样存在近乎完美的线性相关性()。
这意味着,通过监测 UIL 信号的亮度,医生可以实时、定量地知道有多少 ROS 被生成,从而预测癌细胞被杀死的程度。这对于 SDT 这种依赖 ROS 的治疗方式来说,是至关重要的动态优化工具。
体内实验(活体层面):
在活体小鼠模型中,研究人员将 PFPV@HBA-NPs 注射到 4T1 肿瘤中。结果证实:
剂量依赖性的 UIL 信号: 肿瘤区域的 UIL 信号强度随着 PFPV@HBA-NPs 注射剂量的增加而增强。
高效的肿瘤抑制效果: 接受高剂量 PFPV@HBA-NPs + 超声波治疗的肿瘤,体积抑制率高达 83.1%,肿瘤最终体积仅为对照组的零头( vs )。
UIL强度与肿瘤抑制率的高度关联: 定量分析表明,UIL 信号强度与肿瘤抑制率之间存在强烈的正相关性()。高 UIL 信号()对应高抑制率(83.1%),低 UIL 信号()对应低抑制率(53.2%)。
这一系列令人信服的数据,共同确立了 PFPV@HBA-NPs 平台作为 SDT 实时监测和疗效预测纳米报告器的可靠性。
🛡️ 深度穿透与高信噪比:解决“看不清”的痛点
在对比穿透深度上,UIL 成像的优势更是无可匹敌。
实验中,当覆盖 2.0 毫米厚的鸡肉切片时,传统的荧光信号已经变得微弱甚至检测不到,而 UIL 信号仍然清晰可见。更令人振奋的是,UIL 信号穿透深度可达 13.0 毫米,而荧光信号在 2.0 毫米处就已几乎消失。
此外,由于 UIL 是在没有光激发的情况下收集信号,它完美地规避了组织自发荧光的背景干扰。数据显示,在覆盖 2.0 毫米组织时,UIL 的信噪比(SBR)比传统荧光高出 145.0 倍。
这意味着,这项技术可以用于诊断和监测深层、内部的病变,例如淋巴结或深部肿瘤,这是传统光学成像望尘莫及的。
🧬 机制再探:氧化应激与炎症瀑布的协同杀伤
研究人员还通过转录组学分析(RNA-seq),深入探究了 PFPV@HBA-NPs 在超声作用下杀死癌细胞的分子机制。
结果发现,PFPV@HBA-NPs 结合超声激发,显著上调了与氧化应激、炎症反应相关的通路,同时下调了细胞生长和分化相关的通路。这进一步证实了 ROS 产生的细胞毒性作用。
更重要的是,研究揭示了一个**“氧化应激-炎症瀑布”的协同机制:ROS 的产生不仅导致了氧化损伤,还触发了炎症信号级联激活**(如 Nf-Kb 和 IFN 通路)。这种炎症反应反过来又会加剧氧化应激,形成一个自我强化的致病循环。最终,ROS 导致的氧化损伤和炎症负担的协同放大,共同导致了癌细胞的死亡。
🔮 应用展望、局限性与未来路线图:为精准医疗铺路
这项“能量拦截-增强型超声诱导发光”技术平台,为精准肿瘤治疗和监测带来了巨大的想象空间。
🌟 潜在应用场景与社会意义
PFPV@HBA-NPs 作为一个实时自评估的纳米诊疗报告器,解决了 SDT 治疗中最大的挑战之一:如何在治疗过程中实时、量化地追踪药效(ROS 剂量)。
未来,这项技术可以无缝整合到现有的临床超声成像设备中,实现**“肿瘤结构可视化”与“分子水平诊断”的同步进行。医生可以在进行声动力治疗的同时,通过 UIL 信号的强弱变化,立即知道 ROS 是否被有效生成、治疗剂量是否充足,从而动态地调整治疗方案,实现真正的个性化和精准化治疗**,以最小的毒性获得最佳的治疗效果。
⚠️ 局限性与未来发展方向
尽管取得了巨大的成就,但这项研究仍存在一些需要解决的局限性:
首先,尽管 UIL 信号强度提升了 78.7 倍,但其在全身范围内的信号穿透和体内分布特性仍需进一步优化和长期验证。如何在不降低 UIL 效率的前提下,提高纳米粒子在全身循环中的稳定性和肿瘤靶向性,是下一步的关键。
其次,目前的研究主要聚焦于 PFPV 和 HBA 这一组分子。虽然研究明确了压电催化活性和对 ROS 的化学活性是 UIL 体系设计的两大核心原则,但未来的工作需要系统地筛选和设计更多具有不同发射波长和更高生物相容性的分子,以进一步扩大 UIL 的分子库,满足更广泛的临床需求。
最后,该体系目前主要应用于**声动力治疗(SDT)**的监测,未来的路线图将包括将其拓展为其他肿瘤治疗生物标志物(如 值、酶活性等)响应性探针,与其他临床成像模式(如 CT、MRI)进行协同整合,最终推动其在临床上的大规模转化应用。
这项技术如同给原本“黑屏”的超声治疗装上了一个高灵敏度的“分子摄像头”,极大地提高了我们“看见”分子世界的能力,为下一代肿瘤精准诊疗技术提供了强大的工具。