【Angew.Chem.】深度解码(aza)BODIPY自组装:让肿瘤在“生命之窗”无所遁形
✨文章标题:Self-Assembled (Aza)BODIPY Dyes for Biomedical in Vivo Imaging ✉️作者:Prof. Dr. Gustavo Fernández 等 🔗链接:https://doi.org/10.1002/anie.202525491
引言:为什么我们需要“看透”生命的波段?
在现代医学的微观战场上,医生们梦寐以求的“终极武器”莫过于一双能洞穿人体、实时追踪病灶的“火眼金睛”。然而,人体组织就像一堵厚重的粉色围墙,传统的可见光在穿透皮肤几毫米后就会迅速衰减。更糟糕的是,组织自带的“杂波”(自荧光)和严重的散射,让体内的分子成像就像是在浓雾中寻找萤火虫,往往只能看到模糊的轮廓。
为了解决这一痛点,科学家们将目光锁定在了 700-1700 nm 的“近红外(NIR)生物窗口”。在这个波段,光表现出前所未有的穿透力——散射大幅降低、能量损耗极小,能够实现厘米级的深层组织穿透。这不仅是诊断的窗口,更是生命的窗口。
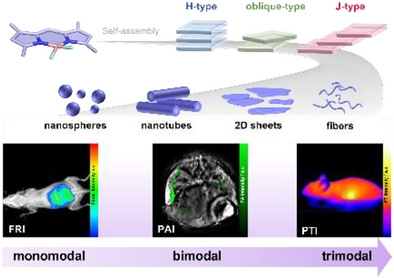
而在众多的发光分子中,BODIPY(氟硼荧)及其氮代类似物 aza-BODIPY 正成为这场精密诊断革命的明星。它们不仅物理化学性质极其稳定、发光效率高,且具备极强的“可塑性”。由德国明斯特大学 Gustavo Fernández 教授团队在国际顶尖化学期刊《德国应用化学》(Angewandte Chemie)上发表的重磅综述指出,通过超分子自组装这一“分子乐高”技术,这些分子不仅能实现性能的百倍飞跃,更能从单一模态进化为三模态成像的“全能战士”。
分子的“华尔兹”与能级魔术
要理解这些染料为何能如此强大,我们得先潜入微观世界,看看化学家们是如何给这些微小的分子“施法”的。
1. 氮原子的“降维打击”
传统的 BODIPY 分子虽然优秀,但它们的“肤色”(吸收峰)通常停留在 600 nm 左右的可见光区,很难跨越 700 nm 的近红外门槛。
化学家们想出了一个精妙的策略:在分子的“心脏”部位引入一个电负性极强的氮原子。 这一小步改动(变成 aza-BODIPY),成功拉低了分子的最低未占轨道(LUMO)能级。这种能级上的“降维打击”大幅缩小了能隙,让分子瞬间具备了捕获近红外长波段光的超能力。
2. Kasha 理论:自组装的“群舞”艺术
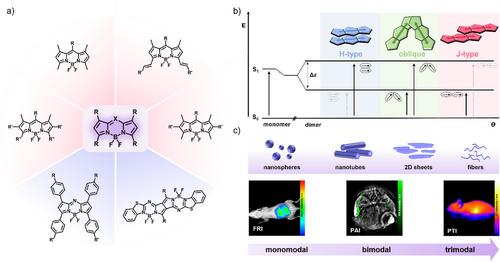
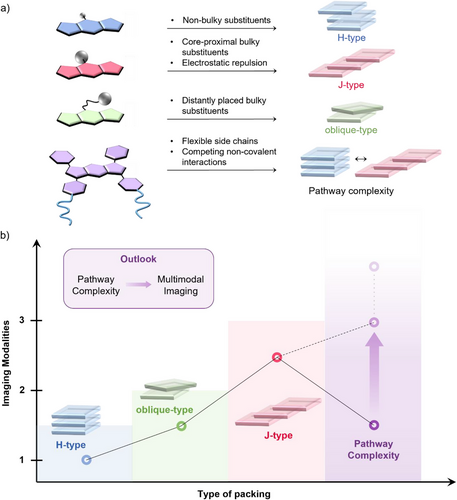
单打独斗的分子力量有限,但当成千上万个 (aza)BODIPY 分子在水中“抱团”自组装时,奇迹发生了。它们排列的方式(堆叠模式)就像一场舞会,不同的“舞姿”直接决定了它们最终的功能:
H-型聚集(面对面堆叠):分子像一沓钞票一样紧紧贴合。在这种紧密接触中,分子的激发能级会发生分裂,导致能量在内部被损耗,荧光像被掐断了一样消失。这在学术上被称为聚集诱导淬灭(ACQ)。
J-型聚集(头尾相接/滑移排列):分子像台阶一样斜向滑移排列。这是生物成像的“圣杯”! 这种排列不仅能让吸收光谱进一步向长波段红移,还能保持甚至增强发光亮度,极大提高了在深层组织中的信噪比。
斜向排列(Oblique-type):这是一种极其罕见的“中间姿态”。分子之间的角度既非平行也非完全错位,产生了一种独特的平衡,这种状态对环境极其敏感,是开发超灵敏探针的绝佳选择。
从单模态到三模态的进化之路
通过对文献中 24 种核心化合物及其组装行为的深度解析,我们发现 (aza)BODIPY 的潜力被严重低估了。
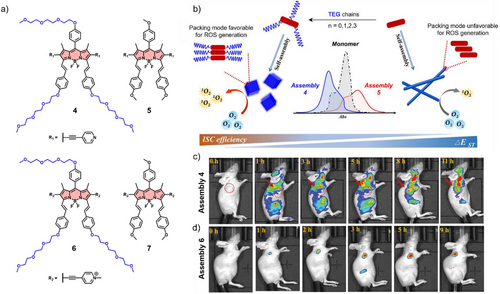
一、 H-型聚集:利用“淬灭”实现华丽转身
虽然 H-型聚集通常被认为会导致荧光消失,但聪明的科研人员利用这种“淬灭”特性开发出了智能荧光开关。
案例:肿瘤环境下的“死而复生”
Gogoi 团队设计了一种带有生物素(Biotin)的 aza-BODIPY(化合物 3)。在正常的生理盐水中,它以非发光的 H-型球形颗粒存在;一旦这枚“导弹”巡航到肿瘤区域,遇到过表达的亲和素(Avidin),颗粒就会发生解离。
数据分析显示: 这种从“聚集态”到“解离态”的转变,让原本关闭的荧光信号在 30 分钟内瞬间点亮,精准地标记出了肿瘤病灶的位置。
更令人吃惊的是,H-型聚集虽然不利于发光,却是杀伤癌症的“重型大炮”。
单线态氧产量飙升 75 倍! 研究对比发现,化合物 4 的 H-型组装体在光照下产生活性氧(ROS) 的效率比其 J-型异构体高出惊人的 75 倍。这意味着,它可以作为一种极其高效的光动力治疗(PDT)试剂,在成像的同时,利用光能直接将氧气转化为剧毒的活性氧,从内部“烧毁”肿瘤。
二、 J-聚集:开启“多模态”超能力的钥匙
J-型组装体是实现跨尺度成像的核心。由于能隙较窄,除了发光,它们还非常擅长将吸收的光能转化为热能(光热)或声能(光声)。
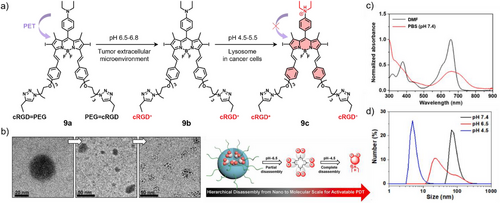
1. PTI(光热成像):精准的“局部高温”监测
化合物 10b 是一种经过 PEG 化修饰的铂配合物。在水中,它通过 J-型自组装形成了高度稳定的纳米颗粒。
实验数据表明: 在 660 nm 激光照射下,注入该物质的小鼠肿瘤局部温度能迅速提升。利用红外热成像仪,医生可以实时监控治疗区域的温度,确保在消融肿瘤的同时不伤害周围的健康组织。
2. PAI(光声成像):穿透力的绝对王者
光声成像是结合了“光”的高对比度和“声”的高穿透力的黑科技。当 J-型组装体吸收脉冲激光后,会产生微小的热膨胀并发出超声波。
由于声音在组织中的散射远小于光,化合物 13 展现出了厘米级的成像深度。在肿瘤生长 24 小时后,光声信号达到峰值,清晰地勾画出了血管分布和肿瘤内部的浸润情况。
三、 三模态合体:全能冠军的“黄金平衡”
真正的技术巅峰是开发出能够同时实现 FI(荧光)+ PAI(光声)+ PTI(光热) 三种功能的材料。
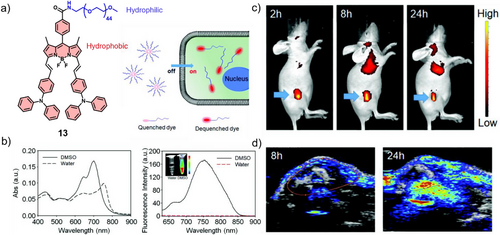
在综述整理的化合物中,化合物 17 堪称“全能战神”。Li 团队通过在 BODIPY 的 3、5 位点引入体积庞大的电子供体,巧妙地诱导了完美的 J-型聚集。
核心数据展示:
荧光量子产率:3.0%(保证了基本的高分辨率定位);
光热转换效率(PCE):54.9%(提供了强大的热杀伤和热成像能力);
单线态氧产量:40.76%(实现了高效的光动力治疗)。
这意味着,医生仅需使用一种药物,就能在术前通过荧光精确定位、术中通过光声评估浸润、术后通过光热/光动力手段彻底扫清残余癌细胞。
四、 路径复杂性:让纳米颗粒具备“智能导航”
这是整篇文献中最具科幻色彩的部分。所谓“路径复杂性”,是指同一个分子在不同的条件下可以自组装成形态完全不同的结构。
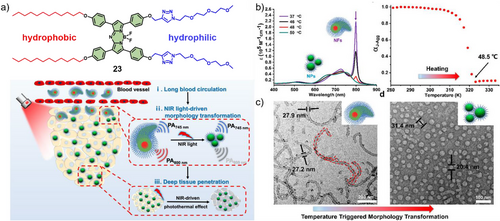
巡航时间延长 7.6 倍的秘密
由 Chen 和 Xing 团队报道的基于 aza-BODIPY 的化合物 23,展示了令人惊叹的**“形态变身”**能力:
形态一(纳米纤维):在血液循环中,分子首先组装成长长的、像蠕虫一样的纳米纤维。由于这种形态不易被免疫系统捕捉,其在血液中的循环时间比普通球形粒子延长了 7.6 倍。
形态二(纳米颗粒):当纤维随血流到达肿瘤部位时,研究者利用近红外光进行轻微加热(约 48°C)。这种热刺激触发了“路径切换”,让长纤维迅速瓦解并重组成微小的球形纳米颗粒。
深度渗透:这些微小的球体具备极强的组织穿透力,能像钉子一样钉入肿瘤最深处。
这种动态调节能力,让自组装体不再是死板的染料堆积,而是一枚能够根据作战阶段自动调整姿态的“智能巡航导弹”。
总结与展望:实验室到临床还有多远?
尽管 (aza)BODIPY 的自组装体在各项实验数据上表现出了压倒性的优势,但我们要客观地看到,从试管走向手术室依然充满挑战。
1. 生产的“克隆”难题
自组装本质上是分子的自发行为。虽然我们在实验室里可以精确控制每一毫克样品的质量,但在工业化的大规模生产中,如何保证每一批次纳米颗粒的尺寸、形态和堆叠模式完全复刻?这是目前制约该技术临床转化的头号技术瓶颈。
2. 长期安全性的“黑匣子”
虽然目前的动物实验表明这些有机分子具有良好的生物相容性,但如此复杂的超分子组装体在人体内的代谢路径、是否会在特定器官(如肝脏或肾脏)产生长期积蓄,仍需要开展大规模的毒理学评价。
3. 社会影响:从“模糊”到“高清”的医学未来
展望未来,基于这些先进自组装技术的造影剂将彻底颠覆肿瘤手术的图景。
术中导航:医生将不再仅凭肉眼辨别组织边界,而是通过特制的智能眼镜,即时看到被“荧光”标记的微小病灶。
一体化治疗:诊断即治疗。在确认肿瘤位置的一瞬间,激光功率的微调即可开启光热或光动力模式,将威胁消灭在萌芽状态。
总而言之,通过超分子自组装对 (aza)BODIPY 进行能级和堆叠方式的精准调控,绝不仅仅是化学家在实验室里的“拼图游戏”。 它们代表了人类探索微观世界、对抗致命疾病的最新高度。随着“路径复杂性”等新概念的深入研究,我们有理由相信,那双能看穿生命深处的“火眼金睛”很快就会成为医生的标准配置。