【Angew.Chem.】零背景”肿瘤手术导航:中国团队如何让荧光信噪比暴增至18.5倍,实现“像素级”精准切除?
✨文章标题:Ferroptosis-Impelled NIR Cyanine Dyes in Situ Generation Enabled Zero-Background Fluorescence Imaging and Precise Surgical Tumor Excision ✉️作者:Prof. Dr. Zan Li, Prof. Dr. Fengli Qu 等 🔗链接:https://doi.org/10.1002/anie.202520221
🔬 从“痛点”到“突破”:癌症手术中的“看不清”难题
想象一下,外科医生在切除恶性肿瘤时,就像在迷雾中寻路。尽管现代医学技术发达,但一个持续困扰临床的“视觉”问题依然存在:如何高精度、实时地将肿瘤组织与健康组织区分开来?
传统的荧光成像技术,虽然能帮助医生定位病灶,但往往伴随着一个致命的缺陷——“高背景”荧光干扰。这就像你对着一块布满星星的夜空拍照,想拍出你手中那盏微弱的信号灯。人体内自身存在的生物分子(比如血液和组织中的卟啉类物质),会自发产生荧光,形成一片“光污染”,学术上称之为“非特异性探针激活”或“高背景”干扰。
这种“高背景”严重拖累了信噪比(Signal-to-Noise Ratio),导致假阳性信号增多,最终影响了医生对肿瘤边界的判断,尤其是对于那些微小、浸润性的癌细胞,极易造成切不干净或过度切除的窘境。
现在,中国科研团队正是瞄准了这一临床痛点,提出了一项颠覆性的“零背景”荧光成像策略,旨在将手术视野的信噪比提升到前所未有的高度。他们不仅提供了一种新的肿瘤诊断工具,更提供了一种影像-治疗协同调控的新范式。
💡 核心方法与技术细节:用肿瘤的“自我毁灭”指令点亮导航灯
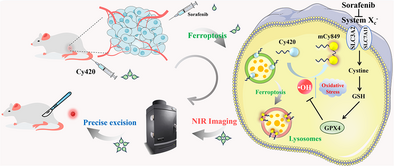
这项研究的创新,在于其机制的巧妙性:它不依赖于简单的荧光标记,而是利用肿瘤细胞的“自杀”过程——铁死亡(Ferroptosis)——作为生物催化剂,在肿瘤内部 “现场”合成出一种高亮度的近红外荧光染料。
铁死亡:肿瘤的“生锈自杀”
首先,我们需要理解“铁死亡”。这是一种由脂质过氧化和铁离子代谢失衡引发的程序性细胞死亡方式。简而言之,就是细胞内部的“铁”超载,导致产生大量的羟自由基 (OH)。羟自由基 (OH)是活性氧(ROS)中最强效的氧化分子,是引发脂质过氧化的关键一环,被认为是铁死亡发生的“枢纽效应分子”。
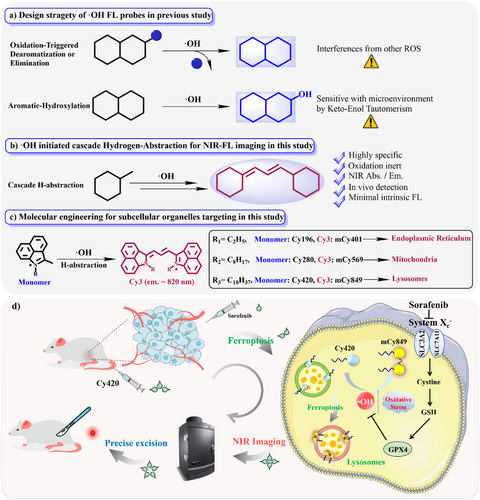
探针设计:从“不发光”到“超亮”的魔术
研究团队设计的核心是Cy420单体(monomer),它在被注射到体内时,几乎不发出近红外(NIR)荧光。Cy420就像一个 “休眠”状态的荧光探针前药。
它的激活钥匙,正是铁死亡过程中产生的羟自由基(OH)。
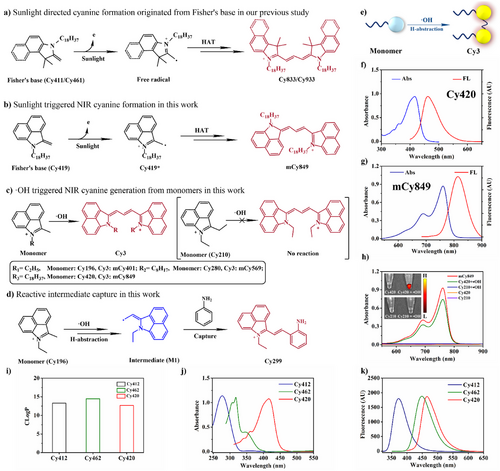
在铁死亡的微环境中,Cy420会通过一个独特的“羟自由基引发的级联夺氢反应(H-abstraction)”,发生异源二聚化。这个化学过程就像一个精密的组装流水线:两个不发光的Cy420单体,在羟自由基的催化下,迅速“焊接”起来,就地合成出一种全新的、拥有极强近红外发射能力的mCy849染料(一种三甲基花青染料,Cy3)。
🎯 目标定位:精准锁死溶酶体
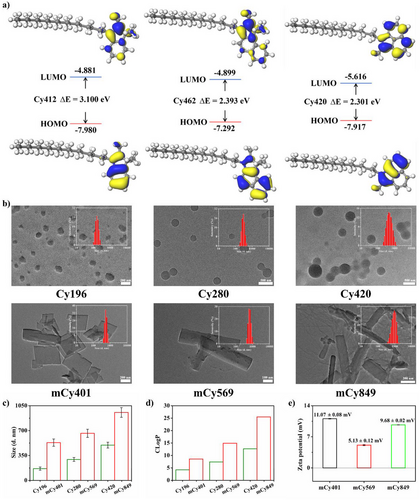
Cy420的成功,还依赖于精巧的“分子工程”设计。科研人员在Cy420的分子骨架上接上了十八烷基长链()。
这条长链赋予了Cy420两个关键特性:
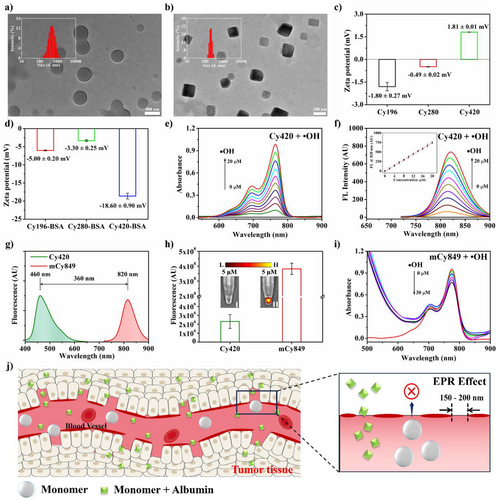
形态控制与肿瘤靶向: 在血液循环中,Cy420单体首先自组装成球形纳米颗粒,但在与血清白蛋白(BSA)结合后,其形态会重塑为更小的、单分散的方形纳米结构,直径约为 纳米。这种150-200纳米的尺寸范围,极其利于通过增强渗透和保留效应(EPR Effect)在肿瘤组织中高效富集。
亚细胞定位: 这种长烷基链设计,使得Cy420能被细胞通过网格蛋白介导的内吞途径(CME)摄取,并最终精准地聚集到细胞的溶酶体中。
为什么是溶酶体?因为有研究表明,索拉非尼(Sorafenib,一种肝癌靶向药)正是通过促进铁蛋白自噬,导致溶酶体内的活性铁离子() 聚集,从而在溶酶体这个酸性微环境内大量生成 OH,引发铁死亡。
因此,Cy420被设计成一个完美的三重奏探针:EPR效应实现肿瘤宏观靶向 十八烷基链实现溶酶体亚细胞定位 溶酶体内的 OH实现原位激活和荧光爆发。
“零背景”原理:波长的魔术与结构的自卫
这项策略之所以能实现“零背景”,主要基于两大机制:
巨大的波长差: 休眠的Cy420单体主要发出蓝色荧光(发射峰460 nm),而激活后生成的mCy849二聚体则发出近红外荧光(发射峰820 nm)。两者之间360 nm的巨大波长差,彻底避开了生物组织中常见的短波长背景荧光干扰,实现“零背景”成像。
强大的“自卫”能力: 生成的mCy849染料继承了Cy420的两个十八烷基长链(双十八烷基链),这种极强的疏水性使其自组装成规整的矩形纳米结构。这种紧密堆积的结构形成了强大的空间位阻,使其对后续不断生成的 OH 氧化攻击具有极强的抵抗能力,从而确保了荧光信号的准确性和持久性。
📈 数据背后的创新与颠覆性:18.5倍的信噪比突破
如果说理论是蓝图,那么实验数据就是支撑起整栋大楼的钢筋。这项研究通过大量的体内外实验,用一组令人震撼的数字,证明了其“零背景”策略的颠覆性。
1. 超高灵敏度与稳定性
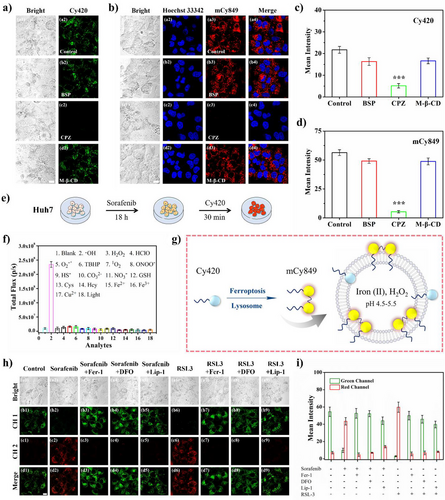
Cy420对羟自由基 (OH)的检测限(Detection Limit)被计算为176.12 nM,这是一个超高灵敏度的数值,意味着它能够对肿瘤微环境中痕量的羟自由基进行精确量化。
更重要的是,在细胞层面,Cy420的 NIR 荧光信号(激活后的mCy849)比其单体(Cy420)的荧光强度增强了165倍。这种由无信号到强信号的巨大转变,为“零背景”荧光提供了坚实的“开关”基础。
2. 体内成像性能:TBR值历史性突破
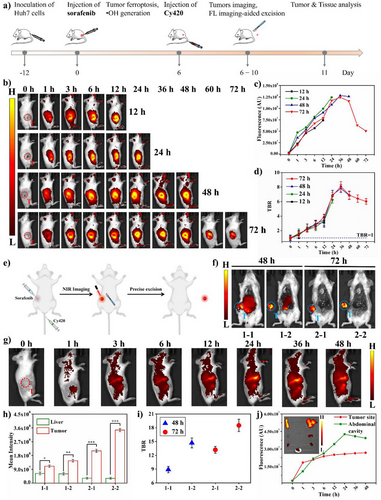
在体内实验中,研究团队选择了索拉非尼(Sorafenib) 预处理的肝癌(Huh7)异种移植小鼠模型,来诱导肿瘤发生铁死亡。
这是最关键的数据:肿瘤与背景组织的对比度(Tumor-to-Background Ratio, TBR)。TBR值是衡量手术导航探针性能的黄金标准。
Cy420组的优异表现: 在索拉非尼预处理后,静脉注射Cy420探针的小鼠,其肿瘤部位的近红外荧光信号显著增强,并在72小时时达到峰值。此时,肿瘤部位的TBR值达到惊人的 。
手术切除后的“像素级”提升: 这一TBR值在进行荧光引导下的肿瘤切除后,被进一步提升。在72小时组,术前TBR为 ,而切除后暴露出的肿瘤部位TBR值飙升至 。
这意味着什么?
传统上,TBR值大于2就被认为是有效的,而这项研究实现的18.5倍对比度,代表了在实时体内成像和手术导航领域的一次历史性突破。它意味着医生在术中可以获得前所未有的“像素级”清晰度,能极高对比度地区分肿瘤组织与周围的正常组织。
3. 完美的时间窗口与高效清除
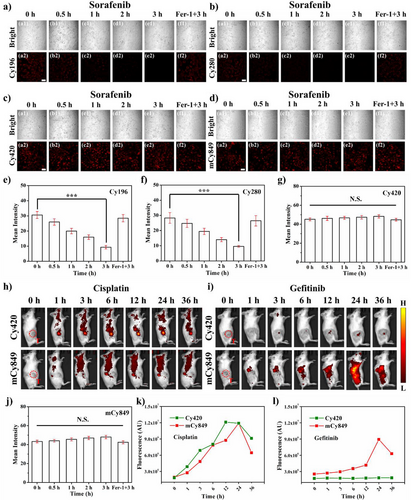
手术导航不仅要看得清,还要看对时机。研究发现,Cy420的体内清除非常高效。在48小时和72小时,Cy420在肿瘤部位富集,同时在正常器官中的代谢清除几乎完成。
在72小时时,肿瘤与肝脏(荧光主要代谢器官)的荧光信号比值达到了6.622。这表明探针在正常器官中已基本代谢完毕,最大限度地减少了正常组织的背景干扰。
相比之下,传统的对照分子mCy849(直接注射生成的Cy3染料),由于缺乏 Cy420 巧妙的自组装和靶向机制,缺乏肿瘤趋向性,荧光主要集中在腹腔(肝脏/脾脏),无法实现肿瘤特异性的高对比度成像。
这证明了Cy420的 “零背景”优势不仅来自于化学激活,更来自于其分子工程设计带来的双重清除机制:未激活的单体被代谢清除,激活的二聚体在肿瘤富集。
4. 短链探针的佐证:分子工程的重要性
为了证明长链的重要性,研究还比较了短链探针Cy196(乙基,靶向内质网)和Cy280(辛基,靶向线粒体)。
实验结果显示,Cy196和Cy280的荧光信号最大强度和最优TBR(分别为2.2和3.7),都显著低于长链Cy420组,且信号衰减快。
这个对比实验完美地证明了分子工程的长链设计(C18)不仅赋予了Cy420精准的溶酶体定位能力,更是实现EPR效应富集、CME内吞和二聚体氧化抵抗的关键,是达成超高TBR值的根本保证。
🚀 应用展望、局限性与未来路线图
这项研究成功建立了一个索拉非尼诱导铁死亡与Cy420原位合成NIR荧光探针的协同系统,为肿瘤手术导航和疗效评估提供了一个全新的、高特异性的工具。
潜在应用场景
高精度肿瘤手术导航: 倍的超高TBR值能帮助外科医生更清晰地辨认肿瘤边界和残余病灶,有望提高肿瘤的完全切除率(R0切除),降低术后复发风险。
抗癌药物疗效评估: OH 信号的动态监测(如图中荧光强度随索拉非尼作用时间的变化),为索拉非尼或其他铁死亡诱导剂的实时药效评估提供了客观、量化的指标。
铁死亡机制研究: 这一系列不同链长的探针(Cy196, Cy280, Cy420)能够靶向内质网、线粒体和溶酶体,为科学家在亚细胞层面研究铁死亡的起始和发展过程提供了有力的工具。
局限性与挑战
尽管这项研究令人鼓舞,但作为一篇深度科普,我们也必须客观地指出其局限性:
临床转化挑战: 迄今为止的实验主要基于小鼠异种移植模型。探针在人体内的药代动力学、毒理学和免疫原性,以及在人体内是否能保持同样的超高TBR表现,仍需大量的临床前和临床试验来验证。
药物依赖性: Cy420的激活依赖于索拉非尼或其他诱导剂引发的铁死亡。对于不适合使用索拉非尼或对铁死亡不敏感的肿瘤类型,其应用会受到限制。
NIR-II 窗口的局限: 虽然820 nm已属近红外范畴,能实现毫米级深度成像,但更深层次的组织成像可能需要波长更长的 NIR-II 区(1000-1700 nm)荧光探针。
未来路线图
研究团队已经明确了未来的方向,包括验证Cy420在耐药模型和转移病灶中的普适性,并探索将其集成到现有的临床术中导航系统中。
总而言之,这项工作提供了一种全新的思路:与其去寻找一个完美的、无背景的体外探针,不如设计一个能利用疾病本身的生物学信号,在病灶内部“即时打印”出高亮信号的“智能墨水”。这种“零背景”的影像-治疗协同策略,无疑为肿瘤的精准诊断和外科治疗,打开了一扇通往更高清晰度和更高治愈率的大门。