【Adv.Mater.】4 合 1 智能纳米马达!肝癌治疗效率飙升 90% 的新突破
✨文章标题:Mitochondria-Targeted Nanomotor: H2S-Driven Cascade Therapy for Hepatocellular Carcinoma ✉️作者:Zhongwei Zhao, Jiansong Ji, Hongbo Zhang 等 🔗链接:https://doi.org/10.1002/adma.202513757
打开新闻,肝癌相关的坏消息总是让人揪心。作为全球发病率第三的恶性肿瘤,它不仅早期症状隐蔽,治疗起来更是难题重重。传统化疗药物像 “不分敌我的炸弹”,在杀死癌细胞的同时,也会损伤正常细胞;单一的靶向治疗又容易让癌细胞产生耐药性,治疗效果往往不尽如人意。
就在 2025 年,《Advanced Materials》期刊刊登了一项颠覆性研究,来自中国和芬兰的联合科研团队研发出一种线粒体靶向纳米马达,能将四种治疗方式精准整合,对肝癌实现 “精准打击 + 协同作战”,实验中肿瘤消融率高达 90% 以上。这个被命名为Au₂Pt@4sMSN/PS-TPP@CM的纳米平台,就像为肝癌治疗量身打造的 “智能作战系统”,彻底打破了传统联合治疗的局限。
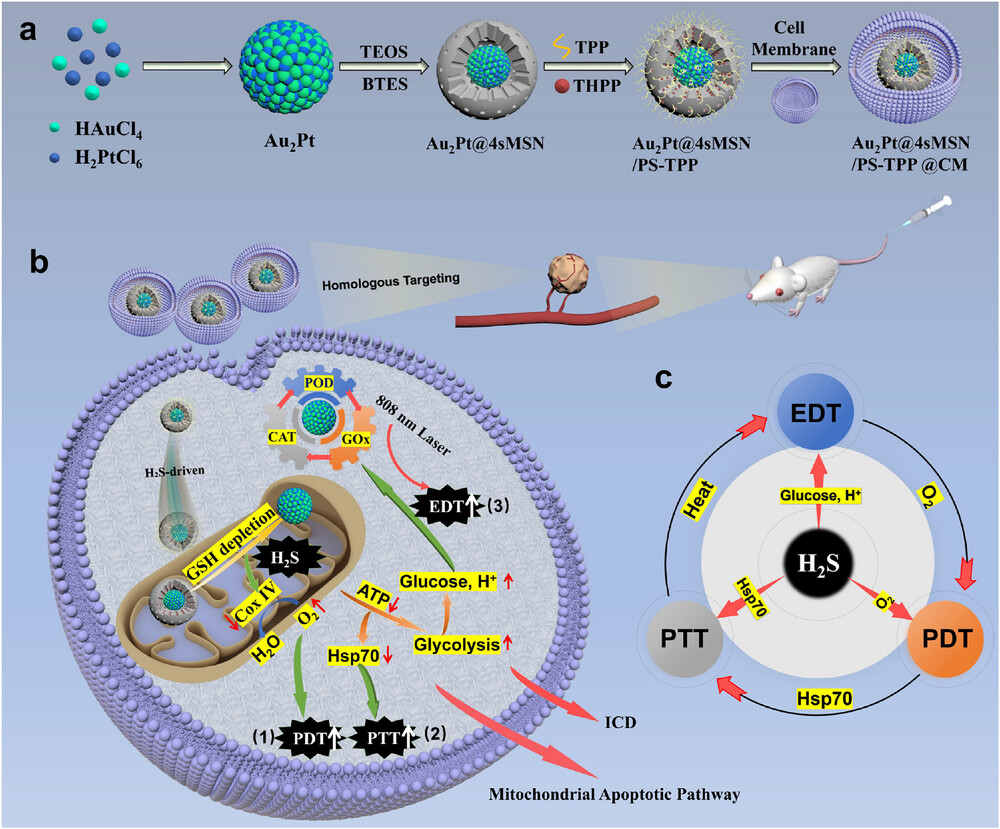
核心突破:为什么这个纳米平台能改写肝癌治疗规则?
要理解这个研究的革命性,首先得搞懂传统癌症治疗的 “致命短板”。不管是光动力治疗(PDT)、温和光热治疗(mPTT),还是酶动力学治疗(EDT)、气体治疗(GT),这些主流的单一治疗方式都有各自的 “软肋”。
光动力治疗需要氧气才能产生杀伤癌细胞的活性氧,但肿瘤微环境偏偏缺氧,就像消防员灭火却没了氧气;温和光热治疗(41-43℃)虽然副作用小,却会让癌细胞产生热休克蛋白 70(HSP70),这种蛋白就像癌细胞的 “防护盾”,能帮它抵御高温损伤;酶动力学治疗依赖催化剂反应,但肿瘤里的反应底物不足,效率大打折扣;而气体治疗中常用的硫化氢(H₂S),虽然能调节癌细胞代谢,但半衰期短、靶向性差,容易 “误伤友军”。
更关键的是,以往的联合治疗大多是 “简单叠加”,比如同时使用两种药物分别进行光动力和光热治疗,就像两支各自为战的军队,没有协同配合,甚至可能互相干扰。而这次研究的核心突破,就是打造了一个 “四位一体” 的协同作战系统,让四种治疗方式像精密配合的乐队,各司其职又相互赋能,形成自我强化的治疗循环。
这个纳米平台的另一个颠覆点,是找到了治疗的 “核心靶点”——线粒体。线粒体就像癌细胞的 “能量工厂”,负责生产癌细胞疯狂增殖所需的 ATP。如果能精准打击线粒体,就能从根源上瓦解癌细胞的生存基础。更妙的是,线粒体还是多种治疗信号的 “整合中心”,能同时响应气体、光、酶等多种治疗刺激,为四种治疗方式的协同提供了天然的 “作战指挥中心”。
技术拆解:纳米马达的 “智能作战” 设计
这个让癌细胞闻风丧胆的 “纳米马达”,结构设计堪称精密工程。它就像一个微型的 “多功能作战机器人”,从核心到外层,每一部分都有明确的作战分工,还具备精准导航和环境响应能力。
核心:三酶合一的 “能量攻击手”
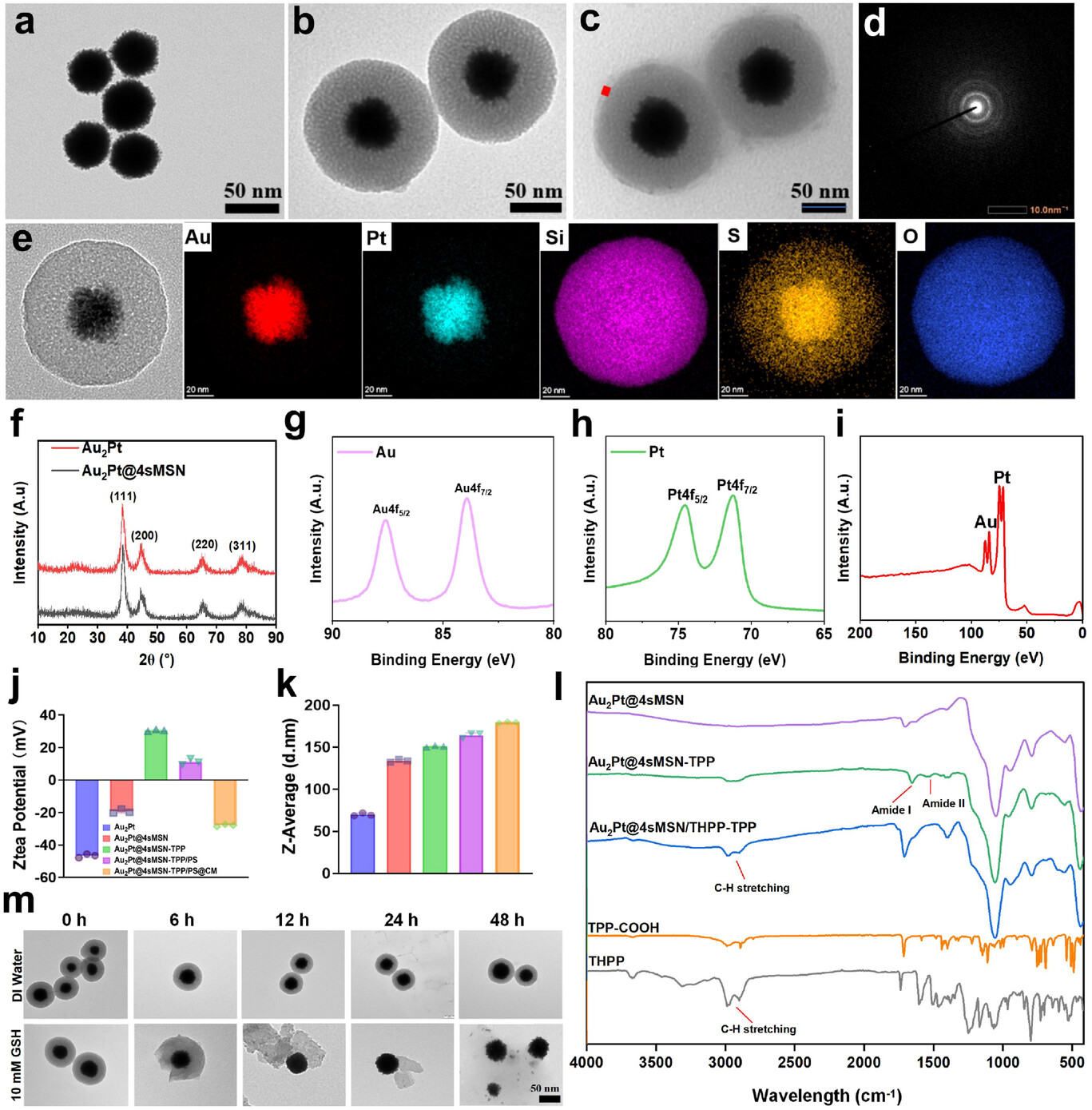
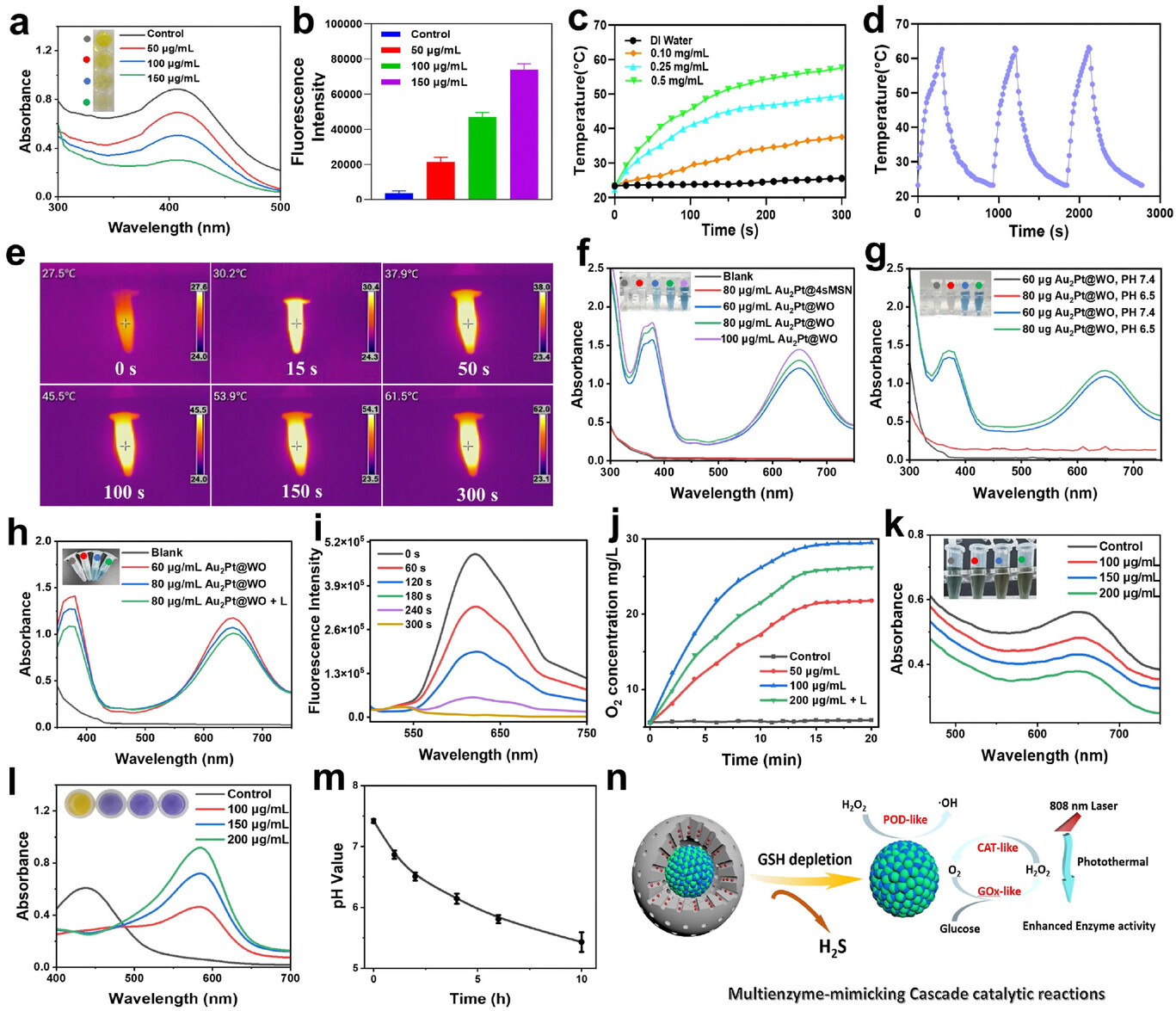
纳米马达的核心是Au₂Pt 合金纳米材料,直径约 50 纳米,差不多是头发丝直径的千分之一。这个核心可不是普通的金属颗粒,而是具备三种酶活性的 “超级催化剂”——葡萄糖氧化酶(GOx)、过氧化氢酶(CAT)和过氧化物酶(POD),相当于同时拥有三个 “攻击技能”。
葡萄糖氧化酶能像 “收割机” 一样,消耗癌细胞赖以生存的葡萄糖,一方面切断癌细胞的能量供应(饥饿疗法),另一方面产生过氧化氢(H₂O₂)和氢离子(H⁺);过氧化氢酶则能将产生的 H₂O₂分解为氧气和水,既解决了光动力治疗的缺氧难题,又能为葡萄糖氧化酶的反应提供持续动力;过氧化物酶则能利用 H⁺和 H₂O₂,产生具有强氧化性的羟基自由基(・OH),直接破坏癌细胞的 DNA 和蛋白质,实现化学动力学治疗。
这三种酶的协同作用,形成了一个 “自我循环的催化级联反应”,就像一个微型工厂,持续不断地生产治疗所需的 “弹药”,同时消耗癌细胞的 “补给”。
中层:智能响应的 “弹药库 + 防护壳”
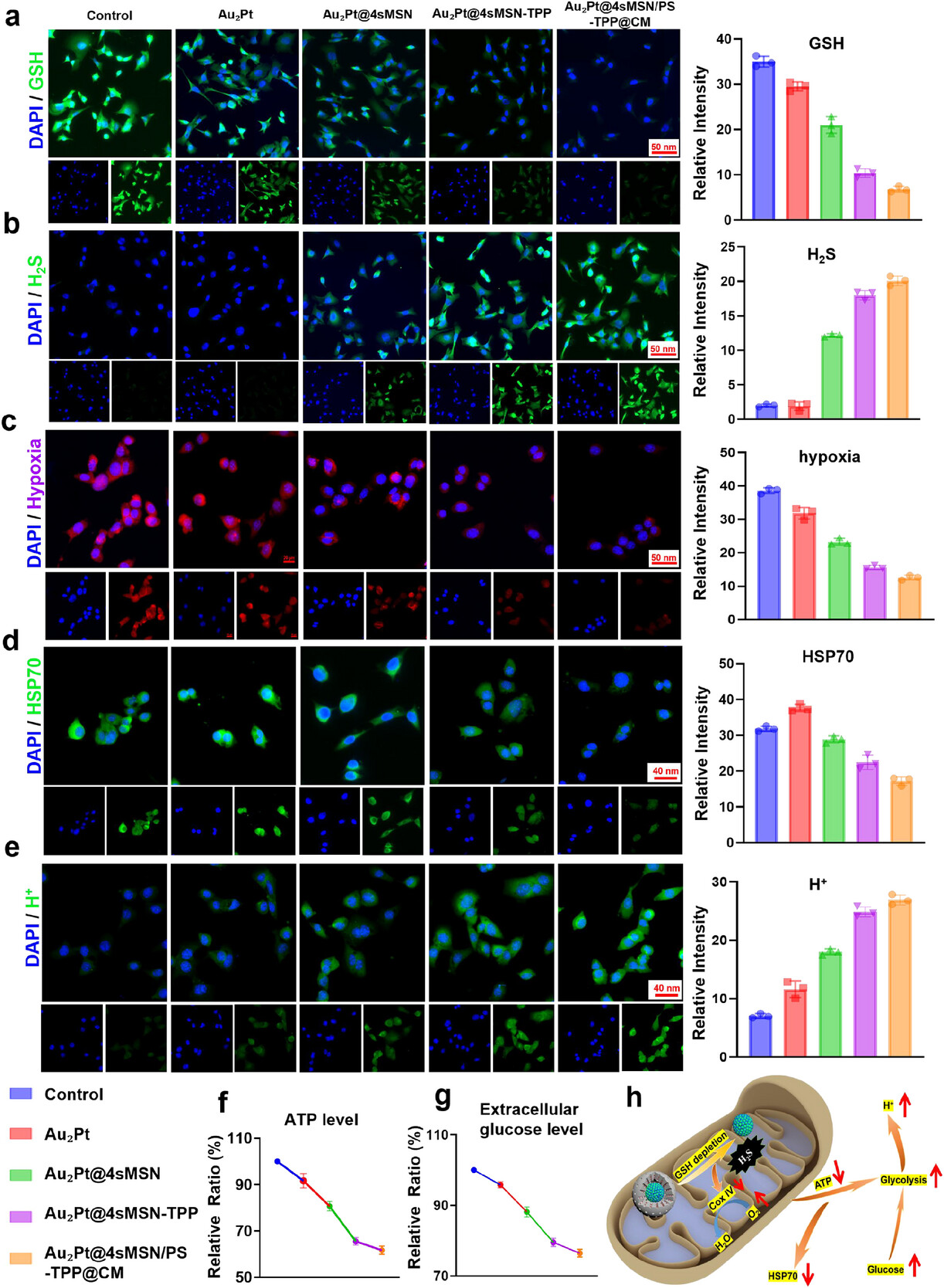
包裹在核心外面的,是一层四硫键连接的介孔二氧化硅壳(4sMSN),厚度约 40 纳米,上面布满了 2.5-4 纳米的微小孔洞。这个外壳有两个关键作用:一是作为 “弹药库”,装载光动力治疗所需的光敏剂(THPP);二是作为 “智能防护壳”,只有在肿瘤微环境中才会降解。
肿瘤细胞内的谷胱甘肽(GSH) 浓度是正常细胞的 10-100 倍,而四硫键对 GSH 高度敏感。当纳米马达进入肿瘤细胞后,高浓度的 GSH 会像 “钥匙” 一样,打开四硫键构成的 “防护壳”,一方面释放出里面的光敏剂,另一方面产生治疗所需的硫化氢(H₂S)气体,同时还能消耗癌细胞的 GSH—— 要知道 GSH 是癌细胞的 “抗氧化盾牌”,消耗它能让癌细胞失去对氧化损伤的抵抗力。
这种 “环境响应式释放” 设计,完美解决了传统药物 “不分敌我” 的问题,确保治疗只在肿瘤部位发生,对正常细胞几乎没有伤害。
表层:精准导航的 “定位系统”
为了让纳米马达精准找到癌细胞的线粒体,研究团队在外壳表面做了两层 “导航修饰”。第一层是三苯基膦(TPP),这是一种经典的线粒体靶向分子,就像给纳米马达装上了 “精准定位器”。
线粒体膜具有特殊的电位差,TPP 能像磁铁一样被线粒体吸引,带领纳米马达精准抵达目标位置。第二层是肿瘤细胞膜(CM)涂层,厚度约 5 纳米,相当于给纳米马达穿上了 “隐身衣”。
这层来自肿瘤细胞的膜,能让纳米马达避开人体免疫系统的 “巡逻兵”,同时利用 “同源靶向” 原理,让纳米马达更容易被同类肿瘤细胞识别和吸收,大大提高了肿瘤部位的富集效率。
动力:气体驱动的 “自主推进器”
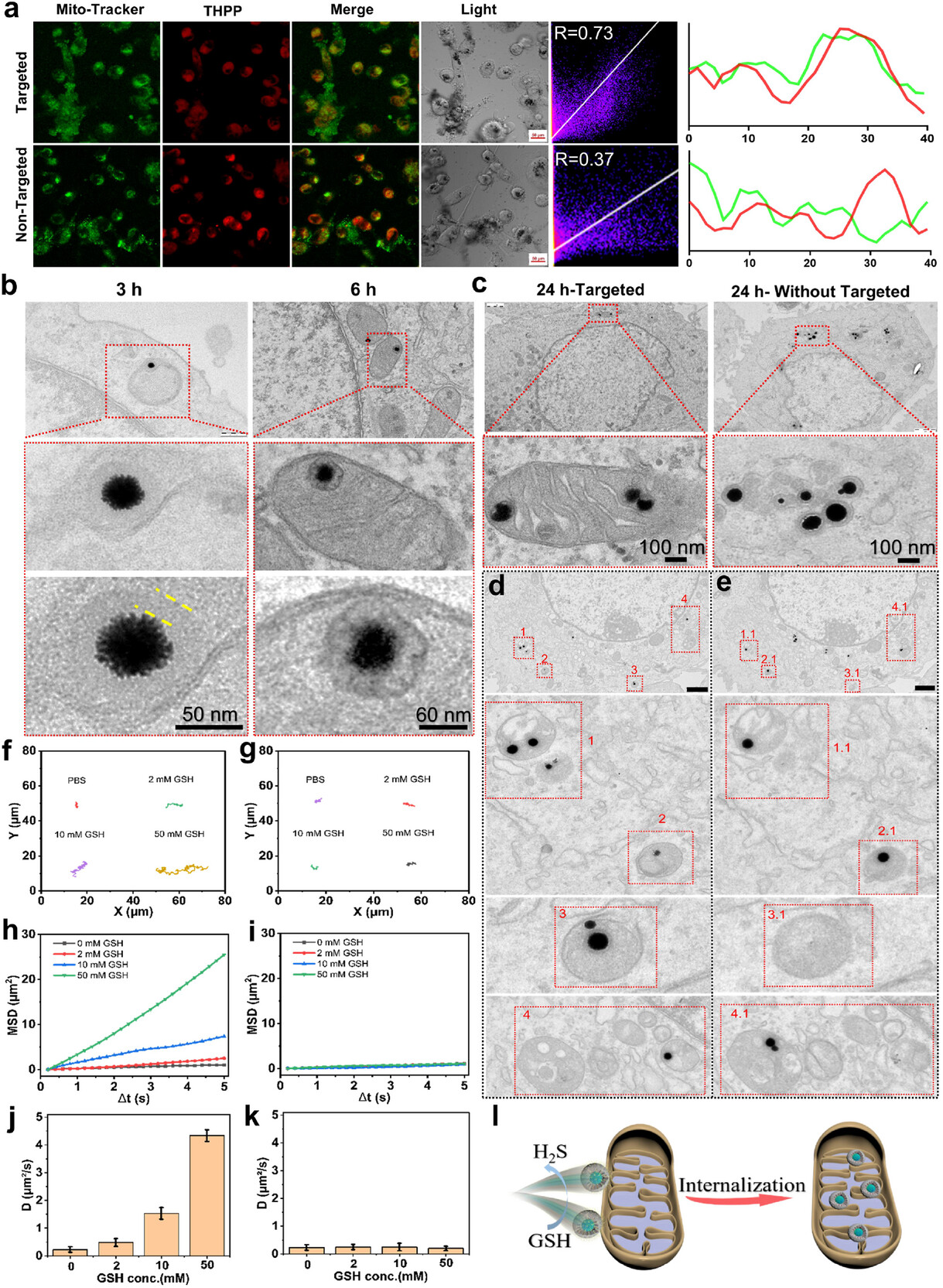
更令人惊叹的是,这个纳米马达还具备 “自主运动能力”。当四硫键被 GSH 切断产生 H₂S 气体时,气体的释放会产生微弱的推力,就像火箭发射一样,推动纳米马达向线粒体方向移动。
这种 “化学驱动” 的运动方式,解决了传统纳米颗粒只能被动扩散的问题,让直径超过 100 纳米的纳米马达,成功突破了线粒体膜的屏障,实现了线粒体的内化 —— 这在以往的研究中是很难实现的,因为大于 100 纳米的颗粒通常无法进入线粒体。
数据解读:90% 肿瘤消融率背后的硬核实力
实验室里的巧妙设计,最终需要实打实的数据来验证。研究团队通过一系列体外细胞实验和体内动物实验,用严谨的数据证明了这个纳米平台的治疗实力,每一项数据都彰显着它的颠覆性。
靶向效率:线粒体富集率提升 1 倍
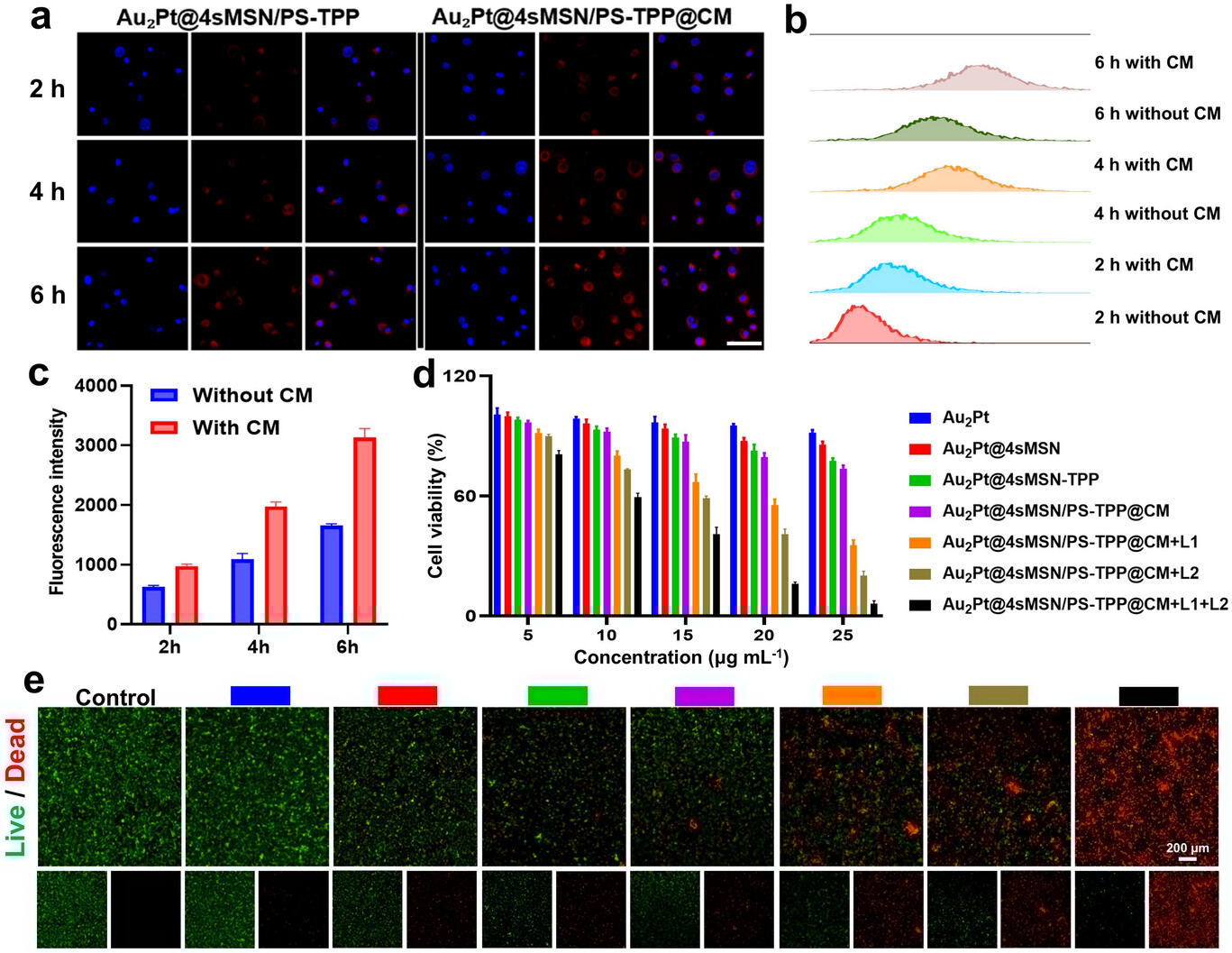
要实现精准治疗,首先要让药物精准到达靶点。实验数据显示,经过 TPP 修饰的纳米马达,与线粒体的共定位系数(Pearson's R)达到0.73,而没有 TPP 修饰的对照组仅为 0.37。
这意味着,有了 TPP 这个 “定位器”,纳米马达找到线粒体的概率提升了一倍以上。通过生物透射电镜(Bio-TEM)观察,研究人员清晰地看到,纳米马达在 6 小时后开始进入线粒体,24 小时后大部分都成功定位在线粒体内,并且外壳已经完全降解,开始发挥治疗作用。
这种精准的靶向能力,让治疗药物能集中在癌细胞的 “能量工厂” 附近,避免了药物在体内的无效扩散,大大提高了治疗效率,同时降低了对正常细胞的损伤。
协同治疗:细胞存活率仅 13.47%
在体外细胞实验中,研究团队测试了不同治疗方式的效果。当使用20μg/mL 的纳米马达,同时施加 808nm 激光(光热治疗)和 660nm 激光(光动力治疗)时,肝癌细胞(Hepa1-6)的存活率仅为13.47%。
而单独使用纳米马达(气体治疗 + 酶动力学治疗)时,细胞存活率为 74.71%;单独使用光热治疗时效果更差,细胞存活率仍有较高水平。这组数据清晰地表明,四种治疗方式的协同作用,产生了 “1+1+1+1>4” 的治疗效果,不是简单的叠加,而是相互促进、放大的协同效应。
进一步的机制研究发现,这种协同效应来自于一个自我强化的循环:光热治疗产生的温和高温,能增强纳米酶的催化活性,产生更多氧气,从而提升光动力治疗的效果;光动力治疗产生的活性氧,又能破坏线粒体的功能,减少 ATP 的产生,进而降低 HSP70 的表达,让癌细胞对光热治疗更敏感;而气体治疗产生的 H₂S,既能抑制线粒体的氧化磷酸化,缓解缺氧,又能促进癌细胞的糖酵解,为酶动力学治疗提供更多底物。
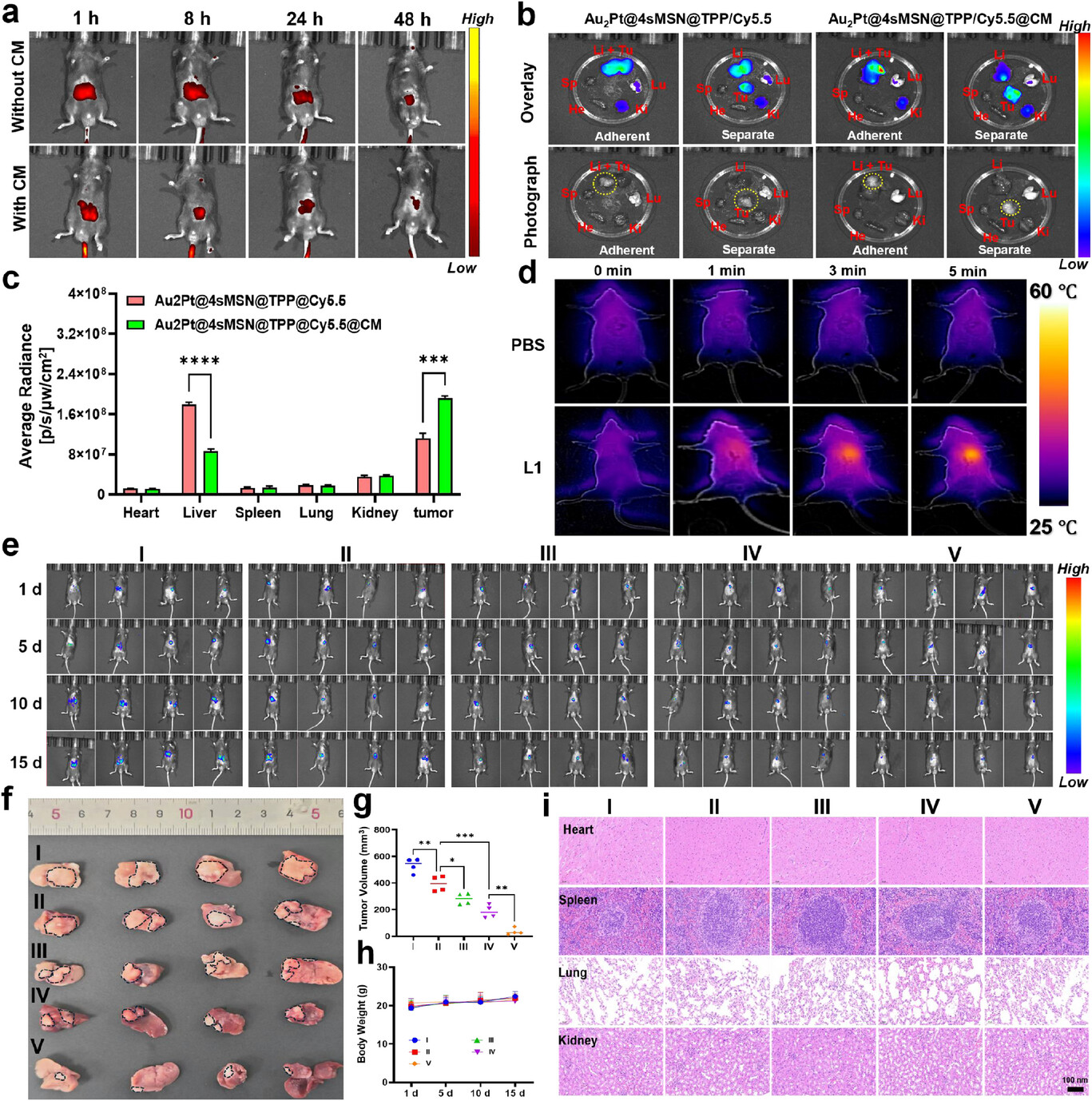
体内疗效:肿瘤体积缩小 90% 以上
在小鼠原位肝癌模型中,治疗效果更是令人振奋。经过 15 天的治疗,联合治疗组(纳米马达 + 双激光) 的肿瘤几乎被完全消融,肿瘤体积较对照组缩小了90% 以上。
通过生物发光成像可以看到,对照组的肿瘤在 15 天内快速增殖,而联合治疗组的肿瘤信号逐渐减弱,最终几乎检测不到。更重要的是,在整个治疗过程中,小鼠的体重没有出现明显下降,主要器官(心、肝、脾、肺、肾)的组织切片经 H&E 染色后,没有发现明显的病理损伤,证明这个纳米平台具有良好的生物相容性和安全性。
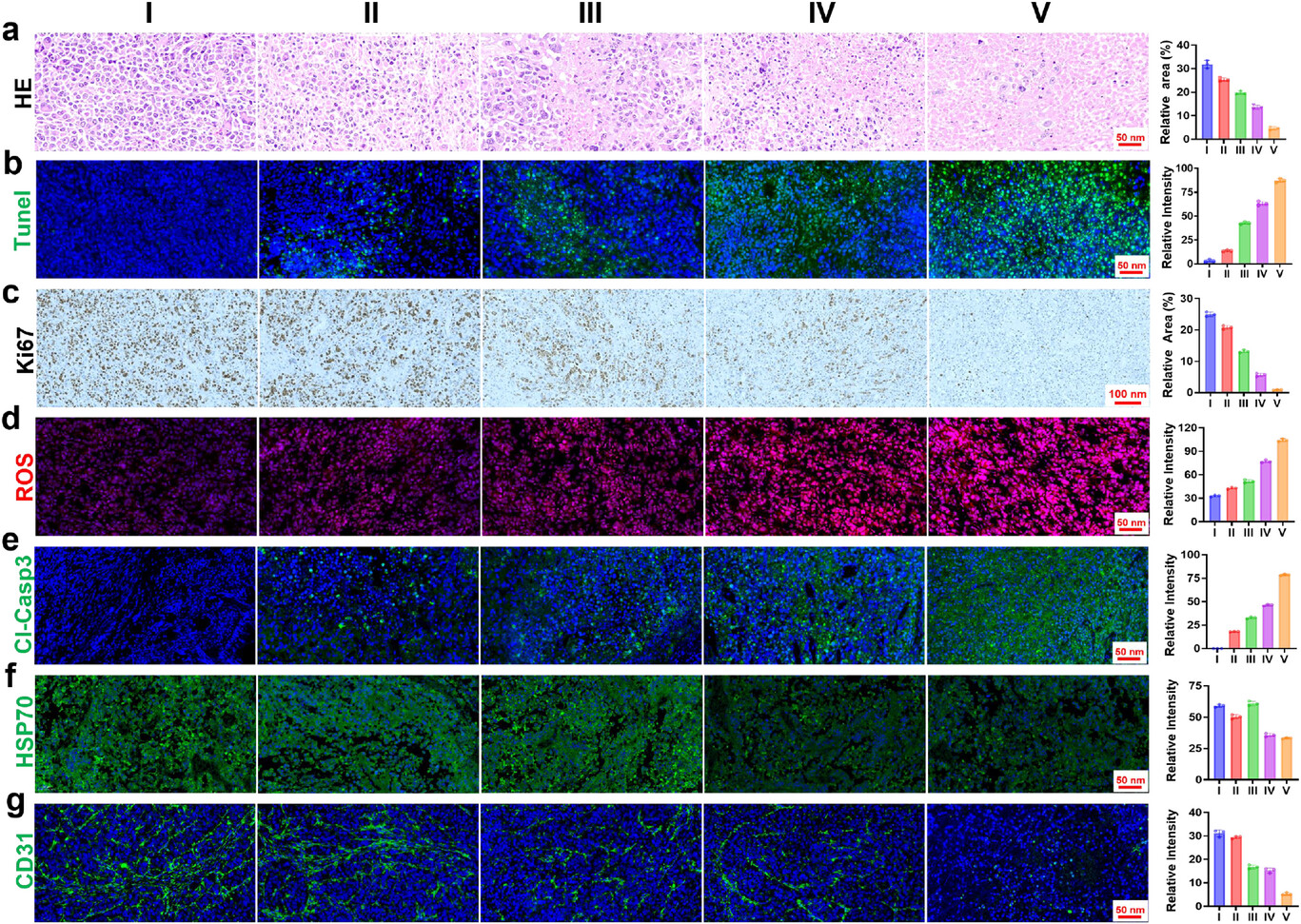
进一步的组织学分析显示,联合治疗组的肿瘤组织中,癌细胞出现了大量凋亡(TUNEL 染色阳性率显著升高),增殖能力被显著抑制(Ki-67 表达降低),同时肿瘤血管被大量破坏(CD31 染色显示血管密度大幅下降),这意味着肿瘤的 “补给线” 被切断,无法继续增殖和转移。
免疫激活:引发长效抗癌免疫
除了直接杀伤癌细胞,这个治疗平台还能激活机体的免疫系统,形成 “长效抗癌记忆”。研究发现,治疗后肿瘤组织中 CD4⁺和 CD8⁺T 细胞的浸润明显增加,这些免疫细胞能持续监视和清除可能残留的癌细胞,有效防止肿瘤复发和转移。
这是因为光动力治疗和光热治疗能引发免疫原性细胞死亡(ICD),让癌细胞释放出 “危险信号”,激活免疫系统。这种 “治疗 + 免疫” 的双重效应,是传统治疗方法很难实现的,为肝癌的根治提供了新的可能。
未来展望:从实验室到临床,还有哪些可能?
这项研究无疑为肝癌治疗带来了革命性的突破,但从实验室走向临床应用,还需要解决一些挑战。首先,纳米马达的大规模制备需要进一步优化,降低生产成本,确保批次间的一致性;其次,虽然在小鼠模型中表现出良好的安全性,但人体的生理环境更为复杂,需要进行更全面的毒理学研究;最后,治疗过程中需要精准控制激光的剂量和照射时间,这需要开发更精准的临床治疗设备。
不过,这些挑战并没有阻挡这项技术的应用前景。除了肝癌,这个纳米平台还可以通过调整靶向分子和治疗药物,应用于其他实体肿瘤的治疗,比如肺癌、乳腺癌、结肠癌等,具有广泛的适用性。
在未来的研究中,研究团队还计划将这个平台与免疫检查点抑制剂结合,进一步增强免疫系统的抗癌能力,实现对晚期癌症的有效治疗;同时,他们还在探索将纳米马达用于肿瘤的早期诊断,让纳米马达同时具备 “诊断 + 治疗” 的功能,实现癌症的精准诊疗一体化。
从长远来看,这项研究的意义不仅在于开发了一种新的肝癌治疗方法,更在于建立了一种 “多模态协同 + 线粒体靶向” 的治疗范式。它证明了通过精准的分子设计,可以让不同的治疗方式形成协同效应,突破单一治疗的局限,为癌症治疗提供了全新的思路。
对于肝癌患者来说,这项技术的临床转化,有望让肝癌从 “难治之症” 变为 “可治之症”,甚至实现 “根治” 的目标;对于整个生物医药领域来说,这种 “智能纳米马达” 的设计理念,也为其他疾病的治疗提供了借鉴,比如心血管疾病、神经退行性疾病等,具有深远的科学价值和社会意义。
随着技术的不断进步,我们有理由相信,在不久的将来,这种 “精准、协同、安全” 的纳米治疗平台,将走进临床,为更多癌症患者带来希望,改写人类与癌症斗争的历史。