【Adv.Mater.】300nm 超大 Stokes 位移!MOF 荧光材料让细胞成像再升级
✨文章标题:Photoswitchable Dual-Color Fluorescence With Large Stokes Shift From Dye-Encapsulated Metal-Organic Framework for Dynamic Cellular Imaging ✉️作者:Zhengluan Liao, Guodong Qian, Yuanjing Cui 等 🔗链接:https://doi.org/10.1002/adma.202518371
在生物医学成像领域,“看得清” 和 “看得深” 一直是科学家们追求的核心目标。就像我们用相机拍照时,会希望画面清晰无噪点、能捕捉到细节一样,细胞成像也需要荧光材料发出的信号足够纯粹、可精准调控。但长期以来,传统荧光材料要么只能发出单一颜色的光,容易受环境干扰;要么Stokes 位移(吸收光和发射光的波长差)太小,导致发射光被激发光 “掩盖”,成像对比度大打折扣。
如今,浙江大学等团队的研究带来了突破性进展 —— 他们研发出一种基于金属有机框架(MOF)的光响应双色荧光材料,不仅能实现绿色和红色的可逆切换发光,还拥有高达 300nm 的超大 Stokes 位移,为高分辨率、深度分辨生物成像打开了新大门。
核心背景:细胞成像的 “老大难” 问题
要理解这项研究的价值,首先得搞懂传统荧光成像面临的两大痛点。第一个痛点是 “信号干扰”,很多荧光材料只能实现 “亮” 和 “灭” 的单状态切换,这种单一的强度变化很容易受测量条件、材料浓度的影响,就像在强光下看手机屏幕,微弱的亮度变化根本难以察觉。
第二个更关键的痛点是 “Stokes 位移太小”。简单来说,Stokes 位移就像是荧光材料 “吸收” 光子后 “释放” 光子的能量差,反映在波长上就是吸收光和发射光的距离。如果这个距离太近,发射光就会被激发光的余光 “淹没”,还会出现光的再吸收和自猝灭现象,就像两个人在同一频率的收音机上说话,信号会相互干扰。传统双色荧光材料的 Stokes 位移通常很小,这让成像的对比度和灵敏度一直上不去,给细胞深处的精细结构观察带来很大困难。
此外,很多光响应材料只能在溶液中工作,一旦制成固体,分子排列太紧密,就无法实现有效的光致异构化(简单说就是光照下的结构变化),这也限制了它们在实际成像中的应用。科学家们一直渴望找到一种能同时解决 “信号可调”“位移够大”“固体可用” 的材料,而MOF 的出现让这个愿望成为可能。
核心方法:给荧光分子搭个 “智能骨架”
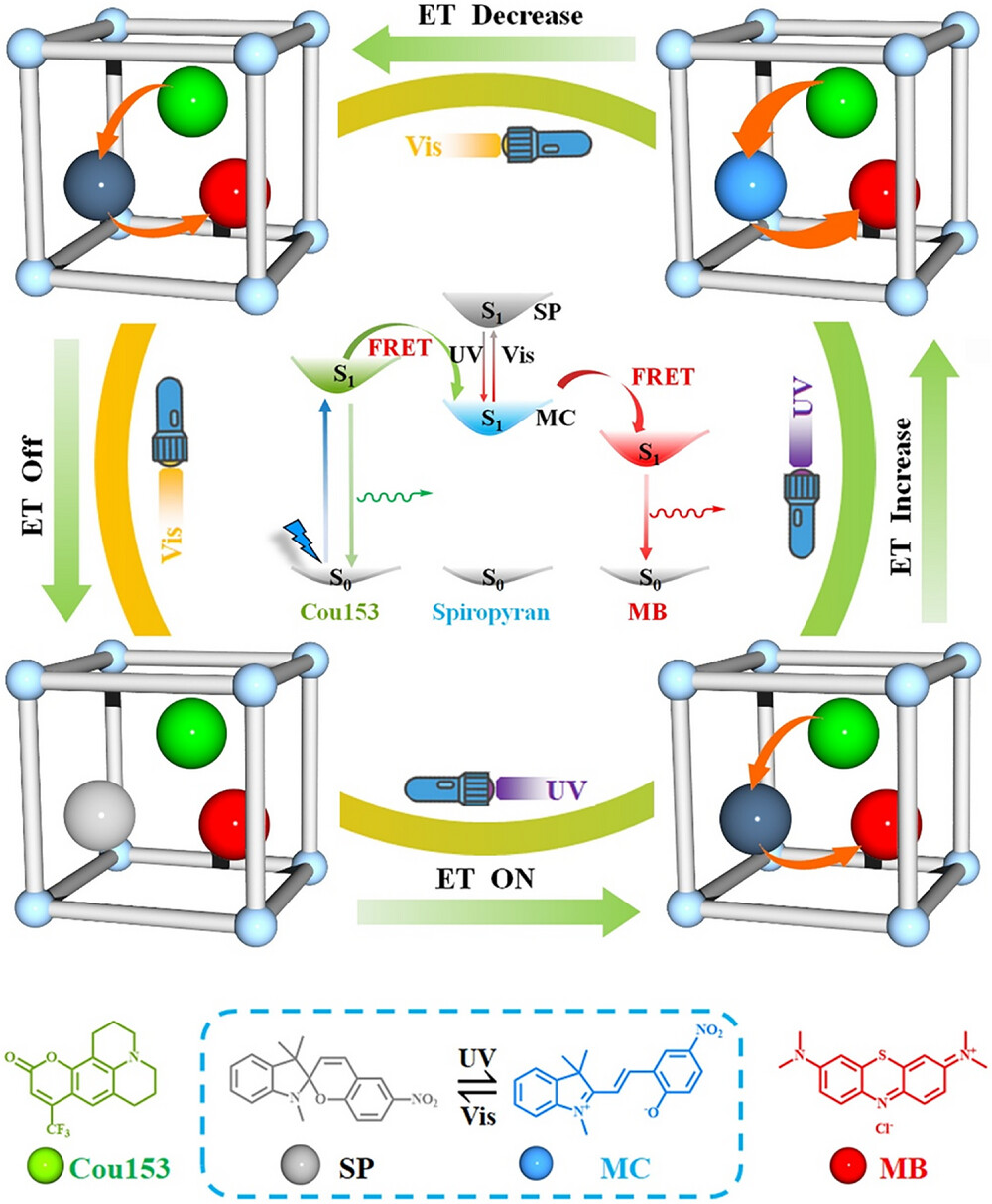
这项研究的核心创新,在于给三种关键分子搭建了一个 “量身定制” 的 MOF 骨架,通过级联能量转移实现了可控的双色发光。我们可以把这个过程想象成一个 “光控能量接力赛”,而 MOF 就是这场接力赛的专用赛道。
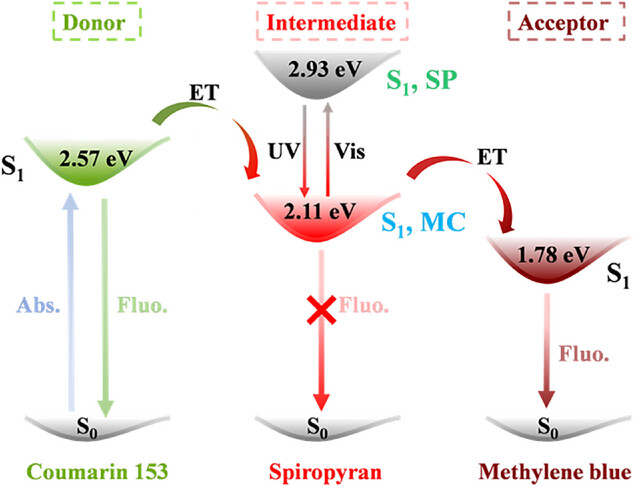
首先得认识一下这场 “接力赛” 的三个核心选手:第一种是香豆素 153(Cou153),它是整个系统的 “能量发起者”,吸收 400nm 左右的光后,会发出 516nm 的绿色荧光;第二种是亚甲基蓝(MB),是 “最终发光者”,接收能量后会发出 700nm 的红色荧光;最关键的第三种是螺吡喃(SP),它是 “能量开关”,能在紫外线和可见光照射下切换结构,决定能量是否能从香豆素 153 传递到亚甲基蓝。
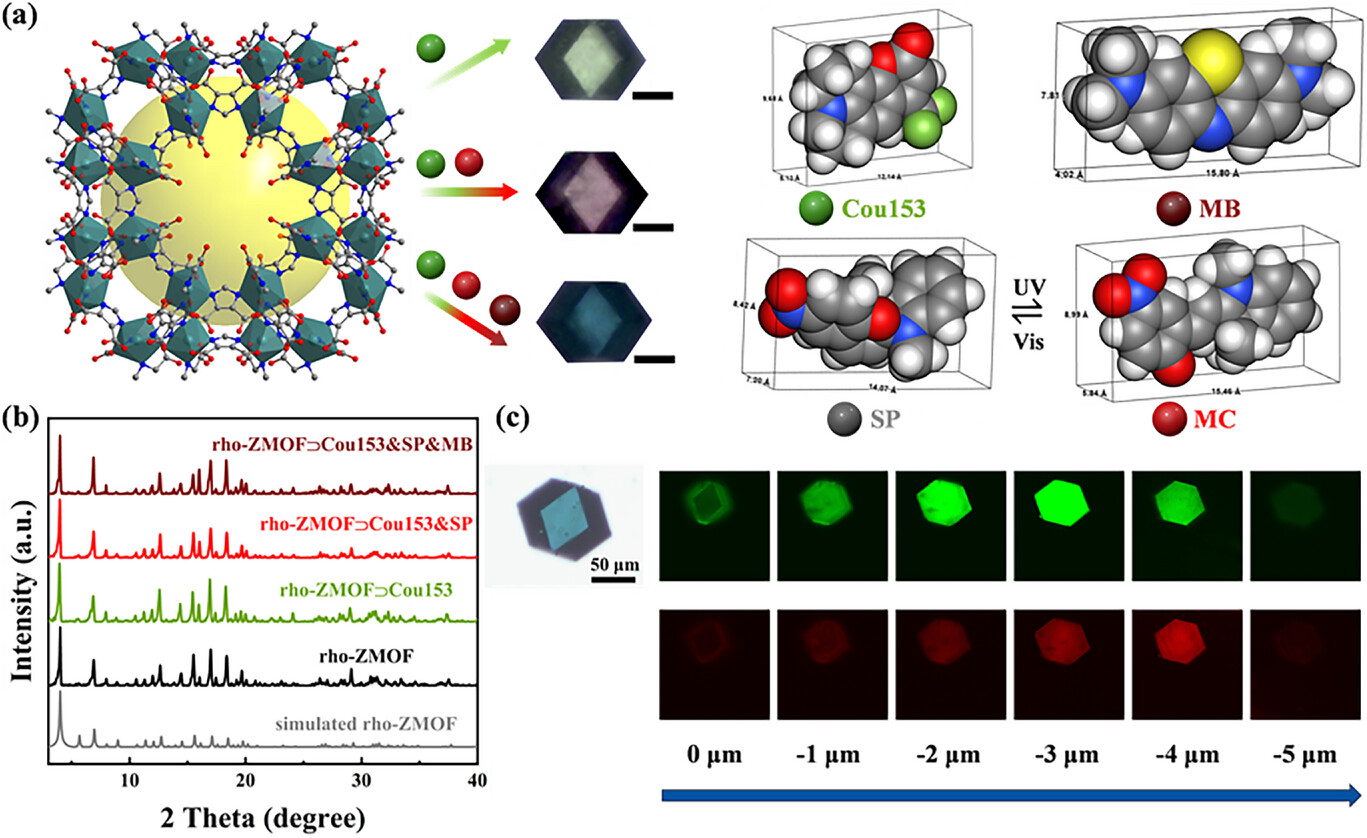
而 MOF 骨架(这里用的是rho-ZMOF)则是让这场接力赛顺利进行的关键。rho-ZMOF 有着规则的十二面体结构,内部有直径约18.2Å 的超大空腔,这个尺寸刚好能容纳上述三种分子,就像一个定制的 “分子公寓”。更重要的是,它的窗口尺寸约 8.7Å,既能让分子顺利进入,又能防止它们 “跑掉”,同时还能为分子提供足够的自由空间,保证螺吡喃能顺利完成光致异构化 —— 这解决了传统材料在固体中无法有效切换的难题。
研究团队通过溶剂热反应合成 rho-ZMOF 后,将三种分子的甲醇溶液与 MOF 晶体在 60℃下浸泡 12 小时,让分子通过孔隙进入 MOF 内部,最终形成了rho-ZMOF⊃Cou153&SP&MB 复合材料。通过调整溶液浓度,他们精准控制了三种分子在 MOF 中的含量,其中最优比例为 0.02wt.% 香豆素 153、1.03wt.% 螺吡喃和 0.16wt.% 亚甲基蓝。
这个设计的巧妙之处在于 “级联能量转移” 机制。当没有紫外线照射时,螺吡喃处于关闭的 SP 状态,此时它的激发态能量很高,香豆素 153 的能量无法传递给它,所以系统主要发出香豆素 153 的绿色荧光;当用 365nm 紫外线照射时,螺吡喃会变成打开的 MC 状态,激发态能量降低,香豆素 153 的能量先传递给 MC,再由 MC 传递给亚甲基蓝,此时绿色荧光减弱,红色荧光增强;而当切换到可见光照射时,螺吡喃又变回 SP 状态,能量传递中断,绿色荧光恢复 —— 整个过程实现了双色荧光的可逆切换。
数据解读:300nm 位移背后的硬核实力
一项技术是否具有突破性,最终要靠数据说话。这项研究的实验数据,全方位展现了这种新型材料的硬核性能,每一个关键数据都直击传统材料的痛点。
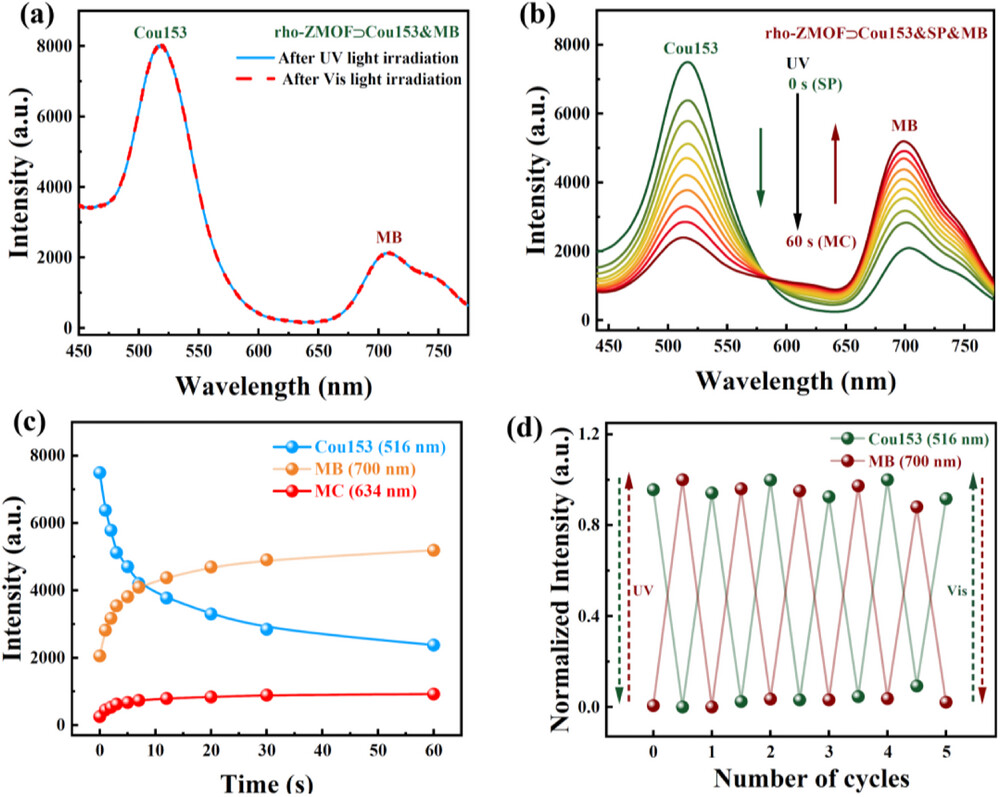
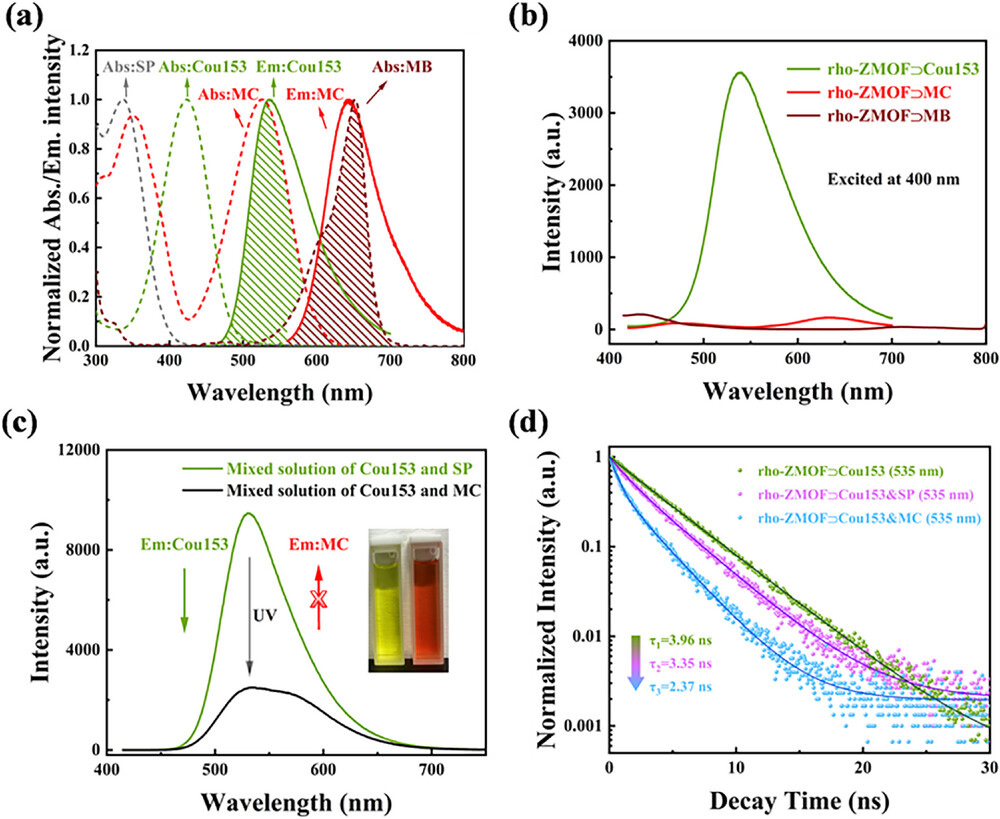
首先是核心的Stokes 位移数据。当用 400nm 光激发时,材料的绿色发射峰在 516nm,红色发射峰在 700nm,最大 Stokes 位移达到 300nm,远超传统双色荧光材料。这个数据意味着什么?简单说,激发光和发射光的波长差足够大,发射光不会被激发光干扰,就像用手电筒照射远处的信号灯,信号灯的光不会被手电筒的光掩盖,成像时的信噪比和对比度会大幅提升。同时,两个发射峰之间的距离约 200nm,光谱分辨率极高,能清晰区分两种信号,为精准成像提供了基础。
其次是光响应性能和稳定性。实验显示,在紫外线照射 60 秒后,绿色荧光强度显著下降,红色荧光强度达到峰值,而切换到可见光照射后,荧光强度又能基本恢复。这种切换可以重复至少 5 个循环,且最大和最小荧光强度衰减极小,说明材料具有良好的抗疲劳性。这就像一个耐用的开关,能反复使用而不失效,为长期动态成像提供了可能。
能量转移效率的测试数据更能体现设计的精妙。通过荧光寿命测量计算,香豆素 153 到 MC 状态螺吡喃的能量转移效率最高可达 40%,而 MC 状态螺吡喃到亚甲基蓝的能量转移效率更是高达 81%。如此高的转移效率,保证了能量传递的顺畅性,让双色切换的响应速度更快、效果更明显。相比之下,在没有 MOF 骨架的甲醇溶液中,这三种分子混合后根本无法实现有效的能量转移和动态荧光切换 —— 这充分证明了 MOF 骨架的关键作用。
材料的生物相容性是其能用于细胞成像的前提。MTT 实验显示,当 4T1 细胞与浓度高达 200μg/mL 的材料共培养 6 小时后,细胞存活率仍保持在 90% 以上,且光毒性极低。这意味着材料对细胞的伤害很小,符合生物医学应用的安全要求,为后续的活体成像奠定了基础。
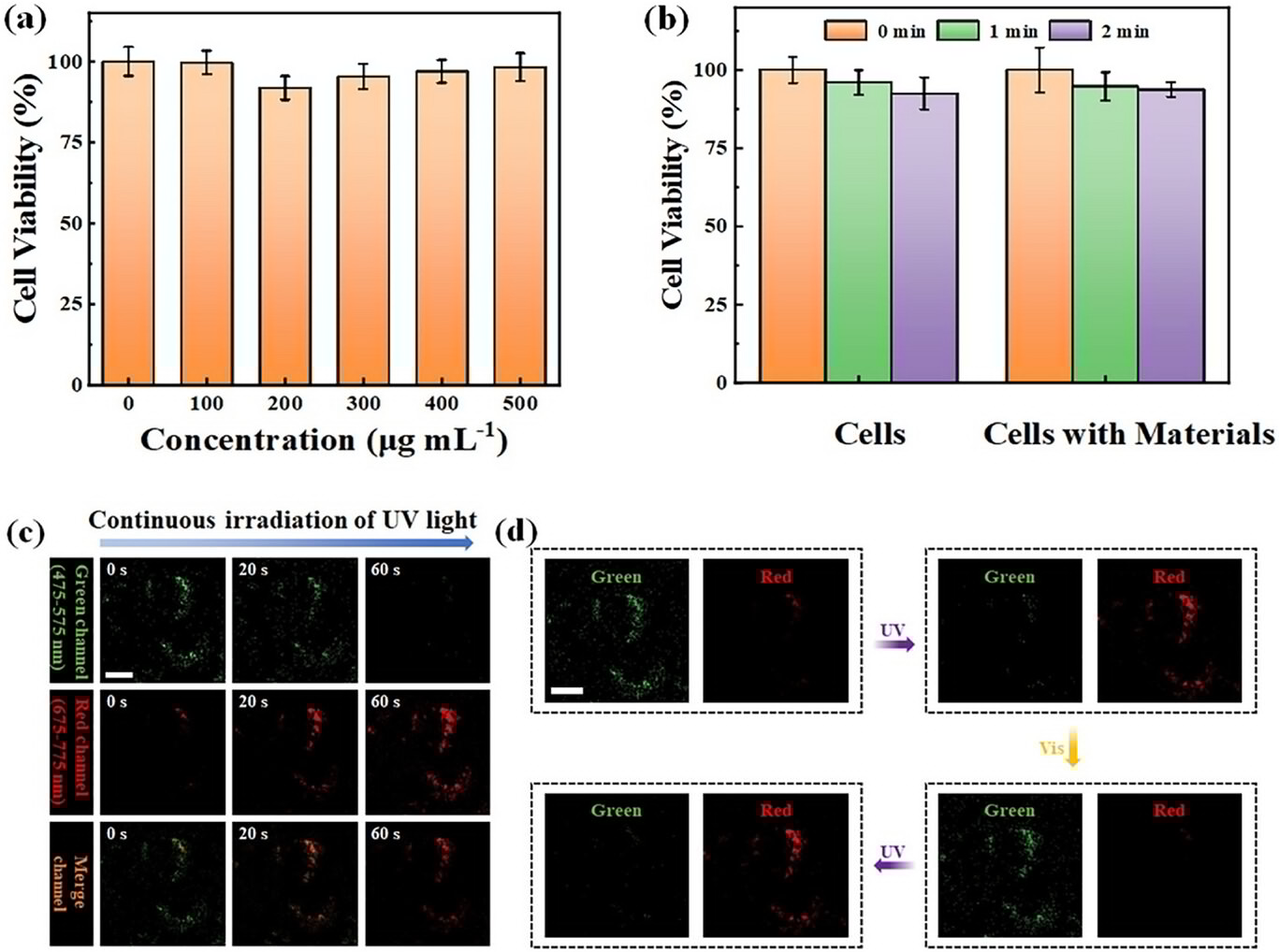
在实际成像测试中,材料的表现同样出色。对 4T1 细胞进行成像时,初始状态下绿色荧光信号强烈,红色信号微弱;经过紫外线照射后,绿色信号逐渐减弱,红色信号同步增强,细胞伪色从绿色逐渐变为黄色,最终变为红色;而可见光照射后又能恢复绿色。这种动态切换在细胞内依然能稳定实现,且Pearson 共定位系数达到 0.79,说明材料在细胞内保持了结构完整性。
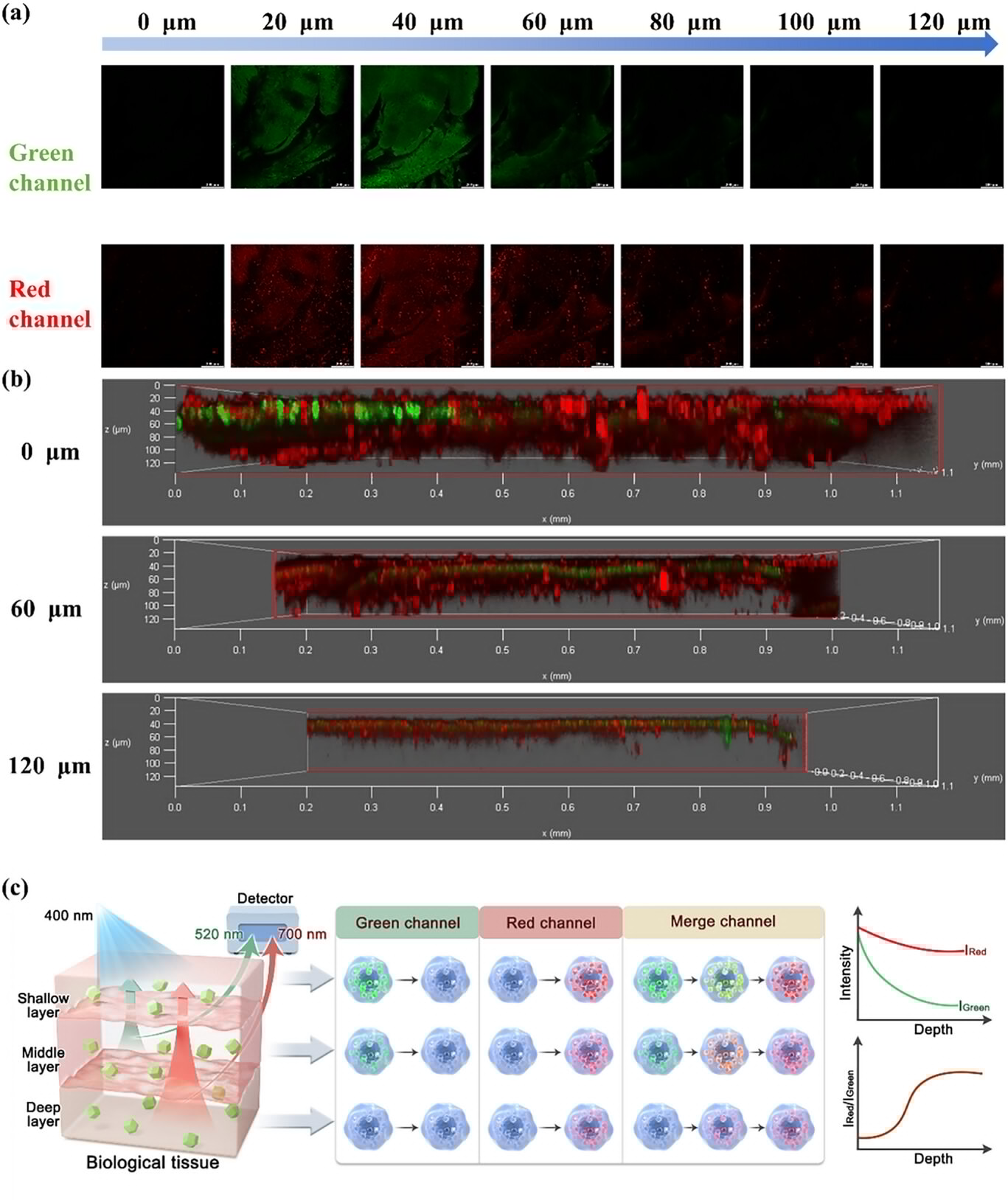
更令人惊喜的是深度分辨成像能力。由于绿色光能量较高,在生物组织中衰减较快,而红色光能量较低,穿透能力更强。实验显示,红色荧光的最大成像深度可达 100μm,远超绿色荧光的 60μm。通过绿色和红色荧光强度的比值变化,还能反映成像的空间深度信息 —— 在浅层组织,图像从绿色经黄绿色变为红色;在中层组织,从绿色变为橙红色再到红色;在深层组织,绿色荧光几乎完全消失,红色荧光成为主导。这种特性让材料能实现 “颜色 - 深度” 的关联成像,为深层组织的精细观察提供了新手段。
应用展望:从基础科研到临床医疗的潜力
这项研究的突破,不仅解决了传统荧光材料的多个痛点,还开辟了多个重要的应用方向,但同时也存在一些需要进一步完善的地方。
从局限性来看,目前材料的制备过程还需要精准控制分子比例和浸泡条件,规模化生产的难度较大;其次,虽然材料的光稳定性较好,但在长期活体成像中,是否会受到生物体内酶、酸碱度等环境因素的影响,还需要进一步验证;此外,红色荧光的成像深度虽然达到 100μm,但对于更深层的组织或器官成像,仍有提升空间。
不过,这些局限性并不影响其巨大的应用潜力。在生物医学成像领域,它可以用于细胞内动态过程的长期追踪,比如观察细胞分裂、蛋白质相互作用等,300nm 的超大 Stokes 位移能让观察更清晰、更精准;在深度成像方面,它可用于肿瘤组织的深层观察,帮助医生更准确地判断肿瘤边界,为手术规划提供支持;在超分辨显微镜技术中,可逆的双色切换特性有望提升成像分辨率,助力科学家发现更多细胞微观结构的奥秘。
在非医疗领域,这种材料还可用于信息加密—— 通过紫外线和可见光的切换,实现信息的 “写入” 和 “读出”,且双色信号和大 Stokes 位移能提高加密的安全性;在光学存储领域,可利用其高稳定性和可逆切换特性,开发高密度的光存储介质,提升存储容量和读写速度。
未来,研究团队可能会进一步优化材料的性能,比如通过调整 MOF 结构或分子配比,进一步提升能量转移效率和光稳定性;也可能尝试将材料与靶向分子结合,实现对特定细胞或组织的精准成像;此外,开发更简单的规模化制备方法,降低成本,也是推动材料走向实际应用的关键方向。
这项研究的核心价值,不仅在于研发出一种性能优异的新型荧光材料,更在于提供了一种 “MOF 骨架 + 级联能量转移” 的设计思路。通过 MOF 对分子的限制和保护作用,解决了传统材料在固体状态下光响应差、量子产率低的问题;通过螺吡喃的光致异构化,实现了能量转移的精准调控;而超大 Stokes 位移和双色切换的结合,则直击成像领域的核心痛点。
随着技术的不断完善,这种材料有望在生物医学、信息存储、光学器件等多个领域发挥重要作用,尤其是在临床诊断和基础科研中,可能会带来成像技术的新一轮升级,让我们 “看清” 更多以前看不到的微观世界,为疾病诊断和科学发现提供更强大的工具。