【Adv.Mater.】PD-L1降解率超55%!南开大学团队研发“自发光”纳米炸弹,0.1%极低氧下精准引爆深部肿瘤焦亡
✨文章标题:Chemiluminescence-Powered Immunotherapy for Deep Tumors: Promoting PD-L1 Degradation and Igniting Pyroptosis Through Subcellular Trafficking and Targeting ✉️作者:Changhua Li 等 🔗链接:https://doi.org/10.1002/adma.202519569
[!summary]
- 研究背景与核心痛点
- 深部肿瘤治疗难: 传统的化学发光疗法(PDT)极度依赖外部光源,但光线进入人体2毫米后就会大幅衰减,导致深层肿瘤和转移灶成为治疗盲区 。
- 免疫抑制屏障: 肿瘤细胞表面高表达的PD-L1蛋白会像“隐身衣”一样让T细胞疲劳、失效,导致即便诱导了免疫原性细胞死亡,效果也往往差强人意 。
- 缺氧环境限制: 大多数光动力疗法依赖氧气产生单线态氧,但在氧气稀缺的实体瘤内部,这种机制往往会“哑火” 。
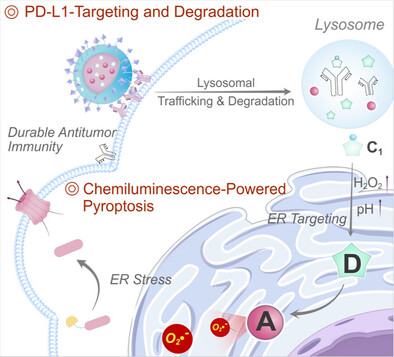
2. 核心创新机制:CPIT平台
研究人员设计了一种多功能的纳米载体 ,其工作流程精密如同一场分阶段的“特种作战”:
- 第一步:PD-L1降解(溶酶体路径)。 纳米颗粒表面修饰了高亲和力的PD-L1配体,能够精准识别并捕捉肿瘤细胞表面的PD-L1蛋白,通过受体介导的内吞作用将其拉入“细胞回收站”——溶酶体进行降解,降解效率超过55% 。
- 第二步:内源性“点火”(内质网靶向)。 纳米颗粒内部装载了化学发光供体 和光敏剂 。它们具有天然的内质网趋向性,能够精准定位到内质网 。
- 第三步:双锁激活与免疫焦亡。 为了防止误伤,供体 只有在同时遇到肿瘤高水平过氧化氢() 和中性pH环境时才会激发 。这种“化学能”激发的ROS(活性氧)会引发严重的内质网应激,进而诱导一种极具战斗力的细胞死亡方式——免疫原性焦亡 。
3. 关键实验数据
- 卓越的肿瘤富集: 依靠主动靶向技术,肿瘤部位的蓄积量高达 10.8% ID/g,远高于普通纳米药物 。
- 无惧极度缺氧: 在仅有 0.1% 氧气 的极端环境下,该系统依然能通过I型光动力路径产生自由基,成功诱发焦亡 。
- 强效抑制转移: 在小鼠肺转移模型中,CPIT显著减少了肺部转移结节,抑瘤率远超单纯的免疫检查点阻断(ICB)或单纯的焦亡治疗 。
- 持久免疫记忆: 治疗后的老鼠产生了持久的免疫记忆。当再次向其体内注射肿瘤细胞时,老鼠自身的免疫系统能直接将其“拒之门外” 。
4. 结论与展望
该研究首次实现了化学发光驱动的、针对特定细胞器的精确免疫治疗 。它不仅避免了光的穿透力限制,还通过降解PD-L1降低了免疫激活门槛,为处理临床上棘手的深层恶性肿瘤和远处转移提供了全新的方案 。
从“痛点”到“突破”:深部肿瘤的“隐身衣”与“禁区”
在人类与癌症的长久拉锯战中,免疫治疗曾被寄予厚望,但现实却远比理想骨感。虽然免疫检查点阻断(ICB)技术如PD-1/PD-L1抑制剂在临床上取得了巨大成功,但T细胞疲劳和免疫抑制环境依然像一层厚重的阴霾,让许多患者难以获得持久的疗效 。更为棘手的是,许多实体瘤不仅躲藏在人体深处,还演化出了极端缺氧的微环境,这让传统的依靠光动力疗法(PDT)诱导免疫反应的策略显得捉襟见肘 。
传统的PDT疗法极度依赖外源光照,然而光的穿透深度在生物组织中往往不足2毫米,这意味着藏在身体深处的病灶和悄然转移的肺部、腹腔结节成了光照触及不到的“禁区” 。此外,大多数光动力药物在低氧环境下会彻底“哑火”,无法产生足够的活性氧来杀伤肿瘤 。为了打破这一僵局,寻找一种无需外源光、无惧低氧、且能同时撕开肿瘤免疫检查点伪装的新型疗法,成为了当前纳米医学和肿瘤免疫领域最前沿的攻坚方向。
近日,南开大学李昌华教授团队在国际顶级学术期刊《Advanced Materials》上发表了一项震撼研究 。他们开发出了一种名为CPIT(化学发光驱动免疫疗法)的智能纳米平台 。这个平台不仅能像“精准制导炸弹”一样深入肿瘤内部,利用化学能替代光能,在内质网内引爆肿瘤细胞焦亡,更通过一种巧妙的逻辑,让肿瘤细胞赖以生存的PD-L1蛋白降解效率超过了55%,从而彻底激活了机体自身的免疫大军 。
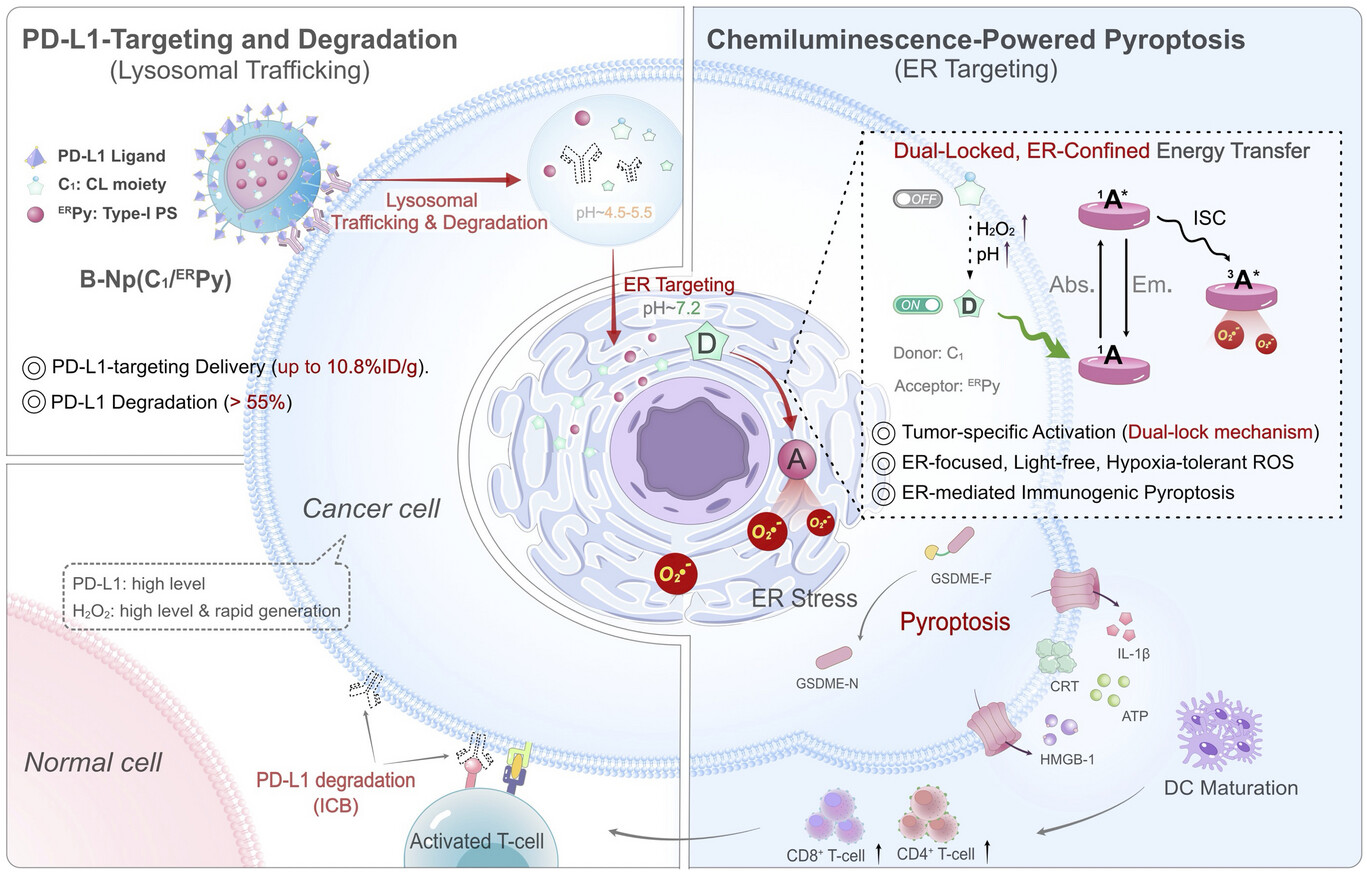
核心方法与技术细节:双锁闭、双靶向的“特种作战”平台
要理解CPIT平台的精妙之处,我们可以将其想象成一个装备极其精良的 “三栖特种作战单位”。它并不是盲目攻击,而是通过一套极其严密的逻辑,先后在细胞的两个重要零件——溶酶体和内质网中完成任务 。这个纳米平台由一种修饰了特定配体的聚合物胶束构成,内部封装了化学发光供体()和新型光敏剂() 。
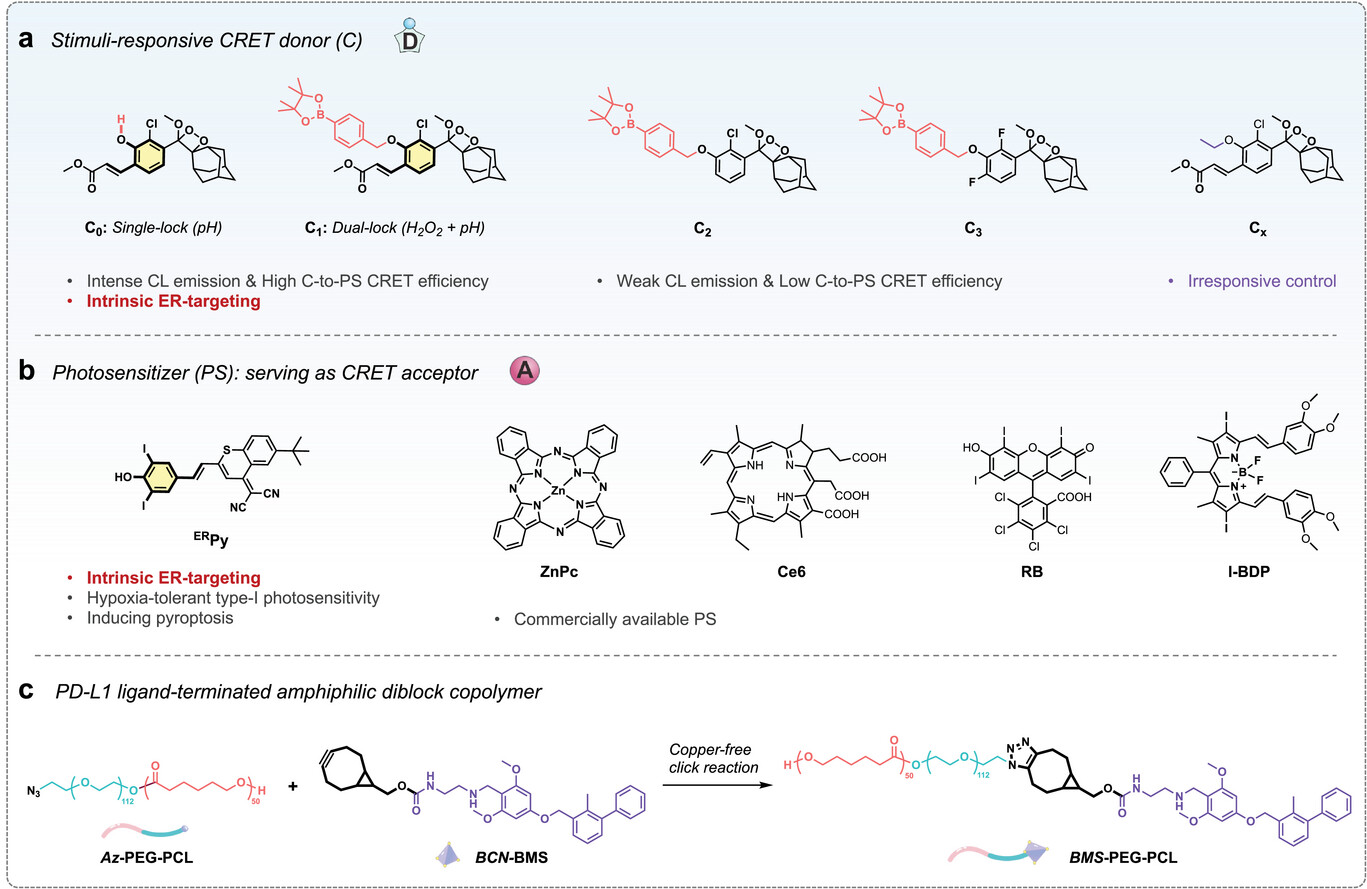
第一阶段的任务是“解除武装”,也就是PD-L1的强力清道夫。 肿瘤细胞之所以能逃脱免疫系统的追杀,关键在于其表面高表达的PD-L1蛋白,这就像是给肿瘤穿上了一层“隐身衣”,让原本英勇的T细胞变得疲惫不堪甚至直接罢工 。CPIT纳米颗粒的表面修饰了高亲和力的PD-L1结合配体 。当这些颗粒随血液循环进入肿瘤组织后,它们会像磁铁一样精准吸附在肿瘤细胞表面的PD-L1上 。通过一种被称为受体介导的内吞作用,纳米颗粒会强行将PD-L1蛋白拖入细胞内的“垃圾处理场”——溶酶体进行彻底降解 。这种策略与传统的药物阻断不同,它是从源头上直接抹除了检查点蛋白,降解效率之高,为后续的免疫冲锋扫清了障碍 。
第二阶段的任务则是“内部爆破”,即内质网定向点火。 在完成了PD-L1的捕获降解后,纳米载体内部的战斗部——化学发光系统会从内质网逃逸并精准定位到内质网(ER) 。为了确保战斗只在敌方内部发生而不伤及无辜,研究团队设计了一套 “双锁激活”机制 。只有当纳米颗粒同时遇到肿瘤内部特有的高水平过氧化氢() 以及内质网中接近中性的 pH环境(约7.2) 时,化学发光反应才会被“点燃” 。这种内源性的化学能会通过CRET(化学发光共振能量转移)效应,将能量传递给光敏剂,激发出致命的活性氧(ROS) 。
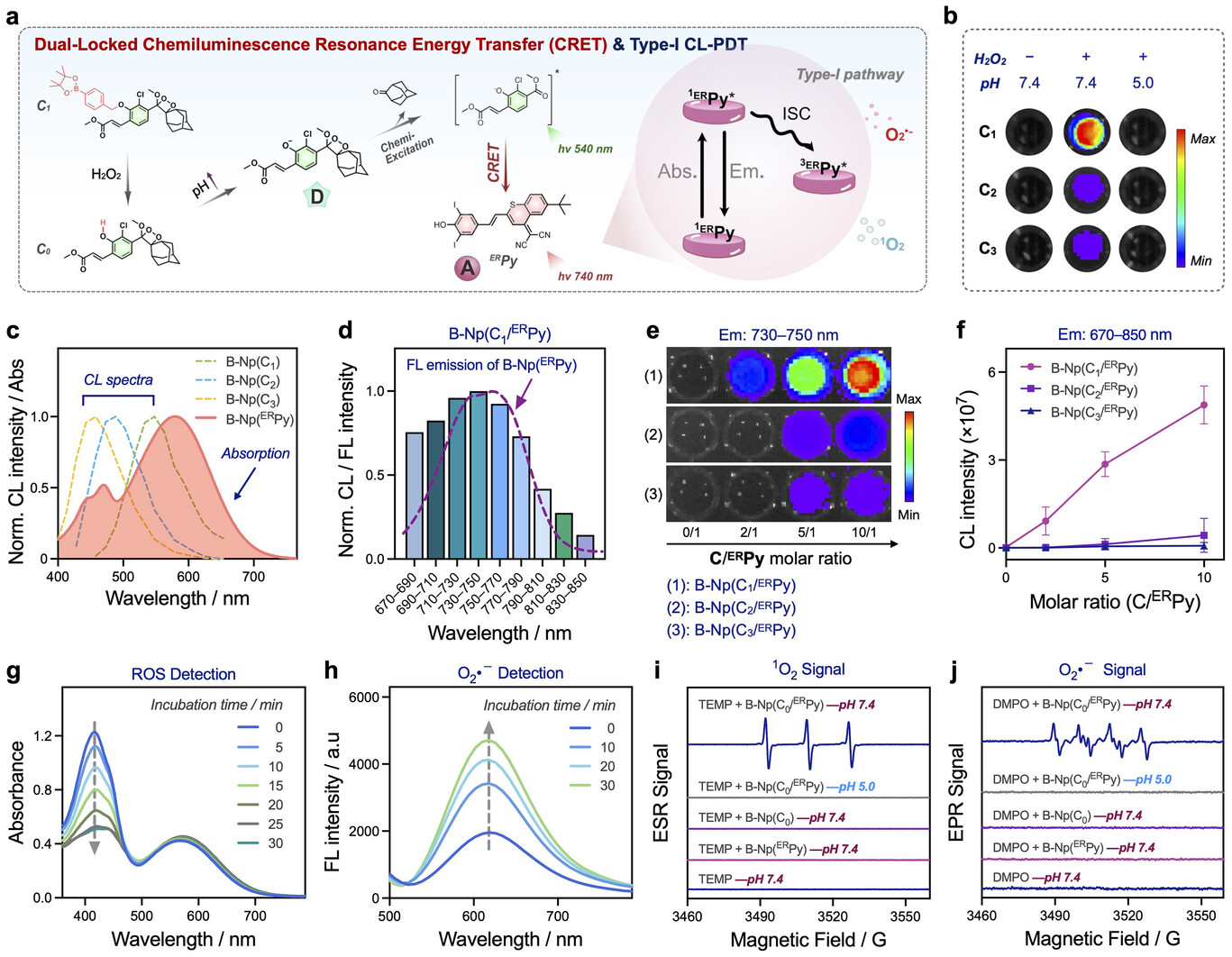
这种设计的最高明之处在于它对特定细胞器——内质网的定点打击 。由于内质网对氧化应激极其敏感,这种局部的ROS爆发会迅速引发严重的“内质网应激”,进而启动一种极其惨烈且具有高度战斗动员能力的死亡方式——免疫原性焦亡 。肿瘤细胞会像充气的气泡一样破裂,并释放出大量的“危险信号”分子,向免疫系统发出最后通牒 。
数据背后的创新与颠覆性:为何它是“深部肿瘤”的克星?
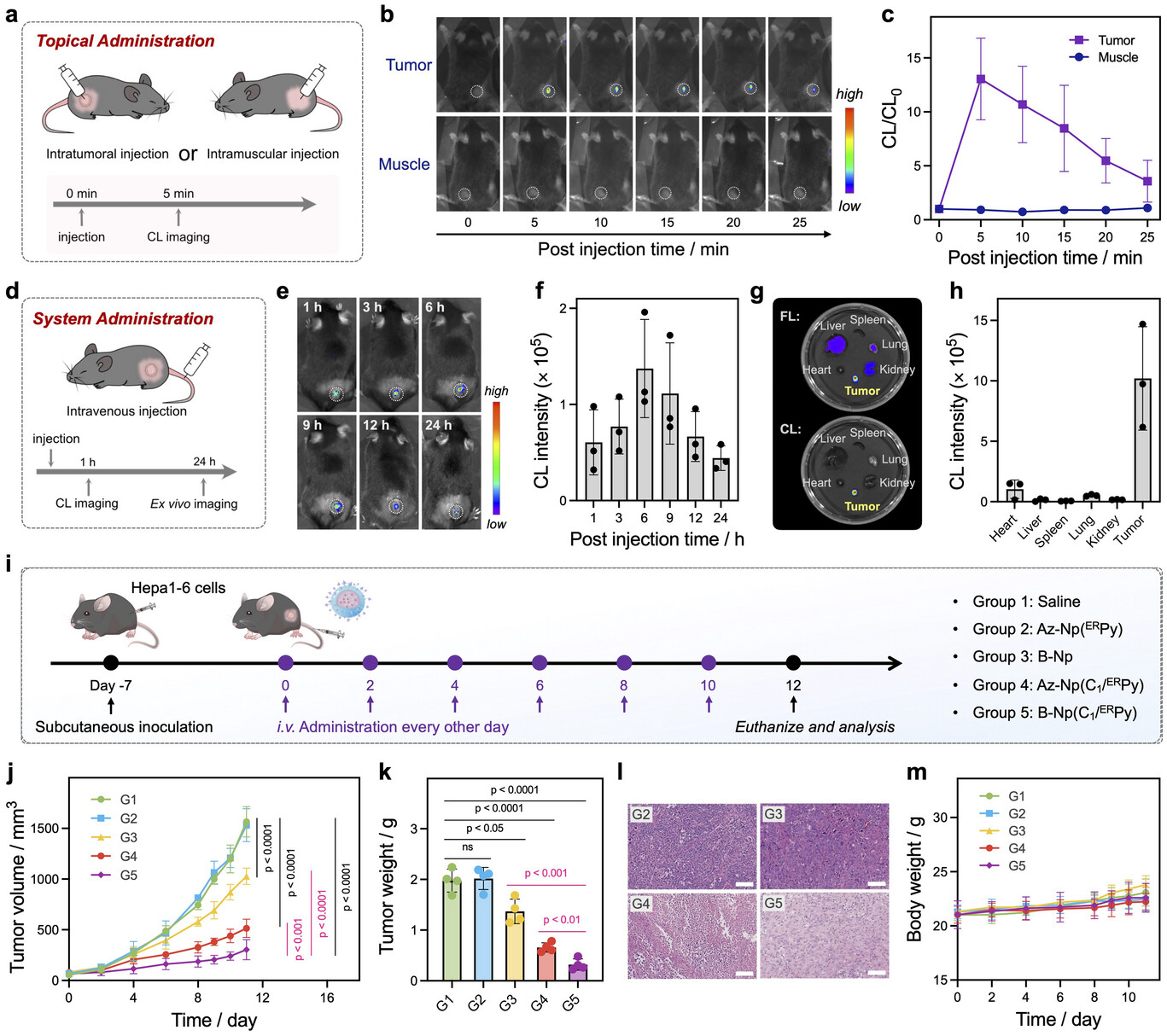
在科学研究中,数据是衡量一项技术是否具有颠覆性的唯一标准。CPIT平台在各项实验中展现出的惊人数据,足以证明其在处理复杂、深部及缺氧肿瘤时的巨大潜力。首先,是其惊人的靶向富集能力。通过主动靶向和被动EPR效应的双重保障,CPIT纳米颗粒在小鼠肿瘤部位的蓄积量达到了惊人的10.8% ID/g 。作为对比,普通的纳米药物往往只有极小部分能进入肿瘤。这种高效的富集确保了药物能够深入敌营,为后续的“化学能爆破”提供了充足的弹药 。
在降解免疫抑制蛋白方面,CPIT展现了非凡的效率。 实验数据显示,在处理HepG2、4T1等多种高恶性肿瘤细胞系时,CPIT诱导的PD-L1蛋白降解效率稳定超过了55% 。这种深度的“去抑制化”让肿瘤组织从原本的免疫荒漠变成了免疫热土。研究发现,在治疗后的肿瘤组织中,活化的 cytotoxic T细胞和 helper T细胞数量大幅增加 。其中,G5治疗组(即CPIT组)的 T细胞浸润水平竟然是常规免疫药物治疗组的3.62倍 。这种指数级的提升,直接决定了肿瘤清除的效果。
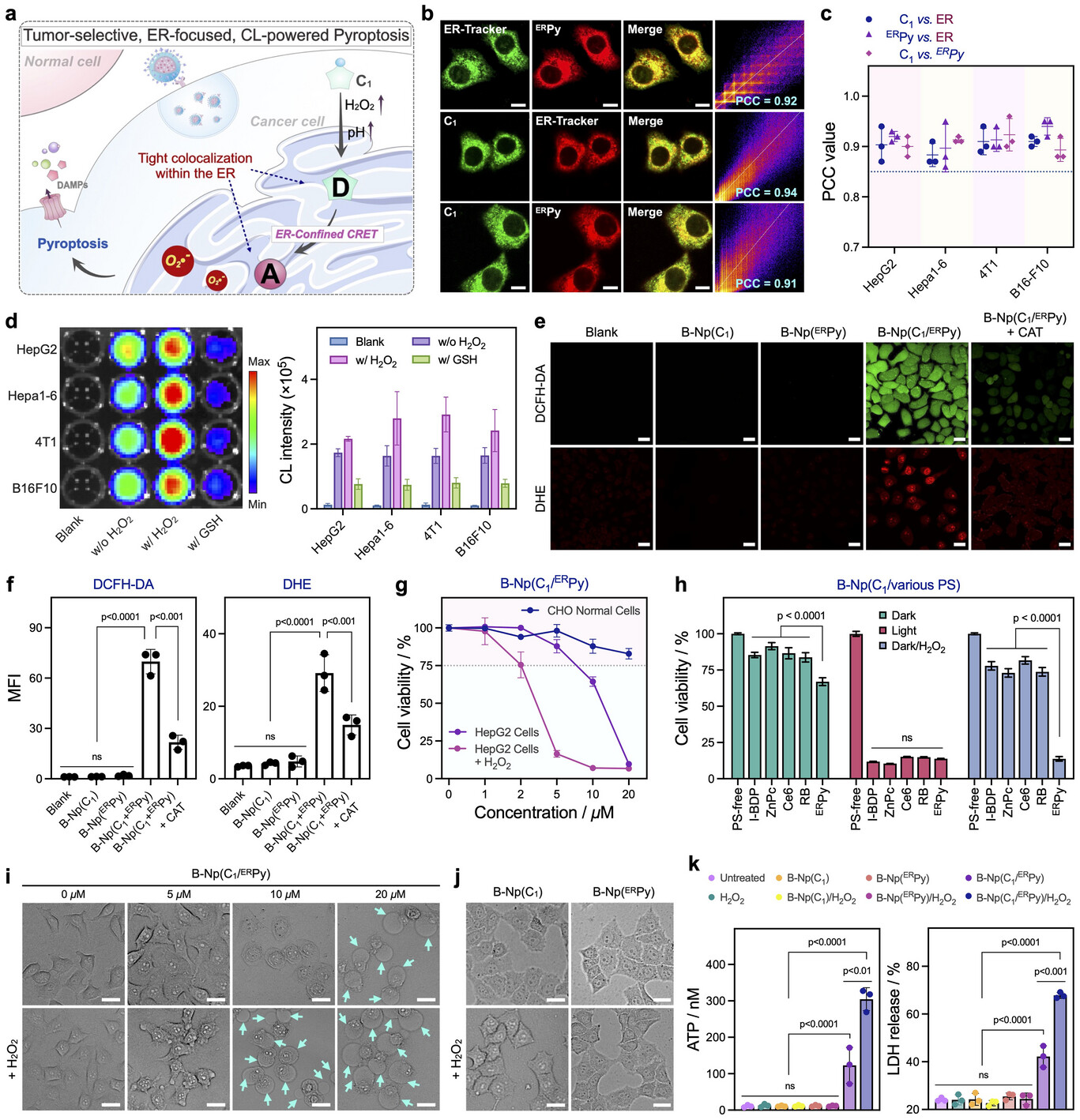
更具突破性的是其在极端缺氧环境下的战斗力。 实体瘤内部的氧气含量往往极低,甚至低至0.1% 。传统的PDT在此时几乎完全失效,因为它们需要氧气作为原料。而CPIT平台采用了一种特殊的I型光动力机制,能够在几乎不依赖氧气的环境下产生超氧阴离子自由基 。实验证明,在0.1%的极端低氧下,CPIT依然能稳定诱发细胞焦亡,释放出关键的免疫原性信号分子,如ATP、HMGB1和细胞表面的钙网蛋白(CRT) 。这意味着即使是躲在缺氧深处的“死硬”肿瘤细胞,也无法逃脱CPIT的精准打击。
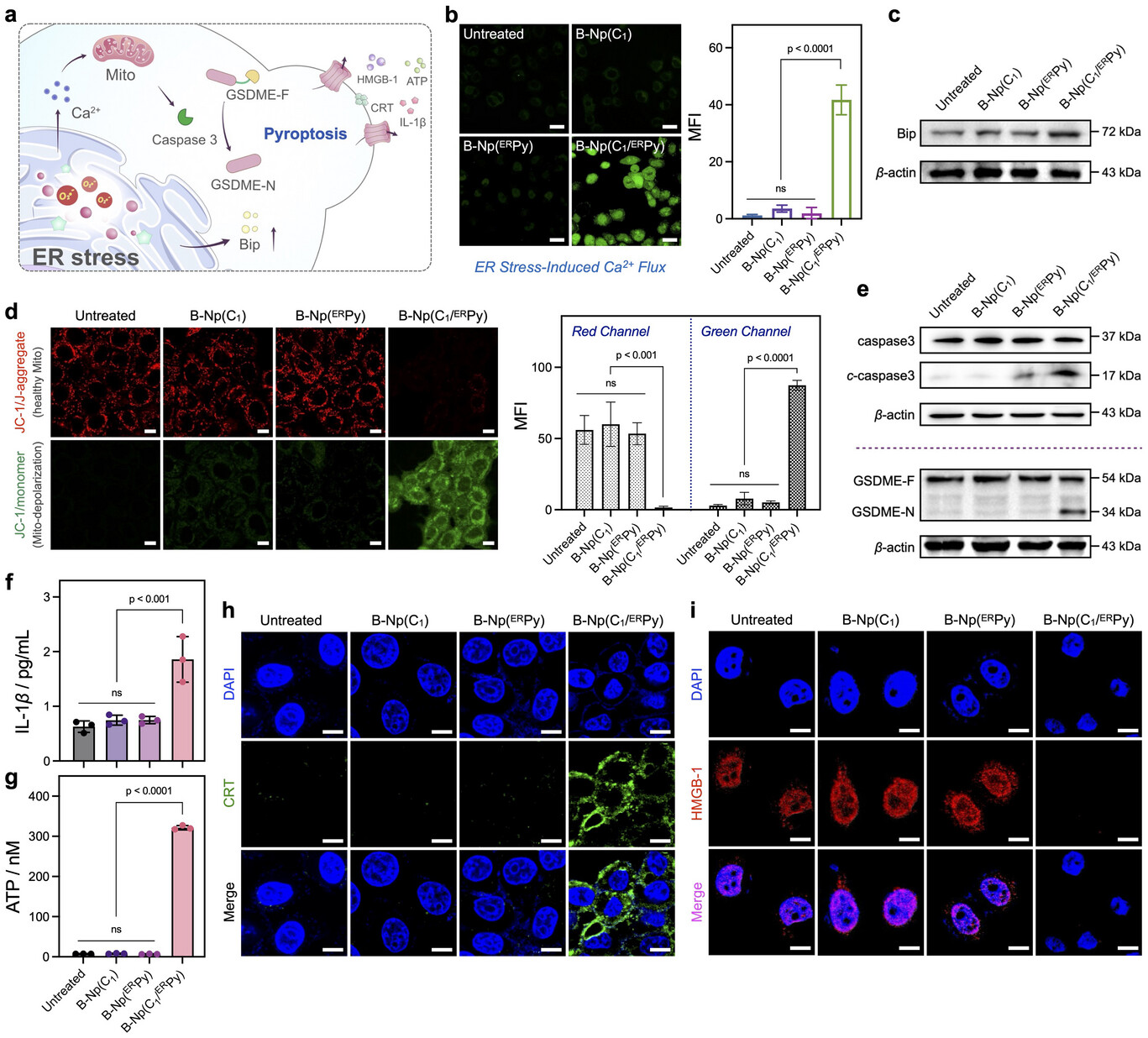
在临床价值最大的肺转移模型中,CPIT的表现堪称亮眼。 肺部转移是癌症死亡的主要原因之一,且病灶分布深、范围广。研究人员建立了4T1乳腺癌肺转移模型,并利用化学发光成像技术实时监测 。结果显示,CPIT能够精准定位到肺部的细小转移结节,其信号强度是无靶向控制组的1.9倍 。在经过为期两周的治疗后,CPIT组小鼠肺部的转移病灶数量大幅下降,且小鼠的生存期得到了显著延长 。这种对深部隐匿病灶的强大杀伤力,正是传统光照疗法梦寐以求的性能。
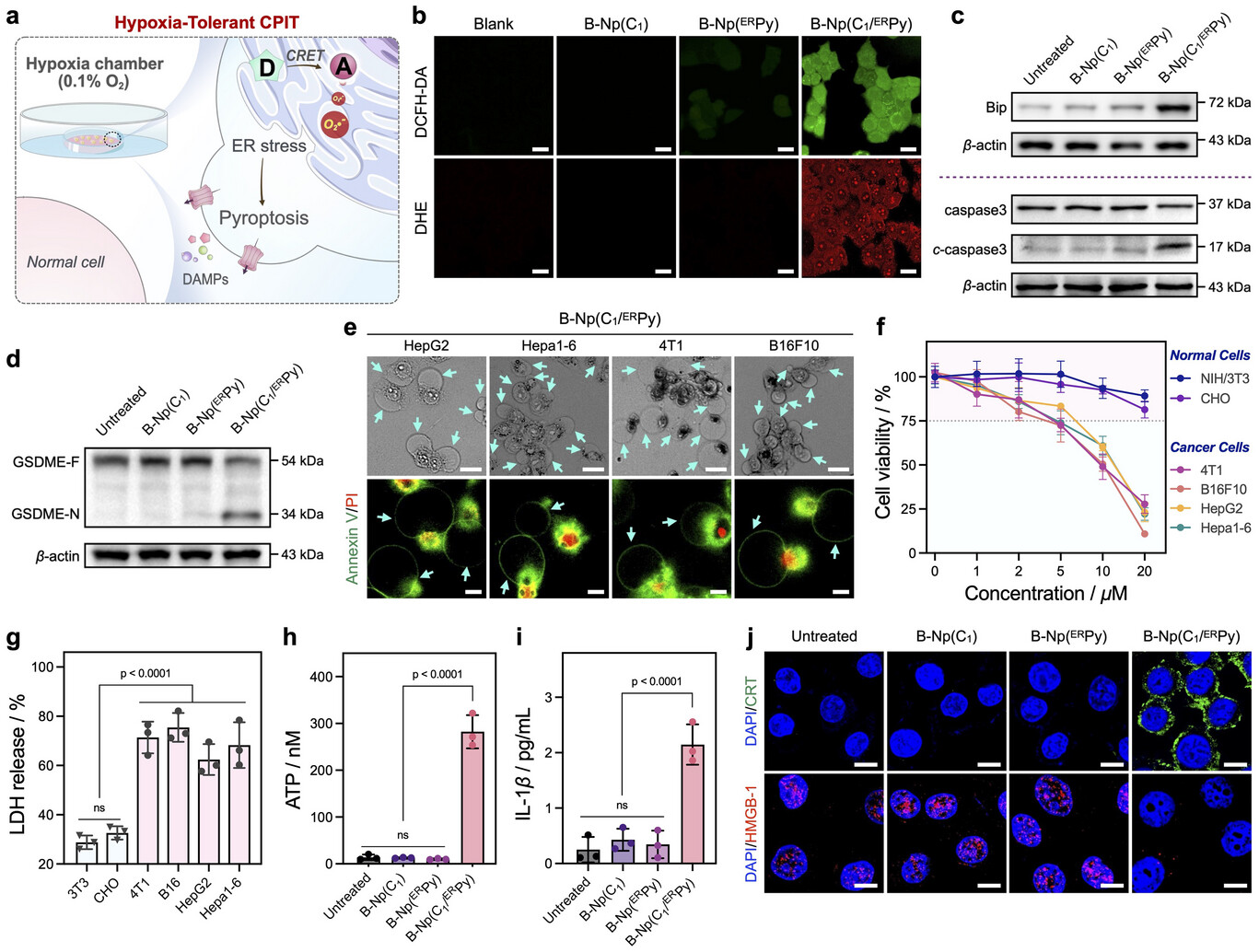
最后,CPIT成功激发了持久的免疫记忆。 这是一种“一劳永逸”的治疗境界。研究人员在手术切除主肿瘤并完成CPIT治疗后,再次向小鼠体内“挑战”注射同样的肿瘤细胞 。令人惊叹的是,这些小鼠体内的免疫系统能够迅速识别并完全排斥新侵入的肿瘤,小鼠体内的效应记忆T细胞()显著扩增 。这意味着CPIT不仅治愈了当前的病灶,还像接种疫苗一样,为机体建立了一道长期的“免疫防火墙”。
应用展望、局限性与未来路线图:从实验室走向临床的思考
CPIT平台的出现,标志着 “无光、精准、器械级” 免疫治疗进入了一个新阶段。这种不依赖外部设备点燃、直接利用生物能触发焦亡的思路,为肝癌、肺癌、腹腔肿瘤等深部恶性病灶的无创治疗开启了广阔空间。其模块化的设计也极具魅力:科学家可以根据不同的癌症类型,轻松地更换表面的配体(用于靶向不同的蛋白)或内部的光敏剂,从而实现“定制化”的精准医疗 。
然而,作为一项前沿的实验室研究,其走向临床仍面临挑战。首先,化学发光底物作为“单次消耗品”,其在体内的剂量控制和动力学分布需要更精准的优化,以确保在人类巨大的肿瘤体积内维持足够的发光时长 。其次,虽然动物实验证明了其良好的生物安全性,但在复杂的长期应用中,如何完全排除纳米材料的累积毒性仍需深入研究 。
未来的研究蓝图已经清晰。研究团队可能会进一步探索如何通过内源性物质的循环利用来延长化学发光的持续时间,或者将该平台与现有的化疗、放疗手段结合,发挥更强大的协同效应。CPIT不仅是一种新型的抗癌工具,更是一种全新的治疗理念——通过亚细胞层面的精准能量转换,将原本冷冰冰的“杀伤”变成一场充满逻辑的“免疫唤醒” 。
如果这项技术在未来能够成功转化,我们或许能迎来这样一个时代:深部肿瘤不再需要承受多次开刀或大剂量放疗的痛苦,仅仅通过一次智能纳米输液,就能在微观世界里悄无声息地引燃肿瘤细胞,依靠病人自身的免疫力量赢得最终的胜利。